Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. - 2008. - Т. 1. - 672 с. : ил.
|
|
|
|
ГЛАВА 18 ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ КОРОНАРНОЙ БОЛЕЗНИ СЕРДЦА
Хирургические методы лечения КБС имеют своей целью прямое увеличение коронарного кровотока. Эта цель может быть достигнута двумя путями: обходным шунтированием коронарных артерий - операция аортокоронарного шунтирования (АКШ) и транслюминальной баллонной ангиопластикой (ТЛБАП), направленной непосредственно на область сужения коронарного сосуда.
Операция АКШ в условиях искусственного кровообращения (ИК) и кардиоплегии остается «золотым стандартом» лечения КБС. Именно поэтому данный метод был, например, использован в лечении экс-президента США Билла Клинтона в 2004 году. Однако в последние годы все шире применяется ТЛБАП (обычно в сочетании с имплантацией стента) и операция АКШ без применения ИК. В качестве кондуитов для АКШ используют аутотрансплантаты: внутреннюю грудную артерию (ВГА), большую подкожную вену голени и лучевую артерию. Современные тенденции развития коронарной хирургии наряду с выполнением операции АКШ на бьющемся сердце включают в себя полную аутоартериальную реваскуляризацию с использованием обеих внутренних грудных, лучевой и правой желудочно-сальниковой артерии (ПЖСА), трансмиокардиальную лазерную реваскуляризацию (ТМЛР) при диффузном поражении коронарных артерий, использование генных и клеточных технологий в хирургии КБС.
Операция прямой реваскуляризации миокарда увеличивает продолжительность жизни, снижает риск развития инфаркта миокарда и улучшает качество жизни по сравнению с медикаментозной терапией, особенно в группах больных с прогностически неблагоприятным поражением коронарного русла.
Ключевые слова: хирургическое лечение КБС, прямая реваскуляризация миокарда, аортокоронарное шунтирование, коронарное шунтирование.
исторический очерк
Идея хирургического лечения КБС была высказана более 100 лет назад парижским профессором-физиологом ФрансуаФранком, который в 1899 году предположил, что симпатическая денервация может улучшить течение КБС. Эта концепция была реализована в 1916 году Т. Жоннеско, который впервые выполнил удаление грудных симпатических узлов у больного, страдавшего стенокардией. В дальнейшем было разработано множество вариантов десимпатизации сердца, включая различные виды симпатических блокад, однако эти операции были оставлены в связи с тем, что они приводили лишь к прерыванию афферентного болевого сигнала.
Пионером другого направления в хирургическом лечении КБС - непрямой реваскуляризации миокарда - был американский хирург Клод Бек, который в начале 30-х годов предложил операцию создания асептического перикардита, получившую название перикардокардиопексии. Операция заключалась в скарификации эпикардиальной поверхности сердца и перикарда металлической щеточкой, что приводило к образованию сращений, которые, по мнению
К. Бека, должны были содержать кровеносные сосуды и, таким образом, компенсировать дефицит коронарного кровотока. В дальнейшем Бек дополнил свою операцию введением раздражающих веществ в полость сердечной сорочки для усиления образования спаек, а Томсон впервые применил с этой целью тальк. Другой вариант непрямой реваскуляризации состоял в подшивании к эпикардиальной поверхности сердца хорошо кровоснабжаемых тканей и органов. Первую операцию подобного рода выполнил в 1938 году Лоренс О'Шонесси, она заключалась в подшивании пряди большого сальника на ножке к эпикарду и получила название оментокардиопексии. В дальнейшем с этой целью были использованы самые различные ткани и органы: грудные мышцы, медиастинальный жир, легкое, кожа и даже желудок и тонкая кишка. Однако эффект операций непрямой реваскуляризации миокарда был ограниченным. Авторы этих вмешательств не учитывали ряд важных факторов: размеров дефицита коронарного кровотока при КБС, строгой локализованности этого дефицита (в зависимости от того, какой именно коронарный сосуд поражен), а также того, что от дефицита кровообращения в основном страдают эндокардиальные, а не эпикардиальные слои сердечной мышцы.
Апофеозом методов непрямой реваскуляризации явилась операция А. Вайнберга, предложенная в 1948 году, которая заключалась в имплантации кровоточащего дистального сегмента внутренней грудной артерии в толщу миокарда. Эта процедура в силу особого строения интрамиокардиального капиллярного русла (лакуны) приводила к развитию широкой сети коллатералей между имплантированной в миокард ВГА и коронарными артериями.
В середине 50-х годов были выполнены первые прямые вмешательства на коронарных артериях - операции коронарной эндартерэктомии, пионером которых был американский хирург Ч. Бейли. Эндартерэктомия (ЭАЭ) заключается в удалении внутренней стенки артериального сосуда, включающей атеросклеротически измененную интиму и часть медии, и была разработана на периферических артериях в 1948 году Дос Сантосом. Эндартерэктомия нередко осложнялась тромбозом коронарной артерии с развитием ИМ, и летальность при этих вмешательствах была очень высока. Эта процедура сохранила известное значение до настоящего времени. При диффузном поражении коронарных артерий иногда приходится выполнять ЭАЭ в сочетании с АКШ.
В 1958 году Ф.М. Соунс в клинике Кливленда разработал методику селективной коронарографии. Это был важнейший поворотный момент во всей истории лечения КБС - коронарография позволила кардиологам и хирургам получать точную информацию о локализации, степени и распространенности поражения коронарных артерий, что позволило более ясно понять сущность заболевания и активно разрабатывать прямые вмешательства. Именно с этого момента началась эра прямой реваскуляризации миокарда. Необходимо отметить, что прямые шунтирующие вмешательства на коронарных артериях в эксперименте проводил еще в 10-х годах ХХ века А. Каррель, а позже - в пятидесятые годы - американец Г. Меррей и выдающийся отечественный исследователь В.П. Демихов. В 1960 году американский хирург Р. Гетц впервые в мире выполнил успешную операцию маммарокоронарного анастомоза у человека, а начиная с 1964 года маммарокоронарный анастомоз (или маммарокоронарное шунтирование) стал систематически выполнять ленинградский хирург В.И. Колесов, которого признают пионером прямой реваскуляризации миокарда. В 1967 году Р. Фавалоро в Кливлендской клинике (США) впервые выполнил аутовенозное аортокоронарное шунтирование, и с 1971 года эта операция получила огромное распространение во всем мире. В начале 80-х годов прошлого века было показано, что отдаленная проходимость внутренней грудной артерии значительно выше, чем проходимость аутовенозных шунтов, и эти данные привели к тому, что большинство хирургов перешли к выполнению комбинированной операции: маммарокоронарного анастомоза с передней межжелудочковой артерией и аутовенозного шунтирования других пораженных артерий.
В 1978 году Андреас Грюнтциг впервые апробировал в клинической практике метод баллонной дилатации (ангиопластики) коронарных артерий. Не являясь в истинном смысле слова хирургическим, этот метод преследует ту же цель, что и операция АКШ - восстановление прямого кровотока по коронарным артериям. Бурное развитие этого метода в конце ХХ века привело к разработке целого ряда усовершенствований, среди которых главное - изобретение так называемого стента - специальной металлической сеточки, удерживающей сосуд после его расширения баллоном в расправленном состоянии.
В нашей стране пионерами реваскуляризации миокарда, помимо В.П. Демихова и В.И. Колесова, был также академик А.Н. Бакулев.
М.Д. Князев в Российским научном Центре хирургии, В.И. Бураковский и А.В. Покровский в Научном центре сердечно-сосудистой хирургии им. А.Н. Бакулева впервые в нашей стране выполнили АКШ в условиях ИК. Среди основоположников хирургии ИБС в России необходимо также назвать В.С. Работникова, возглавившего первое в стране отделение хирургического лечения КБС, и Б.В. Шабалкина, также внесшего неоценимый вклад в развитие этой области медицины.
В конце ХХ века в коронарной хирургии произошли значительные изменения, связанные, главным образом, с внедрением методов АКШ без ИК. Большой вклад в развитие этих технологий внесли латиноамериканские хирурги Буффоло и Бенетти, хирург из Нью-Йорка Субраманиан, а также европейские хирурги, например Сержант и Калафиоре. Следует подчеркнуть, что прототипом этих методов явилась одна из первых в истории операций реваскуляризации миокарда, выполненная В.И. Колесовым также на бьющемся сердце.
Ключевыми моментами в истории хирургического лечения КБС стали разработка селективной коронарографии (Ф. Соунс), операций маммарокоронарного анастомоза (В.И. Колесов) и аутовенозного АКШ (Р. Фавалоро).
показания к реваскуляризации миокарда
Показания к реваскуляризации миокарда при хронической КБС базируются на трех основных критериях: тяжести клинической картины заболевания, характере поражения коронарного русла, состоянии сократительной функции миокарда.
Основным клиническим показанием к реваскуляризации миокарда является тяжелая стенокардия, резистентная к медикаментозной терапии. Тяжесть стенокардии оценивается по субъективным показателям (функциональный класс), а также по объективным критериям - толерантность к физической нагрузке, определяемая по данным велоэргометрии или тредмил-теста. Следует учитывать, что степень клинических проявлений заболевания не всегда отражает тяжесть поражения коронарного русла. Существует группа больных, у кото-
рых при относительно скудной клинической картине заболевания отмечаются выраженные изменения ЭКГ покоя в виде так называемой безболевой ишемии по данным Холтеровского мониторирования. Эффективность медикаментозной терапии зависит от качества препаратов, правильно подобранных дозировок, и в большинстве случаев современная медикаментозная терапия весьма эффективна в смысле устранения болевого синдрома и ишемии миокарда. Однако следует помнить, что катастрофы в течении КБС связаны обычно с нарушением целостности атеросклеротической бляшки и поэтому степень и характер поражения коронарного русла по данным коронарографии являются наиболее важными факторами при определении показаний к операции АКШ. Селективная коронарография остается на сегодняшний день наиболее информативным методом диагностики, позволяющим верифицировать диагноз КБС, определить точную локализацию, степень поражения коронарных артерий и состояние дистального русла, а также прогнозировать течение КБС и ставить показания к хирургическому лечению.
Хирургическая рентгенанатомия коронарных артерий представлена на рис. 18.1. Ствол левой коронарной артерии (ЛКА) имеет в длину от 0,5 до 2,5 см и делится на две крупные ветви. Поэтому с хирургической точки зрения принято выделять три главные коронарные артерии: переднюю межжелудочковую ветвь (ПМЖВ) ЛКА, огибающую ветвь (ОВ) ЛКА и правую коронарную артерию (ПКА). Различают также три типа коронарного кровообращения: правый (встречается приблизительно в 75% случаев), левый (15%), сбалансированный (10%). Тип коронарного кровообращения определяется в зависимости от того, какой из сосудов образует заднюю межжелудочковую ветвь (ЗМЖВ). При правом типе ЗМЖВ образована ПКА, при левом - ОВ ЛКА, при сбалансированном типе имеются две ЗМЖВ - от ПКА и от ОВ ЛКА. Следует учитывать, что как при левом, так и правом типе коронарного кровообращения левый желудочек получает основной объем крови из системы ЛКА.
Накопленный огромный опыт коронарографических исследований подтвердил известный еще по патологоанатомическим данным факт преимущественно сегментарного характера поражения коронарных артерий при атеросклерозе, хотя нередко встречаются и диффузные формы поражения. Ангиографические показания к реваскуляризации миокарда можно сформулировать следующим
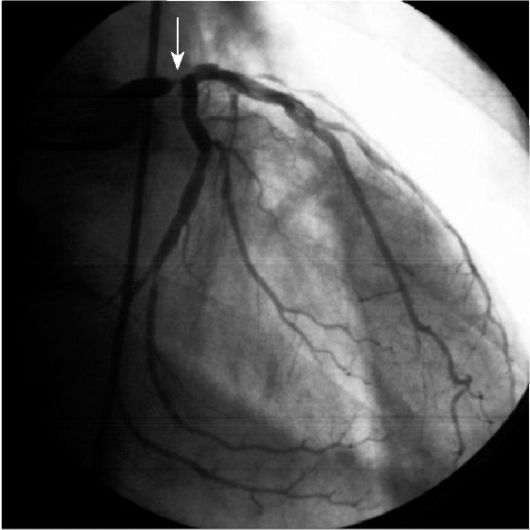 Рис. 18.1. Хирургическая рентгенанатомия системы ЛКА: имеется критический стеноз ствола ЛКА, проксимальные стенозы ПМЖВ, 1 ДВ, ВТК и ЗБВ ОВ
Рис. 18.1. Хирургическая рентгенанатомия системы ЛКА: имеется критический стеноз ствола ЛКА, проксимальные стенозы ПМЖВ, 1 ДВ, ВТК и ЗБВ ОВ
образом: проксимально расположенные, гемодинамически значимые обструкции основных коронарных артерий с проходимым дистальным руслом. Гемодинамически значимыми считаются поражения, приводящие к сужению просвета коронарного сосуда на 75% и более, а для поражений ствола ЛКА - 50% и более. Чем проксимальнее расположен стеноз и чем выше степень стеноза, тем более выражен дефицит коронарного кровообращения и тем в большей степени показано вмешательство. Наиболее прогностически неблагоприятно поражение ствола ЛКА, особенно при левом типе коронарного кровообращения. Крайне опасно проксимальное сужение (выше 1 септальной ветви) передней межжелудочковой артерии, которое может привести к развитию обширного ИМ передней стенки ЛЖ. Показанием к хирургическому лечению является также проксимальное гемодинамически значимое поражение всех трех основных коронарных артерий.
Одним из важнейших условий выполнения прямой реваскуляризации миокарда является наличие проходимого русла дистальнее гемодинамически значимого стеноза. Принято различать хорошее,
удовлетворительное и плохое дистальное русло. Под хорошим дистальным руслом подразумевают проходимый до концевых отделов, без неровности контуров, удовлетворительного диаметра участок сосуда ниже последнего гемодинамически значимого стеноза. Об удовлетворительном дистальном русле говорят при наличии неровности контуров или гемодинамически незначимых стенозов в дистальных отделах коронарной артерии. Под плохим дистальным руслом понимают резкие диффузные изменения сосуда на всем протяжении или отсутствие контрастирования его дистальных отделов (рис. 18.2).
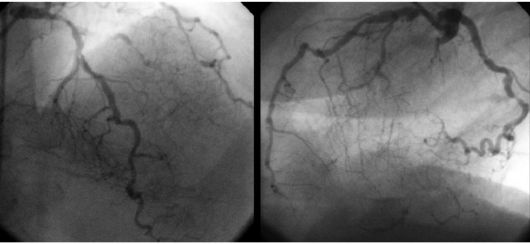 Рис. 18.2. Диффузное поражение коронарных артерий с вовлечением дистального русла
Рис. 18.2. Диффузное поражение коронарных артерий с вовлечением дистального русла
Важнейшим фактором успеха операции считается сохранная сократительная функция, интегральным показателем которой является фракция выброса (ФВ) левого желудочка, определяемая по эхокардиографии или по рентгеноконтрастной вентрикулографии. Фракция выброса, или фракция изгнания, определяется как отношение ударного объема к конечному диастолическому объему левого желудочка, выраженное в процентах, т.е. она показывает какой процент притекающей в диастолу крови ЛЖ выбрасывает в аорту. На практике существуют специальные методы расчета ФВ ЛЖ. При расчете ФВ по вентрикулограмме используют планиметрический метод в стандартной (первой косой) проекции. Принято считать, что нормальное значение ФВ составляет 60-70%. Автор этой главы позволил себе выдвинуть предположение, что «идеальная» ФВ ЛЖ должна
составлять 61,8%, т.е. соответствовать так называемой золотой пропорции. При снижении ФВ менее 40% риск операции значительно возрастает. Снижение ФВ может быть как результатом рубцового поражения, так и ишемической дисфункции. В последнем случае оно обусловлено «гибернацией» миокарда, представляющей собой приспособительный механизм в условиях хронического дефицита кровоснабжения. При определении показаний к АКШ в этой группе больных важнейшим является дифференциация необратимой рубцовой и смешанной рубцово-ишемической дисфункции. Стресс-эхокардиография с добутамином позволяет выявить локальные нарушения сократимости в зонах миокарда и их обратимость. Ишемическая дисфункция потенциально обратима и может регрессировать при успешной реваскуляризации, что дает основания рекомендовать этим больным хирургическое лечение.
Противопоказаниями к аортокоронарному шунтированию традиционно считаются: диффузное поражение всех коронарных артерий, резкое снижение ФВ левого желудочка до 30% и менее в результате рубцового поражения, клинические признаки застойной сердечной недостаточности. Существуют и общие противопоказания в виде тяжелых сопутствующих заболеваний, в частности хронических неспецифических заболеваний легких (ХНЗЛ), почечной недостаточности, онкологических заболеваний. Все эти противопоказания носят относительный характер. При диффузном поражении коронарного русла сохраняют свое значение методы эндартерэктомии из КА в сочетании с АКШ, а в последнее время у таких больных используют лазерную реваскуляризацию, ангиогенную и клеточную терапию. У больных с резким снижением сократительной функции и застойной сердечной недостаточностью все шире выполняют реконструкцию левого желудочка в комбинации с АКШ. Реваскуляризацию миокарда производят и больным с ХНЗЛ, с почечной недостаточностью, в том числе и находящимся на хроническом гемодиализе. Выполняются одномоментные и этапные операции у больных КБС с онкологическими заболеваниями. Преклонный возраст также не является абсолютным противопоказанием к выполнению реваскуляризации миокарда, т.е. более правильно говорить не о противопоказаниях к АКШ, а о факторах операционного риска.
Основными показаниями к реваскуляризации миокарда являются:
1) тяжелая стенокардия, резистентная к медикаментозной терапии;
2) прогностически неблагоприятное поражение коронарного русла - проксимальные гемодинамически значимые поражения ствола ЛКА и основных коронарных артерий с сужениями на 75% и более и проходимым дистальным руслом;
3) сохранная сократительная функция миокарда с ФВ левого желудочка 40% и выше.
техника операции реваскуляризации миокарда
Операция АКШ заключается в создании обходного пути (байпасса) для крови, минуя пораженный (стенозированный или окклюзированный) проксимальный сегмент коронарной артерии. Существует два основных метода создания обходного пути: маммарокоронарный анастомоз и обходное аортокоронарное шунтирование аутовенозным или аутоартериальным трансплантатом (кондуитом). При использовании внутренней грудной артерии ее обычно «переключают» на коронарное русло путем анастомозирования с коронарной артерией ниже стеноза последней. ВГА заполняется естественным путем из левой подключичной артерии, от которой она отходит. При использовании так называемых свободных кондуитов (из больщой подкожной вены, лучевой артерии или ВГА) дистальный конец анастомозируют с коронарной артерией ниже стеноза, а проксимальный - с восходящей аортой (рис. 18.3). Операцию проводят под общим обезболиванием. Параллельно выполняют забор кондуитов и срединную полную стернотомию, выделяют ВГА до места ее отхождения от подключичной артерии. Вскрывают перикард. Проводят полную гепаринизацию. Аппарат искусственного кровообращения (АИК) подключают по схеме: полые вены - восходящая аорта. Искуственное кровообращение (ИК) проводят в условиях нормотермии или умеренной гипотермии (32-28 °С). Для остановки сердца и защиты миокарда используют кардиоплегию: восходящую аорту пережимают между аортальной канюлей АИК и устьями коронарных артерий, после чего в корень аорты ниже зажима вводят кардиоплегический раствор.
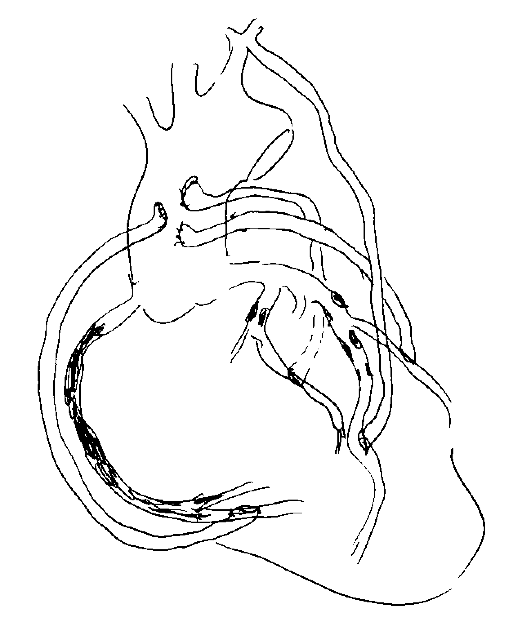 Рис. 18.3. Схема стандартной операции аортокоронарного шунтирования
Рис. 18.3. Схема стандартной операции аортокоронарного шунтирования
Разные хирурги используют различные составы кардиоплегических растворов: фармакохолодовую кристаллоидную кардиоплегию (охлажденный до 4 °С раствор Святого Томаса, Консол, Кустодиол) или кровяную кардиоплегию. При тяжелом поражении коронарного русла помимо антеградной (в корень аорты) применяют и ретроградную (в коронарный синус) кардиоплегию, чтобы обеспечить равномерное распределение раствора и охлаждение сердца. Дренируют левый желудочек через правую верхнюю легочную вену или через восходящую аорту.
Большинство хирургов вначале накладывают дистальные анастомозы аортокоронарных шунтов. Сердце ротируют для доступа к соответствующей ветви. Коронарную артерию вскрывают продольно на относительно мягком участке ниже атеросклеротической бляшки. Накладывают анастомоз конец в бок между трансплантатом и коронарной артерией. Сначала формируют дистальные анастомозы свободных кондуитов, а в последнюю очередь - маммарокоронарный анастомоз. Внутренний диаметр коронарных артерий составляет обычно 1,5-2,5 мм. Чаще всего шунтируют три коронарные артерии: переднюю межжелудочковую, ветвь огибающей и правую. Примерно
у 20% больных требуется выполнение четырех и более дистальных анастомозов (до 8-ми). По окончании наложения дистальных анастомозов после профилактики воздушной эмболии зажим с восходящей аорты снимают. После снятия зажима сердечная деятельность восстанавливается самостоятельно или путем электрической дефибрилляции. Затем на пристеночно отжатой восходящей аорте формируют проксимальные анастомозы свободных кондуитов. Больного согревают. После включения кровотока по всем шунтам постепенно заканчивают ИК. Затем следуют деканюляция, реверсия гепарина, гемостаз, дренирование и ушивание ран.
Существует целый ряд вариантов и модификаций этой стандартной методики АКШ. В качестве кондуитов могут быть использованы не только большая подкожная вена, но также малая подкожная вена и вены руки. Однако они используются только при отсутствии или непригодности большой подкожной вены. В последнее время хирурги все шире используют лучевую артерию в качестве кондуита для АКШ. Существуют данные, свидетельствующие о более высоких показателях отдаленной проходимости лучевой артерии по сравнению с веной. Лучевая артерия обладает большой наклонностью к спазму, в связи с чем при ее использовании больным рекомендуют в течение года после операции принимать антагонисты кальция (дилтиазем). Важной модификацией АКШ является секвенциальное шунтирование, т.е. использование одного кондуита для восстановления кровотока в нескольких коронарных артерий. При этом накладывают один дистальный анастомоз конец в бок и еще 1,2 или 3 анастомоза бок в бок между кондуитом и коронарной артерией. С помощью такого секвенциального шунта шунтируют до 5 коронарных артерий. Объемный кровоток по такому шунту значительно выше, чем по обычному линейному шунту, и считается, что эти шунты дают более высокую проходимость в отдаленном периоде. В последнее время все шире используют так называемые композитные шунты, сформированные из различных кондуитов с использованием У-образных и секвенциальных анастомозов (рис. 18.4, см. на вклейке). Одним из технических вариантов является АКШ в сочетании с эндартерэктомией (ЭАЭ) из коронарных артерий. При поражении ПМЖВ некоторые хирурги используют тотальную открытую ЭАЭ: сосуд вскрывают по передней стенке на всю длину пораженного участка и извлекают атеросклеротический «слепок»
под контролем зрения, освобождая устья септальных и диагональных ветвей. Целостность артерии восстанавливают путем вшивания длинной заплаты из аутовены с последующей имплантацией в нее ВГА (рис. 18.5, см. на вклейке).
Операцию АКШ выполняют в условиях искусственного кровообращения и фармакохолодовой или кровяной кардиоплегии. В качестве кондуитов используют левую ВГА (для ПМЖВ) и свободные аутовенозные трансплантаты для других коронарных артерий. Все шире используются аутоартериальные трансплантаты (например, лучевая артерия).
современные методы реваскуляризации
миокарда
Методы, которые используются для реваскуляризаци миокарда в настоящее время, представлены в табл. 18.1.
Таблица 18.1
Современные методы реваскуляризации миокарда
1. Нехирургические (эндоваскулярные) методы 1.1. Тромболизис 1.2. Транслюминальная баллонная ангиопластика 1.3. Стентирование 2. Миниинвазивная реваскуляризация миокарда 2.1. Операции без ИК через минидоступ (MIDCAB) 2.2. Операции без ИК через стернотомию (OPCAB) 2.3. Операции по методу port access 2.4. Операции с видеоэндоскопической поддержкой 2.5. Полностью эндоскопическая реваскуляризация миокарда (TECAB) 3. Трансмиокардиальная лазерная реваскуляризация (ТМЛР) 4. Терапевтический ангиогенез и клеточная терапия |
Эндоваскулярные методы восстановления кровотока в коронарных артериях
Нехирургические методы реваскуляризации миокарда начали развиваться в 70-е годы прошлого века. Пионером транслюминальной ангиопластики коронарных артерий был А. Грюнтциг. Интракоронарный тромболизис в лечении острого коронарного синдрома впервые применил Е.И. Чазов. Транслюминальная баллонная ангиопластика получила широкое распространение во всем мире. Недостатками этого метода были: достаточно высокий процент осложнений в виде диссекции коронарной артерии с последующим развитием ИМ и тяжелой сердечной недостаточности вплоть до кардиогенного шока и высокая частота рестенозов коронарных артерий в отдаленном периоде. Ситуация кардинально изменилась после внедрения в клиническую практику в середине 90-х годов интракоронарных стентов, представляющих собой плетеный металлический каркас, позволяющий фиксировать атеросклеротическую бляшку после проведения ангиопластики. Стенты решили сразу две проблемы: сетчатый каркас ликвидировал диссекцию коронарной артерии, а в отдаленном периоде препятствовал развитию рестеноза. Однако коронарные стенты не решили проблему рестеноза окончательно. В течение 6 месяцев наблюдения после стентирования коронарных артерий рецидив стеноза отмечается в 15-25% случаев. Наблюдаются 2 типа рестенозов: а) «выпячивание» атеросклеротической бляшки в просвет сосуда у краев стента, б) пролиферация интимы внутри стента с развитием рестеноза. Для профилактики этих осложнений были разработаны специальные стенты, содержащие радионуклиды с коротковолновым излучением. По данным ряда исследований, брахитерапия приводила к уменьшению степени пролиферации интимы в ответ на имплантацию стента. Эти типы стентов просуществовали сравнительно недолго. Относительно недавно на смену им пришло новое поколение стентов, которые сейчас все шире используют в клинической практике. Это так называемые стенты с лекарственным покрытием. Они покрыты специальным препаратом - цитостатиком с целью профилактики интимальной пролиферации и рестеноза. В качестве лекарственного покрытия стентов используются сиролимус, таксол и некоторые другие препараты. Наибольшее распространение в нашей стране получили стенты «CYPHER», содержащие сиролимус. Результаты отдаленного наблюдения за больны-
ми, которым имплантированы стенты с лекарственным покрытием, показывают значительное их преимущество по сравнению с обычными стентами.
Стентирование коронарных артерий получило огромное распространение в силу своей относительно небольшой травматичности. Все более тяжелые типы атеросклеротического поражения коронарных артерий удается лечить с помощью этого метода: стенозы основного ствола ЛКА, «бифуркационные» стенозы, поражения артерий малого диаметра и т.д. Число осложнений сегодня крайне мало, а отдаленные результаты улучшаются. В настоящее время стентирование коронарных артерий постепенно становится альтернативой операциям прямой реваскуляризации миокарда. В развитых странах количество эндоваскулярных процедур соотносится с количеством операций аортокоронарного шунтирования как 1,5-2:1. Тем не менее следует подчеркнуть, что отдаленные результаты стентирования коронарных артерий уступают результатам прямой реваскуляризации миокарда. С другой стороны, стентирование значительно проще повторить, чем операцию. Одно из главных направлений сравнительного исследования двух методов реваскуляризации миокарда заключается в том, чтобы сформулировать точные показания к использованию каждого из этих подходов.
Миниинвазивная реваскуляризация миокарда
С конца 70-х до середины 90-х годов прошлого века в коронарной хирургии наблюдался период относительной стагнации. Были разработаны основные принципы стандартных операций в условиях ИК. Операция давала очень хорошие непосредственные результаты. Отдаленные результаты реваскуляризации миокарда также были весьма удовлетворительными. В этот период времени были проведены многочисленные нерандомизированные и рандомизированные, в том числе многоцентровые исследования, которые показали эффективность этой операции. В 70-80-е годы отдельные хирурги выполняли операции аортокоронарного шунтирования на работающем сердце без искусственного кровообращения. Буффоло и Бенетти, работавшие в Латинской Америке, объясняли эту тактику экономическими проблемами - отсутствием одноразовых оксигенаторов для проведения ИК. В России в 80-е годы большое количество операций АКШ без ИК выполнил А. Михеев. С середины 80-х годов
операции реваскуляризации миокарда на работающем сердце получают распространение в США и странах Западной Европы. Были созданы специальные устройства, позволяющие стабилизировать ограниченный участок миокарда в той области, где накладывают анастомоз с коронарной артерией. В настоящее время используются два основных типа стабилизатора, один из которых стабилизирует миокард путем локального давления, другой - с помощью вакуума. Наибольшее распространение получила система Octopus, основанная на вакуумном принципе.
Существует несколько вариантов реваскуляризации миокарда без ИК. Один из них заключается в том, что выполняют небольшую торакотомию в 5 межреберье слева от грудины (миниторакотомию), выделяют внутреннюю грудную артерию и накладывают анастомоз с ПМЖВ на работающем сердце с применением стабилизатора (так называемая методика MIDCAB). Были использованы и другие минидоступы, например министернотомия. При этих операциях некоторые хирурги пользуются видеоэндоскопической техникой для забора ВГА. В настоящее время подобные операции оставлены большинством хирургов, поскольку их результаты оказались субоптимальными. Кроме того, методика MIDCAB применяется в основном у больных с однососудистым поражением, для которых оптимальным методом реваскуляризации является эндоваскулярная процедура - ангиопластика и стентирование. Большинство хирургов, оперирующих на бьющемся сердце, проводят реваскуляризацию миокарда через обычную стернотомию (OPCAB). Разработаны специальные анестезиологические приемы для успешного проведения таких операций, выполнение которых связано с необходимостью ротировать работающее сердце, при этом важно поддерживать адекватную гемодинамику. Современные достижения хирургии и анестезиологии позволяют выполнять без ИК шунтирование до 5 коронарных артерий, накладывать секвенциальные и композитные шунты, широко использовать аутоартериальные трансплантаты. Существуют хирурги, выполняющие до 80% всех операций реваскуляризации миокарда без ИК. В то же время есть и принципиальные противники этого метода. Большинство хирургов придерживаются дифференцированной тактики, выполняя 15-20% операций АКШ на работающем сердце, хотя в целом следует признать, что количество операций АКШ без ИК во всем мире непрерывно возрастает.
К группе миниинвазивных вмешательств относят также операции, выполняемые по методике port access. Операция заключается в том, что через небольшой прокол («порт») с помощью эндоскопа выделяют ВГА, затем производят подключение ИК путем пункции периферических сосудов. Восходящую аорту пережимают с помощью баллона, введенного через периферическую артерию, и выполняют кардиоплегию, после чего через минидоступ производят реваскуляризацию миокарда. Анастомозы можно накладывать и с помощью современной эндоскопической техники, это так называемая полностью эндоскопическая реваскуляризация миокарда (TECAB). Существует и другая методика TECAB - на работающем сердце. Через «порты» вводят эндоскоп и специальный инструментарий, в том числе министабилизатор миокарда, с помощью которого выполняют маммарокоронарный анастомоз. Эти операции пока не вышли за пределы нескольких клиник.
В самое последнее время начато использование роботов в коронарной хирургии. Робототехника помогает выделять внутреннюю грудную артерию, с использованием робота можно выполнить анастомоз с коронарной артерией. Хирург управляет роботом с помощью джойстиков, при этом полностью устраняется тремор. Созданы роботы, реагирующие на команды, подаваемые голосом хирурга. В НЦ ССХ им. А.Н. Бакулева в июне 1999 года была выполнена первая в мире операция аортокоронарного шунтирования с использованием робота. Наиболее впечатляющим достижением является разработка систем для дистанционной роботохирургии. Сегодня трудно определить, насколько робототехника вытеснит в конце концов хирурга. Однако существует уже новая генерация хирургов, чемто напоминающая современных детей, лихо орудующих джойстиками в компьютерных играх. Не исключено, что в ближайшие десятилетия полностью изменится стиль и метод работы современного хирурга, который будет только манипулировать управляющими устройствами, тогда как робот будет непосредственно с большой точностью производить хирургические манипуляции.
Трансмиокардиальная лазерная реваскуляризация
Идея доставки оксигенированной крови в коронарные сосуды непосредственно из полости ЛЖ (подобно тому, как это происходит у некоторых рептилий) родилась в середине 50-х годов прошлого
века. Массино и Боффи разработали операцию имплантации в миокард стеклянных Т-образных трубочек, один конец которых открывался в полость ЛЖ. Предполагалось, что по этим очень тонким каналам кровь будет поступать из полости ЛЖ непосредственно в сердечную мышцу. Операция Сена (так называемая акупунктура сердца) заключалась в нанесении трансмуральных проколов миокарда специальной иглой в расчете на поступление по образовавшимся каналам оксигенированной крови в коронарные сосуды. Эти операции можно считать прототипами современного метода трансмиокардиальной лазерной реваскуляризации (ТМЛР), который предложен хирургом из Милуоки (США) М. Миросини в середине 80-х годов.
ТМЛР предназначена для больных с диффузным поражением коронарных артерий, которым невозможно выполнить прямую реваскуляризацию миокарда. Вначале предполагалось, что каналы, созданные с помощью высокоэнергетического СО-2 лазера, не будут закрываться подобно механически созданным туннелям, однако гипотеза не подтвердилась. Несмотря на это, после операции ТМЛР отмечается явный положительный клинический эффект - исчезновение или уменьшение стенокардии и повышение толерантности к физической нагрузке. Некоторые авторы указывают на улучшение перфузии миокарда после ТМЛР по данным сцинтиграфии. Положительный клинический эффект объясняют также механизмом симпатической денервации сердца, поскольку лазерное воздействие приводит к разрушению миокардиальных аксонов и к устранению болевого импульса. В последнее время положительный механизм воздействия ТМЛР связывают со стимуляцией ангиогенеза. В нашей стране пионером клинического использования ТМЛР является академик РАМН Л.А. Бокерия. В НЦ ССХ им. А.Н. Бакулева ТМЛР
используется в двух вариантах: изолированно и в сочетании с АКШ (при диффузном поражении одного из коронарных сосудов).
Терапевтический ангиогенез и клеточная терапия
В действительности речь идет о хирургических процедурах. Понятие терапевтический ангиогенез сформулировано в противовес физиологическому (в эмбриогенезе) и патологическому (опухолевый рост, воспаление, травма, ишемия) ангиогенезу. Сущность этого новейшего метода лечения КБС заключается в генетическом воздействии на эндотелий, приводящем к его пролиферации и обра-
зованию новых сосудов. Воздействие производят путем так называемого генного трансфера, т.е. переноса генетической информации в клетку с помощью переносчиков - векторов, в качестве которых используют некоторые вирусы и плазмидные комплексы. В клетке происходит считывание генетической информации и синтез белка (транскрипция и трансдукция), который, воздействуя на специфические рецепторы, приводит к выраженной экспрессии так называемых ангиогенных факторов, важнейшими из которых являются васкулоэндотелиальный фактор роста (VEGF) фибробластный фактор роста (FGF). Ангиогенные факторы были открыты американским хирургом и исследователем Дж. Фолкманом в начале 70-х годов прошлого века, а в 1998 г. они были впервые использованы в клинической практике для стимуляции ангиогенеза у больных с диффузным поражением коронарных артерий. Ангиогенные факторы вводят непосредственно в миокард с помощью шприца при выполнении операции АКШ или ТМЛР. Существуют и катетерные методы введения этих факторов (эндокардиальный и интракоронарный).
Другой новый подход к лечению коронарной болезни заключается в использовании клеточных технологий, т.е. во введении в миокард стволовых клеток, а точнее, мононуклеаров - предшественников эндотелиоцитов. Считается, что это может привести к формированию новых сосудов, которые позволят компенсировать дефицит коронарного кровотока при диффузном поражении коронарных артерий. Результаты использования этих методов нуждаются в дальнейшем изучении.
Среди современных методов реваскуляризации миокарда широкое распространение получили эндоваскулярные процедуры и АКШ на работающем сердце.
непосредственные результаты аортокоронарного шунтирования
Летальность после операций АКШ составляет в большинстве клиник мира около 2%, а некоторые хирурги сообщают о летальности ниже 1%. Следует отметить, что летальность в хорошо оборудован-
ной клинике, где работают квалифицированные специалисты, зависит главным образом от тяжести контингента оперируемых больных. Летальность при операциях у больных с удовлетворительной сократительной способностью миокарда и проходимым дистальным руслом составляет менее 1% и не зависит от количества шунтированных артерий. Основными факторами операционного риска являются.
1. Снижение сократительной функции миокарда с ФВ ЛЖ менее 40%, летальность при этом может возрастать до 5%.
2. Диффузное поражение дистального русла и выполнение ЭАЭ, летальность 6-7%.
3. Пожилой и преклонный возраст: при операциях у больных старше 70 лет риск повышается в 1,5-2 раза.
4. Женский пол большинством хирургов считается фактором, повышающим операционный риск, это обусловлено, прежде всего, меньшим калибром коронарных артерий у женщин, что технически усложняет операцию.
5. Наличие тяжелых сопутствующих заболеваний.
Важным фактором операционного риска является также экстренность вмешательства.
Частота послеоперационного ИМ составляет 2-3%. Инфаркт миокарда после АКШ может быть обусловлен техническими сложностями при выполнении анастомозов, тромбозом шунта, окклюзией боковых ветвей коронарной артерии при выполнении ЭАЭ, неадекватной защитой миокарда. Большинство таких инфарктов являются мелкоочаговыми. Развитие крупноочагового ИМ связано обычно с тромбозом шунта и коронарной артерии.
Наиболее серьезное осложнение операции АКШ - послеоперационная сердечная недостаточность, или синдром низкого сердечного выброса, который обусловлен чаще всего инфарктом миокарда или неадекватной кардиоплегией. Около 15% больных после АКШ требуют инотропной поддержки, т.е. введения катехоламинов (адреналина, норадреналина, допамина, добутрекса).
Изредка наблюдаются другие осложнения: гипоксия и отек головного мозга - 1,5-2%, послеоперационные кровотечения - 3-4%, осложнения со стороны плевры (пневмоторакс или плевральный выпот) - 1-2%, раневые осложнения - менее 1%.
При операциях реваскуляризации миокарда без ИК число осложнений несколько меньше по сравнению с традиционным АКШ.
Некоторые исследователи особенно подчеркивают меньшее число церебральных осложнений при использовании методики OPCAB. Однако основную роль в развитии послеоперационного неврологического дефицита играют манипуляции на восходящей аорте, которые ведут к микроэмболии головного мозга.
Операционная летальность при стандартных операциях АКШ составляет 2%, частота инфаркта миокарда 2-3%, выраженный синдром низкого сердечного выброса развивается у 1,5-2%. Результаты операции зависят от наличия факторов операционного риска, основными из которых являются: экстренность вмешательства, снижение сократительной функции миокарда, пожилой возраст больных и женский пол.
хирургия острых расстройств коронарного кровообращения
К острым расстройствам коронарного кровообращения относят нестабильную стенокардию и ОИМ. Общепризнано сегодня, что возникновение острого коронарного синдрома является показанием к срочной коронарографии. Дальнейшая тактика зависит от результатов исследования. В большинстве случаев целесообразно выполнение эндоваскулярного вмешательства: реканализации, транслюминальной ангиопластики и стентирования коронарной артерии, ответственной за возникновение острого расстройства кровообращения. Вопрос об экстренной или срочной операции может ставиться в том случае, когда выполнение эндоваскулярной процедуры невозможно, а состояние больного не удается стабилизировать. В большинстве случаев больных с нестабильной стенокардией оперируют в отсроченном порядке после стабилизации клинического состояния на фоне медикаментозной терапии.
При остром трансмуральном инфаркте миокарда экстренное хирургическое вмешательство показано только в случае развития жизнеугрожающих осложнений (кардиогенный шок) и невозможности провести реперфузию с помощью эндоваскулярных методов.
При неосложненном течении трансмурального инфаркта миокарда хирургическое лечение не показано.
При интрамуральном (мелкоочаговом) ИМ целью реваскуляризации является обратное развитие инфарктных изменений (при развивающемся инфаркте в первые часы от начала приступа) или «спасение» периинфарктной зоны (в более поздние сроки). Эндоваскулярное вмешательство позволяет осуществить реперфузию значительно быстрее, чем операция. При наличии множественного поражении коронарных артерий после успешного восстановления кровотока инфарктсвязанного сосуда в дальнейшем может потребоваться операция с целью полной реваскуляризации миокарда. Срочное хирургическое вмешательство у больных с интрамуральным инфарктом показано при невозможности эндоваскулярной процедуры и угрозе распространения зоны инфаркта.
Риск АКШ при нестабильной стенокардии и мелкоочаговом инфаркте миокарда выше, чем при стабильной стенокардии, особенно если вмешательство производится экстренно по жизненным показаниям.
Больным с острыми расстройствами коронарного кровообращения показана срочная коронарография. В большинстве случаев при нестабильной стенокардии и остром инфаркте миокарда целесообразно провести реперфузию с помощью эндоваскулярной процедуры. Срочное хирургическое лечение показано при невозможности выполнения эндоваскулярного вмешательства. Операция в отсроченном периоде направлена на осуществление полной реваскуляризации миокарда.
аортокоронарное шунтирование
в особых группах больных
«Особые» группы больных КБС выделяют на основании гендерных и возрастных характеристик. Принято различать 3 группы: пациенток женского пола, больных преклонного возраста и молодых пациентов. Течение и клинические проявления КБС в этих группах имеют целый ряд особенностей. Общим для этих групп пациентов
является то, что они представляют собой группы повышенного операционного риска.
Традиционно принято считать, что женщины реже, чем мужчины, страдают коронарным атеросклерозом, что КБС у них протекает более «доброкачественно» и что это заболевание не является основной причиной смерти в женской популяции. Эти представления являются в значительной степени заблуждением. Действительно, эстрогены потенциально снижают риск развития атеросклероза. Однако в связи с увеличением средней продолжительности жизни, а также с целым рядом других факторов (курение, стрессы, образ жизни) частота КБС у женщин постоянно нарастает. Сегодня общепризнано, что КБС является убийцей ? 1 в популяции женщин так же, как и среди мужчин.
Клиническая картина КБС у женщин характеризуется большей «смазанностью», менее яркой и специфичной симптоматикой. Многие исследователи считают, что существует определенная дискриминация женщин со стороны кардиологов и кардиохирургов как в плане своевременной и современной диагностики КБС, так и в смысле раннего и агрессивного хирургического лечения. По данным целого ряда авторов, реваскуляризация миокарда у женщин связана с более высоким риском развития осложнений и повышенной летальностью по сравнению с мужчинами. Некоторые исследования показали, что женский пол является независимым предиктором, повышающим частоту осложнений и летальных исходов после АКШ. В значительной степени это связано с рядом объективных анатомических факторов. В частности, меньшая площадь поверхности тела и, соответственно, меньший калибр коронарных артерий у женщин являются важными факторами, повышающими риск реваскуляризации миокарда. Однако это говорит лишь о том, что при операциях АКШ у женщин необходим более прецизионный подход.
Повышенный риск реваскуляризации миокарда у пациентов пожилого возраста обусловлен большей частотой сопутствующих заболеваний, таких, как неспецифические хронические легочные заболевания, почечная недостаточность, распространенный атеросклероз с вовлечением нескольких сосудистых бассейнов. Несмотря на это, современная концепция не рассматривает возраст как противопоказание к операции АКШ. Одна из серьезнейших научных статей по этой проблеме была названа авторами следующим образом:
«Реваскуляризация миокарда у 90-летних - трагедия или стратегия?» При решении вопроса о выполнении АКШ у лиц пожилого возраста важнейшее значение имеет тщательное предоперационное обследование и наличие всего арсенала средств для борьбы с возможными осложнениями (дыхательной, почечной недостаточностью, мозговыми осложнениями).
Одной из актуальнейших проблем, особенно в нашей стране, является тяжелая КБС у молодых пациентов. В этой группе больных обычно налицо тяжелые, нередко генетически обусловленные нарушения липидного обмена. Особое значение здесь приобретает дальнейшее лечение пациентов после реваскуляризации миокарда. Может быть, наиболее тяжелую группу больных представляют собой молодые женщины с поражением коронарных артерий. В этой группе риск реваскуляризации миокарда определенно повышен по сравнению с «обычными» больными. Молодые пациентки женского пола нередко страдают семейной гиперхолестеринемией и мультифокальным поражением нескольких сосудистых бассейнов.
Можно выделить еще одну особую группу пациентов с КБС - это больные сахарным диабетом. Поражение коронарного русла в этой группе характеризуются большей диффузностью, вовлечением дистального русла, поражением других сосудистых бассейнов. Сахарный диабет рассматривается рядом авторов как противопоказание к проведению эндоваскулярных процедур, но и при хирургическом лечении риск в этой группе значительно повышен.
В заключение необходимо отметить, что все эти факторы: женский пол, пожилой возраст, молодой возраст, сахарный диабет - нельзя рассматривать как противопоказания к хирургическому лечению, и они не должны служить поводом для дискриминации больных в смысле оказания им адекватной хирургической помощи. Вопрос о хирургическом лечении следует решать в каждом случае индивидуально, основываясь на наличии показаний и условий для реваскуляризации миокарда и проводя стратификацию риска операции на основе принятых международных критериев.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ КБС У БОЛЬНЫХ С ПОРАЖЕНИЕМ СОННЫХ АРТЕРИЙ
В клинической практике в последние годы широко используется термин: мультифокальный атеросклероз. Не являясь вполне корректным с академической точки зрения (атеросклероз всегда мультифокален), этот термин весьма важен в практическом отношении. Под мультифокальным атеросклерозом принято понимать гемодинамически и/или клинически значимое атеросклеротическое поражение двух и более артериальных бассейнов (рис. 18.6). Среди всех вариантов сочетанного атеросклеротического поражения нескольких сосудистых бассейнов наибольшее клиническое и социальное значение имеет сочетанное поражение коронарных и брахиоцефальных артерий, поскольку ИМ и ишемический инсульт являются основными причинами смертности и инвалидизации населения экономически развитых стран, составляя суммарно более 50% в структуре смертности.
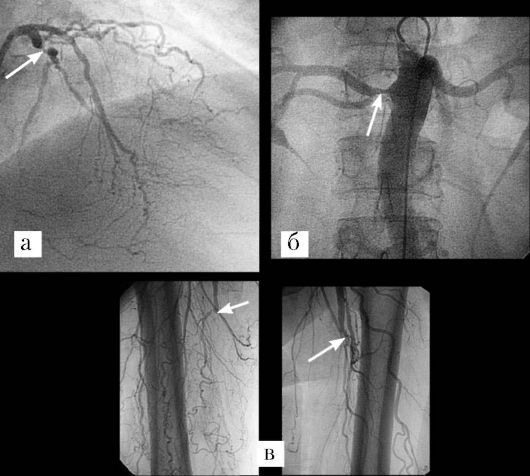 Рис. 18.6. Мультифокальный атеросклероз с поражением: а - коронарных, б - почечных, в - бедренных артерий (ангиограммы)
Рис. 18.6. Мультифокальный атеросклероз с поражением: а - коронарных, б - почечных, в - бедренных артерий (ангиограммы)
Гемодинамически значимое поражение сонных артерий у больных КБС отмечается, по данным разных авторов, в 5-18% случаев, причем более чем у половины больных с сочетанным поражением отсутствуют клинические проявления цереброваскулярной недостаточности. Поэтому современная концепция предполагает необходимость проведения скрининга больных ИБС для выявления асимптомных поражений сонных артерий с помощью ультразвуковой допплерографии и дуплексного сканирования.
Выявление гемодинамически значимого поражения сонных артерий у больного, которому показано АКШ, ставит перед хирургом сложную проблему. Выполнение АКШ на фоне поражения внутренней сонной артерии (ВСА) создает угрозу развития послеоперационного инсульта, обусловленного гипоперфузией головного мозга во время ИК. Выполнение первым этапом каротидной эндартерэктомии (КЭ) позволяет затем более безопасно выполнить реваскуляризацию миокарда, однако при наличии тяжелого поражения коронарного русла и тяжелой стенокардии КЭ весьма часто осложняется развитием острой коронарной недостаточности и ИМ. Поэтому двухэтапная тактика хирургического лечения применима лишь у больных со стабильной стенокардией при относительно благоприятном поражении коронарных артерий. В случае наличия каротидного стеноза у больного с тяжелой КБС показано одномоментное вмешательство: КЭ в сочетании с АКШ.
Одномоментная операция может быть выполнена с использованием различных технологий. Стандартный подход заключается в том, что под одной анестезией вначале выполняют КЭ, а затем проводят АКШ. При таком подходе не исключается развитие коронарной недостаточности на каротидном этапе операции, особенно у больных с тяжелым поражением коронарного русла. Современная технология, разработанная в НЦ ССХ им. А.Н. Бакулева, заключается в том, что каротидный этап вмешательства выполняют в условиях гипотермического ИК, т.е. выделяют сонную артерию, производят стернотомию, подключают АИК и выполняют оба этапа вмешательства в условиях ИК. Данная методика позволяет защитить миокард путем поддержки его с помощью ИК и в то же время оптимально защитить головной мозг на этапе ЭАЭ из сонной артерии за счет системной гипотермии. Опыт показал, что подобные большие операции, восстанавливающие кровообращение одновременно в головном мозге и
в миокарде, имеют несколько более высокий риск развития мозговых и коронарных осложнений, чем обычное АКШ, но риск этот значительно меньше, чем риск двухэтапных операций у больных с сочетанным поражением коронарных и сонных артерий. В последнее время у больных с относительно стабильным состоянием коронарного кровообращения используют методику одномоментной операции без ИК, выполняя вначале КЭ, а следом - АКШ на бьющемся сердце.
Среди больных с сочетанным атеросклеротическим поражением коронарных и брахиоцефальных артерий можно выделить особую группу пациентов с интраторакальной локализацией поражения ветвей дуги аорты (брахиоцефальный ствол и устье левой общей сонной артерии). В таких случаях необходимость одномоментной реконструкции диктуется самой локализацией процесса и общностью хирургического доступа (стернотомия). У таких больных производят одномоментно протезирование супрааортальных ветвей и АКШ.
По данным НЦ ССХ им. А.Н. Бакулева РАМН, при одномоментных операциях КЭ и АКШ летальность составила 5%, частота послеоперационного инфаркта миокарда - 4%, частота послеоперационного инсульта - 3,5%.
Больным КБС необходимо проводить ультразвуковое исследование брахиоцефальных артерий. При наличии гемодинамически значимого поражения сонных артерий у кандидатов на операцию АКШ следует решать вопрос об одномоментном хирургическом вмешательстве и на сонных артериях.
повторная реваскуляризация миокарда при рецидиве стенокардии в отдаленном периоде после акш
Аутовенозные аортокоронарные шунты подвергаются со временем так называемым поздним изменениям, главным образом фиброинтимальной гиперплазии и атеросклерозу. Эти изменения могут приводить в конечном итоге к тромбозу шунтов и рецидиву стенокардии. Частота тромбоза аортокоронарных шунтов в течение первого года после операции составляет около 10%, что обусловлено технически-
ми ошибками при проведении вмешательства. В дальнейшем частота окклюзии шунтов составляет 3-4% ежегодно, к 10-му году после операции около 50% аутовенозных шунтов окклюзированы. Результаты использования аутоартериальных кондуитов значительно лучше. Проходимость шунтов из ВГА к 10-му году после операции составляет 95%. Публикация этих данных привела к тому, что большинство хирургов стали использовать ВГА для шунтирования самого главного коронарного сосуда - ПМЖВ, который некоторые кардиологи называют «рекой жизни». По мере увеличения сроков после первичных операций количество больных с рецидивом стенокардии увеличивается, и в настоящее время в ведущих клиниках выполняется до 10% повторных операций от общего количества АКШ. Основные причины рецидива стенокардии в отдаленном периоде после АКШ представлены в табл. 18.2.
Таблица 18.2
Причины рецидива стенокардии после АКШ
1. Исходно неполная реваскуляризация.
2. Ранний тромбоз шунта (результат технической ошибки).
3. Спазм шунта (при использовании аутоартериальных кондуитов).
4. Фиброинтимальная гиперплазия с развитием стенозов в шунте.
5. Прогрессирование атеросклероза:
• в аортокоронарных шунтах;
• в нешунтированных артериях;
• в дистальных отделах шунтированных артерий.
Наиболее частой причиной рецидива стенокардии после АКШ является поражение аортокоронарных шунтов. У больных со стенозами ранее наложенных аортокоронарных шунтов и нешунтированных коронарных артерий в отдаленном периоде после АКШ возможно выполнение эндоваскулярных процедур. Иногда при полной окклюзии шунтов удается выполнить эндоваскулярное вмешательство на шунтированной коронарной артерии и восстановить нативный кровоток.
При множественном поражении ранее наложенных аортокоронарных шунтов показана повторная реваскуляризация миокарда.
Повторные операции технически более сложны, чем первичные. Они требуют кардиолиза (выделения сердца из спаек). Технические проблемы могут возникать также при канюляции сосудов, проведении кардиоплегии, наложении дистальных и проксимальных анастомозов. Значимой проблемой является выбор кондуитов, часть из которых уже использована при первичном вмешательстве, а также проблема функционирующих (стенозированных) шунтов, которые могут быть повреждены при доступе. В результате всего этого риск повторных операций примерно в два раза выше, чем риск первичного АКШ. В последнее время ряд хирургов выполняют повторную реваскуляризацию миокарда на бьющемся сердце без ИК.
Лучшим методом профилактики рецидива стенокардии после АКШ большинство хирургов считает полную аутоартериальную реваскуляризацию. Существуют и другие пути профилактики, в частности подавление фиброинтимальной гиперплазии аутовенозных шунтов с помощью генетических методов. Важнейшим фактором профилактики тромбоза шунтов является адекватная антиагрегантная, противотромботическая, спазмолитическая и гипохолестеринемическая терапия в отдаленном периоде после АКШ.
Основным путем снижения частоты рецидива стенокардии в отдаленном периоде после АКШ является максимально широкое использование аутоартериальных кондуитов для реваскуляризации миокарда и адекватная антиагрегантная терапия в послеоперационном периоде. Повторные операции АКШ связаны с повышенным риском, но они широко используются у больных с рецидивом стенокардии.
хирургическое лечение постинфарктной аневризмы сердца и ишемической
кардиомиопатии
Инфаркт миокарда приводит к развитию аневризмы сердца у 5-15% больных. По локализации принято различать аневризмы передней стенки ЛЖ, связанные с поражением передней межжелудочковой артерии, аневризмы задней стенки, обусловленные обычно окклюзией правой коронарной артерии. Весьма редко встречаются аневризмы боковой стенки, в результате тромбоза огибающей артерии или ее ветвей. Классификация Л.А. Бокерия и Г.Г. Федорова включает следующие типы аневризм (табл. 18.3).
Таблица 18.3
Классификация постинфарктных аневризм по Л.А. Бокерия и Г.Г. Федорову
По локализации
I а тип. Переднеперегородочно-верхушечные
I б тип. Переднеперегородочно-верхушечные с преимущественным поражением межжелудочковой перегородки
II тип. Передневерхушечные
III тип. Заднебазальные
IV тип. Гигантские аневризмы с поражением всех стенок ЛЖ
По виду аневризмы
1. П лоскостные
2. Мешотчатые
3. Грибовидные
По морфологии стенки
1. Фиброзные
2. Фиброзно-мышечные
3. Ложные
Большая постинфарктная аневризма передней стенки ЛЖ представлена на рис. 18.8 (см. на вклейке).
Первые операции при постинфарктной аневризме сердца были выполнены в начале 50-х годов ХХ века Ч. Бейли без искусственного кровообращения. Специальный зажим накладывали на «шейку» аневризматического мешка, после чего аневризму удаляли, выпускали струю крови из левого желудочка с тем, чтобы «вымыть» тромбы, и рану сердца ушивали над зажимом. Подобные вмешательства сопровождались очень высокой летальностью. Первую операцию по поводу аневризмы сердца в условиях ИК выполнил знаменитый американский хирург Д. Кули в 1958 году. С тех пор ИК стало «золотым стандартом» аневризмэктомии, а сама техника вмешательства претерпела ряд серьезных модификаций.
При операции по методу Кули целостность стенки ЛЖ после резекции аневризмы восстанавливали путем наложения линейного шва. Для предупреждения прорезывания швов использовали тефлоновые прокладки. При этом возникали две проблемы: тефлоновые прокладки играли роль «распорки», затрудняющей сокращения левого желудочка. Другая проблема заключалась в наличии дискинезии межжелудочковой перегородки, которую не удавалось устранить при таком методе резекции. С целью ликвидации дискинезии МЖП было предложено несколько вариантов так называемой септопластики посредством плицирующих швов или синтетической заплаты. В 1984 году бразильский хирург А. Жатене опубликовал статью с программным названием - «Аневризмэктомия левого желудочка: резекция или реконструкция». В этой статье он выдвинул новый принцип хирургической коррекции постинфарктной аневризмы: при выполнении операции следует стремиться к восстановлению нормальной формы и кривизны левого желудочка, приближающейся к тому, что было до перенесенного инфаркта миокарда. Для достижения этой цели - нормализации геометрии полости ЛЖ - Жатене применил следующий метод. На «шейку» аневризматического мешка после резекции он накладывал «кисетный» шов, с помощью которого выполнял циркулярное сужение устья аневризмы. Суженное отверстие затем закрывали швом на прокладках. Данная методика широко используется и в настоящее время. Она позволяет сформировать полость ЛЖ, близкую к норме. Операция Жатене не решает проблемы дискинезии МЖП при ее значительном рубцовом поражении. В 70-е годы в литературе появились сообщения об успешном использовании синтетических заплат для замещения участка стенки левого
желудочка после иссечения некротизированного участка миокарда при остром инфаркте. В 1974 году Р. Стоуни описал свой метод пластики постинфарктной аневризмы по типу «полы пальто» или «сэндвича». Метод Стоуни заключался в том, что, резецируя аневризму, хирург оставлял часть рубцовой ткани на свободной боковой стенке левого желудочка и подшивал ее край к границе рубцово-измененной и мышечной части МЖП, после чего создавал дупликатуру из рубца
МЖП.
В 1985 году хирург из Монако В. Дор сообщил о новой операции, которую он назвал «циркулярная пластика эндовентрикулярной заплатой». Несколько позже, в 1989 году все тот же Д. Кули, пионер аневризмэктомии, имеющий наибольший в мире опыт этих операций, описал аналогичный метод под своим именем, назвав его «эндоаневризмографией».
Классическими показаниями к хирургическому лечению постинфарктной аневризмы левого желудочка являются:
1) стенокардия;
2) сердечная недостаточность;
3) тромбоэмболический синдром;
4) желудочковые аритмии;
5) комбинация этих симптомов.
Стенокардия у больных с постинфарктной аневризмой может быть обусловлена наличием самой аневризмы, поскольку она приводит к повышению нагрузки на сохранную часть миокарда. Кроме того, ишемия миокарда перианевризматической области может быть связана с поражением соответствующей коронарной артерии. Однако в большинстве случаев стенокардия у больных с постинфарктной аневризмой обусловлена множественным поражением коронарных артерий. В настоящее время более 90% операций по поводу аневризмы сердца являются комбинированными, т.е. включают в себя резекцию аневризмы и шунтирование пораженных коронарных артерий. В большинстве случаев у больных с постинфарктной аневризмой передняя межжелудочковая артерия окклюзирована. Нередко, однако, мы видим резкий стеноз ПМЖВ в проксимальном отделе - в этих случаях, очевидно, имела место спонтанная реканализация сосуда в отдаленные сроки после тромбоза. В части случаев имеется тотальная окклюзия ПМЖВ с облитерацией ее дистальных отделов. Чем больше площадь рубцового поля, тем чаще ПМЖВ тотально пора-
жена и, следовательно, нешунтабельна. Тем не менее во всех случаях следует стремиться к шунтированию ПМЖВ даже при отсутствии проходимости дистальных отделов с целью восстановления кровотока в септальных ветвях.
В последние годы в целом ряде исследований доказано, что при площади рубцового поля более 15-20% от площади стенки ЛЖ, даже при отсутствии симптомов, происходит дальнейшая дилатация полости ЛЖ, быстро приводящая к развитию необратимой сердечной недостаточности. Поэтому в настоящее время сам факт наличия аневризмы сердца площадью 15% и выше с индексом конечно-диастолического объема ЛЖ более 100 мл/м1 является показанием к хирургическому лечению.
Метод пластики левого желудочка при постинфарктной аневризме по В. Дору с помощью заплаты заключается в следующем. После вскрытия аневризмы и тщательного удаления тромботических масс выкраивают синтетическую заплату таким образом, чтобы закрыть устье аневризматического мешка путем подшивания краев заплаты по границе рубца и относительно нормального миокарда. Некоторые модификации (Л.А. Бокерия) включают предварительное сужение устья кисетным швом, проведенным по границе фиброзной и мышечной ткани (прием Жатене), что позволяет уменьшить площадь заплаты. Остатки аневризмы сшивают над заплатой. Эта операция позволяет полностью исключить рубцовую ткань из полости левого желудочка и достичь его оптимальной конфигурации и объема (рис. 18.9, см. на вклейке).
Другим вариантом операции В. Дора является использование в качестве заплаты собственной фиброзной ткани МЖП в тех случаях, когда она достаточно плотна и отсутствуют изъязвления и тромботические наложения на эндокарде. Для этого межжелудочковую перегородку расслаивают, отделяя внутренний фиброзный слой, который затем подшивают в виде заплаты к свободной стенке ЛЖ после сужения устья аневризмы кисетным швом. В результате образуются две верхушки сердца - для правого и для левого желудочков.
Совершенно новое направление в хирургическом лечении тяжелых и осложненных форм ИБС - хирургическое лечение ишемической кардиомиопатии. Ишемическая кардиомиопатия - комплексное клинико-анатомическое понятие, включающее в себя следующие основные элементы: а) рубцово-ишемическую дисфункцию миокар-
да со снижением ФВ ЛЖ до 35% и ниже, б) ремоделирование левого желудочка с резкой дилатацией его полости, в) частое развитие относительной митральной недостаточности.
Выше мы говорили, что снижение сократительной функции миокарда с ФВ ЛЖ 40% и менее является основным фактором риска хирургического лечения КБС. Однако если снижение сократительной способности миокарда обусловлено обратимой ишемической или рубцово-ишемической дисфункцией, то эффективная реваскуляризация миокарда может привести к частичному или полному восстановлению контрактильности. При решении вопроса о потенциальной обратимости дисфункции важное диагностическое значение имеют стресс-эхокардиография с добутамином, сцинтиграфия миокарда с Tl-201 в покое и при физической нагрузке, а также позитронноэмиссионная и однофотонно-эмиссионная томография.
В литературе имеется большое количество сообщений об успешной реваскуляризации миокарда у больных с ФВ ЛЖ 20% и ниже, в том числе и у больных, находившихся на листе ожидания пересадки сердца. Операционный риск в этой группе, конечно, выше, чем у больных с сохранной сократительной способностью. Реваскуляризация миокарда у этих больных может улучшить показатели сократительной функции, но она не приводит к значительному сокращению объема левого желудочка и нормализации его геометрических соотношений. С этой целью были предложены другие методы. Бразильский хирург Дж. Батиста в середине 90-х годов прошлого века предложил операцию ремоделирования левого желудочка при дилатационной кардиомиопатии, которая заключалась в резекции клиновидного участка миокарда в относительно бессосудистой зоне между передней диагональной ветвью и ветвью тупого края с удалением до 30% площади миокарда левого желудочка, что приводит к значительному уменьшению его полости. Рану сердца зашивают двухрядным швом на тефлоновых прокладках. Около 20% таких операций сочетаются с протезированием или пластической реконструкцией митрального клапана. Операция Батисты действительно приводит к резкому уменьшению объема левого желудочка и улучшению его геометрических параметров, однако она сопровождается очень высокой операционной летальностью, достигающей 20% и более. Кроме того, в отдаленные сроки после вмешательства у значительной части больных наблюдаются дальнейшая дилатация ЛЖ и рецидив СН. Все
это привело к тому, что оригинальная операция Батисты в настоящее время полностью оставлена. Разработана модификация этого метода, которая заключается в пликации свободной стенки левого желудочка без резекции, что также приводит к редукции его полости, дополнительно сердце окутывают синтетической сеткой с целью профилактики дальнейшего растяжения левого желудочка.
Наиболее эффективным вмешательством у больных ишемической кардиомиопатией, с нашей точки зрения, является геометрическая реконструкция ЛЖ типа операции Дора. В большинстве случаев перед вшиванием заплаты производится циркулярное
сужение ЛЖ кисетным швом. При наличии выраженной относительной митральной регургитации выполняем пластику митрального клапана по методу Альфиери (так называемая бабочка) или другие варианты аннулопластики. По нашим данным, эта операция приводит к значительной редукции объема ЛЖ, нормализации его геометрических соотношений и резкому возрастанию ФВ, что подтверждается результатами чреспищеводной эхокардиографии прямо на операционном столе (рис. 18.10). Обязательным компонентом вмешательства является полная реваскуляризация миокарда.
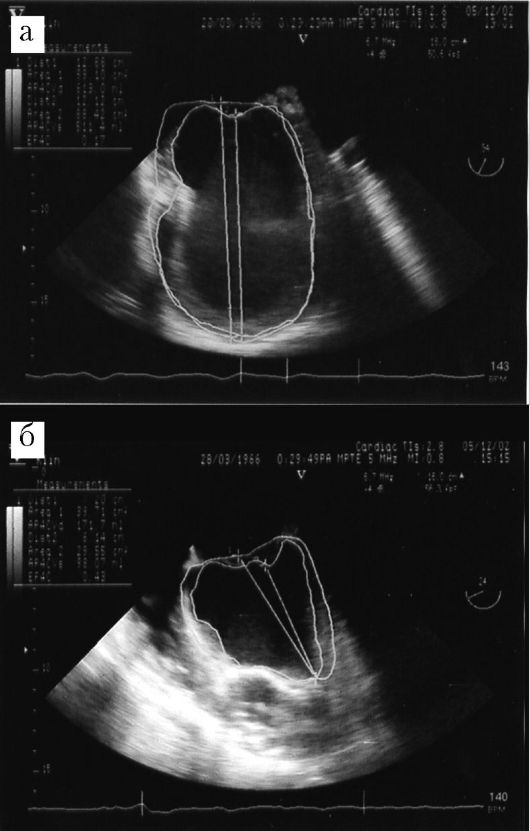 Рис. 18.10. Динамика
эхокардиографической картины после геометрической реконструкции ЛЖ: а -
до операции; б - после операции; значительное уменьшение объема ЛИС
Рис. 18.10. Динамика
эхокардиографической картины после геометрической реконструкции ЛЖ: а -
до операции; б - после операции; значительное уменьшение объема ЛИС
Применение описанной методики реконструкции ЛЖ и нормализации геометрии его полости с использованием синтетической заплаты привело к резкому улучшению результатов хирургического лечения и позволило значительно расширить пределы операбельности больных аневризмой сердца и ишемической кардиомиопатией. Операция геометрической реконструкции приводит к значительному уменьшению конечного диастолического объема левого желудочка, к нормализации формы его полости и резкому возрастанию фракции выброса. Операция позволяет приблизить соотношение длинника ЛЖ и его поперечников (индексов сферичности) к норме и оптимизировать вектор сокращения ЛЖ.
Основными показаниями к операции у больных с постинфарктной аневризмой сердца и ишемической кардиомиопатией являются: сердечная недостаточность, стенокардия, тромбоэмболический синдром, желудочковые аритмии, площадь рубцового поля 15% и более от площади поверхности левого желудочка. Геометрическая реконструкция ЛЖ в комбинации с пластикой митрального клапана и реваскуляризацией миокарда является наиболее эффективным методом хирургического лечения ишемической КМП.
хирургия «механических» осложнений инфаркта миокарда
Одним из наиболее грозных осложнений в течении острого инфаркта миокарда является разрыв межжелудочковой перегородки. Наиболее часто разрыв происходит на 8-10-е сутки от начала развития инфаркта в фазе миомаляции. Более 50% больных умирают в течение первых двух часов от момента разрыва, около 80% - в течение 1 месяца. Летальность зависит главным образом от размеров возникшего дефекта и, соответственно, величины сброса крови слева направо.
Клиническая картина разрыва МЖП характеризуется резким ухудшением состояния больного, развитием сердечной недостаточности вплоть до кардиогенного шока, возникновением грубого
систолического шума над всей поверхностью сердца с эпицентром во 2-3 межреберье слева от грудины, острым появлением признаков перегрузки правых отделов сердца, относительной трикуспидальной недостаточности, венозного застоя, гепатомегалии, олигурии и гемодинамической легочной гипертензии.
Стабилизировать состояние больного удается обычно только с помощью внутриаортальной баллонной контрпульсации (КП ВАБ). До недавнего времени хирургическая тактика была выжидательной: при стабилизации состояния на фоне КП ВАБ операцию стремились выполнить не ранее чем через 3-4 недели после разрыва. Обоснованием данной тактики являлись плохие результаты операций в ранние сроки, обусловленные прорезыванием швов через размягченный миокард. В последние годы хирургическая тактика резко видоизменилась, что связано с изменением техники хирургического вмешательства и использованием операций типа эндовентрикулярной пластики с помощью заплаты.
Методика имплантации синтетической или ксеноперикардиальной заплаты, исключающей инфарцированный миокард и дефект межжелудочковой перегородки из полости левого желудочка, позволила значительно улучшить результаты операций. Поэтому в настоящее время принято оперировать постинфарктный разрыв МЖП в срочном и даже экстренном порядке, не допуская развития полиорганной недостаточности и необратимых изменений системной циркуляции.
Другим жизнеугрожающим осложнением острого инфаркта миокарда является острая митральная регургитация, обусловленная в большинстве случаев разрывом папиллярной мышцы с пролабированием одной из створок в полость левого предсердия. Это осложнение, так же как и разрыв МЖП, возникает обычно в фазе миомаляции, на 8-10-е сутки от начала острого инфаркта миокарда. Клинические симптомы во многом сходны с симптомами разрыва МЖП: возникновение грубого систолического шума и острое развитие отека легких и симптомов застойной СН. Дифференциальный диагноз с разрывом МЖП легко проводится с помощью эхокардиографии. Хирургическое вмешательство при острой митральной регургитации заключается в пластике или протезировании митрального клапана, при этом используется доступ через зону инфаркта. В литературе имеется ряд сообщений об одновременной коррекции
нескольких механических осложнений острого инфаркта миокарда: протезировании митрального клапана в сочетании с закрытием постинфарктного ДМЖП, пластикой левого желудочка и аортокоронарным шунтированием.
Так называемый наружный разрыв сердца является редким, но наиболее грозным осложнением ОИМ. Разрыв сердца происходит в фазу миомаляции, на 8-10-е сутки от начала инфаркта. Разрыв обычно носит щелевидный характер и нередко локализуется на боковой стенке ЛЖ в зоне кровоснабжения ветвей огибающей артерии. Разрыв сердца чаще наблюдается у пациенток женского пола. Считается, что проведение системного тромболизиса в острой фазе ИМ повышает вероятность разрыва свободной стенки ЛЖ. В большинстве случаев смерть наступает мгновенно от тампонады сердца. Иногда успевшие образоваться перикардиальные сращения препятствуют развитию массивного гемоперикарда, а излившиеся сгустки сдавливают щелевидный дефект стенки ЛЖ, что дает возможность выполнить экстренное хирургическое вмешательство, которое заключается в пластике левого желудочка с помощью заплаты. В редких случаях больные переживают острую фазу разрыва, и в дальнейшем у них формируется ложная аневризма левого желудочка.
К «механическим» осложнениям острого инфаркта миокарда относят постинфарктный разрыв межжелудочковой перегородки, острую митральную регургитацию в результате разрыва папиллярной мышцы и наружный разрыв сердца. Агрессивная хирургическая тактика с использованием современных технологий позволяет спасти часть этих больных.
вспомогательное кровообращение в хирургическом лечении больных кбс
Основным методом вспомогательного кровообращения, применяемым в хирургическом лечении КБС, является контрпульсация (противопульсация) внутриаортальным баллоном (КП ВАБ).
Идея метода родилась в середине 50-х годов прошлого века, когда были разработаны системы для проведения «кровавой» контрпуль-
сации: с помощью специального устройства кровь из аорты забирали во время систолы желудочков и возвращали обратно во время диастолы. В 1958 г. Моулопулос разработал, а в 1964 г. Кантровиц впервые применил в клинике внутриаортальный баллон для контрпульсации. Механизм действия этого аппарата вспомогательного кровообращения заключается в том, что раздувание баллончика, введенного в нисходящую грудную аорту через бедренную артерию хирургическим путем или пункционно, во время диастолы приводит к увеличению перфузионного давления в коронарных артериях, а резкое опустошение баллона во время систолы желудочков снижает постнагрузку. Раздувание баллончика производят гелием синхронизированно с зубцом R ЭКГ или с кривой АД в режиме контрпульсации.
Контрпульсация в коронарной хирургии может быть использована как после операции при развитии синдрома низкого сердечного выбро-
Таблица 18.4
Показания к применению контрпульсации
Послеоперационная контрпульсация Синдром низкого сердечного выброса
• АД среднее ниже 55 мм рт. ст.
• СИ менее 2,1 л/(мин-м1)
• Доза адреналина > 0,1 мкг/(кг-мин)
• Давление заклинивания в легочной артерии выше 18 мм рт.ст.
• Диурез менее 1,0 мл/мин
Профилактическая контрпульсация
Экстренная реваскуляризация миокарда при нестабильной стенокардии, остром инфаркте миокарда, кардиогенном шоке
• Поражение ствола ЛКА при левом типе коронарного кровообращения или поражение ствола ЛКА + поражение ПКА в сочетании с нестабильной стенокардией и/или снижением сократительной способности миокарда
• Выраженное снижение сократительной способности миокарда (ФВ менее 35%), ишемическая кардиомиопатия
• Большая аневризма сердца со снижением ФВ сокращающейся части ЛЖ
са (послеоперационная контрпульсация), так и в предоперационном периоде у больных с исходно критическим поражением коронарного русла и миокарда (профилактическая контрпульсация). Показания к использованию контрпульсации представлены в табл. 18.4.
Помимо контрпульсации, в коронарной хирургии используются и более эффективные системы вспомогательного кровообращения, такие, как обход левого и правого желудочков с помощью искусственных желудочков сердца при крайней степени послеоперационной сердечной недостаточности и невозможности отключить больного от ИК на фоне максимальной инотропной терапии и контрпульсации.
заключение
В ХХ веке коронарная хирургия прошла грандиозный и драматичный путь развития. Недаром кардиохирургию и коронарную хирургию называют одним из важнейших достижений ХХ века наряду с освоением космоса. Робкие попытки непрямых и прямых вмешательств на коронарных сосудах, производившиеся в первой половине века, вылились в мощный поток операций реваскуляризации миокарда после 1970 года. Коронарная хирургия привнесла в понимание этиологии, патогенеза, патофизиологии, механизмов развития и динамики коронарной болезни сердца огромное количество позитивной информации, во много раз превышающее то, что дали предшествовавшие 200 лет ее изучения. Сегодня можно с уверенностью сказать, что без коронарной хирургии не было бы ни современной фармакотерапии КБС, ни ангиопластики, ни стентов, ни новейших генных и клеточных технологий. Не следует забывать, что этот прогресс добыт кровью хирургов и кровью их пациентов. Хирургия, в принципе, - антифизиологичный способ лечения. Существует точка зрения, в соответствии с которой расцвет хирургии - признак несовершенства медицины. Я глубоко убежден в том, что будущее в лечении КБС - за таблеткой и, более того, - за профилактикой, быть может, на основе генетики. Уже сегодня мы видим, как коронарная хирургия медленно начинает умирать, уступая место эндоваскулярным процедурам и других новейшим технологиям. Развиваясь по спирали, коронарная хирургия, как все в жизни, завершает свой
виток развития. Возможно, через какие-нибудь 25-50 лет она прекратит свое существование, по крайней мере, в том виде, как мы ее знаем, и останется только в истории. Но это - прекрасная, героическая и чрезвычайно поучительная история.