Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. - 2008. - Т. 1. - 672 с. : ил.
|
|
|
|
ГЛАВА 10 АТЕРОСКЛЕРОЗ: ОБЩАЯ ХАРАКТЕРИСТИКА И МОРФОГЕНЕЗ
Атеросклероз (А) - одно из самых распространенных заболеваний на Земле. Частота атеросклероза во всех странах мира за последние 40-50 лет значительно возросла. Осложнения атеросклероза - коронарная болезнь сердца (КБС), инфаркт миокарда (ИМ), мозговой инсульт (МИ) - являются одними из наиболее частых причин инвалидизации и смертности в большинстве стран мира. Макроскопически атеросклеротические поражения делятся на три типа: липидные бляшки или полоски, бляшки, осложненные поражения (изъязвления, кальциноз, тромбоз). За последние годы атеросклероз помолодел. Начальные проявления атеросклероза, протекающие бессимптомно, выявляются уже у детей. Различные артерии в силу особенностей строения и гемодинамической нагрузки подвергаются атеросклерозу неодинаково: в аорте атеросклеротические изменения наиболее выражены в брюшном отделе, для коронарных артерий наиболее характерен атерокальциноз, для почечных артерий - фиброзные бляшки, располагающиеся в устьях артерий.
Ключевые слова: атеросклероз, артериосклероз, факторы риска, морфогенез атеросклероза.
ОБЩАЯ ХАРАКТЕРИСТИКА АТЕРОСКЛЕРОЗА И АРТЕРИОСКЛЕРОЗА
Термин «атеросклероз» («атер» - кашица, «склерозис» - затвердение) был предложен Маршаном в 1904 г. для обозначения заболевания, при котором возникают поражения крупных и средних сосудов: эластического и мышечно-эластического типа. Процесс начинается с нарушения целостности эндотелия, с последующей липидной инфильтрацией и разрастанием соединительной ткани c образованием фиброзных бляшек, суживающих просвет артерий, что приводит по мере прогрессирования атеросклероза к расстройствам кровообращения. Весь процесс происходит в интиме сосудов.
Следует знать разницу между понятиями «атеросклероз» и «артериосклероз», последний был описан значительно раньше - в 1829 году. Артериосклероз поражает артерии разного калибра, в том числе мелкие и даже артериолы, проявляется под воздействием разнообразных агентов (например, инфекционных - сифилитический артериосклероз; артериолосклероз при гипертензии), не сопровождается отложением в стенке липидов, и сам процесс затрагивает среднюю оболочку сосудов - медию. Высказывается мнение, что атеросклероз является метаболическим артериосклерозом, некоторые авторы рассматривают атеросклероз как частный случай артериосклероза, однако эти точки зрения не получили широкого распространения.
Атеросклероз не является частным случаем артериосклероза и представляет самостоятельное заболевание, связанное с липидной инфильтрацией поврежденной интимы крупных и средних артерий, разрастанием соединительной ткани с образованием фиброзных бляшек, суживающих просвет сосудов.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ АТЕРОСКЛЕРОЗА
В XIX в. главенствовали две теории патогенеза А.
1. Теория К. Рокитанского (1852), базирующаяся на признании основной роли образования пристеночных тромбов в развитии А.
2. Теория Р. Вирхова (1856), в которой ведущая роль отводилась очаговой клеточной пролиферации и инссудации плазмы в сосудистую стенку.
В начале XX в. появилась инфильтративная теория Н.Н. Аничкова, в которой главенствующим моментом в патогенезе А было проникновение липидов в интиму артерий.
Современная концепция этиологии и патогенеза атеросклероза объединяет элементы всех трех этих теорий, однако, несмотря на интенсивное их изучение, некоторые вопросы этиологии и патогенеза А до сих пор остаются во многом неясными.
Выраженное влияние возраста и образа жизни людей на заболеваемость А оправдывает тенденции рассматривать это заболевание как проблему не только медицинскую, но и относящуюся к биологии старения, а также как социально зависимую.
Большое практическое значение имеет изучение общих и индивидуальных факторов риска заболевания атеросклерозом. Показано, что А выявляется чаще и в более молодых возрастных группах населения в странах с более высоким экономическим потенциалом, у жителей городов, людей умственного труда и лиц, подвергающихся стрессам (например, машинистов поездов, водителей автомобилей). На основании этих данных некоторые исследователи относят А к болезням, обусловленным социальной эволюцией.
К наиболее значимым индивидуальным факторам риска заболевания А, кроме принадлежности индивида к вышеперечисленным социальным группам, относятся: неблагоприятная по А наследственность, что особенно сказывается на возникновении в молодом возрасте; мужской пол (или дефицит у женщин эстрогенных гормонов, задерживающих развитие болезни); возраст старше 40 лет; АГ; гиподинамия, курение табака; гипофункция щитовидной железы (ее гиперфункция существенно препятствует атерогенезу); избыточная масса тела; нарушения углеводного обмена (СД); повышение вязкости и свертываемости крови; наличие дислипопротеинемии, характеризующейся повышенным содержанием в плазме крови
липопротеидов низкой плотности (ЛНП) и очень низкой плотности (ЛОНП), либо сниженным содержанием липопротеидов высокой плотности (ЛВП).
На развитие А оказывают большое влияние наследственные факторы, возраст, пол, избыточное питание, курение, гиподинамия, наличие артериальной гипертензии, избыточная масса тела, уровень половых гормонов и гормонов щитовидной железы, наличие диабета.
Роль гиперхолестеринемии в атерогенезе, впервые показанная еще в 1912 г. Н.Н. Аничковым и С.С. Халатовым на модели А у кроликов, уточнена в 60-80-е годы данными о ЛНП и ЛОНП как основных источниках липидной инфильтрации артериальных стенок, предшествующей образованию фиброзных бляшек. Установлено, что белковый компонент одного из классов ЛНП является рецептором холестерина, ответственным за перенос его из плазмы крови в клетки, в то время как ЛВП, напротив, осуществляют акцепцию холестерина с клеточных мембран и переносят его к местам катаболизма, препятствуя тем самым липидной инфильтрации стенок артерий. Вероятность развития А тем выше, чем больше отношение (ЛНП + ЛОНП) к ЛВП, называемое индексом атерогенеза, происходящего, как предполагают, при значениях этого индекса выше 3-3,5. Если в норме перенос холестерина в клетки регулируется как балансом ЛНП и ЛВП, так и уменьшением числа рецепторов холестерина на клетку по мере его поступления, то при высокой концентрации в плазме ЛНП возможен рецепторнезависимый путь избыточного проникновения холестерина в клетку. В образовании фиброзной бляшки, возможно, участвуют также некоторые липопротеиды класса А, обладающие высоким сродством к фибрину и, вероятно, переносящие его в клетку.
Вероятность развития А тем выше, чем выше индекс атерогенеза: отношения содержания в крови (ЛНП + ЛОНП) к содержанию ЛВП. Значение этого индекса 3-3,5 является критическим.
Важный для понимания этиологии А вопрос, являются ли нарушения баланса липопротеидов первопричиной или же только фак-
тором, способствующим инфильтрации уже измененной сосудистой стенки, остается дискуссионным. В пользу первичности изменений сосудистой стенки свидетельствуют: очаговый характер нарушений утилизации ею холестерина; преимущественная локализация атеросклеротических бляшек в участках артериальной системы, которые в большей степени подвергаются гемодинамическому удару (например, так называемые ритмические структуры аорты) или в которых возникают завихрения потока крови (устья артериальных ветвей); морфологическая неоднородность клеток эндотелия по периферии фиброзной бляшки и участие в ее морфогенезе локальных нарушений свертываемости крови; нередкое расхождение между выраженностью А и степенью гиперхолестеринемии. Имеются морфологические и экспериментальные подтверждения атерогенной роли очаговых изменений структуры и функции артериальных стенок, предшествующих их липидной инфильтрации. Как один из факторов повреждающего воздействия на эндотелий рассматривается артериальная гипертензия.
В пользу первичности изменений сосудистой стенки при развитии А свидетельствуют данные о развитии атеросклеротических бляшек в местах наиболее подверженных гемодинамическому удару (на месте ритмических структур), в устьях артериальных ветвей; нередкое расхождение между уровнем гиперхолестеринемии и выраженностью А, морфологическая неоднородность эндотелия сосудов по периферии бляшек.
В последние годы происходит переоценка ключевых положений патогенеза атеросклероза с позиций развития иммунного воспаления в сосудистой стенке. Этому способствуют: 1) установление факта, что модифицированные в результате перекисного окисления ЛП низкой плотности (мЛПНП), образующиеся в крови и сосудистой стенке, в первую очередь ответственны за формирование атеросклеротических поражений артерий; 2) обнаружение при атеросклерозе в крови и особенно в сосудистой стенке аутоиммунных комплексов, включающих мЛПНП в качестве антигена; 3) изучение изменений клеточного состава в очагах атерогенеза с анализом медиаторов воспаления.
Такой подход к рассмотрению патогенеза и морфогенеза атеросклероза во многом созвучен с оценкой воспаления, представленной
И.В. Давыдовским: «...воспаление по существу является приспособительной реакцией в отношении факторов внешней среды, а следовательно, и биологически целесообразной».
Кроме того, известна связь атеросклероза по крайней мере с двумя инфекционными агентами: цитомегаловирусом и хламидией, вызывающей пневмонию. Они обнаруживаются в сосудах, пораженных атеросклерозом и в самих бляшках. Хламидия, например, обнаруживается в коронарных артериях у 80% больных атеросклерозом, в здоровых непораженных атросклерозом артериях хламидии обнаруживаются только в 4% случаев. В процессе формирования атеросклеротической бляшки принимают участие многие индукторы и активаторы воспаления, а также клеточная популяция, характерная для иммунного воспаления, что позволяет трактовать атерогенез как хроническую воспалительную реакцию замедленного типа.
Связь атерогенеза с иммунным воспалением подтверждают: обнаружение при А в крови и сосудистой стенке аутоиммунных комплексов, включающих мЛПНП в качестве антигена, а также наличие медиаторов воспаления и клеточного состава, характерного для хронической воспалительной реакции гиперчувствительности замедленного типа. Обнаружена связь А по крайней мере с двумя инфекционными агентами - цитомегаловирусом и хламидией, вызывающей пневмонию.
МОРФОГЕНЕЗ АТЕРОСКЛЕРОЗА
Пусковым моментом в развитии атеросклероза являются 2 процесса:
1) избыточное проникновение в эндотелий белков плазмы, содержащих липопротеиды (ЛП) низкой плотности (ЛПНП) и их накопление в субэндотелиальном пространстве (СЭП);
2) избирательный захват внутренней оболочкой сосудов моноцитов крови (рис. 10.1). Последний процесс значительно ускоряется при гиперлипидемии. Гемодинамическое давление, особенно в местах разветвления сосудов, способствует повреждению эндотелия и прежде всего его гликокаликса. С применением электронного
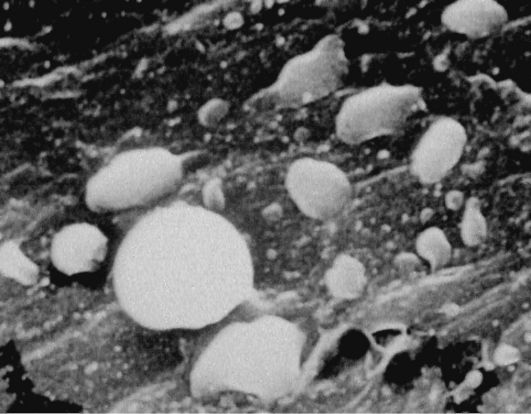 Рис. 10.1. Очаговая
адгезия моноцитов на эндотелии аорты крысы при экспериментальной
гиперхолестеринемии. Сканирующая электронная микроскопия. Ув. χ 8 600
Рис. 10.1. Очаговая
адгезия моноцитов на эндотелии аорты крысы при экспериментальной
гиперхолестеринемии. Сканирующая электронная микроскопия. Ув. χ 8 600
микроскопа доказано, что в местах, предрасположенных к развитию атеросклероза, между эндотелиальными клетками обнаруживаются мигрирующие в просвет сосуда макрофаги.
Атеросклеротические поражения делятся на три типа, наблюдаемые в сосудах макроскопически: липидные пятна или полоски; атеросклеротические бляшки; осложненные поражения (изъязвления бляшек, кальциноз, тромбоз).
Некоторыми авторами также выделяется долипидная стадия А, заключающаяся в разрыхлении и исчезновении наружного защитного слоя эндотелия - гликокаликса, расширении межэндотелиальных промежутков, активации эндоцитоза, что приводит к повышению проницаемости интимы.
Макроскопически атеросклеротические поражения делятся на три типа: липидные пятна или полоски, атеросклеротические бляшки, осложненные поражения (изъязвления, кальциноз, тромбоз). Выделяют также долипидную стадию А,
когда разрушается гликокаликс, расширяются межэндотелиальные пространства, повышается проницаемость интимы для поступления в нее липопротеидов, отмечается пролиферация интимацитов (гладкомышечных клеток и мигрировавших моноцитов крови).
Моноциты крови прикрепляются к эндотелию, в местах формирования атероматозной бляшки происходит экспрессия адгезивных молекул и продуцируются различные вещества типа селектинов, интегринов и интерлейкинов. Адгезивные молекулы способствуют агрегации тромбоцитов, лимфоцитов и других клеток крови, что приводит к дальнейшему повреждению эндотелия. Факторы роста, выделяющиеся, в частности, из тромбоцитов, способствуют пролиферации и активации секреторной активности гладкомышечных клеток (рис. 10.2).
В субэндотелиальном пространстве моноциты подвергаются активации и происходит их дифференциация в макрофаги. Макрофаги
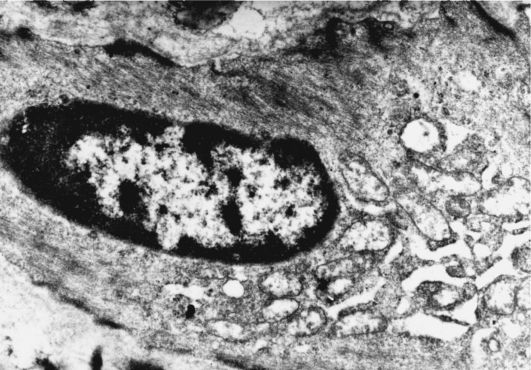 Рис. 10.2. Активированная
гладкомышечная клетка из области ритмических структур аорты человека,
видны хорошо развитые аппараты синтеза - расширенные цистерны
шероховатой эндоплазматической сети. Трансмиссионная электронная
микроскопия. Ув. χ 13 000
Рис. 10.2. Активированная
гладкомышечная клетка из области ритмических структур аорты человека,
видны хорошо развитые аппараты синтеза - расширенные цистерны
шероховатой эндоплазматической сети. Трансмиссионная электронная
микроскопия. Ув. χ 13 000
увеличиваются в размерах, в них возрастает содержание клеточного белка, усиливаются процессы пиноцитоза и фагоцитоза, увеличивается образование супероксидных анионов, различных ферментов (активатор плазминогена, коллагеназа, эластаза, липопротеинлипаза), происходит синтез большого количества активных липидов, образуются пенистые клетки. Кроме того, гладкомышечные клетки также захватывают большое количество плазменных липидов и холестерина и также превращаются в пенистые клетки.
В начальной стадии атерогенеза моноциты крови внедряются в поврежденный слой эндотелия, одновременно с этим происходит накопление ЛП в субэндотелиальном пространстве, пролиферация и активация синтетической активности гладкомышечных клеток, моноциты трансформируются в макрофаги, накапливают липиды, цитоплазма их приобретает пенистый вид - образуются пенистые клетки.
Жировая полоска. Стадия липоидоза характеризуется очаговой инфильтрацией интимы липидами (холестерином), липопротеидами, что ведет к образованию жировых (липидных) пятен и полос. Макроскопически такие жировые пятна выглядят в виде участков желтого цвета, которые иногда могут сливаться и образовывать плоские удлиненные полосы, не возвышающиеся над поверхностью интимы. В этих участках при применении красителей на жиры в изобилии выявляются липиды. Липиды накапливаются в гладкомышечных клетках и макрофагах, которые, как уже отмечалось, получили название пенистых, или ксантомных, клеток (от греч. хапЬкоз - желтый). В эндотелии также появляются липидные включения, что свидетельствует об инфильтрации интимы липидами плазмы крови. Наблюдается набухание и разрушение эластических мембран. Раньше всего жировые пятна и полоски появляются в аорте у места отхождения ее ветвей, затем в крупных артериях. Появление подобных пятен еще не означает наличие атеросклероза, поскольку появление липидных пятен можно наблюдать в раннем детском возрасте не только в аорте, но и в коронарных артериях. Жировые полоски появляются в интиме аорты уже у детей в возрасте 3-6 лет. В артериях мышечно-эластического типа, например в коронарных, они появляются у взрослых в тех местах, где позднее разовьется атероматозная бляшка. Эндотелий, покрывающий жировые полоски,
обычно истончается и выбухает над скоплением пенистых клеток, многие из которых плотно прилегают к клеткам эндотелия. Липиды в основном расположены внутриклеточно, и в пенистых клетках еще не наблюдаются явления некроза. Гладкомышечные клетки мигрируют в субэндотелиальное пространство, где захватывают некоторые ЛП (ЛПНП и ЛПОНП ) с образованием биполярных липидных включений. Жировые полоски не создают препятствий кровотоку и на их месте не обязательно в дальнейшем разовьется бляшка. На секционном материале нередко можно видеть липидные пятна и атеросклеротические бляшки одновременно, что говорит о новом этапе прогрессирования А. С возрастом липидные пятна в подавляющем большинстве случаев исчезают, но могут служить основой для образования новых фиброзных бляшек.
Липидные пятна и полоски являются результатом захвата липидов, а также их синтеза гладкомышечными клетками, моноцитами и макрофагами с образованием пенистых или ксантомных клеток. Появление липидных пятен отмечается уже в детском возрасте, они не всегда трансформируются в атеросклеротические бляшки.
Ключевым моментом в прогрессировании атеросклероза является некроз пенистых клеток с высвобождением жировых компонентов и образованием атеросклеротической бляшки. Гибель пенистых клеток происходит в результате цитотоксического действия частиц ЛПНП, которые накапливаются в интиме артерий с образованием гранулематозных очагов, включающих макрофаги, лимфоциты, многоядерные клетки и некоторые другие компоненты. Происходит пролиферация гладкомышечных клеток и синтез ими элементов соединительной ткани. Образующаяся фиброзная ткань окружает липидные массы, как бы стараясь изолировать их от окружающих тканей. Среди аморфной ткани липидов часто обнаруживаются кристаллы холестерина, остатки соединительнотканных волокон, детрит пенистых клеток.
При дальнейшем прогрессировании атеросклероза формируется зрелая бляшка. Бляшки могут быть разных размеров: от булавочной головки до нескольких сантиметров в диаметре. Фиброзные бляшки выступают в просвет сосудов, затрудняя ток крови, а в артериях среднего калибра, например в коронарных, могут вызвать полную
или частичную окклюзию (рис. 10.3, см. на вклейке). При облитерации просвета артерии более 50% проявляются признаки недостаточного кровоснабжения органа - ишемия. Под микроскопом видно, что атеросклеротические бляшки содержат 3 компонента: клеточный, волокнистый и липидный. Атероматозные бляшки развиваются ассиметрично. При липосклерозе происходит пролиферация фибробластов, рост которых стимулирует разрушение макрофагов (ксантомных клеток) и разрастание в интиме молодой соединительной ткани. Последующее созревание этой ткани сопровождается формированием фиброзной бляшки. Макроскопически фиброзные бляшки представляют собой плотные, круглой или овальной формы образования белого или желтовато-белого цвета, возвышающиеся над поверхностью интимы. Применение красителей на жиры в фиброзных бляшках позволяет выявить липиды. Эти бляшки суживают просвет, что сопровождается нарушением притока крови (ишемией) к органу. Наиболее часто фиброзные бляшки наблюдаются в брюшной аорте, в отходящих от аорты ветвях, в артериях сердца, мозга, почек, нижних конечностей, сонных артериях и др.
При атероматозе липидные массы, расположенные в центральной части бляшки, и прилежащие коллагеновые и эластические волокна распадаются. В образованной мелкозернистой аморфной массе обнаруживаются кристаллы холестерина и жирных кислот, обрывки эластических и коллагеновых волокон, капельки нейтральных жиров (атероматозный детрит). Выявляется обилие ксантомных клеток, лимфоцитов и плазмоцитов. Атероматозные массы отграничены от просвета сосуда слоем зрелой, гиалинизированной соединительной ткани (покрышка бляшки).
Прогрессирование атероматозных изменений ведет к истончению и деструкции покрышки бляшки (рис. 10.4, см. на вклейке). Этот период характеризуется большим числом разнообразных осложнений. Наступает стадия изъязвления, сопровождающаяся образованием атероматозной язвы. Края такой язвы неровные, дно образовано мышечным, а иногда адвентициальным слоем стенки сосуда. Дефект интимы нередко покрывается тромботическими наложениями. В результате некроза глубоких слоев стенки сосуда может формироваться аневризма (выпячивание стенки). Нередко кровь отслаивает интиму от среднего слоя и тогда возникают расслаивающие аневризмы. Опасность этих осложнений заключается в возможности разрыва или аневризмы, или стенки сосуда в местах возникновения
атероматозных язв. Атероматозные массы могут вымываться током крови и формировать эмболы.
Атерокальциноз характеризуется отложением в фиброзные бляшки солей кальция, т. е. их обызвествлением (петрификацией). Это завершающая стадия атеросклероза. Вместе с тем необходимо помнить, что отложение солей кальция может наблюдаться и на его более ранних стадиях. Бляшки приобретают каменистую плотность, стенка сосуда в месте петрификации резко деформируется. Соли кальция откладываются в атероматозные массы, в фиброзную ткань, в межуточное вещество между эластическими волокнами.
Некоторые авторы выделяют 2 фазы развития атеросклеротической бляшки: атерогенная, может протекать как бессимптомно, так и клинически, проявляться в виде синдрома хронической ишемии; тромбогенная, она характеризуется наличием зрелой атеросклеротической бляшки с высоким содержанием липидов (эфиров холестерина и кристаллов). Нарушение поверхности бляшки (разрывы фиброзной покрышки, трещины) приводят к адгезии тромбоцитов на поверхности бляшки.
Зрелая бляшка может продолжать медленно расти и постепенно окклюзировать просвет сосуда, либо в результате тромбоза или разрыва бляшки возникает острая ишемия (нестабильная стенокардия или ИМ). Бляшка, богатая липидами, более склонна к разрывам и тромбообразованию, чем фиброзная бляшка, содержащая много коллагена и кальция.
«Летальные бляшки» растут поперек тока крови, они часто подвергаются крекингу, вскрытию и часто сопровождаются летальным исходом. Это так называемые нестабильные бляшки.
Атеросклеротическая бляшка, выпячиваясь в просвет сосуда, приводит к сужению (стенозу) его просвета (стенозирующий атеросклероз). Медленная окклюзия сосудов приводит к гипоксии органов и развитию мелкоочагового склероза. Острые осложнения атеросклероза обусловлены возникновением тромбов в области нестабильной бляшки, дистальных эмболий вследствие этих тромбов, спазмом сосудов. Возникает острая окклюзия сосудов, что ведет к острой ишемии органов вплоть до развития инфарктов (инфаркт миокарда, серое размягчение мозга, гангрена конечности и др.). Иногда происходит разрыв аневризмы сосуда.