Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. - 2008. - Т. 1. - 672 с. : ил.
|
|
|
|
ГЛАВА 6 РАДИОНУКЛИДНАЯ ДИАГНОСТИКА В КАРДИОЛОГИИ
Методы радионуклидной диагностики впервые были применены для регистрации центральной гемодинамики у больных с сердечнососудистой патологией в середине 30-х гг. ХХвека. По мере совершенствования регистрирующей аппаратуры от обычных гамма-счетчиков, сканеров до однофотонной и позитронной томографии, а также внедрения целого спектра меченых радиофармпрепаратов радионуклидная диагностика превратилась в самостоятельную дисциплину. В кардиологии особый прогресс стал очевиден после синтеза целого ряда кардиотропных препаратов, особенно 201Tl - хлорида таллия-201, при помощи которого стало возможным оценивать состояние перфузии миокарда. Отличительной особенностью ядерной медицины является определение функционально-морфологического состояния органов и систем организма с возможностью количественной оценки как нормальных биологических, так и различных патологических процессов. Проведение радиодиагностических исследований с использованием радиофармпрепаратов (РФП) в индикаторных дозах значительно ниже по лучевым нагрузкам, чем любая рентгенологическая процедура. Сегодня в практике ядерной медицины используется более ста меченых препаратов и постоянно разрабатываются новые. Высочайшая специфичность радиофармпрепаратов к различным органам и заболеваниям в ближайшие годы позволит визуализировать воспалительные процессы, тромбозы, изменения рецепторики и метаболизма органов и многие другие физиологические, патофизиологические и патоморфологические процессы.
Ключевые слова: радионуклидная диагностика, радиофармпрепараты.
ВВЕДЕНИЕ
Значительные успехи в клиническом распознавании коронарной болезни сердца и выяснении некоторых патогенетических механизмов ишемической болезни сердца (ИБС) стали возможны благодаря достижениям ядерной медицины. Особое место среди радионуклидных методов исследования в клинической кардиологической практике принадлежит перфузионной сцинтиграфии миокарда (СЦМ) с 201Tl, которая применяется уже более 20 лет и по праву считается методом выбора среди неизвазивных методов исследования в диагностике ИБС. С помощью СЦМ появилась возможность атравматичным путем получать уникальную информацию о кровоснабжении миокарда на уровне микроциркуляции.
Совершенствование технического оснащения ядерных диагностических исследований позволяет получать томосцинтиграфические изображения с использованием γ-излучающих изотопов при однофотонной эмиссионной компьютерной томографии (ОЭКТ) и позитронно-эмиссионной томографии (ПЭТ) с применением ультракороткоживущих РФП.
Методы ядерной кардиологии играют значительную роль в оценке состояния перфузии и сократительной функции миокарда, его метаболических и рецепторных нарушений, а также их взаимосвязи с состоянием симпатической иннервации (схема 1).
КЛИНИЧЕСКИЕ ЗАДАЧИ ЯДЕРНОЙ КАРДИОЛОГИИ
• Изучение патогенеза, дифференциальная диагностика и прогноз коронарогенных и некоронарогенных повреждений миокарда.
• Оценка функционального состояния сердечно-сосудистой системы.
• Топическая диагностика структурно-метаболических и рецепторных нарушений.
• Оценка жизнеспособности миокарда.
• Диагностика преходящей ишемии миокарда.
• Определение тактики лечения.
• Оценка репаративных процессов.
На схеме представлены методы радионуклидной оценки сердечной деятельности.
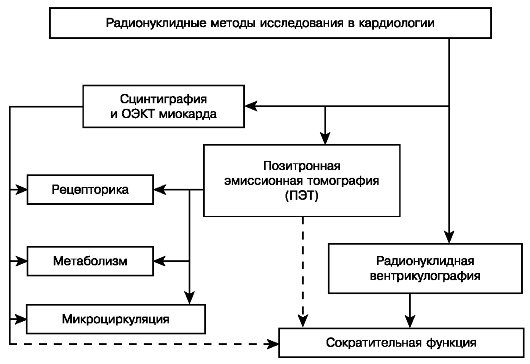 Схема 1. Методы радионуклидной оценки сердечной деятельности
Схема 1. Методы радионуклидной оценки сердечной деятельности
Радиодиагностические исследования при ОИМ
Сцинтиграфические исследования не потеряли свою актуальность для выявления очагов некроза и точной локализации распространенности процесса.
Препарат пирфотех, 99тТс, после внутривенного введения выводится из крови и накапливается в скелете. Через 3-5 ч в скелете концентрируется более 30-35% от введенного количества препарата. В крови к этому времени содержится 10-15%, с мочой экскретируется 35% введенного препарата. Пирфотех через 2 ч активно поглощается в зоне ИМ и в клетках злокачественных новообразований яичников, что позволяет использовать его для визуализации очагов острого ИМ и опухолей яичников. В норме данный РФП в миокард не включается.
В клинике среди радионуклидных методов наибольшее применение получила сцинтиграфия миокарда с 99тТс пирофосфатом, который накапливается в зоне ОИМ (рис. 6.1, см. на вклейке). Достоверное локальное включение 99тТс пирофосфата определяется не ранее 20 ч от возникновения ИМ и в последующие 5-6 дней практически не изменяется, а затем интенсивность включения начинает снижаться. При неосложненном течении ИМ на сцинтиграммах исчезают патологические очаги накопления к 8-14 сут в зависимости от величины и глубины поражения и через 2 ч при использовании 99тТс пирофосфата. Больным после внутривенного введения 99тТс пирофосфата выполняется полипозиционная статистическая сцинтиграфия грудной клетки в 5-ти стандартных проекциях: передняя, передняя левая косая (ПЛК) 30 гр., ПЛК 45 гр., ПЛК 60 гр. и боковая. Интенсивность включения препарата оценивают по шкале от 0 до 3. Достоверным считают включение 99тТс пирофосфата в миокард, сопоставимое с включением в грудину и выше, что соответствует оценке в 2 и 3 балла. Анализ сцинтиграмм в 5-ти проекциях позволяет определить как наличие, так и локализацию РФП в миокарде.
Помимо сцинтиграфии с 99тТс пирофосфатом используется отечественный РФП - 99тТс технетрила (99тТс метилизобутилизонитрил - МИБИ) для оценки состояния перфузии миокарда и в том числе для диагностики ИМ. Этот РФП включается в липидный обмен кардиомиоцитов и отражает состояние перфузии здорового миокарда ЛЖ. Таким образом, при этом исследовании область инфаркта представляет собой дефект перфузии в зоне инфаркта
конкретной артерии. Оптимальные сцинтиграфические изображения миокарда ЛЖ получаются через 30-90 мин после введения МИБИ (рис. 6.2, см. на вклейке).
Сцинтиграфия миокарда с 99тТс-пирофосфатом позволяет определить локализацию и распространенность острого ИМ.
В последние годы с внедрением ОЭКТ проводится томографическая сцинтиграфия, при которой с большей разрешающей способностью определяется локализация и размеры очагового поражения. Особый эффект достигается при нижней локализации инфаркта и его небольших размерах. Ложноположительные результаты могут быть отмечены у больных с нестабильной стенокардией, однако характер включения РФП носит при этом диффузный характер. Вероятность таких результатов достигает 17%, что может быть вызвано повышенной аккумуляцией РФП в области сердца наряду со стенокардией, кардиомиопатией, состоянием после электроимпульсного лечения аритмий, ушибом миокарда и др. Чувствительность сцинтиграфии миокарда с 99тТс, пирфотехом, составляет 88%, специфичность - 70,0%, точность метода - 85,2%.
ПЕРФУЗИОННАЯ СЦИНТИГРАФИЯ И ОЭКТ МИОКАРДА
Применение перфузионной сцинтиграфии миокарда позволяет оценить состояние перфузии и характер нарушения кровоснабжения миокарда, степень выраженности, распространенности и обратимости повреждения миокарда при различных заболеваниях (например, гипертоническая болезнь, сахарный диабет и др.), сопровождающихся поражением миокарда.
Перфузионная сцинтиграфия миокарда основана на оценке распределения внутривенно введенного РФП в сердечной мышце. Распределение РФП происходит пропорционально коронарному кровотоку и отражает его распределение в миокарде. Перфузионная сцинтиграфия является методом, предназначенным для выявления областей относительного или абсолютного снижения кровотока вследствие ишемии или рубцового повреждения миокарда. Оценка
распределения перфузии по характеру распределения РФП может проводиться в покое, в сочетании с различными нагрузочными пробами, либо в покое и при нагрузке. Регистрация изображения может проводиться с применением плоскостной сцинтиграфии миокарда (СЦМ), однофотонной эмиссионной компьютерной томографии (ОЭКТ) или позитронной эмиссионной томографии (ПЭТ). Для визуализации перфузии миокарда применяются РФП, которые экстрагируются и удерживаются миокардом в течение различных временных интервалов. Результаты могут анализироваться визуально либо с применением полуколичественных и количественных подходов. Относительное региональное распределение РФП в миокарде и клиренс регистрируются при помощи СЦМ и ОЭКТМ (рис. 6.4, см. на вклейке). Количественное определение значений миокардиального кровотока осуществляется с помощью ПЭТ. Для визуализации перфузии миокарда методом ОЭКТ применяется РФП - хлорид таллия 201Tl и РФП, меченые 99тТс, такие как МИБИ (метоксиизобутилизонитрил) или тетрофосмин.
Сцинтиграфия миокарда с 201Т1 и 99тТс дают возможность изучать микроциркуляцию (перфузию) миокарда.
Основные показания к применению перфузионной сцинтиграфии миокарда
• Диагностика ишемии или рубцового повреждения миокарда, определение:
- локализации;
- распространенности и тяжести ишемии миокарда или рубцового повреждения.
• Диагностика атеросклеротического поражения коронарных артерий, определение:
- локализации (бассейн коронарной артерии);
- распространенности (число бассейнов коронарных артерий).
• Оценка степени стеноза коронарной артерии и его влияние на региональную перфузию:
- определение функциональной значимости анатомического поражения коронарных артерий, выявленного при ангиографии.
• Оценка жизнеспособности миокарда:
- ишемические изменения или рубцовые;
- предсказание улучшения функции после реваскуляризации.
• Оценка (прогноз) степени риска у пациентов:
- после ИМ;
- предоперационная оценка риска перед большими хирургическими вмешательствами у больных с высоким риском развития коронарных осложнений.
• Контроль и оценка эффективности лечения после:
- коронарной реваскуляризации;
- медикаментозной терапии по поводу застойной сердечной недостаточности (СН) или стенокардии;
- мероприятий по изменению образа жизни. Противопоказания к проведению перфузионной сцинтиграфии
миокарда: беременность, период лактации у женщин.
Описание метода. Проведение исследования
Перфузионную сцинтиграфию миокарда обычно рекомендуется выполнять в сочетании с различными нагрузочными или фармакологическими пробами, поскольку это дает возможность более точно дифференцировать стабильные и преходящие дефекты перфузии.
1. Плоскостная сцинтиграфия миокарда. Исследование выполняют в положении больного «лежа на спине». Учитывая форму и анатомическое положение сердца в грудной клетке, регистрация изображения при СЦМ проводится в трех стандартных проекциях: передней, левой передней косой (для лучшей визуализации перегородки, обычно 45°) и левой боковой 90°.
2. Однофотонная эмиссионная компьютерная томография миокарда.
Метод отличается от ПСЦ, в том, что детектор гамма-камеры совершает оборот вокруг пациента и запись изображения обычно проводится с ротацией детектора по круговой, эллипсоидной орбите или по контуру тела на 180°, или на 360°.
Для визуализации перфузии миокарда применяют целый ряд РФП, представленные в табл. 6.1.
Таблица 6.1
Физические и дозиметрические характеристики применяемых РФП
Наименование | Характеристика препарата | Механизм включения |
201Т1-хлорид | Моновалентный катион, металл Биологический аналог калия | Активный транспорт через клеточную мембрану с помощью K-Na АТФ-азы |
99тТс-МИБИ | Катионный липофильный комплекс: 4-меток- си, 2-изобутилизонит- рил | Пассивный транспорт через клеточную мембрану |
99lnMyoview | Катионный липофильный комплекс: 1,2бис[бис(2-этокси- этил) фосфинолэтан | Пассивный транспорт через клеточную мембрану |
"тТс-ТеоЬогох1те | Нейтральный липофильный комплекс: циклогександиондиоксим + борная кислота | Пассивный транспорт через клеточную мембрану |
201Tl. Визуализацию миокарда на гамма-камере начинают не позднее, чем через 10 мин после внутривенного введения. Первоначально регистрируют исходные сцинтиграммы, и через 2-4 ч (или более поздние, через 18-24-72 ч в зависимости от задач исследования) после введения РФП проводят повторную запись изображения сердца в тех же проекциях, что и при исходном исследовании. Отсроченные сцинтиграммы регистрируют с целью дифференциации ишемии, рубцового повреждения и гибернированного миокарда.
99mTc-MMBM. Существуют два основных варианта проведения исследования. Первый из них подразумевает проведение исследования в покое и при нагрузке в один день, второй - проведение двух исследований последовательно в течение двух дней. Перфузия миокарда в норме представлена на рис. 6.3 (см. на вклейке).
На рисунке 6.4 (см. на вклейке) представлены томосцинтиграммы одного и того же пациента, где видно значительное увеличение размеров дефектов перфузии при нагрузке.
Помимо диагностических задач с помощью перфузионной сцинтиграфии миокарда можно оценить эффективность медикаментозного лечения, реваскуляризации миокарда, а также аортокоронарного шунтирования (рис 6.5, см. на вклейке) .
С этой целью исследование перфузии миокарда выполняют исходно до начала лечения (реваскуляризации, тромболизиса, диеты и т.д.), далее - на разных сроках после лечения.
Локализацию области нарушенного кровоснабжения в миокарде определяют по отделам левого желудочка (ЛЖ) и, соответственно, бассейну кровоснабжаемой артерии. В передней проекции на плоскостных сцинтиграммах бассейну передней нисходящей артерии (ПНА) [возможно, огибающей артерии (ОА)] соответствует переднебоковая стенка, нижнеперегородочная область соответствует бассейну правой коронарной артерии (ПКА) (возможно, ОА), верхушка - ПКА, возможно ПКА и ОА. В левой передней косой проекции переднеперегородочная область соответствует бассейну ПНА, заднебоковая стенка - ОА, нижневерхушечная - ПКА. В левой боковой проекции визуализируется переднеперегородочный сегмент, базальные отделы передней стенки, которые соответствуют бассейну кровоснабжения ПНА, а также нижне-задняя, заднебазальная стенки, соответствующие бассейну ПКА, и верхушка ЛЖ (возможно кровоснабжение из бассейнов всех трех артерий).
При обработке томограмм проводится реконструкция изображения в трех плоскостях: поперечные, фронтальные и саггитальные.
Распределение миокардиальной активности изотопа в различных сегментах левого желудочка дает представление о кровоснабжении миокарда в бассейнах основных коронарных артерий. При обработке изображений можно оценивать распространенность и степень повреждения миокарда. При отсутствии артефактов на изображении производится выбор областей миокарда для количественной обработки, определяются его границы, затем программа вычисляет и выводит на экран параметры относительного распределения миокардиальной активности РФП (вымывания при исследовании с 201Т1).
Распределение миокардиальной активности РФП при томографии может быть выведено на дисплей в системе полярных координат, в виде так называемого бычьего глаза (bull's eye). При этой форме представления результатов срезы, полученные по короткой оси, концентрически располагаются от верхушки к основанию ЛЖ, что позволяет получить информацию о распределении РФП. Срезы, бли-
жайшие к основанию ЛЖ по короткой оси, картируются как наружное кольцо «бычьего глаза». Все последующие срезы от основания до верхушки располагаются концентрически от наружного кольца к центру «бычьего глаза». Центр «бычьего глаза» представлен данными, полученными из срезов по длинной оси в пределах сектора 60° в обе стороны от верхушки (рис. 6.6, см. на вклейке)
Интерпретация/форма представления результатов
Оценка изображений проводится с целью выявления областей концентраций РФП на томо- и/или сцинтиграммах в покое и при нагрузке. Области миокарда с концентрацией РФП ниженормальных значений в покое обычно отражают рубцовые изменения. Снижение концентрации РФП, видимое в покое и усугубляющееся при нагрузке, обычно свидетельствует о наличии ишемии миокарда.
Выявленные на сцинтиграммах и томограммах области со сниженной концентрацией РФП называются дефектами перфузии (ДП) и классифицируются как стабильные и преходящие.
Стабильные ДП регистрируются на всех изображениях без изменений: на исходных в покое, исходных и отсроченных постнагрузочных. Они характерны для очагово-рубцового повреждения и/или кардиосклероза вследствие воспалительных, инфекционных или других заболеваний миокарда, а также могут быть результатом глубокой ишемии миокарда у некоторых больных с тяжелым атеросклерозом коронарных артерий (гибернированный миокард).
Преходящие ДП регистрируются на исходных постнагрузочных сцинтиграммах и полностью отсутствуют или уменьшаются на отсроченных постнагрузочных изображениях и на томо- и сцинтиграммах в покое. Преходящие ДП считают наиболее характерными для ишемии миокарда, обусловленной коронарным атеросклерозом (однако следует учитывать, что они могут регистрироваться у части больных с неизмененными или малоизмененными коронарными артериями при синдроме «Х», гипертрофии ЛЖ, некоторых системных заболеваниях и других состояниях).
Выявленные на сцинтиграммах и томограммах области со сниженной концентрацией РФП 201Т1 и 99тТс называют дефектами перфузии, которые могут быть стабильными (рубцы) или преходящими (ишемия миокарда).
Следует учитывать, что при интерпретации результатов исследования, с целью оценки жизнеспособности миокарда иногда применяют иную характеристику выявленных изменений перфузии миокарда, которые классифицируют как обратимые, частично обратимые и необратимые.
Обратимыми считаются изменения, которые регистрируются на исходных постнагрузочных томо- и сцинтиграммах и отсутствуют на отсроченных постнагрузочных томо- и сцинтиграммах и/или исходных сцинтиграммах в покое.
Частично обратимыми считаются изменения, которые регистрируются на исходных постнагрузочных томо- и сцинтиграммах, сохраняются на отсроченных постнагрузочных сцинтиграммах, а также на исходных сцинтиграммах, зарегистрированных в покое и сцинтиграммах после реинъекции РФП, но являются меньше по распространенности, по сравнению с изменениями перфузии на исходных постнагрузочных сцинтиграммах.
Обратимые и частично обратимые изменения перфузии характеризуют участки жизнеспособного миокарда, в которых может произойти восстановление (улучшение) функции миокарда при успешной реваскуляризации.
Необратимыми считают изменения, которые регистрируются без изменения на исходных и отсроченных постнагрузочных изображениях и в покое и характеризуют участки необратимо измененного миокарда. Успешная реваскуляризация не всегда приводит к восстановлению (улучшению) функции миокарда в необратимо измененных сегментах миокарда.
Таким образом, по результатам исследования сцинтиграммы и томограммы могут быть нормальными и измененными, т.е. отрицательными и положительными.
Наиболее характерным для больных ИБС с коронарным атеросклерозом считают наличие преходящего постнагрузочного дефекта перфузии и замедленние вымывания (при исследовании с 201Tl).
Перфузионная сцинтиграфия миокарда в диагностике основных заболеваний сердечно-сосудистой системы
Нестабильная стенокардия
У больных с нестабильной стенокардией радионуклидное исследование проводится для выявления ишемии в зоне повреждения или в других областях и измерения функции ЛЖ. Изучалось значение накопления таллия-201 при визуализации сердца у больных с нестабильной стенокардией в период отсутствия приступов стенокардии. При этом у 40% больных определялась измененная перфузия при исследовании в покое, у 27% данные исследования были спорными и у 33% были нормальные изображения. Это оставило вопрос о времени исследования после последнего приступа стенокардии открытым. При исследованиях, выполненных на ранних сроках после приступа, 50% больных имели ДП по сравнению с 27% у исследованных ранее. Это позволяет полагать, что у больных с нестабильной стенокардией ДП сохраняются более длительное время, чем клиника и изменения сегмента ST на ЭКГ. Другие авторы использовали в своих исследованиях сцинтиграфию миокарда с 99тТс-МИБИ. Проводилась ОЭКТ после введения 99тТс-МИБИ во время эпизода болей в грудной клетке. Была показана 96% чувствительность метода в диагностике поражения коронарных артерий. Во время введения РФП проводилась съемка ЭКГ, показавшая лишь 35% чувствительность. У больных с безболевой ишемией чувствительность была соответственно 65 и 38%. Специфичность метода составила 79% у больных с приступом стенокардии и 84% у больных с безболевой ишемией. Для ЭКГ специфичность была 74% в обоих случаях. Протяженность ДП коррелировала с протяженностью поражения коронарных артерий.
Хроническая ишемическая болезнь сердца
Визуализация перфузии во время нагрузки или фармакологических проб, включая ПЭТ, используется в диагностике хронических заболеваний коронарных артерий у больных с симптомами стенокардии и болевой ишемии миокарда. Также радионуклидные исследования применяются для оценки жизнеспособности миокарда у больных с дисфункцией ЛЖ и риск-стратификации.
Исследование перфузии миокарда во время нагрузочных проб (фармакологическихилис физическойнагрузкой)являетсявысокочувствительным и специфичным в отношении диагностики ишемии, включая топическую диагностику. Техника проведения исследования позволяет оценить локализацию поражения коронарных артерий. Больные с ИБС обычнонеимеют выраженных симптомов в покое. При нагрузкеже у них могут появляться приступы стенокардии. Проведение сравнения размеров нарушенной перфузии методом ОЭКТ показало, что чувствительность метода ОЭКТ была достоверно выше, по сравнению со стресс-ЭхоКГ. Более того, проводилось сравнение чувствительности ОЭКТ миокарда и нагрузочной пробы (изменения на ЭКГ) у больных с симптомами стенокардии. В результате ОЭКТ показала более высокую чувствительность. От 30 до 50% больных во время нагрузочного теста не смогли выполнить необходимой нагрузки. У данной группы больных возможно применение альтернативных нагрузочных проб: с вазодилятаторами, дипиридамолом или аденозином и с добутамином. Чувствительность в выявлении поражения коронарных артерий посредством количественного анализа составила 87% (82% у больных без ИМ и 96% у больных с перенесенным ИМ). Суммарная специфичность составила 90%. Чувствительность у больных без перенесенного ИМ составила 76% - при однососудистом поражении коронарных артерий, 86% - при двухсосудистом и 90% - при трехсосудистом. Более того, визуализация перфузии с введением таллия-201 на фоне теста с физической нагрузкой или с введением дипиридамола у одних и тех же больных показала соответствие зон нарушенной перфузии у 87% пациентов.
Прогноз
Для определения прогноза необходимо проведение исследования в покое или при нагрузке для оценки производительности ЛЖ. ОЭКТ с физической или фармакологической нагрузкой может быть использована для диагностики ишемии, ее локализации, протяженности и тяжести. У больных с хронической ИБС (ХИБС) фракция выброса (ФВ) ЛЖ является одним из наиболее значимых факторов, определяющих долгосрочный прогноз. Дисфункия ЛЖ в ответ на нагрузку отражает серьезность поражения и является неблагоприятным прогностическим фактором. У больных с ИБС снижение ФВ в ответ на нагрузку по сравнению с исследованием в покое является важ-
ным фактором, указывающим на серьезность заболевания. Имеются работы по изучению ОЭКТ миокарда в покое и при нагрузке для прогноза больших сердечных событий (смерть или нефатальный ИМ). Исследования перфузии методом ОЭКТ с нагрузкой является независимым прогностическим фактором для больных с ИБС даже при проведенной коронарной ангиографии. Более того, протяженность ДП является независимым прогностическим фактором. Данные ПЭТ с Ш3-мочевиной и Б18-ФДГ для оценки кровотока и метаболизма являются предикторами улучшения движения стенки после реваскуляризации.
Инвазивные вмешательства
Исследования перфузии сердца с физической или фармакологической нагрузкой применяются для оценки эффективности инвазивного вмешательства у больных с ИБС и клиникой стенокардии и вероятности развития рестенозов после чрескожной транслюминальной коронарной ангиопластики (ЧТКА) и аортокоронарного шунтирования (АКШ). У больных с нетипичными симптомами и промежуточной вероятностью рестенозирования проводилось изучение перфузии для решения вопроса о ЧТКА. У больных с возвратом атипичных симптомов заболевания необходимо проводить изучение перфузии на нагрузке сразу после появления симптомов, чтобы доказать их связь с ишемий миокарда. Исследование перфузии может быть предпочтительнее, чем стресс-ЭхоКГ, особенно у больных с изменениями на ЭКГ покоя, многососудистом поражении коронарных артерий и при наличии ограничений к проведению нагрузочного теста. Сцинтиграфия миокарда при нагрузке после АКШ показывает улучшение перфузии у большинства больных. В ряде исследований была показана эффективность АКШ в отношении улучшения перфузии сердца, исследуемой с введением препарата таллия-201 на нагрузке. Изменения перфузии были сопоставимы с клиническим статусом и изменениями на ЭКГ во время тредмил-теста до и после АКШ. Через 3 мес после АКШ исследование перфузии сердца применялось для выявления периоперционных инфарктов или раннего закрытия шунтов с возвратом симптомов стенокардии. После 3 мес и далее восстановление гибернации миокарда и ишемии вследствие поражения коронарных шунтов можно изучать посредством перфузионной сцинтиграфии миокарда.
РАДИОНУКЛИДНАЯ ВЕНТРИКУЛОГРАФИЯ
Метод радионуклидной вентрикулографии применяется для количественной оценки сократительной функции миокарда с использованием метки крови и последующей записью прохождения меченого пула крови через камеры сердца в виде радионуклидной ангиографии по первому прохождению препарата или при записи динамической сцинтиграфии, синхронизированной с ЭКГ. В первом случае препарат вводят непосредственно под датчиком гамма-камеры, и с помощью компьютера проводят запись с большой скоростью регистрации в течение нескольких секунд. Для метки крови используют два подхода. В первом случае используют готовый набор альбумина человеческой сыворотки для метки плазмы при обычном внутривенном введении. При обработке результатов по первому прохождению выбираются кадры с максимальной (диастола) и минимальной (систола) активностью и на основании подсчета разницы зарегистрированных импульсов рассчитывается фракция выброса ЛЖ. Во втором - используется метка эритроцитов in vivo, где пациенту предварительно вводят нерадиоактивный препарат (чаще пирофосфат или ДТПА), которые осаждаются на эритроцитах, а затем через 30 мин вводят радиоактивный технеций. В результате происходит метка эритроцитов. Данный способ считается более предпочтительным ввиду стабильности метки, исследования могут неоднократно выполняться в течении 3-4 ч.
При проведении вентрикулографии, синхронизированной с ЭКГ, больной, которому предварительно произведена метка крови, с наложенными электродами ЭКГ укладывается под датчик гамма-камеры, регистрируется R-R интервал, который разделяется на фазы (4, 8, 16, 32 интервалов и более). Чаще всего выбирается интервал в 16 фаз, после чего записывается примерно 250-300 сердечных циклов. Соответствующие циклы суммируются с помощью компьютерных программ и создается один репрезентативный цикл, на котором выбираются контуры конечной систолы и диастолы и проводятся дальнейшие расчеты параметров общей и региональной сократимости ЛЖ. Рассчитывают амплитудные, фазовые и временные параметры сокращения миокарда.
При радионуклидной вентрикулографии оценивается общая и региональная сократимость ЛЖ.
Радиоизотопные методы стали использоваться для риск-стратификации больных после инфаркта миокарда с конца 70-х гг. ХХ века. Радионуклидная вентрикулография обеспечивает надежную прогностическую информацию, что продемонстрировало исследование SOLVD (1991), в котором изучался прогноз жизни больных с сердечной недостаточностью. По данным Multicenter Postinfarction Research Group (1983), значение фракции выброса, определенное с помощью радионуклидной вентрикулографии, позволяет построить градуированную кривую летальности. Особенно неблагоприятным прогнозом, по данным этого исследования, характеризовались больные со значением фракции выброса ниже 40%. Изотопные сцинтиграфические методы могут хорошо выделять как больных с повышенным риском, так и с благоприятным прогнозом. Нормальные или близкие к нормальным результаты, полученные при сцинтиграфии миокарда с 99тТс, ассоциируются с благоприятным прогнозом.
Возможности ядерной медицины в оценке иннервации миокарда
Вегетативная нервная система играет важнейшую роль в регуляции деятельности сердца. Парасимпатическая и симпатическая нервная системы участвуют в регуляции функции кардиомиоцитов, проводящей системы сердца и коронарных сосудов. Обе системы оказывают модулирующее влияние на сократительную функцию миокарда и его электрофизиологические характеристики.
В последние годы ядерная кардиология предоставила возможность исследования симпатической иннервации сердца, изучения ее топографических особенностей с помощью меченых нейротрансмиттеров и антагонистов адренорецепторов.
Современные радионуклидные методики позволяют количественно определить региональный пресинаптический обратный захват катехоламинов, их метаболизм и плотность распределения нейрональных симпатических окончаний и адренорецепторов в миокарде. Радиоактивными аналогами катехоламинов, применяющимися с целью определения плотности симпатических окончаний, являются 123I метайодбензилгуанидин (1231-МИБГ) - при проведении томо- и сцинтиграфии миокарда, а также 11С-гидроксиэфедрин (11C-HED)
и 11C-CGP 12177, являющегося аналогом β-адренорецептора, при исследовании методом ПЭТ.
В настоящее время в клинической практике применяется МИБГ, меченный 123I.
1231-МИБГ является структурным аналогом медиатора симпатических окончаний норадреналина (НА), имеет сходный с ним механизм транспорта. Сопоставление захвата, распределения в миокарде и выведения из сердца меченого норадреналина (3[H]NE) и радиофармпрепарата 1231-МИБГ показало, что 1231-МИБГ полностью отражает распределение НА в симпатических окончаниях. Однако, в отличие от НА, 1231-МИБГ не метаболизируется моноаминоксидазой (МАО) и катехол-О-метилтрансферазой и не вступает во взаимодействие с адренорецепторами, т.е. не оказывает фармакологического эффекта.
В сердце интравезикулярная аккумуляция препарата относительно постоянна, тогда как экстравезикулярная резко снижается от 5 мин до 6 ч. Равновесие между концентрацией 1231-МИБГ в интра- и экстравезикулярном пространстве достигается примерно через 4 ч после в/в введения. В соответствии с этим радионуклидное исследование симпатической активности сердца выполняется через 1530 мин и 4 ч спустя после внутривенного введения РФП.
Распределение 1231-МИБГ в сердце неоднородное и соответствует состоянию функционирующих симпатических нервных окончаний.
Отличительной особенностью радиодинамического накопления при изучении симпатической иннервации сердца является не только выявление участков миокарда с нарушенной функцией симпатических окончаний, но и определение общего количества функционирующих адренергических окончаний.
Состояние общего количества функционирующих адренергических окончаний проводится при оценке соотношения захвата 1231-МИБГ в миокарде с захватом РФП в других органах. В мировой литературе принято определять соотношение сердце/средостение (С/Ср), где накопление 1231-МИБГ минимальное. Этот показатель может варьировать от 1,9 до 3,0. По нашим данным, он составил 2,18±0,45. Уменьшение соотношения С/Ср <1,9 свидетельствует о нарушении симпатической активности миокарда. Этот показатель считается наиболее значимым в оценке степени нарушения нейрональной функции сердца при различных заболеваниях, прогноза заболевания и ответа на лечение.
Изменения нейрональной функции сердца при некоторых сердечно-сосудистых заболеваниях
Нарушения нейрональной функции сердца, отражением которых является изменение захвата 1231-МИБГ, могут быть следствием различных патологических процессов.
Примерами первичного поражения автономной нервной системы сердца могут служить такие заболевания, как сахарный диабет, амилоидоз сердца. Очень важна оценка симпатической системы при трансплантации сердца.
Среди вторичных кардионейропатий рассматриваются большинство сердечно-сосудистых заболеваний: дилатационная и гипертрофическая кардиомиопатии, ишемическая болезнь сердца, артериальная гипертония и ряд других заболеваний.
Так, при обследовании больных с острым коронарным синдромом в первые сутки заболевания обнаружено существенное снижение захвата 1231-МИБГ в области инфаркта миокарда и острой ишемии с последующим уменьшением зон денервации (рис. 6.6, см. на вклейке).
Считается, что симпатические нервные окончания более чувствительны к ишемии, чем кардиомиоциты. Если ишемия вызывает повреждение симпатических нейронов, то следует ожидать, что частые повторные приступы ишемии будут приводить к утрате способности захватывать МИБГ и у больных с коронарным атеросклерозом без ИМ. Таким образом, проведение томосцинтиграфии миокарда с 1231-МИБГ может дать ценную диагностическую информацию о степени ишемического нейронального повреждения, обусловленного различной степенью и распространенностью коронарного атеросклероза.
Особый интерес вызывает изучение нейрональной функции сердца у больных кардиомиопатиями, патогенез развития которых окончательно неизучен.
Семейно-генетическая гипертрофическая кардиомиопатия (ГКМП) - это заболевание, при котором определяются мутации в генах, кодирующих белки саркомеров кардиомиоцитов. Такие характерные клинические проявления ГКМП, как гиперконтрактильность желудочков, предрасположенность к тахиаритмиям и положительный эффект лечения β-адреноблокаторами позволяют предполагать, что в патогенезе заболевания не последнюю роль играют нарушения симпатической активности сердца (рис. 6.7, см. на вклейке).
Влияние симпатической нервной системы играет одну из ведущих ролей в патофизиологии сердечной недостаточности у больных дилатационной кардиомиопатией (ДКМП). Повышение симпатической активности может оказывать прямое действие на кардиомиоциты, изменять клеточный фенотип и приводить к гибели кардиомиоцитов за счет некроза, или апоптоза. По данным сцинтиграфии миокарда с 1231-МИБГ при ДКМП определяется низкий захват РФП и повышенная скорость вымывания.
При сцинтиграфии и однофотонной компьютерной томографии миокарда с 1231-МИБГможно оценивать симпатическую иннервацию миокарда, изменения которой могут быть ранними маркерами его повреждения.
ПОЗИТРОННО-ЭМИСИИОННАЯ ТОМОГРАФИЯ
В КАРДИОЛОГИИ
ПЭТ является одним из самых информативных методов в ядерной медицине. В основе ПЭТ лежит явление регистрации двух противоположно направленных гамма-лучей одинаковых энергий, возникающих в результате аннигиляции. Процесс аннигиляции происходит в тех случаях, когда позитрон, излученный ядром радионуклида (радиоизотопа), встречается с электроном в тканях.
РФП, использующиеся при проведении позитронно-эмиссионных исследований, представляют собой вещества, участвующие в различных метаболических процессах. При производстве РФП для ядерной медицины некоторые химические элементы заменяются на их радиоактивные изотопы. Особенностью РФП, применяемых в позитронно-эмиссионной томографии, является то, что при их производстве используются короткоживущие радиоизотопы, которые должны производиться в непосредственной близости от места проведения исследования. Применение ПЭТ в кардиологии позволяет неинвазивным путем получать информацию о кровоснабжении миокарда на уровне микроциркуляции и скорости метаболических процессов в кардиомиоцитах. С этой целью используются различные меченные ультракороткоживущими изотопами радиофармпрепараты (РФП):
- ^N-аммоний - для количественной оценки миокардиального кровотока;
- 18Б-фтордезоксиглюкоза (18Б-ФДГ) - для исследования скорости утилизации экзогенной глюкозы;
- 11С-жирные кислоты и 11С-ацетат - для изучения скорости окислительного метаболизма в миокарде.
Основным направлением применения ПЭТ в кардиологии является оценка:
• локального миокардиального кровотока;
• регионарного метаболизма миокарда;
• локальной механической функции сердца;
• рецепторики.
ПЭТ с этими РФП позволяет получить полную информацию о миокарде, используется для диагностики ИБС (включая коронарный «Х»-синдром), кардиомиопатий и контроля лечения. Проведение ПЭТ с 18Б-ФДГ и ^N-аммиаком при планировании АКШ или ангиопластики является «золотым стандартом» определения жизнеспособного, но гибернизирующего миокарда.