Гистология, эмбриология, цитология : учебник / Ю. И. Афанасьев, Н. А. Юрина, Е. Ф. Котовский и др.. - 6-е изд., перераб. и доп. - 2012. - 800 с. : ил.
|
|
|
|
Глава 14. СИСТЕМА КРОВЕТВОРЕНИЯ И ИММУННОЙ ЗАЩИТЫ
Это функционально связанные между собой специализированные органы (красный костный мозг, вилочковая железа, селезенка и др.), кровь, лимфа и лимфоидная ткань, ассоциированная со слизистыми оболочками, а также лимфоциты, макрофаги и антигенпредставляющие клетки, находящиеся в составе различных тканей организма.
Различают центральные и периферические органы кроветворения и иммунной защиты.
К центральным органам кроветворения у человека относятся красный костный мозг и тимус (вилочковая железа). В красном костном мозге из стволовых клеток образуются эритроциты, кровяные пластинки (тромбоциты), гранулоциты, В-лимфоциты и предшественники Т-лимфоцитов (см. главу 7). В тимусе происходит антигеннезависимая пролиферация и дифференци-ровка Т-лимфоцитов с огромным разнообразием рецепторов антигенов.
В периферических кроветворных органах - селезенке, лимфатических узлах, миндалинах, червеобразном отростке, а также лимфоидной ткани, ассоциированной со слизистыми оболочками, происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти. Органы кроветворения, скопления лимфоцитов и другие клетки иммунной защиты функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного статуса организма. Все они обеспечивают защиту организма от генетически чужеродных белков (микробов, вирусов и др.) или генетически измененных клеток собственного организма. Деятельность органов кроветворения и иммунной защиты тесно связана с эндокринной и нервной системами. Так, нейропептиды, синтезируемые эндокринными нейронами, влияют на активность иммунокомпетентных клеток. В свою очередь, биологические вещества, синтезируемые иммунокомпетентными клетками, оказывают влияние на клетки и ткани, вызывая эффекты, сходные с эффектами гормонов эндокриноцитов и пептидов нейронов.
Несмотря на различную специализацию, все органы, входящие в систему, имеют общие морфофункциональные признаки и включают: а) строму (ретикулярная соединительная, а в тимусе - эпителиальная ткани), создающую микроокружение, которое необходимо для нормального развития кроветворных клеток; б) большое число фагоцитирующих клеток (макрофагов), участвующих в очищении крови и лимфы от инородных частиц, бактерий, фрагментов погибших клеток; в) характерные особенности строения стенки кровеносных и лимфатических сосудов, что обеспечивает миграцию клеток, изоляцию размножающихся и дифференцирующихся клеток, депонирование крови и др.
14.1. КОСТНЫЙ МОЗГ
Костный мозг (medulla osseum) - центральный кроветворный орган, в котором находятся самоподдерживающиеся популяции стволовых стро-мальных клеток и гемопоэтических стволовых клеток. Здесь же образуются эритроциты, гранулоциты, тромбоциты, моноциты, В-лимфоциты с разнообразными рецепторами антигенов, естественные киллерные клетки и предшественники Т-лимфоцитов.
Развитие. Костный мозг у человека появляется впервые на 2-м мес внутриутробного периода в ключице эмбриона, на 3-м мес он образуется в развивающихся плоских костях - лопатках, тазовых костях, затылочной кости, ребрах, грудине, костях основания черепа и позвонках, а в начале 4-го мес развивается также в трубчатых костях конечностей. До 11-й нед это остеобластический костный мозг, который выполняет остео-генную функцию. С момента врастания кровеносных сосудов из надкостницы в развивающуюся костную ткань между костными трабекулами возникают условия для формирования кроветворного микроокружения, миграции гемопоэтических стволовых и полустволовых клеток. В данный период костный мозг накапливает стволовые клетки, а клетки стро-мы с остеогенными потенциями создают микросреду, необходимую для пролиферации и дифференцировки гемопоэтических стволовых клеток. У 12-14-недельного плода человека в костных полостях начинается гемопоэз. У 20-28-недельного плода человека отмечается усиленная резорбция костных перекладин, в результате чего красный костный мозг получает возможность расти в направлении эпифизов. К этому времени костный мозг начинает функционировать как основной кроветворный орган, причем большая часть образующихся в нем клеток относится к эритроидному дифферону.
У 36-недельного зародыша в костном мозге диафиза трубчатых костей обнаруживаются жировые клетки. Одновременно появляются очаги кроветворения в эпифизах.
Строение. Во взрослом организме человека различают красный и желтый костный мозг.
14.1.1. Красный костный мозг
Красный костный мозг (medulla ossium rubra) является кроветворной частью костного мозга. Он находится в губчатом веществе плоских и трубчатых костей и во взрослом организме составляет в среднем около 4-5 % общей массы тела. Красный костный мозг имеет темно-красный цвет и полужидкую консистенцию, что позволяет легко приготовить из него тонкие мазки на стекле. Стромой костного мозга является ретикулярная ткань, образующая микроокружение для кроветворных клеток. К элементам гемопоэтической среды относятся также остеогенные, жировые, адвентициальные, эндотели-альные клетки и макрофаги (рис. 14.1).
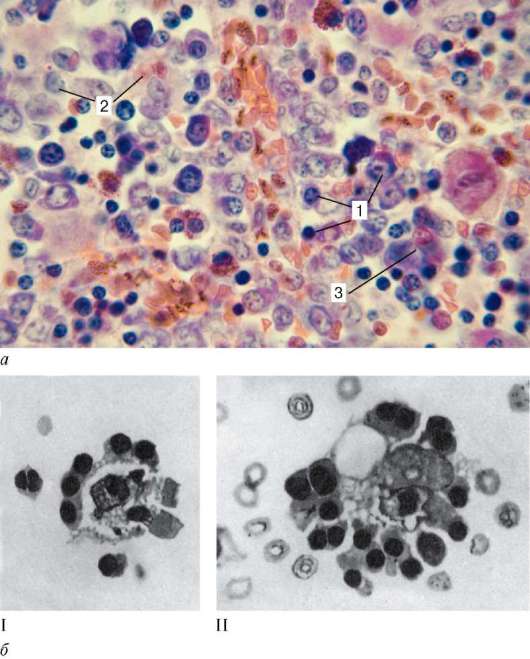
Рис. 14.1. Строение красного костного мозга:
а - срез костного мозга. 1 - клетки гемоцитопоэтических рядов; 2 - ретикулярная клетка; 3 - мегакариоцит; б - волнообразное удвоение количества эритробластов вокруг макрофага в эритробластическом островке (по Ю. М. Захарову): I - первая генерация эритробластов; II - вторая и третья генерации эритробластов
Ретикулярные клетки (фибробласты костного мозга) благодаря своей отростчатой форме (см. «Ретикулярная ткань») выполняют механическую функцию, секретируют компоненты основного вещества - преколлаген, гликозаминогликаны, проэластин и микрофибриллярный белок и участвуют в создании кроветворного микроокружения, специфического для определенных направлений развивающихся гемопоэтических клеток, выделяя ростовые факторы.
Остеогенные клетки входят в состав эндоста и периоста (см. «Костные ткани») и могут находиться в костномозговых полостях. Остеогенные клетки продуцируют цитокины (колониестимулирующие факторы гранулоци-тов, моноцитов, ИЛ-1, ИЛ-6 и др.), которые индуцируют стволовые гемо-поэтические клетки к пролиферации и дивергентной дифференцировке. Наиболее интенсивно кроветворение происходит вблизи эндоста, где концентрация гемопоэтических стволовых клеток примерно в 3 раза больше, чем в центре костномозговой полости.
Адипоциты (см. «Соединительные ткани») являются постоянными элементами костного мозга.
Адвентициальные клетки (см. «Соединительные ткани») сопровождают кровеносные сосуды и покрывают более 50 % наружной поверхности сину-соидных капилляров. Под влиянием гемопоэтинов (эритропоэтин) и других факторов они способны сокращаться, что способствует миграции клеток в кровоток.
Ретикулярные, адвентициальные, жировые клетки развиваются из стволовой стромальной клетки костного мозга.
Эндотелиальные клетки сосудов костного мозга принимают участие в организации стромы и процессов кроветворения, синтезируют коллаген IV типа, гемопоэтины. Эндотелиоциты, образующие стенки синусоидных капилляров, непосредственно контактируют с гемопоэтическими и стромальными клетками благодаря прерывистой базальной мембране. Эндотелиоциты способны к сократительным движениям, которые способствуют выталкиванию клеток крови в синусоидные капилляры. После прохождения клеток в кровоток поры в эндотелии закрываются. Эндотелиоциты выделяют колоние-стимулирующие факторы и белок с антигенными свойствами - фибронек-тин, обеспечивающий прилипание клеток друг к другу и субстрату.
Макрофаги (см. «Соединительные ткани») в костном мозге представлены неоднородными по структуре и функциональным свойствам клетками, но всегда богатыми лизосомами и фагосомами. Некоторые из популяций макрофагов секретируют ряд биологически активных веществ (эритропо-этин, колониестимулирующий фактор, интерлейкины, простагландины, интерферон и др.). Макрофаги при помощи своих отростков, проникающих через стенки синусов, улавливают из кровотока железосодержащее соединение (трансферрин) и далее передают его развивающимся эритроидным клеткам для построения геминовой части гемоглобина (см. рис. 14.1).
Межклеточное вещество. В костном мозге это вещество содержит коллаген II, III и IV типа, гликопротеины, протеогликаны и др.
Гемопоэтические клетки составляют 6 классов (см. главу 7).
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эри-тробластических островков. Эритробластический островок состоит из макрофага, окруженного клетками эритроидного дифферона, вступившими в контакт с макрофагом костного мозга. Клетки от проэритробласта до рети-кулоцита удерживаются в контакте с макрофагом его рецепторами - сиа-лоадгезинами.
Макрофаги служат своего рода «кормильцами» для эритробластов, способствуют накоплению в непосредственной близости от эритробластов и поступлению в них эритропоэтина, витаминов кроветворения (витамина D3), молекул ферритина. Макрофаги островков фагоцитируют ядра, вытолкнутые эритробластами при их созревании, и способны формировать вокруг себя новый очаг эритропоэза (см. рис. 14.1; рис. 7.17, б).
По мере созревания эритробласты отделяются от островков и после удаления ядра (энуклеации) проникают через стенку венозных синусов в кровоток. Стенки синусов состоят из эндотелиальных уплощенных клеток (перфорированных эндотелиоцитов), пронизанных щелевидны-ми отверстиями, или порами, в которые проникают форменные элементы крови и плазма. Среди эндотелиальных клеток есть фиксированные макрофаги.
Клетки гранулоцитарных дифферонов также образуют островки, главным образом по периферии костномозговой полости. Незрелые клетки гранулоцитарных дифферонов окружены протеогликанами. В процессе созревания гранулоциты депонируются в красном костном мозге, где их насчитывается примерно в 3 раза больше, чем эритроцитов, и в 20 раз больше, чем грану-лоцитов в периферической крови.
Мегакариобласты и мегакариоциты располагаются в тесном контакте с синусами так, что периферическая часть их цитоплазмы проникает в просвет сосуда через поры. Отделение фрагментов цитоплазмы в виде тромбоцитов (кровяные пластинки) происходит непосредственно в кровяное русло.
Среди островков клеток миелоидного ряда встречаются небольшие скопления костномозговых лимфоцитов и моноцитов, которые окружают кровеносный сосуд.
В обычных физиологических условиях через стенку синусов костного мозга проникают лишь созревшие форменные элементы крови. Миелоциты и эритробласты попадают в кровь только при патологических состояниях организма. Факт проникновения незрелых клеток в кровяное русло всегда служит верным признаком расстройства костномозгового кроветворения.
14.1.2. Желтый костный мозг
Желтый костный мозг (medulla ossium flava) у взрослых находится в диа-физах трубчатых костей. В его составе находятся многочисленные жировые клетки (адипоциты).
Благодаря наличию в жировых клетках пигментов типа липохромов костный мозг в диафизах имеет желтый цвет, что и определяет его название. В обычных условиях желтый костный мозг не осуществляет кроветворной функции, но в случае больших кровопотерь или при некоторых патологических состояниях организма в нем появляются очаги миелопоэза за счет дифференцировки приносимых сюда с кровью стволовых и полустволовых клеток.
Резкой границы между желтым и красным костным мозгом не существует. Небольшое количество адипоцитов постоянно встречается и в красном костном мозге. Соотношение желтого и красного костного мозга может меняться в зависимости от возраста, условий питания, нервных, эндокринных и других факторов.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2-4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10-14 мкм). Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиаль-ном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит по сосудам со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере циркуляции в кости кровь обогащается минеральными солями и регуляторами кроветворения (колониестимулирующие факторы и др.).
Кровеносные сосуды составляют 50 % массы костного мозга, из них 30 % приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь. Капилляры бывают двух типов: узкие 6-20 мкм и широкие синусо-идные диаметром 200-500 мкм. Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране (см. рис. 13.9).
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в костном мозге в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе
плоских костей. Примерно в 12-18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатиноз-ным костным мозгом. Этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с стромальной ретикулярной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростостимулирующими факторами гемопоэза (см. главу 7). Кроме этого, красный костный мозг является источником стромаль-ных стволовых клеток для развития дифферонов гемопоэтического микроокружения периферических органов кроветворения. Разработаны методы извлечения гемопоэтических стволовых клеток из пуповинной крови, плаценты, красного костного мозга для трансплантации при лечении ряда врожденных заболеваний крови, при химиотерапии рака и др.
14.2. ТИМУС
Тимус (вилочковая железа, thymus), - центральный орган лимфоцитопо-эза и иммуногенеза. Из костномозговых предшественников Т-лимфоцитов в тимусе происходит антигеннезависимая их дифференцировка в Т-лимфоциты, разновидности которых осуществляют реакции клеточного иммунитета и регулируют реакции гуморального иммунитета (см. ниже).
Удаление тимуса (тимэктомия) у новорожденных животных вызывает резкое угнетение пролиферации лимфоцитов во всех лимфоидных узелках кроветворных органов, исчезновение малых лимфоцитов из крови, резкое уменьшение количества лейкоцитов и другие характерные признаки (атрофия органов, кровоизлияния и пр.). При этом организм оказывается весьма чувствительным ко многим инфекционным заболеваниям, не отторгает чужеродные трансплантаты органов. Эндокринная функция тимуса заключается в выработке более 20 факторов, среди которых распространение в медицине получили тимозины, тимопоэтины, тимулин. Кроме воздействия на иммунитет, некоторые из них обладают противоопухолевым свойством.
Развитие. Закладка тимуса у человека происходит в конце первого месяца внутриутробного развития из эпителия глоточной кишки, в области главным образом III и IV пар жаберных карманов в виде тяжей многослойного эпителия. Дистальная часть зачатков III пары, утолщаясь, образует тело тимуса, а проксимальная - вытягивается, подобно выводному протоку экзокринной железы. В дальнейшем тимус обособляется от жаберного кармана. Правый и левый зачатки сближаются и срастаются. На 7-й нед развития в эпителиальной строме тимуса человека появляются первые лимфоциты. На 8-11-й нед врастающая в эпителиальную закладку органа мезенхима
с кровеносными сосудами подразделяет закладку тимуса на дольки. На 11-12-й нед развития плода человека происходит дифференцировка лимфоцитов, а на поверхности клеток появляются специфические рецепторы и антигены. На 3-м мес происходит дифференцировка органа на мозговую и корковую части, причем последняя обильнее инфильтрируется лимфоцитами, и первоначальная типичная эпителиальная структура зачатка становится трудноразличимой. Эпителиальные клетки пласта раздвигаются и остаются связанными друг с другом только межклеточными мостиками, приобретая вид рыхлой сети. В мозговом веществе появляются своеобразные структуры - так называемые слоистые эпителиальные тельца.
Образующиеся в результате митотического деления Т-лимфоциты мигрируют затем в закладки лимфатических узлов (в тимусзависимые зоны) и другие периферические лимфоидные органы.
В течение 3-5 мес наблюдаются дивергентная дифференцировка клеток и появление различных типов ретикулярных эпителиоцитов (периваскуляр-ных, подкапсульных, питающих и др.). Формирование тимуса завершается к 6 мес, когда некоторые типы ретикулярных эпителиоцитов органа начинают секретировать гормоны, а вне тимуса появляются дифференцированные формы - Т-киллеры, Т-супрессоры, Т-хелперы. В первые 15-17 сут после рождения наблюдаются массовое выселение Т-лимфоцитов из тимуса и резкое повышение активности внетимусных лимфоцитов. К моменту рождения масса тимуса равна 10-15 г. В период половой зрелости организма его масса максимальна - 30-40 г, далее наступает возрастная инволюция.
Строение. Снаружи тимус покрыт соединительнотканной капсулой. От нее внутрь отходят перегородки, разделяющие его на дольки. В каждой дольке различают корковое и мозговое вещество (рис. 14.2, 14.3). Долька органа включает эпителиальную ткань, состоящую из отростчатых клеток - ретикулярных эпителиоцитов, а также клеток моноцитоидного происхождения. Для всех ретикулярных эпителиоцитов характерно наличие десмосом, тоно-филаментов и белков кератинов, продуктов главного комплекса гистосовме-стимости I и II классов в составе плазматической мембраны.
Ретикулярные эпителиоциты в зависимости от локализации отличаются формой и размерами, тинкториальными признаками, электронной плотностью гиалоплазмы, содержанием органелл и включений. Описаны секреторные клетки коры и мозгового вещества, несекреторные (опорные) и клетки эпителиальных слоистых телец - телец Гассаля (гассалевы тельца), пери-васкулярные.
Секреторные клетки содержат вакуоли или секреторные включения. При помощи моноклональных антител в них обнаружены гормоноподоб-ные факторы: α-тимозин, тимусный сывороточный фактор, тимопоэтины. Эпителиальные клетки в подкапсулярной зоне и в части коркового вещества имеют глубокие инвагинации, в которых расположены, как в колыбели, лимфоциты. Прослойки цитоплазмы этих эпителиоцитов - тимусных питающих клеток, или «нянек», между лимфоцитами могут быть очень тонкими и протяженными. Обычно такие клетки содержат 10-20 лимфоцитов и более.
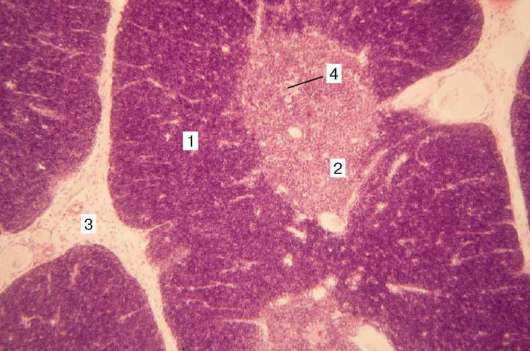
Рис. 14.2. Тимус:
1 - корковое вещество; 2 - мозговое вещество; 3 - соединительнотканная перегородка; 4 - слоистое эпителиальное тельце
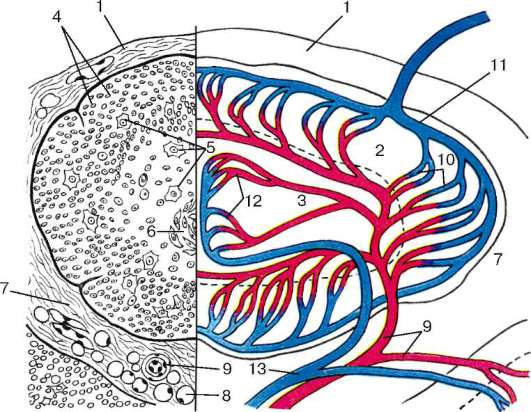
Рис. 14.3. Строение и кровоснабжение дольки тимуса (по Ю. И. Афанасьеву и Л. П. Бобовой):
1 - соединительнотканная капсула; 2 - корковое вещество; 3 - мозговое вещество дольки; 4 - лимфоциты; 5 - эпителиоретикулоциты; 6 - слоистое тельце; 7 - меж-дольковая волокнистая соединительная ткань; 8 - адипоцит; 9 - междольковая артерия; 10 - капиллярная сеть коркового вещества; 11 - подкапсулярная вена; 12 - капиллярная сеть мозгового вещества; 13 - междольковая вена
Лимфоциты могут входить и выходить из инвагинаций и образовывать плотные контакты с этими клетками. Клетки-«няньки» способны продуцировать тимозин.
Макрофаги и дендритные клетки содержат продукты главного комплекса гистосовместимости I и II классов, выделяют ростовые факторы (дендритные клетки), влияющие на дифференцировку Т-лимфоцитов. Макрофаги фагоцитируют лимфоциты, подвергшиеся апоптозу.
Корковое вещество (cortex) - периферическая часть долек, содержит Т-лимфоциты, которые густо заполняют просветы сетевидной эпителиальной основы. В подкапсулярной зоне коркового вещества находятся крупные лимфоидные клетки - лимфобласты - предшественники Т-лимфоцитов, мигрировавшие сюда из красного костного мозга (рис. 14.4).
Они под влиянием тимозина, выделяемого ретикулярными эпителиоци-тами, пролиферируют. Новые генерации лимфоцитов появляются в тимусе каждые 6-9 ч. Созревая, Т-лимфоциты перемещаются в направлении мозгового вещества и покидают тимус через венулы кортикомедуллярной зоны. Полагают, что Т-лимфоциты коркового вещества мигрируют в кровоток, не входя в мозговое вещество. Эти лимфоциты отличаются по составу рецепторов от Т-лимфоцитов мозгового вещества. С током крови они попадают в периферические органы лимфоцитопоэза - лимфатические узлы и селезенку, где созревают в субклассы: антиген-реактивные киллеры, хелперы, супрессоры. Однако не все образующиеся в тимусе лимфоциты выходят в циркуляторное русло, а лишь около 2-5 %, которые прошли «обучение» и приобрели специфические циторецепторы чужеродных антигенов. Лимфоциты, имеющие циторецепторы собственных антигенов, как правило, погибают в тимусе, что служит проявлением отбора иммунокомпетент-ных клеток. При попадании этих Т-лимфоцитов в кровоток развивается аутоиммунная реакция.
Клетки коркового вещества отграничены от крови гематотимусным барьером, предохраняющим дифференцирующиеся лимфоциты коркового вещества от избытка антигенов. В его состав входят эндотелиальные клетки капилляров с базальной мембраной, перикапиллярное пространство с единичными лимфоцитами, макрофагами, фибробластами и межклеточным веществом, а также специализированные ретикулярные эпителиоциты с их базальной мембраной. Барьер обладает избирательной проницаемостью по отношению к антигену. При нарушении барьера среди клеточных элементов коркового вещества обнаруживаются единичные плазматические клетки, зернистые лейкоциты и тучные клетки. Иногда в корковом веществе появляются очаги экстрамедуллярного миелопоэза.
Мозговое вещество (medulla) дольки на гистологических препаратах имеет более светлую окраску, так как по сравнению с корковым веществом содержит меньшее количество лимфоцитов. Лимфоциты этой зоны представляют собой рециркулирующий пул Т-лимфоцитов и могут поступать в кровь и выходить из кровотока через посткапиллярные венулы.
Количество митотически делящихся клеток в мозговом веществе примерно в 15 раз меньше, чем в корковом. Особенностью ультрамикроскопиче-
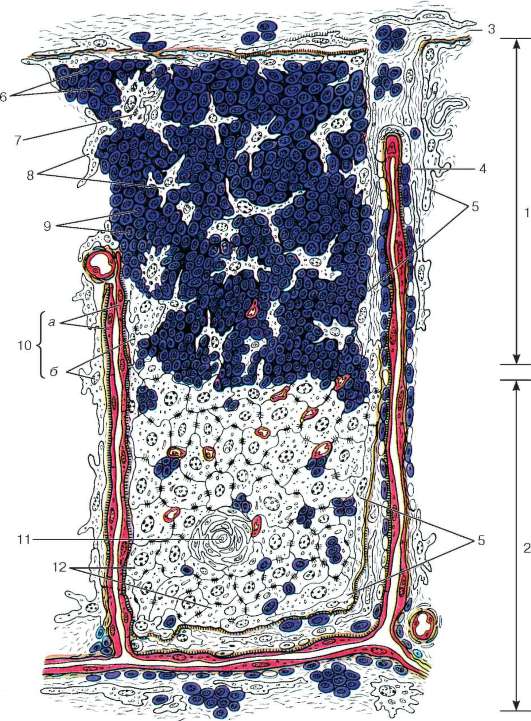
Рис. 14.4. Структурная организация дольки тимуса:
1 - корковое вещество; 2 - мозговое вещество; 3 - капсула; 4 - соединительнотканная перегородка (септа); 5 - ретикулярные эпителиоциты на границе септы; 6 - предшественники Т-лимфоцитов; 7 - макрофаг; 8 - ретикулярные эпителиоциты коры; 9 - Т-лимфоцит; 10 - гематотимусный барьер: а - эндотелий; б - ретикулярные эпителиоциты; 11 - слоистое эпителиальное тельце; 12 - ретикулярные эпителиоциты мозгового вещества (по Вайсу, с изменениями)
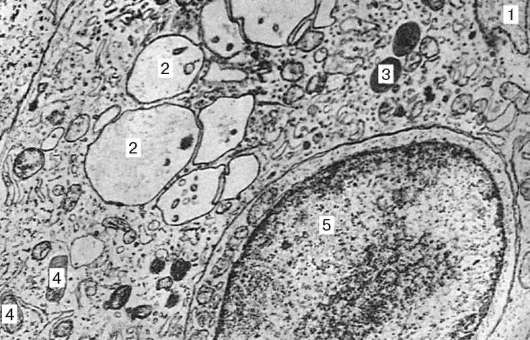
Рис. 14.5. Ретикулярный эпителиоцит мозгового вещества тимуса. Электронная микрофотография, увеличение 18 000 (препарат Л. П. Бобовой): 1 - ядро; 2 - вакуоли; 3 - лизосомы; 4 - митохондрии; 5 - лимфоцит, инвагини-рованный в ретикулярный эпителиоцит
ского строения ретикулярных эпителиоцитов является наличие в их цитоплазме гроздевидных вакуолей и внутриклеточных канальцев, поверхность которых образует микровыросты (рис. 14.5).
В средней части мозгового вещества расположены слоистые эпителиальные тельца (corpusculum thymicum). Они образованы концентрически наслоенными ретикулярными эпителиоцитами, цитоплазма которых содержит крупные вакуоли, гранулы кератина и пучки фибрилл. Они хорошо развиты у человека, собаки, морской свинки и слабо развиты у мышей и крыс. Количество этих телец у человека увеличивается к периоду половой зрелости, затем уменьшается. Функция телец не установлена.
Васкуляризация. Внутри органа артерии ветвятся на междольковые и вну-тридольковые, которые образуют дуговые ветви. От них почти под прямым углом отходят кровеносные капилляры, образующие густую сеть, особенно в корковом веществе. Капилляры коркового вещества окружены непрерывной базальной мембраной и слоем эпителиальных клеток, отграничивающим перикапиллярное пространство. В перикапиллярном пространстве, заполненном тканевой жидкостью, встречаются лимфоциты и макрофаги. Большая часть корковых капилляров переходит непосредственно в подкап-сулярные венулы. Меньшая часть идет в мозговое вещество и на границе с корковым веществом переходит в посткапиллярные венулы, отличающиеся от капсулярных венул высоким призматическим эндотелием. Через этот эндотелий могут рециркулировать (уходить из тимуса и вновь возвращаться) лимфоциты. Барьера вокруг капилляров в мозговом веществе нет.
Таким образом, отток крови из коркового и мозгового вещества происходит раздельно.
Лимфатическая система представлена глубокой и поверхностной (кап-сулярной и подкапсулярной) выносящей сетью капилляров. Глубокая капиллярная сеть особенно богата в корковом веществе, а в мозговом веществе капилляры обнаружены вокруг эпителиальных слоистых телец. Лимфатические капилляры собираются в сосуды междольковых перегородок, идущие вдоль кровеносных сосудов.
Иннервация. Железа иннервируется симпатическими и парасимпатическими нервами: капсула и септы содержат волокна от блуждающего нерва и его ветвей, симпатических пограничных стволов и диафрагмального нерва. Нервные окончания обнаружены в стенке сосудов и на эпителиоцитах.
Возрастная и акцидентальная инволюция тимуса. Тимус достигает максимального развития в раннем детском возрасте. В период от 3 до 20 лет отмечается стабилизация его массы. В более позднее время происходит обратное развитие (возрастная инволюция) тимуса. Это сопровождается уменьшением количества лимфоцитов, особенно в корковом веществе, появлением липидных включений в соединительнотканных клетках и развитием жировой ткани. Слоистые эпителиальные тельца сохраняются гораздо дольше.
В редких случаях тимус не претерпевает возрастной инволюции (status thymicolymphaticus). Обычно это сопровождается дефицитом глюкокортикои-дов коры надпочечников. Такие люди отличаются пониженной сопротивляемостью инфекциям и интоксикациям. Особенно увеличивается риск развития опухолей.
Временная, быстрая, или акцидентальная, инволюция может наступить в связи с воздействием на организм различных чрезвычайно сильных раздражителей (травма, интоксикация, инфекция, голодание и др.). При стресс-реакции происходят выброс Т-лимфоцитов в кровь и массовая гибель лимфоцитов в самом органе, особенно в корковом веществе. В связи с этим становится менее заметной граница коркового и мозгового вещества. Кроме лимфоцитолиза, наблюдается фагоцитоз макрофагами внешне не измененных лимфоцитов. Биологический смысл лимфоцитолиза окончательно не установлен. Вероятно, гибель лимфоцитов является выражением селекции Т-лимфоцитов.
Одновременно с гибелью лимфоцитов происходит разрастание эпителиальной части органа. Эпителиоциты набухают, в цитоплазме появляются секретоподобные капли, дающие положительную реакцию на гликопро-теины. В некоторых случаях они скапливаются между клетками, образуя подобие фолликулов.
Тимус вовлекается в стресс-реакции вместе с надпочечниками. Увеличение в организме количества гормонов коры надпочечника, в первую очередь глюкокортикоидов, вызывает очень быструю и сильную акциденталь-ную инволюцию тимуса.
Таким образом, функциональное значение тимуса в процессах кроветворения заключается в образовании тимусзависимых лимфоцитов, или Т-лимфоцитов (тимоцитов), а также в селекции лимфоцитов, регуляции пролиферации и дифференцировки в периферических кроветворных органах благодаря выделяемому органом гормону - тимозину. Помимо описан-
ных функций, тимус оказывает влияние на организм, выделяя в кровь и ряд других биологически активных факторов: инсулиноподобный фактор, понижающий содержание сахара в крови, кальцийтонинподобный фактор, снижающий концентрацию кальция в крови, и фактор роста.
14.3. СЕЛЕЗЕНКА
Селезенка (splen, lien) - важный кроветворный (лимфопоэтический) и защитный орган, который участвует в организации защитных реакций от антигенов, проникших в кровоток; здесь разрушаются старые и поврежденные эритроциты и тромбоциты, а также депонируется кровь и накапливаются тромбоциты.
В селезенке происходят антигензависимая пролиферация и дифферен-цировка Т- и В-лимфоцитов, и образование эффекторных клеток и клеток памяти. Объем и масса этого органа сильно варьируют в зависимости от депонирования крови и активности процессов кроветворения.
Развитие. У человека селезенка закладывается на 4-5-й нед эмбриогенеза в толще мезенхимы дорсальной брыжейки. В начале развития селезенка представляет собой плотное скопление мезенхимных клеток, пронизанное первичными кровеносными сосудами. В дальнейшем часть клеток мезенхимы дифференцируются в ретикулярную ткань, которая заселяется гемо-поэтическими стволовыми клетками. На 7-8-й нед развития в селезенке появляются макрофаги; на 12-й нед впервые выявляются В-лимфоциты с иммуноглобулиновыми рецепторами. На 3-м мес эмбрионального развития в сосудистом русле селезенки появляются широкие венозные синусы, разделяющие ее на островки. На 5-м мес формируются лимфоидные узелки. Одновременно с развитием узелков происходит формирование красной пульпы, которая становится морфологически различимой на 6-м мес внутриутробного развития. Процессы миелопоэза в селезенке человека достигают максимума на 5-м мес внутриутробного развития, после чего активность их снижается и к моменту рождения прекращается совсем. Напротив, процессы лимфоцитопоэза в селезенке усиливаются к моменту рождения.
Строение. Селезенка человека покрыта соединительнотканной капсулой и брюшиной. Толщина капсулы неодинакова в различных участках селезенки. Наиболее толстая капсула в воротах селезенки, через которые проходят кровеносные и лимфатические сосуды. Капсула состоит из плотной волокнистой соединительной ткани, содержащей фибробласты и многочисленные коллагеновые и эластические волокна. Между волокнами залегает небольшое количество гладких мышечных клеток.
Внутрь от капсулы отходят перекладины - трабекулы селезенки, которые в глубоких частях органа анастомозируют между собой (рис. 14.6). Капсула и трабекулы в селезенке человека занимают примерно 5-7 % общего объема органа и составляют его опорно-сократительный аппарат. В тра-
бекулах селезенки человека сравнительно немного гладких мышечных клеток. Эластические волокна в тра-бекулах более многочисленны, чем в капсуле.
Пульпа селезенки разделяется на белую (pulpa alba) и красную (pulpa rubra). Строма красной и белой пульпы представлена ретикулярной тканью. Строение селезенки и соотношение между белой и красной пульпой могут изменяться в зависимости от функционального состояния органа.
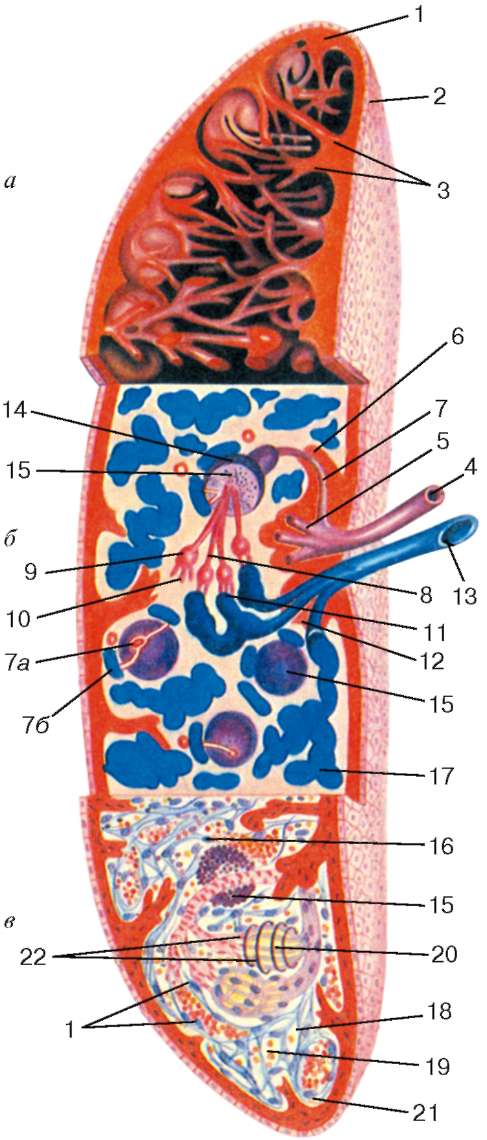
Рис. 14.6. Строение селезенки (по Ю. И. Афанасьеву): а - опорно-сократительный аппарат - капсулы и трабекулы; б - кровообращение; в - гистологическая структура селезенки. 1 - капсула; 2 - мезотелий; 3 - трабекулы; 4 - селезеночная артерия; 5 - трабекулярная артерия; 6 - пульпарная артерия;
7 - центральная артерия; 7а - капилляры в лимфоидном узелке; 7б - краевой синус;
8 - кисточковые артериолы; 9 - эллипсоидная муфта; 10 - капилляр, свободно открывающийся в пульпу (по теории открытого кровообращения); 11 - капилляр, переходящий в венозный синус (по теории закрытого кровообращения); 12 - тра-бекулярная вена; 13 - селезеночная вена; 14 - лимфатическое периартериальное влагалище; 15 - лимфоидные узелки (белая пульпа); 16 - красная пульпа; 17 - венозные синусы; 18 - ретикулярная ткань; 19 - эритроциты и лейкоциты в красной пульпе; 20 - щели в эндотелии синуса; 21 - ядра эндотелиальных клеток; 22 - арги-рофильные волокна
14.3.1. Белая пульпа селезенки
В белой пульпе выделяют лим-фоидные периартериальные муфты (влагалища) и лимфоидные узелки. Периартериальные муфты - это место, где происходит активация, пролиферация и дифференцировка Т-лимфоцитов и активация В-лим-фоцитов. Эту зону называют тимусза-висимой. Строма муфты представлена ретикулярными клетками и ретикулярными волокнами, которые образуют один или несколько концентрических слоев вокруг центральной артерии (см. ниже). В центральных частях муфты находятся антигенпред-
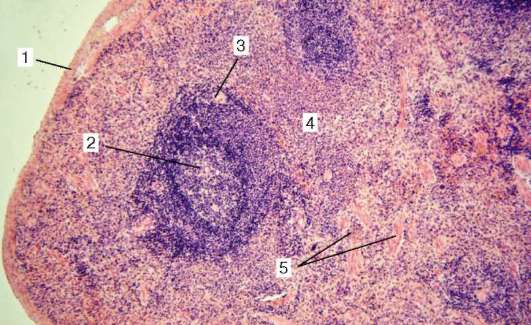
Рис. 14.7. Строение селезенки (микрофотография):
1 - капсула; 2 - лимфоидный узелок (белая пульпа); 3 - центральная артерия; 4 - красная пульпа; 5 - трабекула
ставляющие клетки и рециркулирующие из крови Т-лимфоциты. 75 % из них являются Т-хелперами (CD4+), остальные Т-киллерами (CD8+). Встречаются также В-лимфоциты, плазматические клетки и макрофаги.
Лимфоидные узелки (noduli lymphoideus splenici). В местах ветвления центральной артерии (a. centralis) на периферии периартериальной муфты находятся сферические скопления лимфоцитов (рис. 14.7). Они видны невооруженным глазом как беловатые пятна 0,3-0,5 мм в диаметре. Лимфоидные узелки отделены от периартериальной лимфоидной муфты тонкой капсулой из вытянутых ретикулярных клеток.
Первичные узелки состоят из малых В-лимфоцитов, мигрирующих из кровотока, и антигенпредставляющих дендритных клеток. Вторичные узелки образуются после антигенной стимуляции. Центр размножения, или герминативный центр узелка, состоит из ретикулярных клеток и пролиферирую-щих В-лимфобластов, дифференцирующихся антителообразующих плазматических клеток. Здесь нередко можно обнаружить скопления макрофагов с фагоцитированными лимфоцитами или их фрагментами в виде хромофиль-ных телец и дендритные клетки. В этих случаях центральная часть узелка выглядит светлой («реактивный центр»).
Следующая - мантийная зона - окружает периартериальную зону и центр размножения, состоит главным образом из густо расположенных малых В-лимфоцитов и небольшого количества Т-лимфоцитов, а также содержит плазмоциты и макрофаги. Прилегая плотно друг к другу, клетки этой зоны образуют подобие короны, расслоенную циркулярно направленными толстыми ретикулярными волокнами.
Краевая, или маргинальная, зона узелков селезенки представляет собой переходную область между белой и красной пульпой шириной около 100 мкм. Она состоит преимущественно из Т- и В-лимфоцитов и клеток микроокру-
жения - ретикулярных клеток фибробластического типа. В этой зоне проходит много артериальных веточек и венозных синусов. Маргинальная зона является местом формирования иммунного ответа.
Антигены , приносимые кровью, задерживаются в этой зоне и красной пульпе. Далее они переносятся макрофагами на поверхность антигенпредставляющих (дендритных и интердигитирующих) клеток белой пульпы. При первичном иммунном ответе продуцирующие антитела клетки появляются сначала в эллипсоидных муфтах, а затем в красной пульпе. При вторичном ответе формируются центры размножения, где образуются клоны В-лимфоцитов и клетки памяти. Дифференцировка В-лимфоцитов в плазмоциты завершается в красной пульпе.
14.3.2. Красная пульпа селезенки
Красная пульпа селезенки занимает около 75 % объема и состоит из ретикулярной ткани с расположенными в ней клеточными элементами крови, придающими ей красный цвет, и многочисленными кровеносными сосудами, главным образом синусоидного типа.
Часть красной пульпы, расположенная между синусами, называется селезеночными, или пульпарными, тяжами (chordae splenicae). Здесь по аналогии с мозговыми тяжами лимфатических узлов заканчивают свою диффе-ренцировку и секретируют антитела плазмоциты, предшественники которых перемещаются сюда из белой пульпы, а также в тяжах находится запас тромбоцитов и значительное количество полустволовых гемопоэтических клеток. Строма красной пульпы заполнена В- и Т-лимфоцитами. В этих местах могут формироваться новые лимфоидные узелки. В красной пульпе задерживаются моноциты, которые дифференцируются в макрофаги.
Старые и поврежденные эритроциты не обладают достаточной пластичностью для прохождения по узким щелям между ретикулярными клетками и через поры в стенках синусов. Они остаются в красной пульпе, распознаются и захватываются макрофагами. Повышение фагоцитарной активности макрофагов (гиперспленизм) в отношении клеток крови приводит к ряду заболеваний. При недостаточной активности (гипо-спленизме) в крови появляются эритроциты с зернами железосодержащих соединений - сидероциты. В результате расщепления гемоглобина поглощенных макрофагами эритроцитов образуются и выделяются в кровоток билирубин и содержащий железо трансферрин. Билирубин переносится в печень, где включается в состав желчи. Трансферрин из кровотока захватывается макрофагами костного мозга, которые снабжают железом развивающиеся эритроциты.
Синусы красной пульпы, расположенные между селезеночными тяжами, представляют собой часть сложной сосудистой системы селезенки, в связи с чем их следует рассмотреть отдельно.
Васкуляризация. В ворота селезенки входит селезеночная артерия, которая разветвляется на трабекулярные артерии. Наружная оболочка артерий рыхло соединена с тканью трабекул (см. рис. 14.6). Средняя оболочка хорошо заметна на любом срезе трабекулярной артерии благодаря мышечным
пучкам, идущим в составе ее стенки по спирали. От трабекулярных артерий отходят пульпарные артерии. В наружной оболочке этих артерий много спирально расположенных эластических волокон, которые обеспечивают продольное растяжение и сокращение сосудов. Пульпарная артерия почти сразу после выхода из трабекулы окружается муфтой из лимфоидной ткани и на этом отрезке называется центральной артерией.
Центральная артерия (a. centralis lymphonoduli) - это сосуд мышечного типа среднего размера. От нее под прямым углом отходят тонкостенные сосуды в периартериальную лимфоидную муфту. В этих сосудах лимфоциты занимают пристеночное положение, выселяются, обогащая тем самым клеточный состав муфты и маргинальной зоны. Оставшиеся в капиллярах эритроциты поступают далее в маргинальные венозные синусы. Центральная артерия направляется в маргинальную зону и красную пульпу и разделяется на кисточковые артериолы (arteriolae penicillaris) диаметром 100 мкм. Последние распадаются на множество кисточковых капилляров. Эндотелий капилляров может открывать или закрывать просвет сосуда. Между эндо-телиоцитами существуют поры, базальная мембрана прерывиста. Концы капилляров открываются в венозные синусы (гемокапилляры венозного типа). Однако 90 % капилляров изливают кровь непосредственно в ретикулярную ткань маргинальной зоны и селезеночных тяжей, и только после этого кровь попадает в венозные синусы. Эти капилляры имеют специализированные эллипсоидные образования на своих концах, получивших название макрофагальная муфта (vagina macrophagocytica). Макрофаги муфт содержат фрагменты эритроцитов, располагаются рыхло, формируют губчатую структуру. Муфты участвуют в регуляции кровотока и улавливании антигенов, приносимых кровью.
Таким образом, в селезенке существуют две системы кровоснабжения: закрытая (капилляр-синусоид) и открытая (капилляр-ретикулярная ткань). Закрытая (быстрая) система снабжает ткани кислородом. Открытая (медленная) система приносит эритроциты и антигены для контакта с макрофагами.
Синусы занимают 30 % площади сечения красной пульпы. Они являются началом венозной системы селезенки. Их диаметр колеблется от 12 до 40 мкм в зависимости от кровенаполнения. При расширении совокупность всех синусов занимает большую часть селезенки. Их содержимое - кровь или плазма с небольшим количеством лимфоцитов и моноцитов. Эндотелиоциты синусов расположены на прерывистой базальной мембране (рис. 14.8). По поверхности стенки синусов в виде колец залегают ретикулярные волокна. Синусы не имеют перицитов. Во входе в синусы и в месте их перехода в вены имеются подобия мышечных сфинктеров. При открытых артериальных и венозных сфинктерах кровь свободно проходит по синусам в вены. Сокращение венозного сфинктера приводит к накоплению крови в синусе. Плазма крови проникает сквозь стенку синуса, что способствует концентрации в нем клеточных элементов. В случае закрытия венозного и артериального сфинктеров кровь депонируется в селезенке. При растяжении синусов между эндотелиальными клетками образуются щели, через которые
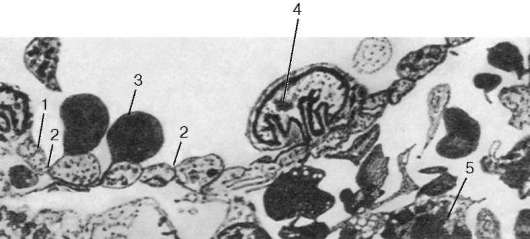
Рис. 14.8. Синус селезенки. Электронная микрофотография, увеличение 3000 (по Судзуки):
1 - эндотелий; 2 - щели в стенке синусоидного капилляра; 3 - эритроцит; 4 - лейкоцит; 5 - макрофаг в красной пульпе
кровь может проходить в ретикулярную строму. Расслабление артериального и венозного сфинктеров, а также сокращение гладких мышечных клеток капсулы и трабекул ведут к опорожнению синусов и выходу крови в венозное русло. Перечисленные особенности строения стенки синусов обеспечивают перемещение плазмы и форменных элементов крови из пульпы в синусы.
Отток венозной крови совершается по системе вен. Трабекулярные вены лишены мышечного слоя. Наружная оболочка вен плотно сращена с соединительной тканью трабекул. Такое строение вен обусловливает их зияние при сокращении гладких мышечных клеток селезенки и облегчает выброс крови. Между артериями и венами в капсуле селезенки, а также между пульпарными артериями встречаются анастомозы. Кровь из селезенки попадает в воротную вену, давление в которой относительно высокое. При извлечении селезенки из организма кровь из нее быстро вытекает, что отражается на гистологической картине, прежде всего, синусов красной пульпы.
Лимфатические сосуды начинаются глубоко в белой пульпе, опоясывают центральную артерию и далее впадают в трабекулярные лимфатические сосуды, образующие выносящий лимфатический сосуд, выходящий из ворот селезенки.
Иннервация. В селезенке имеются чувствительные нервные волокна (дендриты нейронов спинномозговых узлов) и постганглионарные симпатические нервные волокна из узлов солнечного сплетения. Миелиновые и безмиелиновые (адренергические) нервные волокна обнаружены в капсуле, трабекулах и сплетениях вокруг трабекулярных сосудов и артерий белой пульпы, а также в синусах селезенки. Нервные окончания в виде свободных концевых веточек располагаются в соединительной ткани, на гладких мышечных клетках трабекул и сосудов, в ретикулярной строме селезенки.
Возрастные изменения. В старческом возрасте в селезенке происходит атрофия белой и красной пульпы, вследствие чего ее трабекулярный аппарат вырисовывается более четко. Количество лимфоидных узелков в селезенке и
размеры их центров размножения постепенно уменьшаются. Ретикулярные волокна белой и красной пульпы грубеют и становятся более извилистыми. У людей старческого возраста наблюдаются узловатые утолщения волокон. Количество макрофагов и лимфоцитов в пульпе уменьшается, а число зернистых лейкоцитов и тучных клеток возрастает. У детей и людей старческого возраста в селезенке обнаруживаются гигантские многоядерные клетки - мегакариоциты. Количество железосодержащего пигмента, отражающее процесс гибели эритроцитов, с возрастом в пульпе увеличивается, но располагается он главным образом внеклеточно.
Регенерация. Физиологическое обновление лимфоидных и стромальных клеток происходит в пределах самостоятельных стволовых дифферонов. Экспериментальные исследования на животных показали возможность восстановления селезенки после удаления 80-90 % ее объема (репаративная регенерация). Однако полного восстановления формы и размеров органа при этом, как правило, не наблюдается.
14.4. ЛИМФАТИЧЕСКИЕ УЗЛЫ
Лимфатические узлы (noduli limphatici) располагаются по ходу лимфатических сосудов, регионарно, группами, являются органами лимфоцитопоэза, иммунной защиты и депонирования протекающей лимфы.
В лимфатических узлах происходят антигензависимая пролиферация (клонирование) и дифференцировка Т- и В-лимфоцитов в эффекторные клетки, образование клеток памяти. Лимфатические узлы - это округлые или овальные весьма многочисленные (до 1000) образования размером около 0,5-1 см. Обычно они с одной стороны имеют вдавление (рис. 14.9). В этом месте, называемом воротами, в узел входят артерии и нервы, а выходят вены и выносящие лимфатические сосуды. Сосуды, приносящие лимфу, входят с противоположной, выпуклой стороны узла. Благодаря такому расположению узла по ходу лимфатических сосудов он является не только кроветворным органом, но и своеобразным фильтром для оттекающей от тканей жидкости (лимфы) на пути в кровяное русло.
Протекая через лимфатические узлы, лимфа на 95-99 % очищается от инородных частиц и антигенов, от избытка воды, белков, жиров, обогащается антителами и лимфоцитами.
Развитие. У человека большая часть узлов закладывается на 9-10-й нед эмбриогенеза, однако некоторые узлы могут появляться в течение всего пре-натального периода и даже позднее. Как правило, они закладываются на основе расширений или сплетений лимфатических и кровеносных сосудов. Лимфатические щели и сосуды становятся синусами, а окружающая мезенхима дает начало соединительнотканным перегородкам и ретикулярной строме. В перегородки проникают кровеносные сосуды. Заселение стро-мы Т- и B-лимфоцитами и макрофагами начинается с 12-13-й нед, однако на протяжении всего эмбриогенеза преобладают T-лимфоциты. К 15-
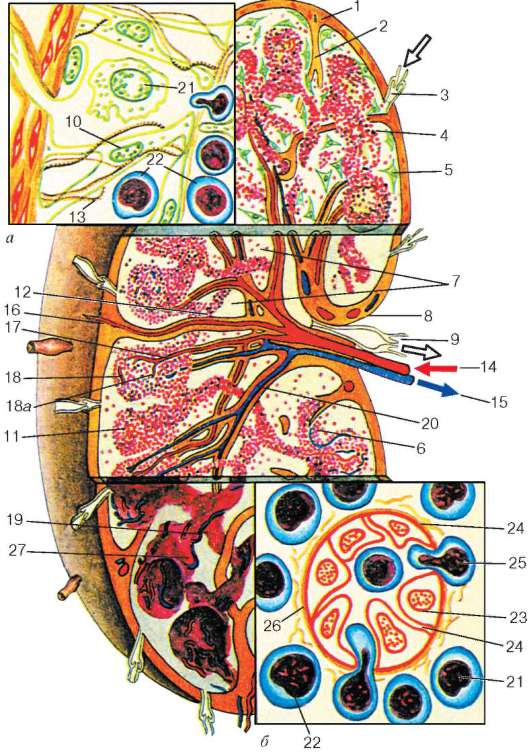
Рис. 14.9. Строение и кровоснабжение лимфатического узла с фрагментами краевого синуса (а) и посткапиллярной венулы (б) (по Ю. И. Афанасьеву): 1 - соединительнотканная капсула; 2 - трабекула; 3 - приносящие лимфатические сосуды; 4 - краевой (подкапсульный) синус; 5 - ретикулярные клетки вокруг синусов (береговые клетки); 6 - вокругузелковый синус; 7 - мозговые синусы; 8 - ворота лимфатического узла; 9 - выносящий лимфатический сосуд; 10 - ретикулярные клетки; 11 - лимфоидные узелки; 12 - мозговые тяжи; 13 - ретикулярные волокна; 14 - артерия лимфатического узла; 15 - вена лимфатического узла; 16 - трабеку-лярная артерия; 17 - артерии мозговых тяжей; 18 - поверхностные и 18а - глубокие гемокапиллярные сети; 19 - вены мозговых тяжей; 20 - трабекулярная вена; 21 - макрофаги в синусах; 22 - лимфоциты и плазматические клетки; 23 - эндотелий; 24 - щели между эндотелиальными клетками; 25 - лимфоцит, проникающий в щель; 26 - базальная мембрана; 27 - паракортикальная зона
16-й нед формируется капсула и хорошо заметен краевой синус. С 19-20-й нед скопления лимфоцитов образуют диффузную кору, первичные лимфатические узелки (без центров размножения) и мозговые тяжи. В этот период хорошо развита система кровообращения, внутри скоплений лимфоцитов коры имеются капиллярные сети. Большинство венозных сосудов выстлано высоким эндотелием, обеспечивающим вселение лимфоцитов. К концу эмбриогенеза в узлах сформированы все структуры: корковое вещество с лимфоидными узелками, мозговые тяжи, синусы, T- и B-зоны. Центры размножения и плазматические клетки появляются после рождения. Вены с высоким эндотелием остаются только в паракортикальной зоне. Входящие в узел лимфатические сосуды становятся приносящими сосудами, а выходящие из ворот - выносящими.
В конце 5-го мес внутриутробного развития лимфатические узлы приобретают черты дефинитивного кроветворного органа.
К концу эмбриогенеза в лимфатических узлах заканчивается формирование всех структур - коркового вещества с лимфоидными узелками, мозговых тяжей, синусов, Т- и В-зон.
Строение. Несмотря на многочисленность лимфатических узлов и вариации органного строения, они имеют общие принципы организации. Снаружи узел покрыт соединительнотканной капсулой, несколько утолщенной в области ворот. В капсуле много коллагеновых и мало эластических волокон. Кроме соединительнотканных элементов, в ней главным образом в области ворот располагаются отдельные пучки гладких мышечных клеток, особенно в узлах нижней половины туловища. Внутрь от капсулы через относительно правильные промежутки отходят тонкие соединительнотканные перегородки, или трабекулы, анастомозирующие между собой в глубоких частях узла. В совокупности они занимают примерно 1/4 площади среза органа. В пространстве между капсулой и трабекулами расположена ретикулярная ткань, в петлях которой находятся лимфоциты разной степени дифференцировки и свободные макрофаги.
На срезах узла, проведенных через его ворота, можно различить периферическое, более плотное корковое вещество, состоящее из лимфоидных узелков, и центральное светлое мозговое вещество, образованное мозговыми тяжами и синусами. Пограничная с мозговым веществом часть коркового вещества называется паракортикальной, тимусзависимой, зоной, так как содержит значительное количество T-лимфоцитов (преимущественно T-хелперов, CD4+).
Соотношение коркового и мозгового вещества неодинаково в узлах разной локализации. В связи с этим выделяют три группы лимфатических узлов: висцеральные, соматические и смешанные. В лимфатических узлах, регионарных для внутренних органов, преобладает мозговое вещество; в соматических, регионарных для опорно-двигательного аппарата, - корковое.
Мозговое вещество представлено синусами и чередующимися с ними плотными скоплениями клеток, отходящими от узелков или диффузной части коркового вещества в глубь узла, - мозговыми тяжами.
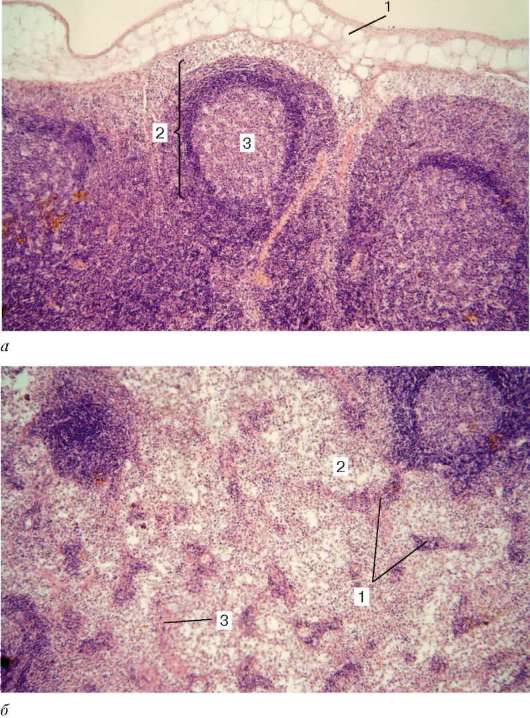
Рис. 14.10. Корковое (а) и мозговое (б) вещество лимфатического узла:
а: 1 - капсула; 2 - лимфоидный узелок; 3 - центр размножения (реактивный центр);
б: 1 - мозговой тяж; 2 - ретикулярные клетки стромы; 3 - трабекула
14.4.1. Корковое вещество
В корковом веществе (noduli lymphatici) выделяются шаровидные структуры - лимфоидные узелки (14.10, а). Они окружены очень плоскими ретикулярными клетками, мало заметными при световой микроскопии, и тонкими аргирофильными волокнами. В межузелковой части располагаются лимфоциты и макрофаги. Различают первичные и вторичные лимфоидные узелки. Узелки содержат антигенпредставляющие дендритные клетки и В-лимфоциты. После рождения и столкновения организма с антигенами в
первичные узелки мигрируют активированные В-лимфоциты и активированные тем же антигеном Т-хелперы. Примерно через 1 нед после попадания антигена в них появляются пролиферирующие В-лимфоциты, образующие центры размножения, корону, и первичные узелки становятся вторичными.
Антигенпредставляющие узелковые дендритные клетки отличаются крупными размерами, имеют складчатую поверхность и длинные ветвящиеся отростки. Ядро большое, дольчатое, гетерохроматин почти отсутствует. При электронной микроскопии выявляются редкие митохондрии, немного гладкой и гранулярной эндоплазматической сети, гладкие и окаймленные пузырьки, полирибосомы, цистерны комплекса Гольджи, редкие лизосомы и секреторные гранулы. Поверхность этих клеток покрыта электронно-плотным материалом, часто имеющим вид тонких нитевидных образований, на длинных отростках выявляются структуры в виде бусин. Они имеют на плазмолемме антигены главного комплекса гистосовместимости (ГКГ) II класса, Fc-рецепторы антител и др. Эти клетки способны длительное время (месяцы и годы) удерживать на своей мембране попадающие в узел антигены или антигенные комплексы и активировать новые В-лимфоциты.
Во вторичном лимфоидном узелке выделяют: темную, светлую базаль-ную, светлую апикальную и мантийную (корону) зоны. В темной зоне плотно расположены интенсивно делящиеся В-лимфоциты - центробласты и немногочисленные дендритные клетки. Светлая базальная зона содержит центроциты (прекратившие деление центробласты), множество дендритных клеток и макрофаги. Макрофаги необычно крупные, с интенсивно окрашивающимися фрагментами лимфоцитов, подвергшихся апоптозу в результате селекции. Светлую апикальную зону заполняют дифференцированные центроциты - В-лимфоциты, отобранные для иммунных реакций. Долгоживущие В-лимфоциты памяти скапливаются на периферии узелка - в короне. Корона имеет полулунную форму, которая постепенно истончается в области мозгового полюса узелка. Лимфоидные узелки формируются на основе ретикулярной ткани. Ретикулярные клетки фибро-бластического типа участвуют в образовании аргирофильных коллагено-вых (из коллагена III типа) волокон, которые обеспечивают механические свойства и перемещение лимфоидных клеток, постоянно происходящее в узлах в связи с иммунизацией. Макрофаги присутствуют во всех зонах лимфатического узла. Их предшественники поступают по приносящим лимфатическим сосудам. Окружающее узелки диффузное корковое вещество представлено ретикулярной тканью и лимфоцитами. В нем выделяют маргинальную зону, располагающуюся между краевым (субкапсулярным) синусом и лимфоидными узелками, и межузелковую зону, через которую проходят синусы. В маргинальной зоне находятся ретикулярные клетки и макрофаги с высокой фагоцитарной активностью. Среди лимфоцитов преобладают В-лимфоциты, отвечающие на тимуснезависимые антигены.
Строение лимфоидных узелков может меняться в зависимости от физиологического состояния организма (рис. 14.11). Различают четыре стадии, отражающие происходящие в них процессы. На I стадии - формирование центра размножения - в лимфоидном узелке имеется небольшой центр,
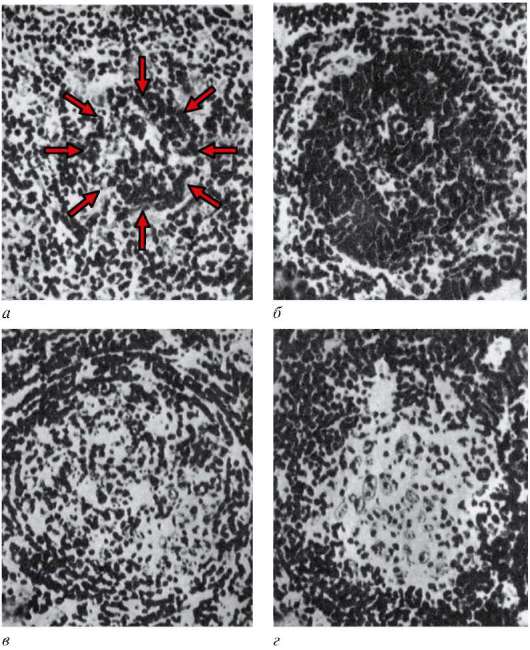
Рис. 14.11. Четыре стадии изменения строения лимфоидных узелков (по Е. Конвей): а - начальная стадия; б - образование центра размножения; в - формирование темной зоны, состоящей из малых лимфоцитов, вокруг светлого центра; г - светлый (реактивный) центр, состоящий из ретикулярных клеток и макрофагов
состоящий преимущественно из малодифференцированных клеток лим-фоцитопоэтического ряда. Некоторые из этих клеток могут быть в состоянии митотического деления. На II стадии у лимфоидных узелков центры крупнее и содержат большое количество митотически делящихся клеток лимфоцитопоэтического ряда (от 10 и более на срезе). Центральная часть узелка выглядит светлой. На III стадии вокруг светлых центров появляется корона из малых лимфоцитов. Уменьшаются число митотически делящихся клеток и количество молодых клеток лимфоцитопоэтического ряда. На IV стадии в центре узелка фигуры митозов и макрофаги единичны. Вокруг узелка корона из малых лимфоцитов состоит преимущественно из В-клеток памяти. Это стадия относительного покоя. Возникновение и исчезновение центров происходит в течение 2-3 сут.
14.4.2. Паракортикальная зона
На границе между корковым и мозговым веществом располагается пара-кортикальная тимусзависимая зона (paracortex). Она состоит из ряда полусферических и полуовальных структур, являющихся продолжением одного или нескольких лимфоидных узелков и переходящих в тяжи мозгового вещества. В этой зоне находятся посткапиллярные венулы с высоким эндотелием, к которому лимфоциты, вышедшие в кровоток из костного мозга и тимуса, имеют специфические рецепторы. Они служат местом подселения в узел циркулирующих и рециркулирующих лимфоцитов. Клетками микроокружения являются ретикулярные клетки, макрофаги и особый вид дендритных антигенпредставляющих клеток - интердигитирующие клетки. Их длинные пальцевидные отростки проникают между соседними клетками на значительные расстояния. Ядро имеет глубокие инвагинации. Полагают, что они мигрируют из тканей по приносящим лимфатическим сосудам. В их плазмолемме имеется большое количество молекул ГКГ II класса, которые в комплексе с пептидами антигенов играют главную роль в активации преобладающих здесь Т-лимфоцитов. После тимэктомии содержание Т-лимфоцитов в паракортикальной зоне резко снижается, поэтому ее называют тимусзависимой.
Развитие иммунного ответа на тимусзависимые антигены начинается в этой зоне. Здесь происходит активация антигеном Т-хелперов, запускающих активацию и пролиферацию В-лимфоцитов и Т-киллеров.
14.4.3. Мозговое вещество
От узелков и паракортикальной зоны внутрь узла, в его мозговое вещество, отходят мозговые тяжи (chordae medullaria), анастомозирующие между собой. Мозговые тяжи, расположенные между синусами, в ретикулярной ткани содержат активированные В-лимфоциты, дифференцирующиеся в плазмобласты и плазмоциты. Мозговые тяжи вместе с окружающими их тра-бекулами и синусами образуют мозговое вещество (medulla) (см. рис. 14.10, б).
Ток лимфы в органе осуществляется по системе внутриорганных лимфатических сосудов, называемых синусами. Они формируют систему анасто-мозирующих трубок и полостей. Из приносящих лимфатических сосудов лимфа вначале попадает в краевой (субкапсулярный) синус, находящийся между капсулой узла и субкапсулярным полюсом короны, далее в межузелковые (между корковыми трабекулами и лимфоидным узелком) и мозговые синусы (между мозговыми трабекулами и мозговыми тяжами), впадающие в области ворот в конечный синус, от которого берет начало выносящий лимфатический сосуд. Стенка венозных синусов образована эндотелиоци-тами, между которыми обнаруживаются щели шириной 1-3 мкм, и прерывистой базальной мембраной. Эндотелиоциты имеют палочковидную форму. Снаружи стенка образована ретикулярными клетками и их отростками. Перициты отсутствуют. Макрофаги мозговых тяжей могут внедрять
свои псевдоподии внутрь синусов и фагоцитировать чужеродные вещества. Полости синусов заполнены отростчатыми ретикулярными клетками и аргирофильными волокнами, значительно замедляющими движение лимфы, разными лимфоцитами, макрофагами, плазматическими клетками и единичными гранулоцитами. Все это облегчает фагоцитоз антигенов и межклеточные контакты. В лимфу синусов поступают секретируемые антитела и уходящие из узла лимфоциты. Таким образом, синусы играют роль защитных фильтров, в которых благодаря наличию фагоцитирующих клеток задерживается большая часть попадающих в лимфатические узлы антигенов.
Лимфатические узлы очень чувствительны к различным внешним и внутренним факторам. Например, под действием ионизирующей радиации быстро погибают лимфоциты в лимфоидных узелках, в мозговых тяжах. При недостаточной функции гормонов коры надпочечников, наоборот, происходит разрастание лимфоидной ткани во всех органах (status thymicolymphaticus). Лимфатические узлы могут быть местом локализации очагов инфекции и опухолевых клеток. Существует ряд заболеваний, приводящих к множественному увеличению лимфатических узлов.
Васкуляризация. Кровеносные сосуды проникают в лимфатические узлы через их ворота. После вхождения в узел одна часть артерий распадается на капилляры в капсуле и трабекулах, другая заканчивается в лимфоидных узелках, паракортикальной зоне и мозговых тяжах. Некоторые артерии проходят сквозь узел, не разветвляясь (транзитные артерии).
В узелках различают две гемокапиллярные сети - поверхностную и глубокую. От гемокапилляров начинается венозная система узла, которая совершает обратный ход, преимущественно отдельно от артерий. Эндотелий посткапиллярных венул более высокий, чем в обычных капиллярах, а между эндотелиальными клетками имеются поры. Особенности строения эндотелия играют роль в процессах рециркуляции лимфоцитов из кровотока в узел и обратно. В обычных физиологических условиях кровь из сосудов не изливается в его синусы. Однако при воспалительных процессах в синусах регионарных лимфатических узлов часто обнаруживаются эритроциты.
Иннервация. Лимфатические узлы имеют афферентную и эфферентную адренергическую и холинергическую иннервацию. В подходящих к органу нервах, а также в капсуле обнаружены интрамуральные нервные узлы. Рецепторный аппарат хорошо выражен во всех макро- и микроскопических структурах: капсуле, трабекулах, сосудах, корковом и мозговом веществе. Имеются свободные и несвободные нервные окончания. Внутри лимфоид-ных узелков нервные окончания не обнаружены.
Возрастные изменения. В течение первых 3 лет жизни ребенка происходит окончательное формирование лимфатических узлов. На протяжении первого года жизни появляются центры размножения в лимфоидных узелках, увеличивается число В-лимфоцитов и плазматических клеток. В возрасте от 4 до 6 лет продолжается новообразование лимфоидных узелков, мозговых тяжей, трабекул. Дифференцировка структур лимфатического узла в основном заканчивается к 12 годам.
С периода полового созревания начинается возрастная инволюция, которая выражается в утолщении соединительнотканных перегородок, увеличении количества жировых клеток, уменьшении коркового и увеличении мозгового вещества, уменьшении в корковом веществе числа лимфоидных узелков с центрами размножения.
В старческом возрасте центры размножения исчезают, капсула узлов утолщается, количество трабекул возрастает, фагоцитарная активность макрофагов постепенно ослабевает. Некоторые узлы могут подвергаться атрофии и замещаться жировой тканью.
Регенерация. Регенерация лимфатических узлов (частичная или полная) возможна лишь при сохранении приносящих и выносящих лимфатических сосудов и прилежащей к узлу соединительной ткани. В случае частичной резекции лимфатического узла его репаративная регенерация происходит через 2-3 нед после повреждения. Восстановление начинается с пролиферации клеток ретикулярной ткани, затем появляются очаги лимфоидного кроветворения и образуются узелки. При полном удалении лимфатического узла, но при сохранении лимфатических сосудов регенерация этого органа начинается с появления большого количества очагов лимфоидного кроветворения, которые возникают из стволовых гемоэтических клеток. При этом приносящие и выносящие лимфатические сосуды анастомозируют между собой в области лимфоидного очага.
В результате дальнейших преобразований анастомозы сосудов оказываются погруженными внутрь лимфоидного очага и превращаются в синусы узла.
14.5. ЕДИНАЯ ИММУННАЯ СИСТЕМА СЛИЗИСТЫХ ОБОЛОЧЕК
Эта система представлена скоплениями лимфоцитов в слизистых оболочках пищеварительного тракта, бронхов, мочеполовых путей, выводных протоков молочных и слюнных желез. Лимфоциты могут формировать одиночные или групповые лимфоидные узелки (миндалины, червеобразный отросток, групповые (агрегированные) лимфоидные узелки, или пейеровы бляшки, кишки). Лимфоидные узелки осуществляют локальную иммунную защиту названных органов.
Общими для всех этих участков являются расположение лимфоцитов в рыхлой волокнистой соединительной ткани оболочек, покрытых эпителием, синтез антител, относящихся к IgA, в образовании которых участвуют как стимулированные антигенами В-лимфоциты и их потомки, плазматические клетки, так и эпителиоциты оболочек, вырабатывающие секреторный компонент IgA. Сборка молекулы иммуноглобулина происходит в слизи на поверхности эпителиоцитов, где они обеспечивают местную антибактериальную и противовирусную защиту. Располагающиеся в узелках Т-лимфоциты осуществляют реакции клеточного иммунитета и регулируют деятельность В-лимфоцитов.
14.6. МОРФОЛОГИЧЕСКИЕ ОСНОВЫ ЗАЩИТНЫХ РЕАКЦИЙ
14.6.1. Воспаление и регенерация
При действии повреждающих агентов (механических, химических, бактериальных и других) в тканях развивается сложная сосудисто-тканевая защитно-приспособительная реакция - воспаление. При воспалении наблюдаются как общие, так и местные изменения. Местные проявления реакции организма в очаге воспаления включают несколько взаимосвязанных фаз: 1) альтерация (повреждение) тканей; 2) высвобождение физиологически активных веществ - так называемых медиаторов воспаления; 3) сосудистая реакция с экссудацией, включающая изменение кровотока в микроцирку-ляторном русле, повышение проницаемости сосудов; 4) резорбция продуктов распада тканей; 5) пролиферация клеток с образованием «грануляционной ткани» и последующей регенерацией тканей. Завершается воспаление, как правило, образованием зрелой волокнистой соединительной ткани.
При описании воспаления обычно выделяют три фазы: лейкоцитарную, с преобладанием в очаге воспаления нейтрофильных гранулоцитов; макро-фагическую, когда продукты распада активно резорбируются макрофагами; фибробластическую, на протяжении которой на месте повреждения разрастается соединительная ткань.
Лейкоцитарная фаза воспаления характеризуется передвижением нейтро-фильных гранулоцитов в очаг распада ткани на месте ее повреждения. Пусковым механизмом воспаления является выброс медиаторов и цитоки-нов (гистамина, серотонина, лизосомных гидролаз и других биологически активных веществ). Источником выделения медиаторов являются тучные клетки, лейкоциты, кровяные пластинки, макрофаги и лимфоциты. При этом развивается комплекс сосудистых изменений, включающий повышение проницаемости микроциркуляторного русла, экссудацию жидких составных частей плазмы, эмиграцию клеток крови. Уже через 6 ч от начала воспаления образуется лейкоцитарный инфильтрат. Нейтрофильные гранулоциты проявляют высокую фагоцитарную активность, поглощая главным образом микроорганизмы (отсюда их название - микрофаги). Часть нейтрофилов при этом распадаются, выделяя большое количество лизосомных гидролаз. Это способствует очищению очага воспаления от поврежденных тканей.
Макрофагическая фаза воспаления протекает при явлениях активизации макрофагов как гематогенных (возникающих из моноцитов крови), так и гистиогенных (оседлых макрофагов - гистиоцитов). Макрофаги энергично фагоцитируют продукты тканевого распада. Вместе с тем они вырабатывают вещества - стимуляторы восстановительных процессов в очаге воспаления.
Фибробластическая фаза является завершающей фазой воспаления. Она характеризуется пролиферацией (размножением) клеток фибробластическо-го ряда и их передвижением к воспалительному очагу. Поскольку к этому времени заканчивается в основном очищение места повреждения от продук-
тов тканевого распада, фибробласты заполняют бывший дефект ткани. Они интенсивно вырабатывают межклеточное вещество. При этом образуются вначале тонкие аргирофильные, а позднее и коллагеновые волокна. Вместе с клетками эти волокна отграничивают воспалительный очаг от неповрежденной ткани. Разрастание фибробластов постепенно приводит к замещению воспалительного очага соединительной тканью. При значительном дефекте ткани на месте очага воспаления формируется рубец. При наличии инородного тела вокруг него образуется соединительнотканная капсула, отчетливо выраженная на 5-7-е сут от начала воспаления. Относительно источников развития фибробластов в очаге повреждения существуют разные гипотезы. Так, различают две субпопуляции фибробластов, имеющие разные источники и различающиеся неодинаковой продолжительностью жизни (коротко- и долгоживущие фибробласты). Фибробласты, которые развиваются из стволовых гемопоэтических клеток, - это короткоживущая популяция фибробластов защитно-трофического типа, участвующая в процессах воспаления, заживления ран и т. п. Другие фибробласты происходят от стволовых стромальных клеток (механоцитов) костного мозга. Это популяция долгоживущих фибро-бластов опорного типа с преимущественно механическими функциями. Кроме того, существуют специализированные формы фибробластов - фиброкласты и миофибробласты (см. главу 8). Фиброкласты обеспечивают перестройку соединительной ткани путем разрушения межклеточного вещества. Клетки выявляются преимущественно в области формирования рубцовой ткани после повреждения органов. Миофибробласты также участвуют в регенерации тканей путем контракции краев раны.
14.7. ИММУННАЯ СИСТЕМА И КЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННЫХ РЕАКЦИЯХ
14.7.1. Общая характеристика. Определение понятий
Иммунная система объединяет органы и ткани, в которых происходит образование и взаимодействие клеток-иммуноцитов, выполняющих функцию распознавания генетически чужеродных субстанций (антигенов) и осуществляющих специфическую реакцию.
Иммунная система обеспечивает поддержание генетической целостности и постоянства внутренней среды организма, выполняя функцию распознавания «своего» и «чужого». В основе этого лежат неспецифические (врожденные) и специфические (приобретенные) реакции с вовлечением большого разнообразия клеточных дифферонов тканей внутренней среды.
К неспецифической защите относят барьерные свойства кожи и слизистых оболочек, бактерицидность и уровень кислотности секретов ряда клеток, а также фагоцитоз чужеродных агентов. Ведущими клетками врожденного иммунитета явля-
ются макрофаги, нейтрофилы, базофилы и тучные клетки (см. выше, воспаление и регенерация).
В специфической защите против определенного возбудителя главными клетками являются специализированные лимфоциты, плазматические клетки, антигенпред-ставляющие макрофаги.
Постоянно перемещающиеся лимфоциты осуществляют «иммунный надзор». Они способны «узнавать» чужие макромолекулы бактерий и клеток различных тканей многоклеточных организмов и осуществлять специфическую защитную реакцию.
Для понимания роли отдельных клеток в иммунных реакциях необходимо прежде всего дать определение некоторым понятиям иммунитета.
Иммунитет (от лат. immunitus - освобождение, избавление от чего-либо) - это защита организма от всего генетически чужеродного: микробов, вирусов, чужих клеток или генетически измененных собственных клеток.
Антигены - это сложные органические вещества, способные при поступлении в организм человека и животных вызывать специфический иммунный ответ. Свойствами антигенов обладают бактерии, вирусы, паразиты, чужеродные клетки и ткани, мутационно изменившиеся собственные клетки тела (например, раковые), продукты жизнедеятельности чужеродных клеток - белки, полисахариды, полипептиды, а также искусственные высокополимерные соединения.
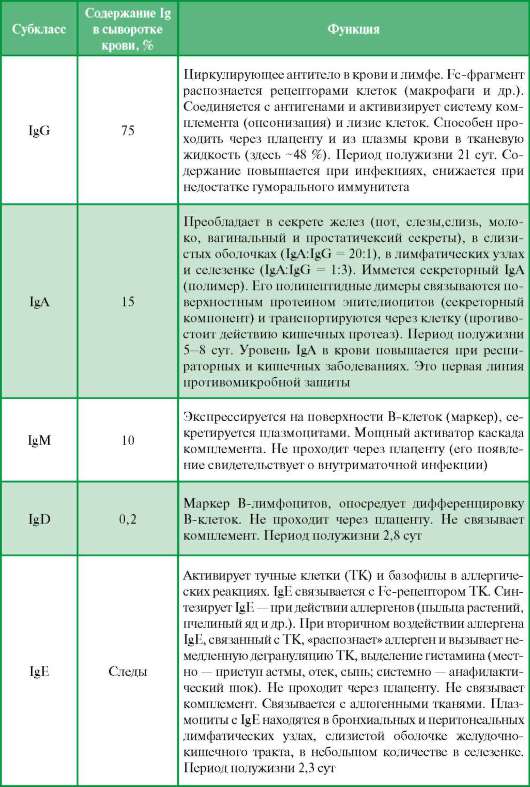
Антитела - это сложные белки, синтезируемые В-лимфоцитами и плазмоцитами, способные специфически соединяться с соответствующими антигенами (например, с бактериальными) и обезвреживать их. Обнаружение антител в глобулиновой фракции белков крови обусловило их название - иммуноглобулины (Ig). Выявлено несколько классов иммуноглобулинов - IgG, IgM, IgA, IgD, IgE (табл. 14.1).
Комплемент - группа белков, содержащихся в свежей сыворотке крови человека и животных, активизирующихся в тех случаях, когда антитело связывается с антигеном. Этот процесс приводит к лизису определенных типов клеток (лизис, опосредованный комплементом) или к образованию биологически активных веществ из белков комплемента, которые, прикрепляясь к бактериям, облегчают их фагоцитоз нейтрофилами. Эти вещества называют опсонинами.
Молекулы гистосовместимости. Практически все тканевые клетки организма экспрессируют молекулы гистосовместимости, которые доступны для опознавания клетками иммунной системы. Это важный механизм для того, чтобы специализированные клетки иммунной системы (Т-лимфоциты) могли распознать «свои» и «чужие» клетки.
В связи с тем, что молекула в составе клетки одного организма, будучи внесенная в другой, вызывает реакцию отторжения, она получила название антиген гистосовместимости, или главная молекула гистосовместимости (ГКГ). Последняя бывает двух классов - I и II.
Молекула гистосовместимости I класса является гликопротеином. Она состоит из трех частей: а) трансмембранного белка (тяжелой цепи), который пронизывает плазмолемму клетки и имеет внутриклеточную, цитоплаз-матическую и внеклеточную части (домены); б) белка малой молекуляр-
Таблица 14.1. Характеристика иммуноглобулинов
ной массы (эпитопа), расположенного между петлями внеклеточной части трансмембранного белка; в) периферического белка. Гены, кодирующие молекулярную организацию трансмембранного белка, расположены на 6-й хромосоме в области, которая получила название главный комплекс гистосов-местимости (англ. МНС - major histocompatibility complex).
Основная биологическая роль молекулы гистосовместимости I класса - дать возможность Т-лимфоцитам с помощью своих Т-клеточных рецепторов распознать «свои» и «чужие» клетки. Информацию об этом несет разнообразный по составу и последовательности расположения аминокислот низкомолекулярный белок - эпитоп. Это фрагмент, возникший из белков, присутствующих внутри клетки. Среди них могут быть: а) фрагменты собственных белков, тогда они не вызывают ответной реакции со стороны специализированных Т-лимфоцитов; б) молекулы белка, кодируемые вирусом; в) молекулы белка, кодируемые мутантным геномом раковой клетки организма. В случае появления двух последних происходит реакция клетки, несущей чужеродный эпитоп, с Т-лимфоцитом, который называется цито-токсическим. Суть реакции заключается в следующем. Цитотоксические лимфоциты имеют рецепторы, с помощью которых осуществляется мониторинг практически всех клеток организма (за исключением тех, которые отделены от лимфоцитов специальными гематотканевыми барьерами). Они имеют специфические рецепторы - Т-клеточные, с помощью которых взаимодействуют с эпитопом тканевой клетки, и особые рецепторы, представленные поверхностными гликопротеинами, которые выявляются моно-клональными антителами CD8 (от англ. cluster of differentiation по номенклатуре, принятой в иммуноцитохимии рецепторов). Если Т-лимфоциты маркируются моноклональным антителом CD8, то они называются CD8+ Т-лимфоцитами, цитотоксическими, или киллерами. Последние связываются только с молекулой гистосовместимости I класса. В случае обнаружения чужеродного эпитопа происходит молекулярное взаимодействие в области контакта рецепторов, что является сигналом к запуску механизмов разрушения клетки, синтезирующей чужеродный белок. Это проявляется секрецией в межклеточное пространство белков - перфоринов, которые в виде трансмембранных белков встраиваются в плазмолемму чужеродной клетки, формируют поры, которые способствуют набуханию и распаду клетки. Кроме того, цитотоксические лимфоциты способны активизировать своими биологически активными веществами ферменты апопто-за через рецепторы чужеродной клетки. Существуют и другие механизмы цитотоксического действия данной субпопуляции лимфоцитов на мишени. Все это характеризует реакции клеточного иммунитета.
Продукты (антигены) ГКГ I класса есть у всех соматических клеток кроме эритроцитов, нейронов, гистологических элементов трофобласта.
Молекула гистосовместимости II класса состоит из двух трансмембранных белков, между петлями которых располагается фрагмент антигена - эпитоп, или антигенная детерминанта. В отличие от описанного выше процесса возникновения эпитопа в составе молекулы гистосовместимости I класса, во втором случае эпитоп появляется как результат двух процессов:
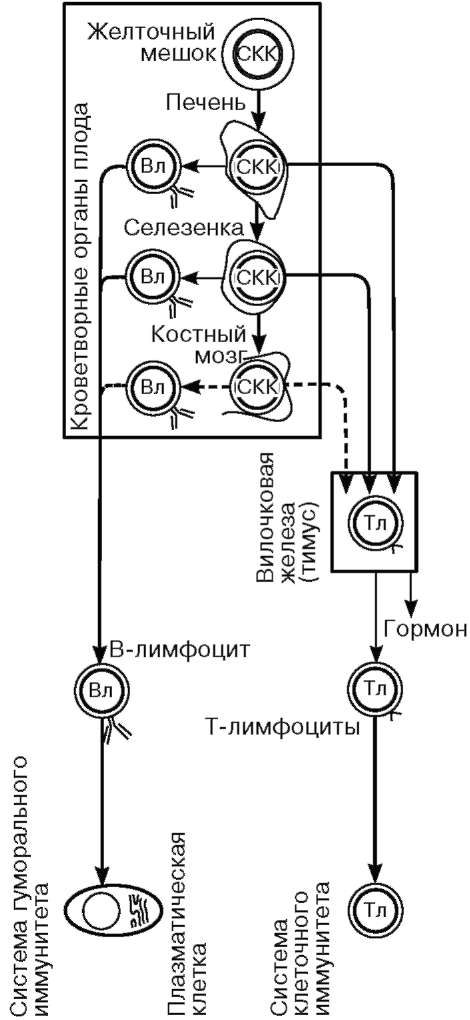
Рис. 14.12. Развитие иммунокомпетент-ных клеток (по М. Куперу и А. Лоутону, с изменениями)
а) фагоцитоза антигена макрофагом (антигенпредставляющей клеткой), внутриклеточного взаимодействия антигена с лизосомами макрофага и возврата фрагмента антигена в виде эпитопа на клеточную поверхность;
б) рецепторно-опосредованного эн-доцитоза В-лимфоцитами растворенного антигена, его модификации и возврата в виде эпитопа на клеточную поверхность.
Следовательно, принципиальные отличия в организации молекулы гистосовместимости II класса заключаются в том, что эпитоп имеет внеклеточное происхождение, а данный класс молекул экспрессирует-ся не на всех клетках - только на антигенпредставляющих клетках (мак рофагах, дендритных клетках, В-лимфоцитах и активированных Т-лимфоцитах). С молекулой II класса могут взаимодействовать лимфоциты, которые имеют на своей поверхности другой - специальный - рецептор класса CD4. К ним относятся CD+4 Т-лимфоциты, или Т-хелперы. Последние вместе с анти-генпредставляющими клетками и В-лимфоцитами отвечают за формирование иммунной реакции, которая проявляется синтезом иммуноглобулинов, или антител, циркулирующих в крови и тканевой жидкости, что составляет суть гуморального иммунитета (см. ниже).
14.7.2. Характеристика иммунокомпетентных клеток
Родоначальник всех клеток иммунной системы - стволовая кроветворная клетка. В эмбриональном периоде эти клетки локализуются в желточном мешке, печени, селезенке. В более поздний период эмбриогенеза они появляются в костном мозге и продолжают пролиферировать в пост-натальной жизни (рис. 14.12). Из СКК в костном мозге образуется клетка-предшественник лимфопоэза (лимфоидная мультипотентная родоначальная
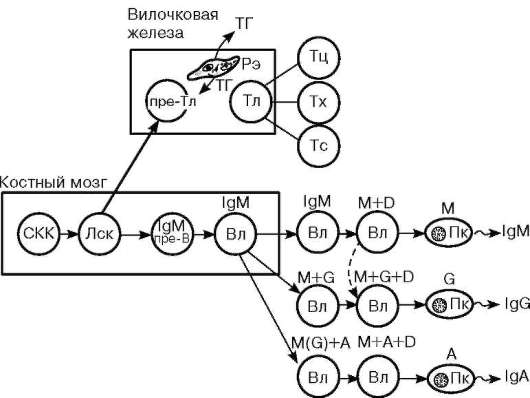
Рис. 14.13. Развитие Т- и В-лимфоцитов (по Р. В. Петрову, с изменениями): СКК - стволовая клетка крови; Лск - лимфоидная стволовая клетка; пре-В - клетка-предшественник В-лимфоцитов с внутриклеточным IgM; Вл - В-лимфоцит с поверхностным IgM; М, G, D, А - поверхностные иммуноглобулины на дифференцирующихся В-лимфоцитах и плазматических клетках; Пк - плазматические клетки; IgM, IgG, IgA - иммуноглобулины, секретируемые плазмоцитами; пре-Тл - клетка-предшественник Т-лимфоцитов; Тл - Т-лимфоциты; ТГ - тими-ческие гормоны; Рэ - ретикулярная эпителиальная клетка; Тц - цитотоксический Т-лимфоцит; Тх - Т-хелпер; Тс - Т-супрессор
клетка), которая генерирует два типа клеток: пре-Т-клетки (предшественники Т-клеток) и пре-В-клетки (предшественники В-клеток) (рис. 14.13).
Согласно клонально-селекционной теории иммунитета, в органах кроветворения формируются многочисленные группы (клоны) лимфоцитов, генетически запрограммированные реагировать на один или несколько антигенов. Поэтому каждый конкретный антиген оказывает избирательное действие, стимулируя только те лимфоциты, которые могут связываться с данным антигеном. При первой встрече с антигеном (первичный ответ) лимфоциты стимулируются и подвергаются трансформации в бласт-ные формы, которые способны к пролиферации и дифференцировке в иммуноциты (бласттрансформация лимфоцитов - явление, впервые описанное А. А. Максимовым). В лимфоците хроматин ядра становится менее плотным, появляется ядрышко, увеличивается объем цитоплазмы, начинается синтез новых РНК и белков. Так возникают лимфобласты, которые делятся 2-4 раза в сутки в течение 3-5 сут. Из одной клетки возникают до 1000 дочерних клеток той же специфичности. Для развития специфического иммунитета требуется от 4 до 7 сут. В результате бласттрансформа-ции Т-лимфоцитов появляются: 1) Т-клетки-киллеры (цитотоксические) - основные эффекторные клетки иммунитета, они разрушают чужеродные
клетки-мишени и обеспечивают генетическое постоянство внутренней среды организма, защищая его от вторжения чужеродных клеток, новообразований, аутоиммунных заболеваний; 2) Т-клетки-хелперы, участвующие в процессах межклеточной кооперации с В-лимфоцитами, без чего невозможна трансформация В-лимфоцитов в плазмоциты; 3) Т-клетки-супрессоры, блокирующие антителообразование В-лимфоцитами при аутоиммунных реакциях; 4) клетки памяти - это лимфоциты, возвращающиеся в неактивное состояние, но несущие информацию (память) о встрече с конкретным антигеном. При повторном введении данного антигена они способны обеспечивать быстрый иммунный ответ большей интенсивности (вторичный ответ) вследствие усиленной пролиферации лимфоцитов и образования иммуноцитов. Эффекторные клетки имеют ограниченный срок жизни, и, когда антиген удален, большинство клеток подвергается апоптозу.
Естественные киллерные клетки
Среди лимфоцитов в крови, кроме Т-киллеров, имеются NK-клетки. Это большие лимфоциты диаметром 12-15 мкм, имеют дольчатое ядро и азурофильные гранулы (лизосомы) в цитоплазме. Клетки содержат гранулы с перфорином и гранзимами и убивают клетки-мишени сходным с Т-киллерами образом. Они распознают и уничтожают клетки, которые в данный момент не экспрессируют или содержат измененные молекулы ГКГ I. Мишенями для них являются зараженные вирусами, стареющие и опухолевые клетки, а также ткани трансплантата. Эти клетки образуют первую линию защиты против чужеродных клеток, действуют немедленно, быстро разрушая клетки. Т-киллеры образуют вторую линию защиты, так как для их развития из неактивных Т-лимфоцитов требуется время, поэтому они вступают в действие позже NK.
Различают антигеннезависимую и антигензависимую дифференцировку и специализацию В- и Т-лимфоцитов.
Антигеннезависимая пролиферация и дифференцировка генетически запрограммированы на образование клеток, способных давать специфический тип иммунного ответа при встрече с конкретным антигеном благодаря появлению на плазмолемме лимфоцитов особых «рецепторов». Она совершается в центральных органах иммунитета (тимус, костный мозг или фабрициева сумка у птиц) под влиянием специфических факторов, вырабатываемых клетками, формирующими микроокружение (ретикулярная строма или эпителиальные клетки в тимусе). В этом случае развитие завершается образованием клеток, готовых к распознаванию антигенов, но еще не встречавшихся с ними. Такие лимфоциты называют «наивными».
Антигензависимая пролиферация и дифференцировка Т- и В-лимфоцитов происходят при встрече с антигенами в периферических лимфоидных органах, при этом образуются эффекторные клетки и клетки памяти.
Образующиеся Т-лимфоциты составляют пул долгоживущих, рецирку-лирующих лимфоцитов, а В-лимфоциты - короткоживущих клеток.
Взаимодействия клеток в гуморальном иммунном ответе. Гуморальный иммунный ответ обеспечивают макрофаги (антигенпрезентирующие клетки), Т-хелперы и В-лимфоциты.
Попавший в организм антиген поглощается макрофагом. Макрофаг расщепляет его на фрагменты, которые в комплексе с молекулами ГКГ класса II появляются на поверхности клетки. Такая обработка антигена макрофагом называется процессированием антигена.
Для дальнейшего развития иммунного ответа на антиген необходимо участие Т-хелпера (Тх), но прежде Тх должны быть активированы сами. Эта активация происходит тогда, когда антиген, обработанный макрофагом, распознается Тх. «Узнавание» Тх-клеткой комплекса «антиген + молекула ГКС II класса» на поверхности макрофага (т. е. специфичное взаимодействие рецептора этого Т-лимфоцита со своим лигандом) стимулирует секрецию интерлейкина-1 (ИЛ-1) макрофагом. Под воздействием ИЛ-1 активизируются синтез и секреция ИЛ-2 Тх-клеткой. Выделение Тх-клеткой ИЛ-2 стимулирует ее пролиферацию. Такой процесс может быть расценен как аутокринная стимуляция, так как клетка реагирует на тот агент, который сама синтезирует и секрети-рует. Увеличение численности Тх необходимо для реализации оптимального иммунного ответа. Тх активируют В-клетки путем секреции ИЛ-2.
Активация В-лимфоцита происходит также при прямом взаимодействии антигена с иммуноглобулиновым рецептором В-клетки (рис. 14.14). В-лимфоцит сам процессирует антиген и представляет его фрагмент в комплексе с молекулой ГКС II класса на клеточной поверхности. Этот комплекс узнает уже задействованный в иммунной реакции Тх.
Узнавание рецептором Тх-клетки комплекса антиген-молекула ГКГ II класса на поверхности В-лимфоцита приводит к секреции Тх-клеткой интерлейкинов - ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, γ-интерферона (γ-ИФН), под действием которых В-клетка размножается и дифференцируется с образованием плазматических клеток и В-клеток памяти. Так, ИЛ-4 инициирует активацию В-клетки, ИЛ-5 стимулирует пролиферацию активированных В-клеток, ИЛ-6 вызывает созревание активированных В-клеток и превращение их в плазматические клетки, секретирующие антитела. Интерферон привлекает и активирует макрофаги, которые начинают более активно фагоцитировать и разрушать внедрившиеся микроорганизмы.
Передача большого количества переработанных макрофагом антигенов обеспечивает пролиферацию и дифференцировку В-лимфоцитов в направлении образования плазматических клеток, вырабатывающих специфические антитела на конкретный вид антигена.
Т-супрессоры (Тс) подавляют способность лимфоцитов участвовать в выработке антител и таким образом обеспечивают иммунную толерантность, т. е. нечувствительность к определенным антигенам. Они регулируют количество образующихся плазматических клеток и количество антител, синтезируемых этими клетками. Оказалось, что тормозить выработку антител может и особая субпопуляция В-лимфоцитов, которые получили название В-супрессоров. Показано, что Т- и В-супрессоры могут действовать подавляюще также на реакции клеточного иммунитета.

Рис. 14.14. В-лимфоциты:
а - В-лимфоциты мыши с меченными 125I антителами (стрелки) против иммуноглобулинов кролика (по Унанье); б - В-лимфоциты человека с иммуноглобулинами на поверхности плазмолеммы (стрелки), выявленные с помощью антисыворотки человека, меченной пероксидазой, увеличение 3000 (препарат В. П. Слюсарчука)
Дифференцировка клеток плазматического ряда
Этот процесс проходит в несколько этапов и продолжается в течение 1 сут. Из стимулированных В-лимфоцитов образуются В-лимфобласты, которые размножаются, часть из них приобретают способность к синтезу
Рис. 14.15. Дифференцировка плазмоцитов (по Вайсу):
1 - предшественник плазмоцита; 2 - плазмобласт; 3 - юный плазмоцит; 4 - плаз-моцит с расширенными цистернами эндоплазматической сети, содержащими иммуноглобулины (тельце Русселя); 5 - зрелый плазмоцит
антител и становятся плазмобластами, превращающимися в последующем в проплазмоциты и плазмоциты (рис. 14.15).
Плазмобласт (plasmoblastus) - крупная клетка, характеризуется наличием большого количества рибосом и небольшим числом уплощенных цистерн гранулярной эндоплазматической сети. Ядро содержит деконденсирован-ный хроматин (эухроматин) и одно-два больших ядрышка.
Проплазмоцит характеризуется меньшим размером, увеличением количества концентрически расположенных узких канальцев гранулярной эндо-плазматической сети. Ядро лежит эксцентрично, хроматин более компактный, зерна хроматина расположены группами около ядерной оболочки (имеет вид спиц колеса). Около ядра видна зона более светлой цитоплазмы, в которой расположен увеличенный комплекс Гольджи.
Плазмоцит (plasmocytus) характеризуется появлением большого количества расширенных цистерн гранулярной эндоплазматической сети, запол-
Рис. 14.16. Плазмоциты лимфатического узла кишечника после антигенной стимуляции. Иммуноцитохимическая реакция на иммуноглобулины. Электронная микрофотография, увеличение 6000 (препарат В. А. Шахламова): 1 - плазмоциты на различных стадиях синтеза иммуноглобулинов; 2 - осмиофиль-ный продукт реакции, маркирующий локализацию иммуноглобулинов в цистернах гранулярной эндоплазматической сети
ненных продуцируемыми клеткой иммуноглобулинами. Ядро компактное, расположенное эксцентрично.
Процесс плазмоцитогенеза сопровождается потерей способности клеток к делению и движению и уменьшением количества поверхностных иммуноглобулинов в плазмолемме. Продолжительность жизни плазмоцитов составляет несколько недель. Лимфобласты и незрелые плазматические клетки из лимфатических узлов, где они образуются, способны проникать в выносящие лимфатические сосуды и заселять соседние лимфатические узлы. Часть образованных из них мелких клеток, напоминающих по виду лимфоциты, проникают в кровеносные сосуды. Они имеют центрально расположенное ядро, окруженное узким ободком цитоплазмы, в которой видна хорошо развитая гранулярная эндоплазматическая сеть. Эти клетки получили название лимфоплазмоцитов.
Синтез иммуноглобулинов (антител) происходит при участии информационной РНК на рибосомах гранулярной эндоплазматической сети В-лимфоцитов и образуемых из них плазмоцитов. Синтезированные молекулы поступают в просвет цистерн. В В-лимфоцитах первые антитела выявляются в перинуклеарных цистернах. В процессе дальнейшей дифферен-цировки плазмоцитов антитела находятся во всех цистернах гранулярной эндоплазматической сети (рис. 14.16).
В зрелых плазмоцитах антитела в перинуклеарных пространствах отсутствуют и исчезают из некоторых цистерн гранулярной эндоплазматической сети. К полипептидным частям тяжелых цепей антител присоединяют-
ся углеводы (N-ацетил-гликозамин), и этот комплекс транспортируется в комплекс Гольджи, где и происходит присоединение дополнительных углеводов (галактоза). Из комплекса Гольджи антитела переносятся на поверхность клетки и выделяются. Наиболее раннее выделение антител на месте действия антигена осуществляется лимфоцитами. Плазмоциты начинают секретировать антитела несколько позднее, но в гораздо большем количестве. Один плазмоцит может продуцировать 3000 молекул антител в сутки. Часть иммуноглобулинов может депонироваться в растянутых цистернах гранулярной эндоплазматической сети.
Макрофаги
Макрофаги играют важную роль как в естественном, так и в приобретенном иммунитете организма. Участие макрофагов в естественном иммунитете выражается в их способности к фагоцитозу и в синтезе ряда активных веществ - пищеварительных ферментов, компонентов системы комплемента, фагоци-тина, лизоцима, интерферона, эндогенного пирогена и другие, являющихся основными факторами естественного иммунитета. Их роль в приобретенном иммунитете заключается в передаче антигена иммунокомпетентным клеткам (Ти В-лимфоцитам), в индукции специфического ответа на антигены. На мембране они несут молекулы ГКГ I и II классов. Распад поглощенных антигенов идет до пептидов. Пептиды объединяются с молекулами ГКГ II, выводятся на плазмолемму, где могут находиться длительное время. Расщепление фагоцитированного антигена до пептидов и появление их в комплексе с молекулами ГКГ на поверхности называется процессированием антигена. Такие комплексы представляются макрофагами Т-лимфоцитам.
Для оптимального развития иммунных реакций при действии большинства антигенов необходимо участие макрофагов как в первой индуктивной фазе иммунитета, когда они стимулируют лимфоциты, так и в его конечной фазе (продуктивной), когда они участвуют в выработке антител и разрушении антигена. Антигены, фагоцитированные макрофагами, вызывают более сильный иммунный ответ по сравнению с теми, которые не фагоцитированы ими. Блокада макрофагов введением в организм животных взвеси инертных частиц (например, туши) значительно ослабляет иммунный ответ. Макрофаги способны фагоцитировать как растворимые (например, белки), так и корпускулярные антигены. Корпускулярные антигены вызывают более сильный иммунный ответ.
Некоторые виды антигенов, например пневмококки, содержащие на поверхности углеводный компонент, могут быть фагоцитированы после предварительной опсонизации. Фагоцитоз значительно облегчается, если антигенные детерминанты чужеродных клеток опсонизированы, т. е. соединены с антителом или комплексом антитела и комплемента. Процесс опсонизации обеспечивается присутствием на плазмолемме макрофага рецепторов, которые связывают часть молекулы антитела (Fc-фрагмент) или часть комплемента. С плазмолеммой макрофага у человека непосредственно могут связываться только антитела класса IgG, когда они находятся в комбинации с соответствующим антигеном. IgM могут связываться с плазмо-
леммой макрофага в присутствии комплемента. Макрофаги способны «распознавать» растворимые антигены, например гемоглобин.
В коже, слизистых оболочках, В-зонах лимфатических узлов и селезенки имеются специализированные макрофаги организма (дендритные клетки), на поверхности многочисленных отростков которых сохраняются антигены, попадающие в организм и передающиеся соответствующим клонам В-лимфоцитов. В Т-зонах лимфоидных фолликулов расположены интерди-гитирующие клетки, влияющие на дифференцировку клонов Т-лимфоцитов. Дендритные клетки имеют длинные ветвящиеся отростки, проникающие между другими клетками, и имеют большую площадь поверхности, на которой могут удерживать антигены в течение нескольких лет. В отличие от макрофагов, их способность к фагоцитозу более слабая.
Одной из разновидностей дендритных клеток являются клетки Лангерганса кожи (внутриэпидермальные макрофаги) и слизистых оболочек. Током лимфы они переносятся в тимусзависимые (паракортикальные) зоны лимфатических узлов, а также в кортикомедуллярную зону тимуса. Здесь они оседают и называются интердигитирующими клетками.
Интерстициальные дендритные клетки обнаружены в большинстве органов (сердце, легких, печени, почках, пищеварительном тракте). При пересадках органов тканевые дендритные клетки мигрируют из трансплантата в регионарные лимфатические узлы и запускают реакцию отторжения трансплантата. Они могут циркулировать в крови, составляя 0,1 % лейкоцитов крови. Дендритные клетки, находящиеся в коже, слизистых оболочках и маргинальных зонах белой пульпы селезенки, относят к незрелым. Мигрируя в участки повреждения тканей, опухолевого роста или попадания микробов, они поглощают антигены и начинают созревать. Зрелые клетки мигрируют в Т-клеточные зоны лимфатических узлов или белой пульпы селезенки, становясь антигенпредставляющими дендритными клетками, активирующими Т-лимфоциты. Дендритные клетки костномозгового происхождения подразделяются на миелоидные и лимфоидные клетки. К миелоидным относят дендритные клетки, располагающиеся в коже, слизистых оболочках и в интерстиции органов. Лимфоидные дендритные клетки обнаружены в лимфатических узлах, селезенке и тимусе. В тимусе они отвечают за выбраковку Т-лимфоцитов, агрессивных к собственным антигенам (отрицательную селекцию).
В лимфоидных узелках лимфатических узлов, селезенки и лимфоидной ткани слизистых оболочек располагаются особые фолликулярные дендритные клетки (ФДК). На плазмолемме они несут множество рецепторов антител и комплемент и, в отличие от других дендритных клеток, не имеют молекул ГКГ II класса. ФДК специализируются на связывании и накоплении на плазмолемме комплексов антиген-антитело и представлении антигенов В-лимфоцитам. Они могут выделять цитокины, стимулирующие пролиферацию лимфоцитов. Эти клетки не мигрируют из мест своего расположения и, соединяясь отростками, образуют стабильную сеть.
Таким образом, макрофаги и их разновидности принимают непосредственное активное участие в кооперативном взаимодействии клеток (Т- и В-лимфоцитов) в иммунных реакциях организма (рис. 14.17, а, б).
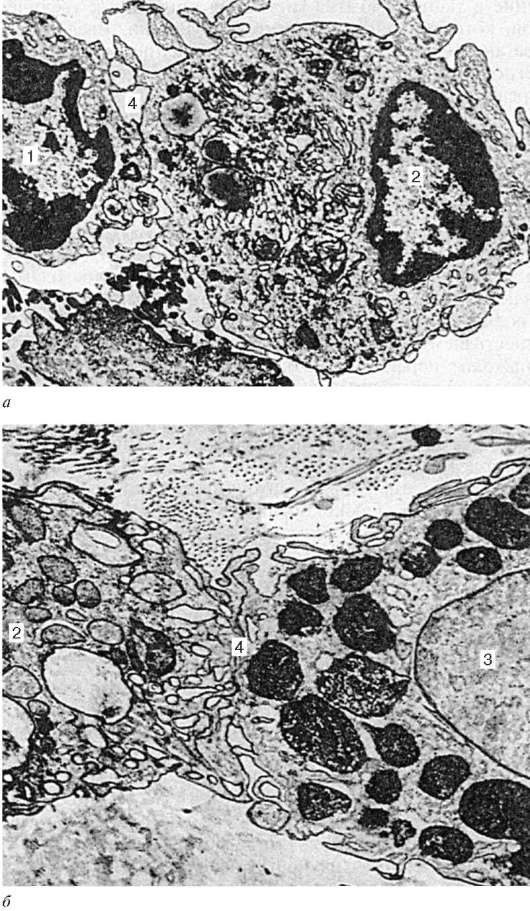
Рис. 14.17. Взаимодействие клеток при развитии иммунных реакций. Электронные микрофотографии (препараты А. И. Радостиной):
а - кооперация лимфоцита с макрофагом, увеличение 6000; б - взаимодействие макрофага с тучной клеткой, увеличение 20 000. 1 - лимфоцит; 2 - макрофаг; 3 - тучная клетка; 4 - межклеточные контакты
Участие тучных клеток и эозинофилов в иммунных реакциях
При первичном и особенно при повторном введении антигенов наблюдаются увеличение числа тучных клеток, их контакт с макрофагами и массовая дегрануляция. Высказывается предположение, что дегрануляция обусловлена соединением антигена с антителами (IgE), фиксированными на плазмолемме. При этом выделяются содержащиеся в гранулах биологически активные вещества (гистамин, серотонин, гепарин), которые могут оказывать неспецифическое стимулирующее влияние на процессы пролиферации и дифференцировки иммунокомпетентных клеток Т- и В-лимфоцитов.
Появление в тканях избытка гистамина приводит к увеличению числа эозинофилов, которые участвуют в его разрушении. Введение в организм большинства антигенов сопровождается увеличением числа эозинофилов в тканях и регионарных лимфатических узлах. В ранней (индуктивной) фазе иммунной реакции, когда происходит «распознавание антигена», эозино-филы, как и тучные клетки, принимают участие в активизации макрофагов (см. рис. 14.17, б). В продуктивной фазе иммунитета (выработка антител) эозинофилы выполняют дезинтоксикационную функцию, участвуя в фагоцитозе и разрушении комплекса антиген-антитело.
Механизмы интеграции элементов иммунной системы
Иммунная система функционирует как единое целое благодаря наличию центральных нейрогуморальных и местных факторов, регулирующих процессы пролиферации и дифференцировки клеток, упорядоченную миграцию, осуществляемую через кровь и лимфу (рис. 14.18). В эмбриональном периоде происходит переключение кроветворения из желточного мешка в печень и далее в костный мозг. У взрослых основным поставщиком стволовых гемопоэтических клеток становится костный мозг, при этом в кровь мигрирует за 1 сут около 2 % всех стволовых клеток костного мозга. При действии антигенов их число увеличивается в десятки раз. Предполагают, что процесс миграции стволовых гемопоэтических клеток из костного мозга и их рециркуляция находятся под контролем гормонов гипофиза и надпочечников. Глюкокортикоидные гормоны коры надпочечников препятствуют избыточной миграции стволовых гемопоэтических клеток и тем самым предохраняют их от «перерасходования».
Циркуляция лимфоцитов зависит также от специфических взаимодействий между поверхностью лимфоцита и поверхностью специализированных эндотелиальных клеток, выстилающих посткапиллярные венулы с высоким эндотелием - HEV (hight endothelial venulae) во вторичных лим-фоидных органах: лимфоциты временно прикрепляются к ним, а затем мигрируют через посткапиллярные венулы (рис. 14.19). Моноклональные антитела, связываясь с поверхностью лимфоцитов и подавляя их способность присоединяться к специализированным эндотелиальным клеткам в срезах тканей, а также циркулировать in vivo, помогают определить различные «homing-рецепторы» на эндотелиоцитах, от которых зависят пути миграции лимфоцитов.
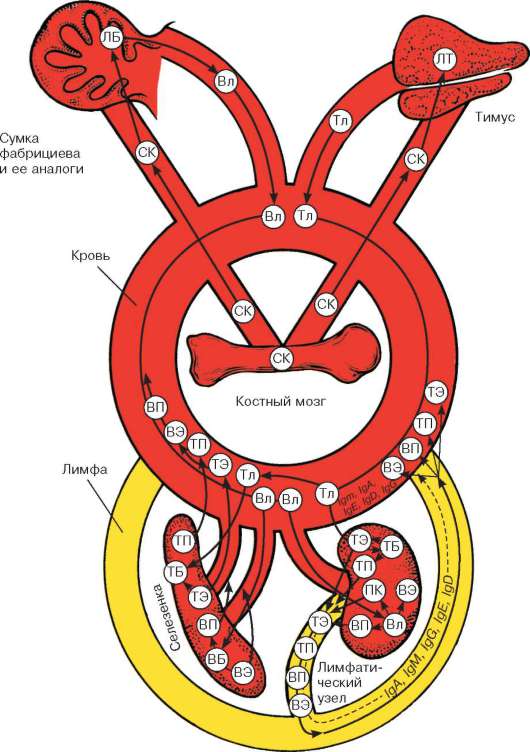
Рис. 14.18. Миграция и рециркуляция клеток в иммунной системе (схема): СК - стволовая клетка крови; JIT - лимфоцит тимуса; Тл - Т-лимфоцит; ЛБ - лимфоцит бурсы; Вл - В-лимфоцит; ВБ - В-бласт; ТБ - Т-бласт; ВП - В-лимфоциты памяти; ТП - Т-лимфоциты памяти; ТЭ, ВЭ - эффекторные Т- и В-лимфоциты; ПК - плазматическая клетка; IgA, IgG, IgM, IgE, IgD - иммуноглобулины
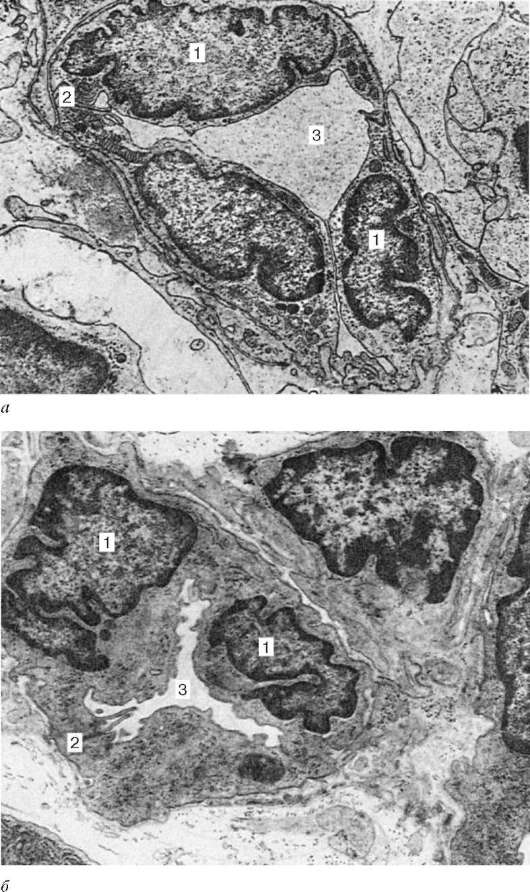
Рис. 14.19. Посткапиллярные венулы с высоким эндотелием (HEV). Электронные микрофотографии:
а, б - интактный лимфатический узел, увеличение 16 000 (препараты Т. И. Лебедевой); в - лимфатический узел после антигенной стимуляции (препарат А. С. Головацкого). 1 - эндотелиоциты; 2 - межклеточные контакты эндотелиоцитов; 3 - просвет венулы; 4 - лимфоцит, проходящий через эндотелиоцит
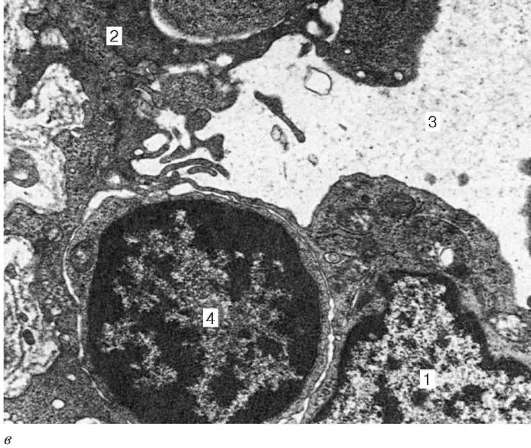
Рис. 14.19. Продолжение (обозначение см. «а», «б»)
Различают два типа миграции клеток иммунной системы: медленный и быстрый. Продолжительность медленной миграции измеряется неделями. Медленный тип миграции характерен для стволовых клеток и Т- и В-лимфоцитов, заселяющих периферические лимфоидные органы. Быстрый тип миграции (несколько часов) характерен для постоянно рециркулирую-щих долгоживущих лимфоцитов памяти. Они мигрируют из крови в периферические лимфоидные органы и из них обратно в кровь. Популяция быстро рециркулирующих лимфоцитов содержит главным образом Т-лимфоциты. Большинство медленно мигрирующих клеток относятся к В-клеткам. При остром иммунном ответе происходит миграция предшественников эффек-торных цитотоксических лимфоцитов и плазмоцитов через кровь и лимфу во все отделы иммунной системы и соединительную ткань, где обеспечиваются условия для иммунного ответа. Число рециркулирующих лимфоцитов в крови человека составляет около 1010.
Рециркулирующие лимфоциты представляют собой основную часть популяции малых лимфоцитов, большинство из которых являются долгоживу-щими Т-лимфоцитами; меньшее число составляют В-лимфоциты.
Рециркулирующие лимфоциты имеют оптимальную возможность встречи с любой чужеродной мишенью, которую они сами непосредственно уничтожают, вырабатывая антитела.
Лимфоциты при помощи рецепторов осуществляют «проверку» всех тканей организма, выявляя чужеродный материал. При попадании анти-
гена в периферические лимфоидные органы в зонах его расположения концентрируются Т-лимфоциты. В этих же зонах несколько позднее появляются В-лимфоциты. Происходит взаимодействие макрофагов, Ти В-лимфоцитов и кооперативное распознавание антигена, приводящее к дифференцировке из В-лимфоцитов клеток памяти и плазматических клеток, продуцирующих антитела.
Лимфоциты памяти живут в течение 20 лет и более. Приобретенное свойство памяти лимфоцитов наследуется.
Таким образом, процессы миграции и рециркуляции клеток иммунной системы обеспечивают поддержание генетической индивидуальности организма.
Контрольные вопросы
1. Источники развития, строение красного костного мозга. Характеристика костномозгового кроветворения, роль стромы в регуляции кроветворения.
2. Этапы эмбрионального кроветворения.
3. Тимус: развитие, строение, функции, роль в становлении иммунитета в детском возрасте.
4. Органы периферического лимфоидного комплекса, развитие, строение, характеристика Т- и В-зон в процессе антигензависимой пролиферации и дифференцировки лимфоцитов.
5. Перечислите иммунокомпетентные клетки, которые участвуют в распознавании антигенов.