Военно-полевая хирургия.: учебник/Под ред. Е.К. Гуманенко.- 2-е издание. - 2008. - 768 с. : ил.
|
|
|
|
ГЛАВА 11 ИНФЕКЦИОННЫЕ ОСЛОЖНЕНИЯ БОЕВЫХ ХИРУРГИЧЕСКИХ ТРАВМ
Инфекционные осложнения (ИО) у раненых развиваются в 5-6 раз чаще, чем у больных с хирургической патологией. У 80% раненых, умерших в поздние сроки после боевой травмы, они являются причиной смерти.
Археологические находки свидетельствуют, что еще доисторический человек лечил раны и их осложнения, полученные на охоте и во время боевых столкновений. Фактически же наука о заживлении ран начинается с Гиппократа (460-370 гг. до н. э.), который описал клинику флегмон и абсцессов и выдвинул основной принцип их лечения - «ubi pus ibi evacua». К сожалению, и в настоящее время хирургическое лечение гнойных осложнений ран часто исчерпывается только этим мероприятием. На протяжении последующих веков в науке о лечении ран многократно происходила смена ведущей роли консервативных методов (прижигание каленым железом и кипящим маслом, использование различных мазей) и активного хирургического лечения (рассечение и иссечение ран, дренирование, наложение швов).
Существенное влияние на тактику лечения раневой инфекции оказали предположения Н.И. Пирогова о «госпитальных миазмах» (
Полную несостоятельность консервативного лечения огнестрельных ран и их осложнений показал опыт Русско-турецкой войны 1877-1878 гг. (К.К. Рейер, Н.В. Склифосовский, Э. Бергман, С.П. Коломнин) и Русско-японской войны 1904-1905 гг. (Р. Р. В р е д е н , В . Б . Г ю б б е н е т ), а затем первой мировой войны 1914-1918 гг. (Н.А. Вельяминов, В.А. Оппель, Н.Н. Петров и др.). Признание необходимости активного хирургического
лечения представляло собой коренной переворот в учении о ране и раневой инфекции. Тщательная хирургическая обработка раны и последующее местное применение антисептиков стало стандартом лечения огнестрельных ран (Н.Н. Петров, П. Фридрих, Ж. Брэн, А. Годье, А. Каррель). Во время второй мировой войны были окончательно определены такие понятия, как первичная и вторичная хирургическая обработка ран (ПХО и ВХО), уточнены их характер, техника и объем (С.С. Гирголав, П.А. Куприянов, С.С. Юдин).
В 1940-е гг. закончилась доантибиотическая эра в медицине. С появлением антибиотиков связывались большие надежды на хорошие исходы огнестрельных ранений. В армии США во время войны во Вьетнаме 1964-1973 гг., благодаря широкому применению ПХО вместе с профилактическим и лечебным использованием антибиотиков, удалось снизить уровень ИО ран до 3-5% (Р. Хардавэй). Однако уже в 1960-е гг. результаты лечения раневой инфекции методами, основанными на этиотропном подходе, ухудшились. Появились госпитальные штаммы микроорганизмов, способные быстро вырабатывать устойчивость к антибиотикам. Это послужило стимулом для дальнейшего изучения этиологии и патогенеза раневой инфекции. Стало ясно, что различные формы хирургической инфекции часто вызываются одинаковыми или близкими по составу ассоциациями условно-патогенных возбудителей. Было установлено определяющее значение патогенетических факторов повреждения в возникновении раневой инфекции. Новые алгоритмы диагностики и лечения завершили формирование современной концепции возникновения и развития хирургической инфекции. Ее создание связано с такими именами, как И.В. Давыдовский (аллергическая теория сепсиса), А.Н. Беркутов, А.П. Колесов (лечение анаэробной инфекции), И.И. Дерябин, И.А. Ерюхин, Е.К. Гуманенко (концепция ТБ), Е. Фрай, В.Г. Бочоришвили, В.А. Гологорский (ПОН при сепсисе), И.А. Ерюхин и В. Ертель (хирургический эндотоксикоз и цитоки-новая концепция сепсиса). Появилась концепция «системного воспалительного ответа» (СВО), позволившая систематизировать представления о генерализованных ИО в хирургии (Р. Е . Б о у н ).
11.1. ТЕРМИНОЛОГИЯ, СОВРЕМЕННАЯ КОНЦЕПЦИЯ
ПАТОГЕНЕЗА, КЛАССИФИКАЦИЯ ИНФЕКЦИОННЫХ
ОСЛОЖНЕНИЙ РАНЕНИЙ И ТРАВМ
Общепринятые представления об ИО ранений и травм связаны с такими основными понятиями, как инфекционный процесс, нагноение раны и раневая инфекция.
Инфекционным процессом называется антагонистическое взаимодействие микроорганизмов и макроорганизма, характеризующееся динамически развивающимися патологическими, защитно-приспособительными и компенсаторными реакциями макроорганизма в ответ на проявление патогенных свойств микробов.
При любом повреждении и внедрении микробов в рану (контаминацию) запускается комплекс реакций воспаления, направленных на восстановление антигенного постоянства организма и функций пограничных тканей. Эти реакции осуществляются как системами неспецифической резистентности, одинаково отвечающими на антиген любой природы (фагоцитоз, система комплемента, лизо-цим), так и иммунной системой, формирующей специфический, обусловленный конкретным антигеном, ответ. При ранениях и травмах источником антигенов являются возбудители раневой инфекции и продукты их жизнедеятельности, а также продукты распада собственных тканей - аутоантигены.
Нагноение раны - инфекционный процесс в зонах первичного и вторичного некроза, обеспечивающий удаление некротизированных тканей, формирование защитного барьера на пути возбудителей («лейкоцитарный вал») и подготовку раны к заживлению.
Очищение раны происходит за счет «расплавления» погибших тканей с образованием гноя в результате фагоцитоза экзо- и эндогенных антигенов (поврежденные клетки организма и раневая микрофлора). С позиции биологии, нагноение - это этап заживления раны, «физиологический инструмент», помогающий отграничить поврежденные травмой и патогенными микробами ткани от внутренной среды и обеспечить антигенное постоянство организма. Этот процесс предполагает наличие 2 условий: 1 - способность организма раненого сформировать защитный барьер на границе живых и мертвых тканей,
2 - возможность свободного оттока из раны образующегося гноя. При отсутствии этих условий гной скапливается в замкнутом пространстве и начинает инфильтрировать стенки раневой полости, то есть инфекционный процесс выходит за пределы мертвых тканей. Развивается раневая инфекция.
Раневая инфекция - инфекционный процесс, развивающийся в живых тканях, окружающих рану, под воздействием микробов, проникших в нее в момент ранения или спустя некоторое время, и сопровождающийся повреждением и гибелью клеточных структур с формированием новых очагов некроза и клинически выраженной общей реакцией организма.
В отличие от нагноения как естественного этапа заживления, раневая инфекция является нозологической формой инфекционного процесса. Ей присущи характерные местные и общие симптомы, отражающие развитие нового патологического состояния.
Термин «раневая инфекция» в настоящее время используется как синоним местных форм ИО ранений и травм. В целом же понятие «ИО ранений и травм» охватывает 3 варианта инфекционного процесса, сопровождающегося повреждением организма на различных его уровнях:
• клеточный и тканевой(первичные очаги повреждения);
• органно-системный (органы и системы на дистанции от первичного очага);
• организменный (генерализованные формы инфекции, поражающие организм в целом). Микробиологическая характеристика ИО ранений и травм. Травма, шок и последующее лечение раненого сопровождаются взаимодействием макроорганизма с разными формами микробиоты: случайной, эндогенной и госпитальной. В очаг травматического повреждения тканей попадают случайные («уличные») микроорганизмы. Травматический шок с централизацией кровообращения, нарушением микроциркуляции и ишемией органов в зоне спланхнического бассейна приводит к появлению в лимфе грудного протока, портальной крови, а затем и в системном кровотоке эндогенных микроорганизмов. Это один из вариантов развития генерализованных септических осложнений, в частности, так называемого «кишечного» сепсиса. Длительное пребывание пациентов в отделении интенсивной терапии, использование инвазивных методов диагностики, мониторирования и лечения приводят к появлению в организме раненого третьего инфекционного компонента - госпитальных возбудителей.
Возбудителями (случайными, эндогенными, госпитальными) ИО являются условно-патогенные аэробные или анаэробные микроорганизмы, постоянно сосуществующие с организмом человека. Наиболее часто выделяются стафилококки, стрептококки, энтерококки, кишечная палочка, протей, клебсиеллы, синегнойная палочка, клостридии, бактероиды, фузобактерии.
До 90% возбудителей раневой инфекции - эндогенного происхождения. Госпитальные микробы полирезистентны к антибактериальным препаратам. Отличительной особенностью раневых инфекций является их полимикробный характер.
Современная концепция возникновения и развития хирургической инфекции, определяющая алгоритмы профилактики, диагностики и лечения ИО ранений и травм, лежит в основе систематизации различных клинико-морфологических форм этой инфекционной патологии. Классификация ИО, разработанная на кафедре военно-полевой хирургии ВМедА им. С.М. Кирова, основана на патофизиологических представлениях о стадийности развития СВО организма на любое экстраординарное воздействие и обширном опыте клиники по диагностике и лечению хирургической инфекции у наиболее тяжелого контингента раненых и пострадавших.
Концепция этиопатогенеза хирургической инфекции и классификация ИО одновременно являются составной частью концепции травматической болезни.
СВО на повреждение и/или контаминацию - это сложный стадийный патофизиологический процесс, необходимый для сохранения антигенного постоянства организма. СВО обеспечивается механизмами неспецифической резистентности и сопровождается активацией т.н. «цитокиновой сети» - комплекса функционально связанных иммунокомпетентных клеток (система фагоцитов, полиморфно-ядерные лейкоциты, лимфоциты, тромбоциты, эндотелио-циты, другие клетки) и выделяемых ими цитокинов.
Авторы концепции СВО (Р.Е. Боун и соавт., 1992) выделяют 3 стадии этого типового патофизиологического процесса.
В первой стадии при развитии ответа на антиген (микробные и аутоантигены) в реакцию прежде всего вовлекаются клеточные факторы неспецифической резистентности - макрофаги. Эти клетки продуцируют цитокины с функцией медиаторов доиммунного воспаления - фактор некроза опухолей TNFα, интерлейкины IL-1, IL-6 и осуществляют отграничение очага острого местного воспаления
от внутренних сред организма. На данной стадии организм стремится к очищению раны и в конечном итоге репарации тканей в зоне ранения.
Во второй стадии малые количества цитокинов выбрасываются в системный кровоток. Это приводит к повышению местной резистентности за счет привлечения в очаг циркулирующих гранулоцитов (микрофаги), лимфоцитов и тромбоцитов. Одновременно на этой стадии обычно активируется региональный адаптивный иммунитет за счет мобилизации зрелых клеточных элементов и эффекторных молекул региональных лимфоидных образований. Затем инициируется острофазовая реакция. Уровень и активность провоспали-тельных цитокинов тонко контролируется в этой стадии выработкой противовоспалительных цитокинов. II cтадия СВО продолжается до заживления ран, разрешения местного инфекционного процесса и восстановления гомеостаза.
При чрезмерном воздействии на организм (обширное разрушение тканей, массивная кровопотеря, травматический шок, экзо- и эндогенная токсинемия) СВО последовательно переходит в третью стадию, на протяжении которой системно активируются провоспалительные цито-кины. Развивается так называемый цитокиновый «пожар» («взрыв»). Эта фаза клинически проявляется как сепсис с множественными органными и системными дисфункциями или как септический шок.
На рис. 11.1 представлены патофизиологические взаимоотношения стадий СВО и вариантов иммунного ответа на повреждение, этиологии и структуры полиорганной недостаточности (ПОН) с периодами травматической болезни.
Начальная стадия СВО (стадия локальной продукции цитокинов) клинически проявляется классической пентадой острого местного воспаления - «dolor, tumor, rubor, calor, functio laesa» - и может быть обозначена как «доиммунное воспаление» (первая стадия иммунного ответа). Целесообразность включения организмом механизмов врожденного иммунитета обусловлена необходимостью отграничить очаг повреждения и/или инфекции от внутренней среды. Это обеспечивается сторожевой полисистемой плазмы крови и первичным фагоцитозом.
На протяжении следующей - второй стадии СВО (стадия выброса цитокинов в системный кровоток) - процессы генерализации воспаления сбалансированы, эта стадия одновременно является «преим-мунным ответом» (вторая стадия иммунного ответа) и представляет
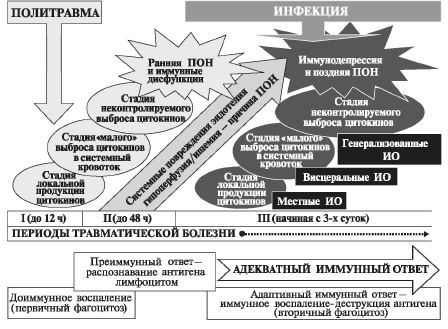
Рис. 11.1. Соотношение стадий СВО, иммунного ответа на повреждение, ранней и поздней ПОН, инфекционных осложнений в динамике ТБ
собой необходимую ступень для формирования адекватного адаптивного иммунитета (третья стадия иммунного ответа).
Такая последовательность событий соответствует теории общей адаптации и современной концепции травматической болезни. «Доим-мунное воспаление», обеспечиваемое механизмами естественной неспецифической резистентности, соответствует фазе немедленной или срочной адаптации и проявляется в месте повреждения - первый и второй периоды ТБ. Переход организма в фазу долговременной или устойчивой адаптации при адекватном сопряжении названных фаз предполагает включение механизмов «преиммунного ответа» с последующим формированием адаптивного иммунитета на протяжении третьего и четвертого периодов ТБ.
Если такой переход невозможен - из-за чрезмерности травматического воздействия - то уже в первые сутки после травмы (первый
и второй периоды ТБ) формируется посттравматическая дисфункция иммунной системы, генез которой в большей степени связан с неадекватной работой систем амплификации (усиления) воспаления. Это сопровождается системным повреждением эндотелия, ишемией тканей и развитием ранней (неинфекционной) ПОН. Выраженность этой иммунной дисфункции активационного типа в свою очередь зависит от тяжести полученного ранения, объемов кровопотери и гемотрансфузии, глубины органной и клеточной гипоксии, энергопластических возможностей организма, состояния цитокиновой регуляции, последствий ятрогенной иммуносупрессии и других факторов. Развитие иммунных дисфункций при тяжелых ранениях закономерно. Дисрегуляция и последующая дезорганизация иммунной системы - на протяжении второго и третьего периодов травматической болезни - в условиях преобладания иммунодепрес-сивных нарушений являются основой патогенеза тяжелых местных и висцеральных ИО, а также раневого сепсиса и поздней (септической) ПОН у раненых с тяжелыми ранениями.
Представленная концепция СВО хорошо согласуется с классификацией ИО ранений и травм:
• Стадия локальной продукции цитокинов, не завершившаяся
• отграничением «очага», соответствует местным ИО. Стадия выброса малого количества цитокинов в системный кровоток приводит к прогрессированию местных и развитию висцеральных ИО. •Стадия генерализации воспалительной реакции является главным звеном патогенеза генерализованных ИО (сепсиса) и дальнейшего прогрессирования первых 2 групп осложнений (рис. 11.2).
Развернутая классификация ИО ранений и травм включает в себя частные формы ИО, систематизированные в зависимости от: распространенности - местные, висцеральные, генерализованные; этиологического фактора - аэробные и анаэробные инфекции; клинического варианта - нагноение, абсцесс, флегмона, гнойный затек; морфологической формы - целлюлит, фасциит, миозит, мионекроз, тендовагинит, остеомиелит; локализации - органные (висцеральные) системы - ЦНС, сердечно-сосудистая система, органы дыхания, желудочно-кишечный тракт, мочевыводящая система, полисерозиты; тяжести - сепсис, тяжелый сепсис, септический шок; длительности патологического процесса - острый, хронический.
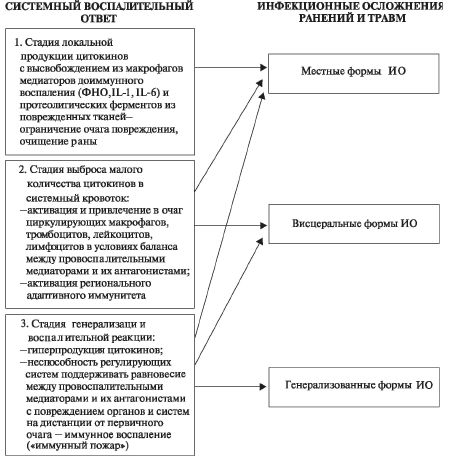
Рис. 11.2. Стадии системного воспалительного ответа и классификация инфекционных осложнений ранений и травм
Классификация ИО ранений и травм:
I. Местные ИО - клинико-патогенетические формы инфекционного процесса, развивающегося под воздействием микробов в живых тканях, окружающих рану, который сопровождается повреждением или гибелью клеточных структур и клинически выраженной общей реакцией организма.
Острые формы:
1. Аэробная (гнойная) инфекция:
а) нагноение раны22;
б) раневая инфекция:
- абсцесс раневого канала, полости, органа;
- околораневая флегмона (в форме целлюлита, миозита, фасциита,
остита или их сочетаний); - гнойный затек.
2. Анаэробная инфекция:
а) моноинфекции:
- клостридиальный целлюлит, клостридиальный мионекроз; - анаэробный стрептококковый миозит, анаэробный стрептококковый целлюлит;
б) полимикробные (синергические) инфекции (с преобладанием анаэробного компонента):
- синергический некротический фасциит; - синергический некротический целлюлит.
Хронические формы:
1. Хроническое нагноение:
- свищи мягких тканей (возникшие вследствие длительного существования гнойных полостей, содержащих костные и/или мягкотканные секвестры, инородные тела);
- пролежни (возникшие вследствие длительного нарушения трофики тканей).
2. Хроническая раневая инфекция (открытые, закрытые и свищевые формы):
- фасциит;
- тендовагинит;
- остеомиелит.
3. Хронические полимикробные инфекции (с преобладанием анаэробного компонента):
- прогрессирующая синергическая бактериальная гангрена; - хроническая пробуравливающая язва.
22 Нагноение огнестрельной раны с общебиологических позиций нельзя однозначно относить к осложнениям. Самостоятельное очищение и заживление огнестрельной раны с первичным и вторичным некрозом возможно только через нагноение. При таких условиях - нагноение не осложнение, а обязательный этап заживления раны. Нагноение послеоперационных ран следует считать осложнением, когда оно является результатом нерационального лечения (неполное удаление очагов некроза и нежизнеспособных тканей при хирургической обработке; инфицирование послеоперационных ран; неадекватное послеоперационное лечение и дренирование; формирование новых очагов некроза при травматичном оперировании)
II. Висцеральные ИО 23 - клинико-патогенетические формы инфекционного процесса, развивающегося на дистанции от первичного очага в органах и системах организма, скомпрометированных факторами СВО на ранение или травму.
1. ЦНС (менингит, энцефалит, менингоэнцефалит).
2. Органы дыхания (трахеобронхит, пневмония).
3. Сердечно-сосудистая система (тромбофлебит, миокардит, эндокардит).
4. Желудочно-кишечный тракт (панкреатит, холецистит, антибио-тикоассоциированные колиты, в т.ч. псевдомембранозный колит).
5. Мочевыводящая система (нефрит, пиелонефрит, цистит, уретрит).
6. Системные поражения соединительной ткани - полисерозиты (плеврит, синовиит, полиартрит, асцит, перикардит).
III. Генерализованные ИО - клинико-патогенетические формы инфекционного процесса, вызванные генерализацией и неадекватным развитием СВО на первичный очаг повреждения при участии микробов, сопровождающийся утратой организмом способности локализовать и подавить возбудителей раневой инфекции за пределами инфекционного очага и отличающийся невозможностью самостоятельного выздоровления.
1. Сепсис: синдром СВО и очаг инфекции.
2. Тяжелый сепсис (в т.ч. разлитой перитонит 24 : сепсис и ПОН.
3. Септический шок: сепсис и рефрактерная гипотония. Одним из важнейших выводов и требований классификации является необходимость диагностирования всех трех групп ИО ранений и травм, а не только местных, на которые нередко традиционно направлено все внимание практического врача. Следует также подчеркнуть, что новые местные и висцеральные ИО у раненых с сепсисом должны
23 Эти осложнения объединены в самостоятельную группу и систематизированы в соответствии с локализацией патологического процесса. Они не могут быть отнесены ни к местным, ни к генерализованным инфекционным осложнениям. Группа висцеральных ИО представлена как «хирургическими» осложнениями, требующими оперативного или инвазивного лечения (деструктивный холецистит, инфицированный панкреонекроз, экссудативный плеврит и другие серозиты), так и «терапевтической» патологией, которая предполагает проведение интенсивного консервативного лечения
24 Также неоднозначной в предлагаемой классификации является оценка перитонита. Так называемые ограниченные и неограниченные местные формы перитонита в зоне повреждения не имеют принципиальных отличий от нагноения или раневой инфекции и поэтому относятся к местным осложнениям. Дистантные поражения брюшины на фоне системного воспалительного ответа практически не встречаются. В то же время, разлитой перитонит, независимо от причины, всегда протекает как абдоминальный сепсис, т.е. относится к генерализованным формам ИО
рассматриваться как вторичные септические очаги, и это является признаком прогрессирования септического процесса.
Классификация ИО ранений и травм является обязательной составляющей концепции травматической болезни и описывает все многообразие ИО в рамках этой патологии. В свою очередь, теоретический смысл концепции ТБ состоит в логичном построении причинно-следственных отношений между патологическими процессами в динамике, соотношений патологических и защитно-приспособительных процессов в каждом временном интервале - и на этой основе моделировании течения болезни в каждом конкретном случае. Именно такой подход объясняет закономерную взаимосвязь и последовательность развития событий по схеме: тяжелое ранение/травма - шок - СВО - полиорганная дисфункция - ИО.
Из этого исходит практический смысл концепции травматической болезни - прогнозирование и своевременное выявление этих процессов, управление защитно-приспособительными реакциями и устранение патологических процессов, своевременная профилактика и опережающее лечение осложнений.
ИО ранений и травм являются особой формой хирургической инфекции, основные патогенетические звенья которой - механизмы СВО - включаются уже в момент ранения/травмы, на поле боя, еще до начала активного размножения возбудителей. Развитие инфекции приводит к повторному нарастанию негативных эффектов СВО.
11.2. ПРИНЦИПЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ БОЕВОЙ ХИРУРГИЧЕСКОЙ ТРАВМЫ
О развитии ИО у раненого свидетельствуют следующие клинические признаки:
1. Наличие пяти классических симптомов местного воспаления - боль, гиперемия, отек, повышение температуры, нарушение функции (dolor, rubor, tumor, calor, functio laesa).
2. Клиническая манифестация ССВО (см. гл. 11, раздел 11.4).
3. Сочетание первых и вторых признаков. Первый вариант клинических проявлений соответствует местным
ИО. При втором необходима диагностика конкретной формы висцеральных ИО, и высока вероятность развития сепсиса. Третий вариант однозначно характеризуется как сепсис.
Дальнейшая клиническая, лабораторная и инструментальная диагностика включает:
• анализ клинических проявлений инфекционного процесса; •общеклинические анализы крови, мочи;
• биохимические анализы крови (глюкоза, билирубин, креатинин, мочевина, общий белок, аланин- и аспартатаминотрансферазы и др. показатели); •маркеры воспалительного (с-реактивный белок), инфекционного (прокальцитониновый тест - РСТ) процессов и иммунограмма по показаниям; •ЭКГ;
• лучевые методы диагностики - ультразвуковое исследование (УЗИ), рентгенологическое исследование, компьютерная томография (КТ), магнитно-резонансная томография (МРТ); •инструментальное обследование - пункционные методы, фибро-бронхоскопия (ФБС), фиброгастродуоденоскопия (ФЭГДС), фиброколоноскопия (ФКС), эндовидеохирургические методы; •микробиологические методики - исследования раневого отделяемого, стенок раны, биологических жидкостей в соответствии с локализацией процесса; бактериоскопия мазка, окрашенного по Граму при подозрении на анаэробную инфекцию. На основании полученных данных формулируется диагноз ИО (табл. 11.1). Составными частями диагноза ИО должны быть все разделы классификации ИО.
Таблица 11.1. Пример формулирования диагноза ИО
Диагноз ранения | Местные ИО | Висцеральные ИО | Генерализованные ИО |
Осколочное слепое ранение предплечья с повреждением лучевой артерии и сухожилий | Острый глубокий гнойный полимикробный (стафилококко-во-протейный) целлюлит и некротический тендова-гинит предплечья (пространства Пирогова) | Антибиотико-ассоциирован-ный колит | Острый раневой стафилококковый сепсис, септицемия |
11.2.1. Диагностика местных инфекционных осложнений
Алгоритм диагностики местных форм ИО состоит из последовательного рассмотрения 5 вопросов.
1. Вероятность развития осложнения.
Распознавание угрозы раневой инфекции сводится к выявлению признаков неблагоприятно протекающей первой фазы раневого процесса (фазы воспаления) и оценке факторов риска.
Признаки неблагоприятно протекающей первой фазы раневого процесса:
• быстрое нарастание травматического отека с признаками ишемии тканей (бледность, синюшность или «мраморность» кожи) и появлением эпидермальных пузырей с геморрагическим содержимым;
• сильные, пульсирующие боли в ране в 1-2 сут после ранения;
• раннее, на 1-2 сут после ранения или операции повышение температуры тела до 38 ?С и числа лейкоцитов до 12х109/л. Факторы риска раневой инфекции:
• первичная ишемия тканей (повреждение артерии, жгут);
• загрязнение ран землей, наличие инородных тел;
• травматический шок II-III степени, терминальное состояние;
• обширное повреждение мягких тканей и обширная отслойка кожи;
• множественный оскольчатый характер огнестрельных переломов длинных трубчатых костей;
• тяжелые сочетанные ранения, особенно головы, груди, живота и таза в различных комбинациях;
• оказание первой врачебной помощи в поздние сроки (свыше 6 ч);
• поздние сроки (более 24 ч.) и низкое качество оказания хирургической помощи. Вероятность развития анаэробной инфекции, помимо названных факторов, определяется:
• близостью раны к местам естественного обитания анаэробов - полость рта, дистальные отделы пищеварительного тракта, верхние дыхательные пути, промежность, нижние конечности;
• сроками оказания хирургической помощи, превышающими 3 сут;
• характером раны - обширный, с повреждением костей, загрязнением землей, наличием инородных тел и гематом.
2. Дифференциальная диагностика нагноения раны и раневой инфекции
основана на местных и общих симптомах:
- нагноение раны диагностируется, если преобладают местные симптомы в виде расплавления очагов первичного некроза с образованием гноя в ране. Общие признаки выражены слабо - субфебрилитет до 38 ?С, умеренный лейкоцитоз до 12х109/л;
- раневая гнойная инфекция диагностируется, если клинические
проявления инфекционного процесса начинаются с общих
? симптомов - фебрилитет 38 С и выше, лейкоцитоз 12х109/л
и больше, лимфопения <20%, сдвиг лейкоцитарной формулы влево. Нейтрофилез свидетельствует об активности острого воспалительного процесса, лимфопения указывает на состояние иммунодепрессии и стресса, наличие эозинофилов на этом фоне свидетельствует об относительной надпочечниковой недостаточности и истощении адаптационной реакции. Если с самого начала раневая флора представлена грамотри-цательными эндотоксическими микробами, то общие проявления инфекции в некоторых случаях запаздывают (отсутствует экзотоксин) и достигают клинической выраженности только после активного размножения возбудителей в тканях и их прорыва в сосудистое русло (эндотоксин). Подобные ситуации возникают при тяжелых закрытых повреждениях и при глухом шве раны после операции, когда ведущим путем заражения является эндогенный.
Раневая гнойная инфекция может протекать в 3 основных вариантах или их сочетаниях.
1. Абсцесс (раневого канала, полости, органа) - скопление гноя, детрита, раневого экссудата в раневой полости и распространение воспаления стенок раневого канала на глубжележащие ткани (возникновение околораневой флегмоны) из-за нарушения оттока раневого отделяемого.
2. Околораневая флегмона - диффузно распростран яющийся инфек-ционно-воспалительный процесс с нарастанием отека, гиперемии, усилением болей в окружности раны, увеличением регионарных лимфатических узлов, лимфангоитом, тромбофлебитом. В зависимости от вида пораженных тканей флегмона протекает в форме целлюлита, фасциита, миозита. Следует всегда определять границы гнойной и серозной инфильтрации (воспаления) тканей. Точное обозначение пораженных тканей необходимо для определения объема лечебного пособия.
3. Затек (гноя, детрита, раневого экссудата) - вариант абсцесса раневого канала с распространением гноя, детрита, раневого экссудата по межмышечно-фасциальным пространствам. Его следует подозревать
при несоответствии между общим тяжелым состоянием раненого и видом раны. Местно в ране определяются вялые, синюшные грануляции, иногда без гнойного отделяемого, а в отдалении от раны, в дис-тально расположенных областях тела или сегментах конечностей, при внимательном обследовании можно диагностировать формирование т.н. «неожиданных» инфильтратов, наличие которых подтверждается при УЗили КТ-исследованиях.
Хроническая раневая инфекция проявляется главным образом формированием свищей. Чаще всего микробному повреждению подвергается плотная соединительная ткань (фасциит, тендовагинит) или кость (остеомиелит). Речь может идти и о хроническом нагноении, когда расплавлению подвергается выпавший в полость раны мягкот-канный или костный секвестр или инородное тело, а инфекционный процесс в окружающих живых тканях ликвидирован или протекает благоприятно.
3. Определение преобладающего характера раневой инфекции - аэробный и ли анаэробный.
Патогномоничные (и наиболее постоянные) симптомы анаэробного характера раневой инфекции (рис. 11.3, 11.4 цв. илл.)).
1. Зловонный, гнилостный запах экссудата (образование летучих жирных кислот, сернистых соединений, индола, водорода, азота, метана).
2. Гнилостный характер некроза - бесструктурный детрит серого, серо-зеленого или коричневого цвета.
3. Отделяемое раны в виде жидкого экссудата серо-зеленого или коричневого цвета с капельками жира; при микроскопии мазков раневого отделяемого, окрашенных по Граму, выявляется большое количество микроорганизмов и отсутствие лейкоцитов (гноя нет!). При этом обнаружение лейкоцитов и наличие гнойного пропитывания не исключает анаэробного компонента инфекционного процесса.
4. Газообразование в очагах анаэробной инфекции наблюдается в 2 вариантах:
- эмфизема, выявляемая при пальпации и аускультации (крепитация), а также при рентгенографии (ячеистый рисунок при целлюлите, перистый - при миозите);
- анаэробный газовый абсцесс - скопления газа в тканях и полостях с образованием уровня «газ-жидкость» на рентгенограммах.
5. Симптомы, характерные для любого раневого инфекционного процесса, при анаэробной инфекции имеют специфические черты, позволяющие заподозрить это осложнение:
- боль быстро нарастает, перестает купироваться анальгетиками; - отсутствие в начальном периоде развитие раневой инфекции выраженных внешних признаков воспаления на фоне тяжелого эндотоксикоза; имеется лишь легкая гиперемия кожи, пастозность, отсутствие гноеобразования, серозный характер воспаления тканей, окружающих зоны некроза; ткани имеют тусклый, бледный вид; - признаки эндотоксикоза: бледность кожного покрова, икте-ричность склер, выраженная тахикардия (ЧСС до 120 в 1 мин и более) всегда «обгоняет» температуру, эйфория сменяется заторможенностью, быстро нарастает анемия и гипотензия; - динамика признаков: появившись, симптомы нарастают в течение одного дня или ночи (анемия, симптом «лигатуры», тахикардия и т.д.). Значение анаэробных возбудителей или анаэробно-аэробных ассоциаций при перитонитах, абсцессах легких и эмпиемах плевральной полости, инфекциях в органах малого таза, ЛОР-органах и челюстно-лицевой облости настолько велико, что инфекции другой этиологии уходят на последний план как в ходе диагностики, так и в процессе лечения.
Дифференциальные признаки различных форм анаэробной инфекции яснее проявляются в начальных стадиях, когда поражен какой-либо определенный вид ткани. В далеко зашедших случаях эти отличия стираются, и у врача остается возможность определить лишь анаэробный характер инфекционного процесса для выработки адекватной лечебной тактики.
4. Определение конкретных возбудителей инфекции (оценка бактериологических исследований). Ориентировочная этиологическая диагностика проводится на основании:
• сроков с момента повреждения, сроков поступления, сроков
• появления признаков инфекционного процесса; клинических ориентиров, характерных для того или иного вида
• возбудителя; данных микробиологического мониторинга лечебного стационара. В результате оценки этих данных определяется характер инфекции: •внебольничная инфекция - 1-2 сут после госпитализации; •госпитальная инфекция - свыше 2 сут после поступления;
• аэробный или анаэробный характер инфекции (в т.ч. по данным нативной бактериоскопии).
Выводы используются для проведения рациональной эмпирической (стартовой) антибактериальной терапии.
Окончательная этиологическая диагностика проводится следующим образом.
1. Забор материала для посевов производится из глубоких слоев раны, по возможности из кусочков стенки раны после удаления раневого отделяемого, обработки раневой поверхности антисептиком и 0,9% раствором натрия хлорида. Возбудители раневой инфекции находятся в живых тканях и могут отличаться от микробов, вегетирующих на поверхности раны.
2. Интерпретация результатов. При выделении условно-патогенных микроорганизмов, их необходимо отнести к одной из следующих категорий:
- микроорганизм - истинный возбудитель инфекции, если он выделен из первично стерильного локуса
(термин, характеризующий микробиологическое состояние органов, тканей и
жидкостей организма, стерильных у здорового человека) или из необычного для него локуса в количестве более 105 бактерий в
- микроорганизм - компонент нормальной микрофлоры локуса, например, S. epidermidis при его выделении с кожного покрова или S. viridans при их выделении со слизистой оболочки зева;
- микроорганизм - колонизующий локус, если получен малопатогенный микроорганизм из инфекционного очага в небольшом количестве. Например, Enterococcus spp. или S. epidermidis, обнаруженные в ране иммунокомпетентного раненого, как правило, не участвуют в патологическом процессе;
- микроорганизм - контаминировавший (загрязнивший) клинический материал, если получены единичные колонии микроорганизмов - представителей кожной или воздушной микрофлоры. Загрязнение клинического материала нужно выявлять предварительным просмотром мазка. Наличие эпителиальных клеток и отсутствие лейкоцитов в мазке свидетельствует о возможности массивной контаминации клинического материала и делают нецелесообразным дальнейшее исследование.
3. Бактериологическая диагностика анаэробной инфекции требует применения специальной анаэробной техники - специальные
среды, анаэростаты и др. Наиболее перспективным в настоящее время считается метод парофазного газохроматографического анализа, позволяющий определить вид возбудителя и даже чувствительность к антибиотикам в течение нескольких часов. Более простой и доступной является микроскопия мазков экссудатов, окрашенных по Граму: - большое количество микроорганизмов и отсутствие лейкоцитов
подтверждает анаэробный характер инфекции; - наличие крупных грамположительных палочек с четко выраженной капсулой говорит о клостридиальной инфекции; - грамположительные кокки в виде цепочек или гроздей свидетельствуют об анаэробной кокковой моноинфекции; - мелкие грамотрицательные палочки, в т.ч. веретенообразной формы, являются бактероидами или фузобактериями. 5. Оценка результатов лабораторных и инструментальных методов исследований.
1. Клинический анализ крови является чрезвычайно информативным тестом. Ухудшение показателей клинического исследования крови - нарастание лейкоцитоза, лимфопения, сдвиг лейкоцитарной формулы влево, увеличение СОЭ и др., - свидетельствуют о нарастании антигенной нагрузки и прогрессировании воспалительного процесса, т.е. о раневой инфекции. Нейтрофилез свидетельствует об активности острого воспалительного процесса, лимфопения указывает на состояние иммунодепрессии и стресса, возрастание числа эозинофилов на этом фоне свидетельствует об относительной надпочечниковой недостаточности и истощении адаптационной реакции.
2. УЗИ очень быстро и достоверно позволяет выявить и локализовать зону серозного воспаления, флегмоны, абсцесса и газообразования в тканях.
3. Рентгенологическое исследование проводится для диагностики свищевых, анаэробных форм инфекции, для выявления деструктивного процесса в костях.
4. При некоторых локализациях местных ИО (внутричерепные и внутрибрюшинные абсцессы, гнойный медиастинит, паранефрит и др.) необходимо выполнение КТ, МРТ, сцинтиграфии.
5. Пункционный метод является самым доступным, однако он сопряжен с определенным риском и имеет высокий процент лож-ноотрицательных результатов.
• Результатом диагностического процесса становится диагноз, который должен содержать следующие характеристики местного ИО: длительность процесса: острый, хронический; •топография: поверхностный (эпифасциальный), глубокий (суб-фасциальный), межмышечный, межкишечный, подпеченочный и т.п.; •этиология: - моноинфекция, полимикробная инфекция, смешанная (аэробно-анаэробная) инфекция; - преобладающий характер инфекционного процесса - аэробный или анаэробный; •морфологическая характеристика: целлюлит, миозит, некроз тканей; •область (сегмент) тела.
Диагноз должен обеспечить тактическое решение по лечению раненого, преемственность между врачами и возможность научного анализа.
11.2.2. Диагностика висцеральных инфекционных осложнений
Цепь патофизиологических процессов при травматической болезни, запущенных этиологическими факторами, воздействующими на организм в момент травмы/ранения с последующим развитием неинфекционных, инфекционных висцеральных и генерализованных осложнений, можно трактовать, используя теорию адаптации и теорию функциональных систем. Согласно этим теориям, при тяжелом повреждении немедленно включаются запрограммированные механизмы срочной адаптации, направленные на устранение гипоксии основных жизнеобеспечивающих систем. Примерами таких механизмов являются централизация и гипердинамия кровообращения, аутогемодилюция, стимуляция процессов гликогенолиза и липолиза.
Особенностью этих приспособительных реакций, обеспечивающих первый (острый) период ТБ и период относительной стабилизации жизненно важных функций, является их высокая энергоемкость и, как следствие этого, быстрая истощаемость. При отсутствии адекватного лечения, к исходу вторых суток механизмы срочной компенсации становятся неэффективными. «Перерасход» свободного биоэнергетического потенциала организма на реакции срочной адаптации замедляет развертывание механизмов более совершенной долговременной адаптации, основанной на синтезе белков-адаптогенов (альбуминов, глобулинов, белков с ионами металлов переменной валентности,
гликопротеинов, церулоплазмина и других белков), специфических иммуноглобулинов, а также на мобилизации клеток-эффекторов реакций иммунореактивности. Механизмы долговременной адаптации обычно реализуются под контролем и управлением единой интег-ративно-регуляторной системы организма.
Следовательно, третий период ТБ - период максимальной вероятности развития осложнений, в т.ч. висцеральных и генерализованных ИО - по своей патогенетической сути является периодом неустойчивой адаптации: срочная адаптация уже несостоятельна, а механизмы долговременной адаптации еще не успевают полноценно включиться. В этот период в первую очередь страдают функциональные системы, скомпрометированные травмой/ранением, ослабленные сопутствующей патологией, имеющие несовершенные генетические особенности организации, а также высокодифферен-цированные морфо-функциональные системы - элементы нервной, эндокринной и иммунной систем.
Таким образом, висцеральные ИО ранений и травм могут явиться следствием:
• воздействия факторов стадии генерализации СВО (гиперцитоки-немии при неадекватном развертывании адаптивного иммунного ответа и формировании тяжелой иммунодепрессии) как самостоятельно, так и в сочетании с ятрогенными факторами; •врачебного воздействия (ятрогении) на органы и системы организма, скомпрометированные факторами СВО (стадия преим-мунного воспаления), то есть возникать до развития генерализации инфекции; •обострения предшествующего хронического заболевания под
• воздействием ранения или факторов СВО; развития сопутствующего острого хирургического заболевания
(например, острый холецистит). Алгоритм диагностики висцеральных ИО заключается в целенаправленном поиске признаков патологии органов и систем, закономерно компрометируемых факторами, ответственными за развертывание СВО. В обязательный круг поиска включаются органы и системы с максимальным кровотоком и подвергающиеся агрессивным ятрогенным воздействиям (ИВЛ, катетеризация, эндоскопия, прочие инвазивные методы диагностики и лечения, «агрессивная» медикаментозная терапия): головной мозг, сердце, легкие, печень, почки, дыхательные и мочевыводящие пути.
Другие органы и системы исследуются при появлении соответствующих клинических признаков. Активное выявление признаков висцеральных осложнений (мониторинг) ведется до окончания проявлений СВО.
Основанием для установления диагноза висцерального ИО являются:
• клинические признаки поражения органа или системы, появившиеся в динамике травматической болезни (например: нарушение сознания, очаговая неврологическая симптоматика, тахикардия, одышка, кашель, дизурия, диарея, боли и отеки в суставах и др.);
• лабораторные признаки воспалительно-деструктивного процесса в органе или системе (например: повышение уровня билирубина, трансаминаз, ферментов поджелудочной железы; пиурия, бакте-риурия, протеинурия, цилиндрурия и др.);
• данные инструментального обследования - ЭКГ, рентгенографии, УЗИ сердца, почек, печени, поджелудочной железы, КТ, МРТ головного мозга, легких, брюшной полости, суставов;
• микробиологический мониторинг и выявление микробов в «стерильном» органе (экскрете или экссудате) или микробов, не свойственных данному локусу, или обычных обитателей локуса в концентрации, на порядок большей, чем обычно.
Принципиально важным является непрерывное мониторирование функционального состояния органов и систем, вовлеченных в инфекционно-воспали-тельный процесс. Следует различать висцеральные ИО без нарушения и с нарушением функции органа или системы. При развитии полиорганной дисфункции необходимо констатировать развитие у раненого тяжелого сепсиса.
11.2.3. Диагностика генерализованных инфекционных осложнений
Термин сепсис (греч. σηψιξ - гниение, лат. sepsis - гнилокровие) в современной медицине используется для определения ИО различных заболеваний, сопровождающихся утратой организмом способности локализовать и подавить возбудителей инфекционного процесса за пределами первичного очага и, как следствие этого, невозможностью самостоятельного выздоровления.
Международная терминология, характеризующая генерализованные формы ИО, принята Согласительной конференцией Американской Коллегии торакальных хирургов и Общества специалистов интенсивной терапии (Consensus Conference Committee - ACCP/SCCM, 1991). В основу концепции сепсиса, предложенной по итогам работы
этой конференции, были положены
представления о СВО и роли цитокинов в генерализации воспаления.
Введение этого нового понятия знаменовало собой определенный прорыв в
концептуальных представлениях о патофизиологии и патогенезе
генерализованных форм хирургических инфекций. Это подвело итог работам
Р.Е. Боун (1991) и В. Ертель (1991), которые сформулировали необходимую
теоретическую базу, основанную на фундаментальных исследованиях таких
предшественников современной концепции сепсиса, как Х. Шотмюллер, K.
Бингольд (1925), И.В. Давыдовский (1956) и В.Г. Бочоришвили (1988).
Методические рекомендации по диагностике и лечению сепсиса приняты на
Калужской согласительной конференции Российской ассоциации специалистов
по хирургической инфекции (РАСХИ) в июне
Клиническая диагностика сепсиса основана на выявлении клинически определяемого первичного инфекционного очага или бактериемии в сочетании с ССВО.
Критерии ССВО.
1. Тахикардия с ЧСС свыше 90 в 1 мин.
2. Тахипноэ свыше 20 в 1 мин или pСО2a меньше
3. Температура тела выше 38 или ниже 36 ?С.
4. Количество лейкоцитов в периферической крови больше 12000 в 1 мм3 или меньше 4000 в 1 мм3, или число незрелых форм превышает 10%.
Синдром СВО считается положительным при наличии не менее двух из представленных критериев. Кроме того, следует выделять:
• тяжелый сепсис - сепсис, сопровождающийся развитием органной дисфункции (недостаточности одного и более органов или систем организма). Для диагностики органной дисфункции достаточно одного из клини-ко-лабораторных критериев.
1. Дисфункция в системе гемостаза (коагулопатия потребления): - продукты деградации фибриногена >1/40; D-димеры>2; - ПТИ<70%, тромбоцитов <150 x 109/л, фибриноген <2 г/л.
2. Повреждение газообменной функции легких: - pО2a <
- билатеральные легочные инфильтраты на рентгенограмме; - pО2a /FiO2<300;
- необходимость ИВЛ с ПДКВ>
4. Печеночная дисфункция: - билирубин крови >34 мкмоль/л; - увеличение АсАТ, АлАТ, щелочной фосфатазы в два раза и
более от нормы.
5. Дисфункция ЦНС: - нарушение сознания менее 15 баллов по шкале ком Глазго.
6. Гастроинтестинальная недостаточность: - кровотечение из острых язв («стресс-язвы») желудка; - паралитическая кишечная непроходимость длительностью
• более 2 сут; - диарея (жидкий стул более 4 раз в сут). септический шок - это сепсис, сопровождающийся гипотонией, рефрактерной к проводимой терапии (САД -
1. наличие септического очага с тенденцией к распространению (критерий инфекции);
2. ССВО (критерий выброса медиаторов воспаления в системную циркуляцию);
3. органная недостаточность (критерий воспаления на дистанции от первичного очага).
Для определения дифференцированной лечебной тактики необходимо установить форму сепсиса, его тяжесть и структуру синдрома органной недостаточности. В зависимости от конкретной причины развития СВО организма или, если говорить еще точнее, неконтролируемого выброса медиаторов воспаления (генерализация воспалительного ответа) и недостаточности механизмов, ограничивающих их эффект, различаются три формы сепсиса.
Первая - терапевтический сепсис. Развивается у пациентов с впервые возникшим или предшествовавшим инфекционному заболева-
нию иммунодефицитом (врожденным, после иммунодепрессивной терапии, облучения, на фоне сахарного диабета и т.д.). «Терапевтический» сепсис может быть также связан с чрезвычайно патогенным возбудителем, проникшим в организм, минуя естественные барьерные системы, через небольшие раны, места инъекций, при инфузии нестерильных лекарственных сред и т.п. Такой сепсис не требует хирургического вмешательства. Это м.б. сепсис брюшнотифозный, туберкулезный и т.п.
Вторая - хирургический сепсис, осложняющий острые хирургические инфекционные заболевания и травмы. Эта форма сепсиса включает в себя т.н. «органный» (гинекологический, урологический, абдоминальный и т.д.) и «раневой» сепсис, вызванный местной раневой инфекцией.
Развитие «терапевтического» и «хирургического» сепсиса обусловлено в первую очередь патогенными свойствами микроорганизмов. Без патогена нет и характерной для этих форм инфекции патологии. При этом дефицит резистентности, иначе - преобладание силы микробного воздействия над ответной защитной реакцией организма, является в конечном итоге результатом повреждения микробными токсинами механизмов противоинфекционной защиты.
Принципиально иная последовательность событий обнаруживается при тяжелой травме. Вызванные ею каскадно нарастающие системные нарушения, чрезмерная активация цитокиновой сети формируют неконтролируемый СВО, обусловливающий вторичную по отношению к этому процессу диссеминацию возбудителей и генерализацию инфекции.
Третья форма сепсиса - постшоковый сепсис, развивающийся после тяжелой травмы, когда генерализация СВО, свойственная любому сепсису в стадии разгара, развивается еще до колонизации и активного размножения микробов во внутренней среде организма. Чрезмерную активацию цитокиновой сети вызывает главным образом массивное поступление в общий кровоток медиаторов воспаления, ферментов и других внутриклеточных структур из очагов повреждения и естественных резервуаров. В этом случае входными воротами и источником диссеминации возбудителей могут быть как рана, так и органы, барьерные функции которых пострадали вследствие системных гипоперфузионных нарушений - желудочно-кишечный тракт, легкие. Поэтому развитие сепсиса у прежде здорового человека возможно без местной раневой инфекции (особенно при закрытых
травмах) и вообще без макроскопически видимого инфекционного очага, подлежащего хирургическому лечению.
В настоящее время для оценки выраженности ПОН широко используются несколько шкал оценки, которые отличаются по пороговым значениям физиологических переменных и по количеству включенных для оценки параметров. Наличие различных методик и предпочтения к их применению в практической деятельности тех или иных стационаров являются следствием отсутствия единой и общепринятой системы оценок.
Мониторинг тяжести состояния, хирургическая тактика и интенсивная терапия у пациентов отделений интенсивной терапии и реанимации предполагает использование объективных методик оценки функциональных нарушений и оценки степени ПОН. Для решения первой задачи наиболее часто используются системы A PA CHE, SAPS, модели вероятной летальности - М РМ, для описания синдрома ПОН - шкалы S OFA, M ODS. На кафедре военно-полевой хирургии для диагностики ПОН используется шкала ВПХ-СС. Методика оценки тяжести состояния ВПХ-СС построена по принципу диагностического алгоритма и является надежным и эффективным инструментом для определения тяжести состояния пострадавших с тяжелой травмой. Эта шкала обладает высокой чувствительностью в отношении прогноза исхода и вероятности развития осложнений, позволяет в полной мере сформировать клинический образ конкретного пациента с тяжелой травмой/ранением, оптимизировать реализацию принципа индивидуальной направленности в хирургическом лечении и интенсивной терапии (см. гл. 5).
В практическом отношении чрезвычайно важна дифференциальная диагностика молниеносного сепсиса и септического шока.
Она должна основываться в первую очередь на клинической картине. Это объясняется, с одной стороны, наличием четких симптомов, а с другой - необходимостью быстро диагностировать эти виды сепсиса и начинать лечение не позднее первых 6-8 ч заболевания.
Обе формы могут возникнуть на любой стадии инфекционного процесса. При этом ориентация на формальные признаки септического шока: септический шок=ССВО+ПОН+гипотония или «тяжелый сепсис»+гипотония, - может оказаться недостаточной. Во-первых, эти признаки могут совпасть у обеих форм инфекционного процесса. Во-вторых, они могут вообще отсутствовать из-за стремительности процесса и, в-третьих, возникать на фоне относительного
благополучия без предшествовавшей клиники сепсиса. При этом абсолютно необходимо немедленно провести дифференциальную диагностику этих состояний, т.к. определенные направления их терапии прямо противоположны.
В основе патогенеза молниеносного (грамположительного, стафилококкового) сепсиса лежит первичное поражение стафилококковым экзотоксином миокарда с падением его сократительной способности (первичное нарушение центральной гемодинамики). Для него характерна триада симптомов:
• резкий подъем температуры тела до 39-41 ?С;
• раннее развитие острой левожелудочковой недостаточности (сердечная астма, отек легких, расширение границ сердца, глухость сердечных тонов);
• страх смерти.
Развитие септического (эндотоксинового, инфекционно-токсическо-го) шока проявляется картиной первичного нарушения периферического кровообращения (микроциркуляции):
• мраморность кожи, коллаптоидные пятна;
• падение АД, нитевидный исчезающий пульс;
• чистые и ясные тоны сердца (нередко громкие);
• высокая лихорадка, быстро падающая до нормы;
• состояние сознания характеризуется эйфорией, сменяющейся
заторможенностью. Этиологическим фактором септического шока являются, как правило, грамотрицательные эндотоксические микробы. Но при наличии обширного, длительно существующего гнойного очага клиническая картина септического шока может не зависеть от вида гемокультуры. В этом случае шок обусловлен как микробными, так и собственными тканевыми токсинами, которые запускают сложный каскад цито-токсических иммунных реакций с преимущественным поражением эндотелия сосудов. Циркуляторные расстройства, приводящие к поступлению в общий кровоток эндотоксина из желудочно-кишечного тракта, по-видимому, не отличаются принципиально от ситуации при травматическом шоке. Здесь диагностическая ценность критериев ССВО, ПОН и гипотонии несомненна.
Дифференциальная диагностика грамположительного (в основном стафилококкового) и грамотрицательного острого сепсиса по клиническим признакам является более сложной. Для стафилококкового сепсиса типично относительно острое начало (температурные
«свечи», высокая лихорадка) и отсутствие в первые дни головной боли, анорексии и бессонницы. Очень характерны для стафилококкового сепсиса:
• вторичные гнойные высыпания (на фоне уже существующей лихорадки) в виде ложных фурункулов, пустул;
• острые некрозы кожи;
• милиарная мелкопузырчатая сыпь (cristalina milliaria). Для грамотрицательного сепсиса показательны с самого начала сильная головная боль, бессонница, нарушение сознания, анорексия.
Бактериологическая диагностика сепсиса - метод гемокультуры. Достоверные результаты можно получить, производя заборы крови не менее 2-х раз в сут в течение 2 дней. На это время отменяется антибактериальная терапия. Каждая проба засевается в 2 колбы. Результат считается положительным, если из 50% проб высевается один и тот же микроб. Результаты гемокультуры должны сопоставляться с данными, полученными из предполагаемых инфекционных очагов - стенки раны или абсцесса, удаляемый катетер, аспират из трахеобронхиаль-ного дерева, моча и т.п.
Главные достоинства предлагаемого подхода к классификации и диагностике сепсиса заключаются в простоте и достаточно высокой взаимосвязи клинико-лабораторных критериев синдрома СВО с генерализованным воспалением, возможности быстрой постановки диагноза и, что крайне важно, перестройки программы лечения. Принципиальным является наличие доказательств остро развившихся функциональных расстройств со стороны различных органов или систем, поскольку предложенные симптомы синдрома СВО, указывая на проникновение медиаторов воспаления в системный кровоток, далеко не всегда являются свидетельством появления локусов воспаления на дистанции от первичного очага, угрозы ПОН и тяжелого сепсиса. Именно тяжелый сепсис и составляет клиническую проблему.
Унификация диагностики создает основу для объективизации определения эффективности различных препаратов, методов терапии и рационального разделения потоков пациентов по месту лечения (ОРИТ ? 1, 2 или 3, профильные отделения). Появляется возможность изучения эпидемиологии сепсиса и стандартизации лечебного процесса.
11.3. ХИРУРГИЧЕСКОЕ И КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ МЕСТНЫХ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ
Основные направления профилактики и лечения местных ИО включают в себя:
• удаление из раны некротических и нежизнеспособных тканей; •обеспечение оттока раневого отделяемого путем пассивного либо
• активного дренирования; восстановление жизнеспособности тканей, окружающих зоны некроза, за счет устранения отека, восстановления микроциркуляции, нормализации биохимических процессов; •подавление возбудителей раневой инфекции (антимикробная
• профилактика и терапия); предотвращение проникновения микробов (в т.ч. госпитальных штаммов) из внешней среды путем закрытия раны швами или защитной повязкой. Они реализуются хирургическими и консервативными методами лечения ран и раневой инфекции.
11.3.1. Хирургические методы лечения местных инфекционных осложнений ранений
• Принцип активного хирургического лечения включает в себя три основных компонента (рис. 11.5): ВХО;
• полноценное дренирование; •раннее закрытие раневой поверхности.
Решающее значение в достижении целей лечения раневой инфекции имеет вторичная (или повторная «по вторичным показаниям») хирургическая обработка раны. Особенности операции ВХО раны.
1. Применение при хирургической обработке ран, осложненных раневой инфекцией, общего или регионарного обезболивания. При обширных гнойных ранах местная анестезия не может создать обезболивания, достаточного для удаления всех нежизнеспособных тканей, дренирования раны, фасциотомии и наложения швов.
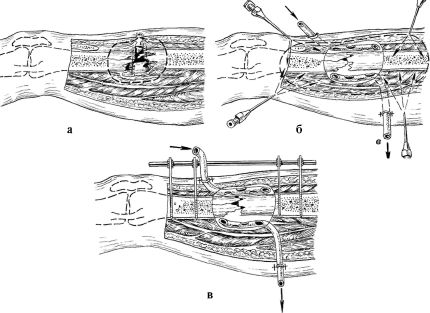
Рис. 11.5. Этапы вторичной хирургической обработки раны: а) объем тканей, подлежащих иссечению в ходе вторичной хирургической обработки; б) активное дренирование раневой полости и зона противовоспалительной блокады по А.С. Рожкову; в) внеочаговый остеосинтез огнестрельного перелома бедренной кости стержневым аппаратом комплекта КСТ-1
2. Рассечение раны должно включать широкое раскрытие фасци-альных футляров, позволяющее не только хорошо осмотреть рану, но и обеспечивающее восстановление жизнеспособности тканей за счет декомпрессии отечных тканей и улучшения их кровоснабжения.
3. Иссечение является основным содержанием операции ВХО. Цель его - обеспечить удаление из раны некротических и нежизнеспособных тканей, освободив тем самым организм от необходимости «использования нагноения» как биологического этапа заживления раны. Объем иссечения определяется:
- границами некроза;
- границами гнойного и серозного воспаления живых тканей; - видом и функциональной значимостью пораженных тканей; - анатомической и функциональной целесообразностью;
- возможностями сохранения тканей, пораженных раневой
инфекцией, с помощью консервативного лечения; - состоянием раненого. Подлежат безусловному удалению, помимо мертвых тканей, пораженные инфекционным процессом плотная соединительная ткань (участки сухожилий, фасций), хрящевая ткань и кость. Инфекционный процесс в этих тканях консервативными способами остановить нельзя.
4. Максимальное устранение условий для колонизации и размножения микроорганизмов, подавление возбудителей раневой инфекции путем создания тканевых барьеров (кожных, мышечных) между внешней средой и тканями со слабой устойчивостью к инфекции, тщательным гемостазом с предотвращением образования гематом, замкнутых пространств. Необходимо предельно бережное отношение к коже и стремление при первой возможности к восстановлению кожного покрова.
5. Стремление к раннему закрытию ран. Непременным условием прекращения местного инфекционного процесса является восстановление покровных тканей как барьера между внешней и внутренней средой.
Показаниями к наложению швов являются:
• полное очищение раны от мертвых и нежизнеспособных тканей, достигаемое хирургической обработкой инфекционного очага и консервативным лечением; •отсутствие выраженных воспалительных изменений кожи в
• окружности раны; возможность адекватного сопоставления краев раны без чрезмерного их натяжения. Применение швов после хирургической обработки не означает наложения «глухого» шва на инфицированную рану. Необходимо сочетание шва инфицированной раны с активным дренированием, обеспечивающим полноценный отток отделяемого из раневой полости. Если края раны трудно сблизить без натяжения, то показана кожная пластика местными тканями или свободная пластика расщепленными лоскутами (рис. 11.6 цв. илл.).
Кроме того, применяется методика дерматотензии, позволяющая длительное время сочетать открытое ведение обширных ран мягких тканей с постепенным увеличением площади кожных лоскутов. Она позволяет сразу после купирования инфекционного процесса закрыть рану полноценными покровными тканями (рис. 11.7 цв. илл.).
6. Дренирование ран при ВХО может быть пассивным и активным. Пассивное дренирование - использование марлевых тампонов, резиновых (перчаточных) выпускников и трубчатых дренажей различного диаметра - применяется лишь при лечении ран с минимальными признаками раневой инфекции. Для лечения ран, осложненных раневой инфекцией, методы пассивного дренирования мало эффективны и нередко наносят прямой вред раненому, т.к. быстро сопровождаются прекращением оттока раневого отделяемого вследствие физико-химических свойств гноя.
Активное дренирование заключается в сочетании:
• аспирации отделяемого из раневой полости;
• постоянного промывания полости раны;
• прямого воздействия на раневую микрофлору и стенки раневой полости с помощью вводимых в растворе антибиотиков, антисептиков и протеолитических препаратов. Наиболее эффективны при лечении гнойной раны силиконовые двухпросветные трубчатые дренажи или несколько однопросвет-ных дренажей, обеспечивающих активное дренирование. Сочетание всех трех элементов активного дренирования является наилучшим, однако требует специального оснащения. В военно-полевых условиях наиболее простым и удобным является длительное активное дренирование «проточным» способом или вакуумный дренаж по Редону. При любом способе дренирования трубку следует помещать точно по дну гнойной полости и выводить ее через самый низкий участок гнойного очага. Важным моментом является подведение дренирующих элементов через отдельные проколы, вне кожной раны, т.к. здоровые ткани более устойчивы к инородному телу (дренажу) и дают меньше осложнений.
Особенности хирургического лечения анаэробной инфекции.
Методом выбора при хирургическом лечении анаэробной инфекции является ВХО. ВХО при анаэробной инфекции имеет следующие особенности:
• радикальная некрэктомия;
• дополнительное дренирование;
• заполнение раны угольными сорбентами;
• на конечностях дополнительно выполняется фасциотомия всех
• мышечных футляров вне зоны поражения; выполнение на границе здоровых тканей и зоны серозного отека преграждающих разрезов кожи и подкожной клетчатки.
При установленной нежизнеспособности сегмента (сегментов) конечности, пораженного анаэробным процессом, показана его ампутация, которая может выполняться в двух вариантах:
• ампутация по типу ВХО раны с максимальным сохранением длины конечности за счет тщательного удаления только явно нежизнеспособных и пораженных тканей при компенсированном и субкомпен-сированном (по шкалам ВПХ-СП, ВПХ-СГ или ВПХ-СС) состоянии раненого и возможности сохранения вышележащего сустава; •ампутация или экзартикуляция в пределах здоровых тканей минимально травматичным способом - выполняется при крайне тяжелом (декомпенсированном по шкалам ВПХ-СП, ВПХ-СГ или ВПХ-СС ) состоянии раненого, не способного перенести более длительное и травматичное оперативное вмешательство. Ампутации проводятся только под общим обезболиванием. Целесообразно предварительно перевязывать магистральные сосуды на уровне, сохраняющем кровообращение культи, чтобы не применять жгут. В ходе операции обязательно выполняется широкое раскрытие всех фасциальных футляров пораженных групп мышц на культе. Независимо от типа операции недопустимо наложение первичного шва на рану. В то же время для предотвращения ретракции кожно-фасци-альных лоскутов они сводятся и удерживаются над лечебной повязкой 2-3 провизорными швами. Необходимы ежедневные программированные оперативные ревизии раны с некрэктомией (под общей анестезией) вплоть до полного очищения раны. Наиболее часто рана закрывается ранним вторичным швом.
11.3.2. Принципы консервативного лечения местных инфекционных осложнений ранений и травм
В 1-й фазе раневого процесса (воспаления) эффективными являются мероприятия, ускоряющие очищение раны, нейтрализующие неблагоприятные факторы воспаления (отек, нарушение кровообращения, чрезмерную активацию протеолиза) и обеспечивающие адекватное дренирование раны. К ним относятся:
1. Чрескостное промывание тканей в конце ПХО костно-мышечной раны по методике А.Н. Сызганова - Г.К. Ткаченко (1978) препаратами для внутривенного введения, обладающими антимикробным, противовоспалительным и обезболивающим действием.
2. Аппликационное лечение свежих и гнойных ран в фазе воспаления препаратами, обладающими гидрофильностью и оказывающими
на рану комплексное, многонаправленное действие - антимикробное, дегидратирующее, некролитическое, противовоспалительное и обезболивающее. Наилучшим образом отвечают перечисленным требованиям препараты на основе полиэтиленг-ликоля - «левосин», «левомеколь», диоксидиновая мазь, 10% мазь мафенида ацетата. Мощным протеолитическим (некролитичес-ким), антимикробным и дегидратирующим действием обладает препарат «КФ» (А.В. Каплан, С.С. Фейгельман, 1985), состоящий из пепсина - 15%, аскорбиновой кислоты - 30%, глюкозы - 54,25% и гидроперита - 0,75%. Препарат применяется в виде присыпки или раствора - 30-60 г на 400,0 мл воды - для приточно-отливно-го дренирования. Применение традиционного гипертонического (10%) раствора хлорида натрия, раствора фурацилина (1: 5000), 3% раствора борной кислоты эффективно только при постоянном медленном капельном или дискретном подведении раствора через трубчатый дренаж в глубь раны (глубокие слои повязки).
3. Вульнеросорбция активированными углеводородными волоконными материалами, фиксирующими белковые молекулы, как начальный компонент аппликационного лечения. Применение указанных сорбентов эффективно также при лечении раневой инфекции с преобладанием дегенеративно-некротических процессов на фоне разрушения грануляций, что характерно для анаэробной инфекции.
4. Повторная инфильтрация мягких тканей в окружности раны антибиотиками широкого спектра действия в 0,25% растворе новокаина или в 0,2% растворе лидокаина (100-200 мл).
5. Ранняя длительная внутриартериальная (через катетеризированную a. epigastrica inf.) инфузия 0,25% раствора новокаина - 100,0-150,0, спазмолитиков (папаверин - 2-4 мл, но-шпа, компламин - по 4-6 мл в 75-100 мл 0,9% раствора хлорида натрия для каждого препарата), антикоагулянта (гепарин 5000 ед.), антиагрегантов (трентал - 5 мл, гидроксиэтилкрахмал, реополиглюкин или гемодез - 400 мл) и антибиотиков в высших разовых дозах - 1-2 раза в сут. Она показана при повреждении нижних конечностей, особенно с открытыми переломами костей II-III степени по классификации АО.
6. «Противовоспалительные» паравульнарные блокады по методике А.С. Рожкова (1981) с применением высоких доз глюкокортико-идов, ингибиторов протеаз и антибактериальных препаратов. В состав смеси входят следующие ингредиенты: 0,25% раствор
новокаина (0,2% раствор лидокаина) - до 250,0 (при большем объеме количество сухого новокаина не должно превышать
Профилактическим применением антибиотиков в хирургии называется их периоперационное (до, во время и в определенных ситуациях после операции) введение с целью снижения риска развития послеоперационных ИО. Антимикробная профилактика ИО особенно важна при высоком риске их возникновения.
Основные принципы антибиотикопрофилактики:
• микробная контаминация любой, в т.ч. операционной раны практически является неизбежной; •при проведении антибиотикопрофилактики не следует стремиться к полной эрадикации этиопатогенов (уничтожению всех микроорганизмов); •эффективная концентрация антибиотика должна быть достигнута к началу операции и сохраняться до ее конца; •внутривенное введение антибиотиков осуществляется за 30-40 мин
• до начала операции; продолжение введения антибиотика более 24 ч после операции не приводит к повышению эффективности антибиотикопрофи-лактики. В военно-полевой хирургии и в хирургии повреждений для профилактики раневой инфекции препаратами выбора являются цефа-лоспорины I-II поколения (цефазолин, цефуроксим) или аминопенициллины (ампициллин, амоксициллин), если нет признаков повреждения полых
органов или других источников грамотрицательной и/или анаэробной микрофлоры. В последних случаях указанные антибиотики комбинируются с аминогликозидами (амикацин, нетилмицин) и/или метронидазолом.
Чем тяжелее ранение и ранние системные нарушения микроциркуляции (травматический шок с централизацией кровообращения), тем вероятнее транслокация (перемещение) смешанной эндогенной микрофлоры из обычных мест обитания в просвете желудочно-кишечного тракта в системный кровоток и колонизация ими других органов и тканей, скомпрометированных системной гипоперфузией. В соответствии с этим выбор антибактериального препарата смещается к цефалоспоринам III-IV поколений - цефтриаксону, цефипиму (смешанный грам+ и грам- спектр), в т.ч. обладающим антианаэробной активностью - цефокситину, цефотетану или к антибиотикам других групп: ингибиторозащищенным аминопенициллинам - ко-амоксиклав, пиперациллин/тазобактам и др.; фторхинолонам - ципро-, пефло-, лево-флоксацин или карбопенемам - имипенем, меропенем.
Антимикробная терапия ИО осуществляется в двух вариантах:
1. Эмпирическая (стартовая) антибактериальная терапия - до получения результатов антибиотикограммы. Она может осуществляться как в варианте монотерапии, так и комбинацией антибиотиков.
Применяемые препараты:
- цефалоспорины II-III поколений (цефотаксим, цефтазидим);
- защищенные пенициллины (амоксициллин\клавуланат; пипе-рациллин\тазобактам; тикарциллин\клавуланат);
- фторхинолоны (ципрофлоксацин);
- карбопенемы (имипенем, меропенем).
Выбор конкретного препарата определяется локализацией первичного очага (табл. 11.2).
Таблица 11.2. Выбор
схемы эмпирической антибактериальной терапии сепсиса в зависимости от
локализации первичного очага инфекции (Руднов В.А.,
Локализация первичного очага инфекции | Вероятные возбудители | Схемы эмпирической антибактериальной терапии |
Ротоглотка | Streptococcus spp., Staphylococcus spp., Anaerobes | Ко-амоксиклав ? нетил-мицин или тобрамицин |
Окончание таблицы 11.2
Локализация первичного очага инфекции | Вероятные возбудители | Схемы эмпирической антибактериальной терапии |
Средостение | Enterobacteriaceae, Anaerobes | Цефотаксим или цефтриак- сон? амикацин +метрони- дазол; Ципрофлоксацин или пефлоксацин+метрони- дазол; Имипенем |
Легкие (внебольничная пневмония) | S.pneumoniae, Enterobacteriaceae, Legionella | Цефотаксим или цефтри-аксон ? эритромицин или спирамицин |
Легкие (госпитальная пневмония, развившаяся вне ОРИТ) | Enterobacteriaceae, S.aureus | Цефтазидим или ципрофлоксацин или цефепим?амикацин |
Легкие (госпитальная пневмония, развившаяся в ОРИТ, вентиля-тор-ассоциированная пневмония) | Pseudomonas aeruginosa, Acinetobacter spp., Klebsiella pneumonia, Enterobacteriaceae, S.aureus | Цефтазидим или ципрофлоксацин или цефепим ? амикацин; Имипенем или меропенем |
Брюшная полость | Enterobacteriaceae, Enterococcus spp., Bacteroides | Ко-амоксиклав + амикацин; Пиперацилин/тазобактам + амикацин; Тикарциллин/клавуланат + амикацин; Имипенем + метронидазол |
Почки | Enterobacteriaceae, чаще E.coli | Цефотаксим или ципрофлоксацин ? амикацин; Имипенем |
Кожа и мягкие ткани | S.aureus, Enterobacteriaceae | Ко-амоксиклав или пипера-циллин/тазобактам ? нетил-мицин |
Матка | Enterobacteriaceae, Streptococcus spp., Anaerobes, Staphylococcus spp. | Ко-амоксиклав + нетилми-цин или тобрамицин; Цефотаксим+нетилмицин + метронидазол; Имипенем |
Ангиогенный сепсис (катетер-связанная инфекция, сепсис у наркоманов) | S.aureus, S.epidermidis | Оксациллин + нетилмицин; Ванкомицин ? рифампицин |
Метронидазол обязательно включается в схему антимикробной терапии при выборе цефалоспоринов или фторхинолонов в качестве базовых препаратов у пациентов с абдоминальной и кожной формой хирургической инфекции. Аминогликозиды могут быть добавлены в схему терапии по решению лечащего врача. В случае внебольничной инфекции используются любые из аминогликозидов II-III поколений, при госпитальной инфекции препаратом выбора является амикацин.
В зависимости от распространенности и выраженности инфекционного процесса антибиотики следует вводить паравульнарно, внут-рикостно, внутримышечно, внутривенно, внутриартериально, эндо-лимфатически. Чем тяжелее протекает инфекция, тем чаще показано сочетание нескольких способов введения.
2. Аргументированная (направленная) антибактериальная терапия - это назначение/смена антимикробных средств по результатам посевов крови, мочи, мокроты, отделяемого ран и антибиотикограмме. При необходимости комбинированной терапии в пределах названных групп антибиотиков возможен подбор препаратов по данным антибио-тикограмм.
В последние годы при планировании этиотропного лечения ИО тяжелых и крайне тяжелых ранений предлагается использовать принцип «деэскалационной терапии» (т.е. терапии, не предусматривающей расширение числа применяемых антибиотиков). При этом первоначально назначается наиболее эффективный из имеющихся в настоящее время антибиотиков широкого спектра действия (например: ими-пенем/циластатин - группа карбопенемов) с последующим переходом на направленную терапию по данным антибиотикограммы.
Особенности консервативного лечения анаэробной инфекции.
Консервативное лечение анаэробной инфекции необходимо начинать до начала операции.
1. Предоперационная подготовка. Стабилизация
гемодинамики и устранение гиповолемии достигается введением в течение
0,5-1,5 ч кристал-лоидных растворов с антибиотиками в высших разовых
дозах (антибактериальная терапия анаэробной инфекции изложена ниже),
растворов гидроксиэтилкрахмала или других коллоидов в сочетании с
инотропной подддержкой (дофамин в дозе 5 и более мкг/кг/мин) в общем
объеме 1,0-
противовоспалительная блокада»: введение в окружность очага большого количества раствора (250-500 мл и более), содержащего анестетик (лидокаин, новокаин), антибиотики, 100,0 5% раствора метронидазола, ингибиторы ферментов (гордокс 200 000-300 000 ЕД), глюкокортикоиды (гидрокортизон 125-375 мг, преднизолон 60-90 мг) - с целью замедления распространения воспалительно-экссудативного процесса.
2. Интраоперационная терапия. Продолжается инфузионная и транс-фузионная терапия, обеспечивающая антитоксический эффект (белковые препараты, альбумин, плазма). Операция заканчивается повторным проведением «противовоспалительной блокады» (см. пп. 1.) в зоне серозного воспалительного отека тканей. Большое количество инъецируемой жидкости, вводимое для промывания пораженных экзотоксинами тканей, выполняет существенную антитоксическую функцию. Полость раны рыхло дренируется полосами марли, пропитанными раствором перекиси водорода, детергентов или антисептиков с двухтрехкратной сменой повязки в течение суток. Высокоэффективным методом консервативного лечения является применение угольных сорбентов.
3. Послеоперационная терапия. Наибольшую
опасность в первые часы и сутки после операции представляет ОДН и
нарастающая анемия. Необходимо проведение продленной или длительной
ИВЛ, массивной трансфузионно-инфузионной терапии, применение белковых
препаратов (
При развитии сердечно-сосудистой недостаточности проводится инотропная поддержка (дофамин от 5 мкг/кг/мин.), целесообразно включение в схему лечения глюкозо-инсулино-калиевой смеси (40% раствор глюкозы 400,0, 5% раствор калия хлорида 200,0, инсулина 160 ЕД!).
Проводится патогенетическое лечение ПОН в соответствии с выявляемой патологией.
Гипербарическая оксигенация является важным мероприятием, входящим в комплекс лечебных мер при анаэробной раневой инфекции.
Пассивная иммунизация. При клостридиальной инфекции внутривенно вводится 150 000 МЕ сыворотки (по 50 000 МЕ сывороток анти-перфрингенс, антиэдематиенс и антисептикум). Сыворотка разводится в 5-10 раз 0,9% раствором хлорида натрия, вводится медленно, не более 25-30 капель в 1 мин.
Антибактериальная терапия анаэробной инфекции. Скоротечность
анаэробного процесса, его генерализованный характер, невозможность в
первые часы после установления диагноза достоверно идентифицировать
возбудителей и их чувствительность определяют жизненные показания для
проведения эмпирической антибактериальной терапии с помощью наиболее
мощных современных антибактериальных препаратов, эффективных в
отношении анаэробов. Наиболее эффективной является комбинация
карбопенемов (имипенем, меро-пенем 2 - 4 г/сут внутривенно и
Если при микроскопии мазков раневого отделяемого, окрашенных по Граму, установлена клостридиальная или грамположительная кокковая анаэробная инфекция, препаратом выбора является бензилпе-нициллин (40-80 млн ЕД/сут). Антибиотиками резерва в этом случае считаются карбопенемы, цефамицины, обладающие антианаэробной активностью, - цефокситин (2г в/в каждые 6 ч), цефметазол и цефо-тетан, доксициклин (100 мг 2 раза в сут внутривенно).
Высокой активностью и широким спектром действия по отношению к грамположительным и грамотрицательным неклостри-диальным анаэробам обладает клиндамицин (600 мг 4 раза в сут). Антибиотиком резерва в отношении грамотрицательных анаэробов является цефокситин. Кроме этих препаратов, достаточный эффект может быть получен от рифампицина и линкомицина. Все указанные антибиотики вводятся в максимальных дозах.
Аминогликозиды не обладают антианаэробной активностью, но должны применяться для подавления аэробного компонента микробной ассоциации вместе с цефалоспоринами.
11.4. КОМПЛЕКСНОЕ ЛЕЧЕНИЕ СЕПСИСА У РАНЕНЫХ
Лечение сепсиса (без ПОН) может быть обеспечено выполнением двух основных мероприятий:
• хирургической санацией инфекционного очага; •проведением адекватной антибактериальной терапии и симптоматического лечения. В случае неэффективности указанной терапии - либо не санирован инфекционный очаг, либо нерациональна комбинация антибактериальных препаратов.
Лечение тяжелого сепсиса (сепсис и ПОН).
• Хирургическая санация инфекционного очага (независимо от сроков возникновения они должны подвергаться ВХО с активным дренированием).
• Комплексная многокомпонентная интенсивная терапия. В последние годы признано целесообразным применение лекарственных препаратов и способов лечения, эффективность которых подтверждена с позиций доказательной медицины. В их основе лежит положение о том, что в практической медицине должны применяться только:
- методы и препараты, эффективность которых подтверждена обширной клинической практикой:
■ ранняя рациональная антибиотикотерапия;
■ своевременная респираторная поддержка;
■ использование лекарственных средств для сосудистой и инотропной поддержки;
■ коррекция гиповолемии;
■ искусственная нутритивная поддержка;
■ гемодиализ/гемофильтрация при развитии ОПН. - препараты, эффективность которых доказана в проспективных
контролируемых рандомизированных исследованиях, - иммуноори-ентированная терапия:
■ пентаглобин при развитии септического шока;
■ ронколейкин в профилактике сепсиса и комплексной терапии тяжелого сепсиса.
- методы и препараты, использование которых целесообразно с позиций патогенеза, однако их результативность доказана лишь экспериментально и не подтверждена корректными клиническими испытаниями:
■ управляемая гипокоагуляция, использование ингибиторов протеаз, криоплазмы, антиоксидантов, пентоксифиллина.
Методы, применение которых признано неэффективным при лечении сепсиса: гемосорбция, внутрисосудистое лазерное облучение крови, непрямое электрохимическое окисление крови гипохлоритом натрия, внутривенное введение озонированных растворов кристаллоидов, инфузия ксеноперфузата, другие методы экстракорпоральной гемокоррекции.
Общие принципы комплексного лечения сепсиса представлены на рис. 11.8.
Лечение септического шока:
• немедленно вводится 500-2000 мг (в зависимости от состояния гемодинамики) преднизолона внутривенно;
• 5000-10 000 ЕД гепарина струйно, затем 30 000-50 000 ЕД - внутривенно в течение суток (контроль времени свертывания крови);
• инфузионная терапия под контролем почасового диуреза и ЦВД. При отсутствии признаков обезвоживания инфузия начинается с реологически активных растворов (реополиглюкин, гемодез).
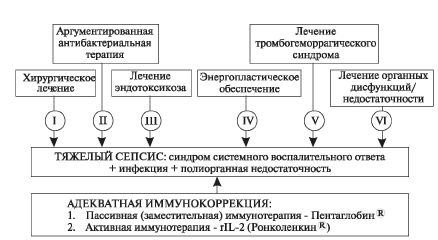
Рис.11.8. Основные направления лечения сепсиса
При обезвоживании вводятся сначала кристаллоидные растворы. Общий объем инфузии должен составить 3-4 л в сутки;
• инотропная поддержка (допамин). Совершенно недопустимым при септическом шоке является применение катехоламинов с периферическим ангиотропным действием, вызывающих немедленное и значительное ухудшение состояния кровообращения;
• эмпирическая антибактериальная терапия проводится комбинацией цефалоспоринов 3-го поколения (цефотаксим, цефтазидим, цефоперазон, цефтриаксон) или фторхинолонами (ципрофлок-сацин), аминогликозидами (нетилмицин, амикацин), применяемых в максимально допустимых дозах, и метронидазола. Однако наиболее эффективна эмпирическая монотерапия карбопенема-ми (имипенем, меропенем);
• объем хирургического вмешательства (с целью санации септических очагов) при септическом шоке определяется состоянием пациента. При невозможности выполнить радикальную вторичную хирургическую обработку (ВХО) - дальнейшая генерализация инфекционного процесса может быть временно приостановлена проведением «противовоспалительной блокады» с кортикостероидами, ингибиторами протеаз и антибиотиками.
При молниеносном (грамположительном, стафилококковом) сепсисе лечение должно быть направлено на борьбу с левожелудочко-вой недостаточностью и на срочную неспецифическую и специфическую детоксикацию (нейтрализация экзотоксина). На фоне инотропной поддержки (дофамин в возрастающих дозировках) и введения сердечных гликозидов, гепарина, ингибиторов протеаз проводится дегидратация (в отличие от септического шока!) с целью снятия дополнительной нагрузки на сердце (лазикс 40-60 мг внутривенно). Интенсивная инфузионная терапия, даже при низком АД, приводит к быстрой гибели от сердечной недостаточности. Проводится монотерапия карбопенемами или цефалоспоринами 3-4 поколений, или комбинация ингибиторозащищенных амино-пенициллинов с аминогликозидами. Проводится непрерывная в течение 72 ч внутривенная инфузия препаратов иммуноглобулинов (пентаглобин).
11.5. ПОМОЩЬ НА ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ
Задачами медицинской помощи по профилактике ИО ранений и травм на догоспитальном этапе являются: предотвращение вторичного микробного загрязнения, устранение ишемии тканей в окружности раны, предотвращение распространения и подавление возбудителей в ране.
Первая и доврачебная помощь. На поле боя для профилактики раневой инфекции особо важными являются:
- наложение асептической повязки с помощью пакета перевязочного индивидуального (ППИ); - применение щадящих способов временной остановки кровотечения с максимальным сохранением кровотока в дистальных участках конечностей; - транспортная иммобилизация, в т.ч. при обширных повреждениях мягких тканей; - пероральный прием доксициклина из аптечки индивидуальной (АИ). Первая врачебная помощь. Наиболее эффективные мероприятия, направленные на предупреждение ИО ранений:
- исправление или смена сбившихся асептических повязок;
- паравульнарные новокаиновые блокады с высшими разовыми
дозами антибиотиков; - парентеральное введение профилактических доз антибиотиков; - замена жгута на иной способ временной остановки кровотечения для уменьшения ишемии конечности; - иммобилизация поврежденной области табельными средствами. Квалифицированная медицинская помощь. В современных условиях большинство раненых доставляется на этап оказания квалифицированной медицинской помощи не позднее 2-3 ч. Средние сроки пребывания раненых в омедб (омедо) не превышают 2 сут. В этих условиях ИО на этапе оказания квалифицированной медицинской помощи, как правило, не успевают развиться. Профилактика ИО ранений включает следующие мероприятия:
• Обязательное выполнение ПХО огнестрельных ран при проведении оперативных вмешательств.
• Отказ от наложения первичного шва после хирургической обработки огнестрельных ран и ампутаций конечностей.
• Паравульнарное введение антибиотиков широкого спектра действия в 100-300 мл 0,25% раствора новокаина как в процессе ПХО, так и раненым, которым выполняется только туалет ран.
• Профилактическое внутривенное введение антибиотиков широкого спектра действия во время подготовки раненого к операции или введения в наркоз. Этот вид антимикробной профилактики продолжается до устранения условий, представляющих высокий риск возникновения ИО (открытые раны, очаги некроза, симптомы травматического шока и т.п.), с периодичностью, позволяющей поддерживать терапевтическую концентрацию применяемого антибиотика в крови.
• При выполнении ПХО у раненых с огнестрельными переломами костей производится чрескостное промывание тканей растворами с антибиотиками.
• Осуществляется жесткая иммобилизация переломов: - транспортная иммобилизация табельными шинами, укрепленными
гипсовыми кольцами, у раненых, которым ПХО не выполнялась; - лечебно-транспортная иммобилизация стержневыми аппаратами комплекта КСТ-1 либо модулями аппарата Илизарова после выполнения ПХО.
• При высоком риске анаэробной инфекции (проникающие ранения груди и живота с повреждением полых органов, повреждения магистральных сосудов, сопровождающиеся ишемией конечностей), антимикробная профилактика осуществляется антибиотиками широкого спектра действия в комбинации с метронидазо-лом (начальная доза 200,0 0,5% раствора).
• Все раненые, у которых подозревается анаэробная инфекция, не подлежат дальнейшей эвакуации с этапа оказания квалифицированной медицинской помощи. Они направляются в палатку для лечения анаэробной инфекции («анаэробную»). Для исключения контактного пути передачи инфекции необходимо для раненых с анаэробной инфекцией создать должный санитарно-гигиенический режим. Раненые становятся транспортабельными после того, как будут устранены явления анаэробной инфекции, то есть при благоприятном течении процесса эвакуация ориентировочно оказывается возможной лишь через 2-3 суток после оперативного вмешательства. Специализированная медицинская помощь раненым с ИО включает весь комплекс современных лечебно-профилактических мероприятий
при раневой инфекции. Приобретает существенное значение дифференциальная диагностика между нагноением раны и раневой инфекцией. Раненые и пораженные с острыми формами раневой инфекции не подлежат эвакуации в ТГЗ до устранения осложнений. Даже кратковременный вынужденный перерыв в полноценном лечении приводит к ухудшению течения раневой инфекции и ее генерализации. При затяжных формах ИО, требующих длительного лечения и повторных реконструктивных вмешательств, раненые (после стабилизации состояния) эвакуируются в тыл страны.
11.6. СТОЛБНЯК
Общий столбняк (тетанус) - это специфическая форма анаэробной раневой инфекции с минимальными местными проявлениями и общей тяжелой интоксикацией организма вследствие избирательного поражения ЦНС. Изредка встречаются местные формы столбняка конечностей, которые не представляют серьезной опасности. Однако местный столбняк лица, головы сопряжен с риском опасных расстройств дыхания.
По этиологии различается столбняк раневой (после ранений, ожогов или отморожений) и послеоперационный, сравнительно часто связанный с удалением старых инородных тел. Кроме того, в тяжелой форме столбняк может возникнуть после криминальных абортов и родов в домашних условиях (тетанус новорожденных). При отсутствии видимых повреждений говорят об идиопатическом столбняке. В таких случаях возбудитель попадает в глубокие трещины подошвенной поверхности стоп (хождение босиком) либо в небольшие раны, успевшие зажить к началу заболевания.
В истории прошлых войн частота столбняка среди раненых была высокой. В годы Первой мировой войны в русской армии столбняк регистрировался в 5-7 случаях из 1000 раненых. В период Великой Отечественной войны частота столбняка, благодаря внедрению ранней ПХО ран, сократилась среди советских военнослужащих в 10 раз (0,5-0,7 на 1000 раненых). В то же время, в армиях государств, заблаговременно иммунизировавших призываемые контингенты для участия в войне (США, Англия), наблюдались лишь единичные случаи этой инфекции. В послевоенные годы в нашей стране, как и в других развитых странах мира, заболеваемость столбняком значительно снизилась, благодаря широкомасштабной иммунизации населения
(в т.ч. военнослужащих) вакцинами, содержащими столбнячный анатоксин [вакцина адсорбированная коклюшно-дифтерийно-стол-бнячная (АКДС) и др.].
Возбудитель столбняка - Clostridium tetani - широко распространенная в природе грамположительная палочка с булавовидным уплотнением на конце относится к строгим анаэробам; в процессе роста образует споры, очень устойчивые к факторам внешней среды. C. tetani находит благоприятные условия для выживания и размножения в глубоких ранах, содержащих инородные тела и некротизированные, сильно загрязненные ткани. Возбудители вырабатывают экзотоксин - один из самых сильных природных нейротропных ядов.
Тетанотоксин состоит из двух основных фракций - тетаноспаз-мина, поражающего нервную систему, и тетанолизина, вызывающего гемолиз. Токсин всасывается и поступает в кровь и лимфу, распространяется по всему организму, достигая в составе нервных стволов двигательных центров спинного мозга и ствола головного мозга. Гема-тоэнцефалический барьер непроницаем для тетанотоксина. В ЦНС избирательно поражаются структуры, ответственные за функцию центрального торможения (вставочные нейроны полисинаптических рефлекторных дуг). В результате выключается тормозной компонент двигательного акта, а процессы возбуждения остаются на прежнем уровне активности. Как показали современные исследования, тета-нотоксин также направленно действует на ферментативные системы, участвующие в проведении импульса через межнейронные синапсы. Специфическое воздействие токсина на важные центры мозгового ствола проявляется в тяжелых случаях гипертермией, повышенной потливостью, тахикардией и наклонностью к артериальной гипотен-зии. Обнаружено прямое патологическое влияние токсина на сердце, легкие, печень и систему кровообращения.
К продромальным клиническим проявлениям общего столбняка относятся вялость, бессонница, головная боль, болезненные ощущения в затылке, спине, парестезии на лице. В зоне раны - «входных воротах» инфекции - могут наблюдаться фибриллярные подергивания мышц, возникновение или усиление болевых ощущений. Вскоре появляются и нарастают симптомы «классической триады», описанной еще Гиппократом: тризм, дисфагия, ригидность затылочных мышц. В результате поражения мимической мускулатуры лицо раненого приобретает улыбающееся и вместе с тем страдальческое выражение («сардоническая улыбка»). В ранние сроки развития столбняка появляется
напряжение передней стенки живота, которое может послужить причиной напрасной лапаротомии (рис. 11.9).
Ригидность затылка обычно бывает первым проявлением гипертонуса мышц, распространяющегося в нисходящем порядке, - на длинные мышцы спины, поясничную область, все туловище, включая конечности. Распространенная мышечная ригидность представляет тонический компонент судорог, к которым вскоре присоединяются клонические судороги. Вначале их провоцируют сильные внешние раздражители, но через некоторое время и при тяжелых формах инфекции они возникают спонтанно. Клонико-тонические (тетани-ческие) судороги характерны только для столбняка. В тяжелых случаях очередной либо внезапно развивающийся судорожный приступ приводит к остановке дыхания (апноэтический криз).
Чем глубже специфическая интоксикация организма, т.е. чем тяжелее инфекция, тем короче инкубационный и начальный периоды, и тем быстрее нарастают все клинические симптомы. Инкубационный период (время от момента ранения до первого симптома) в нетяжелых случаях столбняка составляет 2-3 нед; период начала заболевания
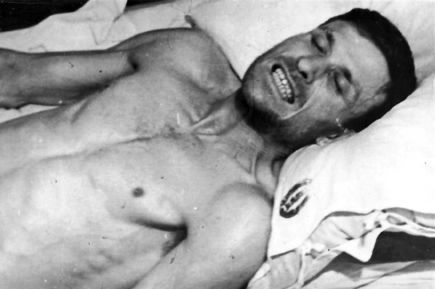
Рис. 11.9. «Сардоническая улыбка» у раненого со столбняком
(время от первого симптома до генерализации судорог) - не менее 4 сут. При тяжелых формах столбняка эти периоды короче: инкубационный - 7-9 сут, период начала заболевания - 1-3 сут.
Диагноз столбняка в раннем периоде непрост. Столбняк часто ошибочно подозревают при возникновении судорог на фоне тех или иных внешних повреждений. Для дифференциальной диагностики следует иметь в виду, что для общего столбняка патогномонична «классическая» триада симптомов (тризм, дисфагия, ригидность затылочных мышц). Кроме того, для столбняка характерна непрерывно нарастающая динамика всех симптомов (отсутствие «светлых промежутков»), сохраненное сознание и неучастие в судорогах дистальных отделов конечностей (кистей рук, стоп ног).
Современное лечение столбняка, основанное на реанимационных принципах, должно проводиться в отделении реанимации и интенсивной терапии. По возможности выделяется тихая изолированная палата с рассеянным светом и постоянным наблюдением (опасность внезапного возникновения смертельной судорожной асфиксии).
Рана - предполагаемые «входные ворота» инфекции - подлежит ревизии сразу после поступления раненого или при возникновении у него первых признаков инфекции. Показана срочная вторичная хирургическая обработка раны с удалением всех инородных тел, некротизиро-ванных тканей и тщательное промывание раствором перекиси водорода. В дальнейшем рана ведется открытым способом со сменой влажно-высыхающих повязок с частотой 2-3 раза в сутки. С еще не заживших ран к моменту проявления столбняка швы подлежат удалению и под анестезией производится ревизия, вторичная хирургическая обработка. В общем лечебном комплексе ведущая роль принадлежит проти-восудорожной терапии, особенно устранению судорог, угрожающих расстройствам дыхания:
• Широко применяется диазепам (бензодиазепиновый транквилизатор, агонист ГАМК), доза препарата постепенно увеличивается до получения желаемого результата. Может потребоваться 250 мг/сут и более. Используются также лоразепам и мидазолам, действующие дольше диазепама. Препараты, благодаря короткому периоду полувыведения, вводятся путем длительной внутривенной инфузии. •В лечении тетанических судорог эффективны внутримышечные инъекции нейроплегической смеси (аминазин + проме-дол + димедрол + скополамин или атропин). Внутривенно
• вводится седуксен (реланиум), в клизмах - хлоралгидрат. Противосудорожная эффективность перечисленных средств более выражена при их комбинированном применении; при этом заметно снижаются их дозы. Целесообразно действие стандартной нейроплегической смеси усиливать последующим введением гексенала или тиопентала в умеренной дозировке. •Главная цель противосудорожной терапии - устранить угрозу
асфиксии при минимальном седативном эффекте. При лечении заболевших столбняком тяжелой степени важна хорошая организация и главное - обеспечение постоянной готовности к незамедлительному устранению внезапных апноэтических кризов. Угрозу судорожной асфиксии удается устранить, если в тяжелых случаях заранее наложить трахеостому, ввести подключичный катетер и держать наготове миорелаксанты. Возле раненого со столбняком должен постоянно находиться аппарат для ИВЛ и электроотсасыватель.
Когда применение противосудорожных препаратов не устраняет угрозы судорожной асфиксии, а их дозы приводят к чрезмерному угнетению дыхания, показан переход на систематическое введение мио-релаксантов с переводом на режим длительной ИВЛ. Тогда лечение столбняка в течение ближайших 1-1,5 недель превращается в типичную интенсивную терапию. Ее ключевыми моментами являются: адекватное проведение ИВЛ, систематическая санация трахеи и бронхов, уход за трахеостомой, восполнение энергетических затрат организма, предупреждение легочных осложнений (ателектазы и др.). Содержание эритроцитов восстанавливается переливаниями крови, утрата воды, электролитов, белков - инфузиями альбумина, плазмы, солевых и энергетических растворов. Кишечник систематически очищается с помощью клизм и слабительных.
Антитоксическая терапия, направленная на связывание и разрушение свободного тетаноспазмина, находящегося в крови и непосредственно в ране, обеспечивается введением токсиннейтрализующих антител. На токсин, успевший связаться с нервными клетками, они не действуют. Препарат выбора - противостолбнячный иммуноглобулин (ПСЧИ - противостолбнячный человеческий иммуноглобулин). Он вводится безотлагательно, в дозе 3000 - 6000 ед в/м (обычно за несколько инъекций из-за большого объема). ПСЧИ желательно ввести до выполнения ВХО раны. Целесообразность обкалывания им раны или введения его проксимальнее раны сомнительна. Дополнительные
дозы препарата не требуются, так как он имеет длительный период полувыведения. Вместо ПСЧИ могут использоваться препараты иммуноглобулинов для внутривенного введения.
Применяется и противостолбнячная сыворотка ПСС (сыворотка противостолбнячная лошадиная очищенная концентрированная жидкая). Она дешевле противостолбнячного иммуноглобулина, но имеет более короткий период полувыведения и нередко вызывает аллергические реакции немедленного типа (анафилактический шок) и сывороточную болезнь. ПСС с лечебной целью вводится в рекомендуемой действующей инструкцией дозе 120000 МЕ. Сыворотка разводится на изотоническом растворе NaCl (не менее, чем 1:10) и половина дозы вливается в первые часы начинающегося лечения; остальное вводится однократно в мышцу.
Антибактериальная терапия применяется
для уничтожения вегетативной формы Clostridium tetani , хотя
эффективность такой терапии не доказана. Обычно назначается
бензилпенициллин (10-12 млн ед/ сут внутривенно в течение 10 суток) или
метронидазол (500 мг внутрь или в/в каждые 6 ч или
Перенесенный столбняк не оставляет после себя иммунитета, и после выздоровления раненые подвергаются трехкратной иммунизации столбнячным анатоксином (анатоксин столбнячный очищенный адсорбированный жидкий).
Летальность даже при современном уровне лечения столбняка остается высокой (35-40%), в основном за счет тяжелых легочно-сердечных осложнений на фоне легочных ателектазов и пневмоний в группе раненых, переводимых на режим многодневной миорелаксации и ИВЛ. Поэтому столь важна массовая иммунизация вакциной АКДС, проводимая в нашей стране с раннего детского возраста, которая создает надежную защищенность от столбняка уже после 3-й - 4-й прививки.
На этапах медицинской эвакуации у военнослужащих, привитых трехкратно, для экстренной иммунизации в случаях ранений и других наружных повреждений кожи или слизистых оболочек применяется только столбнячный анатоксин 1,0-0,5 мл подкожно однократно. У непривитых раненых, особенно при наличии загрязненных и обширных ран,
а также отсутствии данных о вакцинации показано введение противостолбнячного иммуноглобулина (ПСЧИ). ПСЧИ вводится в дозе 250 ед в/м; после этого в течение 4-6 нед обеспечивается защитный уровень антител. Если вместо него приходится использовать противостолбнячную сыворотку, она вводится в дозе 3000-6000 ед.
При подозрении на развитие столбняка показана срочная эвакуация воздушным транспортом на этап специализированной хирургической помощи (профиль госпиталя определяется полученными ранениями).
Контрольные вопросы:
1. Назовите «классические» симптомы местного воспаления?
2. Чем отличается патогенез ИО травм от патогенеза хирургических инфекционных заболеваний?
3. В чем отличие нагноения раны от раневой инфекции?
4. Какие морфологические формы гнойной раневой инфекции следуст выделять?
5. Какими разделами представлена структура диагноза ИО ранений и травм?
6. Чем отличается ВХО ран от ПХО?
7. Назовите этиологические варианты анаэробной инфекции.
8. Какие критерии свидетельствуют о положительном синдроме СВО?
9. Как обоснованно поставить диагноз сепсиса? 10.Для какого вида сепсиса (грам+ или грам-) характерны сильная
головная боль, бессонница, нарушение сознания, анорексия?
11.Какие мероприятия обеспечивают профилактику раневой инфекции на этапах медицинской эвакуации?
12.Описанная Гиппократом «классическая триада» признаков характеризует начальные проявления особого вида раневой инфекции. Какая раневая инфекция начинается с этих проявлений? Опишите их.