Военно-полевая хирургия.: учебник/Под ред. Е.К. Гуманенко.- 2-е издание. - 2008. - 768 с. : ил.
|
|
|
|
ГЛАВА 8 ТРАВМАТИЧЕСКИЙ ШОК И ТРАВМАТИЧЕСКАЯ БОЛЕЗНЬ
Травматический шок определяется как наиболее часто встречающаяся клиническая форма тяжелого состояния раненого, развивающаяся вследствие тяжелой механической травмы или ранения и проявляющаяся синдромом низкого минутного объёма кровообращения и гипоперфузии тканей.
Необходимо знать, что, кроме травматического шока, существуют и другие клинические формы тяжелого состояния раненых, обусловленные ранением или травмой - травматическая кома, ОДН и острая сердечная недостаточность 19. Они имеют специфические пусковые механизмы, требуют специального подхода к диагностике и лечению, а поэтому будут рассмотрены в соответствующих главах.
Частота травматического шока у раненых в современных условиях ведения боевых действий возрастает, достигая 25%. Это обусловлено увеличением поражающей силы оружия, неблагоприятными климатическими условиями (жаркий климат, горно-пустынная местность) и связанными с ними трудностями адаптации, широкомасштабным использованием авиамедицинской эвакуации - в лечебные учреждения доставляются раненые с крайне тяжелой боевой травмой, многие из которых не смогли бы перенести длительную эвакуацию наземными видами транспорта.
8.1. ЭВОЛЮЦИЯ ВЗГЛЯДОВ НА ШОК
И СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
О ЕГО ПАТОГЕНЕЗЕ
Первые наблюдения необычной заторможенности при тяжелых ранениях принадлежат Амбруазу Паре (XVI в.). Медицинский термин «шок» (shock) появился при переводе на английский язык хирургом Джеймсом Латта изданной в
19 Тяжесть состояния раненого - интегративный показатель, рассчитываемый путем суммирования наиболее информативных симптомов с помощью шкал «ВПХ-СП» или «ВПХ-СГ» (см. Главу 5). Клиническими формами тяжелого состояния раненых являются: травматический шок и терминальное состояние (63%), травматическая кома (18%), ОДН (13%),острая сердечная недостаточность (6%)
хирурга Анри Ледрана, в которой аналогичным словом («secouse», фр. - удар, потрясение) описывалось тяжелое состояние раненых при огнестрельных ранениях.
В истории учения о травматическом шоке можно выделить 3 периода - описательный, теоретической разработки концепции и современный - научно-практический, когда изучение патофизиологических процессов в ответ на тяжелые травмы было перенесено из экспериментальных лабораторий в специализированные «противошоковые» центры.
Среди многих хирургов разных стран, описывавших травматический шок, возвышается фигура Н.И. Пирогова, который ярко и глубоко представил картину травматического шока у раненых: «С оторванною ногою или рукою лежит такой окоченелый на перевязочном пункте неподвижно; он не кричит, не вопит и не жалуется; не принимает ни в чем участия и ничего не требует; тело его холодно, лицо бледно, как у трупа; взгляд неподвижен и обращен в даль, пульс, как нитка, едва заметен под пальцем и с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя чуть слышным шепотом, дыхание тоже едва приметно. Рана и кожа почти вовсе нечувствительны; но если большой нерв, висящий из раны, буде чем-нибудь раздражен, то раненый одним легким сокращением личных мускулов обнаруживает признак чувства. Иногда это состояние проходит через несколько часов от употребления возбуждающих средств, иногда же оно продолжается до самой смерти» 20.Особую роль в формировании учения о шоке сыграли теории травматического шока: нейрогенная, кровоплазмопотери и токсическая.
Нейрогенную теорию травматического шока выдвинул в 1890-х гг. американский хирург Г . К р а й л ь . В ХХ в. ее всесторонне разрабатывал отечественный патофизиолог И.Р. Петров. Сторонники нейрогенной (нервно-рефлекторной) теории связывали «первичную поломку», происходящую в организме после тяжелых ранений и травм, с мощной нервно-болевой импульсацией из зон тяжелых механических повреждений в ЦНС и в органы-мишени (надпочечники и другие эндокринные органы). Действительно, современными методами подтверждается возникновение при тяжелой травме патологических
20 Пирогов Н.И. Начала общей военно-полевой хирургии, взятые из наблюдений военно-госпитальной практики и воспоминаний о Крымской войне и Кавказской экспедиции 1864, 1865-1866 гг. - Собрание сочинений, Т. 5. - М., 1961. - С. 71
изменений в ЦНС, происходящих на субклеточном уровне. Не исключено, что они закладывают основу для развития более поздних осложнений. Однако основные положения нейрогенной теории травматического шока не подтвердились: она утверждает чрезмерную роль нервно-болевых влияний, но для доказательства ведущей роли нервно-болевых факторов использовались неадекватные экспериментальные модели (многочасовые раздражения электротоком крупных нервных стволов или многочисленные удары тяжелыми металлическими предметами по конечности). Кроме того, исследования всех отделов нервной системы не обнаружили признаков ее угнетения при травматическом шоке. Торможение больших полушарий действительно наступает на заключительной стадии терминального состояния - агонии и клинической смерти, но как прямое следствие критического снижения кровообращения в головном мозге. Вместе с тем, указание на ограниченную роль болевых импульсов в механизмах развития травматического шока не должно давать повода к недооценке обезболивания.
В самом начале ХХ в. английский исследователь А. Малколм отвел ведущую роль в механизме развития травматического шока острой кровоплазмопотере. Последующая разработка и широкое применение объективных методов определения объема кровопотери (прямые измерения ОЦК и др.) подтвердили абсолютно приоритетную роль острой кровопотери в патогенезе травматического шока. Тяжелым механическим повреждениям, сопровождающимся снижением АД, как правило, сопутствует острая кровопотеря, пропорциональная уровню гипотен-зии. Именно массивная кровопотеря формирует симптомокомплекс травматического шока. Теория кровоплазмопотери оказалась наиболее плодотворной для совершенствования лечебной тактики, поскольку нацеливала врачей на поиск источника острого кровотечения, вызывающего гемодинамическую катастрофу (травматический шок).
Признание ведущей роли острой кровопотери в патогенезе травматического шока все же не дает основания для отождествления шока травматического и геморрагического. При тяжелых механических повреждениях к патологическому влиянию острой кровопотери неизбежно присоединяется негативное действие боли - ноцицептивная импуль-сация, последствия висцеральных повреждений, а при ранах, сопровождающихся образованием обширных очагов первичного некроза (огнестрельные ранения), раздавливанием или размозжением тканей - выраженный эндотоксикоз. В системный кровоток поступают в большом количестве токсические субстанции - продукты разрушенных тканей,
нарушенного метаболизма, рассасывающихся обширных гематом. Все эти вещества отрицательно воздействуют на вегетативные центры в головном мозге, сердце, легкие, обеспечивающие адекватное кровообращение и дыхание. При нарушении целости полых органов живота в кровоток поступают токсические продукты, всасывающиеся через обширную поверхность брюшины. Перечисленные токсические вещества оказывают угнетающее действие на гемодинамику, газообмен и способствуют формированию необратимых изменений в клетках. Впервые на большую роль токсического фактора при тяжелых механических повреждениях обратили внимание в годы первой мировой войны французские врачи Э. К е н ю и П. Дельбе - авторы токсической теории травматического шока.
Таким образом, клиническую и патогенетическую основу травматического шока составляет синдром острого нарушения кровообращения (гипоциркуляции), возникающий вследствие сочетанного воздействия на организм раненого жизнеугрожающих последствий травмы, - острой кровопотери, повреждения жизненно важных органов, эндотоксикоза, а также нервно-болевых влияний. К этому выводу пришли отечественные ученые из «Группы ? 1», изучавшие травматический шок на полях сражений Великой Отечественной войны (Н.Н. Еланский, М.Н. Ахутин, 1945).
Взгляды на
травматический шок как синдром гипоциркуляции подтвердились в третьем
историческом периоде развития учения о шоке, хронологически совпавшем с
формированием в 1960-х гг. новой медицинской специальности -
реаниматологии. В эти годы стали организовываться специализированные
отделения и центры, где концентрировались тяжелопострадавшие с
явлениями травматического шока, а в их лечении принимали участие не
только хирурги и реаниматологи, но и клинические физиологи. В нашей
стране первый такой центр - научно-исследовательскую лабораторию по
изучению шока и терминальных состояний при кафедре и клинике
военно-полевой хирургии Военно-медицинской академии - создал известный
хирург А.Н. Беркутов в
непосредственной связи с лечением травматический шок стал рассматриваться не как научная теория, а как лечебно-тактическая концепция, т.е. методология патогенетически обоснованного лечения.
На сегодняшний день патогенез травматического шока упрощенно представляется следующим образом. В результате тяжелого ранения или травмы у раненого формируется один либо несколько (при множественных или сочетанных травмах) очагов повреждения тканей либо органов. При этом повреждаются сосуды различного калибра - возникает кровотечение; происходит раздражение обширного рецепторного поля - образуется массивное афферентное воздействие на ЦНС; повреждается более или менее обширный объем тканей, продукты их распада всасываются в кровь - возникает эндотоксикоз. При повреждении жизненно важных органов происходит нарушение соответствующих жизненно важных функций: повреждение сердца сопровождается снижением сократительной функции миокарда; повреждение легкого - снижением объема легочной вентиляции; повреждение глотки, гортани, трахеи - асфиксией. Так им образом, механизм развития травматического шока моноэтиологический (травма), но одновременно и полипатогенетический (перечисленные патогенетические факторы) в отличие от геморрагического шока (например, при колото-резаных ранениях с повреждением крупных сосудов), где патогенетический фактор один - острая кровопотеря.
Массивное афферентное воздействие на ЦНС (ноцицептивная афферентная импульсация) из очага (очагов) повреждения и информационное воздействие через барорецепторы стенок артериальных сосудов на центры вегетативной нервной системы (гипоталамус) об объеме кровопо-тери являются пусковым механизмом для запуска неспецифической адаптационной программы защиты организма. Основной задачей ее является выживание организма в экстремальной ситуации. Непосредственным «организатором» и «исполнителем» этой программы является гипота-ламо-гипофизарно-надпочечниковая система, реализующая эволю-ционно сформированные механизмы нейро-эндокрийной регуляции, направленные на спасение жизни раненого.
Получив информацию из центра и периферии, гипоталамус запускает адаптационную программу путем выделения стрессорных рили-зинг-факторов, воздействующих на соответствующие зоны гипофиза. Гипофиз, в свою очередь, резко усиливает инкрецию стрессорных гормонов и прежде всего адренокортикотропного гормона (АКТГ). Таким образом, в ответ на травму запускается стрессорный каскад нейрогуморальных взаимодействий, итогом которых является резкая
активация адреналовой и кортикальной систем надпочечников. Они выделяют в кровь большое количество адреналина, норадреналина и глюкокортикоидных гормонов.
Вслед за этим реализуются эффекторные механизмы адаптационной программы.
В результате усиления нервной симпатической эфферентации и резкого
выброса в кровоток большого количества катехоламинов (адреналина и
норадреналина) развивается генерализованный спазм мелких сосудов на периферии (конечности, таз, брюшная полость). Первой по времени реакцией, компенсирующей кровопотерю, является спазм емкостных сосудов вен. Веноконстрикция, снижающая емкость венозного резервуара, мобилизует для циркуляции до
При прогрессировании кровотечения и действии других факторов травматического шока снижается ОЦК и АД, развивается циркуля-торная и тканевая гипоксия. Включается второй уровень защиты. Для компенсации дефицита ОЦК, циркуляторной гипоксии, обеспечения должного объема кровообращения учащаются сердечные сокращения - развивается тахикардия, выраженность которой прямо пропорциональна тяжести шока. Компенсация гипоксии осуществляется и за счет замедления кровотока в легких в результате спазма посткапиллярных сфинктеров; замедление прохождения крови через легочные капилляры увеличивает время насыщения эритроцитов кислородом (рис. 8.1).
Перечисленные выше защитно-приспособительные реакции реализуются в течение первого часа после травмы, в патогенетическом отношении представляют собой стадию компенсации, а в клиническом - травматический шок I и II степени.
При тяжелых черепно-мозговых ранениях или травмах обязательным компонентом травмы является первичное либо вторичное (вследствие отека и дислокации головного мозга) повреждение структур межуточного мозга и ствола, где сосредоточены многочисленные центры нейрогуморальной регуляции всех жизненно важных функций человеческого организма. Главным результатом такого повреждения является несостоятельность адаптационной программы защиты организма. В поврежденном гипоталамусе нарушаются процессы образования рилизинг-факторов, нарушаются обратные связи между гипофизом и эффекторными эндокринными железами, прежде всего надпочечниками. Вследствие этого не развиваются централизация кровообращения и тахикардия, а обмен веществ приобретает невыгодный для организма гиперкатаболический характер. Развивается патогенетическая и клиническая картина травматической комы, для которой характерны: утрата сознания и рефлекторной деятельности, мышечный гипертонус вплоть до судорог, артериальная гипертензия
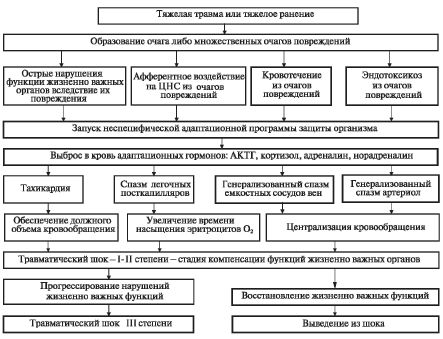
Рис. 8.1. Схема патогенеза травматического шока I-II степени
и брадикардия, т.е. симптомокомплекс, противоположный проявлениям травматического шока.
Если патогенетические факторы шока продолжают действовать, а медицинская помощь запаздывает либо неэффективна, защитные реакции приобретают противоположное качество и становятся патологическими, усугубляя патогенез травматического шока. Начинается стадия декомпенсации. В результате длительного генерализованного спазма мелких сосудов развивается микроциркуляторная гипоксия, обусловливающая генерализованное гипоксическое повреждение клеток, - главный фактор патогенеза затянувшегося в динамике травматического шока III степени.
Прогрессирующие расстройства транспорта кислорода в клетках сопровождаются выраженным снижением содержания аденозинтри-фосфорной кислоты (АТФ) - основного переносчика энергии, возникновением энергетического дефицита в клетках. Выработка энергии в клетках переходит на путь анаэробного гликолиза, и в организме накапливаются недоокисленные метаболиты (молочная, пировиноградная кислоты и др.). Развивается метаболический ацидоз. Тканевая гипоксия ведет к усилению перекисного окисления липидов, которое вызывает повреждение клеточных мембран. В результате деструкции клеточных мембран и энергетического дефицита прекращает работать высокоэнергетический калий-натриевый насос. Натрий проникает в клетку из интерстициаль-ного пространства, за натрием в клетку перемещается вода. К леточный отек вслед за деструкцией мембран завершает цикл клеточной гибели.
В результате деструкции лизосомальных мембран высвобождаются и поступают в кровоток лизосомальные ферменты,
которые активируют образование вазоактивных пептидов (гистамин,
брадикинин). Эти биологически активные вещества вместе с кислыми
анаэробными метаболитами вызывают стойкий паралич прекапиллярных
сфинктеров. Общее периферическое сопротивление критически падает, и артериальная гипо-тензия становится необратимой. Следует помнить, что при падении сАД ниже
важных органов, то есть одновременное нарушение функции легких, сердца, почек, печени и других органов желудочно-кишечного тракта, не достигшее пока еще критических значений.
Патологические процессы, происходящие в стадии декомпенсации, характерны для затянувшихся (на часы) случаев травматического шока. Быстро начатые и правильно проводимые реанимационные мероприятия часто бывают эффективными при травматическом шоке III степени, реже - при терминальном состоянии (в случаях изолированных ранений). Поэтому в широкую практику скорой помощи вошло правило «золотого часа», смысл которого состоит в том, что медицинская помощь при тяжелых травмах эффективна только в течение первого часа; за это время раненому должна быть оказана догоспитальная реаниматологическая помощь, и он должен быть доставлен в стационар.
Последней стадией развития патологических процессов при затянувшемся травматическом шоке III степени является прогрессиро-вание нарушений функции жизненно важных органов и систем. При этом нарушение их функции достигает критических значений, за порогом которых функция органов уже недостаточна для обеспечения жизнедеятельности организма - развивается полиогранная недостаточность (ПОН) (рис. 8.2).
В подавляющем большинстве случаев исходом ее является терминальное состояние и смерть. В отдельных ситуациях при великолепно организованной реаниматологической помощи в специализированных центрах по лечению тяжелых травм возможна коррекция полиорганной дисфункции жизненно важных органов и даже ПОН с помощью сложных дорогих и высокотехнологичных методов: ИВЛ аппаратами III-IV поколений с многочисленными режимами искусственного дыхания, многократные санационные фибробронхоскопии, больше-объемная экстракорпоральная оксигенация крови, различные методы экстракорпоральной детоксикации, гемофильтрация, гемодиализ, упреждающее хирургическое лечение, направленная антибактериальная терапия, коррекция нарушений в иммунной системе и т.п.
При успешной реанимации ПОН в большинстве случаев трансформируется в целый ряд осложнений, которые имеют свою этиологию и патогенез, т.е. являются уже новыми этиопатогенетическими процессами. Наиболее типичными из них являются: жировая эмболия, тромбоэмболия, пневмония, желудочно-кишечные кровотечения, различные виды аэробной и анаэробной инфекции различной локализации. В 40% случаев ближайшим исходом ПОН является сепсис.
В 30% случаев при сепсисе, в 60% - при тяжелом сепсисе и в 90% - при септическом шоке исходом является смерть. Таким образом, героические усилия специалистов (реаниматологов, хирургов, анестезиологов и др.) при использовании дорогих и современных методов лечения могут вернуть к жизни только 30-40% раненых, перенесших ПОН, развившуюся в результате затянувшегося травматического шока III степени.
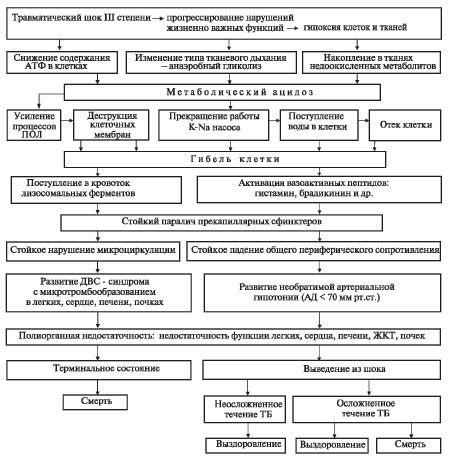
Рис. 8.2. Схема патогенеза травматического шока III степени
Возможности излечения раненых и пострадавших с тяжелыми ранениями и травмами, сопровождавшимися шоком III степени, появились в 1960-е гг. в связи со стремительным развитием анестезиологии и реаниматологии и с появлением специализированных многопрофильных центров для лечения тяжелых травм. Наша страна была лидером в этом направлении. В эти же годы сформировался очевидный парадокс: чем быстрее и эффективнее раненым с тяжелыми травмами оказывается медицинская помощь на догоспитальном этапе и в противошоковых отделениях специализированных центров, тем выше вероятность их ближайшей выживаемости, т.е. по формальным показателям (сАД) они выводятся из состояния шока. Но этот факт не означает выздоровления. После выведения раненых из состояния шока III степени у 70% из них в последующие периоды развиваются тяжелые осложнения, лечение которых нередко сложнее, чем выведение из шока.
Таким образом, при тяжелых и крайне тяжелых травмах или ранениях выведение раненых из состояния травматического шока, особенно III степени, является только первым этапом лечения. В последующем у этих раненых развиваются новые этиопатогенетические процессы, определяемые как недостаточность органов или осложнения, лечение которых имеет серьезную специфику. Тем не менее, все защитные и патологические процессы, развивающиеся у раненых после тяжелых травм или ранений, детерминированы травмой и связаны между собой причинно-следственными отношениями. Все они составляют патогенетическую сущность травматической болезни (ТБ).
8.2. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ.
В 1970-е гг. в нашей стране стали формироваться теоретические и клинические предпосылки новой тактики лечения раненых и пострадавших с тяжелыми ранениями и травмами. В основу их была положена концепция травматической болезни, основоположниками которой являются российские ученые, прежде всего патофизиолог С.А. Селезнев и военно-полевой хирург И.И. Дерябин.
ТБ определяется как лечебно-тактическая концепция, т.е. методология лечения тяжелых ранений и травм. Как концепция она объясняет механизмы и последовательность развития защитных и патологических процессов, а на этой основе обеспечивает возможность прогнозирования динамики их развития, своевременной профилактики и лечения.
Следовательно, травматический шок как лечебно-тактическая концепция, является методологией спасения жизни раненых в первые часы после тяжелых ранений и травм, а ТБ - методологией их лечения до окончательного исхода.
В течение ТБ выделяются 4 периода.
1-й период (острый) - период острого нарушения жизненно важных функций. В 63% случаев нарушение жизненно важных функций проявляется в виде травматического шока или терминального состояния, в 18% - травматической комы при тяжелых повреждениях головного мозга, в 13% - ОДН при тяжелых повреждениях груди, в 6% - острой сердечной недостаточности при повреждении сердца. Он начинается сразу же после травмы и продолжается 6-12 ч в зависимости от тяжести травмы и эффективности лечебных мероприятий. В этом периоде раненые получают догоспитальную помощь и реаниматологическую помощь в противошоковых отделениях специализированных центров либо в отделениях реанимации и интенсивной терапии (ОРИТ) районных (областных) больниц, омедб, МОСН, ВГ. Основной лечебной задачей в этот период является выявление причин нарушения жизненно важных функций, систем, в которых они произошли; активная, в т.ч. инструментальная, диагностика повреждений; выполнение неотложных и срочных оперативных вмешательств и консервативных реанимационных мероприятий: пункция и катетеризация крупных вен и даже артерий, ИТТ, ИВЛ, мониторирование жизненно важных функций и т.п. Именно в этом периоде осуществляется выведение раненых из состояния травматического шока. Оптимальным местом лечения раненых в первом периоде ТБ являются противошоковые операционные, где можно создать условия для одномоментного проведения инструментальной инвазивной диагностики (плевральная, люмбальная и др. виды пункций, лапароцентез, лапа-ро- и торакоскопия и т.п.); выполнения неотложных и срочных оперативных вмешательств; инвазивных мероприятий интенсивной терапии (пункции и катетеризации вен и артерий, трахеостомии). В этом периоде умирают до 10% тяжелораненых или пострадавших от жизнеугрожающих последствий травм. Период завершается окончательной диагностикой повреждений, устранением причин нарушений жизненно важных функций, возмещением кровопотери и относительной стабилизацией основных показателей систем дыхания и кровообращения.
2-й период - период относительной стабилизации жизненно важных функций. В этот период формальные показатели жизненно важных функций (АД, пульс, напряжение кислорода в крови, показатели крови) приближаются к нормальным значениям или отклоняются незначительно, но компенсация функций неустойчива, возможны срывы. Этот период
продолжается от 12 до 48 ч. Его значение очень велико в лечении раненых, т.к. именно в это время создаются условия для профилактики тяжелых, угрожающих жизни осложнений преимущественно хирургическим путем: операции на магистральных сосудах конечностей, длинных костях, костях и органах таза, позвоночнике и спинном мозге. Особенно это важно при сочетанных травмах (политравмах), когда одновременно повреждаются несколько областей тела, а множественные очаги повреждений и множественные переломы являются источниками ферментативной агрессии, кровопотери, избыточной афферентной импульсации и гиподинамии. Оперативные вмешательства выполняются в специально оборудованных операционных, часто одномоментно на нескольких областях тела многопрофильными хирургическими бригадами, наркоз и интенсивная терапия проводятся специально подготовленными анестезиологами с мониторированием жизненно важных функций. Такая активная лечебная тактика получила определение - хирургическая реанимация, а оперативные вмешательства относятся к категории отсроченных. Местом лечения раненых во втором периоде ТБ являются отделения реанимации и интенсивной терапии. В этом периоде умирают до 5% тяжелораненых и пострадавших преимущественно от ранней ПОН 1.
3-й период - период максимальной вероятности развития осложнений.
В этот период создаются оптимальные условия для развития осложнений. Вследствие большой кровопотери, эндотоксикоза, ДВС-синдро-ма, системного воспалительного ответа во внутренних органах (легкие, сердце, селезенка, печень, кишечник, почки) сформировались множественные очаги микротромбозов. Эти очаги являются мишенью для микроорганизмов, поступивших в кровоток из ран, верхних дыхательных путей и кишечника; кровяных макрофагов, фиксирующихся вместе с бактериями на эндотелии сосудистой стенки и нарушающих тем самым уже скомпрометированную микроциркуляцию в органах.
Особенно благоприятные условия для развития тяжелых осложнений создаются в легких.
1. Микротромбы и жировые эмболы поражают легкие на уровне артериол, прекапилляров, капилляров - при достижении критического уровня развиваются такие жизнеопасные осложнения, как тромбоэмболия мелких ветвей легочной артерии или жировая эмболия с летальностью до 50%.
1 Ранняя ПОН - недостаточность функций жизненно важных органов, достигшая критических уровней и обусловленная травматическим шоком III степени. Поздняя ПОН - недостаточность функций жизненно важных органов, обусловленная генерализацией инфекционных осложнений (сепсисом)
2. Биологически активные вещества, жир, ферменты разрушенных клеток, токсины различного происхождения, циркулирующие в крови, проходя через легочные капилляры, воздействуют на базальную мембрану альвеол и вызывают в ней «химическое» воспаление - повышается проницаемость стенки капилляров, белок проникает в базальную мембрану, и она становится непроницаемой для кислорода - нарушается диффузия газов в альвеолах, снижается напряжение кислорода в крови - развивается острый респираторный дистресс-синдром с летальностью до 90%.
3. При затянувшемся травматическом шоке III степени защитная сосудистая реакция в легких (спазм легочных посткапилляров), направленная на замедление скорости прохождения эритроцитов через легочные капилляры для увеличения времени их обогащения кислородом, переходит в свою противоположность и становится патологической. В результате затянувшегося спазма легочных посткапилляров повышается давление в системе легочной артерии. Гиповоле-мия, перемещение ионов Na+ в клетки, клеточная гипергидратация, внутрисосудистая дегидратация приводят к снижению осмотического давления в сосудистом секторе - осмотический градиент направляется в сторону альвеол. В результате этих двух процессов в альвеолы пропотевает жидкость из капилляров, происходит снижение активности сурфак-танта (поверхностно-активное вещество, препятствующее слипанию стенок альвеолы), снижается воздушность альвеол, затем они слипаются или заполняются жидкостью - формируются микроателектазы. При прогрессировании процесса микроателектазы сливаются в более крупные очаги ателектазирования - формируется очаговая пневмония. Средний срок развития пневмоний у раненых с тяжелой травмой - 3- 6-е сут. При крайне тяжелых травмах, при острой массивной кровопо-тере патологические процессы в легких проходят более стремительно и драматично: альвеолы быстро заполняются жидкостью - формируется синдром «влажного» («мокрого», «шокового») легкого, который при прогрессировании процесса переходит в отек легкого, как правило, завершающийся летальным исходом.
Системные процессы микротромбообразования происходят и в поврежденных внутренних органах, сегментах и тканях опорно-двигательной системы - они являются хорошей средой для развития местных, висцеральных и генерализованных инфекционных осложнений.
1-м этиологическим фактором возникновения таких осложнений является эндогенная микрофлора. Здесь также проявляется философский
закон «единства и борьбы противоположностей», когда защитная реакция централизации кровообращения приводит к глубоким нарушениям кровообращения и метаболизма в кишечной стенке. В результате нарушается естественный барьер кишечной трубки, т.е. стенка кишечных капилляров становится проницаемой для микроорганизмов, вегети-рующих в просвете кишки здорового человека. Таким образом, энте-робактерии, протеи, клебсиела, кишечная палочка и другие условно патогенные микроорганизмы поступают в кровь, циркулируют в ней и оседают в очагах микротромбозов, в поврежденных тканях, где взаимодействуют с тканевыми и кровяными макрофагами и другими факторами иммунной защиты. Этот микробиологический феномен называется гематогенной транслокацией, т.е. переселением микроорганизмов через кровь в новую среду обитания с последующим формированием нового (метастатического) патологического микробиоценоза.
2-м важным фактором, влияющим на вероятность развития инфекционных осложнений, является состояние очага повреждения: раны, области перелома, области отслойки кожи и т.п. Состояние очага повреждения определяется объемом некротизированных тканей, их функциональной значимостью, степенью нарушения кровоснабжения поврежденного органа либо сегмента, а в конечном итоге - вероятностью прогрессирования или регрессирования некроза в очаге повреждения. Существенной является и эффективность лечебных мероприятий: полнота удаления некротизированных тканей во время хирургической обработки, восстановление адекватного кровообращения в поврежденном органе (сегменте), создание условий для восстановления микроциркуляции в очаге повреждения и регенерации тканей.
3-м фактором, влияющим на вероятность развития инфекционных осложнений, является микробная инвазия.
При открытых повреждениях инвазия происходит через рану - этот путь
микробного загрязнения является наименее опасным, поскольку после
удаления очага некроза хирургическим путем
3-й период ТБ начинается с 3-х сут и завершается 10-ми. При этом на 3-4-е сут развивается максимальное количество висцеральных инфекционных осложнений, в основном - пневмоний; на 6-10-е - максимальное количество местных и генерализованных инфекционных осложнений: гнойных трахеобронхитов, перитонитов, многообразных форм местной гнойной инфекции различной локализации (абсцессы, флегмоны, анаэробные целлюлиты, миозиты и т.п.), а также сепсиса.
Следует понимать, что в 3-м периоде ТБ не всегда развиваются осложнения, но вероятность их развития именно в эти сроки патогенетически обоснована и научно доказана. Поэтому лечебно-тактическая целесообразность выделения 3-го периода ТБ состоит в целенаправленном сосредоточении внимания врачей-хирургов и реаниматологов на активном выявлении висцеральных инфекционных легочных осложнений на 3-4-е, инфекционных осложнений других локализаций и сепсиса - на 6-10-е сут, на построении интенсивной терапии по принципу предупреждения развития осложнений, на построении рациональной антибактериальной и иммунной терапии, на рациональном определении показаний к восстановительным операциям и проведении их с соответствующим профилактическим компонентом. В 3-м периоде ТБ умирают до 15% тяжелораненых и пострадавших от осложнений травм.
В течении ТБ выделяются 4 типа: 1-й - благоприятное течение с выздоровлением (40%), 2-й - осложненное течение с выздоровлением (30%), 3-й - осложненное течение с летальным исходом (20%), 4-й - неблагоприятное течение с летальным исходом (10%).
При 1-м типе течения 2-й период ТБ раненые полностью проходят в отделении реанимации и интенсивной терапии, а 3-й период пребывания раненого в ОРИТ может быть сокращен до 2-4 сут, если вероятность развития осложнений сводится к минимуму. Эти раненые рано вступают в 4-й период ТБ и переводятся в специализированные хирургические отделения для восстановительного лечения и реабилитации. При 2-м и 3-м типах течения ТБ у раненых развиваются осложнения, и вследствие этого они должны быть переведены из «чистого» ОРИТ в специализированное ОРИТ для лечения раненых с ИО травм. В этом отделении осуществляются хирургические вмешательства на очаге повреждения и мероприятия интенсивной терапии раневой инфекции. После ликвидации инфекционных осложнений раненые переводятся в специализированные отделения. При 4-м типе течения ТБ летальный исход наступает в 1-е сут до развития осложнений.
4-й период ТБ - период полной стабилизации жизненно важных функций. В этот период все показатели жизненно важных функций восстанавливаются до нормальных значений или близких к ним. Временных параметров для этого периода не существует - они значительно варьируют в зависимости от тяжести травмы, локализации травмы (например, особо выделяются по длительности предыдущих периодов тяжелые повреждения головного мозга), тяжести и характера осложнений. Объективным критерием перехода раненого в 4-й период ТБ является стабилизация состояния до уровня компенсации по шкалам «ВПХ-СГ и ВПХ-СС» (см. Приложение 1).
В этот период раненые проходят лечение на специализированных (нейрохирургическом, травматологическом и др.) отделениях в соответствии с локализацией ведущего повреждения. Им выполняются плановые оперативные вмешательства с целью восстановления структуры и функции поврежденных тканей, органов и систем, выполняются мероприятия медицинской реабилитации.
Средняя летальность раненых с тяжелыми и крайне тяжелыми огнестрельными ранениями составляет до 10%, с тяжелыми и крайне тяжелыми сочетанными травмами - до 30%, средняя продолжительность их лечения длительная и превышает 50 сут.
8.3. КЛИНИКА, ДИАГНОСТИКА И КЛАССИФИКАЦИЯ ТРАВМАТИЧЕСКОГО ШОКА
Основными критериями травматического шока являются клинические признаки нарушения кровообращения по типу гипоциркуляции в сочетании с наличием тяжелого ранения либо механической травмы.
К клиническим проявлениям травматического шока относится резкая бледность либо серая окраска кожного покрова, липкий холодный пот, цианоз губ и подногтевых лож, усиление рельефа поверхностных вен. Черты лица заострены, а при надавливании на кожу лба образуется долго неисчезающее белое пятно. Снижение АД - наиболее яркий и достоверный симптом травматического шока - вследствие действия механизмов компенсации проявляется не сразу. Однако в практической диагностике травматического шока именно снижению сАД придается решающее значение.
При отсутствии артериальной гипотензии диагноз травматического шока не ставится.
На симптомы гипоциркуляции вследствие острой кровопотери накладываются специфические особенности отдельных видов тяжелых травм. Например, при проникающих ранениях груди и выраженной гипоксии возникает психомоторное возбуждение, повышение тонуса мышц, кратковременный подъем АД, вслед за которым наступает его резкое снижение. В случаях проникающих ранений живота с продолжающимся внутренним кровотечением и повреждением полых органов на явления гипоциркуляции накладываются симптомы перитонита с его характерной картиной. При черепно-мозговых травмах (ЧМТ) симп-томокомплекс шока наблюдается только при нетяжелых повреждениях головного мозга и кровопотере либо из покровных тканей головы, либо из других очагов повреждения при сочетанных травмах. В случаях тяжелых повреждений головного мозга развивается картина травматической комы, которая и патогенетически, и клинически противоположна проявлениям травматического шока. «Классическая» клиника травматического шока, описанная Н.И. Пироговым, относится к тяжелым ранениям конечностей на поздней стадии расстройств кровообращения, близкой к травматическому шоку III степени.
О величине кровопотери, подтверждающей диагноз травматического шока, можно судить по уровню сАД, частоте пульса, удельному весу крови, количеству эритроцитов в мм3, гемоглобину и гема-токриту. При переломах костей ориентировочная величина кровопо-тери определяется локализацией и характером перелома: переломы плечевой кости - до 500 мл, костей голени - 500-700 мл, бедра - до 1000 мл, при множественных переломах костей таза - более 1000 мл. По завершении неотложной операции и осуществлении радикального гемостаза, наиболее точную информацию дают прямые измерения излившейся в полости крови. Зависимость тяжести травматического шока от величины кровопотери представлена в табл. 8.1.
О прогрессировании травматического шока свидетельствуют усиление бледности кожного покрова и губ, учащение и ухудшение качеств пульса, снижение АД. Напротив, критериями выхода из травматического шока следует считать появление розовой окраски кожи, потепление кожного покрова, исчезновение холодного пота. Пульс становится реже, отмечается улучшение его качественных характеристик. Отмечается повышение АД и увеличение его амплитуды.
Для разделения травматического шока по степени тяжести в практике оказания неотложной помощи из многих параметров, доступных регистрации, наиболее информативным является уровень сАД. Дело в
Таблица 8.1. Зависимость тяжести травматического шока от величины кровопотери, уровня сАД, частоты пульса
Степень тяжести шока | Объем кровопотери | Уровень АД, мм рт.ст. | Частота пульса, уд./мин |
Шок I степени | До 20% ОЦК (1000 мл) | 100-90 | До 100 |
Шок II степени | 20-40% ОЦК (2000 мл) | 85-75 | 100-120 |
Шок III степени | 40-60% ОЦК (3000 мл) | 70 и менее | 120-140 |
Терминальное состояние | >60% ОЦК (>3000 мл) | Не определяется | >140 Определяется только на магистральных артериях, либо не определяется |
том, что именно сАД имеет самую тесную обратную корреляционную связь с величиной кровопотери, которая прежде всего определяет клиническую картину травматического шока. Другие параметры лишены такой корреляции. Например, на частоту пульса помимо гиповолемии заметно влияют психоэмоциональный стресс, вводимые медикаменты, сопутствующая ЧМТ и другие факторы. По этой причине так называемый «индекс шока» (ЧСС/АД) не обладает большой ценностью в диагностике травматического шока, особенно при соче-танных травмах.
Классификация травматического шока.
По уровню сАД и по выраженности клинических симптомов травматический шок делится на 3 степени тяжести, после которых возникает новая качественная категория - следующая форма тяжелого состояния раненого - терминальное состояние.
Травматический шок I степени чаще всего возникает в результате изолированных ранений или травм. Он проявляется бледностью кожного покрова и незначительными нарушениями гемодинамики. сАД удерживается на уровне 90-100 мм рт.ст. и не сопровождается высокой тахикардией (пульс до 100 в мин).
Травматический шок II степени характеризуется заторможенностью раненого, выраженной бледностью кожного покрова, значимым нарушением гемодинамики. АД снижается до 85-75 мм рт.ст., пульс учащается до 110-120 ударов в мин. При несостоятельности
компенсаторных механизмов, а также при нераспознанных тяжелых повреждениях, поздних сроках оказания помощи тяжесть травматического шока возрастает.
Травматический шок III степени обычно
возникает при тяжелых соче-танных либо множественных ранениях
(травмах), часто сопровождающихся значительной кровопотерей (средняя
величина кровопотери при шоке III степени достигает 3000 мл, в то время
как при шоке I степени не превышает 1000 мл). Кожный покров
приобретает бледно-серую окраску с цианотичным оттенком. Пульс сильно
учащен (до 140 в 1 мин), бывает даже нитевидным. сАД падает ниже
Длительная гипотония при снижении сАД до 70-60 мм рт.ст. сопровождается уменьшением диуреза, глубокими метаболическими нарушениями и может привести к необратимым изменениям в жизненно важных органах и системах организма. В связи с этим указанный уровень сАД принято называть «критическим».
Несвоевременное устранение причин, поддерживающих и углубляющих травматический шок, препятствует восстановлению жизненно важных функций организма, и шок III степени может перейти в терминальное состояние, которое является крайней степенью угнетения жизненно важных функций, переходящей в клиническую смерть.
Терминальное состояние развивается в 3 стадии.
1. Предагональное состояние характеризуется отсутствием пульса на лучевых артериях при наличии его на сонных и бедренных артериях и не определяющимся обычным методом АД.
2. Агональное состояние имеет те же признаки, что и предагональное, но сочетается с дыхательными нарушениями (аритмичное дыхание типа Чейн-Стокса, выраженный цианоз и др.) и утратой сознания.
3. Клиническа я смерть начинается с момента последнего вдоха и остановки сердца. К л и н и че ск ие п ризна к и ж изн и у раненог о пол нос т ью отсутствуют. Однако обменные процессы в мозговой ткани продолжаются еще в среднем 5-7 мин. Выделение клинической смерти в виде отдельной формы тяжелого состояния раненых целесообразно, поскольку в тех случаях, когда у раненого нет несовместимых с жизнью повреждений, это состояние при быстром применении реанимационных мероприятий может быть обратимым.
Следует подчеркнуть, что реанимационными мероприятиями, предпринятыми в первые 3-5 мин, удается достигнуть полного восстановления жизненно важных функций организма, в то время как реанимация, проведенная в более поздние сроки, может привести к восстановлению только соматических функций (кровообращение, дыхание и т.п.) при отсутствии восстановления функций ЦНС. Эти изменения могут быть необратимыми, вследствие чего возникает стойкая инвалидность (дефекты интеллекта, речи, спастические контрактуры и т.д.) - «болезнь оживленного организма». Термин «реанимация» следует понимать не узко, как «оживление» организма, а как комплекс мероприятий, направленных на восстановление и поддержание жизненно важных функций организма.
Необратимое состояние характеризуется комплексом признаков: полная утрата сознания и всех видов рефлексов, отсутствие самостоятельного дыхания, сердечных сокращений, отсутствие биотоков головного мозга на электроэнцефалограмме («биоэлектрическое молчание»). Биологическая смерть констатируется лишь тогда, когда указанные признаки не поддаются реанимационному воздействию на протяжении 30-50 мин.
8.4. ПРИНЦИПЫ ЛЕЧЕНИЯ ТРАВМАТИЧЕСКОГО ШОКА
1. Неотложный характер оказания медицинской помощи при травматическом шоке. Этот принцип продиктован угрозой возникновения необратимых последствий критических расстройств жизненно важных функций и прежде всего нарушения кровообращения, глубокой гипоксии. Диагноз «шок» важен как сигнал тревоги, показывающий необходимость первоочередного лечения для спасения жизни раненого.
2. Целесообразность дифференцированного подхода при лечении раненых в состоянии травматического шока. Лечить следует не шок как таковой, не «типовой процесс» или «специфическую патофизиологическую реакцию» (оба термина являются устаревшими). Противошоковая помощь оказывается конкретному раненому с опасными нарушениями жизнедеятельности, в основе которых лежит тяжелая травма («морфологический субстрат» шока) и, как правило, острая кровопотеря. Выраженные расстройства кровообращения, дыхания и других жизненно важных функций вызываются тяжелыми морфологическими повреждениями жизненно важных органов и систем организма. Это положение при
тяжелых травмах приобретает смысл аксиомы и нацеливает врача на срочный поиск конкретной причины травматического шока. Хирургическая помощь при шоке бывает эффективной только при быстрой и точной диагностике локализации, характера и тяжести повреждений.
3. Ведущее значение и неотложный характер хирургического лечения при травматическом шоке. Противошоковая помощь оказывается одновременно анестезиологом-реаниматологом и хирургом. От эффективных действий первого зависит быстрое восстановление и поддержание проходимости дыхательных путей, газообмена в целом, начало инфузионной терапии, обезболивание, медикаментозная поддержка сердечной деятельности и других функций. Однако патогенетический смысл имеет неотложное хирургическое лечение, устраняющее причину травматического шока - остановка кровотечения, устранение напряженного или открытого пневмоторакса, устранение тампонады сердца и др. Таким образом, современная тактика активного хирургического лечения тяжелораненого занимает центральное место в программе противошоковых мероприятий и не оставляет места устаревшему тезису - «сперва выведи из шока, потом оперируй».
8.5. ПОМОЩЬ ПРИ ТРАВМАТИЧЕСКОМ ШОКЕ НА ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ
При оказании первой и доврачебной помощи (поле боя, МПб) спасение раненых в состоянии шока зависит от их быстрого розыска, остановки наружного кровотечения, устранения острых дыхательных расстройств и первоочередной эвакуации. Поэтому обязательными мероприятиями на этапах оказания первой и доврачебной помощи являются остановка наружного кровотечения (давящая повязка, тугая тампонада раны, наложение табельного кровоостанавливающего жгута), восстановление дыхания (устранение асфиксии, введение воздуховода, ингаляция кислорода и даже ИВЛ) при отсутствии безнадежно тяжелых повреждений головного мозга, инфузия кристаллоидного плаз-мозаменителя путем подключения к раненому через периферическую вену специального полиэтиленового контейнера емкостью 800-1000 мл; он подкладывается под спину раненого, и инфузия продолжается в процессе эвакуации под действием веса раненого и специального дозатора капель в системе. Для обезболивания на поле боя из шприц-тюбика вводится 1 мл 2% промедола. Фельдшер МПб имеет возмож-
ность усилить анальгезию путем введения морфина, бупранала. Возможна ингаляционная аутоаналгезия ингалином, трихлорэтиленом через специальные испарители. Эффективную иммобилизацию переломов и укладку на носилках в функционально выгодном положении также следует рассматривать как важнейший элемент обезболивания в его широком смысловом значении.
На этапе оказания первой врачебной помощи раненые в состоянии травматического шока должны в первую очередь направляться в перевязочную.
Противошоковая помощь в МПп (медр) должна ограничиваться необходимым минимумом неотложных мероприятий, чтобы не задерживать эвакуацию в лечебное учреждение, где может быть оказана хирургическая и реаниматологическая помощь. Следует понимать, что цель этих мероприятий - не выведение из шока (которое в условиях МПп невозможно), а стабилизация состояния раненого для дальнейшей первоочередной эвакуации.
В перевязочной выявляются причины тяжелого состояния раненого и выполняются мероприятия по его устранению. При острых нарушениях дыхания устраняется асфиксия, восстанавливается внешнее дыхание, герметизируется плевральная полость при открытом пневмотораксе, дренируется плевральная полость при напряженном пневмотораксе, осуществляется ингаляция кислорода. При наружном кровотечении выполняется его временная остановка, а при наличии кровоостанавливающего жгута - осуществляется контроль за ним.
Важным противошоковым мероприятием является внутривенная инфузия
800-1200 мл кристаллоидного раствора (лактасол, 0,9% раствор натрия хлорида и др.), а при массивной кровопотере (
При внутреннем кровотечении основной задачей первой врачебной помощи является немедленная вертолетная эвакуация раненого на этап оказания квалифицированной или специализированной (при близком расстоянии) медицинской помощи, где ему будет выполнена неотложная операция для устранения источника кровотечения. Основным мероприятием первой врачебной помощи перед эвакуацией является установка
инфузионной системы в периферическую вену через гибкий катетер или специальную флексюлю и начало инфузии кристаллоидного, а при шоке III степени - коллоидного раствора умеренным темпом, чтобы не усиливать кровотечение. Уменьшение интенсивности внутритазового и внутрибрюшинного кровотечения возможно при наличии специальных противошоковых надувных костюмов (в странах НАТО на снабжении имеются противошоковые костюмы MASS (military antishoсk suit) за счет раздувания тазовой или брюшной секции.
Обязательным противошоковым мероприятием первой врачебной помощи является обезболивание. Всем раненым с травматическим шоком вводятся наркотические анальгетики. Однако лучшим методом обезболивания являются новокаиновые блокады. При повреждении органов груди с открытым пневмотораксом эффективна ваго-симпа-тическая блокада, при множественных переломах ребер - паравертеб-ральная или межреберная. При переломах длинных костей конечностей обязательным является выполнение проводниковых либо футлярных новокаиновых блокад. Эффективны новокаиновые блокады при множественных переломах костей таза, особенно заднего полукольца. После выполнения новокаиновых блокад обязательным мероприятием первой врачебной помощи является транспортная иммобилизация поврежденных сегментов конечностей, таза и позвоночника.
Приоритетной задачей для спасения жизни раненых в состоянии шока является быстрая доставка на этап оказания квалифицированной или специализированной помощи. Здесь уже во время приема и выборочной сортировки осуществляется быстрое выявление раненых в состоянии шока. В неотложной диагностике шока необходимо одновременное участие хирургов и анестезиологов-реаниматологов.
Раненые с признаками шока должны в первую очередь направляться в операционную для выполнения операций по неотложным показаниям (асфиксия, тампонада сердца, напряженный или открытый пневмоторакс, продолжающееся внутреннее кровотечение и др.) либо в палату интенсивной терапии при отсутствии показаний к неотложной операции (для устранения расстройств жизненно важных функций, подготовки к выполнению срочных вмешательств или эвакуации).
У раненых, нуждающихся в неотложных операциях, противошоковая терапия должна начинаться в приемно-сортировочном отделении и продолжаться под руководством анестезиолога-рениматолога одновременно с выполнением хирургического вмешательства. В дальнейшем после операции противошоковая терапия завершается в палате интенсивной терапии.
В палате интенсивной терапии продолжаются работы по восполнению кровопотери, восстановлению ОЦК, начатые еще в операционной, а также проводятся мероприятия по восстановлению функции системы кровообращения и коррекции последствий острой кровопотери. Эти мероприятия условно сгруппированы по нескольким направлениям.
Восстановление ОЦК при кровопотере до
Стимуляция тонуса периферических сосудов для повышения и стабилизации сАД - как необходимое условие функционирования сердца, легких, печени, почек. Она эффективна при адекватно восполненной кровопотере и осуществляется капельным введением допамина в дозе 10-15 мкг/кг в мин либо норадреналина в дозе 1,0-2,0 мл 0,2% раствора в 400 мл 5% глюкозы со скоростью 40-50 капель в минуту.
Стабилизация гемодинамики с помощью глюкокортикоидов (преднизо-лон 10-30 мг/кг в сут в течение первых двух суток), которые улучшают сократительную функцию миокарда, снимают спазм периферических сосудов, стабилизируют клеточные мембраны, снижают проницаемость сосудистой стенки.
Улучшение реологических свойств крови применением реологически активных кровезаменителей (реополиглюкин, реоглюман), кристал-лоидных растворов (5% раствор глюкозы, раствор Рингера, лактосол), дезагрегантов (трентал, аспизол).
Коррекция свертывающей системы крови,
определяемая степенью выраженности синдрома ДВС: при ДВС-синдроме I
степени (гиперкоагуляция, изокоагуляция) используются гепарин 50 ЕД/кг
4-6 раз в сут, преднизолон 1,0 мг/кг 2 раза в сут, трентал,
реополиглюкин; при ДВС-синдроме II степени (гипокоагуляция без
активации фибриноли-за) применяются гепарин до 30 ЕД/кг в сут (не более
5000 ЕД), предни-золон 1,5 мг/кг 2 раза в сут, альбумин, плазма,
реополиглюкин, цельная кровь не более 3 сут консервации; при
ДВС-синдроме III степени (гипокоагуляция с начинающейся активацией
фибринолиза) используются преднизолон 1,5 мг/кг 2 раза в сут, контрикал
60 000 ЕД в сут, альбумин, плазма, кровь малых сроков консервации,
фибриноген, желатина, дицинон; при ДВС-синдроме IV степени
(генерализованный фибринолиз) применяются преднизолон до
Коррекция метаболизма в ходе восполнения кровопотери. Она сводится к коррекции ацидоза, обусловленного, с одной стороны, многофакторной гипоксией тканей, с другой - переливанием большого объема консервированной крови. Для коррекции ацидоза используются буферные растворы бикарбоната натрия (70-100 ммоль в сут) либо трисамин. С целью предотвращения неблагоприятного действия консерванта крови (цитрата натрия) при больших объемах трансфузии, на каждые 500 мл крови необходимо вводить 15 мл 10% раствора хлорида кальция.
Нейтрализация ферментативной агрессии, являющейся неизбежным следствием травмы, кровопотери, гипоксии и гемотрансфузий. Осуществляется введением в состав инфузионной терапии ингибиторов ферментов (контрикал 100 000-160 000 ЕД, трасилол 300 000-500 000 ЕД).
Восстановление и подержание функции почек. При своевременном и адекватном восполнении кровопотери, нормализации гемодинамики - восстанавливается почечный кровоток, клубочковая фильтрация, что проявляется диурезом превышающим 50-60 мл мочи в 1 ч. Длительная гипотония и большие объемы переливаемой крови угнетают функцию почек и приводят к развитию преренальной почечной недостаточности, начальным проявлением которой является почасовой уровень диуреза ниже 50 мл. Следовательно, в процессе восполнения кровопотери необходима постоянная катетеризация мочевого пузыря и регистрация почасового диуреза.
Показанием для стимуляции функции почек является развитие преренальной почечной недостаточности, несмотря на восстановление системной гемодинамики. Стимуляция начинается внутривенным введением салуретиков (лазикс 60 мг однократно, 200-300 мг в сут), поскольку они увеличивают диурез только благодаря блокаде реабсорбции натрия в почечных канальцах; следует помнить, что салуретики уменьшают ОЦК и могут применяться только при восполнении ОЦК. При получении адекватного ответа на применение салуретиков, поддержание адекватного диуреза осуществляется стимуляцией гемодинамики и почечного кровотока путем включения в состав инфузионно-трансфузионной терапии реологически активных кровезаменителей, дезагрегантов, осмотических (1 г/кг маннитола в сут) и онкотических (1 г/кг альбумина в сут) диуретиков. Осмодиуре-тики увеличивают ОЦК за счет повышения осмолярности плазмы, а за счет слабой реабсорбции в почечных канальцах - обеспечивают увеличение диуреза.
Таким образом, основная задача квалифицированной медицинской помощи - спасение жизни раненых - реализуется выведением их из состояния травматического шока путем выполнения неотложных оперативных вмешательств и проведения противошоковых мероприятий интенсивной терапии.
Для выведения раненых из состояния травматического шока (в т.ч. после выполнения неотложных операций в операционной) на этапах оказания квалифицированной медицинской помощи развертываются две палаты интенсивной терапии: 1-я - для раненых, 2-я - для обожженных на 14-16 коек каждая. Средний срок выведения раненого из состояния шока на войне - 8-12 ч. Следовательно, при массовом потоке раненых на одной «интенсивной койке» противошоковую помощь получают 2 раненых, т.е. возможности этапа оказания квалифицированной медицинской помощи в отношении раненых в состоянии травматического шока составляют 28-32 раненых в сут при использовании одной палаты интенсивной терапии и 56-64 - при использовании двух.
В настоящей главе представлен стандарт оказания реаниматологической помощи при травматическом шоке. Вероятно, он не всегда будет выполним в условиях крупномасштабной войны вследствие массовых потоков раненых, некомплекта анестезиологов-реаниматологов, дефицита лекарственных препаратов и других причин. В то же время, в локальных войнах (Афганистан, 1979-1989 гг.) и контртеррористических операциях (Северный Кавказ, 1994-1996 гг., 1999-2002 гг.)
все перечисленные мероприятия реально выполнялись во всех омедб (Афганистан), в МОСН и в ВГ 1-го эшелона (Северный Кавказ).
Контрольные вопросы:
1. Встречаются ли другие, кроме травматического шока, клинические формы тяжелого состояния раненых?
2. Перечислите основные патофизиологические механизмы травматического шока I-II степени (стадия компенсации).
3. Характерна ли тахикардия для травматической комы? Какие другие клинические признаки характеризуют развитие травматической комы?
4. Сохраняется ли централизация кровообращения при травматическом шоке III степени (стадия декомпенсации)? Какими клиническими признаками характеризуется эта стадия шока?
5. Перечислите возможные варианты нарушений жизненно важных функций, развивающиеся сразу после травмы.
6. Каким образом, по вашему мнению, удается уменьшить частоту и тяжесть развития осложнений травм после выведения раненого из шока?
7. Перечислите причины развития легочных осложнений при травме.
8. Каким образом эндогенная микрофлора становится одной из причин развития инфекционных осложнений?
9. Перечислите степени и критерии тяжести травматического шока.
10.Охарактеризуйте вклад отечественных ученых в развитие учения о травматическом шоке.
11.Что происходит после выведения раненого из шока III степени? Как называются клинические и патогенетические процессы, развивающиеся у раненого после выведения его из шока?
12.Каков основной метод лечения шока при внутриполостном кровотечении? Что важнее: операция или переливание крови?
13.В каких случаях лечение шока проводится с использованием переливания крови?
14.Назовите наиболее эффективный способ обезболивания при травматическом шоке.
15.На каком этапе медицинской эвакуации возможно проведение полноценной противошоковой терапии и выведение раненого шока?