Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 19 МЕТОДЫ ВТОРОГО ЭТАПА ДИАГНОСТИКИ НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
ПОПУЛЯЦИОННО-СТАТИСТИЧЕСКИЙ МЕТОД
Перед вторым этапом обследования больных с наследственной патологией врач может принять решение о применении популяционностатистического метода, который не относится ни к методам первого этапа, ни к методам второго этапа диагностики наследственной патологии.
Популяционно-статистический метод - это общий эпидемиологический метод, связанный с изучением частоты распространения наследственной патологии и проявлений ее полиморфизма в разных популяционных группах. По этой причине данный метод почти не востребован клинической генетикой.
Вместе с тем, необходимость его использования может возникнуть у врача в целях научного исследования и анализа на основе обширного статистического материала внутрисемейных, межсемейных и популяционных особенностей распространения наследственного и врожденного заболевания.
Сущность метода. Среди населения Земли невозможно найти генетически одинаковых лиц, хотя общность генов хорошо прослеживается у прямых и дальних родственников. Исключением из этого правила являются монозиготные близнецы, у которых предполагается наличие 100% одинаковых генов. Вместе с тем, в общей популяции человека всегда присутствует в гетерозиготном состоянии значительное количество рецессивных и доминантных аллелей патологических генов, которые обусловливают потенциальный груз моногенно наследуемых заболеваний, и это примерно 3-5% населения.
Частота проявления генетического груза зависит от концентрации патологических аллелей, и она постепенно возрастает в малочисленных популяциях при заключении кровнородственных браков. Такие группы населения, как правило, изолированы на основе географического и/или религиозного принципов, и патологические гены
(генотипы) в них передаются через многие поколения, приводя к увеличению частоты их проявления.
В то же время в крупных по численности популяциях распространены свободные браки, и наследование патологических генов не меняет частоты их аллелей в последующих поколениях.
Как следует из закона Харди-Вайнберга, сумма частот аллелей одного гена в генофонде разных популяций является постоянной величиной: р + q = 1. В свою очередь, сумма генотипов аллелей данного гена также является постоянной величиной: р2 + 2pq + q2 = 1. Следовательно, значение q или частота рецессивной аллели «а» есть корень квадратный из числа рецессивных гомозигот «aa». Тогда значение р или частота доминантной аллели «А» составит p = 1 - q. После этого вычисляется число гетерозигот, равное 2 рq. Таким образом, статистический анализ распространенности в популяциях аллелей патологических генов и контролируемых ими признаков, проведенный на основе популяционностатистического метода, позволяет определять их адаптивную ценность в основном за пределами одной семейной родословной.
МЕТОДЫ ВТОРОГО ЭТАПА ДИАГНОСТИКИ
НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
Второй этап диагностики наследственной патологии связан с использованием параклинических методов. При их применении врач обязан соблюдать ряд профессиональных требований и правил:
• принимать самостоятельное решение (начинающий врач должен следовать решению врачебного консилиума) о назначении обследования больного пробанда с использованием параклинических методов;
• принимать личное участие в проведении назначенных им параклинических методов, чтобы быть полностью уверенным в объективности полученных результатов;
• всегда помнить, что «последнее слово» в постановке окончательного диагноза наследственного и врожденного заболевания принадлежит исключительно ему (юридическая обязанность врача), тогда как роль специалиста по параклинической диагностике (во многих случаях не врача, а биолога, физиолога или другого профессионала) в решении этого вопроса может быть только вспомогательной.
Кроме того, при переходе от лабораторной диагностики к постановке окончательного диагноза в случаях моногенного заболевания или хромосомного синдрома врачу необходимо соблюдать еще три дополнительных правила (всего их 6):
• данные объективного врачебного осмотра должны совпадать с данными лабораторной диагностики;
• должна исключаться возможность лабораторной ошибки, для избежания которой врач назначает (при малейшем подозрении на нее) проведение повторного лабораторного исследования образца биологического материала, взятого от одного и того же больного;
• в случае планирования последующего деторождения здорового ребенка в семье консультируемого лица, в которой уже диагностировано моногенное заболевание, врач обязан подтвердить или отвергнуть факт гетерозиготного носительства будущими родителями генов данного заболевания (особенно тяжелых НБО) и только на этой основе делать заключение о прогнозе здоровья потомства.
Характеристика параклинических методов
К основным параклиническим методам относятся: методы аналитической биохимии (включая аналитические системы и программные продукты), иммунологические методы, цитогенетический метод, а также молекулярно-генетические методы обследования пробанда, его больных и здоровых родственников.
Большинство параклинических методов пришли в клиническую генетику из общей генетики, молекулярной биологии, биохимии, иммунологии и других сопряженных с ней областей молекулярной биологии и медицины. Показания для применения параклинических методов различаются в зависимости от поставленных целей и задач, одни методы применяются чаще, другие - реже.
Методы аналитической биохимии
Объектами лабораторного тестирования больного с наследственной патологией с помощью методов аналитической биохимии являются разные классы органических и неорганических соединений: аминокислоты, углеводы, липиды и их метаболиты, ионы металлов, сульфаты и др. При этом изучаются не только состав, но и концентрация структурных компонентов клеток и тканей, а также изменения активности ферментов, участвующих в их преобразованиях.
С помощью методов аналитической биохимии можно исследовать любую биологическую ткань и жидкость организма. Универсальность
этих методов широко используется в определении причин и механизмов наследственных заболеваний, выявлении гетерозиготного носительства патологических генов, а также антигенной несовместимости организмов матери и плода. Во многих случаях применяются комбинации биохимических методов с другими методами, например иммуногенетическое тестирование при анализе иммунодефицитных состояний и антигенной несовместимости матери и плода по группам крови и резус-фактору.
Другим примером служит иммуногистохимическое тестирование мышечных белков с помощью специфических антител при прогрессирующих мышечных дистрофиях Дюшенна и Беккера.
Методы аналитической биохимии бывают следующие.
• Качественные. С их помощью определяют избыточную концентрацию субстратов заблокированных ферментных реакций или их производных, накапливающихся при НБО.
• Количественные и полуколичественные. С их помощью определяют изменения концентрации веществ и нарушения кислотнощелочного равновесия.
Кроме того, разные количественные и полуколичественные методы аналитической биохимии широко применяются для эффективной диагностики НБО. Именно с этой целью была разработана и внедрена в практику здравоохранения развитых стран мира стандартная двухэтапная система обследования больных на основе программ массового (тотального) и селективного (выборочного) скрининга.
Первый этап - это экспресс-диагностика НБО у всех новорожденных (собственно массовый скрининг) или экспресс-диагностика в группах детей высокого риска конкретной наследственной патологии (селективный скрининг). Массовый скрининг охватывает популяцию целиком, а селективный - только часть популяции.
Выявляемые в ходе экспресс-диагностики наследственные заболевания, как правило, характеризуются широкой распространенностью, тяжелым прогредиентным течением, приводящим к инвалидности при отсутствии лечения, а также наличием высокочувствительных и эффективных методов их диагностики и лечения.
В ходе массового скрининга выполняются достаточно простые, надежные и экономически выгодные (как для лечебнопрофилактического учреждения, так и для самого пациента) ориентировочные экспресс-тесты с биологическими материалами, взятыми у новорожденных (кал, кровь, мокрота, моча, пот, слюна).
Селективный скрининг также основан на простых и надежных ориентировочных экспресс-тестах. Но в этом случае могут еще использоваться специальные методы диагностики наследственных заболеваний в группах пациентов высокого риска конкретной патологии. Например, у больных с врожденной катарактой проводится диагностика галактоземии, у больных с частыми обструктивными бронхитами - диагностика муковисцидоза.
В настоящее время разработан ряд экспресс-тестов и диагностических методов.
• А. Качественные тесты с мочой:
- органолептический тест на специфический цвет и запах при алкаптонурии, 3-гидроксил-3-метилглутаровой ацидурии, изовалериановой ацидемии, лейцинозе, тирозинемии, ФКУ, цистинурии;
- тест Бенидикта при алкаптонурии, галактоземии, врожденной непереносимости фруктозы, лактазной недостаточности, приеме антибиотиков;
- тест с хлоридом железа при алкаптонурии, гиперглицинемии, гистидинемии, лейцинозе, тирозинемии, ФКУ; этот тест также является положительным при гипербилирубинемии, лактатацидозе, кетоацидозе, меланоме, плеохромоцитоме и циррозе печени;
- тест с динитрофенилгидразином (ДНФГ-тест) при алкаптонурии, гиперглицинемии, гликогенозах, лактат-ацидозе, лейцинозе, ФКУ;
- тест с п-нитроанилином при метилмалоновой ацидурии;
- сульфитный тест при недостаточности молибденового кофактора;
- тест на гомогентизиновую кислоту при алкаптонурии;
- тест с нитрозонафтолом при галактоземии, тирозинемии, фруктоземии.
• Б. Полуколичественные тесты с мочой:
- тест на пролин при аминоглицинурии, пролинемии I и II;
- тест с цианид-нитропруссидом при гомоцистинурии, цистинурии;
- ЦПХ-тест при мукополисахаридозах.
Второй этап - это уточняющая диагностика. В ходе такой диагностики применяются более сложные количественные методы аналитической биохимии, а также молекулярно-генетические и молекулярноцитогенетические методы.
К количественным и качественным методам аналитической биохимии относятся: методы исследования метаболического пути, определение количества метаболитов, их кинетики и накопления.
Эти методы позволяют определить спектр разных классов органических и неорганических соединений (например, аминокислот) или концентрацию конкретного вещества (например, ФА или тирозина с помощью флуорометрии).
Среди количественных и качественных методов выделяются:
• хроматомасс-спектрометрия (ХМС) или комбинированный метод хроматографии и масс-спектрометрии, с помощью которых анализируется количество и качество (включая молекулярную массу) желчных кислот, органических кислот (при аминоацидопатиях), холестерина и его производных (при болезнях холестеринового обмена);
• электрофорез гликозоаминогликанов (ГАГ) - анализируются сложные сахара при мукополисахаридозах;
• одномерная и двухмерная тонкослойная хроматография (ТСХ) - определяются спектр, количество и дефекты аминокислот, имидазолов, моно- и дисахаридов (при наследственных болезнях желудочно-кишечного тракта), олигосахаридов, мукополисахаридов, пуринов и пиримидинов, сиаловых и фенольных кислот - всего до 3000 соединений, являющихся метаболическими маркерами различных классов НБО;
• высокоэффективная жидкостная хроматография (ВЭЖХ) - определяются аминокислоты, птеридины (при «злокачественной» ФКУ), лактат, пируват, 3-гидроксибутират и ацетоацетат (при МТБ), ионы металлов и сульфаты (при болезнях обмена металлов), карнитин и его эфиры, хлориды, стероидные и тиреоидные гормоны, пурины и пиримидины;
• газовая хроматография (ГХ) - анализируются холестерин и его производные, триацилглицериды, пипеколиновая и фитановая кислоты, жирные кислоты и плазмалогены (при пероксисомных болезнях);
• тандемная масс-спектрометрия (ТМС) - анализируются аминокислоты и ацилкарнитины, разветвленные и неразветвленные дикарбоновые кислоты (от С6 до С14).
Биологическими материалами при этих методах служат плазма или сыворотка крови (количественные тесты), а также образцы мочи (качественные тесты).
Среди более сложных методов биохимического анализа значатся: методы прямого измерения концентрации (иммунохимические методы) и определения активности ферментов (энзимодиагностика), методы оценки физико-химических и кинетических параметров мутантных белков; методы исследования мутантных белков с помощью нагрузочных проб мечеными субстратами и методы гибридизации соматических клеток.
Существуют также методы исследования структуры мутантного гена с помощью рестрикционного анализа.
Аналитические системы и программные продукты
Говоря о значении методов аналитической биохимии для протеомики , следует отметить, что в настоящее время в России основная часть протеомных исследований выполняется с использованием стандартного метода двухмерного гель-электрофореза на полиакриламидном геле или метода 2-D PAGE. Вместе с тем, наиболее ощутимый прорыв в протеомике может быть обеспечен широким применением комбинаций методов ВЭЖХ и ТМС.
В пользу такого прогноза свидетельствуют результаты анализа образцов протеинов человека с помощью программного пакета TurboSEQUEST ТМ для автоматической идентификации протеинов. Этот пакет обеспечивает быструю и точную идентификацию даже при низких концентрациях белков в сложных смесях. Например, при применении жидкостного хроматографа «Surveyor» и массспектрометрического детектора «LCQ DECA XP» с анализатором - ионной ловушкой в течение всего 5 ч можно идентифицировать 95 протеинов, тогда как при применении стандартного метода 2-D PAGE - только 25 протеинов при более значительных затратах времени.
К современным протеомным аналитическим системам также относятся следующие.
• ВЭЖХ Surveyor LC, которую характеризуют: короткий цикл анализа образцов, высокая производительность, позволяющие при малых скоростях потоков создавать условия для исследования огромного количества образцов. Система включает модуль подготовки растворителей - Solvent Platform, насос Surveyor MS Pump со встроенным дегазатором, автодозатор Surveyor Autosampler и детектор - фотодиодную матрицу Surveyor PDA.
• Система Finnigan LCQ ADVANTAGE обеспечивает быструю идентификацию компонентов анализируемых образцов. Это компакт-
• ный настольный масс-спектрометр с анализатором - ионной ловушкой, способный выполнять исследования с подтверждением молекулярной массы, а также структурные анализы методом ВЭЖХ МС/МС. Селективность МС/МС обеспечивает идентификацию соединений путем их сравнения со спектральной библиотекой, что дает возможность получать количественные результаты для сложных матриц. Усовершенствованная система Finnigan LCQ DECA XP или идеальный масс-спектрометр (самый высокочувствительный прибор среди всех систем ВЭЖХ) для изучения метаболизма, анализа чистоты биологических образцов, идентификации протеинов и других сложных молекул, позволяющий полностью исследовать их структуру.
Таким образом, хроматография, масс-спектрометрия, аналитические системы и программные продукты относятся к основным инструментам современных исследований в протеомике.
Цитогенетические методы
Как сказано в главе 1, развитие цитогенетики начиналось с применения методов анафазного и телофазного анализа хромосом, затем появился более совершенный метод метафазного анализа хромосом, а в начале 80-х годов большое распространение получил самый информативный метод - анализ прометафазных хромосом.
Прометафазный метод подтвердил существование микрохромосомных мутаций: микроделеций, микродупликаций, парацентрических инверсий, лежащих в основе ряда наследственных болезней.
Такие микроперестройки хромосом нередко сопровождают рак. Например, свыше 500 нозологий МБ проявляются неоплазией, и среди них каждое второе заболевание сопровождается микроперестройками хромосом.
В клинической генетике с помощью цитогенетических методов проводится обследование пробанда, его больных и здоровых родственников или обследование плода при подозрении на хромосомное нарушение.
Таким образом, цитогенетические методы диагностики применяются для кариотипирования и цитогенетического анализа хромосомного набора пробанда, его больных и здоровых родственников (см. главу 2).
Иммунологические методы
В середине XX в. были разработаны применяемые при подозрении на наследственные иммунодефицитные состояния (атаксиятелеангиэктазия, дис- и агаммаглобулинемия и др.) иммунологические методы. С их помощью исследуют антигенную несовместимость матери и плода, устанавливают биологическое отцовство, изучают генетические маркеры при анализе сцепления генов и оценке наследственной предрасположенности к болезням (гены с выраженным фенотипическим проявлением). В числе таких методов значатся: анализ гамма-глобулинов, В- и Т- лимфоцитов, содержания комплемента в крови, исследование функции фагоцитарных клеток, определение HLA-антигенов в лейкоцитах и др.
Молекулярно-генетическая диагностика: подходы и характеристика
Целью молекулярно-генетических методов диагностики наследственной патологии является определение нарушений молекулярной структуры и функционирования генов, их белковых и небелковых продуктов. Эти методы относятся к основным диагностическим тестам, применяемым в клинической генетике последних лет.
Необходимость разработки этих тестов была обусловлена молекулярной природой наследственной патологии, ее выраженным генетическим и клиническим полиморфизмом, наличием аллельных серий, генокопий и фенокопий и другими особенностями, создающими для врача трудности в дифференциальной диагностике заболеваний (см. главы 2-5 и 17).
Широкое распространение получила ДНК-зондовая диагностика, или ДНК-диагностика.
Известно, что молекула ДНК, являясь главной молекулой жизни, сохраняет свою стабильность в течение всего онтогенеза (см. главы 2 и 12). Эта молекула одинакова во всех клетках, что делает ее абсолютно пригодной для диагностики наследственной патологии.
Задача ДНК-диагностики.
• Исследование мутаций патологического гена - это прямой подход. Используется в случаях, когда известны ген заболевания и его основные мутации, например, для диагностики муковисцидоза (мажорная мутация - del F508), ФКУ (R408W), хореи Гентингтона (экспансия CTG-повторов). Кроме того, прямой подход применяется для выявления в популяции гетерозиготного носительства
• генов рецессивно наследуемых заболеваний у родителей и родственников больного пробанда. Анализ сегрегации (накопления) заболевания в семейной родословной, характеризующейся наличием измененных аллелей полиморфных (маркерных) локусов, тесно сцепленных с патологическим геном (однонуклеотидные замены, делеции, инсерции оснований, нуклеотидные повторы) - это косвенный подход. Такой подход применяется в тех случаях, когда прямой подход не дает результата (например, при большой протяженности и сложной организации гена, а также при широком спектре его мутаций) или когда не выделен патологический ген, а известна только его локализация на хромосоме. Объектом исследования при косвенной ДНК-диагностике являются полиморфные сайты - микросателлитные повторы (мономеры) протяженностью до 5 н.п. и минисателлитные повторы (мономеры), содержащие 5-60 н.п. И микро-, и минисателлитные повторы разбросаны по всему геному и наследуются по моногенному варианту.
Вместе с тем, наиболее типичными считаются микросателлитные сайты (динуклеотидные повторы), в том числе самый распространенный СА-повтор (цитозин-аденин).
Оба подхода (прямой и косвенный) базируются на идентификации небольших и строго определенных фрагментов молекулы ДНК с последующим анализом при помощи электрофореза в агарозном (или полиакриламидном) геле либо с помощью радиоавтографии.
Следует отметить, что золотым стандартом ДНК-диагностики наследственной патологии (особенно МБ) является комплексное применение и прямого, и косвенного методов, что позволяет врачу получить наиболее адекватный результат.
Базовые методы ДНК-диагностики
В основе многочисленных методов ДНК-диагностики лежат два базовых метода: блот-гибридизационный анализ и ПЦР.
Блот-гибридизационный анализ
Блот-гибридизационный анализ - это самый первый метод исследования молекулы ДНК, предложенный Э. Саузерном еще в 1975 г. Именно этот метод стал универсальной технологической основой для идентификации мутаций в патологических генах.
Сущность метода заключается в следующем: ДНК, выделенная из биоптата органа, ткани или культуры лимфоцитов периферической
крови, подвергается расщеплению рестриктазами*, которые «узнают» в ней строго определенную последовательность нуклеотидов. Несмотря на нарезание рестриктазами множества фрагментов ДНК разной длины, их набор для каждого индивида всегда постоянен по количеству и величине данной рестриктазы.
Далее из множества нарезанных фрагментов нужно найти один или несколько фрагментов ДНК с определенной последовательностью и охарактеризовать их. С этой целью полученную смесь фрагментов подвергают электрофорезу, в ходе которого фрагменты ДНК разделяются по размеру (мелкие в геле мигрируют быстрее больших). Затем разделенные фрагменты «перепечатывают» на целлюлозный фильтр или нейлоновую мембрану, фиксируют и подвергают гибридизации с зондом (олигонуклеотидом), интенсивно меченным радиоактивным изотопом или флуоресцентной меткой.
Такой зонд является ключевым элементом - это искусственно клонированная с помощью генно-инженерных методов нуклеотидная последовательность конкретного гена. Именно зонд выявляет необходимый фрагмент, присутствующий среди исследуемого множества фрагментов. При этом происходит специфическое связывание последовательностей зонда с комплементарными ему последовательностями фрагмента ДНК, зафиксированного на фильтре.
Далее следует отмывка несвязанной с фильтром радиоактивной метки и экспозиция фрагмента на рентгеновской пленке. Изменение положения фрагмента по сравнению с контролем, его исчезновение или появление нового фрагмента свидетельствуют о перестройках последовательностей нуклеотидов в исследуемом гене или его ближайшем окружении.
В настоящее время блот-гибридизационный анализ ограниченно применяется для гибридизации ДНК-зондов с электрофоретически разделенными молекулами РНК (нозерн-блот) или молекулами белков, фиксированных на фильтре с мечеными антителами (вестерн-блот).
Полимеразная цепная реакция
ПЦР - второй по значимости метод ДНК-диагностики, метод специфической амплификации (копирования или умножения), зна-
* Рестриктазы - это своеобразные «биологические ножницы». В настоящее время получены рестриктазы, «узнающие» более 500 специфических последовательностей нуклеотидов с длиной от 4 до 8 пар и более.
чительно потеснивший блот-гибридизационный анализ. Метод ПЦР был предложен в 1983 г. К. Муллисом, удостоенным за его разработку Нобелевской премии в 1992 г.
Метод ПЦР позволяет в течение одного часа увеличить in vitro в миллионы раз количество заданного фрагмента геномной ДНК (имеющего длину от нескольких десятков до нескольких тысяч н.п.), что существенно облегчает поиск искомой мутации или изучение полиморфных сайтов.
Необходимым условием для проведения ПЦР служит знание нуклеотидных последовательностей ДНК, фланкирующих участок амплификации (находятся на его флангах). Такие участки называются «затравками» или олигопраймерами. Их длина - 20-30 пар оснований, они комплементарны З'-концам амплифицируемых участков на смысловой и антисмысловой нитях ДНК.
На основе свойства комплементации определяют длину амплифицируемых участков, соответствующую расстоянию между олигопраймерами.
Принципиальная схема ПЦР приведена на рис. 61. ПЦР идет в четыре этапа на специальных программных термоциклерах, задающих и поддерживающих определенный температурный режим реакции. Компонентами этой реакции служат: матричная ДНК, олигопраймеры, смесь дезоксинуклеотидов и термофильная ДНК-полимераза. Их добавляют в специальный солевой буфер непосредственно перед помещением пробирки в термоциклер. На первом этапе реакции двухнитевая матричная ДНК переводится в однонитевую форму при нагревании в течение нескольких минут до температуры 95-98 °С. На втором этапе (этап гибридизации) температура реакционной смеси снижается до 30-50 °С, и олигопраймеры гибридизируются с денатурированной (одноцепочечной) ДНК, содержащей комплементарные участки. На третьем этапе температура повышается до 60-70 °С (она оптимальна для термофильной ДНК-полимеразы), что позволяет запустить синтез ДНК в направлении от 5'- к 3'-концу геномной ДНК-матрицы. На четвертом этапе происходит дальнейшее повышение температуры до 80-90 °С, что прекращает синтез ДНК, и начинается денатурация с освобождением синтезированных фрагментов ДНК с геномной матрицы.
В результате образовавшиеся фрагменты ДНК становятся матрицами для следующих циклов амплификации, и процесс может протекать в геометрической прогрессии, давая необходимое количество циклов. Если один полный цикл амплификации занимает 1-2 мин,
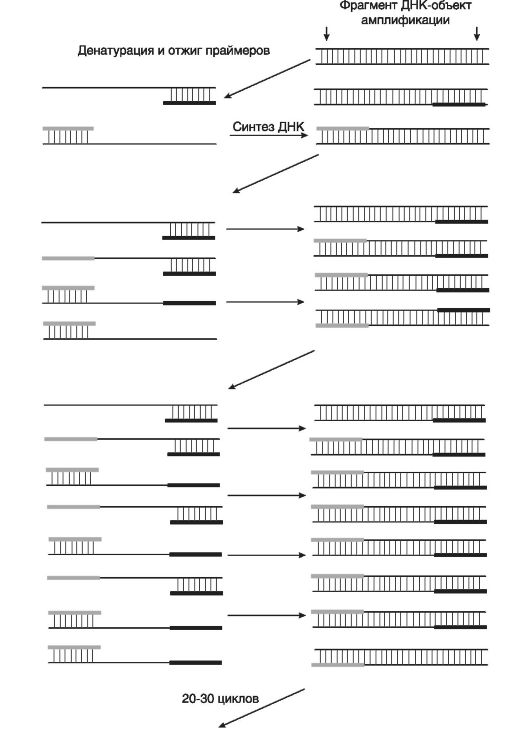 Рис. 61. Принципиальная схема ПЦР (по Баранову В.С., Иващенко Т.Э., 2005)
Рис. 61. Принципиальная схема ПЦР (по Баранову В.С., Иващенко Т.Э., 2005)
то в течение 25-30 циклов количество синтезированных копий ДНК достигнет несколько миллионов. При этом выбор оптимального режима работы определяется длиной и специфичностью амплифицируемого участка молекулы ДНК.
Анализ результатов ПЦР проводится с помощью гельэлектрофореза продуктов амплификации, которые в случае необходимости обрабатываются рестриктазами. В дальнейшем гели окрашивают бромидом этидия и исследуют продукты рестрикции в проходящем УФ-свете с длиной волны 380 нм на наличие в них невыявленных мутаций. Таким образом, ПЦР служит универсальной моделью для получения образцов фрагментов ДНК, обусловливающих развитие наследственной патологии.
В настоящее время на основе ПЦР разработано множество диагностических тестов, позволяющих эффективно диагностировать самые разные формы наследственной патологии.
СОВРЕМЕННЫЕ МЕТОДЫ ДНК-ДИАГНОСТИКИ
Методы идентификации мутаций генов наследственных болезней
К методам идентификации мутаций генов наследственных болезней относятся: идентификация известных мутаций, идентификация невыявленных мутаций, идентификация мутаций и генетических полиморфизмов.
Идентификация известных мутаций
В настоящее время идентифицированы сотни генов, мутации в которых вызывают моногенные и мультифакториальные заболевания. Созданы банки данных об этих генах, отражающие спектр, классификации и механизмы возникновения мутаций, а также методы их диагностики. Во многих генах выделены мажорные (наиболее часто встречающиеся) мутации, разработаны алгоритмы молекулярной диагностики.
Кроме того, созданы коммерческие наборы, выявляющие в автоматическом режиме сразу несколько диагностически значимых мутаций в генах разных заболеваний, например миодистрофии Дюшенна- Беккера, МВ, серповидно-клеточной анемии и ФКУ.
Из известных точковых мутаций наиболее просто диагностируются однонуклеотидные замены, которые приводят или к исчезнове-
нию, или к образованию сайта узнавания эндонуклеаз (рестриктаз) после обработки этими ферментами амплифицированного фрагмента ДНК, содержащего мутацию. Сайт узнавания (рестрикции) - это специфическая область ДНК размером в 5-6 нуклеотидов.
К методам выявления известных мутаций также относятся следующие.
Амплификации рефрактерной мутационной системы
Метод амплификации рефрактерной мутационной системы (ARMS) предложен C.R. Newton et al. и C.D.K. Bottema et al. в 1989-
1990 гг.
Суть метода состоит в параллельной постановке двух ПЦР, для одной из которых праймером служит аллельспецифическая мутантная ДНК, а другой - нормальные олигонуклеотидные последовательности ДНК. При этом в качестве второго праймера в двух реакциях выбирают одну и ту же олигонуклеотидную последовательность, чтобы могли амплифицироваться участки ДНК одинаковой протяженности.
В исследуемой ДНК амплифицированные фрагменты образуются только в том случае, если в качестве аллельспецифичного праймера выбирается мутантная последовательность, тогда как нормальный олигонуклеотидный праймер блокируется.
Метод нашел широкое применение при идентификации мутаций в генах МВ, бета-талассемии, ФКУ и для типирования генов HLA- системы.
При применении этого метода возможно полное автоматическое сканирование.
ПЦР-опосредованный сайт-направленный мутагенез
Метод ПЦР-опосредованного сайт-направленного мутагенеза предложен H.G. Eiken et al. и I.S.L. Ngo et al. в 1991 г.
Суть метода состоит в том, чтобы выбор амплифицируемого участка ДНК соответствовал следующим требованиям:
• 3'-конец одного из праймеров должен примыкать непосредственно к мутантному сайту;
• один из нуклеотидов со стороны 3'-конца следует изменить так, чтобы он в сочетании с нуклеотидом мутантного сайта мог создать (или не создать) в этом месте сайт рестрикции для какойлибо нуклеазы.
Таким образом, обязательным условием является то, что ПЦРпродукты с нормального и мутантного аллелей должны отличаться
по наличию индуцированного сайта рестрикции. В результате на электрофореграмме у гомозигот будет присутствовать два фрагмента, содержащих мутацию, а у гетерозигот - один фрагмент, и все они должны соответствовать по длине рестрифицированным участкам молекулы ДНК.
К сожалению, из-за наличия этого обязательного условия данный метод почти не востребован в диагностике наследственных болезней. Аллельспецифические олигонуклеотиды
Метод аллельспецифических олигонуклеотидов (ASO) предложен J. Reiss в 1991 г. Суть метода состоит в амплификации фрагментов ДНК и последующей гибридизации с мечеными аллельспецифическими олигонуклеотидами, к которым обычно относятся последовательности размером 19 н.п., имеющие в центре мутантный сайт.
При этом каждый из двух зондов должен быть комплементарным к нормальному или мутантному вариантам ДНК. Условия гибридизации подбирают таким образом, чтобы стабильные дуплексы образовывались при полной комплементации гибридных пар. В таких условиях амплифицированные фрагменты ДНК без мутации будут гибридизироваться только с нормальным зондом, ДНК гомозигот с мутацией - только с мутантным зондом, а ДНК гетерозигот - с обоими маркерными зондами.
В 1994 г. И.В. Лебедева и соавторы предложили модифицированный вариант этого метода с использованием аллельспецифических ДНК-зондов, меченных биотином или пероксидазой хрена (метод применяется для автоматической регистрации мажорных мутаций при муковисцидозе и серповидноклеточной анемии).
В модификации F.F. Chebaba (1993) для автоматического анализа используется принцип ленточного фильтра (стрипта) с нанесенными пятнами олигопраймеров, каждый из которых соответствует определенной мутации. Стрипт помещают в раствор со смесью меченых амплифицированных фрагментов и создают условия для гибридизации, после чего выявляют тестируемые мутации. Именно этот принцип использован в ряде новых технологий исследования мутаций и генетических полиморфизмов (см. ниже).
Лигирование синтетических однонуклеотидных зондов
Метод лигирования синтетических однонуклеотидных зондов (OLA) был предложен U.N. Landergren в 1993 г. Суть метода состоит в том, что ДНК-зонды для лигирования подбирают так, чтобы они были полностью комплементарными нормальному фрагменту ДНК
в области локализации мутации, причем сама нуклеотидная замена должна находиться на стыке двух праймеров.
После гибридизации синтезированные нуклеотидные фрагменты сшиваются ДНК-лигазами, выделенными из термофильных микроорганизмов. В результате при наличии мутаций в анализируемом участке ДНК на конце одного из зондов образуется сайт некомплементарного спаривания, непосредственно примыкающий к месту лигирования. Сшивки между зондами в этом случае не происходят.
Метод включает несколько циклов гибридизации, лигирования и денатурации с последующим электрофоретическим анализом меченых однонитевых фрагментов ДНК. Метод был успешно применен для тестирования глобиновых генов при серповидноклеточной анемии и мутации F508 при МВ.
Идентификация невыявленных мутаций
Как оказалось, с помощью ПЦР выявляются не только протяженные делеции амплифицированных фрагментов ДНК, но и небольшие делеции и вставки единичных нуклеотидов, которые влияют на размеры этих фрагментов. Например, такие изменения можно зарегистрировать при электрофорезе в агарозном или полиакриламидном гелях при исследовании наиболее часто встречающихся мутаций в гене МВ (делеции трех нуклеотидов или del F508).
Вместе с тем, при замене одного или нескольких нуклеотидов в гене длина амплифицированного фрагмента остается неизменной, тогда как некоторые физико-химические свойства мутантной молекулы меняются. Разработаны разные варианты поиска мутантных фрагментов ДНК и идентификации в них точковых мутаций. Основными из них являются следующие методы.
Анализ конформационного полиморфизма однонитевой ДНК или выявление точковых мутаций
Метод анализа конформационного полиморфизма однонитевой ДНК или выявления точковых мутаций (метод SSCP), предложен М. Orita et al. (1989) и D. Clavac, M. Dean (1993). Метод получил широкое распространение. Метод включает амплификацию фрагментов размером от 50 до 300 н.п., их денатурацию и электрофорез в полиакриламидном геле. Эффективность обнаружения (детекции) мутаций при размерах фрагмента менее 200 н.п. составляет 70-95%, а при длине более 400 н.п. уменьшается до 50%. Метод основан на регистрации различий в электрофоретической подвижности одно-
нитевых фрагментов молекулы ДНК (одинаковых по величине, но разных по пространственной ориентации) вследствие имеющихся в них разных нуклеотидных замен, что влияет на конформацию (скручивание) небольших однонитевых фрагментов.
Денатурирующий градиентный гель-электрофорез
Метод денатурирующего градиентного гель-электрофореза (DGCE) был предложен Р. Майерс и др. (1990), а также R. Fodde и М. Losekoot (1994). Метод основан на зависимости свойств денатурации небольших двухнитевых молекул ДНК от их нуклеотидной последовательности (соотношение АТ-пар и ГЦ-пар).
Различия выявляются при сравнении подвижности нормальных и мутантных двухнитевых фрагментов ДНК при их электрофорезе в условиях денатурации благодаря разности температур при создании градиента концентрации мочевины или формальдегида в геле.
Метод пригоден для анализа крупных фрагментов ДНК. Его разрешающая способность при исследовании фрагментов до 600 н.п. составляет 95%.
Метод эффективно применяется при анализе индуцированных точковых мутаций, возникающих в одной из 100 клеток, обработанных мутагеном. Однако он технически сложен и отличается высокой стоимостью.
Гетеродуплексный анализ
Метод гетеродуплексного анализа (НА) предложен W. Hiao и P.J. Oefner в 2001 г. Позволяет идентифицировать мутации, локализованные в одной из нитей матричной ДНК и находящиеся в гетерозиготном состоянии. В амплифицированной смеси наряду с двумя типами гомодуплексов (нормальная и мутантная последовательности нуклеотидов) возникают гетеродуплексы между нормальной и мутантной цепочками ДНК.
У мутантных гетеродуплексов иная подвижность, чем у гомодуплексов (за счет конформационных особенностей в местах несовпадения нуклеотидов - mismatch), что выявляется при электрофорезе в полиакриламидном геле.
Разрешающая способность метода при исследовании фрагментов менее 300 н.п. достигает 80-95%.
Имеются модифицированные варианты этого метода, например, дополненные конформационно-чувствительным гель-элекрофорезом в сочетании с флуоресцентными красителями - метод CSGE (широко используется для поиска мутаций в разных генах); метод жидкостной хроматографии - метод DNPLC (см. ниже).
Химическое расщепление некомплементарных сайтов
Метод химического расщепления некомплементарных сайтов или метод СМС, предложен М. Grompe в 1993 г. Информативность - 95-100%. Метод основан на способности ряда химических соединений или ферментов специфически разрывать нить ДНК в месте локализации неспаренного основания (рис. 62).
В частности, высокой чувствительностью к гидроксиламину отличается неспаренный цитозин, а к тетраоксиду осмия - неспаренный тимин. Последующая обработка такой молекулы ДНК пиперидином ведет к ее полному разрыву в модифицированном сайте.
Суть метода СМС заключается в выявлении мутаций с помощью меченых ДНК-зондов, соответствующих нормальным вариантам молекулы ДНК. Такими зондами служат синтезированные олигонуклеотиды, клонированные участки ДНК или амплифицированные фрагменты. При применении метода эталонную меченую ДНК смешивают с избытком тестируемой ДНК или РНК. К тестируемым образцам ДНК относятся клонированные ДНК, обработанные соответствующими эндонуклеазами, либо амплифицированные фрагменты. Смесь нагревают до полной денатурации двухнитевых молекул и после этого охлаждают, чтобы создать условия для образования дуплексов.
При наличии мутаций в тестируемых образцах ДНК (в гетеродуплексах, возникших в результате гибридизации между однонитевыми молекулами эталонной и тестируемой ДНК) образуются места негомологичного спаривания.
После обработки соответствующими химическими агентами на основе электрофореза и радиоавтографии проводится идентификация и локализация мутантных сайтов в исследуемых участках ДНК. Появление укороченных фрагментов ДНК на электрофореграмме указывает на наличие мутантного сайта, а определение размера укороченного фрагмента выявляет локализацию этого сайта в тестируемой молекуле ДНК.
Большими преимуществами метода СМС являются:
• возможность исследовать протяженные участки ДНК (до 2 тыс. н.п.);
• возможность одновременно выявлять (локализовать) несколько мутаций в одном фрагменте ДНК;
• возможность использовать несколько ДНК-зондов для поиска мутаций (при мультиплексном варианте метода).
В последние годы для идентификации точковых нуклеотидных замен широкое применение получил флуоресцентный вариант этого метода.
Идентификация мутаций и генетических полиморфизмов
Денатурирующая жидкостная хроматография высокого разрешения
Метод денатурирующей жидкостной хроматографии высокого разрешения (DNPLC) был предложен P.J. Oefner и P.A. Underbill в 1995 г. Позволяет в течение 2-3 мин определить однонуклеотидные замены, делеции и инсерции в амплифицированных участках с размерами до 1,5 тыс. н.п. Информативность метода достигает 95%. Метод представляет собой модифицированный вариант гетеродуплексного
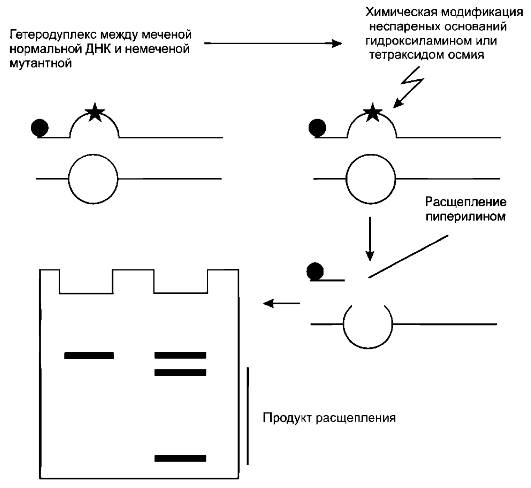 Рис. 62. Принцип метода СМС (по Баранову В.С., Иващенко Т.Э., 2005)
Рис. 62. Принцип метода СМС (по Баранову В.С., Иващенко Т.Э., 2005)
анализа с последующим автоматическим анализом результатов при помощи жидкостной хроматографии (см. выше).
Согласно этому методу, продукты ПЦР исследуемого фрагмента ДНК подвергаются частичной денатурации в растворе с контрольными образцами того же фермента в соотношении 1:1 путем нагревания смеси до 95 °С и медленной последующей ренатурации (охлаждение).
При отсутствии мутаций в исследуемом фрагменте формируется только один тип гомодуплексов, тогда как при наличии мутаций - несколько типов гетеродуплексов и гомодуплексов.
Возникающие гетеродуплексы значительно менее устойчивы к температуре, чем гомодуплексы. Именно это свойство улавливается с помощью жидкостной хроматографии.
Предварительный подбор температур плавления гомо- и гетеродуплексов резко повышает чувствительность данного метода по сравнению с таковой SSCP-метода (см. выше), метода двухмерного сканирования гена и собственно гетеродуплексного анализа (см. выше).
Метод DNPLC широко используется при генотипировании путем определения однонуклеотидных замен (SNP) и EST (Hiao W. и Oefner P.J., 2001), а также при первичном анализе мутаций в генах-кандидатах, изучении молекулярных маркеров и мутаций Y-хромосомы и вообще при картировании генов.
Поверхностный плазмоновый резонанс
Метод поверхностного плазмонового резонанса (метод SPR) основан на одноименном явлении, представляющем квантово-оптический (оптико-электронный) феномен, возникающий в результате взаимодействия между поляризованным светом с определенной длиной волны и поверхностью металла.
Метод SPR позволяет выявлять молекулы ДНК и контролировать процесс связывания между двумя молекулами и более в режиме реального времени. Взаимодействие фрагментов ДНК приводит к изменению показателя преломления света в поверхностном слое чувствительного датчика, которое фиксируется как изменение в интенсивности сигнала SPR. При этом одна из взаимодействующих молекул в реальном времени отражается на сенсорограмме.
Уже при введении образца проба связывается с иммобилизованными на поверхности чувствительного датчика олигонуклеотидами, что усиливает сигнал SPR. В конце процедуры введения
образца проба изменяется под непрерывной струей буфера, и наблюдающееся уменьшение сигнала SPR отражает диссоциацию пробы от поверхностно-связанного комплекса. В зависимости от нуклеотидного состава исследуемой молекулы ДНК характер ассоциации и диссоциации изменяется (рис. 63). ДНК-чипы
С помощью метода ДНК-чипов достигнуты значительные успехи в идентификации и массовом сканировании однонуклеотидных замен (SNP).
• Чипы (arrays) - это серии коротких олигонуклеотидных последовательностей, отличающихся по своему составу и зафиксированных (химическими способами) на стекле таким образом, что на 1 см2 их размещается до 1000. При этом позиция каждого чипа четко фиксируется и может определяться в автоматическом режиме. В настоящее время применяются 3 типа чипов. Гибридизационные чипы. Они разработаны на основе аллельспецифической гибридизации. Это олигонуклеотидные последова-
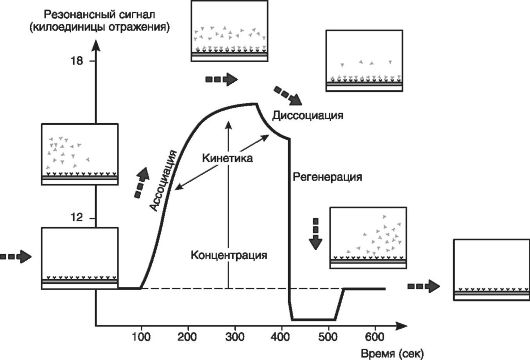 Рис. 63. Схема сенсорограммы (по Баранову В.С., Иващенко Т.Э., 2005)
Рис. 63. Схема сенсорограммы (по Баранову В.С., Иващенко Т.Э., 2005)
тельности, комплементарные двум разным аллелям (SNP), фиксируются на стекле. Флуоресцентный ПЦР-продукт, содержащий SNP, гибридизируется на чипе, и образовавшийся гибридизационный паттерн анализируется под микроскопом или с помощью специальных компьютерных программ.
• Чипы с фиксацией олигонуклеотидов на агарозной матрице. Они разработаны на основе аллельспецифической гибридизации, но фиксируются при помощи электрического тока на специальной агарозной подложке или матрице. Взаимодействие анализируемых проб с олигонуклеотидными последовательностями происходит под действием электрического поля, которое направляет отрицательно заряженные фрагменты ДНК к положительно заряженному чипу с иммобилизованными на нем последовательностями. При этом концентрация последовательностей в анализируемой пробе локально повышается в непосредственной близости от чипа, что позволяет повысить скорость гибридизации и сократить время проведения анализа.
• Чипы с ферментным процессингом. Они разработаны на основе двух методов: блот-гибридизации и ПЦР. Суть разработки: олигонуклеотиды, примыкающие к SNP, фиксируются на чипе, затем проводится реакция с ДНК-полимеразой и дидезоксинуклеотидами, меченными разными флуорохромами. В этой реакции каждый зафиксированный на матрице олигонуклеотид становится праймером для ПЦР, которая начинается и заканчивается присоединением к праймеру единственного меченого дидезоксинуклеотида, соответствующего нуклеотиду на матрице. Цвет флуоресценции свидетельствует о том, какой из четырех нуклеотидов вступил в реакцию с олигопраймером.
Таким образом, ДНК-чипы позволяют не только быстро идентифицировать SNP, но и определять их природу (Gut I.G., 2001 г.).
Анализ сцепления болезни с полиморфными маркерами
Анализ сцепления болезни с полиморфными маркерами считается одним из наиболее перспективных методов диагностики. Метод предложен американским генетиком Д. Ботстейном в 1980 г. Используется для определения локусов, сцепленных с моногенными и мультифакториальными заболеваниями в семьях (включая злокачественные опухоли).
Как известно (см. главу 5), на хромосомной карте человека локализовано около 6 тыс. полиморфных генных локусов или полиморфных
ДНК-маркеров. Для анализа обычно используются 300-500 маркеров, распределенных по всему геному, т.е. это метод полногеномного сиквенирования.
По существу, данный метод обеспечивает картирование локуса, сцепленного с заболеванием, и последующий скрининг на мутации в генах-кандидатах, лежащих внутри картированной области или области позиционных кандидатов.
Именно эта стратегия получила название стратегии позиционного клонирования или «обратной генетики» (путь от гена к признаку, см. главу 1).
Анализ полиморфизма длин рестрикционных фрагментов
Метод анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) позволяет маркировать нормальные и патологические гены в ядерных семьях и определять их наличие у членов семейной родословной, что имеет большое значение для профилактики наследственной патологии. Наиболее просто идентифицируются мутации, изменяющие длину амплифицированных фрагментов, ибо они легко визуализируются при электрофоретическом анализе.
В частности, протяженные делеции захватывают целые экзоны и могут быть выявлены по изменению длины рестрикционных фрагментов методом блот-гибридизации.
Для выявления протяженных делеций на половых хромосомах разработан простой и надежный вариант диагностики - мультиплексная ПЦР, например, для обнаружения делеций в гене дистрофина при миодистрофии Дюшенна-Беккера.
Другой вариант ПЦР, позволяющий идентифицировать протяженные делеции у гетерозигот, основан на использовании в качестве матрицы для ПЦР кодирующей ДНК (кДНК), полученной путем обратной транскрипции мРНК, изолированной из тканей или культур клеток, экспрессирующих ген дистрофина.
Особое значение метод анализа ПДРФ имеет для пренатальной диагностики наследственных болезней. Например, в случае обнаружения у плода гена миодистрофии Дюшенна-Беккера или гена ФКУ такая беременность должна быть прервана.
Анализ полиморфизма микросателлитных последовательностей
Как сказано выше, микросателлитные повторы - это наиболее удобный объект для применения косвенной ДНК-диагностики. Показано, что кластеры динуклеотидных СА-повторов встречаются в геноме человека с частотой 1 кластер в среднем на 30 тыс. н.п. Причем
во многих кластерах присутствуют от 10 до 30 динуклеотидных пар, и типичное количество аллелей составляет 4-8, что обеспечивает высокую информативность метода анализа полиморфизма микросателлитных последовательностей (повторов) и позволяет определить, с каким из этих повторяющихся аллелей в ядерной семье сцеплено повреждение ДНК и на каком расстоянии от маркера оно находится - все это имеет большое значение для оценки генетического риска, который определяется частотой рекомбинации между сайтом повреждения и полиморфным генным локусом.
Анализ ассоциации болезни с полиморфными маркерами
Метод анализа ассоциации болезни с полиморфными маркерами основан на сравнении частот встречаемости конкретных полиморфных маркеров у больных с МФЗ и здоровых лиц в одной популяционной группе.
Полиморфными маркерами служат определенные аллели генов и антигены HLA-комплекса. Наиболее частые ассоциации с HLA- антигенами разных классов выявлены при аутоиммунных и инфекционных заболеваниях. Достоверными являются ассоциации с HLA- антигенами при анкилозирующем спондилите (антиген В27), болезни Аддисона (DR3), гемохроматозе (A3), гнездной алопеции (DQW7), псориазе CW6), псориатическом спондилите (В27), рассеяном склерозе (DR3), ревматоидном артрите (DR4).
Наибольшая эффективность метода отмечается при применении в популяциях с высоким уровнем инбридинга, а также в ядерных семьях с разными типами браков.
Анализ идентичных по происхождению аллелей
Метод анализа идентичных по происхождению аллелей или метод IBD, относится к непараметрическим методам, основанным на изучении частоты встречаемости одного и того же аллеля в разных парах родственников (сибсы, дядя-племянник, дед-внук), ибо известно, что среди родственников общие аллели обнаруживаются чаще, чем при их случайной сегрегации. Если идентичный по происхождению аллель сцеплен с МФЗ, то частота его встречаемости в парах больных родственников будет достоверно превышать ожидаемую частоту при отсутствии сцепления, и в этом случае достоверность отличий будет оцениваться с помощью метода кси-квадрат.
FISH-метод диагностики хромосомных нарушений
Основным методом диагностики хромосомных болезней и хромосомных нарушений является цитогенетический метод.
В 90-е годы XX в. для диагностики хромосомной патологии был предложен молекулярно-цитогенетический метод FISH или метод флуоресцентной in situ гибридизации.
Данный метод имеет ряд преимуществ в сравнении с методом блот-гибридизации, сочетающейся с радиоактивным мечением. В частности, FISH-метод обеспечивает: более точную локализацию гибридизационного сигнала на хромосоме, проведение анализа за 2-3 дня, безопасность нерадиоактивной метки, одновременное использование не одного, а нескольких ДНК-зондов с различной цветовой окраской.
Вместе с тем, для эффективного применения FISH-метода, например для идентификации хромосом, фрагментов онкогенов, фрагментов гена инсулина и других компонентов хромосом, необходимо наличие коллекции меченных биотином ДНК-зондов, а также дорогостоящей флуоресцентной микроскопической техники.
Методы диагностики врожденных аномалий развития
Молекулярно-генетическая диагностика врожденных аномалий развития направлена на определение их первопричины. Среди генетических причин врожденных аномалий развития могут быть мутации доминантно и рецессивно наследуемых генов, аддитивное действие генов и факторов внешней среды и хромосомный дисбаланс (см. главу 23). Поэтому для идентификации таких причин применяется большой арсенал вышеперечисленных методов диагностики.
Тестирование неполноценного белка
Основными объектами для тестирования неполноценного белка служат продукты мутантных генов: неполноценные структурные или функциональные пептиды и полипептиды. Сначала из лейкоцитов крови выделяют тотальную мРНК, проводят обратную транскрипцию, амплифицируют специфические экзоны кДНК (метод RT-PCR). Затем встраивают амплифицированную область в экспрессионную бесклеточную систему и анализируют образовавшийся в ней белковый продукт.
Метод RT-PCR особенно эффективен при выявлении мутаций в протяженных генах, например при миодистрофии Дюшенна и нейрофиброматозе типа I.