Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 8 ПУТИ И МЕХАНИЗМЫ УПРАВЛЕНИЯ МЕТАБОЛИЗМОМ
Регуляция активности ферментов
Поскольку все протекающие в клетке метаболические реакции катализируются ферментами, то пути и механизмы управления метаболизмом сводятся к регуляции уровней метаболитов или активности ферментов. В целом регуляция активности ферментов обеспечивается взаимодействием генных, метаболических (энергетических и трофических), нервных, гормональных и иммунных реакций, а также с помощью огромного количества нервных окончаний (синапсов) в органах и тканях и клеточных рецепторов, реагирующих на действие постоянно поступающих к ним сигнальных молекул (нейромедиаторы, гормоны, факторы транскрипции и т.д.).
В первую очередь эффективность регуляции метаболизма зависит от адекватного питания и трофики отдельных клеток и целого организма, а также активности (интенсивности) происходящего в них обмена веществ. Цель такой регуляции заключается в поддержании баланса между химическими реакциями в системе «синтез-распад» (см. главу 7).
Возникает вопрос: какие ферменты метаболического пути следует регулировать? Ответ давно известен - ферменты, расположенные в стратегически важных местах: на необратимой стадии в целом обратимого процесса.
Стратегический пункт контроля - это, как правило, первый фермент метаболического пути.
В качестве примера следует привести ранее рассмотренную первую обратимую реакцию синтеза пуриновых нуклеотидов, которую катализирует ФРПФ-синтетаза, ингибируемая АМР, АDР, GМР и СМР. Затем образуется 5-фосфорибозиламин и далее следует каскад из 9 реакций, завершающихся сборкой пуринового нуклеотида, содержащего гипоксантин - молекулу инозиновой кислоты, которая преобразуется либо в аденин, либо в гуанин.
Другой пример - регуляция через обратную связь (ингибирование конечным продуктом).
В молекулярной биологии существует ряд способов регуляции активности ферментов (путей и механизмов управления метаболизмом).
Основные способы регуляции относятся к обратимому влиянию на скорость ферментативных реакций путем изменения количества фермента или его каталитической активности.
Дополнительные способы регуляции относятся к необратимой активации ферментов.
Рассмотрим сначала наиболее значимые для жизни клетки и организма основные способы - это аллостерическая регуляция и ковалентная модификация белка.
Первый способ относится к механизмам внутреннего (внутриклеточного), а второй способ - к механизмам внешнего (внеклеточного) управления метаболизмом. В этом случае часто используется старое название: фосфорилирование и дефосфорилирование.
Аллостерическая регуляция и основные секреты молекулярной жизни
Аллостерическая регуляция происходит внутри клетки и определяется избирательным связыванием аллостерических регуляторов фермента с субстратом.
Приставка «алло» означает «другой». Она подразумевает наличие на ферменте (кроме участка связывания субстрата) еще одного или нескольких участков для связывания лигандов или низкомолекулярных соединений (небольших белков).
Лиганды - это аллостерические эффекторы или регуляторы. Обычно они не похожи на субстрат, но их действие происходит при определенной концентрации субстрата.
Как правило, эффекторы управляют аллостерической реакций, но ее регуляторами могут быть и сами метаболиты.
Положительные эффекторы увеличивают активность фермента - это активаторы, отрицательные эффекторы ее понижают - это ингибиторы. Аллостерическая реакция мгновенна, но она обратима, когда концентрация фермента в среде уменьшается и становится прежней.
Следует отметить, что существование клетки как сложной биологической системы было бы нереальным без аллостерической регуляции. Именно этот механизм «открыл для эволюции» возможность создавать множество информационных каналов (каналов связи), которые позволяют получать сигналы из любой точки метаболических событий, происходящих в клетках и организме в целом.
Практически сразу после своего открытия аллостерическая регуляция была названа вторым секретом молекулярной жизни . Безусловно, что первым секретом является сама молекула ДНК и главное свойство содержащихся в ней генов - их экспрессия, благодаря которой синтезируются различные белки - носители многочисленных биологических функций (признаков) клетки и организма. Причем не должно быть никаких сомнений, что белки - еще один из секретов молекулярной жизни, а третий он или иной по значимости - не столь принципиально!
Примерами внутреннего управления метаболизмом являются: регуляция обмена гликогена, гликолиза и глюконеогенеза, уровня пируватдегидрогеназы, концентрации лимонной кислоты (цикл Кребса), активности окислительного фосфорилирования, процессов окисления и синтеза жирных кислот, переноса электронов в митохондриях. Таким образом, управление метаболизмом внутри клетки обычно (но далеко не всегда) осуществляется с помощью аллостерической регуляции, цель которой - избежать дефицита или перепроизводства необходимых для жизни клетки веществ, т.е. поддержать их баланс.
Ковалентная модификация белка
Ковалентная модификация белка - это третий по значимости, но уже внешний способ обратимой регуляции активности ферментов.
В его основе лежит механизм переноса (с помощью протеинкиназы) фосфатного остатка с аденозинтрифосфата (АТР) на гидроксильную группу (НО) одного из остатков аминокислоты - серина. В результате изменяется конформация регуляторных белков (соотношение между молекулами киназ и фосфорилаз), что улучшает их каталитические свойства (рис. 35).
Лигандзависимая внешняя сигнализация
Внешнее управление метаболизмом осуществляется также с помощью агонист ов (в том числе лигандов), находящихся снаружи клетки.
При такой регуляции лиганд разносится током крови по всему организму, но влияет только на свои клетки-мишени. Если клетка не имеет рецепторов к лиганду, то она «не видит» предназначенный ей сигнал и ионный канал не открывается (рис. 36). Если же клетка имеет соответствующие рецепторы, то она «видит» сигнал и ионный канал открывается.
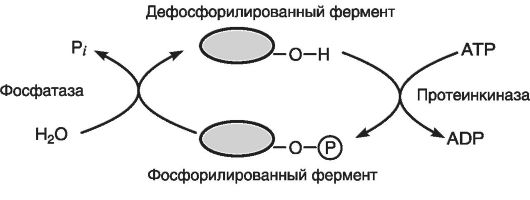 Рис. 35. Регуляция активности фермента посредством фосфорилирования (по Эллиот В., Эллиот Д., 2002)
Рис. 35. Регуляция активности фермента посредством фосфорилирования (по Эллиот В., Эллиот Д., 2002)
Именно так работает рецептор ацетилхолина, открывающий лигандзависимый Na+/ К+-канал (см. главу 13). При связывании ацетилхолина этот канал открывается, позволяя ионам Na+ двигаться в клетку, а ионам К+ выходить из клетки. При этом первые ионы (из-за более высоких концентраций) входят в клетку быстрее, чем вторые ионы выходят из нее, что приводит к уменьшению отрицательного заряда внутри клетки и вызывает деполяризацию плазматической мембраны вблизи ацетилхолиновых рецепторов синапса. В результате стимулируется распространение нервного импульса, идущего
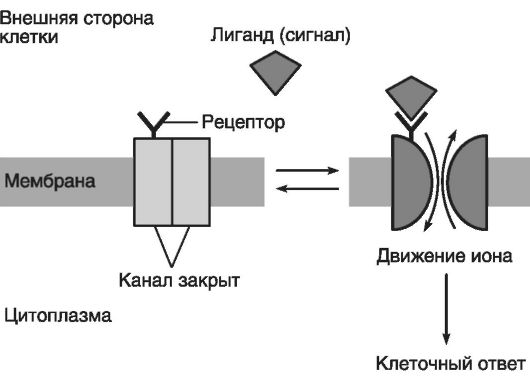 Рис. 36. Лигандзависимый ионный канал (по Эллиот В., Эллиот Д., 2002)
Рис. 36. Лигандзависимый ионный канал (по Эллиот В., Эллиот Д., 2002)
по нервному волокну, но оно (распространение) идет уже с участием ионных каналов другого типа, называемых потенциалзависимыми ?+/К+-каналами, открывающимися при нарушении потенциала покоя. Примерами внешнего лигандзависимого управления служат способы регуляции:
• гликолиза и глюконеогенеза;
• метаболизма углеводов и жиров с помощью адреналина и норадреналина, а также глюкагона и инсулина;
• синтеза циклического АМР из АТР с помощью ацетилатциклазы;
• расщепления клетками гликогена;
• поглощения клетками глюкозы и жиров.
Рецептор-опосредованная сигнализация
Сначала вспомним клеточные рецепторы, данные о которых были рассмотрены в главе 6.
Механизм регуляции (сигнализации) с помощью внешних сигналов зависит от того, что большинство сигнальных молекул способно растворяться в воде и поэтому связывается только с внешними рецепторами клетки. Механизм такой регуляции приведен на рис. 37.
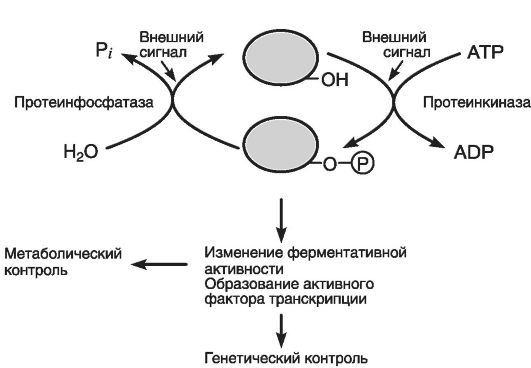
Рис. 37. Механизм регуляции для большинства внешних сигналов (по Эллиот В., Эллиот Д., 2002)
Вместе с тем, некоторые сигнальные молекулы , например стероидные гормоны, тироксин и оксид азота, растворяются в липидах и поэтому поступают прямо в клетку через липидный бислой мембраны, где связываются с внутренними рецепторами. Такая внутренняя регуляция получила название рецептор-опосредованной сигнализации (рис. 38). В частности, если сигнальными молекулами являются стероиды, то они связываются в цитоплазме с лигандами и в комплексе с ними движутся в клеточное ядро.
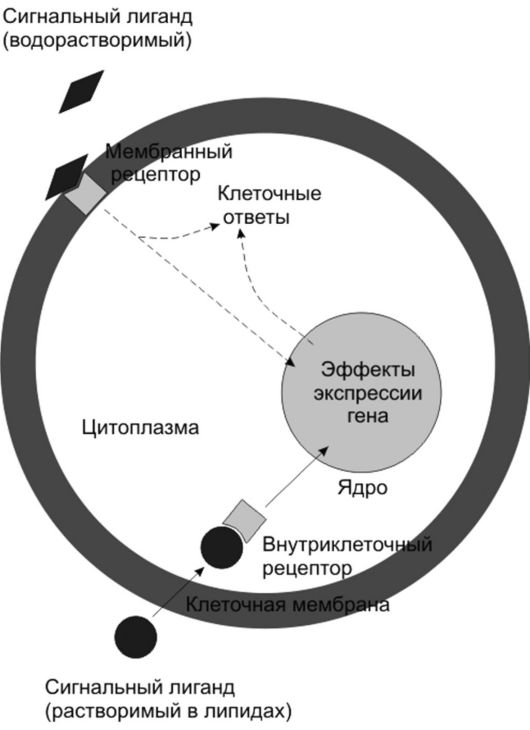 Рис. 38. Основные события при внутренней рецептор-опосредованной сигнализации (по Эллиот В., Эллиот Д., 2002)
Рис. 38. Основные события при внутренней рецептор-опосредованной сигнализации (по Эллиот В., Эллиот Д., 2002)
Если лигандом является оксид азота, то внутриклеточный рецептор вырабатывает циклический GMP, оказывающий прямое метаболическое действие.
Завершая рассмотрение основных путей и механизмов управления метаболизмом, следует подчеркнуть, что все они часто контролируют одни и те же ферментативные реакции. Безусловно, что такой контроль происходит в соответствии с программой онтогенеза, которая определяет, какой путь управления и когда следует применить на уровне клетки и организма (см. главы 12 и 13). Вместе с тем, на вопрос, как она это делает, ответить пока нельзя.
Более того, возникает новый вопрос: как рассмотренные пути и механизмы используются в конкретных условиях регуляции метаболизма в отдельной клетке и организме в целом? Ответа нет.
Например, если внешняя регуляция путем фосфорилирования - дефосфорилирования зависит от активности фермента-мишени, которая определяется внешним сигналом, то внутренняя аллостерическая регуляция осуществляется при совместном участии фермента и субстрата.
Следовательно, в этой проблеме существует много вопросов, на которые почти нет ответов.
Другие ранее известные способы внешнего и внутреннего управления метаболизмом
Кроме механизма открытия лигандзависимых ионных каналов, сигнальные молекулы могут передаваться в клетку (к ее ядерным и цитоплазматическим структурам) непосредственно от соседних клеток. Выделены два таких механизма: непосредственная передача сигнала при активации Т-хелперной клетки антигенпредставляющей клеткой (см. главу 15); передача сигнала через регуляторные поры или щелевые контакты между соседними клетками, когда АТР и сигнальные молекулы переходят из клетки в клетку благодаря прямому взаимодействию между их цитоплазмами (см. главу 6).
Способы и примеры управления метаболизмом, описанные в последние годы
Поступающие к клеткам внешние сигналы регулируют внутриклеточную активность двумя способами управления метаболизмом: не затрагивая и затрагивая экспрессию генов.
Примерами регуляции без затрагивания экспрессии генов являются:
• активация ацетилхолином произвольных мышечных сокращений;
• открытие лигандзависимых пор в мембранах нейронов при включении нервного импульса;
• регуляция активности ферментов, участвующих в метаболизме жиров и углеводов.
Имеются также многочисленные примеры регуляции с затрагиванием экспрессии генов, так как от нее зависят практически все внутриклеточные генетические процессы.
ДНК-связывающие факторы
В регуляции клеточной активности с затрагиванием экспрессии генов участвуют ДНК-связывающие факторы, работающие преимущественно на уровне транскрипции мРНК. К ним относятся молекулы РНК-полимеразы I (для рРНК), II (для мРНК) и III (для тРНК) и многочисленные факторы транскрипции. Они участвуют в генной экспрессии на протяжении всего онтогенеза, включая процессы дифференцировки клеток и тканей.
В последние годы были идентифицированы гомейотические гены, или гены, ответственные за эмбриональное развитие (см. главу 12). Продукты их экспрессии - пептиды имеют сходные домены или гомеодомены, а участки ДНК, кодирующие такие гомеодомены, называются гомеобоксами.
Большинство гомеодоменов - это ДНК-связывающие факторы. Они представляют собой пептиды длиной не более 60 аминокислотных остатков. Гомеодомены сгруппированы в семейства, среди которых выделены «белки с мотивами».
«Мотив» - это узнаваемое структурное свойство или небольшой участок молекулы белка, связывающийся с операторным участком гена. Выделены три типа «мотивов».
Первый тип мотива: «спираль-поворот-спираль», или НТН-белки (рис. 39). Такая молекула включает две альфа-спирали, соединенные бета-изгибом. Из них одна узнающая спираль располагается в большой бороздке молекулы ДНК.
При этом ДНК-узнающий участок мотива этого типа является неполным палиндромом (палиндром - это фраза, одинаково читаемая слева-направо и справа-налево, например: «ум его - бог ему»). Две половины палиндрома действуют как единое целое.
И хотя палиндром не абсолютен, обе его половины представляют собой участки идентичного связывания нуклеотидных последова-
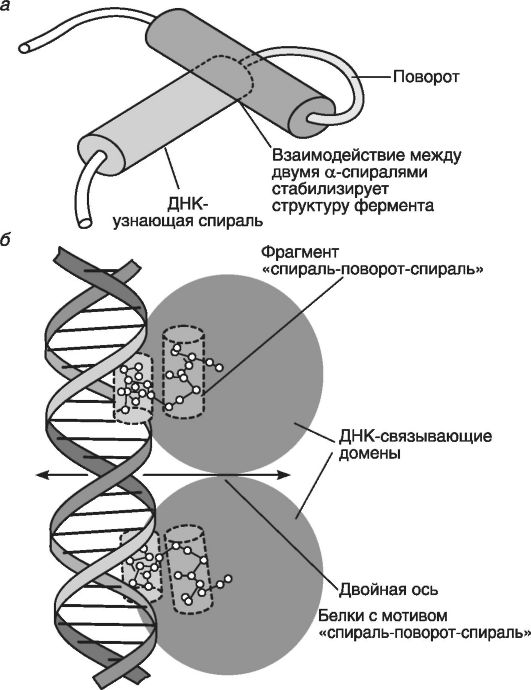 Рис. 39. Белок с мотивом «спираль-поворот-спираль» (по Эллиот В., Эллиот
Рис. 39. Белок с мотивом «спираль-поворот-спираль» (по Эллиот В., Эллиот
Д., 2002)
тельностей ДНК. Примерами служат белки-гомодимеры, состоящие из двух одинаковых субъединиц (узнаюшие спирали), которые подходят к нуклеотидам.
Второй тип мотива: «цинковые пальцы« (рис. 40). Молекула такого белка включает один атом цинка, два остатка гистидина и два остатка цистеина, например, в составе рецепторов для стероидных гормонов. Другой пример - это мутация в гене GLI3 (7p15.1), которая обусловливает развитие краниосиндактилии Грейга или цефалополисиндактилии.
Третий тип мотива: «лейциновая молния», или гомеодоменные белки со структурой, напоминающей «застежку-молнию» (рис. 41). В молекуле белка с таким мотивом каждая седьмая аминокислота представлена лейцином, остатки которого появляются на одной сто-
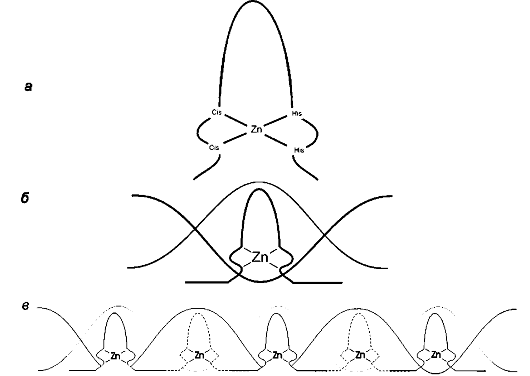 Рис. 40. Белки
с мотивом «цинковые пальцы» (по Эллиот В., Эллиот Д., 2002): а -
структура «цинкового пальца»; б - модель взаимодействия между областью
мишени в ДНК и белком, содержащим «цинковый палец». Одна сторона
структуры «пальца» представляет собой спираль, она прикрепляется к
большой бороздке ДНК;
Рис. 40. Белки
с мотивом «цинковые пальцы» (по Эллиот В., Эллиот Д., 2002): а -
структура «цинкового пальца»; б - модель взаимодействия между областью
мишени в ДНК и белком, содержащим «цинковый палец». Одна сторона
структуры «пальца» представляет собой спираль, она прикрепляется к
большой бороздке ДНК;
в - множество фрагментов типа «цинковых пальцев», связанных с ДНК
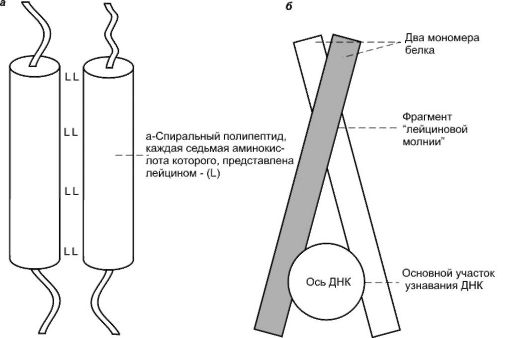 Рис. 41. Белки
с мотивом «лейциновая молния» (по Эллиот В., Эллиот Д., 2002): а -
строение фрагмента «лейциновой молнии». Гидрофобные остатки лейцина
располагаются друг против друга, но не переплетаются, подобно зубцам на
молнии; б - прикрепление к ДНК белка, содержащего «лейциновую молнию»
(вниз по оси ДНК)
Рис. 41. Белки
с мотивом «лейциновая молния» (по Эллиот В., Эллиот Д., 2002): а -
строение фрагмента «лейциновой молнии». Гидрофобные остатки лейцина
располагаются друг против друга, но не переплетаются, подобно зубцам на
молнии; б - прикрепление к ДНК белка, содержащего «лейциновую молнию»
(вниз по оси ДНК)
роне альфа-спирали, формируя гидрофобную поверхность. Две такие поверхности соединяются за счет взаимодействия между боковыми цепями лейцинов.
Особенности путей передачи внутриклеточных и межклеточных сигналов
В настоящее время известны как минимум 17 путей передачи внутриклеточных и межклеточных сигналов и два пути передачи сигнала на клетку при стрессовых воздействиях.
Все эти сигналы передаются с помощью сигнальных молекул: гормонов, нейромедиаторов, факторов роста, факторов некроза опухолей, цитокинов и других посредников, а также через каскадные реакции, регулирующие в ответ на внешние воздействия клеточные эффекты: дифференцировку, пролиферацию, апоптоз и некроз (см. главу 11).
Для передачи любого рода сигналов в клетке и организме важны две особенности.
Первая особенность - это реакции «белок-белок», формирующие широкие сети межмолекулярных связей, отличающихся высокой сте-
пенью сложности (как и метаболические пути). Например, основной путь внутриклеточной сигнализации - RAS-путь - связан с другими регуляторными путями во многих перекрывающихся точках (см. ниже), т.е. речь идет об интерференции регуляторных механизмов.
Вторая особенность состоит в том, что разные ферменты одного и того же пути передачи сигнала могут иметь разные белки-мишени, т.е. существует возможность активации альтернативных путей и регуляторных каскадов. Например, Rаs-белок (участник основного RAS-пути) может фосфорилироваться и активироваться протеинкиназой А (ПК А) только тогда, когда она будет активирована в фосфоинозитидном пути.
В свою очередь, в ходе этого пути способен активироваться внутриклеточный рецептор (но уже другим ферментом - тирозинкиназой), который может соединиться с SН2-белками других путей передачи сигналов, т.е. один тип рецептора в состоянии вызвать активацию разных сигнальных путей.
Прежде чем дать характеристику основных сигнальных молекул клетки и организма, дополнительно рассмотрим еще несколько наиболее изученных путей передачи внутриклеточных сигналов и их особенности.
Изменение активности протеинкиназы под действием сАМР
Циклический нуклеотид АМР (сАМР) образуется из АТР с помощью аденилатциклазы, локализованной на внешней стороне плазматической мембраны. Этот нуклеотид часто используется гормонами как вторичный мессенджер, тогда как сами гормоны являются первичными посредниками в регулируемых ими реакциях, например, адренокортикотропный и антидиуретический гормоны, гонадотропины, глюкагон, катехоламины (адреналин и норадреналин), соматостатин, тиреостимулирующий и паратиреоидный гормоны.
Известны два направления сАМР-опосредованного пути изменения активности протеинкиназы под действием этого нуклеотида:
• контроль уровня сАМР;
• контроль действия сАМР на транскрипцию гена.
В ходе первого направления происходит активация аденилатциклазы адреналином, и в результате в клетках печени и скелетных мышц образуется сАМР. Посредником здесь служит гетеромерный G-белок, у которого на альфа-субъединице расположен участок, связывающий либо GDP (тогда ничего не происходит), либо GTP (тогда следует реакция). Иными словами, G-белок перемещается от рецептора к
аденилатциклазе и обратно, являясь своеобразным «переключателем».
Важность этого события можно продемонстрировать на примере гидролиза GTP, происходящего при действии токсина, вырабатываемого холерным вибрионом. Этот токсин необратимо ингибирует GTP- активность G-белка, что не позволяет выключить «переключатель», и поэтому продолжающееся образование сАМР приводит к массированной потере клетками ионов Na+, их дегидратации (в результате изнуряющей организм диареи) и смерти больного от потери жидкости и электролитов.
В ходе второго направления сАМР активирует ПК А, участвующую в механизме регуляции клеточной активности с затрагиванием генной экспрессии. Когда ПК А фосфорилирует CREB-белок, то последний становится активным фактором транскрипции по типу мотива «лейциновая молния« (см. выше).
Следует выделить еще один путь сигнализации с использованием уже другого циклического нуклеотида - сGМР, увеличение уровня которого активирует протеинкиназу G (ПК G). В этом случае образование сGМР из GТР катализирует образование мембраносвязанной и растворимой форм гуанилатциклазы.
Первая форма представлена внутриклеточным доменом рецепторного белка (он опосредует клеточный ответ, активируя ПК G по ходу катализа сGМР). Примером этого пути служит ?+-уретический фактор предсердий, вырабатываемый в эндотелиальных клетках. Этот фактор стимулирует выделение почками натрия.
Эффекты сGМР отмечаются также при расслаблении гладких мышечных волокон, работе нейронов и реализации функции зрения.
Вторая форма гуанилатциклазы включает в качестве простетической группы молекулу гема, с которой связывается оксид азота, образуемый в эндотелии сосудов из гуанидиновой группы аргинина под действием нитроксидсинтетазы. Оксид азота диффундирует в мышечные волокна кровеносных сосудов, вызывая образование сGМР и расслабление тонуса сосудов. Процесс образования оксида азота опосредуется нервной регуляцией (стимулируется ацетилхолином) и происходит в ответ на механическое воздействие на стенки сосудов, оказываемое током крови, что ведет к вазодилатации. Именно на этом механизме основано действие тринитроглицерина при лечении приступов стенокардии.
RAS-путь
RAS-путь - это наиболее распространенный путь внутриклеточной сигнализации (от мембраны к гену) или путь к белковым факторам транскрипции с участием тирозинкиназы, которая ассоциирована с рецепторами факторов роста.
Особенностями RAS-пути являются: отсутствие низкомолекулярных вторичных посредников; все компоненты этого пути принадлежат к белкам.
Все клетки имеют Rаs-белок или небольшой мономерный GTP- связывающий белок, а также белок, связывающий рецептор фактора роста (GRB), который взаимодействует с фосфорилированным рецептором при участии SН2-домена (см. выше).
В свою очередь, GRB соединен с SOS-белком, и их комплекс (GRB-SOS) контактирует c активированным рецептором, что вызывает в Ras-белке обмен GDP на GTP. Этот обмен напоминает активацию G-белка при образовании сАМР и обусловлен тем, что Ras- белок обладает низкой GTPазной активностью, позволяющей ему выполнять функцию молекулярного «хронометражного прибора» (рис. 42).
Следующим компонентом RAS-пути является Raf-белок или протеинкиназа серин-треонинового типа, для активации которой необходимо соединение Ras-белка с GTP.
Именно с активации протеинкиназы серин-треонинового типа начинается каскад реакций, завершающихся фосфорилированием белковых факторов транскрипции.
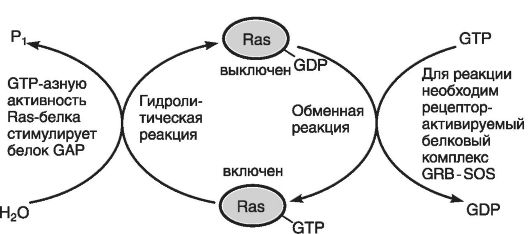 Рис. 42. Активация Rаs-белка (по Эллиот В., Эллиот Д., 2002)
Рис. 42. Активация Rаs-белка (по Эллиот В., Эллиот Д., 2002)
Считается, что мутации Rаs- и Rаf-белков онкогенны, так как приводят к неконтролируемому клеточному делению (новые копии этих белков постоянно находятся в активированном состоянии).
Прямой путь внутриклеточной сигнализации
С рассмотренным выше RAS-путем резко контрастирует относительно простой прямой путь сигнализации от рецептора к ядру клетки с помощью гамма-интерферона (белок, секретируемый клеткой, инфицированной вирусом). Эта активация способствует присоединению такого белка к чувствительным интерферон-стимулируемым рецепторам или JSRE-элементам, что обеспечивает транскрипцию гена STAT (рис. 43).
Характеристика сигнальных молекул
Сигнальные молекулы - это различные химические соединения: адреналин, ацетилхолин, вазопрессин, глюкагон, дофамин, инсулин, норадреналин, тироксин, оксид азота, эйкозаноиды (простагландины, тромбоксаны тромбоцитов и лейкотриены лейкоцитов), а также стероиды (глюкокортикоиды, прогестерон и эстроген). Среди них выделяют полярные и неполярные соединения.
Первые соединения не проникают внутрь клетки, но связываются с находящимися на ее поверхности рецепторами, которые передают клетке сигнал, инициируя цепь последовательных реакций (каскадов).
Вторые соединения (например, стероидные гормоны) легко проникают в клетку, диффундируя через липидный бислой.
Сигнальные молекулы разделены на многочисленные группы: гормоны, рафты, регуляторные факторы развития, цитокины, интерлейкины, нейромедиаторы, факторы некроза опухолей и т.д.
Рассмотрим основные из них.
Гормоны
Гормоны - это классические сигнальные молекулы. В обобщенном виде действие гормона можно представить как действие первичного месседжера, который связывается с рецепторами клетки-мишени и через них передает сигнал.
В ряде случаев, например, при действии глюкагона, адреналина или норадреналина, может проявиться уровень вторичного месседжера - молекулы, запускающей внутри клетки те или иные метаболические реакции в ответ на связывание первичного месседжера.
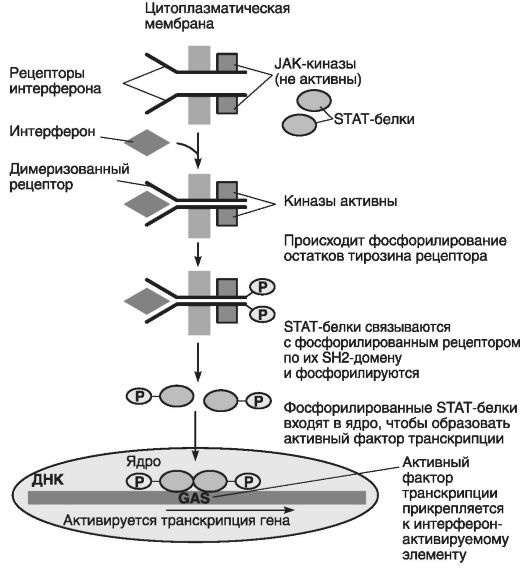 Рис. 43. Сигнальный путь с участием гамма-интерферона (по Эллиот В., Эллиот Д., 2002):
Рис. 43. Сигнальный путь с участием гамма-интерферона (по Эллиот В., Эллиот Д., 2002):
JAK - киназы или цитоплазматические тирозинкиназы; STAT - белки или передатчики сигналов и активаторы транскрипции; GAS - активируемый гамма-интерфероном; JSRE - элемент в нуклеотидной последовательности
гена
В роли вторичного мессенджера обычно выступает сАМР, синтезируемый ацетилатциклазой из АТР (см. выше). При этом циклический АМР аллостерически активирует протеинкиназу, которая в свою очередь активирует киназу фосфорилазы, а та с помощью протеинфосфатазы I активирует фосфорилазу из неактивной формы b в активную форму a.
Иногда при передаче клетке сигнала извне происходит событие, получившее название «управление числом рецепторов» (см. главу 25). Оно связано с длительным контактом гормона с рецепторами клетки, что обусловливает обратимое снижение числа рецепторов, и слабый ответ клетки на сигнал - это так называемая даунрегуляция. Кроме того, рецепторы клетки могут быть инактивированы в результате фосфорилирования цитоплазматической киназой.
Рафты
Рафты или кавеолы играют важную роль в передаче клеточных сигналов через мембраны. Рафты находятся с обеих сторон мембраны и стабилизируются в присутствии мембранных белков, определяющих их структуру. Основой для их образования служат трансбислойная и латеральная асимметрия липидов, разная упаковка жирнокислотных цепей, обеспечивающая смешиваемость.
Это плотные маленькие частицы около 50-70 нм в диаметре, связывающие множество молекул гликофосфоинотизидов у GPI- заякоренных белков. Размеры этих частиц зависят от концентрации липидов в клетке и внешних условий, что создает непрерывность рафтовых модификаций.
Особый тип рафтов - это пещеры (малые карманы), являющиеся структурами клеточной поверхности, активно участвующими в следующих реакциях.
• Образование эндо- и экзоцитозных компартментов на поверхности мембран, способных импортировать молекулы внутрь клетки или экспортировать их во внеклеточное пространство, что имеет огромное значение для сигнализации. Например, это малые карманы адипоцитов, фибробластов, всех типов мышечных клеток, клеток эндотелия капилляров, пневмоцитов I типа.
• Трансцитоз, разложение (интернализация) токсинов, бактерий и вирусов, транспорт холестерина, гомеостаз Са2+, сортировка мембранных белков, трансдукция клеточных сигналов, генерация и конверсия патогенных форм прионных белков, включая развитие болезни Альцгеймера (см. главу 28). Рафты - пещеры - пред-
ставляют собой липидорганизованные микродомены или своеобразные мембранные «машины», сортирующие молекулы. Они способны координировать пространственно-временную организацию путей передачи сигналов внутри определенных областей мембраны, называемых сигналосомами. Последние содержат специфические пептиды: кавеолины 1-3, флотиллины 1-2, ганглиозиды GM1-GM3, а также GPI-заякоренные белки - все они латерально диффундируют внутри мембраны (подобны «челноку»). Именно рафты-сигналосомы предназначены для процессов трансдукции сигналов, выполнения транспортных функций по везикулярной интерканализации микромолекул и межклеточному движению макромолекул (трансцитоз). Они участвуют в клеточной адгезии и связывании антигенов рецепторами В-клеток. В настоящее время получены убедительные доказательства в пользу существования рафтов, способных быстро собрать (кластеризировать) высокоупорядоченный сигнальный комплекс и обеспечить перекрещивание между собой нескольких одновременно протекающих сигнальных путей, включающих как задержку, так и усиление их взаимодействия с индивидуальными белками клетки.
Показано, что рафты участвуют в передаче сигналов рецепторами с помощью:
• связывающих G-белков;
• эпидермального фактора роста (EGFR);
• различных GPI-заякоренных белков;
• белков, реагирующих на инсулин и фактор роста фибробластов-2
(FGF).
Показано также, что рафты могут быть использованы различными патогенами для их проникновения в клетку, включая бактерии (и их токсины), вирусы и микроорганизмы.
Кроме того, в процесс проникновения патогенов могут быть вовлечены GPI-заякоренные белки типа CD48, ганглиозид GM1 и гликолипид Gb3, используемые в качестве рецепторов, и микобактерии с холестерином. Большой интерес представляет взаимодействие нейротоксинов столбняка и ботулизма с ди- и трисиалоганглиозидами (Gd1a, GD1, GT1b) на поверхности пресинаптических мембран нейронов. Для объяснения этого механизма С. Montecucco (1986) предложил модель «двойного рецептора» .
Согласно этой модели, рафты обеспечивают «окружение» патогенов и токсинов большим количеством низкоаффинных рецепто-
ров, стабилизирующих их «захват» на поверхности клетки, и затем перемещают патогены и токсины к высокоаффинным рецепторам. При этом специфические липиды в рафтах могут действовать как белки - молекулярные шапероны, инициируя конформационные изменения в структуре белков патогенов и токсинов, перемещенных к высокоаффинным рецепторам.
Кроме того, данная модель соответствует реакции слияния, наблюдаемой в ходе инфицирования клеток человека вирусом иммунодефицита.
Цитокины
Цитокины - это вещества белковой природы, секретируемые клетками, вступившими в кооперативные отношения, что необходимо для полноценного созревания эффекторных и регуляторных клеток.
В ходе кооперативных отношений цитокины связываются с рецепторами на клеточных мембранах, вызывая каскадные реакции, индуцирующие (усиливающие или подавляющие) активность регулируемых ими генов.
Первоначально понятие «цитокин» использовалось иммунологами для обозначения молекулярных факторов взаимодействия, участвующих в иммунном ответе (см. главу 15). В дальнейшем его стали использовать для характеристики рецепторов, действия гормонов, проведения нервного импульса и других целей.
Цитокины - это кратковременно живущие и жестко регулируемые факторы, представляющие собой небольшие белки (8-80 кДа), действующие аутокринно или паракринно.
У человека выделено более 100 разновидностей цитокинов и постоянно выявляются новые.
К цитокинам относятся: факторы роста, интерлейкины (их известно не менее 18), интерфероны (не менее 15), факторы некроза опухолей (ФНО), колониестимулирующие факторы, хемокины или хемотаксические цитокины (их более 50).
Цитокины редко образуются по отдельности и редко действуют в одиночку. Между ними имеется небольшое сходство на уровне контролирующих их экспрессию нуклеотидных последовательностей ДНК и аминокислотных последовательностей в них самих.
По гомологии функционирования среди цитокинов выделяют три семейства.
К первому семейству цитокинов (по сходству первичной и третичной структуры) относится большинство цитокиновых рецепторов, являющихся гликопротеинами, состоящими из единственного трансмембранного домена (см. главу 6). Среди них выделяют наиболее известные цитокины - рецепторы: к интерлейкинам (ИЛ 2-7, ИЛ 9-12), гранулоцитарному колониестимулирующему фактору (Г-КСФ) и гранулоцитарному макрофагальному колониестимулирующему фактору (ГМ-КСФ), включая рецепторы к СТГ и пролактину.
Ко второму семейству относятся иммуноглобулинподобные рецепторы ко всем интерлейкинам и отдельно к ИЛ 1-альфа, ИЛ 1-бета и
М-КСФ.
Третье семейство - это рецепторы, связывающие ФНО-альфа и ФНО-бета, лимфотоксин, фактор роста нервов и FAS или CD95 (его связывание с лигандом FASL служит сигналом клеточной гибели нейронов).
Регуляторные факторы роста
Регуляторные факторы роста (или развития - их так называли раньше) - это регуляторные белки, выделяемые клетками той же ткани, к которой они принадлежат, например гепатоцитами и лимфоцитами. Большинство факторов роста диффундируют на короткие расстояния и поэтому действуют на близлежащие клетки - это паракринный эффект.
Выделен также местный аутокринный эффект (на клетку, которая продуцирует эти факторы), например, интерлейкин-2 стимулирует пролиферацию Т-клеток.
Регуляторные факторы роста взаимодействуют с наружными рецепторами клеток-мишеней и тем самым влияют на инициацию транскрипции тканеспецифических генов.
При определенных условиях один и тот же регуляторный фактор роста может выступать как стимулятор или, наоборот, как ингибитор клеточной дифференцировки. Среди регуляторных факторов роста выделены: EGF - фактор роста эпидермиса; PDGF - фактор роста тромбоцитов (образуется не только в них, но и в других клетках); интерлейкины или колониестимулирующие факторы (регулируют развитие лейкоцитов); факторы гемопоэза в костном мозге (их около 20).
Интерлейкины
Интерлейкины выполняют роль нейротрансмиттеров или переносчиков сигнальной информации, регулирующей метаболические,
трофические, иммунные и другие процессы в нейронах. Они также принимают участие в апоптозе нейронов (см. главы 11 и 13).
Факторы некроза опухолей
Наряду с интерлейкинами в апоптозе нейронов принимают участие ФНО. Это медиаторы эндотоксического шока, вызывающие блокаду русла терминальных сосудов с последующим некрозом ткани мозга.
ФНО - это еще и иммунологические модуляторы, вызывающие иммунные реакции в других тканях и органах путем прямого или опосредованного действия через цитокины. ФНО также называют медиаторами взаимосвязи нервной и иммунной систем или посредниками между ЦНС и периферической иммунной системой. Например, в случае некротического энтероколита при воздействии эндотоксина кишечной палочки, продуцирующего ФНО, развивается повреждение перивентрикулярной области (ПВО) мозга (см. главу 13). При этом повреждении ишемия ПВО развивается за счет гипотензивного эффекта и усиления коагуляции с образованием очагов сосудистой деструкции, а также за счет стимуляции продукции фактора активации тромбоцитов - этот процесс называется вазоконстрикцией.
ФНО способствуют деструкции олигодендроглиоцитов и пролиферации астроцитов, вызывая иммунные сдвиги в мозге и дисмиелинизацию нервных волокон белого вещества ПВО.
Во внутриутробном онтогенезе ФНО стимулируют продукцию простагландинов, что может вызвать преждевременные роды и способствует низкому гестационному возрасту, т.е. проявляется как фактор риска перивентрикулярной лейкомаляции и других поражений ПВО.
По-видимому, интерлейкины, нейромедиаторы и ФНО преимущественно функционируют как факторы роста, участвующие в формообразовании мозговых структур (как составная часть ПВО).
Интерфероны
Как было сказано выше, сигнализация с помощью интерферонов - это прямой путь передачи информации от рецептора к ядру. В 1957 г. было установлено, что инфицированные вирусом клетки секретируют белки-интерфероны, которые их защищают от тех же или других вирусов.
На клетках имеются интерферон-стимулирующие чувствительные элементы или JSRE-рецепторы, при присоединении к которым
интерфероны вызывают специфический ответ генов клетки, усиливающий их экспрессию. Рецептор гамма-интерферона связывается с двумя молекулами цитоплазматической тирозинкиназы (JAK- киназы). Связывание лиганда вызывает димеризацию рецептора, что ведет к активации тирозинкиназы, и в результате фосфорилируются остатки тирозина рецепторного димера. Это, в свою очередь, ведет к связыванию двух цитозольных белков с фосфорилированным рецептором, которые имеют SH2-домены. Такие же домены есть у GRB- белка в ходе RAS-пути (см. выше).
После фосфорилирования SH2-доменов последние превращаются в фосфорилированные STAT-белки , которые движутся в клеточное ядро, где собираются в активный фактор транскрипции, который прикрепляется к интерферон-активированному элементу, что способствует транскрипции JSRE-элементов (см. рис. 43).
Нейромедиаторы
Нейромедиаторы - это небольшие заряженные молекулы, которые выделяются пресинаптическими мембранами и связываются с рецепторами постсинаптических мембран. Они участвуют в процессах умственной деятельности и обеспечивают работу нейронов, иннервирующих ткани и органы (см. главу 13).
Как известно, основой умственной деятельности является межнейрональная связь, а пусковым сигналом служит нервный импульс. В нервных окончаниях (аксонах нейронов) в ходе сложных биохимических превращений производится специфический медиатор, который поступает к постсинаптической мембране, где соединяется с молекулой соответствующего ему рецептора. В результате в нейронемишени рождается новый нервный импульс, и так происходит по всей цепочке межнейрональных связей.
Биохимический тип синапса определяет сродство молекул медиатора, выделяемого в синапс, и специфического к нему рецептора, принимающего медиатор на постсинаптической мембране.
Характеристика эргических систем
Нейроны, способные выделять (кринировать) в синаптическую щель один и тот же медиатор, так же как и нейроны, имеющие мембранные рецепторы к данному нейромедиатору, объединяются в эргические системы. Наиболее изученными из них считаются: дофаминэргическая, норадреналинэргическая, ацетилхолин-эргическая и серотонинэргическая системы. Как правило, нейроны, форми-
рующие эти системы, связаны между собой особыми нервными путями - эргическими трактами. Это аксональные и дендритные отростки, соединенные эргическими синапсами.
В случае любых эргических систем всегда существует одно направление прохождения сигнала: от пресинаптической мембраны к постсинаптической.
На рис. 44 приведена схема работы синапса норадреналинэргической системы.
Как следует из этой схемы, межмолекулярные взаимодействия при распространении нервного импульса через норадреналинэргический синапс включают ряд звеньев.
Первое звено - терминальное окончание аксона. Нервный импульс активирует ионы Са 2+, инициирующие продвижение синаптических пузырьков к пресинаптической мембране, в которую включаются эти пузырьки. Здесь поступивший из крови тирозин превращается в присутствии тирозингидроксилазы в дезоксифенилаланин (ДОФА), который (в присутствии дофамин-Ь-гидроксилазы) превращается в норадреналин или тирозин-Дофа-норадреналин.
Второе звено - синаптическая щель , Сюда из пресинаптической мембраны выходят синаптические пузырьки и разрываются в ней с выделением (кринированием) нейромедиатора. Условно разделим весь объем выделившегося медиатора на четыре порции.
Первая порция поступает в постсинаптическую мембрану клеткимишени.
Вторая порция обратно поглощается (пиноцируется) пресинаптической мембраной, где утилизируется с образованием синаптических пузырьков.
Третья порция под влиянием катехол-О-метилтрансферазы инактивируется и распадается на конечные продукты. Четвертая порция возвращается к пресинаптической мембране, но не превращается в синаптические пузырьки, а служит сигналом к торможению образования новых порций норадреналина из его предшественников.
Третье звено - постсинаптическая мембрана. Здесь происходит соединение первой порции медиатора с белками мембраны. В результате запускаются молекулярные реакции двух направлений.
Первое направление - половина первой порции медиатора фосфорилирует мембранные белки (из АТФ в присутствии аденилатциклазы образуется сАМФ, из которого в присутствии фосфодиэстеразы образуется АМФ, и далее в присутствии АМФ идет фосфорилирование).
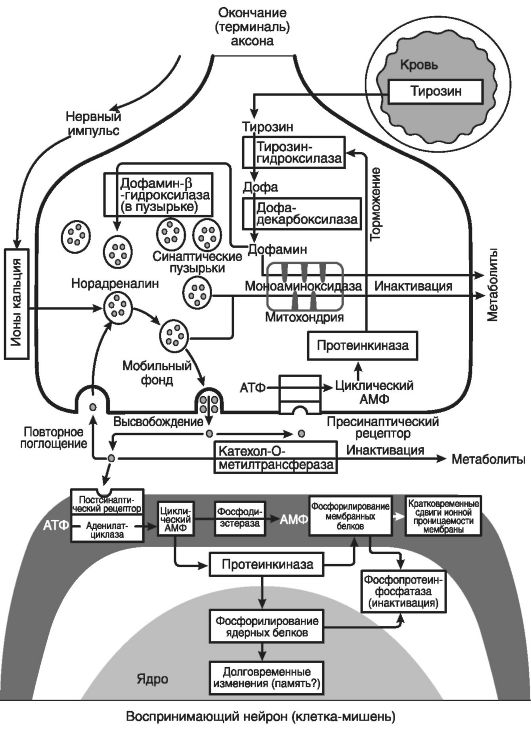 Рис. 44. Схема работы синапса норадреналинергической системы (по Скворцову И.А., 2000)
Рис. 44. Схема работы синапса норадреналинергической системы (по Скворцову И.А., 2000)
Второе - вторая половина первой порции медиатора фосфорилирует с помощью протеинкиназы мембранные белки, а с помощью протеинфосфатазы - ядерные белки, что обусловливает развитие долговременной «памяти» нейрона о произошедших молекулярных событиях.
Четвертое звено - это также постсинаптическая мембрана. В ней в результате фосфорилирования мембранных белков происходят кратковременные сдвиги ионной проницаемости, благодаря которым запускается процесс деполяризации мембраны и рождается новый импульс, распространяющийся к другой клетке-мишени в виде очага нервного возбуждения.
Следовательно, любую эргическую систему определяют связи между различными образованиями головного и спинного мозга через рецепторы мембран нейронов в этих образованиях. Такие рецепторы способны обеспечить специфическую реакцию на нейромедиатор или другую молекулу-посредник в ходе передачи информации. Их называют нейромодуляторами (нейротрансмиттерами).
Нейромедиаторами являются глутамат, норадреналин и серотонин (синапсы центральной нервной системы), а также ацетилхолин (синапсы периферической нервной системы).
При контактах нейромедиаторов с рецепторами клеток-мишеней в мембранах открываются лигандзависимые ионные каналы, специфичные для ионов Са2+, и К+ (см. выше).
Очевидно, что функционирование эргических систем обеспечивается необходимым количеством энергии в виде АТР (см. главу 7). Необходимо отметить, что резервным макроэргическим соединением для АТР является креатинфосфат, который при участии фермента - креатинкиназы приводит к взаимодействию АТР и креатина, т.е. в ходе креатинкиназной реакции происходит регенерация АТР за счет использования фосфатных групп молекулы креатинфосфата, обладающих высокой активностью (как, например, метильные группы).
При работе мышечных клеток фосфатная группа молекулы креатинфосфата может обратимо передаваться на ADP с образованием АТР, но получаемый при этом креатинин не будет нести никаких функций и выделится с мочой пропорционально мышечной массе тела.
Завершая рассмотрение путей и механизмов управления метаболическими реакциями и сигнализации в клетке и организме, следует заключить, что эволюция не ограничилась созданием только выше-
перечисленных путей и механизмов. Безусловно, их должно быть гораздо больше.
Поэтому и нераскрытых секретов молекулярной жизни клетки и организма должно быть больше, чем это известно в настоящее время. В пользу такой убежденности свидетельствуют, например, следующие факты.
Так, гормоны гипофиза, надпочечников и щитовидной железы воздействуют на метаболизм не всегда понятным образом: их действие обычно опосредовано множеством событий и растянуто во времени.
Другой пример: в клетках мозга и печени поглощение глюкозы не зависит от инсулина, а в мышечных клетках и клетках жировой ткани оно ускоряется инсулином. По-видимому, в этих тканях по-разному происходит ускоренный перевод неактивных транспортных белков в активные белки клеточных мембран, что ведет к изменению равновесия между цитоплазматическим и мембранным уровнем этих белков.
Таких пока еще не до конца изученных путей и механизмов управления ферментативными реакциями довольно много. Сегодня ясно лишь одно: все они контролируются программой онтогенеза. Но как это происходит? Этот вопрос во многих случаях остается без ответа.