Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 3 ФУНКЦИОНАЛЬНАЯ ГЕНОМИКА (ПРОТЕОМИКА)
ЭКСПРЕССИЯ ГЕНОВ
Эволюция человека сформировала на основе молекулы ДНК внутриклеточные генетические процессы; основной из них - биосинтез полипептидных цепей (белков) как главных носителей биологических функций клетки и организма.
Производство белков в рибосомах клетки основано на механизме перевода наследственной информации, зашифрованной в последовательности нуклеотидов в молекуле ДНК, в последовательность аминокислот в молекуле полипептида - это механизм экспрессии (работы) генов или главный механизм функционирования генов.
Рассмотрим вопрос: что с молекулярных позиций представляют собой экспрессия генов и результаты ее реализации - белки?
Экспрессия генов - механизм передачи наследственной информации от молекулы ДНК с помощью различных типов РНК к молекуле полипептида, однонаправленный поток информации (ее путь) из ядра в рибосомы цитоплазмы клетки (рис. 13). Основные звенья экспрессии генов:
• ядро клетки, в котором происходят расплетение нитей молекулы ДНК, транскрипция мРНК с помощью РНК-полимеразы II, процессинг и сплайсинг (созревание) мРНК;
• цитоплазма клетки, в которой происходят транспорт созревшей мРНК от ядра к рибосомам, перевод (трансляция) с помощью рРНК и тРНК информации о последовательности нуклеотидов в молекуле мРНК в последовательность аминокислот в молекуле белка.
Благодаря механизму генной экспрессии в клетке образуется множество молекул мРНК; число их соответствует числу генов, активных в момент экспрессии.
Подразумевается, что одна молекула мРНК приносит в рибосомы информацию о конкретной последовательности нуклеотидов, на основе которой рРНК формирует в них конкретную последовательность аминокислот, поставляемых с помощью тРНК (см. главу 2).
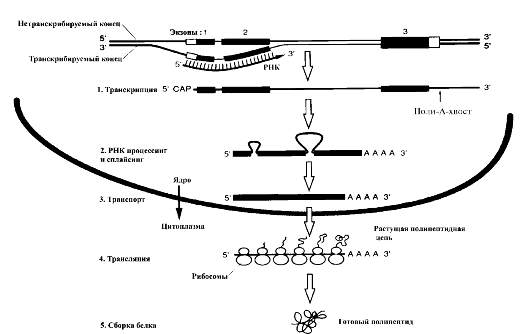 Рис. 13. Механизм экспрессии генов (по В. Эллиот, Д. Эллиот, 2002)
Рис. 13. Механизм экспрессии генов (по В. Эллиот, Д. Эллиот, 2002)
Все эти процессы происходят при участии ряда ферментов, и в результате из рибосом выходят белковые (полипептидные) цепочки (рис. 14).
Как сказано выше, образование копий мРНК обеспечивает РНКполимераза II. Именно она служит для таких молекул своеобразной «штамповочной машиной». РНК-полимераза II выполняет еще ряд функций, например, отбор подлежащих экспрессии генов, определение в гене места, откуда надо начинать копирование ДНК, и места, где следует остановиться, а также контроль скорости, времени экспрессии и количества производимого белка. В последние годы установлено: для образования в молекуле ДНК основного инициаторного комплекса или кэп-сайта, к которому присоединяется РНКполимераза II в ходе транскрипции гена (см. главу 2), требуется ряд
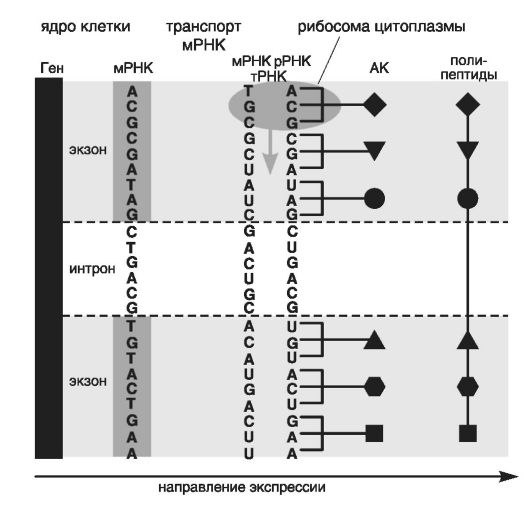 Рис. 14. Примерная схема формирования полипептидов из аминокислот (АК) при взаимодействии мРНК, рРНК и тРНК в рибосомах цитоплазмы
Рис. 14. Примерная схема формирования полипептидов из аминокислот (АК) при взаимодействии мРНК, рРНК и тРНК в рибосомах цитоплазмы
специфических белков - факторов транскрипции. В настоящее время их выделено несколько сотен (см. главу 8). Они присутствуют во всех клетках, в том числе среди них есть TBP-белок или TATA-белок, присоединяющийся к ТАТА-боксу (см. рис. 11). С ТАТА-боксом связаны около 10 TAF-белков (или ТВР-связывающих факторов). Они формируют TFPD-комплекс, фактор транскрипции D для РНК-полимеразы II и белков, образующих ОИК. Вышеперечисленное происходит в генах, имеющих ТАТА-боксы.
Если ТАТА-бокса нет, то кэп-сайт собирается в инициаторной области гена, но, по-видимому, уже с использованием другого фактора (для достижения правильного положения РНК-полимеразы II).
Кроме основного фермента - РНК-полимеразы II, у человека выделены РНК-полимераза I (транскрибирует большую часть молекул рРНК) и РНК-полимераза III (транскрибирует тРНК и более мелкие рРНК).
В случаях с РНК-полимеразами I и III формируются другие стабильные инициаторные комплексы.
Следует отметить, каким образом взаимодействие факторов транскрипции и ОИК регулирует инициацию транскрипции, сегодня еще не вполне ясно. Вероятно, здесь важна «гибкость» регуляции механизма экспрессии генов, ибо многие факторы транскрипции вносят свой вклад в эту регуляцию при наличии на молекуле ДНК соответствующих участков их связывания (взаимодействия ДНК - белок).
В главе 2 сказано: экспрессия - главное свойство гена. Как продукт эволюции, процесс экспрессии имеет свои особенности.
Во-первых, для постоянной экспрессии нужна постоянная транскрипция мРНК. Причем, находящаяся в клетке молекула ДНК неизменно стабильна и готова к функционированию, тогда как образовавшаяся на одной из ее цепей молекула мРНК имеет период полужизни всего от 20 мин до нескольких часов, т.е. любой ген способен лишь к кратковременному производству полипептида.
Во-вторых, объем и скорость производства полипептидов зависят от числа рибосом в клетке и активности ферментов для биосинтеза белков.
В-третьих, в любой момент жизненного цикла клетки в состоянии экспрессии одновременно находятся не более 5-10% генов генотипа, тогда как остальные гены репрессированы.
Последнее объясняется одинаковым генотипом всех соматических клеток, и все без исключения гены этого генотипа могут экспрес-
сироваться в любые полипептиды, необходимые для жизни клетки и организма в разные моменты их развития. Иными словами, все гены в хромосоме (ДНК, связанной с белками) находятся в «выключенном», репрессированном состоянии (вне транскрипции мРНК), поскольку нуклеосома блокирует область инициации транскрипции каждого промотора (см. главу 2). И до тех пор пока блок не снят (что позволило бы осуществить сборку ОИК), ген не будет транскрибироваться.
Экспрессия одной части генов клетки имеет постоянный характер (например, экспрессия генов «домашнего хозяйства»), тогда как экспрессия другой части генов имеет временный характер (например, экспрессия тканеспецифических генов).
Примерами генов «домашнего хозяйства« служат гены, кодирующие белки-ферменты, необходимые для синтеза ДНК, или гены, кодирующие ферменты гликолиза. Их экспрессия постоянно нужна любой клетке, кроме высокоспециализированных зрелых эритроцитов.
Примерами тканеспецифических генов служат гены, кодирующие белки клеток крови, печени, почек, мышц и т.д.
В-четвертых, если говорить о количественном участии генов в распределении белковых функций, то синтез РНК и белков контролируют 22% генов, внутриклеточный метаболизм - 17% генов, обеспечение механизмов деления, защиты, клеточных сигналов - по 12% генов (всего 36%), формирование клеточных структур - 8% генов; другие функции - 17% генов. Наибольшее число генов кодируют белки-ферменты (каждый третий ген - 31,2%). Существуют гены, кодирующие белки-модуляторы белковых функций, они стабилизируют, активируют или свертывают белки - их 13,6%.
Кроме перечисленных групп генов, выделены индуцибельные гены, экспрессия которых зависит от действия стероидных гормонов, и ряд других.
Как сказано выше, в активации экспрессии одного и того же или разных генов принимают участие разные факторы транскрипции. К ним относятся факторы, связывающиеся с ГЦ- и ЦААТ-боксами. Они расположены перед стартовой точкой транскрипции и присутствуют во всех клетках. Причем каждый фактор транскрипции имеет два участка: один для связывания с ДНК, другой для связывания с белками, формирующими ОИК.
Дифференцированная экспрессия генов, очевидно, контролируется внутриклеточными и внеклеточными (организменными) фак-
торами на основе программы онтогенеза, но как реально обстоит дело, пока неясно.
Вместе с тем в последние годы установлено: гены, кодирующие факторы транскрипции, избыточно представлены среди генов, обусловливающих развитие врожденных болезней. Например, более 30% таких генов связано с фенотипическим проявлением врожденных заболеваний (табл. 2).
Таблица 2. Фенотипическое проявление генов врожденных заболеваний
Название и локализация гена | Врожденное заболевание |
MITF (3p12) | Синдром Ванденбурга, тип 2 |
KIT (4q12) | Неполный альбинизм |
SHH (7q36), (7q32.3) и (2р21) | Голопрозэнцефалия |
PTC (9q22) | Синдром Горлина |
TBX5 (12q24) | Синдром Холта-Орама |
LIGAM (Xq28) | Гидроцефалия |
PAX (2p25.2) и (11p13.1) | Аниридия 1 и 2 |
Особенно высок удельный вес врожденных болезней, проявляющихся на первом году жизни ребенка, обусловленных мутациями в генах, кодирующих белки-ферменты (47%) и свидетельствующих о нарушениях гомеостаза в метаболизме таких детей (до их рождения метаболизм контролировался через плаценту и соответствовал материнскому гомеостазу).
Болезни, вызванные мутациями в генах, кодирующих белкирецепторы, выявляются после первого года жизни на протяжении всего периода пубертата, а болезни, обусловленные мутациями в генах, кодирующих белки-модуляторы белковых функций, - в зрелом возрасте (до 50 лет).
Следует отметить, что механизм экспрессии генов длительное время считался соответствующим только формуле, предложенной Дж. Бидлом и Э. Тейтемом в 1941 г. («один ген - один фермент») и в дальнейшем преобразованной в формулу «один ген - одна полипептидная цепь». Эта формула длительное время считалась центральной догмой молекулярной биологии, однако затем произошло ее дополнение другими формулами, объясняющими механизмы экспрессии генов, и она перестала так называться.
Такое событие произошло в 1965 г., когда У. Дрейер и Дж. Беннет предложили для объяснения механизма биосинтеза иммуноглобулинов формулу «два гена - одна полипептидная цепь».
Оказалось, что в случае биосинтеза антител один ген отвечает за синтез вариабельной области иммуноглобулина (всего таких V-генов выделено 500), а другой ген отвечает за синтез константной области иммуноглобулина (как правило, либо единственный С-ген, либо резко ограниченное их число).
Благодаря указанному соотношению (500:1) рекомбинация (перегруппировка) наследственного материала в ходе образования лимфоцита происходит таким образом, что только один из всех V-генов создает информационный комплекс с С-геном в виде созревшей мРНК.
Спустя 30 лет Р. Дулиттл (1995) предположил: раз белковый домен - синтетаза жирных кислот - имеет только одну полипептидную цепь, но содержит в ней все необходимое для катализа семи реакций, значит, налицо общий результат действия семи разных генов. Тем самым была предложена еще одна формула: «семь генов - одна полипептидная цепь».
В результате выполнения международной программы «Геном человека» право на существование теперь имеют и такие формулы: «один ген - две, три или более полипептидные цепи», а также «разные участки одного гена - разные полипептидные цепи».
Например, мутации в разных частях онкогена RET обусловливают развитие четырех разных наследственных болезней: двух форм полиэндокринного аденоматоза (ZA - 10q21.2; ZB - 10q13), семейной медуллярной тиреоидной карциномы (10q21.2) и болезни Гиршпрунга (10q11).
Из вышесказанного следует вывод: независимо от того, один, два, семь генов или разные участки одного гена контролируют биосинтез одной или нескольких полипептидных цепей, конечным результатом их действия (взаимодействия) является образование многочисленных и сложно организованных полипептидов - носителей разных биологических функций на уровне клетки и организма.
Таким образом, данные о различной специфичности генной экспрессии не только расширили границы ранее существовавших представлений о непоколебимости центральной догмы молекулярной биологии, но и существенно их дополнили. Стала очевидной необходимость дальнейшего изучения характера связей между генами и полипептидами. Это касалось не только формулы, объясняющей механизм или путь от гена к полипептиду («обратная генетика«), но и формулы, объясняющей механизм альтернативного пути: от полипептида к гену («прямая генетика» и концепция клинической протеогеномики).
Говоря о механизмах альтернативного пути, предположим существование обратной связи или системы управления (контроля) за экспрессией генов со стороны продуцируемых ими белковых продуктов.
В частности, есть факт: биосинтез белков идет параллельно с экспрессией генов. Значит, должна поддерживаться тесная связь между указанными процессами.
Оказывается, такая связь действительно имеется: конкретные гены в ходе экспрессии создают конкретные белковые факторы (пептиды или полипептиды), контролирующие экспрессию самих же генов. Следовательно, экспрессия генов - неиссякаемый источник пептидов и полипептидов, возможности которого в пределах одного клеточного цикла безграничны по спектру полипептидов для всех генов генотипа, но ограничены числом рибосом, а также продолжительностью экспрессии и активностью ферментов, участвующих в биосинтезе полипептидов.
Возможности этого источника по спектру полипептидов в пределах жизни многоклеточного организма, вероятно, не имеют ограничений вообще, хотя в теоретическом плане они (возможности) должны зависеть от числа клеточных делений, контролируемых программой онтогенеза, - речь идет о числе Хейфлика, согласно которому общее число делений одной клетки ограничено определенным пределом (см. главу 9).
БЕЛКИ КАК РЕЗУЛЬТАТ ГЕННОЙ ЭКСПРЕССИИ
Анализируя результаты работы генов, экспрессирующихся с образованием различных по своему назначению и функциям белков, приходишь к заключению: в живой природе нет ничего более удивительного, чем протеины (разумеется, после главной молекулы жизни - молекулы ДНК).
Как сказано в главе 1, протеины изучаются около 200 лет. Еще в начале XIX в. химики назвали так определенные специфические вещества (от греческого «proteios» - «удерживающий первое место»). В России их нарекли белками в связи с белым цветом альбумина куриных яиц (один из самых распространенных протеинов) при его свертывании под влиянием высокой температуры.
Именно белкам принадлежит всеобъемлющая роль в молекулярной жизни клетки и организма, зависящей от производства
и функционирования огромного числа белков. Их молекулы с невероятной точностью «узнают» другие молекулы (белковой и небелковой природы) и вступают во взаимодействие с ними в ходе онтогенеза.
Особое значение имеет полиморфизм белков, основанный на генетическом полиморфизме, в разных вариациях обусловливающем уникальную внутреннюю и внешнюю характеристику каждой клетки и целого организма. Тот же полиморфизм делает отдельные клетки и ткани, органы и даже целые системы многоклеточного организма более склонными к определенным болезням. Подобная склонность неизбежно прослеживается на уровне белков в виде их дефектов, возникших в ходе трансляции генетической информации, модификации белковых молекул и нарушений их взаимодействия при наследственных и врожденных заболеваниях.
Общая характеристика
Белки - главный строительный материал для клеток, тканей, органов и систем организма.
По теоретическим расчетам, организм человека состоит из 1015 клеток, формирующих 264 типа тканей, построенных из 350-400 тыс. белков, т.е. последних в 10 раз больше, чем генов, а с учетом модификаций общее количество белков в организме достигает 6 млн*.
Строение, свойства и спектр белковых молекул
Белковая молекула есть полипептидная цепь из аминокислотных остатков. Один такой остаток - одна аминокислота.
Все живые организмы используют для строительства своих белков одни и те же основные аминокислоты. Их всего 20, и только они кодируются с помощью классического генетического кода (см. главу 2).
Основные аминокислоты содержат в своей структуре общий химический компонент:
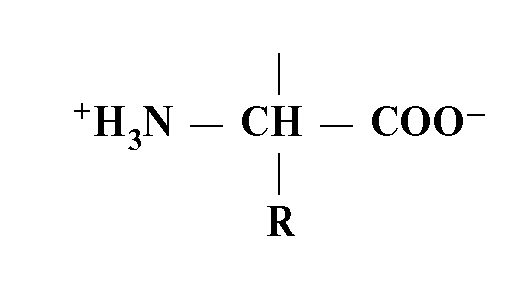 * Максимально возможному количеству синтезируемых у человека белков соответствует принцип «Cvantum satis» (столько, сколько нужно).
* Максимально возможному количеству синтезируемых у человека белков соответствует принцип «Cvantum satis» (столько, сколько нужно).
Они отличаются друг от друга по аминокислотным радикалам (R). Каждая аминокислота имеет полипептидный скелет (или цепь без радикалов):
- NH - СН - СО - NH - СН - СО - NH - СН - СО -
Различия аминокислот по форме, размерам и полярности позволяют использовать их в качестве основных строительных единиц («кирпичей»), чтобы удовлетворить многочисленные и жесткие требования к структурной организации белков.
В коротких цепях белков менее 80 аминокислотных остатков (пептиды). В длинных цепях белков более 80 аминокислотных остатков (полипептиды).
Самая длинная из известных полипептидных цепей у человека содержит около 5000 аминокислотных остатков, однако большинство структурных белков содержат менее 2000 аминокислотных остатков.
Аминокислотный алфавит допускает существование бесконечного множества белковых молекул (слов).
Порядок расположения аминокислот в полипептидной цепи называется аминокислотной последовательностью - это первичная структура белка.
Процедура определения такой последовательности именуется сиквенированием (так же, как определение последовательности нуклеотидов в молекуле ДНК - см. главу 2).
Белок с природной укладкой полипептидной цепи - нативный белок. Белок с развернутой беспорядочной укладкой цепи - денатурированный белок. Денатурация - процесс превращения нативного белка в денатурированный.
Тепловая денатурация - общее свойство разных белков. Нагревание белка почти всегда нарушает его активность, и оно смертельно для клетки.
Каждый белок химически индивидуален (уникален) по своей первичной структуре - это основа гетерогенности белков.
Структурная (биохимическая) уникальность каждого белка обусловливает полиморфизм белков человека, его биохимическую индивидуальность.
Гетерогенность белков зависит также от активности белка (способности к денатурации), величины белкового пика, наличия антигенных детерминант и аминоконцевой последовательности.
Например, первичная структура коллагенов (см. ниже) представлена повторами аминокислотной последовательности типа глицин -
Х-Y, в которых глицин является каждой третьей аминокислотой, позицию Х занимает пролин, а позицию Y занимают, как правило, гидроксипролин или гидролизин.
Другие примеры - первичная структура мономера инсулина (рис. 15) и схема строения (рис. 16) молекулы инсулина (51 аминокислотный остаток).
Когда полипептидная цепь принимает в пространстве специфическую конфигурацию, то это вторичная структура белка (или собственно полипептидный скелет). Ее формируют 3 типа укладки: альфа-спираль, бета - складчатые слои и соединительные петли, распределенные вдоль полипептидной цепи.
Дальнейшая пространственная укладка полипептидной цепи называется третичной (трехмерной) структурой белка.
К белкам с трехмерной структурой относится большинство белков: белки клеточных мембран, цитохромы (содержат гем в качестве простетической группы), дегидрогеназы (содержат флавинадениндинуклеотид - FAD), гликопротеины (связаны с углеводными компонентами), протеогликаны (формируют межклеточный матрикс), белки плазматических мембран, секреторные белки, белки сыворотки крови, белки муцина (слизи) и т.д.
Причем трехмерная структура характерна как для глобулярных белков (компактное сферическое образование в виде глобул со слабыми
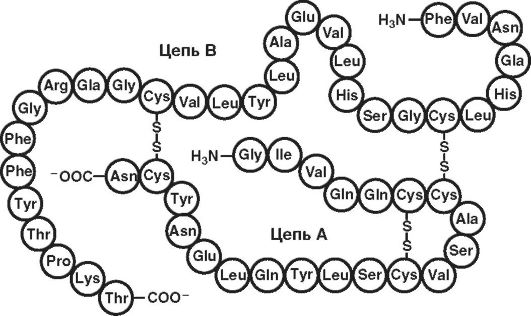 Рис. 15. Первичная структура мономера инсулина (по Сэнджер Ф., 1954; http://www.transplantology.com/index.php.&page39)
Рис. 15. Первичная структура мономера инсулина (по Сэнджер Ф., 1954; http://www.transplantology.com/index.php.&page39)
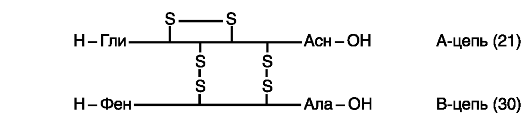 Рис. 16. Схема
строения молекулы инсулина (по: www. xumuk.ru;
http://www.xumuk.ru/biologhiim/22.html). Между цепями АиВи внутри А-цепи
образуются дисульфидные (-S-S-) связи. Близкими по первичной структуре
оказались инсулины человека, свиньи и кашалота. Единственным отличием
инсулина человека от инсулинов других видов является нахождение треонина
в положении 30 В-цепи вместо аланина
Рис. 16. Схема
строения молекулы инсулина (по: www. xumuk.ru;
http://www.xumuk.ru/biologhiim/22.html). Между цепями АиВи внутри А-цепи
образуются дисульфидные (-S-S-) связи. Близкими по первичной структуре
оказались инсулины человека, свиньи и кашалота. Единственным отличием
инсулина человека от инсулинов других видов является нахождение треонина
в положении 30 В-цепи вместо аланина
пептидными связями), так и фибриллярных белков, имеющих длинные вытянутые вдоль общей оси полипептидные цепи с прочными непептидными связями.
Наиболее наглядными примерами фибриллярных белков служат коллагеновые белки, из которых состоят соединительная ткань и сухожилия, а также белки на основе альфа-кератина (волосы и ногти) или эластина (клетки кожи и стенок артерий и легочных альвеол).
Коллагены - филогенетически наиболее старые белки, с них начиналась органическая жизнь на Земле.
В настоящее время в геноме человека идентифицировано более 40 коллагеновых генов и еще столько же участков ДНК, содержащих характерные для коллагеновых генов последовательности нуклеотидов разной протяженности.
Всего описано 28 типов коллагенов. Их молекулы включают три полипептидные альфа-цепи, соединенные в уникальную конформацию - тройную спираль.
На рис. 17 приведена схема синтеза коллагеновых белков: в шероховатом ретикулуме цитоплазмы пре-преколлагеновая цепь преобразуется (благодаря отщеплению сигнального пептида) в проколлагеновую альфа-цепь (в таком виде она представлена в аппарате Гольджи).
Затем альфа-цепь подвергается воздействию ферментов секреторных вакуолей, обеспечивающих процессы ее гидроксилирования, гликозилирования и образования дисульфидных связей. Потом три альфа-цепи превращаются в проколлагеновую молекулу, поступающую в экстраклеточный матрикс, где от нее отщепляются пропептиды, и она становится коллагеновой молекулой.
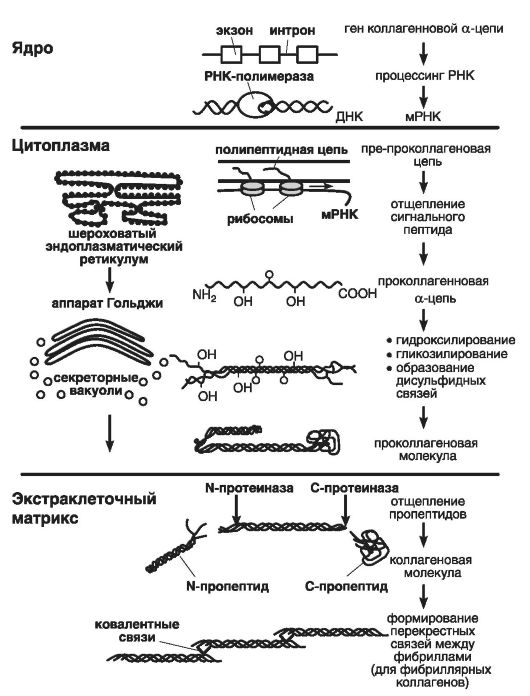 Рис. 17. Схема синтеза коллагеновых белков (по: Курниковой М.А., 2007)
Рис. 17. Схема синтеза коллагеновых белков (по: Курниковой М.А., 2007)
Далее происходит формирование перекрестных связей между фибриллами, характерное для фибриллярных коллагенов, для которых супрамолекулярными структурами служат фибриллы, состоящие из тройных спиралей. Путем их взаимодействия с различными гликопротеинами и протеогликанами экстраклеточного матрикса формируются трехмерные структуры, напоминающие «строительные леса».
Многие из компонентов внеклеточного матрикса содержат домены тройных спиралей, но они отличаются от фибриллярных коллагенов и относятся к нефибриллярным.
На рис. 18 приведена супрамолекулярная структура фибриллярных коллагенов: она представлена фибриллярными белками (типы I-III, Y, XI, XIY и XXYII), листоподобными белками (типы: IY, YIII и X) и якорными (связывающими) белками (типы YI, YII, IX, XI и
XIY).
Агрегаты молекул фибриллярных коллагенов следующие: димеры, димеры-тетрамеры, тетрамер «паук», нитеподобные филаменты, якорные фибриллы и др.
Существуют также белки с макромолекулами, представленными функционально активными комплексами, состоящими из нескольких полипептидов. Это субъединицы олигомерного (протомерного) белка. Укладку субъединиц в таком белке называют четвертичной (четырехмерной) структурой, или пространственным расположением взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепочками.
Такая структура характерна для белков, построенных из двух или более полипептидных цепей. Это способ укладки протомеров в пространстве. Причем протомеры связаны друг с другом посредством нековалентных связей (ионных, водородных, гидрофобных) и взаимодействуют между собой только определенными участками поверхности (www.biochemistry.ru). Например, эритроциты содержат гемоглобин - белок, образованный четырьмя цепями аминокислот. Каждая цепь присоединяется к молекулярной группе (группа гема) с один атомом железа, фиксирующим молекулу кислорода и переносящим ее от легких к тканям, а диоксид углерода - от тканей к легким. Так реализуется элементарное проявление жизни, называемое молекулярным дыханием. И хотя на первый взгляд его механизм выглядит простым, он основан на взаимодействии многих типов атомов в гигантской молекуле гемоглобина.
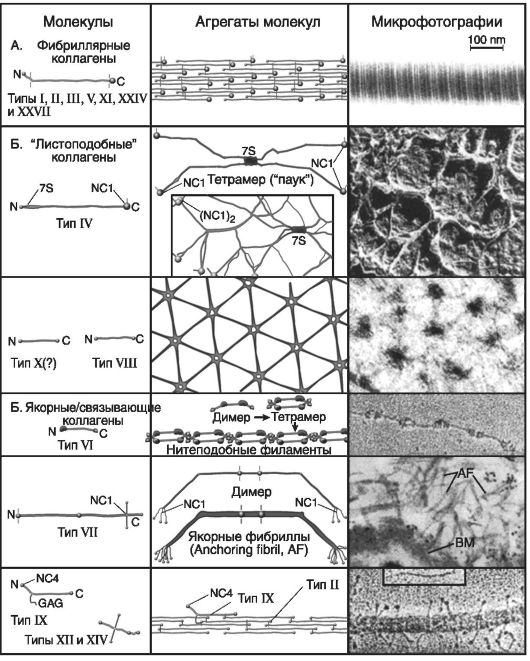 Рис. 18. Супрамолекулярная структура фибриллярных коллагенов (по: М.А. Курниковой, 2007)
Рис. 18. Супрамолекулярная структура фибриллярных коллагенов (по: М.А. Курниковой, 2007)
Подсчитано: в одном эритроците содержится около 340 млн молекул гемоглобина. Каждая из них состоит из 103 атомов, относящихся к С, Н, О, N, S и Fe (последний элемент представляют 4 атома). Атомы железа расположены в центре гема - пигмента, придающего крови характерный красный цвет. Каждая из четырех молекул гема «обернута» одной полипептидной цепью (рис. 19).
В молекуле гемоглобина взрослого человека НЬА (от англ. adult) находятся четыре полипептидные цепи, вместе составляющие белковую часть (или глобин). Две из них, называемые α-цепями, имеют одинаковую первичную структуру и содержат по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков.
Таким образом, вся молекула глобина состоит из 574 аминокислот. Во многих положениях в α- и β-цепях гемоглобина разные аминокислотные последовательности при почти одинаковых пространственных структурах.
Получены доказательства, что у 20 видов животных в структуре гемоглобинов 9 аминокислот оказались одинаковыми в своей последовательности и консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие - в составе неполярной внутренней структуры глобулы.
На рис. 19 приведена четырехмерная структура гемоглобина.
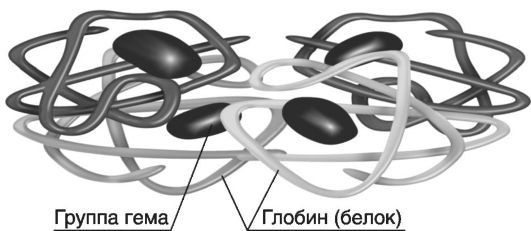 Рис. 19. Четырехмерная
структура гемоглобина (по
http://www.rusmedserver.ru//med/anatome/sistkrovi/19.hml). Гемоглобин в
качестве белкового компонента содержит глобин, а небелкового - гем.
Видовые различия гемоглобина обусловлены глобином, в то время как гем
одинаков для всех видов гемоглобина
Рис. 19. Четырехмерная
структура гемоглобина (по
http://www.rusmedserver.ru//med/anatome/sistkrovi/19.hml). Гемоглобин в
качестве белкового компонента содержит глобин, а небелкового - гем.
Видовые различия гемоглобина обусловлены глобином, в то время как гем
одинаков для всех видов гемоглобина
Наряду с белками, обладающими указанными выше структурными особенностями (способы укладки), выделены белки-домены (или белковые модули), представляющие собой фрагменты полипептидной цепи, сходные по свойствам с глобулярными белками.
Домены автономны, но подчинены общему биологическому смыслу, что позволяет представить их как совокупность отдельных элементарных процессов.
Идея модульной конструкции белков-ферментов допускает частое появление и быструю эволюцию новых функциональных белков по принципу сборки электронного устройства из микросхем.
Иногда белки-домены кодируются отдельными фрагментами генов - экзонами. Значит, не исключена перетасовка экзонов (и соответственно доменов) как механизм эволюции белков.
Концепция модульного фолдинга
Рассмотрим ситуацию, возникающую в клетке после синтеза полипептида. Он «пробует» самостоятельно преобразоваться в трехмерную структуру за счет взаимодействия аминокислотных остатков. Известно, что возможности ассоциации аминокислотных остатков друг с другом безграничны.
Именно этот беспорядочный и безграничный процесс назван фолдингом.
Ответ на вопрос о том, какая именно трехмерная структура белка возможна после синтеза полипептидной цепи, известен: это определяется аминокислотной последовательностью. Однако сама последовательность не позволяет ответить на другой вопрос: каким образом такая структура может возникнуть? Иными словами, это одна из нерешенных проблем молекулярной биологии.
Процесс фолдинга происходит с участием двух классов белков: белков-ферментов и белков - молекулярных шаперонов.
К первому классу белков относятся два белка-фермента. Один из них - протеиндисульфидизомераза (ПДИ), образующая, перемещающая или разрушающая в самой полипептидной цепи связи -S-S- между остатками цистеина и тем самым корригирующая фолдинг (в эндоплазматическом ретикулуме клетки). Второй белок - пептидилпролинизомераза (ППИ) - катализирует цис- и трансизомеризацию пептидных связей пролина, обеспечивая правильную конфигурацию белка. Например, к таким белкам относятся циклофиллины.
Они связывают циклоспорин (антибиотик и иммунодепрессант) при трансплантации органов.
Молекулярные шапероны включают семейство высокоспециализированных белков, находящих правильную пространственную структуру для вновь синтезированных белков. Их название происходит от слова «шаперон» (буквально - пожилая дама, сопровождающая молодую девушку на балах).
Шапероны связываются с ошибочными структурами белка, что стабилизирует частично свернутую молекулу до того момента, пока не произойдет правильный фолдинг (после отхода шаперона).
Таким образом, шапероны стабилизируют неустойчивую форму и способствуют образованию правильной формы полипептида в ходе различных молекулярных процессов: олигомерной сборки или транспорта белка, самого фолдинга, а также контроля за «переключением» конформации белка (активная - неактивная, нормальная - патологическая). В последнем случае такими примерами служат переключения, происходящие в специфических рецепторах для глюкокортикоидов и в ходе преобразования нормальной изоформы в патологическую изоформу для прионных белков (см. главу 29).
Классы белков и их функции
Многие известные классификации белков основаны на случайных показателях (физико-химические свойства, форма молекул, локализация и происхождение, аминокислотный состав), а также на особенностях структуры и функционирования протеинов. Большинство подобных классификаций не соответствует постоянно возрастающему уровню знаний о белках.
В частности, расшифрованы структура и функции только нескольких сотен природных белков, а их около 6 млн модификаций. Стройная система номенклатуры белков и их подразделение на типы отсутствуют, из-за чего ряд авторов ограничиваются разделением белков человека на два класса: структурные и функциональные протеины (белки-ферменты).
В первую очередь рассмотрим самую старую классификацию белков, основанную на определенных (не вполне значимых) данных об их структуре, составе и свойствах. Согласно этой классификации, белки делятся в зависимости от химического состава на простые и сложные.
Простые белки построены из остатков аминокислот и при гидролизе распадаются только на свободные аминокислоты. Различают
подгруппы простых белков: альбумины, гистоны, глютелины, глобулины, проламины, протамины и др.
Сложные белки двухкомпонентны, состоят из простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Классификация сложных белков основана на химической природе входящего в их состав небелкового компонента, в соответствии с чем различают гликопротеины (содержат углеводы), липопротеины (содержат липиды), металлопротеины (содержат металлы), нуклеопротеины (содержат нуклеиновые кислоты), фосфопротеины (содержат фосфорную кислоту) и хромопротеины (содержат пигменты).
В более сложной классификации белков учитываются особенности их структуры. Различают α-, β-, α+β- или α/β-белки.
Причем α-белки содержат только α-спирали (не менее 60%); β-белки - только β-спирали; α+β-белки и α/β-белки - ите,и другие структуры в пределах одной полипептидной цепи (например, молекулы лизоцима). Так, в α/β-белках множество α- и β-структур, чередующихся вдоль полипептидной цепи или так называемых доменов, создаваемых объединением α-спиралей и β-слоев, между которыми открываются более рыхлые структуры.
В качестве примеров белков, классифицируемых по структурному принципу, выше рассмотрены: инсулин (см. рис. 15, 16), коллагены (см. рис. 17, 18) и гемоглобин (см. рис. 19).
Вместе с тем наиболее распространенная классификация белков - их разделение по функциональному принципу. Выделен класс протеинов, обладающих способностью катализировать химические реакции, разработана стройная система их номенклатуры, учитывающая химическую природу и типы белков. Однако этот класс белков охватывает лишь незначительную их долю, не более 3000.
По функциональному принципу выделяют 12 основных классов белков: каталитически активные белки-ферменты; белки-гормоны (в том числе стероидные гормоны); белки-регуляторы активности генома; защитные белки (антитела) и белки свертывающей и антисвертывающей систем крови; токсические белки; транспортные белки; мембранные белки; сократительные белки; рецепторные белки; белки-ингибиторы ферментов; белки вирусной оболочки; белки с иными функциями (например, прионные белки).
Прионные белки
В последние годы в клинической генетике выделен класс нейродегенеративных заболеваний, связанных с прионными белками. Они устойчивы к действию протеаз и обнаружены в мозге человека и животных как в нормальной, так и в патологической формах, представляющих собой две изоформы одного и того же полипептида, кодируемые одним и тем же геном.
Однако их конформация различна: патологический белок имеет высокое содержание бета-слоев, тогда как нормальный белок их почти не имеет.
Кроме того, патологический белок сам себя воспроизводит, что позволяет ему выступать в роли возбудителя прионной болезни (см. главу 29).
ОСНОВНЫЕ ПОНЯТИЯ ПРОТЕОМИКИ
Сначала рассмотрим общие положения, связанные с появлением основных понятий протеомики. Среди главных факторов, принимающих участие в формировании белковых продуктов онтогенеза - носителей разнообразных функций клетки и организма (отдельных признаков и фенотипа в целом), выделены 3 группы:
• гены и генотип (см. главу 2);
• механизмы взаимодействия между материнским и отцовским геномами (см. главу 4);
• факторы окружающей среды (см. главы 4 и 5).
Для упрощенного рассмотрения действия этих факторов при формировании признаков и фенотипа в середине XX в. предложено основное уравнение: Р = G + E, в котором Р - это признак (фенотип), G - ген (генотип), Е - фактор(ы) среды.
Следовательно, признак (фенотип) охарактеризован как результат действия гена (генотипа), фактора среды или их совместного влияния (общий эффект).
Иными словами, Р - это регистрируемый результат (внутренний и/или внешний) действия (функции) генов и факторов среды, их фенотипическое проявление.
Таким образом, за любым признаком (фенотипом) стоит функция конкретного гена (генотипа) и/или эффект фактора(ов) среды.
С позиций протеомики, признак (фенотип) - это результат экспрессии гена, проявляющийся в виде структурного или регуляторного белка (белка-фермента) или их комплексов.
Теперь сформулируем основные понятия протеомики.
Признак, нормальный признак, патологический признак
Признак - это фенотипическое проявление или результат действия гена(ов), фактора(ов) среды или их совместного действия.
Другое определение признака: это дискретная единица, характеризующая конкретный уровень организма (молекулярный, биохимический, клеточный, тканевый, органный или системный); она отличает один организм от другого.
Разные организмы (в пределах одного биологического вида) имеют разные признаки (окраска глаз, курчавость волос, длина и масса тела и т.п.).
К признакам клетки и организма, проявляющимся на молекулярном (генетическом и биохимическом) уровне, или молекулярным признакам, относятся так называемые строительные материалы клеток и тканей, органов и систем, т.е. макромолекулы и микромолекулы органических соединений со встроенными в них неорганическими веществами. Главные из таких молекул - нуклеиновые кислоты (полинуклеотиды и нуклеотиды), белки (полипептиды, пептиды и аминокислоты), полисахариды и моносахариды, липиды и их компоненты.
К надмолекулярным (супрамолекулярным) признакам, проявляющимся на клеточном, тканевом, органном и организменном уровнях, относятся: антропометрические, анатомические, морфологические (гистологические), физиологические (функциональные), неврологические, эндокринологические, иммунологические, психические, психологические и другие фенотипические особенности организма.
Признаки делятся на нормальные и патологические.
Нормальный признак - это фенотипическое проявление определенного признака в пределах установленных для него границ нормы, результат нормального действия гена, фактора окружающей среды или их совместного влияния.
Например, нормальное количество лейкоцитов в крови ребенка - 6-9 тыс.
Патологический признак - это фенотипическое проявление определенного признака, выходящее за пределы установленных для него границ нормы, либо это проявление ранее неизвестного (нового) признака.
Например, если в крови у ребенка меньше 6 тыс. лейкоцитов - это лейкопения, а больше 9 тыс. - это лейкоцитоз.
Патологический признак как симптом болезни - это результат патологического действия гена, фактора окружающей среды или их совместного влияния.
Фенотип, нормальный фенотип, патологический фенотип
Фенотип - это совокупность всех признаков организма, обусловленных совместным действием генотипа и факторов среды.
Нормальный фенотип - это совокупность всех нормальных признаков организма, обусловленных нормальным действием генотипа и факторов среды (результат их взаимодействия).
Патологический фенотип - это наличие ряда патологических признаков организма, обусловленных патологическим действием генотипа и факторов среды (результат их взаимодействия), на фоне других нормальных признаков организма.
Здесь следует пояснить смысл формулировки «...на фоне других нормальных признаков».
Если у больного человека выявлен конкретный патологический признак или фенотип (например, симптоматика ОРВИ), то это совсем не означает, что у него исчезли другие (нормальные) признаки, например голубая окраска глаз, курчавость волос и др.
Патологический фенотип как симптомокомплекс болезни - это результат совместного патологического действия генотипа и факторов окружающей среды.
Фенотипический полиморфизм
Фенотипический полиморфизм - это многообразие нормальных и патологических признаков и фенотипов, выявляемых на любых уровнях дискретности организма: молекулярном, клеточном, тканевом, органном и организменном.
С фенотипическим полиморфизмом тесно связаны:
• полиморфизм последовательностей ДНК или генетический полиморфизм (см. главу 2), служащий основой генетической уникальности (индивидуальности) человека;
• полиморфизм белков, или протеомный (биохимический) полиморфизм (см. выше), служащий основой фенотипической уникальности (индивидуальности) человека.
Понятия клинической протеомики
Клиническая протеомика - это патологические (клинические) признаки и фенотипы, с которыми имеет дело врач любой специальности, проводящий осмотр пациентов.
К клиническим признакам и фенотипам относятся:
• симптом болезни (см. «патологический признак»);
• симптомокомплекс болезни (см. «патологический фенотип»);
• болезнь, патокинез и прогредиентность.
Болезнь - это патологический процесс, возникший в ходе онтогенеза, это временный или постоянный патологический фенотип (симптомокомплекс болезни), характеризующийся патокинезом и прогредиентностью.
Понятия «патокинез» и «прогредиентность» впервые введены И.В. Давыдовским (1961).
Патокинез - это движение патологического процесса, т.е. болезнь движется от начала до конца, последовательно проходя стадии продромы (скрытый, или латентный период), манифестации первых признаков, течения болезни (начало, совпадающее с манифестацией, середина течения и исход). Исход - это выздоровление, переход болезни в хроническое состояние или смерть.
Прогредиентность - это прогрессирование патологического процесса или нарастание степени тяжести (экспрессивности) болезни по мере ее течения.
Наследственная болезнь
Наследственная болезнь - это возникший в ходе онтогенеза постоянный (конституциональный) патологический фенотип с признаками патокинеза и прогредиентности, передаваемый из поколения в поколение.
Врожденная болезнь
Врожденная болезнь - это возникший внутриутробно постоянный патологический фенотип без признаков патокинеза и прогредиентности, передаваемый или не передаваемый из поколения в поколение, что связано с генетической или негенетической причиной болезни.
Например, если диагноз синдрома Дауна поставлен уже при рождении ребенка, то фенотип такого больного остается стабильным в течение всей его жизни, ибо он обусловлен хромосомным нарушением.
Хромосомный синдром
Хромосомный синдром - это вариант врожденной болезни, вызванный генетической причиной (структурной или геномной мутацией), но, как правило, не наследуемой, за исключением случаев сбалансированных семейных транслокаций (см. главу 17).
Клинический синдром
Понятие «клинический синдром« созвучно понятию «хромосомный синдром», но отнюдь не совпадает с ним.
Клинический синдром характеризует наиболее выраженные клинические особенности отдельного заболевания (их группы) или отдельные периоды болезни. Таких синдромов насчитывается несколько десятков. В качестве примеров следует привести:
• респираторный нейродистресс-синдром - вариант начала гликогенозов разных типов (см. главу 21);
• синдром дыхательной недостаточности - развивается у новорожденного из-за незавершившейся дифференцировки альвеолярного эпителия и слабой выработки сурфактанта (см. главу 14);
• синдром «внезапной смерти» («смерти в колыбели») - вариант исходов гликогеноза Помпе и адреналового криза при сольтеряющей форме АГС (см. главы 14,17 и 21);
• синдром мальабсорбции или нарушенного кишечного всасывания - одна из характерных особенностей многих наследственных болезней обмена (см. главу 21);
• синдром гормонального криза (см. главу 14);
• синдром нечувствительности к андрогенам (см. главу 16);
• талидомидный синдром (см. главу 23).
Синдром как понятие тератологии
В тератологии (дисморфологии) понятие «синдром« обозначает устойчивое сочетание двух или более пороков развития, выявляемых в разных системах организма и патогенетически связанных между собой (см. главу 23). В основе такого синдрома лежит одна причина, которая может быть обусловлена генной мутацией, хромосомной аберрацией или действием тератогена.
Врожденный порок развития
Врожденный порок развития (ВПР) или большая аномалия развития (БАР) - стабильный патологический признак, регистрируемый как морфологическое изменение органа (большого участка тела), выходящее за пределы вариаций границ строения (за границы нормы) и сопровождающееся нарушением функции, т.е. стойкое морфофункциональное нарушение.
В зависимости от этиологической причины ВПР (БАР) либо передается из поколения в поколение, либо нет. В первом случае это
ВПР, обусловленные доминантно и рецессивно наследуемыми генными мутациями, пороками мультифакториальной природы, а также семейными транслокациями. Во втором случае это пороки экзогенного происхождения.
Малая аномалия развития
Малая аномалия развития (МАР) - это, как правило, стабильный патологический признак или изменение органа (участка тела) на конечной стадии морфогенеза (стадии гистогенеза), не выходящее за пределы вариаций границ строения и не сопровождающееся нарушением функции, т.е. стойкое (в большинстве случаев) гистологическое нарушение.
В зависимости от этиологической причины МАР могут передаваться или не передаваться из поколения в поколение, а в ряде случаев изменяться с возрастом вплоть до полного исчезновения (см. главу 23).
Клинический полиморфизм, уровни его проявления и признаки
Клинический полиморфизм как понятие клинической протеомики подразумевает различия в клинической картине одного и того же заболевания у разных больных, т.е. несовпадение отдельных симптомов (симптомокомплексов).
Известно, что в древности и особенно в средние века врачи отличались глубокими знаниями анатомии на тканевом, органном и системном уровнях организма.
Медики XVIII-XIX вв. изучали человека уже на клеточном уровне; стали востребованы гистология, биохимия, физиология, патологическая анатомия и физиология, микробиология. В XX в. приобрели актуальность вирусология, аллергология, иммунология, общая и медицинская генетика, молекулярная биология и генетика, биофизика, физико-химическая медицина; во второй половине века начались исследования на молекулярном уровне.
Современная молекулярная медицина основана на знаниях геномики, протеомики и биоинформатики. Начался переход на атомный, субатомный (аттомолярный) уровни, наноуровень (см. главу 20).
Причем, если раньше медицина прогрессировала медленно, веками, то в современных условиях появление и внедрение нового происходит значительно быстрее - в течение нескольких десятилетий.
Параллельно с развитием медицины усложнялась проблема клинического полиморфизма патологических признаков и фенотипов. Как сказано выше, клинический полиморфизм обусловлен действием генов в составе генотипа организма (взаимодействием материнского и отцовского геномов) с участием или без участия факторов окружающей среды. В отличие от генетического и биохимического полиморфизмов, определяемых на молекулярном уровне, клинический полиморфизм проявляется на тканевом, органном и системном уровнях, в связи с чем врач самостоятельно оценивает патологические признаки и фенотипы в ходе осмотра пациентов, применяя доступные только ему общие клинические, клинико-инструментальные и клинико-лабораторные методы обследования больных с наследственной и ненаследственной патологией (см. главу 18).
Кроме того, если врач осматривает в конкретной семье помимо самого больного еще его родственников, страдающих тем же заболеванием, то имеет место следующий уровень клинического полиморфизма - уровень внутрисемейных различий.
Если же врач осматривает разных больных с одним заболеванием в неродственных семьях, то имеет место еще один уровень клинического полиморфизма - уровень межсемейных различий.
Таким образом, всего выделяют 5 уровней клинического проявления патологических признаков и фенотипов: тканевый, органный, организменный, внутри- и межсемейный.
К признакам клинического полиморфизма, выявляемым на всех уровнях, относятся: антропометрические, анатомические, морфологические (гистологические), физиологические (функциональные), неврологические, эндокринологические, иммунологические, психические, психологические и другие особенности организма, фиксируемые самим врачом при осмотре (обследовании) больного.
Таким образом, понятие «клинический полиморфизм» по спектру признаков и фенотипов значительно уже (только патология), чем понятие «фенотипический полиморфизм» (и норма, и патология). В свою очередь, и методов исследования проблемы клинического полиморфизма пока известно значительно меньше (см. главу 18), чем методов для изучения проблемы фенотипического полиморфизма (см. главу 19).
Вместе с тем, в условиях современной молекулярной медицины у врачей не должно быть никаких сомнений в отношении будущего существенного расширения спектра молекулярных и субмолекулярных методов изучения клинического полиморфизма.