Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 15 ОНТОГЕНЕЗ ИММУННОЙ СИСТЕМЫ И ЕГО НАРУШЕНИЯ
ХАРАКТЕРИСТИКА ИММУННОЙ СИСТЕМЫ
К понятию «иммунитет« (защита) относятся реакции организма, нейтрализующие все чужеродное, что в него проникает через слизистые оболочки органов дыхания, зрения, желудочно-кишечного тракта или через органы слуха, кожу (включая инъекционный путь).
К чужеродным агентам и веществам относятся бактерии, микроорганизмы, вирусы, вакцины, сыворотки, поврежденные клетки собственного организма, лекарственные препараты, химические и другие соединения. Эти вещества называются антигенами.
Молекула антигена состоит из двух частей: носитель или стабилизирующая часть (занимает 97-99% всей массы), и эпитоп (специфическая детерминантная группа). На одном носителе может быть несколько эпитопов. По специфичности детерминантных групп выделяют видовые, групповые, стадийные, типовые и штаммоспецифичные антигены.
По чужеродности антигены делятся на ксеноили гетероантигены (не принадлежат к данному виду), гомоили аллоантигены (принадлежат к данному виду) и аутоантигены (собственные антигены).
В ответ на проникновение антигенов в организме происходят иммунные реакции, в ходе которых в крови и тканевой жидкости продуцируются антитела (крупные гликопротеины), способные к образованию иммунных комплексов «антиген-антитело». Вещества, не способные к образованию этих комплексов, называются гаптенами.
Таким образом, иммунный ответ - это защитная система организма, избавляющая его от генетически чуждых веществ и соединений. Она представлена лимфоидными органами и клетками. Среди лимфоидных органов выделяют:
• первичные органы - тимус и костный мозг (их развитие не стимулируется антигенами);
• вторичные органы - лимфатические узлы, селезенка, лимфоидная ткань слизистых оболочек (их развитие стимулируется антигенами).
Все лимфоидные органы тесно связаны со всеми тканями, органами и системами организма при помощи сетей кровеносных и лимфатических сосудов и капилляров, нервных волокон и окончаний.
Морфофункциональным субстратом иммунной системы являются иммунокомпетентные клетки, постоянно взаимодействующие друг с другом в ходе иммунного ответа. В первую очередь это лимфоциты, относящиеся к самой большой популяции клеток, отвечающей за специфическое распознавание, разрушение и элиминацию антигенов. Лимфоциты отличают «свое» от «чужого», сохраняют об этом память, осуществляют синтез антител и цитотоксические реакции. Среди них выделяют:
• В-клетки - синтезируют антитела или поверхностные рецепторы, специфичные к определенным антигенам.
• Т-клетки - включают три субпопуляции клеток с различными функциями.
- первая субпопуляция - взаимодействует с В-клетками, помогая им размножаться, созревать и образовывать антитела - это хелперные клетки (Тх) или помощники;
- вторая субпопуляция - взаимодействует с мононуклеарными фагоцитами, способствуя разрушению находящихся в них микробов, - это также хелперные Т-клетки;
- третья субпопуляция - разрушает клетки организма, зараженные вирусами, и опухолевые клетки - это цитотоксические клетки (Тц) или натуральные (естественные) киллеры (NK-клетки); они действуют при отсутствии антител (без предварительной иммунизации); к этой субпопуляции также относятся К-клетки, разрушающие клетки-мишени, содержащие на поверхности малое количество JgG.
• Большие гранулярные лимфоциты - совместно с Т-клетками и мононуклеарными фагоцитами участвуют в образовании медиаторов иммунных реакций или цитокинов.
Среди других клеток-участниц иммунного ответа выделяют следующие.
• Макрофаги и их предшественники - моноциты. К ним относятся мононуклеарные фагоциты системы комплемента и полиморфноядерные нейтрофилы. Они обеспечивают фагоцитоз и представ-
ление антигенов лимфоцитам, продуцируют цитокины (простагландины, интерлейкины, факторы комплемента).
• Вспомогательные клетки (тучные клетки, тромбоциты и базофилы). Они участвуют в реакциях воспаления и анафилактических реакциях.
• Другие клетки. Среди них: тканевые клетки (посылают сигналы лимфоцитам, отвечают на действие цитокинов, выделяемых Т-клетками и макрофагами, а также продуцируют интерфероны), клетки печени (производят вместе с макрофагами белки и факторы комплемента).
Все указанные клетки продуцируют ряд медиаторов, среди которых:
• специфические медиаторы - антитела или иммуноглобулины основных классов: A, D, E, G и M, а также антигенраспознающие рецепторы В-клеток и Т-клеток;
• антигенспецифические медиаторы; продуцируются Т-клетками, усиливают или угнетают факторы иммунного ответа;
• неспецифические медиаторы; среди них лимфокины, монокины, ФНО и факторы торможения миграции макрофагов, медиаторы гиперчувствительности немедленного типа (гистамин, серотонин, фактор активации тромбоцитов), лизоцим и факторы системы комплемента.
Плазма крови поступает в различные ткани организма (их не менее 264 типов) из сосудистых капилляров, образуя межклеточную (тканевую) жидкость, омывающую все клетки. При этом она отдает клеткам питательные вещества и забирает от них продукты жизнедеятельности, после чего тканевая жидкость поступает через венозные и лимфатические капилляры сначала в мелкие, а затем в более крупные лимфатические сосуды, открывающиеся в грудной проток и две подключичные вены.
Происхождение клеток иммунной системы показано на рис. 53. В частности, тромбоциты продуцируются мегакариоцитами. Гранулоциты и моноциты мигрируют из кровотока в ткани. Тучные клетки присутствуют во всех тканях. В-клетки созревают в печени плода и костном мозге, а Т-клетки - в тимусе. Большие гранулярные лимфоциты производятся в костном мозге, они обладают активностью нормальных киллеров (НК). Лимфоциты мигрируют из кровотока, проходят через вторичные лимфоидные ткани и снова поступают в кровоток.
Роль антигенпрезентирующих клеток во вторичных лимфоидных тканях выполняют интердигитарные и дендритные клетки. В разных местах организма лимфатические сосуды образуют узлы, где концентрируются лимфоциты. Эти узлы «отслеживают» (фильтруют) лимфатическую жидкость, в которой циркулируют лимфоциты, вступающие в прямые контакты с антигенами. При этом 1-2% лимфоцитов не остаются в лимфатических узлах, а снова перемещаются по кровеносным и лимфатическим сосудам из одного органа к другому, т.е. рециркулируют, что позволяет им находиться в постоянном контакте с соответствующими антигенами.
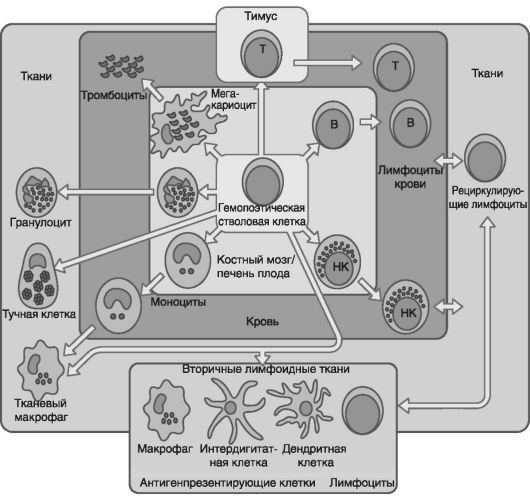
Рис. 53. Происхождение клеток иммунной системы (по Ройту А. и соавт., 2000). Все изображенные на рисунке клетки происходят от гемопоэтической стволовой клетки
В случае повторной иммунизации одним и тем же антигеном рециркуляция останавливается приблизительно на 24 ч, что объясняется избирательной задержкой антигенспецифичных лимфоцитов в лимфоузлах, «дренирующих» место проникновения антигена. Лимфоидная ткань слизистых оболочек содержит 40% всех лимфоцитов, селезенка - 30%, лимфатические узлы - 20%, кровеносные и лимфатические сосуды - по 5%.
Единство иммунной, эндокринной и нервной систем
Иммунная система функционирует в тесном взаимодействии с нервной и эндокринной системами. Совместно эти главные регуляторные и защитные системы обеспечивают приспособляемость организма к окружающей среде. Получено много доказательств такого взаимодействия. Например, на клетках иммунной системы выделены рецепторы к гормонам (кортикостероидам, инсулину, СТГ, тестостерону) и другим биологически активным веществам - ацетилхолину, бета-адренергическим медиаторам, эндофинам, энкефалинам, эстрадиолу.
Ряд гормонов (глюкокортикоиды, андрогены, эстрогены и прогестерон) подавляют иммунные реакции, в то время как другие гормоны (инсулин, тироксин и СТГ) наоборот их стимулируют. Интерлейкины (их не менее 18) выполняют функции медиаторов ЦНС. Так, ИЛ-2 продуцируется клетками нервной ткани и влияет на пролиферацию олигодендроглии. В последние годы показано, что иммунитет контролируется гипоталамо-гипофизарно-адреналовой системой. Например, при изучении влияния нейроэмоционального стресса на активность иммунитета у спортсменов-профессионалов оказалось, что такой стресс индуцирует у них транзиторный иммунодефицит, в ходе которого снижается активность NK-клеток, уменьшается соотношение показателей маркеров CD4/CD8 и содержание JgA, замедляется пролиферация лимфоцитов в ответ на действие антигенов и митогенов. Получены также доказательства связей активации локальных иммунных реакций (увеличение лейкоцитарной инфильтрации эндометрия, количества Т-клеток, NK-клеток, макрофагов, рост титров иммуноглобулинов М, Аи G) c обусловливающими прерывание беременности нарушениями следующих процессов: имплантации зародыша в стенку матки; инвазии; развития хориона.
ОНТОГЕНЕЗ ЛИМФОИДНЫХ ОРГАНОВ
Иммунная система начинает формироваться на 4-й неделе онтогенеза.
Первичные лимфоидные органы
Тимус
Тимус (вилочковая железа) - это инфильтрированный лимфоцитами орган, секретирующий ряд пептидных гормонов, участвующих в дифференцировке лимфоидных органов и клеток (см. главу 14). Из них хорошо изучены тимулин, альфа- и бетатимозин и тимопоэтин. Тимус развивается раньше других лимфоидных органов из зачатков III и IV пар жаберных карманов головного конца кишечной трубки. Начиная с 5 нед в тимусе секретируются предшественники Т-клеток и хемотаксические факторы, привлекающие протимоциты костного мозга (будущие лимфоциты). Лимфатические сосуды тимуса представлены густой капиллярной сетью, начинающейся в междольковых септах соединительной ткани, в которых концентрируются и окончательно созревают Т-клетки. На 6-7 нед беременности в тимусе начинается дифференцировка на мозговую и корковую зоны, он смещается за грудину и вокруг образуется капсула. В 7-16 нед дифференцируются секреторные клетки - это критический период развития, во время которого корковая зона инфильтрирована малыми лимфоцитами, нейтрофилами, эозинофилами и тучными клетками. Здесь же находятся гемоцитобласты (источники будущих лимфоцитов) и отдельные очаги экстрамедуллярного лимфопоэза. Мозговая зона содержит небольшое количество лимфоцитов, многоядерных клеток слияния, крупных светлых клеток и макрофагов (способных к фагоцитозу). В конце дифференцировки в тимусе содержатся 84% Т-клеток и 1% В-клеток, что соответствует клеточному составу железы взрослого человека.
По мере созревания привлеченных из костного мозга протимоцитов на их поверхности начинают экспрессироваться антигены, включая маркер CD1 (специфичен для незрелых Т-клеток) и маркеры CD3, CD4, CD5 и CD8 (специфичны для Т-хелперов и Т-киллеров).
Зрелые тимоциты экспрессируют маркер CD44, который служит рецептором для компонентов внеклеточного матрикса и выявляется на всех циркулирующих лимфоцитах.
Максимальное развитие тимуса отмечается в детском возрасте, когда наблюдается быстрый рост тела. После полового созревания развитие железы замедляется и начинается ее инволюция, которая продолжается до конца жизни. Примерно к 25-летнему возрасту прекращается рост тела человека (чему способствует эффект СТГ) и нарушается ранее стабильное соотношение Т- и В-клеток. После 40 лет продукция гормонов тимуса снижается на 50%.
Костный мозг
Костный мозг как кроветворный орган развивается, начиная с 16-18 нед. До этого срока кроветворную функцию выполняет печень. В первой половине жизни в костном мозге выявляются 16-18% В-клеток и 1,5-1,8% Т-клеток. В дальнейшем их количество постепенно снижается параллельно с инволюцией тимуса. Лимфоциты образуются в костном мозге в течение всей жизни из полипотентных стволовых клеток.
Вторичные лимфоидные органы
Селезенка
Селезенка развивается из мезенхимы дорсальной брыжейки будущего большого сальника. На 4 нед развития она представлена скоплением клеток на стенке желудка, а на 5 нед в этом скоплении определяются единичные бласты, макрофаги и ретикулярные волокна. На 13 нед это уже отдельный полый орган, готовый для депонирования крови. В нем видны ретикулярная ткань, трабекулярный остов и сеть кровеносных сосудов.
На 14 нед в селезенке появляются фолликулы (без лимфоцитов) и слабо определяется гемопоэтическая функция. На 15 нед селезенка «заселяется» лимфоцитами: В-клетки составляют 13%, Т-клетки - 2,5% (до этого времени В-клетки определяются только в печени).
На 16-20 нед в селезенке уже 30% В-клеток и 16% Т-клеток, и такое соотношение сохраняется до рождения ребенка.
У взрослого человека в селезенке преобладает антителообразование. К другим ее функциям относится участие в системе неспецифической резистентности, которую обеспечивают поступившие в селезенку прелимфоциты, преобразующиеся в NK-клетки.
Лимфатические узлы
Лимфатические узлы имеют фолликулы, синусы и строму. Их функция заключается в «вылавливании» антигенов из лимфы. Они
расположены в местах разветвления лимфатических сосудов, находящихся в «стратегических» пунктах лимфоидной системы: шейной, подмышечной и паховой областях, средостении и брюшной полости. В них собирается лимфа из глубоких и поверхностных областей тела.
Если лимфоузлы расположены поверхностно, их называют подкожными (защищают кожу), если глубоко, то это висцеральные узлы (защищают слизистые оболочки органов дыхания, пищеварительного тракта и мочеполовых путей).
Лимфатические узлы развиваются в разное время. В одних случаях они развиваются на 6-7 нед беременности (шейные узлы, узлы перинтонеальной и паховой областей). В других случаях они развиваются поздно - это мезентериальные узлы. На первом году жизни определяются затылочные узлы, после трех лет - подчелюстные узлы.
Окончательно все лимфатические узлы формируются к 10 годам жизни, и их количество у взрослого человека достигает 500, а общая масса соответствует 1% массы тела.
В возрасте 16-50 лет функция всех лимфатических узлов относительно стабильна, а после 60 лет в них уменьшается число лимфоцитов.
Лимфоидная ткань слизистых оболочек
Лимфоидная ткань слизистых оболочек (ЛТС) - это скопления лимфоцитов, фагоцитов и плазматических клеток, находящихся в бескапсулярных субэпителиальных фолликулах. Она расположена под слизистыми оболочками в легких, глоточном кольце Вальдейера- Пирогова (включает язычную, нёбную и глоточную миндалины), пейеровых бляшках (нижняя часть подвздошной кишки) и аппендиксе (отросток слепой кишки).
Глоточное кольцо развивается (как и тимус) из головного отдела кишечной трубки.
У детей 3-7 лет глоточные миндалины наиболее развиты, с 12 лет начинается их инволюция и уже к 16 годам обнаруживаются только остатки миндалин.
Лимфоциты ЛТС представлены Т-клетками, многие из которых являются клетками памяти (имеют маркер CD45RO). Они преимущественно синтезируют иммуноглобулины JgA и JgE (плазматические клетки в основном производят JgA), слабо реагируют на антитела к маркеру CD3, но чувствительны к антителам к маркеру CD28.
ЛТС отличается от других лимфоидных органов еще и тем, что циркулирующие в организме лимфоциты возвращаются главным образом в нее, что объясняется экспрессией клетками этой ткани «молекул возврата домой», связывающихся с молекулами адгезии или адрессинами, находящимися на поверхности эндотелиоцитов, а также пейеровых бляшек.
Аппендикс
Первые скопления лимфоидной ткани в аппендиксе (и тонкой кишке) определяются на 3 мес развития. С 4 мес появляются групповые фолликулы, количество и масса которых постепенно нарастает. С 17 нед в нем определяются В- и Т-клетки. В первые дни жизни в фолликулах аппендикса появляются скопления лимфобластов. До 22 лет их масса медленно увеличивается, а в 28 лет - уменьшается, и к 40 годам наступает атрофия фолликулов (у стариков - облитерация отростка).
Печень
Печень закладывается на 4 нед и уже с 5 нед является центром кроветворения, в котором определяется небольшое количество Т-клеток. С 9-10 нед из стволовых клеток, находящихся в островках гемопоэтической ткани, появляются В-клетки. На 12-14 нед их максимум достигает 15%. На 16-18 нед печень прекращает свою кроветворную функцию, передавая ее к функционально активному в это время костному мозге.
ИММУННЫЙ ОТВЕТ
Общая характеристика и гены иммунного ответа
Иммунный ответ организма на действие антигенов - это генетически детерминированный процесс, в котором принимают участие лимфоидные органы и клетки, имеющие сложную систему организации, включающую клеточные рецепторы, иммуноглобулины, медиаторы и другие компоненты.
Иммунный ответ имеет две фазы: ранняя - распознавание антигена специфическими лимфоцитами и их активация, и поздняя (эффекторная) - координация механизмов устранения чужеродных веществ. Каждый из участников иммунного ответа контролируется одним или несколькими генами, а вся иммунная реакция - это
результат работы множества генов (целая генная сеть), ответственных за сохранение генетического и белкового (антигенного) постоянства организма. В настоящее время в основном завершено изучение генов, контролирующих развитие и функционирование иммунитета. Систему иммунитета у человека контролирует генная сеть, включающая 2190 генов, состоящих из 166 миллионов нуклеотидов ДНК или 6% всех генов генотипа.
Основная часть этих генов локализована на хромосоме 6. Из общего числа генов 633 гена находятся в неактивном состоянии, т.е. кодируемые ими белки не экспрессируются (не транскрибируются). Функции оставшихся 1557 генов изучены примерно у половины, в том числе показана роль 130 генов в развитии нарушений иммунитета (см. ниже). Обычно иммунные реакции в организме протекают скрытно и почти незаметно приводят к полному разрушению антигенного агрессора или частичному подавлению его патогенного действия.
Иммунный ответ включает ряд основных событий. Среди них:
• переработка и представление антигена в иммуногенной форме;
• кооперация Т- и В-клеток в распознавании антигена;
• внутриклеточный синтез антител (антигенраспознающих рецепторов);
• переключение синтеза одного класса иммуноглобулинов на другой.
В результате этих событий в ходе иммунного ответа в организме происходит нейтрализация и уничтожение чужеродных антигенов. Первая встреча с антигеном характеризуется ранней продукцией антител IgM-класса, и позднее появляются антитела IgG-класса.
Первый иммунный ответ связан с тремя фазами накопления антител:
• латентная фаза - время между проникновением антигена и появлением в сыворотке первых антител;
• фаза роста - быстрое увеличение концентрации антител до максимальных величин;
• заключительная фаза - снижение концентрации антител (вплоть до полного их исчезновения) с сохранением небольшого числа «клеток памяти».
Продолжительность этих фаз зависит от числа лимфоцитов и стадии их дифференцировки, структурных особенностей, дозы, способа и места проникновения антигена, а также индивидуальных особенностей организма.
При повторной иммунизации антитела, образовавшиеся за счет «клеток памяти» при первой иммунизации, накапливаются быстрее и в значительно большем количестве. Повторный контакт с тем же антигеном приводит к преимущественному накоплению IgG- антител.
Межклеточная кооперация
Для полноценной продукции антител в ходе иммунного ответа необходима межклеточная кооперация по крайне мере двух типов клеток: Т- и В-лимфоцитов, так как одна В-клетка не может реализовать свой потенциал, пока не получит помощь со стороны Т-хелперов.
Выделены три участника процесса антителообразования: В-клетки, Т-клетки и макрофаги. Функция каждого из них в гуморальном иммунном ответе предопределена.
В упрощенной форме межклеточные отношения можно представить следующим образом:
• проникший в организм антиген захватывается макрофагом;
• после внутриклеточной переработки фрагменты антигена выводятся на клеточную поверхность макрофага в иммуногенной форме (доступной для В- и Т-клеток);
• В-клетки с помощью своих антигенраспознающих рецепторов (поверхностных IgM) узнают антиген и тем самым подготавливают себя к продукции антител;
• Т-хелперы (одна из субпопуляций Т-клеток) также распознают этот антиген и становятся способными к оказанию помощи В-клеткам для их полноценного развития и функционирования.
Межклеточная кооперация также необходима для формировании клеточного иммунного ответа на трансплантат. В этом случае в ближайшем к месту трансплантации лимфатическом узле наблюдается взаимодействие предшественника Т-киллеров с Т-хелперами и макрофагами и взаимодействие В-лимфоцита с Т-хелперами и макрофагами.
Реакция трансплантационного иммунитета включает три этапа:
• распознавание антигенов трансплантата;
• созревание и накопление эффекторов реакции трансплантации в ближайшей к трансплантату периферической лимфоидной ткани;
• разрушение трансплантата.
Системы иммунного ответа
Несколько условно иммунный ответ организма на действие чужеродных веществ и контроль за уничтожением собственных (поврежденных) клеток делят между собой на четыре системы: неспецифическая резистентность, врожденный иммунитет, приобретенный иммунитет и иммунологическая толерантность.
Неспецифическая резистентность
Неспецифическая резистентность - это защитные реакции, обусловливающие невосприимчивость организма к инфекциям. Они зависят от целостности и функциональной активности кожи и слизистых оболочек, а также интенсивности клеточного фагоцитоза, но не зависят от специфичности чужеродных агентов.
В этой защите главная роль принадлежит макрофагам: мононуклеарным моноцитам и нейтрофилам (эозинофилам и базофилам). Эти клетки способны переходить из одной формы в другую.
Кроме участия в фагоцитозе, мононуклеарные моноциты выполняют функции клеток, презентирующих (представляющих) антиген для узнавания лимфоцитами.
К клеткам неспецифической резистентности также относятся прелимфоциты (будущие NK-клетки), дифференцировка которых завершается в селезенке.
Врожденный иммунитет
Врожденный иммунитет - филогенетически наиболее древняя защитная система организма, оберегающая его от разных патогенов (вирусы, бактерии, грибы). Эта система особенно важна для раннего развития, когда механизмы адаптивного иммунитета еще не развиты.
Согласно современным представлениям, распознающими рецепторами при врожденном иммунитете являются эволюционно консервативные Toll-подобные (like) рецепторы или TLR, которые не меняют своего функционального назначения в ходе онтогенеза (всегда стабильны), контролируются генами раннего развития и передаются из поколения в поколение через клетки зародышевой линии (см. ниже).
TLR были открыты у млекопитающих в конце 90-х годов XX в. Эти рецепторы экспрессируются моноцитами, макрофагами, NK-клетками, незрелыми дендритными клетками, клетками эпителия и эндотелия. Они инициируют врожденный иммунитет, рас-
познавая паттерны (образцы) молекул патогенов, отсутствующие у человека.
Ранее считалось, что ключевую роль во врожденном иммунитете играет система комплемента, о которой в последние годы говорят все меньше и меньше. Однако старое название по-прежнему актуально.
В систему комплемента входят около 30 белков плазмы крови, из которых 9 - это собственно белки комплемента (С1-С9), а остальные - это его факторы (B, D, P, H и др.).
Некоторые белки комплемента являются проферментами и активизируются только после диссоциации на отдельные фрагменты.
Многие белки комплемента представляют собой «мозаику» из продуктов экзонов, относящихся к генам разных суперсемейств. Например, Os - фермент классического пути - имеет участки аминокислотной последовательности, состоящей из сериновой эстеразы и рецептора для липопротеинов низкой плотности, а также короткий общий повтор, встречающийся в суперсемействе регуляторных белков комплемента. Сходным образом устроены белки С6-С9, относящиеся к лизирующему мембрану комплексу, имеющему общие свойства с перфорином цитотоксических Т-лимфоцитов и катионным белком эозинофилов.
Белки комплемента способны отличать «свое» от «чужого». Эта способность в нормальном организме обеспечивается за счет регуляторных молекул, находящихся на поверхности собственных клеток и подавляющих активацию комплемента.
Активация белков комплемента происходит по классическому и альтернативному пути. В нормальном состоянии поверхностные регуляторные молекулы клеток и тканей организма блокируют действие основного белка - С3, что подавляет активацию других белков комплемента. В случае проникновения в организм чужеродных структур, лишенных регуляторных белков, начинается активация молекулы белка С3а. Например, такая активация происходит при попадании в ткани и кровь (либо образовании в них) разных активаторов (грамположительные и грамотрицательные бактерии, вирусы, микроорганизмы, иммунные комплексы). С началом активации происходит каскадное взаимодействие белков комплемента и образование промежуточных продуктов, повреждающих мембраны чужеродных клетокмишеней. При классической активации происходит связывание чужеродных иммунных комплексов с белком С3, что объединяет
приобретенный иммунитет (образование антител) с врожденным иммунитетом (система комплемента).
В плазме крови постоянно происходит «холостая» активация С3, приводящая к фиксации небольшого числа его молекул на поверхности как «своего», так и «чужого». Активаторами альтернативного пути служат компоненты микроорганизмов. Участниками этого пути являются факторы В, D и др. Основные события происходят после расщепления белка С3. При этом формируется мембрано-атакующий комплекс (МАК), состоящий из белков С5-С9. Кульминацией событий является присоединение молекулы С9 к мембране клеткимишени и последующее изменение конформации адсорбированного на ней макромолекулярного комплекса с образованием воронкообразного отверстия, после чего наступает лизис клетки. В результате работы белков комплемента появляются анафилотоксины (освобождают гистамин из базофилов и тучных клеток), хемотаксины (вызывают миграцию клеток в место работы комплемента) и модуляторы иммунного ответа (С3а подавляет, а С5а усиливает продукцию антител). В случае затяжного инфекционного процесса в организме образуется стабильный иммунный комплекс «агент-антитело», который становится активатором комплемента по классическому пути.
К основным событиям в ходе активации комплемента относятся:
• опсонизация микробов для их поглощения фагоцитами;
• непосредственное уничтожение микробов путем лизиса;
• активация и хемотаксическое привлечение лейкоцитов в очаг воспаления;
• процессинг (расщепление) иммунных комплексов;
• индукция специфических антител.
Для фагоцитирования чужеродной частицы, как правило, требуется ее связывание с белковыми компонентами С3Ь и iC3b. Некоторые вирусы после взаимодействия с антителом могут нейтрализоваться только с помощью компонентов C1 и С4. Для инактивации других вирусов требуется участие компонентов С2 и С3.
Иммунное прилипание, заключающееся в соединении иммунного комплекса с рецептором комплемента 1 (CR1), происходит при активации белков комплемента на этапе от молекулы С4 до молекулы
С3.
Высвобождение гистамина из тучных клеток, сокращение гладких мышечных волокон и усиление сосудистой проницаемости, вызванные активностью анафилотоксина, являются свойствами каждого из
двух фрагментов (С3а и С5а), высвобождающихся при расщеплении конвертазами молекул С3 и С5. Эти фрагменты также являются хемотаксическими факторами для полиморфно-ядерных лейкоцитов. Хемотаксические свойства особенно выражены у фрагмента С5а, вызывающего экзоцитоз нейтрофилов.
Следовательно, основными функциями системы комплемента являются: лизис клеток; растворение иммунных комплексов; участие в фагоцитозе и воспалительной реакции; образование хемотаксинов; модуляция иммунного ответа и нейтрализация веществ.
Приобретенный иммунитет
Приобретенный или адаптивный иммунитет - это система адаптации организма в ответ на действие чужеродных веществ, когда система врожденного иммунитета по тем или иным причинам с ними не справляется. Эта система сформировалась в ходе эволюции в результате перегруппировки генов иммуноглобулинов в костном мозге и упорядочения Т-клеточного иммунитета в тимусе человека.
Известно, что в случаях, когда организм инфицируется микроорганизмами, основная нагрузка падает на В-лимфоциты. Результатом их работы является синтез и накопление специфических антител, которые нейтрализуют эти микроорганизмы и их токсины.
Если же организм столкнулся с вирусной инфекцией, то в работу вступают субпопуляции Т-лимфоцитов и находящиеся на их поверхности антигенраспознающие или Т-клеточные рецепторы (ТКР), а также большая группа (около 100) регуляторных молекул - цитокинов. Иными словами, формируется многообразие распознающих элементов клетки, перекрывающее весь спектр существующих в природе антигенов. Одна из клеточных субпопуляций - Т-киллеры (цитотоксические Т-клетки) - является основным участником антивирусного иммунитета.
Иммунной системой как «свои» определяются эпитопы антигенов собственных клеток и тканей, закодированных в молекуле ДНК, тогда как все другие эпитопы определяются как «чужие». В первом случае комплексы «антиген-антитело» не образуются, так как этому препятствуют механизмы иммунологической толерантности.
Вместе с тем, иммунная система может неадекватно отреагировать на аутоантигены, т.е. образовать с ними такие комплексы, которые приведут к тяжелым последствиям для организма.
Иммунологическая толерантность
В ходе иммунного ответа в организме производится огромное число антигенспецифичных антител (рецепторов), находящихся на поверхности клеток. При этом некоторые рецепторы могут вступать во взаимодействие с антигенами, находящимися на собственных клетках организма, и именно тогда наблюдается иммунологическая толерантность (невосприимчивость), предотвращающая нежелательное действие антител против собственных клеток и тканей. Указанная система иммунного ответа включает тимическую (центральную) и посттимическую невосприимчивость к аутоантигенам. В первом случае ее обеспечивают Т-клетки тимуса, обладающие низкой аффинностью (сродством) с аутоантигенами. Из них формируются Т-лимфоциты, которые не образуют с ними иммунных комплексов. Во втором случае выделяют три механизма:
• Циркулирующие в крови аутореактивные Т-клетки не замечают аутоантигены, локализованные в тканях, не связанных с их циркуляцией.
• Аутореактивные Т-клетки становятся анергичными за счет снижения экспрессии рецепторов, т.е. утрачивают способность взаимодействовать с аутоантигенами.
• Иммунное отклонение. Известны две популяции Т-лимфоцитов, продуцирующих разные цитокины. Одна из них поддерживает Тх2, другая подавляет Тх2 при воспалительной реакции и реакции гиперчувствительности замедленного типа, либо обе популяции препятствуют дифференцировке Тх0 в Тх2. Такое иммунное отклонение искусственно вызывается для предотвращения отторжения трансплантата, а также для лечения ряда аллергических и аутоиммунных болезней.
Главный комплекс гистосовместимости
Открытие закономерностей реакции отторжения клеток трансплантата от клеток организма хозяина было связано с открытием комплекса локализованных на лимфоцитах антигенов, получивших название HLA-системы (human leukocyte antigen - человеческий антиген лейкоцитов). В дальнейшем совокупность генов, контролирующих широкий спектр их активности, получила название генов главного комплекса гистосовместимости (ГКГ) или Major Histocambility Complex (MHC). Известны 220 тесно сцепленных между собой генов ГКГ, локализованных на коротком плече хромосомы 6, где они зани-
мают 3500 кб. Все гены разделены на три класса, и их продуктами являются антигены также трех классов.
Название генов и антигенов состоят из букв (обозначают гены) и цифр (обозначают аллели этих генов), например A3, В45, DR15, DQ4. Цифры присваиваются по мере открытия новых аллелей.
Гены и антигены ГКГ обладают выраженным генетическим полиморфизмом. В первых публикациях по иммунологии совокупность генов и антигенов ГКГ ошибочно обозначалась как генотип и фенотип, хотя эти понятия классической генетики относятся исключительно к организму индивида, и такое их использование неверно. Поэтому лучше говорить о количестве генов (генных локусов), локализованных на коротком плече хромосомы 6, и количестве молекул антигенов, экспрессируемых этими генами на поверхности клеточных мембран.
Распределение, структура и особенности генов и антигенов главного комплекса гистосовместимости
На рис. 54 приведено распределение генов и антигенов ГКГ. На коротком плече хромосомы 6 локализованы три класса генов (локусов) ГКГ.
• Локусы I класса (А, В и С). Они кодируют трансплантационные белки-гетеродимеры, состоящие из двух типов молекул: а) моле-
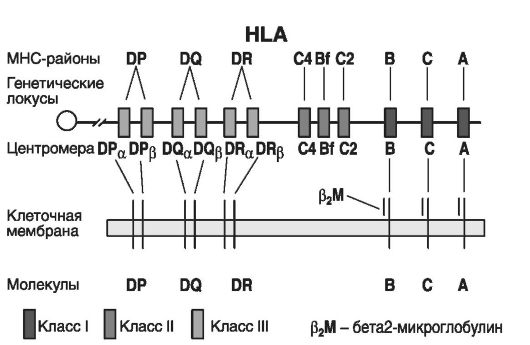
Рис. 54. Гены, их локусы и антигены ГКГ
кула легкой Р2-цепи микроглобулина (12 кДа), являющаяся продуктом гена, локализованного на хромосоме 15; б) молекула тяжелой α-цепи (44 кДа), являющаяся продуктом гена, локализованного на хромосоме 6. При этом антигены I класса (HLA-A, HLA-B и HLA-C) кодируются тремя отдельными парами генов, экспрессируются и выводятся на наружную поверхность клеточных мембран почти во всех клетках и тканях организма, кроме клеток нейроглии ворсинчатого трофобласта. Продукт четвертого D-локуса этого класса - антиген HLA-D (на рис. 54 он не обозначен) экспрессируется только в ворсинчатом трофобласте. Чаще всего антигены этого класса определяются на лимфоидных клетках, в меньшей степени - на клетках печени, легких, почек и редко встречаются на клетках мозга и мышц.
• Локусы II класса (DP, DQ и DR) или D-область, кодирующая α- и β-цепи молекул антигенов DP, DQ и DR. Молекулы этих антигенов также являются трансплантационными гетеродимерными белками, состоящими из легкой β-цепи (26 кДа) и тяжелой α-цепи (33 кДа). Эти белки экспрессируются на поверхности клеточных мембран. Распределение антигенов II класса более ограничено по сравнению с таковым антигенов I класса. Они ассоциированы с В-клетками и антигенпрезентирующими клетками (клетки Купфера), дендритными клетками, клетками альвеолярного эпителия, а также макрофагами. Например, их можно обнаружить при активации гамма-интерфероном эпителия капилляров. Некоторые различия между антигенами II класса объясняются тем, что альфа-цепь DQ-локуса инвариантна, и ее аллельное разнообразие обусловлено бета-цепью (бета1-доменом). В то же время в антигенах, кодируемых DP- и DQ-локусами, обнаружены аллельные формы легкой и тяжелой цепей, но и их основой является бета1-домен. Кроме того, у антигенов этого класса антигенсвязывающий центр формируется альфа1- и бета1-доменами, в то время как роль мембранных доменов сводится к усилению связывания антителопродуцирующих клеток.
• Локусы III класса (С4, Bf и С2). Все локусы этого класса находятся между локусами I и II классов. Они контролируют синтез белков комплемента 2, 4a и 4Ь и производство цитокинов: TNFa и ΤNFβ.
Структура антигенов I и II классов хорошо изучена. Например, определена аминокислотная последовательность десятков вариантов
этих молекул и пространственная конфигурация некоторых из них (HLA-A2). Оба этих класса антигенов относятся к суперсемейству иммуноглобулинов.
В отличие от основных классов иммуноглобулинов, где разнообразие молекул достигается за счет мультигенной системы, разнообразие антигенов этого суперсемейства обеспечивается полиморфной системой, базирующейся на множественности аллелей.
По состоянию на апрель 2002 г. в базе данных нуклеотидных последовательностей ДНК содержалась информация о 1528 аллелях ГКГ, в том числе:
• первый класс - 245 алллелей HLA-A, 480 алллелей HLA-B, 117 аллелей HLA-C, 6 аллелей HLA-E, 1 аллель HLA-F и 15 аллелей HLA-G;
• второй класс - 3 аллеля HLA-DRA, 380 аллелей HLA-DRB, 22 аллеля HLA-в DQA1, 52 аллеля HLA-DQB1, 20 аллелей HLA- DPA1, 97 аллелей HLA-DPB1, 4 аллеля HLA-DMB, 8 аллелей HLA-DOA и 8 аллелей HLA-DOB. Их типирование не завершено, и ежегодно открываются новые аллели.
Наследование генов ГКГ соответствует моногенному варианту, и гены наследуются кодоминантно двумя блоками - по одному от каждого родителя. Такой блок называется гаплотипом и обозначает совокупность аллелей одних и тех же генов (см. главу 3). От каждого родителя гаплотип передается потомку практически без рекомбинаций - их частота не превышает 1% (в материнской хромосоме 6 она несколько выше, чем в отцовской).
Таким образом, каждая клетка человека имеет 8 антигенов или 4 пары (A, B, C и D), и потомок двух родителей в 25% случаев имеет полное совпадение с родителями по 2 из 8 антигенов (сходство двух гаплотипов), в 50% случаев - сходство с родителями по одному гаплотипу (4 из 8 антигенов) и в 25% случаев - полное несоответствие гаплотипов.
Функции главного комплекса гистосовместимости и дифференцировка Т-лимфоцитов
ГКГ занимает центральное место в дифференцировке и окончательном созревании Т-лимфоцитов. Перед дифференцировкой пре-Тлимфоциты мигрируют из костного мозга в тимус, где на поверхности лимфоцитов начинается экспрессия двух маркеров (CD4 - маркер Т-хелперов и CD8 - маркер Т-киллеров). Однако у них еще нет антигенраспознающих Т-клеточных рецепторов (ТкР). Экспрессия
ТкР начинается с момента обучения Т-клеток, в ходе которого из множества попавших в тимус клеток дальнейшее развитие получают только те, чьи рецепторы способны взаимодействовать с антигенами ГКГ, обильно представленными в строме железы.
Селекция клонов Т-клеток - это основное событие в тимусе, связанное с отбором клеток по способности распознавать собственные антигены, что является определяющим условием дифференцировки. Все остальные клетки, не прошедшие контроль на специфичность, гибнут.
В тех случаях, когда распознаются антигены класса I, лимфоциты «выбирают» путь развития в сторону Т-киллеров (маркер CD8). Если распознавание связано с антигенами ГКГ класса II, то формируются Т-хелперы (маркер CD4). Причем узнавание «своего» осуществляется не всем антигенраспознающим центром ТкР, а лишь его частью. Оставшаяся часть центра будет взаимодействовать с возможными в будущем антигенами, и только тогда принцип двойного распознавания «своего» или «чужого» найдет реальное проявление.
Таким образом, антигены ГКГ выступают как факторы селекции Т-клеток (определяют становление клонов, способных к узнаванию аутоантигенов) и как факторы дифференцировки (формируют субпопуляции клеток).
Показано, что антигены ГКГ вовлечены в дифференцировку эмбриональных клеток, а возможно, и клеток плаценты.
Антигены класса I входят в состав гормональных рецепторов. Например, связывание инсулина заметно снижается, если с поверхности клетки удалить эти антигены (но не антигены класса II).
Описаны ассоциации антигенов с рецепторами глюкагона, эпидермального фактора роста и гамма-эндорфина. Кроме того, антигены ГКГ участвуют в опосредованных гормонами неиммунологических реакциях, например в регуляции массы тела.
Иммуноглобулины
Все известные антитела представляют собой иммуноглобулины. У человека выделено 5 основных классов иммуноглобулинов: IgA, IgG, IgD, IgE и IgM. Каждый из этих классов обладает своими биологическими свойствами, однако все они построены по общему плану.
Из всех классов иммуноглобулинов наиболее сложно организован IgM. Так, если IgG представляет собой одну субъединицу, то IgM - это уже 5 субъединиц.
Общее число иммуноглобулинов очень велико. Эта вариабельность обусловлена значительным набором V-генов (не менее 500 для V-области тяжелой цепи и не менее 100 для V-области легкой цепи) и только одним геном (или весьма ограниченным их числом) для константной области (С). Благодаря этому в процессе созревания В-лимфоцита рекомбинация генетического материала происходит так, что один из сотен V-генов образует единый информационный комплекс с С-геном в виде уникальной молекулы мРНК, что объясняет специфичность конкретных антител.
Хромосомная локализация генов иммуноглобулинов
Хромосомная локализация генов иммуноглобулинов ддна в табл. 9.
Таблица 9. Хромосомная локализация генов иммуноглобулинов
Иммуноглобулины | Хромосомы |
IgH (тяжелые цепи) | 14, 15, 16 |
λ-цепь (лёгкие цепи) | 22 |
к-цепь(лёгкие цепи) | 2 |
α-цепь ТкР | 14 |
β-цепь ТкР | 7 |
γ-цепь ТкР | 7 |
δ-цепь ТкР | 14 |
β2-микроглобулин | 15 |
Антигенраспознающие рецепторы
В настоящее время определены антигенраспознающие рецепторы В- и Т-лимфоцитов и причины их разнообразия. Множественность генов V-областей (Н- и L-цепи иммуноглобулинов) - одна из таких причин. Еще четыре причины - множественный аллелизм генов, а именно:
• соматический мутагенез (создает разные V-гены);
• соматическая рекомбинация между сегментами одного V-гена (создают разные белки);
• генная конверсия (ведет к копированию отдельных частей гена);
• вставки добавочных нуклеотидов (кодируют остатки V-областей).
Секретируемые В-клетками иммуноглобулины представляют собой бифункциональные молекулы. Их V-домены предназначены для связывания с антигеном, тогда как С-домен взаимодействует с
рецепторами на клетках организма-хозяина или с факторами комплемента.
Что касается общей регуляции уровня антител в организме, то степень катаболизма иммуноглобулинов находится в прямой зависимости от их тотальной концентрации, тогда как синтез антител в основном регулируется с помощью антигенной стимуляции. Например, у животных, содержащихся в стерильных условиях, уровень IgG чрезвычайно низок, но он быстро повышается после возвращения животного в нормальные условия.
Распознавание антигенов В-клетками осуществляется за счет молекул мембраносвязанных иммуноглобулинов (mIg). При этом на поверхности каждого лимфоцита экспрессируются 10-100 тысяч молекул антител. Основными классами mIg, находящихся на поверхности зрелых и нестимулированных В-лимфоцитов, являются молекулы IgM и IgD. На одной В-клетке могут одновременно присутствовать обе эти молекулы. У них одинаковая специфичность, и они могут взаимодействовать между собой, осуществляя кооперативный контроль за активацией и супрессией лимфоцитов.
В ходе иммунного ответа одновременно экспрессируются другие классы иммуноглобулинов. Если рецептором В-клетки, узнающим антиген, является IgM, то мембраносвязанный IgM представляет собой, как правило, мономерный иммуноглобулин. Эта молекула имеет гидрофобную часть, расположенную на C-конце тяжелой цепи и предназначенную для фиксации молекулы на мембране. При этом mIgM кодируются тем же набором генов, что и их сывороточные аналоги.
Единственным структурным отличием является дополнительный фрагмент на С-конце, играющий роль мембранного якоря.
Цитоплазматический участок у mIg невелик и не пригоден для взаимодействия с С-белками или тирозинкиназами. Роль CD3 в случае mIgM, по-видимому, играет ассоциированный с mIgM гетеродимер, состоящий из двух соединенных дисульфидной связью (-S-S-) гликопротеинов с молекулярной массой 32-34 кДа (Ig-альфа) и 37-39 кДа (Ig-β и Ig-γ). Цепи β и γ являются продуктами одного гена и образуются в результате альтернативного сплайсинга. Обе цепи относятся к представителям указанного выше суперсемейства иммуноглобулинов и содержат во внеклеточной части по одному домену. Участки этих полипептидов имеют консервативную последовательность, включающую 6 аминокислот. Распознавание анти-
гена Т-клетками усложнено вступлением в этот процесс антигенов ГКГ.
Захваченный фагоцитирующей Т-клеткой антиген после внутриклеточной переработки экспрессируется на клеточной поверхности в комплексе с антигенами ГКГ. Если данный комплекс включает антигены класса I, то он распознается Т-киллерами, если в комплекс входят антигены класса II, то в реакцию вступают Т-хелперы.
Toll-подобные рецепторы
Toll-подобные рецепторы или TLR относятся к филогенетически наиболее древним сигнальным рецепторам клетки. Это трансмембранные белки, содержащие в своей внеклеточной части фрагменты, состоящие из множества остатков лейцина, формирующих бета-цепи и альфа-спирали, которые непосредственно взаимодействуют с паттернами патогенов (см. выше).
У человека идентифицировано 11 типов TLR. Их экспрессия клетками иммунной системы приведена в табл. 10.
Следует отметить, что TLR 1, 2, 4-6, 10 и 11 экспрессируются в ответ на компоненты бактериальных стенок патогенов. В свою очередь, TLR3, 7-9 специфичны к нуклеиновым кислотам бактериального и вирусного происхождения, в том числе TLR3 узнает двухцепочечную РНК, TLR8 и TLR9 активируются одноцепочечными РНК, богатыми гуанином и урацилом либо РНК, содержащими poly-U мотивы; TLR7 взаимодействует с одноцепочечной РНК вируса гриппа и ВИЧ, повышает синтез альфа-интерферона и противовоспалительных цитокинов; TLR9 взаимодействует с неметилированными СрG- повторами ДНК вирусов и бактерий.
Таблица 10. Экспрессия Toll-подобных рецепторов клетками иммунной системы (по 1ашепш S., Beyaert R., 2003)

 Примечание. ДК
- дендритные клетки, МФ - макрофаги, NК - естественные киллеры, Мо -
моноциты, НФ - нейтрофилы, ИЛ-6 - интерлейкин, ФГА - фитогемагглютинин,
ЛПС - липополисахарид, ПЯЛ - полиморфноядерные лимфоциты.
Примечание. ДК
- дендритные клетки, МФ - макрофаги, NК - естественные киллеры, Мо -
моноциты, НФ - нейтрофилы, ИЛ-6 - интерлейкин, ФГА - фитогемагглютинин,
ЛПС - липополисахарид, ПЯЛ - полиморфноядерные лимфоциты.
Основные реакции и связанные с ними нарушения иммунного ответа
Нарушения иммунитета в ответ на действие антигенов называются иммунопатологией, которая проявляется в двух основных формах: гиперчувствительность (воспаление или аутоиммунная реакция) и иммунодефицитное состояние.
В первом случае говорят о патологических реакциях гиперчувствительности и аутоимммунных болезнях (когда собственные клетки организма приобретают антигенные свойства и к ним вырабатываются антитела).
Во втором случае говорят о патологических состояниях, при которых (несмотря на поступление антигенного материала) иммунные реакции не развертываются в результате несостоятельности иммунитета, которая может быть наследственной или приобретенной.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ НА АНТИГЕН
Системы иммунитета организма характеризуются реакциями гиперчувствительности четырех типов: I тип (немедленный), II и III типы, IV тип (замедленный). Первые три типа реакций имеют гуморальный характер (обеспечиваются антителами), и первое поступление антигена приводит к каскадной активации систем иммунитета. Последний IV тип имеет клеточный характер.
Реакции немедленного I типа
Реакции немедленного I типа сопровождают процесс воспаления и обычно протекают без грубых структурных и функциональных нарушений (носят транзиторный характер). Первое поступление антигена активирует иммунитет, приводит к синтезу IgE. Затем эти антитела (реагины) фиксируются на поверхности клеточной мембраны базофилов ткани (и крови), так как они имеют высокое сродство (аффинность) к Fc-рецепторам тучных клеток. Этот синтез длится 1 нед и дольше.
При повторном попадании того же антигена он снова взаимодействует с IgE, что вызывает дегрануляцию цитоплазмы базофилов ткани и крови, в ходе которой из нее выходят медиаторы (гистамин и ферменты), участвующие в синтезе брадикинина и лейкотриенов, которые вызывают вазодилатацию, увеличивают сосудистую проницаемость и сокращают гладкую мускулатуру. При этом базофилы выделяют хемотаксические факторы для привлечения нейтрофилов и эозинофилов и активируют свертывание крови и систему комплемента, что ведет к дополнительной дегрануляции.
Реакции II типа
Реакции II типа характеризуются выработкой и взаимодействием антител с антигенами на поверхности клеток-мишеней, что приводит к их разрушению. При этом антиген может быть внешним (например, лекарство, которое при соединении с белком клеточной мембраны стимулирует иммунный ответ) либо собственным, который ошибочно распознается как чужеродный антиген (по неизвестным причинам) и обусловливает цитотоксический эффект Т-клеток или опосредованный белками и факторами комплемента лизис клетокмишеней. Во втором случае это является причиной аутоиммунного заболевания.
Реакции этого типа происходят в организме при контактах с антигенами групп крови, клетками и тканями при трансплантации и во время беременности. В ходе этих реакций образующиеся антитела могут повреждать клетки и ткани в результате активации комплемента, а также путем связывания и активации эффекторных клеток, несущих рецепторы Fc-гамма (как и в случае реакций I типа). Например, такие антитела против собственных нейтрофилов и лимфоцитов производятся при тромбоцитопении и системной красной волчанке, против тромбоцитов - при тромбоцитопенической пурпуре.
Материнские антитела к антигенам крови плода, проходя через плаценту, разрушают эритроциты, вызывая гемолитическую болезнь новорожденных. Среди гемолитических анемий выделены типа типа, вызванные тепловыми и холодовыми аутоантителами (соответственно t 37 °С и ниже), а также антителами, образующимися в ответ на введение лекарственных препаратов.
При беременности в реакциях этого типа часто участвует антиген резус D (RhD). Если при резус-конфликте (мать имеет Rh+, у ребенка Rh-) во время первой беременности ребенок, как правило, здоров, то при повторных беременностях риск гемолитической болезни резко возрастает. Повреждения тканей могут быть вызваны аутоантителами к базальным мембранам при нефрите или синдроме Гудпасчера, к молекулам межклеточной адгезии при пузырчатке, к рецепторам ацетилхолина на мембранах мышц при миастении.
Реакции III типа
При реакциях III типа в тканях происходит накопление иммунных комплексов, что ведет к активации белков и факторов комплемента, сопровождается повреждением тканей и развитием острого воспаления, т.е. обусловливает развитие иммунокомплексного заболевания. Болезни иммунных комплексов развиваются при затяжном инфицировании или аутоиммунных заболеваниях. Они имеют системный характер, если вызываются циркулирующими в крови антителами (например, сывороточная болезнь), или локальный характер, когда иммунный комплекс формируется в месте поступления антигена (например, феномен Артюса). При этом система комплемента способствует разрыву связей между антигеном и антителом, что поддерживает нахождение комплекса в растворенном состоянии. Если при недостаточности комплемента образуются слабые связи (слабые
комплексы), то комплексы откладываются в тканях, особенно в почечных клубочках. При сывороточной болезни они откладываются в стенках сосудов, нарушают их проницаемость, вызывают воспаление, артроз или гломерулонефрит.
Болезни иммунных комплексов связаны с:
• персистенцией инфекции (сочетание хронической инфекции со слабым гуморальным ответом); примеры: проказа, малярия, геморрагическая лихорадка денге, вирусный гепатит, стафилококковый эндокардит;
• аутоиммунными заболеваниями, в ходе которых поражается («устает») система, ответственная за удаление комплексов (мононуклеарные фагоциты, эритроциты и комплемент), и в результате они начинают откладываться в тканях; примеры: ревматоидный артрит, системная красная волчанка и полимиозит;
• вдыханием антигенного материала, включающего компоненты актиномицетов, антигенов растительного (заплесневевшее сено), животного и другого происхождения.
В результате развиваются воспаление, аллергический альвеолит и фиброз - эти реакции могут протекать совместно с реакциями немедленного типа, обусловливая такую патологию, как «легкое фермера» или «легкое голубевода».
Безусловно, что сюда же следует отнести другие классы профессиональных заболеваний, например силикоз.
Реакции замедленного IV типа
У реакций этого типа клеточный характер. В данном случае при первом поступлении антигена происходит накопление сенсибилизированных Т-клеток, тогда как повторное поступление антигена приводит к образованию цитотоксических Т-клеток (рис. 55). Эти клетки способствуют выработке Т-хелперными клетками белков CD4 (кластер дифференциации). Эти белки обусловливают лизис чужеродных клеток (например, путем перфорации мембраны при освобождении белка-перфорина) либо вызывают их апоптоз. Прямая цитотоксичность T-клеток играет важную роль в иммунном ответе на действие клеток, несущих чужеродные антигены или инфицированных вирусом, опухолевых или пересаженных клеток. Эти реакции вызываются сенсибилизированными антигенами T-клеток, которые могут проявить свой цитотоксический эффект непосредственно или через секрецию цитокинов, приводящих к
воспалению, активации и привлечению макрофагов, что дополнительно усиливает воспаление.
В реакциях замедленного типа участвуют не антитела, а сами клетки. Механизм непосредственного действия наблюдается при ряде аутоиммунных болезней, контактном дерматите, в ходе иммунного ответа на влияние опухолевых клеток, клеток, инфицированных вирусом, пересаженных клеток, а также клеток, несущих чужеродные антигены. Обычно эти реакции возникают через 24-72 ч после введения антигена сенсибилизированному человеку, что отличает их от реакций немедленного типа, которые развиваются в пределах нескольких минут. При первом поступлении антигена происходит первичное накопление сенсибилизированных Т-лимфоцитов. Повторное введение антигена приводит к возникновению вторичного иммунного ответа с образованием Т-киллеров, обусловливающих последующее гранулематозное воспаление и казеозный некроз.
Выделяют три типа реакции гиперчувствительности замедленного типа.
• Контактная реакция, когда нанесенный на кожу гаптен поглощается клетками Лангерганса, которые презентируют его антигенспе-
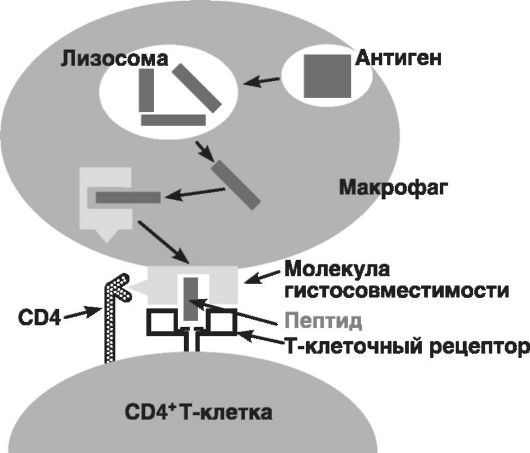 Рис. 55. Инициация иммунного ответа цитотоксической Т-клеткой (по Ройту А. и соавт., 2000)
Рис. 55. Инициация иммунного ответа цитотоксической Т-клеткой (по Ройту А. и соавт., 2000)
цифичным Т-клеткам и вместе с кератиноцитами и макрофагами участвуют в этой реакции.
• Туберкулиновая реакция - диагностическая проба на присутствие в организме разных инфекционных агентов.
• Гранулематозная реакция. В этом случае возникает опосредованный Т-клетками баланс между иммунитетом к нерастворимому антигену и повреждением ткани. Гранулематозная реакция - это персистенция антигена, приводящая к дифференцировке макрофагов в эпителиальные клетки и их слиянию в гигантские клетки. Формирование гранулем также зависит от ФНО. Примером реакции служит туберкулоидная форма проказы (лепра). Имеется множество примеров заболеваний человека, связанных с реакциями гиперчувствительности замедленного типа. Их причины: возбудители широко распространенных инфекций, лепры, туберкулеза и шистосомоза (черви), микобактерии, простейшие.
Вместе с тем, до сих пор не установлены причины таких заболеваний, как саркоидоз и болезнь Крона, при которых также наблюдаются реакции замедленного типа. Полагают, что в случае саркоидоза это результат накопления в тканях активированных макрофагов с последующим гранулематозом и фиброзом лимфоидной ткани и лимфоузлов, а в случае болезни Крона - это хроническое воспаление подвздошной и толстой кишок вследствие скопления в них макрофагов и лимфоцитов, что обусловливает сужение просвета кишечника и образование свищей в прилегающих тканях и органах.
Аллергические и атопические заболевания
Понятия аллергические и атопические заболевания часто путают. В патогенезе аллергических заболеваний играют роль реакции гиперчувствительности немедленного типа, тогда как в основе атопических заболеваний лежат реакции замедленного типа.
Аллерген - это антиген или участник иммунной реакции. Действие аллергенов внешней среды может проявиться покраснением кожи и даже появлением на ней волдырей.
Атопия - это реакция (заболевание) с участием аллергенов внешней среды. Следует отметить, что контакт с антигеном (аллергеном) приводит к образованию IgE у всех людей, тогда как атопическое заболевание возникает лишь у немногих.
В разных странах атопическими заболеваниями страдают 10-20% населения. К атопическим заболеваниям относятся: бронхиальная
астма, астматические бронхиты, сенная лихорадка, крапивница, непереносимость некоторых продуктов питания (в том числе пищевые аллергии). Как правило, эти заболевания проявляются как семейные формы.
В патогенезе атопических заболеваний важную роль играет наследственная предрасположенность, в частности наследование генов ГКГ. При этом возможно, что экспрессия генов предрасположенности (включая гены ГКГ) сочетается с повышенной способностью В-клеток секретировать IgE при контакте с аллергенами.
Кроме того, тяжесть атопического заболевания зависит от дозы, пути введения и продолжительности контакта с аллергеном, характера питания, хронического инфицирования, вирусных инфекций, применения лекарственных средств и наличия сопутствующих заболеваний. Вместе с тем, идентификация признаков аллергии у родителей ребенка с атопическим заболеванием является фактором риска развития у потомства этого заболевания. В частности, если аллергией страдают оба родителя, то риск для ребенка равен 50%, если один из родителей, то 30%.
КЛАССИФИКАЦИЯ НАРУШЕНИЙ ИММУННОЙ СИСТЕМЫ
Нарушения иммунной системы проявляются у человека в виде разных классов заболеваний, включающих бактериальные и вирусные инфекции, аллергические (атопические), аутоиммунные, первичные и вторичные иммунодефицитные заболевания, а также иммунопролиферативные болезни (всего 6 классов). По диагностическим признакам, связанным с нарушениями иммунного ответа, среди них выделяют следующие.
• Инфекционные болезни. Для них характерны: длительный субфебрилитет, лихорадка неясной этиологии, хронические инфекции ЛОР-органов, лимфадениты, бронхиты, пневмонии, ОРВИ (4-6 раз в течение года), герпес, паразитарные инфекции, бактериальные и грибковые заболевания кожи и подкожной клетчатки (абсцессы, вульвиты, парапроктиты, пиодермия, флегмоны, фурункулез), ногтей и слизистых оболочек (гнойные конъюнктивиты, кариес, пиелонефриты, уретриты, циститы, эндометриты).
• Аллергические (атопические) болезни. Среди них: атопический и контактный дерматит, крапивница, отек Квинке, феномен Артюса, экзема, аллергия ЛОР-органов, астматический бронхит, бронхиальная астма, гиперчувствительные пневмониты, непереносимость пищевых продуктов, лекарств, химических соединений.
• Аутоиммунные болезни и аутоиммунные формы заболеваний. Сюда относятся: воспалительные заболевания опорнодвигательного аппарата, болезнь Аддисона, болезни печени, гипертиреоз и другие болезни щитовидной железы, громерулонефриты, дерматомиозит, ревматоидный артрит, синдромы Шегрена, Фелти), системная красная волчанка, системные васкулиты (васкулит Вегенера, узелковый периартериит и др.), склеродермия, неврологические заболевания (рассеянный склероз, миастения гравис), инсулинзависимый сахарный диабет, неспецифический язвенный колит, цитопенические болезни крови. К этому классу болезней следует также отнести аутоиммунные формы бесплодия, патологию беременности, психопатологию (например, шизофрения и др.).
• Первичные иммунодефициты детского возраста. Среди них: синдромы Вискотта-Олдрича, Ди-Джорджи и Луи-Бар, наследственные ангионевротические отеки и др.
• Вторичные иммунодефициты, включая алопецию, все проявления хронических инфекционных заболеваний с генерализацией и торпидным к терапии течением, де- и гиперпигментацию кожи, СПИД и случаи приобретенной иммунной недостаточности.
• Лимфопролиферативные заболевания: гиперплазия лимфоузлов, сочетающаяся с воспалением и очагами бактериальной инфекции (вне лимфоузлов), опухоли иммунной системы (болезнь Ходжкина, лимфолейкозы, лимфомы, лимфосаркомы, саркома Капоши), последствия спленомегалии и инфекционного мононуклеоза, Х-сцепленный лимфопролиферативный синдром у детей .
ЗАКЛЮЧЕНИЕ
Иммунная система функционирует в тесном взаимодействии с нервной и эндокринной системами организма, в пользу чего получено много доказательств.
На клетках иммунной системы выделены рецепторы к гормонам (кортикостероиды, инсулин, СТГ, тестостерон) и другим биологически активным веществам - ацетилхолину, бета-адренергическим медиаторам, эндорфинам, энкефалинам, эстрадиолу.
Одни гормоны (глюкокортикоиды, андрогены, эстрогены и прогестерон) подавляют иммунные реакции, тогда как другие (инсулин, тироксин и СТГ) наоборот их стимулируют.
Функции медиаторов ЦНС выполняют интерлейкины, например ИЛ-2, продуцируемый клетками нервной ткани, влияет на пролиферацию олигодендроглии.
Иммунитет в целом контролируется гипоталамо-гипофизарноадреналовой системой. В частности, нейроэмоциональный стресс оказывает значительное влияние на активность иммунитета у спортсменов-профессионалов, индуцируя у них транзиторный иммунодефицит. В последние годы в основном завершено исследование генов системы иммунитета, генная сеть которого включает около 2200 генов, или 6% генов генотипа. Из общего числа этих генов 633 гена (около 30%) находятся в неактивном состоянии, т.е. кодируемые ими белки не экспрессируются. Изучены функции примерно половины оставшихся 1557 генов, в том числе показано участие 130 генов в развитии нарушений иммунитета.
Подтверждением общности молекулярно-генетических причин и механизмов иммунного ответа с одной стороны и реакции отторжения клеток трансплантата от клеток организма хозяина с другой стороны стало открытие генов HLA-системы, включающей 220 генов, тесно сцепленных между собой и локализованных на хромосоме 6.
В базе данных нуклеотидных последовательностей ДНК содержится информация о более 1,5 тыс. аллелей генов этого комплекса, наследуемых по моногенному варианту.
Определена хромосомная локализация генов, кодирующих различные иммуноглобулины и антигенсвязывающие рецепторы, и изучены генетические причины их разнообразия.
Связи иммунной системы с другими регуляторными и защитными системами организма можно обнаружить в общности симптоматики при целом ряде бактериальных, вирусных, аллергических, атопических, аутоиммунных, иммунодефицитных и иммунопролиферативных болезней.
Активация локальных иммунных реакций при внутриутробном инфицировании зародыша и хроническом эндометриозе у матери
обусловливает нарушение имплантации зародыша в стенку матки и последующее нарушение инвазии и развития хориона, что ведет к прерыванию беременности. Поэтому подходы к лечению указанных заболеваний должны быть системными, учитывающими неврологические, эндокринологические и иммунологические особенности проявляющейся у больных симптоматики, а современная профилактика таких нарушений должна строиться на основе требований по медико-генетическому консультированию больных и их родственников (см. главу 30).