Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 6 КЛЕТКА КАК СТРУКТУРНАЯ И ФУНКЦИО- НАЛЬНАЯ ЕДИНИЦА ОРГАНИЗМА
Все эукариоты состоят из клеток, межклеточных соединений, тканей, органов и систем.
Клетка - это структурная и функциональная единица живой материи, и именно из ее структурных компонентов и связывающих их между собой органических и неорганических соединений и материалов построено «здание» как самой клетки, так и всего многоклеточного организма.
Организационная структура клетки и ее органеллы
Клетка окружена плазматической мембраной, которая отделяет внутреннюю среду от внешней среды, удерживает вместе все внутриклеточные компоненты и обеспечивает поступление внутрь или выведение наружу различных химических соединений.
На рис. 25 приведена схема организационной структуры клетки и ее органеллы.
В клетке выделяют ядро, цитоплазму и цитоскелет.
Ядро, или центральная часть клетки, окружено двойной мембраной. Оно представляет собой своеобразный «штаб» или пульт управления. В нем находится основная часть молекулы ДНК, и про-
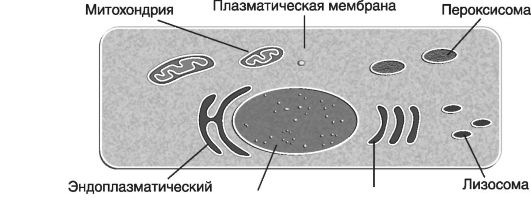
Рис. 25. Схематичное изображение клетки и ее органелл (по В. Эллиот, Эллиот Д., 2002)
исходят синтез (репликация) ядерной ДНК, образование мРНК, ее процессинг и сплайсинг.
Цитоплазма содержит другие части клетки, необходимые для ее жизнеобеспечения. Синтезируемые в цитоплазме специфические молекулы поступают в клеточное ядро через специальные поры (белки-каналы). Для этого используются короткие аминокислотные фрагменты или сигнальные последовательности, которых, например, нет у небольших ядерных белков-гистонов. В случае доставки в ядро факторов транскрипции такие фрагменты могут находиться внутри полипептидных цепочек.
Цитоскелет или каркас клетки, - это внутриклеточные перегородки из белковых волокон, пронизывающих всю цитоплазму и во многих точках связанных с внутриклеточными мембранами, отграничивающими друг от друга отдельные органеллы клетки.
Каркасные белки (белки цитоскелета) не способны к латеральной диффузии, свойственной белкам наружной мембраны, отграничивающей клетку от окружающей внешней среды.
Подробно рассмотрим органеллы цитоплазмы клетки, которые изолированы друг от друга собственными мембранами. Среди этих органелл выделяются следующие.
Эндоплазматический ретикулум (ЭР) или эндоплазматическая мембранная система.
ЭР - это основная структура цитоплазмы, занимающая половину объема клетки и представленная сетью мембранных трубочек и цистерн - так называемый гладкий ретикулум.
Здесь происходит синтез всех мембранных и секреторных белков и других веществ, которые доставляются в аппарат Гольджи либо подготавливаются к выведению из клетки. При этом структурные и регуляторные белки синтезируются в рибосомах, также расположенных в ЭР, но это уже так называемый шероховатый ретикулум (ШР).
Синтезируемые в рибосомах регуляторные белки-ферменты (и ферментные системы) концентрируются в других органеллах цитоплазмы: лизосомах, пероксисомах.
Аппарат Гольджи (АГ) - это стопки уплощенных цистерн, в которых накапливаются синтезируемые в ЭР соединения, заключенные в отпочковывающиеся (окруженные мембранами) пузырьки разного калибра, попадающие либо в лизосомы, либо в пероксисомы. Причем некоторые пузырьки возвращаются обратно в ШР, например фермент протеиндисульфатизомераза, участвующий в гликозилирова-
нии (см. ниже). Таким образом, АГ в определенном смысле служит сортировочным центром по рассылке внутриклеточной «молекулярной почты».
При этом рассылаемые из АГ разные ферменты обладают способностью «узнавать» в цитоплазме именно свои специфические структуры, например, лизосомные ферменты узнают лизосомы и фосфорилирируют маннозу в их олигосахаридной части.
Лизосомы - это крупные пузырьки, содержащие высокоактивные гидролитические ферменты, расщепляющие различные макромолекулы клетки, включающие как собственные (нежелательные для клетки) соединения, так и ксенобиотики. При этом гидролитическая активность лизосомных ферментов столь высока, что если бы мембрана лизосом разрушилась под их действием, то клетка сразу же подверглась бы самоперевариванию.
В случае наследственных дефектов строения и функционирования лизосом развиваются лизосомные болезни. Например, из-за нарушения процесса деградации мукополисахаридов последние будут накапливаться в лизосомах, что обусловит развитие болезни I-клеток.
Выделено 44 нозологии лизосомных болезней или болезней накопления (см. главу 21).
Пероксисомы - это средние по размерам пузырьки (мельче лизосом), содержащие ферменты, обеспечивающие окислительные реакции в клетке. Например, пероксисомы участвуют в деградации белков (см. главу 3). Следует отметить, что и лизосомы, и пероксисомы условно можно отнести к органеллам, «перерабатывающим отходы жизнедеятельности» клетки. В случае наследственных дефектов строения и функционирования пероксисом развиваются пероксисомные болезни. Среди них выделено не менее 17 нозологий (см. главу 26).
Митохондрии - это органеллы, предназначенные для энергетического метаболизма. В их внутренней мембране образуется большинство энергетических молекул (в основном аденозинтрифосфат или АТР), т.е. митохондрии выступают в роли производителей энергии или своего рода «электростанций», обеспечивающих энергией клеточные нужды.
Митохондрии служат источником активных форм кислорода (АФК), которые в случае их гиперпродукции и нарушения клеточного гомеостаза приводят к повреждению и даже гибели клетки (см. главу 11).
В случае наследственных дефектов строения и функционирования митохондрий развиваются митохондриальные болезни, в их числе насчитывается свыше 200 нозологий (см. главу 26).
Следует заметить, что если о лизосомных болезнях известно давно, то первые сообщения о пероксисомных и митохондриальных болезнях появились сравнительно недавно: в ходе реализации международной научной программы «Геном человека» (см. главу 1).
Примерно тогда же эти три класса заболеваний получили название болезней материнского наследования, потому что они передаются из поколения в поколение вместе с органеллами цитоплазмы яйцеклетки, т.е. исключительно по линии мать-дочь (см. главу 4).
Завершая рассмотрение организации и функционирования основных органелл цитоплазмы соматической клетки, следует особо отметить наличие в организме уникальной клетки, не имеющей таких органелл, - это зрелый эритроцит. Данная клетка представляет собой двояковогнутый диск, что позволяет увеличить поверхность газообмена между цитоплазмой эритроцита и окружающей средой, придает ему гибкость и упругость, и поэтому эритроцит легко проходит по капиллярам.
Такую способность обеспечивает эритроциту белок - спектрин, связанный с якорным белком - анкирином, который в свою очередь связан с белком внутренней поверхности мембраны - гликофорином, отвечающим за транспорт анионов.
В протеомике выделен наследственный дефект структуры спектрина или наследственный элиптоцитоз (сфероцитоз), когда эритроциты имеют необычную форму и поэтому у них нарушена способность к прохождению через капилляры (такие эритроциты разрушаются в селезенке).
Кроме того, нарушение способности эритроцитов к прохождению через капилляры в результате их «засахаривания» наблюдается при сахарном диабете.
Химический состав структурных компонентов клеток, межклеточных соединений и тканей
Клетки, межклеточные соединения и ткани состоят из одних и тех же химических веществ.
Прежде всего, это вода (Н2О), на долю которой приходится около 70-90% общего состава химических веществ, и поэтому свойства клеток и тканей во многом определяются физическими и химическими свойствами воды.
В воде растворены соли основных химических элементов клетки: натрия, калия, кальция, магния и хлора.
Оставшаяся доля общего состава клетки - это органические вещества (10-30%), состоящие из атомов углерода (С), связанных с атомами водорода (Н), кислорода (О2), азота (N), серы (S) и фосфора (Р).
Основное органическое вещество клетки - это углеводороды, соединения из двух атомов (С и Н) с простой химической (ковалентной) связью между ними в виде одной пары электронов - по одному для каждого атома. Связь очень прочная, и чтобы ее разорвать, необходимо затратить много энергии.
Углеводороды - ценный вид биологического топлива, содержащего запасы энергии.
Все химические элементы клетки характеризуются валентностью, или способностью образовывать определенное количество химических связей (рис. 26).
В частности, валентность углерода равна четырем, поэтому каждый его атом может быть связан с четырьмя другими атомами. Благодаря этой особенности образуется большое количество комбинаций атомов, а в результате - значительное разнообразие органиче-
 Рис. 26. Разнообразие органических молекул на основе атомов углерода, соединенных в цепи (по Гуттман Б. и соавт., 2004)
Рис. 26. Разнообразие органических молекул на основе атомов углерода, соединенных в цепи (по Гуттман Б. и соавт., 2004)
ских молекул. Например, в простых случаях, если к углеродной цепи присоединяется гидроксильная группа (НО), то образуется спирт, если аминогруппа (NH2), то амин.
Более сложные молекулы органических соединений имеют кольца в виде замкнутых в них линий, в местах соединения которых атомы углерода обычно не обозначаются.
Наиболее важные из структурных компонентов служат «строительными материалами» для любой клетки. Среди них нуклеиновые кислоты (ДНК и РНК), белки, липиды и углеводы (информация о них изложена в соответствующих главах пособия). Эти структурные компоненты нередко отличаются гигантскими размерами своих молекул - это макромолекулы, имеющие большой молекулярный вес, исчисляемый тысячами условных единиц.
Макромолекулы характеризуются сравнительно несложной структурой: они представляют собой полимеры, как правило, состоящие из одинаковых или почти одинаковых повторяющихся частей - мономеров. Например, нуклеиновые кислоты состоят из двух или одной полинуклеотидных цепей (соответственно ДНК и РНК), составленных из множества нуклеотидов, каждый из которых включает сахар-фосфат-основание.
Нуклеиновые кислоты являются носителями наследственной информации. При этом они занимают почти весь объем ядра (95%) и небольшую часть объема цитоплазмы (5%).
Белки состоят из длинных полипептидных цепей, включающих мономеры, называемые аминокислотами. Каждая аминокислота имеет аминогруппу и карбоксильную группу. При встраивании аминокислоты в полипептидную цепь она утрачивает эти группы и становится аминокислотным остатком.
Белки - это не только структурные материалы, но и главные «рабочие лошади» организма, выполняющие практически все его функции, отождествляемые с понятием «живой организм». В частности:
• белки формируют видимые и невидимые структуры тела: кожа, ногти и волосы - это кератины; соединительная ткань, хрящи и кости - это коллагены; мышцы - это актин и миозин, осуществляющие сокращение и растяжение мышц;
• белки - сигнальные молекулы, из которых основные - это гормоны, обеспечивающие связи между разными типами клеток и тканей, органов и систем;
• рецепторы - это белки, принимающие сигналы (приемные устройства);
• регуляторы - это ферменты, обеспечивающие все химические реакции и процессы в клетке и организме;
• переносчики ионов и небольших молекул - это белкитранспортеры через клеточные мембраны и т.д.
В свою очередь, липиды (жиры) состоят из длинных углеводородных цепей, обычно включающих 16-18 атомов углерода и другие компоненты.
И наконец, углеводы - это макромолекулы сахаров (полисахариды), состоящие из моносахаров или небольших молекул; они имеют общую формулу: С6Н12О6.
К моносахарам относятся: глюкоза, лактоза, манноза и другие мономеры - они соединяются в длинные цепи и образуют сложные сахара: целлюлозу, крахмал, гликоген.
Клеточные мембраны
Клеточные мембраны имеют ключевое значение в организационной структуре и функционировании разных типов клеток и тканей.
Жидкокристаллическая модель организации мембран
Конструкционной основой наружных и внутренних клеточных мембран служит липидный бислой, образующий текучую жидкокристаллическую матрицу за счет латеральной диффузии липидных и белковых молекул. Другие компоненты занимают не более 5% от общего состава мембран.
По составу и структуре клеточные мембраны - это динамические (модифицирующиеся) системы, скоординированные с внутриклеточными процессами. Они организованы на основе липидов, белков и холестерина. В основе динамики мембранного бислоя лежат липидлипидные и липид-белковые взаимодействия. При этом липиды свободно перемещаются в пределах монослоя мембраны, не взаимодействуя друг с другом, и их поведение зависит от собственной химической структуры.
На рис. 27 приведена жидкокристаллическая модель организации мембраны.
Эта модель объясняет неодинаковое количество молекул белка, приходящееся на единицу площади мембраны, их асимметрию, возможность локализации на наружной или внутренней поверхности, разную толщину мембраны, ее высокое электрическое сопротивле-
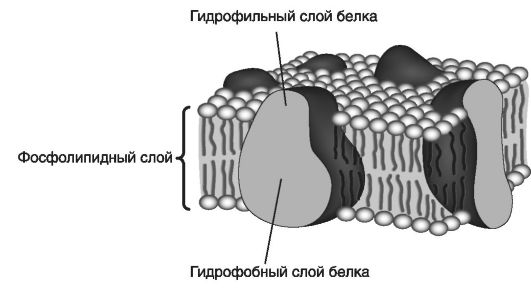 Рис. 27. Жидкокристаллическая
модель организации мембраны (по Cell Structure and Function: Lipid
Membranes.http:scidiv.bcc.etc.edu/rkr/Biology101 / lectures/ pddfs)
Рис. 27. Жидкокристаллическая
модель организации мембраны (по Cell Structure and Function: Lipid
Membranes.http:scidiv.bcc.etc.edu/rkr/Biology101 / lectures/ pddfs)
ние, избирательную проницаемость, изменчивость, а также латеральную диффузию с разной скоростью движения липидов и белков в плоскости наружного монослоя. Поэтому данную модель часто называют жидкомозаичной (рис. 28).
Плоскостная (латеральная) структура мембраны сложна, так как содержащиеся в ней липиды и белки не имеют полной свободы перемещения: они «заякорены» за внутренние цитоплазматические структуры клетки (микрофиламенты). Во всех клеточных мембранах выделяют внешнюю (верхняя часть рис. 28, где обозначены волокна внеклеточного матрикса или ЕСМ) и внутреннюю поверхности (под ней расположены волокна цитоскелета).
На внешней поверхности мембраны расположены гликолипиды, и их полярные углеводные части (остатки моно- и олигосахаридов) экспонированы в окружающую среду, т.е. выступают над поверхностью мембраны, образуя наружную оболочку, или гликокаликс. Эти молекулы обеспечивают клеточное узнавание (рецепцию) и иммунохимические реакции. При этом они не могут свободно перемещаться из одного монослоя мембраны в другой.
Центральный (внутренний) монослой мембраны образован фосфолипидами с включениями интегральных белков. Этот монослой обращен жидкокислотными цепями (хвостами фосфолипидов) внутрь бислоя, формируя гидрофобную фазу («боится воды»). Полярные
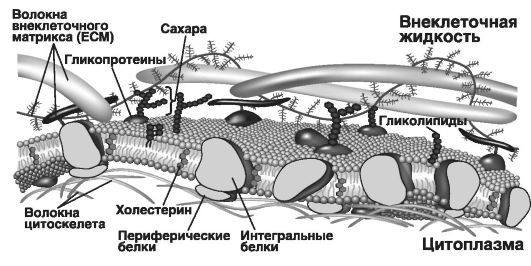 Рис. 28. Схема
жидкомозаичной мембраны (по: Cell Structure and Function: Lipid
Membranes.http:scidiv.bcc.etc.edu/rkr/Biology101 /lectures/ pddfs)
Рис. 28. Схема
жидкомозаичной мембраны (по: Cell Structure and Function: Lipid
Membranes.http:scidiv.bcc.etc.edu/rkr/Biology101 /lectures/ pddfs)
гидрофильные головки фосфолипидов обращены наружу по обеим сторонам внутреннего неполярного слоя («любит воду»).
Следует отметить, что в ходе эволюции сохранился только общий принцип построения клеточных мембран, в то время как состав составляющих их липидов и жирных кислот существенно изменился у разных видов. Например, в мембранах обнаруживаются сотни липидных единиц, соотношения которых специфичны для разных типов мембран, что объясняется их участием во многих внутриклеточных процессах и свидетельствует об уникальности каждого липида.
В целом клеточные мембраны содержат гетерогенную смесь фосфолипидов, и каждый из них отличается структурой полярной головки, размерами жирнокислотной цепи, степенью ненасыщенности ацильных цепей, характером их связывания и другими особенностями.
Фосфолипиды ведут «двойную жизнь», являясь одновременно «строительными блоками» и модуляторами клеточных процессов. Это либо фосфоглицериды (организованы на основе молекулы глицерина), либо сфингомиелины (производные сфингозина).
Обязательный компонент фосфолипидов - это фосфатная группа, к которой присоединена полярная группа в виде неспецифических азотистых оснований (этаноламин или холин), которые не
кодируют наследственную информацию. Нередко вместо них может встраиваться аминокислотный остаток - серин или углеводный компонент - инозит.
Такие упорядоченные (твердые или гелеобразные) фосфолипиды способны к фазовым переходам, которым свойственна определенная температура плавления (текучести) или Тфп - это переход фосфолипидов от фазы упорядоченного в фазу текучего жидкокристаллического состояния.
Температура фазового перехода зависит от:
• длины ацильных цепей и степени их ненасыщенности;
• природы и величины заряда полярных головок;
• химической структуры стеринов и соотношения фосфолипиды/холе- стерин;
• характера взаимодействия между фосфолипидами и белками;
• давления, объема, кислотности;
• концентрации ионов Са2+.
Насыщенными цепями богаты сфинголипиды, что создает условия для наиболее плотной молекулярной упаковки, и поэтому они имеют сравнительно высокую Тф.п.
Наоборот, у глицерофосфолипидов, содержащих ненасыщенные ацильные цепи, Тф.п. более низкая.
Увеличение жидкостности характерно для мембран, образованных на основе ФС, ФГ и ФИ (см. ниже), включающих ненасыщенные жирные кислоты.
В то же время присутствие гликосфинголипидов (например, ганглиозидов), имеющих гидрофобную область (похожую на таковую у сфинголипидов), придает бислою мембраны жесткость.
В таблице 6 приведены температуры фазовых переходов для фосфатидилхолина (ФХ) и фосфатидилэтаноламина (ФЭ), содержащих разные жирные кислоты (по Shaw A.W. et al., 2004).
Таблица 6. Температуры фазовых переходов для фосфатидилхолина и фосфатидилэтаноламина с разными жирными кислотами

 Примечание. С
- стерил; П - пальмитоил; О - олеил; Л - линолеил; ДС, ДП, ДО, ДЛ и ДМ -
соответственно дистерил, дипальмитоил, диолеил, дилинолеил и
димиристоил; ФХ - фосфатидилхолин, ФЭ - фосфатидилэтаноламин.
Примечание. С
- стерил; П - пальмитоил; О - олеил; Л - линолеил; ДС, ДП, ДО, ДЛ и ДМ -
соответственно дистерил, дипальмитоил, диолеил, дилинолеил и
димиристоил; ФХ - фосфатидилхолин, ФЭ - фосфатидилэтаноламин.
Типы клеточных мембран
По электрическому потенциалу выделяют три типа мембран: нейтральные, положительно и отрицательно заряженные мембраны.
Нейтральные (увиттериновые) мембраны находятся в клетках головного мозга и содержат молекулы цереброзидов (ганглиозидов и олигосахаридов), являющихся производными сфингозина (как сфингомиелины). Некоторые ганглиозиды связаны с избыточным накоплением продуктов частичного расщепления гликосфинголипидов, что, например, лежит в основе болезни Тея-Сакса (см. главу 21).
По составу ганглиозидов можно определять группы крови в системе АВО, так как их углеводные части отличаются концевыми остатками в олигосахаридных цепях и благодаря этому обладают антигенными свойствами (см. главы 1 и 15).
Следует отметить, что мембраны самих нейронов и миелиновых оболочек нервных волокон богаты гликосфинголипидами.
Положительно заряженные мембраны имеют на своей поверхности полярные группы молекул лецитина (см. ниже).
Отрицательно заряженные мембраны имеют на поверхности полярные группы молекул фосфатидилсерина (фосфорилирует белкимишени и с помощью факторов роста контролирует пролиферацию) и молекулы фосфатидилинозитдифосфата (посредник для двух химических сигналов).
В ходе метаболизма этот посредник преобразуется в диацилглицерин (ДАГ) с образованием Са2+, который крайне необходим для максимальной активации протеинкиназы С, связанной с молекулой фосфатидилсерина.
Мембранные липиды
Мембранные липиды - это неполярные природные соединения разной структуры. Они включают глицерофосфолипиды (нейтраль-
ные глицериды или фосфолипиды), сфинголипиды и жирные кислоты.
Кроме этих классов, к липидам относятся воска (их молекулы включают до 36 атомов углерода) и некоторые другие вещества. Все они выполняют функции главных компонентов мембран или биоэффекторов, регулирующих внутренние реакции клетки и межклеточные взаимодействия, а также служат формой запаса биологического топлива.
Фосфолипиды клеточных мембран выступают в роли матрикса (ЕСМ), в который встроены белки и ферментные системы клетки.
Общий компонент химической структуры мембранных фосфолипидов - полярная головка и два гидрофобных хвоста (рис. 29).
Главное свойство молекулы фосфолипидов - это амфифильность или сродство к полярной (водной) и гидрофобной (жировой) средам. Оно обеспечивается гидроводородными радикалами жирных кислот
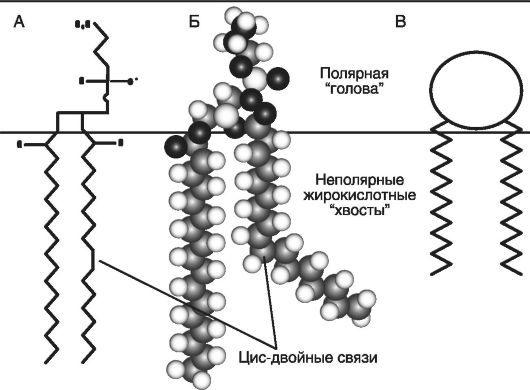 Рис. 29. Химическая структура молекулы фосфолипида клеточной мембраны (по Ипатовой О.М., 2005):
Рис. 29. Химическая структура молекулы фосфолипида клеточной мембраны (по Ипатовой О.М., 2005):
А - общая схема; Б - молекулярная схема; В - упрощенная схема полярной головки и неполярных жирнокислотных хвостов ФЛ
(головка) и остатком фосфата (хвост), соединенными сложноэфирной связью с аминоспиртом.
При этом сама клетка и ее органеллы служат примером липосомы, а находящиеся в крови липопротеины отвечают за транспорт биохимических соединений и по своему строению служат мицеллами.
Липосомы (липидные везикулы) образуются при механическом диспергировании взвеси фосфолипидов в воде. Формы организации липидов в воде определяются зарядом их полярных головок и соотношением объемов, занимаемых головками и неполярными жирнокислотными цепями. Когда эти объемы выравниваются, образуется липидный бислой, и его молекулы имеют цилиндрическую форму.
Если преобладает объем полярных головок, то образуется форма обращенного конуса или мицеллярная форма молекулы фосфолипидов в водном окружении, например лизоФХ.
Глицерофосфолипиды
Глицерофосфолипидами называются липиды, в структуре которых сопряжение между жирной кислотой и полярной группой осуществляется через сложный спирт - глицерин.
К глицерофосфолипидам относятся смеси липидов, молекулы которых содержат одну и ту же полярную часть - фосфохолин и разные жирнокислотные остатки, т.е. одна и та же полярная головка может соединяться с разными цепями, что позволяет создавать многочисленные комбинации молекул. Рассмотрим наиболее важные из них.
Фосфатидилхолин (ФХ) или лецитин, - это основной универсальный фосфолипид, занимающий 35-50% общего объема в мембранах клеток и тканей и 70-75% объема фосфолипидов липопротеинов плазмы крови. ФХ доминирует во многих тканях, например, его содержание в легких - 46,5%, печени - 43,6%, селезенке - 41,2%.
У него многочисленные функции:
• «строительный блок» для мембран;
• интегральный компонент липопротеинов высокой плотности;
• метаболический предшественник для фосфатидилэтаноламина и сфингомиелина;
• источник ряда липидных мессенджеров и биологически активных соединений, включая лизофосфатидилхолин, лизофосфолипиды, факторы активации тромбоцитов и арахидоновой кислоты, диглицериды; чем больше ФХ, тем хуже он превращается в диглицериды;
• источник холина в клетках мозга;
• в форме дипальмитоилфосфатидилхолина (ДПФХ) или ФХ с высоким содержанием насыщенных жирных кислот входит в состав легочного сурфактанта, обеспечивающего стабильность альвеол и снижающего их поверхностное натяжение, что препятствует слипанию альвеол в момент выдоха;
• участник построения липопротеиновых частиц в эпителиальных клетках кишечника (обволакивает жировые капли, обеспечивая образование поступающих в кровь хиломикронов);
• участник образования желчи в печени, обеспечивающий экскрецию холестерина и его метаболитов (составляет 95% фосфолипидов желчи);
• участник функционирования в клетках печени цитохрома Р450 . Синтез ФХ в клетках и организме строго контролируется.
Последствия нарушений синтеза ФХ опасны для жизни клетки. Например, в результате ингибирования цитозиндифосфохолин (ЦДФ)- зависимого пути или сверхэкспрессии метилирования ФЭ в ФХ может нарушиться липидный гомеостаз, что приведет к избытку или дефициту мембранной поверхности, внутриклеточному накоплению липидов, задержке роста и гибели клетки.
Особенно опасны такие нарушения для быстро обновляющихся клеток крови и печени, в которых ФХ играет роль связывающего звена между апопротеином и нейтральными липидами.
Фактор активации тромбоцитов (PAF) является биологически активным аналогом ФХ. Содержит простую эфирную связь (вместо сложной эфирной связи у ФХ). Этот фактор инициирует клеточный ответ в гладкой мускулатуре печени, легочной ткани, сердечной мышце и других тканях и органах. Его синтез и высвобождение из клетки ведут к агрегации и освобождению серотонина из тромбоцитов. В низких концентрациях он вызывает агрегацию тромбоцитов, оказывая гипотензивный эффект. Кроме того, PAF является медиатором острого воспаления (благодаря опосредованному присоединению к специфическим рецепторам), гиперчувствительности и анафилактического шока (синтезируется в ответ на образование комплекса антиген - IgE на поверхности базофилов, нейтрофилов, эозинофилов, макрофагов и моноцитов).
В клетках PAF обычно не накапливается (только при воспалении!).
Фосфатидилэтаноламин (ФЭ) или кефалин, участвует в регуляции систем свертывания крови, клеточной адгезии, эндоцитозе и фол-
динге белков (контролирует степень погружения белка в мембрану, обеспечивая необходимую его конформацию), влияет на форму мембраны (благодаря плоскостной структуре вступает в определенное соотношение с ФХ).
ФЭ служит «строительным блоком» для мембраны, являясь одним из электронейтральных (увиттериновых) липидов, в состав которых также входят ФХ и сфингомиелины (СМ).
Анионные фосфолипиды
В последние годы выделены анионные фосфолипиды. Их свойства зависят от пространственного сопряжения положительно заряженных участков белковых доменов и отрицательно заряженных головок липидов, которые окружают эти домены. К наиболее известным анионным фосфолипидам относятся фосфатидилсерин, фосфатидилинозит, фосфатидная кислота (ФК), фосфатидилглицерин и кардиолипин (КЛ).
Анионные фосфолипиды образуют на поверхности мембраны отрицательно заряженную область, формирующую электростатические связи (полярные и неполярные) с катионными областями пептида, расположенного вблизи мембраны (наибольшую активность проявляют ФК и КЛ; см. ниже).
Среди анионных фосфолипидов различают поверхностномембранные (прилегают к белкам с обеих сторон водной фазы) и внутримембранные (влияют на топологию, ориентацию и образование ансамблей интегральных белков).
Показана уникальная способность анионных фосфолипидов стимулировать «транслокацию» водорастворимых белков, создающую условия для их активации.
Транслокация водорастворимых белков - это их непосредственное присоединение к мембране, что связано с конформационными изменениями белковой молекулы, инициирующими ее переход в активное состояние.
К наиболее изученным внутриклеточным ферментам, регулирующим транслокацию белков к фосфолипидной поверхности, относятся: цитозольная фосфолипаза (cPLA2), секреторная фосфолипаза (sPLA2), ЦДФ-холин-зависимая трансфераза и протеинкиназа С.
Фосфатидилсерин (ФС) - единственный фосфолипид с остатком аминокислоты. Его содержание в мембранах в среднем менее 10%, но наибольший его уровень отмечается в мозговой ткани, достигая в мембране ЭР нейрона 20% от общего состава липидов.
По химическому составу молекула ФС имеет три ионизированные группы (аминогруппа, карбоксильная и фосфатная группы). Это кислый липид, поэтому в природе он существует только в солевой форме.
Из его внутриклеточных эффектов наиболее изучено взаимодействие с протеинкиназой С (головки ФС связываются с С2-доменами этого фермента). Другие эффекты ФС обусловлены локализацией на несвойственной для него внешней стороне мембраны, которая электронейтральна, но может приобрести отрицательный заряд (например, при активации тромбоцитов или в ходе апоптоза), что приведет к модификации поверхности клетки и ее «узнаванию» белками системы свертывания крови и макрофагами (с последующим удалением).
Интересен также механизм связывания ФС с аннексином V или Са2+-независимым фосфолипид-связывающим белком. Этот антикоагулянт имеет высокое сродство к ФС, который транслоцируется к поверхности мембраны с образованием кальциевых «мостиков», что вызывает воспалительный ответ (путем ингибирования фосфолипазы PLA2).
При воспалении аннексин V образует кластеры на поверхности монослоя, предотвращая доступ фосфолипаз к фосфолипидам. При активации клеток аннексин V транспортируется к ядерным мембранам, где возможно образование высокоспецифичного к нему фосфолипидного домена, характерного для апоптических клеток.
Предполагается также связь между процессами перекисного окисления, окислением ФС (не предотвращается витамином Е как антиоксидантом) и транслокацией аннексина V.
Помимо указанных механизмов также возможны тяжелые иммунные нарушения, называемые антифосфолипидным синдромом, при которых клетки экспрессируют на своей поверхности ФС, связывающийся с бета-2-гликопротеином, что ведет к их удалению макрофагами с помощью специфических рецепторов.
Фосфатидилинозит (ФИ) - важнейший фосфолипид для всех организмов; является ключевым компонентом мембран и одновременно участником различных метаболических процессов.
ФИ - это кислый полианионный фосфолипид, содержащий фосфатидную кислоту, связанную через фосфатную группу с шестиатомным спиртом - инозитом.
В мембранах ФИ локализован на цитозольной стороне бислоя и присутствует во всех тканях, но больше всего в мозговой ткани (до 10%).
В составе ФИ много стеариновой и арахидоновой кислот. Поэтому он служит основным источником арахидоновой кислоты, необходимой для синтеза эйкозаноидов, включая простагландины. ФИ имеет изомеры: ФИ-4-фосфат (PIP), ФИ-4,5-дифосфат (PIP2), ФИ-3,4,5-трифосфат, которые минимально присутствуют в клетках и тканях, составляя только 5% от общего количества фосфолипидов. Установлено, что содержание PIP и PIP2 постоянно поддерживается на внутренней стороне мембраны с помощью серий непрерывных реакций фосфорилирования-дефосфорилирования, катализируемых киназами и фосфатазами (см. главу 8).
Наиболее активная роль ФИ и его изомеров связана с процессами трансдукции сигналов, в ходе которых внутренние структуры клетки «узнают» о внеклеточных событиях, например о присоединении антигенов, белков, гормонов и других соединений, выступающих в роли внеклеточных сигнальных молекул (передача апоптозных сигналов, сигналов перегруппировки актинового цитоскелета и инициации внутреннего везикулярного транспорта).
Одновременно ФИ участвует в поддержании структуры GPI- заякоренных белков, в межфазном связывании белков и регуляции их поведения на границах раздела фаз в клетке (электростатическое взаимодействие с ними), особенно РН-доменов.
Как известно, РН-домены обладают сходной третичной структурой, могут служить медиаторами в белок-липидных и белок-белковых взаимодействиях.
Лигандами для них являются фосфорилированные киназами ФИ. В процессе их фосфорилирования до PIP2 (с участием АТР и киназ) и клеточной активации (в ответ на внешний сигнал) начинает действовать фосфолипаза С, с помощью которой образуются диглицерид и инозит-трифосфат-3,4,5.
Каждое из этих соединений служит вторичным мессенджером, включающим каскад реакций, в ходе которых диглицерид активирует протеинкиназа С, а инозит-трифосфат-3,4,5 индуцирует выход внутриклеточного Са2+. Нарушения регуляции этих процессов ведут к разнообразной клеточной патологии.
Фосфатидная кислота (ФК) присутствует во всех живых организмах, являясь важным промежуточным соединением в биосинтезе триглицеридов и большинства фосфолипидов.
ФК - это дианион или отрицательно заряженная молекула, требующая присутствия противоионов. Является биосинтетическим
интермедиатором, который синтезируется in situ из других фосфолипидов при действии фосфолипазы D.
Добавление молекулы ФК к фосфатидилхолиновым везикулам повышает чувствительность к агрегации и слиянию, вызываемому
Са2+.
Показано, что ФК стимулирует гидролиз ФХ-везикул sPLA2 и может генерироваться во внешнем слое мембраны при воспалении.
Высокая активность такой реакции показана при септическом шоке, при котором уровень секреторной фосфолипазы возрастает в 100 раз, достигая величин, достаточных для гидролиза мембран. ФК присутствует в артритной синовиальной жидкости, а также микровезикулах, образующихся при отпочковывании мембран и отделении участков ее наружного слоя (процесс «шединга»). На это указывает образование лизоФК (предшественник ФК) при действии sPLA2.
Полагают, что ФК также связана с процессами, происходящими в аппарате Гольджи, участвует в передаче внутриклеточных сигналов, способствует слиянию мембран, усиливая их кривизну (эффект, противоположный действию лизоФК).
Фосфатидилглицерин (ФГ) образуется при соединении двух молекул фосфатидной кислоты через гидроксил фосфатной группы. Это отрицательно заряженная молекула при физиологическом значении рН среды. ФГ локализуется в легочном сурфактанте вместе с ДПФХ (см. выше), где, по-видимому, участвует в связывании альвеолярных белков. Кроме того, показана роль ФГ как физиологического активатора протеинкиназы С.
Кардиолипин (КЛ). Если к двум молекулам фосфатидной кислоты присоединить еще один фосфоглицериновый фрагмент (через гидроксил второй фосфатной группы), то образуется дифосфатидилглицерин или кардиолипин. Его молекула несет два отрицательных заряда. Она расположена преимущественно на внутренней стороне митохондриальной мембраны и, по-видимому, участвует в доставке белков внутрь митохондрий.
Сфингофосфолипиды
Сфингофосфолипиды (сфинголипиды) или сфингомиелины (СМ). Молекула СМ имеет две цепи, из них одна включает 15 углеродных атомов, другая - остатки жирных кислот. Сопряжение между цепями осуществляется через аминосодержащий спирт - сфингозин. СМ - это многофункциональный аналог ФХ или фосфохолино-
вое производное церамида (церамидфосфадилхолин). Его молекула содержит длинное сфингоидное основание и жирные кислоты.
Концентрация СМ в животных клетках достигает 50% от общего количества фосфолипидов (меньше, чем содержание ФХ). Они локализованы на внешней стороне мембраны, что делает их «строительными блоками» и придает мембране жесткость.
К СМ относятся ганглиозиды, глобозиды, сульфатиды и цереброзиды. В частности, СМ являются структурными компонентами липидов головного мозга (около 10%) и липопротеинов плазмы крови, тесно связаны с холестерином (проявляют к нему сродство), что подтверждается их совместным преобладанием в плазматической мембране и мембране аппарата Гольджи. Вместе с холестерином они составляют основу специфических мембранных доменов, называемых «рафтами» или «кавеолами», которые играют важную роль в передаче внутриклеточных сигналов (см. главу 8).
Показано участие сфинголипидов и их метаболитов в адгезии, ангиогенезе, апоптозе, вазорелаксации (путем регуляции тонуса сосудов через активацию эндотелиальной NO-синтазы), миграции, пролиферации, росте клеток. Некоторые из них (церамид, сфингозин, сфингозин-1-фосфат или SIP) являются медиаторами цитокинов, факторов роста, стрессорных факторов внешней среды. Например, стрессовые факторы среды приводят к генерации транслокации СМ в рафтах, асимметрии в плазматической мембране. В результате ФС остается на несвойственной ему внешней стороне мембраны, а СМ вытесняются из нее на внутреннюю цитоплазматическую сторону, где, по-видимому, гидролизуются СМазой с образованием церамида.
При такой дислокации нарушаются физико-химические свойства мембраны, изменяется жидкостность ее микродоменов, происходит перераспределение холестерина по направлению к внутренней части клетки или внеклеточному акцептору (липопротеину), и все это ведет к активации апоптоза.
Показано, что сфинголипиды и их производные участвуют в развитии таких патологических состояний, как атеросклероз и его осложнения, проявления кардиотоксичности, вызванные антрациклинами. Они также усиливают воздействие на клетку внеклеточных эффекторов (цитокинов, факторов роста и липопротеинов), обусловливающих сосудистые нарушения.
Сфинголипиды поступают в организм с пищей, гидролизуются в кишечнике до церамидов и длинноцепочечных оснований, которые затем всасываются и метаболизируются.
За рубежом полагают, что СМ должны входить в состав биологически активных пищевых добавок для профилактики атеросклероза и рака толстой кишки, так как они снижают уровень холестерина в ЛНП и повышают его в ЛВП. Например, в США суточная потребность СМ в расчете на душу населения составляет 0,3-0,4 г.
Плазмалоген - это наиболее сложное по строению производное сфингозина: алкильная или алкенильная форма винилового эфира. В виде холинплазмалогена входит в состав миелина нервной ткани и саркоплазматического ретикулума ткани сердца.
Лизофосфолипиды
Лизофосфолипиды (лизоФЛ) занимают важное место в метаболизме и регуляции функций фосфолипидов. Они состоят из большой гидрофильной полярной головки, прикрепленной к глицериновому или сфингозиновому скелету, а также из одной длинной гидрофобной углеводородной цепи, включающей остаток жирных кислот для лизоглицероФЛ или сфингоидное основание для лизоФЛ. Биологические функции лизоФЛ связаны с ростом клетки, включая пролиферацию, дифференцировку, выживание и апоптоз. Как правило, их концентрация в мембранах низкая (0,5-6,0%). Именно в такой концентрации они обнаруживаются в крови в связанном с альбумином виде и действуют как вторичные мессенджеры, преобразующие сигналы, полученные от мембранных рецепторов.
В мембранах лизоФЛ генерируются в ходе ферментативного расщепления глицерофосфолипидов и сфинголипидов. Их концентрация повышается при активации тромбоцитов, повреждении тканей, воспалении и неоплазии, ишемии и аритмии миокарда, ишемии и демиелинизации периферических нервов.
Лизофосфолипиды, входящие в состав ЛНП или поврежденных клеток, играют важную роль на ранних стадиях развития атеросклероза и воспалительного процесса, проявляют противоопухолевые свойства и бактерицидную активность. К лизофосфолипидам относят лизосфинголипиды и лизоглицерофосфолипиды.
Лизосфинголипиды
Лизосфинголипиды образуются при гидролизе СМ с последующим обратимым расщеплением церамида до сфингозина и фосфорилиро-
ванием сфингозина до SIP, который обладает высокой активностью, являясь регулятором ангиогенеза (см. главу 17). SIP увеличивает пролиферацию и хемотаксис эндотелиальных клеток, стабилизирует атеросклеротические бляшки, стимулирует образование капилляров, усиливает действие фактора роста фибробластов на ткани рогового слоя; SIP также вовлечен в церебральный вазоспазм.
Уровень SIP регулируется ферментами: сфингозинкиназой, SIP- фосфатазой, SIP-лиазой. Вместе с тем, он может покидать мембрану.
В последние годы открыт продукт деацилирования СМ или сфингозин-фосфорилхолин (SPC). Этот лизосфинголипидный регулятор, по-видимому, активирует NO-синтазу и связанный с ней метаболический путь.
SIP и SPC входят в состав ЛНП, особенно в их окисленных формах. Считается, что они относятся к ключевым сигнальным молекулам, вовлеченным в стимуляцию клеточного роста. Эти молекулы совместно со сфингозином являются потенциальными переносчиками Са2+ или кальций-мобилизирующими агонистами. Причем SIP усиливает инициируемое сфингозином освобождение Са2+, а SPC его мобилизует в гладкомышечных и эндотелиальных клетках.
Лизоглицерофосфолипиды
Лизофосфатидилхолин (лизоФХ). Его немного, но он контролирует молекулярный состав всех мембранных фосфолипидов.
ЛизоФК является высокоактивным лизоглицерофосфолипидом. Его молекула содержит одну длинную углеводородную цепь и фосфатно-гидроксильную полярную головку.
ЛизоФХ входит в состав фосфолипидов ЛНП плазмы крови (особенно в окисленной модифицированной форме), а также в состав безлипопротеиновой фракции крови в комплексе с альбумином - это 6-9% всех фосфолипидов сыворотки. Молекулы лизоФХ образуются путем циклического деацилирования-реацилирования при гидролизе ФХ цитозольной фосфолипазой (cPLA2).
При этом освобождается ненасыщенная арахидоновая кислота, являющаяся основным субстратом для синтеза простагландинов и лейкотриенов. Включение лизоФХ в состав мембраны саркоплазматического ретикулума приводит к снижению активности Са2+-АТРазы, не вызывая изменения подвижности жирнокислотных цепей.
Установлено также, что при экспрессии генов лизоФХ стимулируется рост макрофагов (обусловлен опосредованной протеинкиназой С активацией Т-лимфоцитов и дифференциацией в макрофаги кле-
ток HL-60). Кроме того, лизоФХ служат уникальными стимуляторами процесса сигналинга (медиаторами активности Edg-рецепторов), сопряженного с регуляторными белками (универсальные G-белки) через GPCR-рецепторы, активирование которых инициирует процессы внутриклеточной сигнализации (см. главу 8).
Обнаружение увеличенного содержания лизоФХ в составе окисленных ЛНП считается диагностическим признаком атеросклероза.
Лизофосфатидная кислота (лизоФК) относится к мультифункциональным фосфолипидам с активностью, подобной активности факторов роста. ЛизоФК быстро продуцируется и освобождается из активированных тромбоцитов, оказывая влияние на многие клеткимишени.
Под действием лизоФК-ацилтрансферазы (либо при быстром расщеплении с помощью лизофосфолипаз) лизоФК может превращаться в фосфатидную кислоту, которая индуцирует пролиферацию и дифференцировку, вызывает агрегацию тромбоцитов, сокращение гладкой мускулатуры, сокращение аксонов, ассоциацию адгезивных молекул, участвует в ангиогенезе (совместно с простагландинами и ганглиозидами) и опухолевом росте. Например, лизоФК индуцирует пролиферацию и митогенный сигналинг клеток при раке простаты.
Существенный подъем ее уровня также обнаружен в сыворотке крови женщин с карциномой яичников (уже на первой стадии болезни). Необходимо отметить, что лизоФК совместно с SIP и SPC рассматривается как важнейшая внеклеточная сигнальная молекула , имеющая широкий спектр действия, включая дифференцировку, миграцию клеток, апоптоз, а также регуляцию процессов агрегации тромбоцитов, сосудосуживающей активности, заживления ран, иммуностимуляции и ангиогенеза, мобилизации кальция, ингибирования аденилатциклазы и активации митогенактивирующей протеинкиназы (МАРК) .
Следует отметить, что лизофосфолипиды в целом способствуют повышению уровней инозит-3,4,5-трифосфата, диглицеридов, арахидоновой и фосфатидной кислот и благодаря большим полярным головкам обладают способностью инициировать работу мембранных К+-каналов (TREK-каналов), которые регулируются в ходе фосфорилирования, открываются под действием различных стимулов, включая действие самих лизоФЛ, жирных кислот и некоторых анестетиков.
Высокий уровень функционирования TREK-каналов наблюдается в нервной ткани.
Совместное действие лизофосфолипидов и сфинголипидов
Совместное действие лизоФЛ и сфинголипидов на клеточные процессы в организме строго координируется. При этом между собой тесно связаны биохимические реакции их биосинтеза, расщепления и сигналинга. Известны три механизма усиления синтеза ФК с участием сфингозина, SIP и лизоФК.
Первый механизм связан с участием СМазы, создающей в мембране условия для расщепления фосфолипидов фосфолипазой D.
Второй механизм - это стимуляция активности фосфолипазы D с помощью лизоФК.
Наиболее сложный третий механизм - это регуляция взаимопревращений ФК в диглицериды и наоборот, с помощью сфингозина и SIP, включая стимуляцию синтеза ФК и ингибирование путей ее расщепления (образование лизоФК с последующим расщеплением до моноглицеридов).
В ходе третьего механизма взаимодействие лизоФК и SIP может быть кооперированным либо антагонистическим. Например, сфингозин и SIP ингибируют образование моно- и диглицеридов, катализируемое фосфолипазой, что обусловливает подавление стимуляции протеинкиназы С, тогда как лизоФК, напротив, стимулирует этот процесс.
Наблюдаемые многочисленные эффекты сочетанного действия лизоФК и сфинголипидов предполагают широкие возможности использования их агонистов и антагонистов для контроля за внутриклекточными процессами, включая механизмы ангиогенеза, онкогенеза, старения и трансплантации.
Значение асимметрии структуры липидов и их распределения в мембранах
Асимметрия структуры липидов и их различное распределение между монослоями мембран позволяют им диффереренцированно действовать на внутриклеточные органеллы.
Доказано, что холинсодержащие липиды, ФХ и СМ расположены на внешней поверхности в просвете створок органелл, а аминосодержащие фосфолипиды (ФЭ и ФС) присутствуют и там, и там. При этом белки-ферменты локализованы только на внутренней цитозольной стороне эндоплазматического ретикулума (ЭР) и обычно дают неравный асимметричный прирост в одном монослое.
Для перераспределения липидов и доставки к местам будущей локализации внутри мембран ЭР и аппарата Гольджи существуют липидные транспортеры. Известны два механизма перераспределения липидов.
Первый механизм основан на различиях конформационных размеров полярных головных групп: у холина три метильные группы, и поэтому им надо больше места, чем, например, этаноламину, у которого одна маленькая головка.
Второй механизм - это транслокация липидов. Она связана с участием АТР-зависимых белков-транспортеров липидов. Это основной вид транспорта, вызывающий рандомизацию и асимметрию липидов.
Определены два вида транспортеров липидов, включая АТРзависимую аминофосфолипидтранслоказу или флипазу, транспортирующую фосфолипиды от внешнего к внутреннему монослою. Другая молекула флипазы делает это в противоположном направлении. Выделены также АТР-независимые транспортеры или скрамблазы, включая Са2+-активируемую и связанную с ЭР (специфична к глицерофосфолипидам и липидам, содержащим углеводный фрагмент). В целом асимметрия структуры липидов поддерживается двумя противоположно направленными потоками: внутрь идут аминофосфолипиды, наружу - холин и сфингомиелин; неселективные скрамблазы их уравнивают, а АТР-зависимые транспортеры поддерживают асимметрию.
Именно таким образом скрамблазами нивелируются градиенты концентрации в ответ на стимуляцию клетки.
Небольшой вклад в асимметрию структуры липидов вносит трансмембранная диффузия, протекающая с низкой скоростью из-за высокой собственной энергии (диффузия латеральных доменов фосфолипидов).
Фосфолипидный состав клеток и тканей и липопротеинов плазмы крови
Указанные выше классы основных фосфолипидов занимают в разных клетках и тканях человека от 40 до 90% состава всех фосфолипидов. Причем содержание этих классов и отдельных фосфолипидов меняется в различных ситуациях, на разных стадиях жизненного цикла клетки и онтогенеза в целом.
Например, в эндотелии человека присутствуют фосфолипиды с простыми эфирными связями. Фосфолипиды нервной ткани содержат больше СМ и ФИ-4-фосфата. В шванновских клетках больше
10% ФИ, 3% ФС и 14% ФЭ.
Мало фосфолипидов минорного типа (алкил-ацилФХ и этаноламин-плазмалоген) в коже глазного века и эпидермисе (на фоне повышенного уровня ФХ).
Имеются данные о росте СМ в мембранах клеток при старении и об изменении их содержания в скелетных мышцах.
Особый интерес представляет содержание фосфолипидов в липопротеинах плазмы крови.
Выделяют три основных класса липопротеинов: высокой плотности (ЛВП), низкой плотности (ЛНП) и очень низкой плотности (ЛОНП). Они различаются по размерам и содержанию, наличию определенных белков (апопротеинов) и метаболическому поведению.
Отдельные классы фосфолипидов на поверхности липопротеинов плазмы крови расположены в виде сегрегированных доменов.
Вместе с тем, эти классы липопротеинов имеют общее строение: они формируют глобулы или мицеллы, включающие нейтральные липиды - триглицериды и эфиры холестерина, покрытые монослоем фосфолипидов с белковыми включениями.
На рис. 30 приведено строение глобул липопротеинов плазмы крови. В основе функционирования фосфолипидов в липопротеинах плазмы крови лежит общее с клеточными мембранами свойство - амфифильность (см. выше). При этом фосфолипиды играют роль пограничного слоя между водной средой плазмы крови и гидрофобной глобулой нейтральных липидов, что обусловливает организацию поверхностного монослоя полярных головок в виде ориентированной к наружной водной фазе и устремленных к центру жирнокислотных цепей фосфолипидов.
Иными словами, подобная молекулярная организация фосфолипидов липопротеинов плазмы крови сходна с молекулярной организацией наружного слоя плазматических мембран клеток. В пользу этого свидетельствуют многочисленные данные, например мозаичное расположение белковых молекул и связанная с гидрофобностью и наличием альфа-спиральных фрагментов степень их погружения в липиды.
Белок ЛВП - апопротеин AI (апоА!) локализован на поверхности глобулы, где он взаимодействует с полярными головками фосфолипидов и соприкасается с окружающей водной фазой, что обусловливает его относительную подвижность (вплоть до возможности покинуть липопротеиновую частицу в процессе ее трансформации).
 Рис. 30. Строение глобул липопротеинов плазмы крови (по Ипатовой О.М., 2005)
Рис. 30. Строение глобул липопротеинов плазмы крови (по Ипатовой О.М., 2005)
Другой белок ЛВП - апопротеин AII глубже погружен в гидрофобную область липопротеина (из-за наличия жирнокислотных цепей фосфолипидов) и поэтому трудно отделяется от липопротеиновой частицы.
Еще большей гидрофобностью обладает белок - апопротеин В, часть фрагментов которого взаимодействует с остатками жирных кислот фосфолипидов и неполярными гидрофобными липидами (из окружения ядра липопротеиновой частицы, состоящей из эфиров холестерина и триглицеридов). Размеры этого гидрофобного ядра зависят от количества фосфолипидов: объем фосфолипидного монослоя нарастает по мере снижения диаметра ядра.
Другие компоненты поверхности липопротеинов - это также белки. Их содержание колеблется от 2 до 55% в наиболее мелкой (по размеру и плотности) подфракции ЛВП3.
Еще один схожий компонент липопротеинов расположен в поверхностном монослое между молекулами фосфолипидов (в наружном
слое мембран и липосомах) - это свободный холестерин; здесь его мало (5-15%).
Следует подчеркнуть сходство липопротеинов (ЛОНП и ЛНП) и клеточных мембран по величинам молярного соотношения холе- стерин/фосфолипиды, которое соответствует 0,7-0,8, тогда как для подфракций ЛВП оно вдвое ниже.
Таким образом, состав фосфолипидов липопротеинов плазмы крови подобен составу таковых наружного слоя мембран, для которого характерна преимущественная локализация холинсодержащих фосфолипидов, ФХ и СМ.
Вместе с тем, у липопротеинов нет внутреннего мембранного слоя и почти отсутствуют аминосодержащие фосфолипиды, что, возможно, связано с конусообразной формой их молекул.
В липопротеинах более 90% от объема всех фосфолипидов приходится на долю ФХ, СМ и лизоФХ. В основном это ФХ, доля которого вдвое выше, чем в клеточных мембранах, что связано с особенностями синтеза липопротеинов и их секреции в печени мембранами гепатоцитов.
Так, в гепатоцитах липопротеиновые частицы формируются под влиянием синтезированных в них апопротеинов, которые секвестируют участки микросомального бислоя мембраны ЭР со всеми находящимися в них пулами фосфолипидов. При этом эффективным предшественником последних в липопротеинах плазмы крови является не ФЭ, а ФХ.
Возможен также путь внеклеточного формирования пребета-ЛВП, согласно которому апоА1 в свободном состоянии может секретироваться клетками печени, а остальные фосфолипиды забираются им с мембран белка АВС А1.
При образовании ЛОНП (как и хиломикронов в кишечнике) фосфолипиды совместно с апопротеинами покрывают поверхность высокогидрофобных триглицеридов, обеспечивая их секрецию в кровь в виде стабильных фрагментов.
Частицы ЛВП высокодинамичны и постоянно ремодулируются с участием специфических транспортных и ферментных белков плазмы крови и клеточных мембран.
В таблице 7 приведен состав и объем фосфолипидов липопротеинов плазмы крови.
Таблица 7. Состав и объем фосфолипидов липопротеинов плазмы крови (%)
Классы фосфолипидов | ЛОНП | ЛНП | ЛВП | ||
ФХ | 76,2 ± 1,6 | 77,1 ± 2,1 | 66,0 ± 0,2 | 79,2 ± 2,91 | 67,3 ± 3,8 |
СМ | 13,1 ± 0,4 | 16,2 ± 0,1* | 29,2 ± 0,6 | 13,5 ± 0,21 | 15,6 ± 0,1 |
ФЭ | 4,7 ± 0,2 | 3,6 ± 0,4 | 4,8 ± 0,2** | 2,3 ± 2,19 | - |
ФС | 0,13 ± 0,03 | 0,7 ± 0,1 | - | 0,06 ± 0,02*** | - |
ФИ | 0,41 ± 0,04 | 0,4 ± 0,1 | - | 2,81 ± 0,04 | - |
ЛизоФХ | 3,2 ± 0,1 | 2,1 ± 0,1 | - | 0,14 ± 0,08 | - |
КЛ + ФГ | 0,42 ± 0,04 | 0,77 ± 0,08 | - | 0,4 ± 0,06*** | - |
Примечание
* Значение РЛНП достоверно по отношению к РЛОНП и РЛВП (Subbaich P.V., 1997). ** Данные для ФЭ приведены вместе с таковыми для плазмалогеном. *** Данные для ФС приведены по работе H. Deguchi е! al., 2000. - Измерения не проводились.
Между тем, стойкие различия по составу фосфолипидов в липопротеинах плазмы крови определить не всегда возможно по причине постоянно идущих в кровяном русле процессов их преобразования, транспорта (перехода) индивидуальных апопротеинов и липидов с участием фосфолипид-транспортного белка и непрерывного обмена фосфолипидов между липопротеинами и мембранами клеток.
К редким примерам генетических нарушений состава липопротеинов плазмы крови относятся два заболевания.
• Абеталипопротеинемия. Ген локализован в коротком плече хромосомы 2 (2р24). Болезнь характеризуется отсутствием транспорта триглицеридов из тонкого кишечника и печени. В результате развивается дефицит ЛНП.
• Семейная форма болезни танжьерских островов. Характеризуется дефицитом ЛПВ.
Жирные кислоты клеточных мембран
Жирные кислоты клеточных мембран - это цепи длинных молекул, содержащих от 10-12 до 26-28 атомов углерода. Они соединены с аминоспиртом с помощью карбоксильной (СО) и гидроксильной (НО) групп. Всего насчитывается около 800 типов жирных кислот. Однако в составе природных липидов всех тканей их количество не превышает 20, а фактически встречаются только 10-12 типов.
Например, в мембранах человека выделены не менее 10 типов ФХ, включающего разные жирнокислотные остатки: пальмитиновый, арахидоновый, линолевый, стеариновый и др.
Выделяют ненасыщенные, насыщенные и полинасыщенные жирные кислоты (ПНЖК). Они присутствуют в каждой мембране или липопротеине.
Показателем ненасыщенности молекул жирных кислот является наличие в их структуре двух двойных связей и более (таких кислот больше 50%). От этого показателя зависят положение, поведение и свойства фосфолипидов в мембране. В ходе метаболизма в молекулу жирных кислот могут быть введены либо дополнительные двойные связи (с помощью фермента - десатуразы), либо может быть увеличена длина углеводородного скелета на 2 атома углерода (благодаря ферменту - элонгазе).
К основным ненасыщенным жирным кислотам (моноеновым) в фосфолипидах относятся олеиновая и в меньшем объеме - пальмитолеиновая кислоты.
Основные насыщенные жирные кислоты - это пальмитиновая и стеариновая; редко встречаются миристиновая, каприловая и лигноцериновая.
Все клетки способны синтезировать основные насыщенные жирные кислоты de novo.
Полинасыщанные жирные кислоты (ПНЖК) в природе, как правило, встречаются в виде линолевой, альфа-линоленовой и докозагексаеновой кислот. Причем первые две кислоты совместно с арахидоновой кислотой - это эссенциальные жирные кислоты, которые поддерживают жидкостность и проницаемость мембран. По мере увеличения массы тела в мембранах клеток сердца, мышц, печени и почек снижается содержание ПНЖК (особенно докозагексаеновой кислоты), что отражает степень метаболической активности этих клеток.
Существует определенная избирательность в предпочтении отдельных жирных кислот отдельными фосфолипидами, например, для ФИ, ФХ и ФС - это пальмитиновая, для СМ - докозагексаеновая, для ФС и КЛ - линоленовая, для ФИ - арахидоновая. Такая избирательность связана с их участием в разных метаболических процессах. Например, сочетание пальмитиновой и олеиновой кислот характерно для ФХ (21% всего состава), тогда как в молекулах ФЭ, ФИ и ФС у тромбоцитов они не встречаются. Сочетание арахидоновой и стеари-
новой кислот преобладает в молекулах ФЭ и ФИ (до 71%).
Арахидоновая кислота служит источником тромбоксана и неравномерно распределена между ФЛ, что говорит о селективности на начальном этапе образования тромбоксана и простагландинов (в первую очередь гидролизуются ФЭ и ФИ).
Мембранные белки
Если образно представить структуру липидного бислоя мембраны как «море липидов», то плавающие в нем белки - это «айсберги». Их называют интегральными белками , они частично погружены в мембрану или пронизывают ее насквозь (см. рис. 28). У такого белка один конец полипептидной цепи гидрофобный («боится» воды), другой - гидрофильный (взаимодействует с водой), т.е. это амфипатичные белки. При этом последовательности гидрофобных остатков аминокислот формируют сами пронизывающие мембрану структуры, а последовательности гидрофильных остатков аминокислот образуют функциональные домены по обе стороны мембраны, создавая не строго фиксированную мозаичную структуру, а своеобразные кластеры (семейства) из участков поверхностного монослоя.
С интегральными белками связаны реакция клетки на внешние и внутренние воздействия, а также регуляция потоков ионов через мембрану извне и внутрь клетки. Причем для транспорта определенных ионов существует свой определенный белок.
Имеются также ассоциированные с мембранами глобулярные белки. Они расположены либо на полярной поверхности мембраны, либо частично погружены в ее внутренний слой с обеих сторон. Такие белки удерживаются на поверхности мембраны с помощью нековалентных связей, и поэтому их нередко называют периферическими белками.
В целом среди белковых компонентов мембраны выделены белкитранспортеры, белки-рецепторы и белки-регуляторы. Например, в последнем случае это регуляторы синтеза, состава и расположения индивидуальных фосфолипидов, регуляторы (с помощью фосфорилазы А) деацилирования (ремоделирования) и трансбислойного перемещения отдельных молекул фосфолипидов (механизм «флипфлоп», или перемещение между наружным и внутренним монослоями мембран).
Все встроенные в мембрану белки придают ей функциональную гибкость и способность участвовать в различных клеточных эффектах. Кроме встраивающихся, выделены белки, которые в мембрану не
встраиваются, а удерживаются на ее поверхности за счет слабых связей и взаимодействий, благодаря так называемому заякориванию.
Особый класс белков - это адгезионные белки: кадхенрин, тканеспецифические белки, обеспечивающие объединение однотипных клеток в ткани, например молекулы NSAMS или соединительные белки нервных клеток.
Другие компоненты клеточных мембран
Наряду с липидами и белками существуют следующие компоненты клеточных мембран.
Гликопротеины. К выступающей над клеточной мембраной части молекулы белка присоединяются короткие или иногда разветвленные цепочки сахаров. На их концах находятся молекулы сиаловой (нейраминовой) кислоты - именно такой комплекс регулирует прохождение потоков ионов через мембрану.
Этот комплекс или гликопротеидный рецептор (см. ниже) обладает сродством к лигандам и поэтому способен их распознавать. К ним относятся: антигены, медиаторы, рецепторы других клеток, бактерии, вирусы и прочие чужеродные вещества.
Гликолипиды. Это производные церамида (близки по форме к ацилглицерину), лишенные фосфорильных групп, но содержащие углеводные компоненты. Поэтому их также называют гликосфинголипидами. Состав мембранных гликолипидов или гликолипидных рецепторов (см. ниже) представлен остатками жирных кислот, образующих их гидрофобный хвост.
Холестерин. Холестерин необходим как для пролиферации (см. главу 9), так и для функционирования клеток.
Конфигурация молекулы холестерина позволяет ему включаться в состав мембран, так как он представляет собой вытянутую молекулу с жестким стероидным ядром и гибкой углеводной цепью. Эта молекула амфипатична. На одном из концов молекулы холестерина находится полярная гидроксильная группа (НО), которая встраивается между молекулами липидов в зоне полярных головок мембранного бислоя.
В жидкокристаллическом состоянии холестерин повышает степень упорядоченной ориентации и снижает скорость движения углеводородных цепей фосфолипидов. Благодаря этому он активно участвует в «текучести» мембраны, препятствуя плотной упаковке углеводородных цепей и снижая температуру плавления липидов. Внешне это выглядит как «расплывание области фазового перехода»
(см. выше). Без холестерина фазовый переход происходит в узком температурном интервале.
Содержание холестерина в клеточных мембранах колеблется. Например, мембрана эритроцита содержит 25% холестерина, но его крайне мало в мембранах митохондрий и вообще нет в бактериальных мембранах.
Изменение биосинтеза холестерина - это самостоятельный путь регуляции физического состояния мембран. Он опосредован высвобождающимся из ЭР транскрипционным фактором (SREBP). Выход этого фактора блокируется холестерином, а при дефиците холестерина «блок» снимается и включается процесс транскрипции оксиметилглютарил-СоА-редуктазы. Важность участия холестерина в обменных процессах в организме можно проследить на примере морфологических, молекулярных (генетических) и популяционногенетических доказательств. Например, хорошо изучен механизм проникновения ЛНП в сосудистую стенку путем пиноцитоза или через межэпителиальные щели с последующей сорбцией холестерина гликозоаминогликанами, отложением в виде атеросклеротических пятен, полосок и бляшек и пролиферацией гладкомышечных клеток.
Показано также образование атеросклеротических бляшек в культуре клеток при добавлении в питательную среду бета-липопротеинов. К генетическим доказательствам относятся гомо- и гетерозиготные формы семейной гиперхолестеринемии (см. главу 22), при которых наблюдается высокое содержание холестерина в плазме крови.
По признанию специалистов, моногенно наследуемая семейная гиперхолестеринемия - это природная модель «галопирующего атеросклероза».
Наконец, к популяционным доказательствам значения холестерина относится наличие двух народностей (вегетарианцы в Новой Гвинее и мясоеды в Африке), не болеющих атеросклерозом, у которых уровень плазменного холестерина не превышает 5,2 ммоль/л.
Вместе с тем, у американских эмигрантов японского происхождения частота и тяжесть атеросклероза значительно выше, чем у японцев, проживающих на исторической родине, что связывают с диетическими различиями.
Принципиальными являются данные о возможности процесса регрессии атеросклероза при голодании организма, исключении атерогенной диеты и экстракции холестерина из плазмы крови
(гемосорбция). Эти данные были получены группой российских ученых, сформулировавших учение о холестеринозе и выделивших три периода в развитии клетки и организма, связанных с обменом холестерина.
• Первый период - это интенсивный рост и пролиферация клеток, сопровождающиеся высокой потребностью в холестерине, который идет в основном на строительство клеточных мембран (физиологическая или «оправданная», гиперхолестеринемия).
• Второй период - это самый длительный, наиболее активный период жизни организма (см. главу 11). В этом периоде, как правило, наблюдается устойчивое равновесие между поступлением (синтезом) и расходом холестерина, участвующего в процессах образования жирных кислот и стероидных гормонов, необходимых для поддержания активной физической и психической (трудовой и интеллектуальной) деятельности и репродуктивной функции.
• Третий период - это наступление инволюции клеток и организма, когда функции второго периода постепенно утрачиваются и происходит медленное накопление холестерина в плазматических мембранах сначала в отдельных клеточных ассоциациях, затем отдельных органах и целом организме.
Вода (см. также начало главы 7). Роль воды как компонента клеточных мембран заключается в ее способности к удержанию на поверхности мембран, что обеспечивается с помощью водородных связей, возникающих между полярными головками фосфолипидов и молекулами воды, - это стабилизирует бислой, покрывающий снаружи молекулы фосфолипидов и белков.
Функции клеточных мембран
Клеточные мембраны обеспечивают не менее 12 клеточных функций. Среди них следующие.
• Определение границ компартментов цитоплазмы (отграничение их от окружающей внутриклеточной среды), что позволяет им сохранять автономность внутреннего устройства клетки и независимость работы ее многочисленных функциональных систем, изолированно осуществлять и регулировать реакции метаболизма. При этом внутриклеточные ферменты либо катализируют трансмембранные реакции, либо участвуют в реакциях на поверхности наружной мембраны, обеспечивая их избирательность и эффективность.
• Поддержание высоких концентраций (градиентов) необходимых химических соединений и ограничение поступления чужеродных соединений, что обеспечивает необходимый электрический потенциал и позволяет запасать энергию в отдельных органеллах и клетке в целом. Например, мембрана как барьер препятствует утечке из клетки компонентов цитоплазмы и сильно полярных молекул. Вместе с тем через мембрану как проводник легко диффундируют слабо полярные молекулы малого размера.
• Обеспечение активного и пассивного трансмембранного транспорта веществ и соединений с помощью транспортных белков и других молекул. Следует отметить, что только из уже перечисленных функций видно, что мембраны активно участвуют в обеспечении основных клеточных процессов, и в случае разрушения мембран может наступить гибель клеток.
• Определение природы всех внутренних и внешних связей клетки с помощью специфических рецепторных белков.
• Сохранение содержимого клетки и обеспечение межклеточного взаимодействия. Мембраны сохраняют молекулярное содержимое клетки и не позволяют ему свободно проходить через них.
• Объединение однотипных клеток в ткани с помощью мембранных белков - кадхенринов (см. выше), что обеспечивает участие клеток в тканеспецифической дифференцировке.
• Всасывание и последующий перенос компонентов биологического топлива (см. главу 7).
• Преобразование сигналов (рецепторная функция). Как известно, молекулярная жизнь - это непрерывные биохимические преобразования, в ходе которых клетки должны работать согласованно в соответствии с нуждами всего организма, о которых они узнают с помощью сигналов в виде поступающих к ним химических веществ (нейромедиаторы, гормоны, другие факторы). Одни сигналы проникают внутрь клетки, другие - нет. В любом случае, они связываются на поверхности клетки со специализированными белками-рецепторами, которые отвечают за прием и передачу сигналов, благодаря цепи последовательных реакций, происходящих внутри клетки. Именно это имеется в виду, когда говорят о клеточных мембранах как преобразователях сигналов.
• Участие в клеточном делении. Мембраны участвуют в делении благодаря возможности слияния и разделения липидных бислоев, чему способствуют появление и ликвидация перетяжек в ходе митоза.
• Участие в эндоцитозе, или процессе поглощения клеткой частиц или крупных молекул, которые не могут пройти через мембрану, и тогда вокруг них образуется вакуоль или пузырек (отщепившаяся часть плазматической мембраны).
• Участие в экзоцитозе или процессе перемещения вакуоли наружу клетки, выводящем ее содержимое во внеклеточную окружающую среду, например, секреция ферментов поджелудочной железы.
• Обеспечение работы натриево-калиевого насоса или Na+/ K+ - АТРазы. Этот насос выкачивает натрий и закачивает калий благодаря гидролизу АТР до АDР + Pj. Данный фермент имеет две субъединицы (альфа и бета), взаимодействующие с лигандами (см. главу 8). Изменения в натриево-калиевом насосе происходят при фосфорилировании белка, который изменяет свое сродство к ионам натрия и калия. При этом натрий связывается и выходит в межклеточное пространство. Одновременно на внешней поверхности мембраны связывается калий и также происходит фосфорилирование белка, которое возвращает его в первоначальное состояние, и поэтому ионы калия поступают в цитоплазму. Один цикл работы такого насоса сопровождается встречным переносом трех ионов Na+ (внутри) и двух ионов K+ (снаружи) + АТР + Н2О - три иона Na+ (снаружи) + два иона K+ (внутри) + АDР + Pj + H+. Следует отметить, что работа насоса угнетается сердечными гликозидами (например, наперстянкой), что увеличивает концентрацию ионов Na+ в миокардиоцитах и тем самым уменьшает его градиент, что ведет к увеличению содержания в цитоплазме ионов Са2+ и стимулирует сокращение сердечной мышцы.
• Обеспечение механизма унипорта или переноса любых растворимых веществ с одной стороны мембраны на другую. В таком переносе участвуют транспортные белки, например фермент
Са2+-АТРаза из ЭР.
• Участие в механизме симпорта или совместного переноса молекул через мембрану. Выделен специфический белок, отвечающий за симпорт ионов Na+ и глюкозы в строго эквимолярных количествах. В результате глюкоза движется внутрь клетки против своего концентрационного градиента за счет градиента ионов Na+. Так как градиент возникает за счет гидролиза АТР, то сам АТР косвенно служит движущей силой для транспорта глюкозы. Подобный механизм работает при всасывании аминокислот и глюкозы в кишечнике с использованием для симпорта других
• белков. Следует отметить, что белков для совместного переноса разных молекул через мембраны очень много. Их транспорт может быть пассивным, когда движущей силой служит градиент концентрации. Однако молекулы могут двигаться против собственного градиента (активный транспорт). Участие в механизме антипорта или жестко связанного противотока. Этот механизм характерен, например, для действия сердечных гликозидов, в ходе которого наружу выкачиваются ионы Са2+, а также молекулы, транспортируемые против собственного концентрационного градиента за счет энергии натриевого градиента, который, в свою очередь, создается благодаря гидролизу
АТР.
На рис. 31 приведено участие митохондриальной мембраны в механизмах антипорта и симпорта.
Клеточные рецепторы
Для приема сигналов в клетке имеются связанные с мембраной специфические структуры - рецепторы. Рецептор - это участок мембраны с олигосахаридной цепочкой. Если эта цепочка связана с молекулой мембранного белка, то это гликопротеидный рецептор, если с молекулой липида - гликолипидный рецептор.
Гликопротеидный рецептор - это молекула глобулярного или спирального белка, погруженная в оба слоя мембраны, поэтому рецептор может в ней «плавать», перемещаться и соединяться с другими рецепторами, образуя агрегаты, концентрирующиеся на одном из
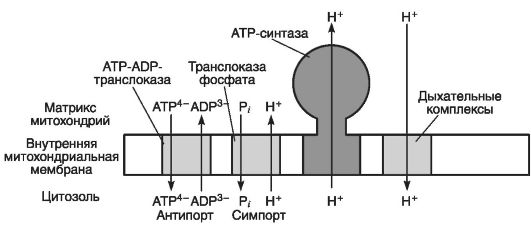 Рис. 31. Участие митохондриальной мембраны в механизмах антипорта и симпорта (по Эллиот В., Эллиот Д., 2002)
Рис. 31. Участие митохондриальной мембраны в механизмах антипорта и симпорта (по Эллиот В., Эллиот Д., 2002)
полюсов клетки с образованием рецепторного поля - так называемый киппинг-эффект.
Гликолипидный рецептор (ганглиозид, сульфатид) связан с одним поверхностным слоем мембраны и замещает в нем одну молекулу фосфолипидов. Он может «сбрасываться» в межмембранное пространство, поступать в кровяное русло, а из него снова встраиваться в мембрану.
Молекулы ганглиозидов находятся в мембране в стационарном состоянии, но постоянно перестраиваются в зависимости от рецепторной функции, переходя из рецепторов одной формы в таковые другой формы. При этом олигосахаридная цепочка видоизменяется по составу, количеству и последовательности соединения сахаров - это система легких рецепторов. Их образование резко возрастает при дендритном спраунинге (см. главу 12). Наоборот, гликопротеидные рецепторы - это система тяжелых (тугоподвижных) рецепторов.
При внешней сигнализации существует определенная обратная зависимость между числом рецепторов на мембране и готовностью клетки к образованию межклеточных контактов, а также ее способностью к пролиферации: чем больше число рецепторов и межклеточных контактов, тем ниже потенциал пролиферации клеток (см. главу 8 и 25).
Следует отметить, что клетки злокачественных опухолей, обладающие высоким потенциалом пролиферации, «сбрасывают» свои рецепторы (ганглиозиды), уменьшая тем самым способность к контактам с другими клетками.
Вместе с тем, нейрон никогда не перерождается в злокачественную клетку, так как способен к образованию до 10 тыс. синаптических контактов.
В силу способности к растворению в воде большинство сигнальных молекул связываются только с внешними рецепторами. Их меньшая часть (стероидные гормоны, тироксин и оксид азота) растворяются в липидах и поэтому поступают прямо в клетку через липидный бислой мембраны, где связываются с внутренними рецепторами. Такая регуляция получила название рецептор-опосредованной сигнализации (см. главы 7, 8 и 11).
Межклеточные соединения
К межклеточным соединениям (промежуткам) относятся плотные белковые конструкции, состоящие из соединительной ткани. Они не пропускают через себя биологическое топливо, в них нет латеральных
движений белков. Зато есть особые щелевые контакты или контактные поры - это белки, способные пропускать молекулы АТР и сигнальные молекулы. В этих контактах также содержатся адгезионные белки, необходимые для объединения однотипных клеток в ткани.