Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 11 ЗАЩИТНЫЕ И ВОССТАНОВИТЕЛЬНЫЕ СИСТЕМЫ КЛЕТКИ
Общие данные
Как сказано в главе 6, клеточные мембраны в условиях нормального функционирования обеспечивают множество функций. Плазматическая и внутриклеточные мембраны либо функционируют самостоятельно - в основном за счет интегральных белков, находящихся по обе стороны мембраны, либо участвуют в сопряженных с ними функциях клетки (за счет контроля со стороны рецепторных и транспортных белков), а также функциях структурных компонентов клетки, сформированных из других белков, липидов, сахаров и микроэлементов.
В целом повреждения клетки сопровождаются нарушениями происходящих в ней генетических, биохимических и физико-химических процессов и связаны с преобразованиями макро- и микромолекул, включая: полинуклеотиды и нуклеотиды, полипептиды и пептиды, полисахариды и моносахариды, липиды и их компоненты (фосфолипиды, сфинголипиды, жирные кислоты, холестерин), а также перемещениями ионов металлов и других химических соединений, свободных радикалов, электронов, атомных и аттомолярных структур.
Именно поэтому столь велико значение для клетки ее защитных и восстановительных (репарационных) ферментных систем при разного рода повреждениях. Рассмотрим эти системы с учетом приведенных в предыдущих главах пособия данных о структурной организации, причинах и механизмах повреждения клетки, а также данных об основных формах клеточной гибели.
ЗАЩИТНЫЕ И ВОССТАНОВИТЕЛЬНЫЕ
ФЕРМЕНТНЫЕ СИСТЕМЫ ОРГАНИЗМА
Как известно, к главным защитным и восстановительным системам организма относятся нервная, эндокринная и иммунная системы (см. главы 13-15). Затем (по значимости) следуют детоксицирующие системы внутренних органов (печень, селезенка, почки),
тканей (кожа и слизистые оболочки) и, наконец, клеточные защитные и восстановительные системы, включая: системы цитохрома Р450, глутатионзависимых ферментов, супероксиддисмутазы (СОД), каталазы, плазмалогенов, пероксидаз и фосфолипаз (в частности, фосфолипидные) и другие системы, связанные с восстановлением структурообразующих компонентов клетки. Отдельного внимания заслуживают многочисленные системы репарации ДНК и пока еще мало изученные ферментные защитные системы биологических жидкостей организма (крови, лимфы, церебральной жидкости, желудочного и кишечного сока). Все эти защитные и восстановительные системы организма основаны на действии генов, объединенных в единые генные сети (см. главу 2).
В первую очередь рассмотрим наиболее известные защитные системы клетки.
Системы детоксикации ксенобиотиков
Системы инактивации (детоксикации) чужеродных для организма веществ или ксенобиотиков, контролируются генами внешней среды, кодирующими синтез многочисленных белков-ферментов, метаболизирующих (деградирующих и детоксицирующих) и выводящих из организма ксенобиотики.
Мутации генов детоксикации нередко обусловливают наследственную предрасположенность к тяжелым заболеваниям, поражающим различные системы организма и отдельные органы. Например, хорошо изучена связь клинических проявлений муковисцидоза, обусловленного мажорной мутацией (CFTR), с состоянием генов системы детоксикации. Основными проявлениями этого заболевания являются тяжелые хронические обтурационные пневмонии, приводящие к преждевременной смерти больных детей, как правило, не доживающих до двадцатилетнего возраста. В свою очередь, мутации самих генов детоксикации нередко предрасполагают к развитию заболеваний легких: бронхиальной астмы, хронического обтурационного бронхита, рака, эмфиземы и другой легочной патологии.
Было также высказано предположение, что и аллельные варианты генов детоксикации могут влиять на клинические проявления при муковисцидозе. Это предположение было подтверждено в работе М.А. Бакай и соавт. (1999). Оказалось, что больные со смешанной формой и тяжелым течением муковисцидоза либо были гомозиготами по «нулевому» аллелю гена глутатионтрансферазы М1 (GSTM1 0/0) -
ферменту второй фазы детоксикации ксенобиотиков, либо имели медленно экспрессирующийся S-аллель гена первой фазы детоксикации - микросомальной эпоксигидролазы (mEPXH).
В этой работе было также отмечено достоверное преобладание гомозиготного состояния по аллелю S (или S/S) в гене mEPXH у больных с хроническими респираторными заболеваниями.
Учитывая четкую корреляцию легочной патологии с «медленным» аллелем гена mEPXH и «нулевым» аллелем гена GSTM1, сделали вывод, что у больных с муковисцидозом, связанным с соответствующим распределением аллелей (mEPXH S/S и GSTM1), легочная патология развивается наиболее часто и протекает особенно неблагоприятно. По этой причине авторы посчитали целесообразным выяснение не только характера мутации в гене муковисцидоза, но и определение у больных случаев носительства неблагоприятных аллелей генов mEPXH S/S и GSTM1. Иными словами, в этой работе показано четкое влияние некоторых аллелей генов DQA1 локуса HLA на тяжесть течения муковисцидоза и хронических респираторных заболеваний.
Детоксикция с помощью цитохрома Р450
В мембранах ЭР клеток печени, а также других органов и тканей находятся монооксидазные ферментные системы, обеспечивающие биосинтетические и дезинтоксикационные процессы по нейтрализации (трансформации) ксенобиотиков (лекарств и техногенных соединений - прокарциногенов) в первой фазе детоксикации. Эти системы сформированы из гиперсемейств цитохромов Р450 или монооксигеназ, которые метаболизируют широкий спектр экзогенных и эндогенных субстратов.
По состоянию на январь 2006 г., в геномах человека и животных было идентифицировано 1174 белка и соответствующее количество кодирующих их генов, относящихся к цитохромам Р450 (Лисица А.В., 2007). При этом количество известных химических соединений, взаимодействующих с ферментами системы цитохрома Р450, насчитывало 1708, включая 1223 субстрата, 115 индукторов и 484 ингибитора.
В организме человека выделено около 50 форм цитохромов Р450 (Helson, 1998), участвующих в реакции монооксигеназного катализа и играющих в ней ведущую роль благодаря способности избирательно связываться с субстратом. Функционирование цитохромов Р450 определяется их взаимодействием с белками-партнерами. Ферменты цитохрома Р450 замыкают цепочку переноса электронов и используют полученные редокс-эквиваленты для окисления субстрата. В каче-
стве белков-партнеров цитохрома Р450 могут быть либо несколько белков, например НАДФН-цитохром Р450-редуктаза и цитохром Ь5, а также адренодоксин-редуктаза и адренодоксин, либо это может быть только один белок, например редуктаза.
В числе генов человека, кодирующих ферменты цитохрома Р450, был выделен ген ароматазы CYP19, ответственный за синтез фермента, катализирующего переход андрогенов в эстрогены в разных тканях, включая ткань грудной железы. Этот ген имеет 11 полиморфизмов ДНК, связанных с усилением или ослаблением его экспрессии (аллели: ТТТА7, ТТТА11 ТТТА12 и др).
Другой ген этой системы - ген CYP1A1 кодирует цитохром Р4501А1, который метаболизирует углеводороды табачного дыма и также имеет свои полиморфизмы (Т623С, А4489G).
Ген CYP17 кодирует цитохром Р450с17альфа. Он участвует в биосинтезе половых стероидов.
Следует отметить, что локализация цитохромов Р450 в микросомах печени обеспечивает получение ими электронов от белкафлавопротеина (цитохром Р450-редуктаза), а сами цитохромы Р450 являются активной формой белка-гемопротеина. При этом стабильность данного белка обеспечивается липидным бислоем мембраны, состоящим из фосфатидилхолина или смеси микросомальных фосфолипидов.
Установлено, что при взаимодействии цитохрома Р450 с ксенобиотиком происходит его инактивация, в ходе которой он переходит из активной формы цитохрома Р420 в неактивную. Кроме того, данная неактивная форма может быть получена при инкубации изолированных микросом печени при температуре 37 °С.
В реакциях «ксенобиотик-цитохром Р450» все ксенобиотики выступают в роли либо экзогенных субстратов (канцерогены, лекарства, пищевые добавки, токсины, яды), либо эндогенных субстратов (жирные кислоты, простагландины, стероиды, холестерин). Молекулы этих субстратов связываются в мембранах ЭР с молекулами цитохрома Р450, вызывают цепь реакций ПОЛ и другие изменения. При этом они могут действовать как прямо, так и опосредованно. Во втором случае среди них выделяют облигатные и факультативные ксенобиотики.
Облигатные ксенобиотики, например фенобарбитал, оказывают прямое токсическое действие на гепатоциты (эффект зависит от дозы), что ведет к гепатомегалии за счет индукции печеночных ферментов.
В свою очередь, ксенобиотик кортизон вызывает жировую инфильтрацию печени или стеатоз в результате трансформации в высокотоксичные промежуточные соединения, например салицилаты и полициклические углеводороды.
Кроме того, прямое действие облигатных ксенобиотиков или их метаболитов вызывает нарушение обмена билирубина (на всех этапах его синтеза от гема до экскреции в желчные протоки), дилатацию синусоидов и окклюзию вен печени, что ведет к некрозу и реже к апоптозу клеток печени.
Факультативные ксенобиотики вызывают иммуно-опосредованные реакции, лежащие в основе идиосинкразии или непереносимости соединений, например аллергические реакции на лекарства.
Молекула самого цитохрома Р450 поражается за счет двух механизмов повреждения: непосредственно белка свободными радикалами и липидного окружения белка в мембране.
В целом механизм детоксикации ксенобиотиков в печени с участием цитохрома Р450 включает три фазы.
• Первая фаза - контакт ксенобиотика с ферментами ЭР (микросомальная фракция гепатоцитов), монооксигеназами, цитохром с-редуктазами, восстановленным НАДФ (в качестве кофактора) и цитохромом Р450. Во время контакта происходит модификация ксенобиотика с формированием (освобождением) функциональных групп.
• Вторая фаза - биотрансформация или конъюгация (соединение) молекулы ксенобиотика с эндогенными молекулами при участии двух ферментов: UDP-глюкуронилтрансферазы и глутатион-S- трансферазы, обеспечивающих детоксикацию или снижение токсичности с ускоренным выведением ксенобиотика (см. ниже). В этой фазе микросомальная глутатион^-трансфераза непосредственно связана с молекулой цитохрома Р450, что способствует быстрой инактивации промежуточных продуктов метаболизма или реакционных метаболитов ксенобиотика.
• Третья фаза - активный транспорт и экскреция (эвакуация) трансформированных с помощью цитохрома Р450 продуктов ксенобиотика с желчью и мочой.
Таким образом, инактивация цитохрома Р450 - это показатель повреждения мембран ЭР в печени. Вместе с тем, по скорости инактивации цитохрома Р450 можно судить о восстановлении или репарации поврежденных мембран клетки.
Детоксикация гидроперекисей фосфолипидов
К системе детоксикации гидроперекисей фосфолипидов (LOOH) относятся три глутатионзависимых комплекса ферментов, осуществляющих двухэлектронное восстановление LOOH: глутатионпероксидаза, фосфолипид-пероксид-глутатион-пероксидаза, а также селеннесодержащая глутатион-трансфераза, тип альфа (-SH-S-) или GST-комплекс. Эти ферментные комплексы относятся к антиоксидантам - хинолам (енолам), присутствуют во всех клетках, тканях и органах, осуществляют взаимодействие с витаминами Е, С и убихинолом (кофермент Q) и являются универсальными системами для связывания активных метаболитов. Все три глутатионзависимые антиоксидантные системы относятся к ферментной редокс-системе глутатиона (ФРСГ), которая участвует в ПОЛ и пролиферации иммунокомпетентных клеток. ФРСГ контролирует деление и активность прооксидантов, угнетает свободно-радикальные стадии перекисного окисления, разрушает (нерадикальным путем) перекиси и взаимодействует с неперекисными продуктами перекисного окисления.
Свойства редокс-системы определяются состоянием баланса: «окисление- восстановление» (см. главу 9).
Уровень активности глутатионзависимых ферментов в разных клетках и тканях отражает состояние всей антиоксидантной системы, так как эти ферменты необходимы для защиты от агрессии АФК, цепных свободно-радикальных реакций и усиления процессов
ПОЛ.
Индукция глутатионзависимых ферментов характеризуется «избыточностью» их активности и сбалансированностью по отношению к оксигенации клеток, тканей и органов.
Особая роль принадлежит GST-комплексу, включающему 21 фермент, из которых истинно цитозольными являются 16. Они сгруппированы в 6 подсемейств (классов): альфа, мю, омега, пи, тета и дзета. Каждый класс - это димер, состоящий из двух равных или разных субъединиц (с собственными активными центрами), которые действуют независимо друг от друга. В каждой субъединице 2 домена, связанных короткой линкерной цепочкой из 6 аминокислотных остатков.
Каждый из шести классов ферментов кодируется кластерами генов.
• Класс альфа - кластер генов расположен в локусе 6р12, содержащем гены GSTA1, GSTA2, GSTA3, GSTA4 и GSTA5 и 7 псевдоге-
нов. Гены этого класса участвуют в обмене билирубина, гема и стероидных гормонов. Гены GSTA1 и GSTA2 экспрессируются во всех тканях. Ген GSTA3 выделен из 8-9-недельной плаценты. Ген GSTA5 из тканей не выделен.
• Класс мю - кластер картирован в локусе 1р13.3. Включает 5 генов: ген GSTM1 (представлен тремя аллельными вариантами: А, В и О; экспрессируется в клетках печени и крови); ген GSTM2 (только в мышцах); гены GSTM3 и GSTM4 (тестикулы и мозг); ген GSTM5 (легкие, мозг, сердце, тестикулы), а также 2 псевдогена.
• Класс омега - кластер состоит из двух генов, картированных в локусе 10q25.1. Из них ген GSTO1 кодирует уникальный фермент «домашнего хозяйства«, удаляющий S-тиоловые радикалы, образующиеся в ответ на оксидантный стресс. Второй ген - это GSTO2 (мало изучен). Транскрипты этих генов широко представлены во всех тканях. Максимальная их экспрессия наблюдается в печени, скелетных мышцах и сердце; минимальная экспрессия характерна для легких, мозга и плаценты.
• Класс пи - представлен одним геном GSTP1, картированным в локусе 11q13, и псевдогеном GSTPP, картированным в локусе 12q13-q14. Ген GSTP1 имеет 3 аллельных варианта, связанных с полиморфизмом нуклеотидных последовательностей в кодонах 105 и 114, относящихся к активным центрам ферментов. Этот ген является ингибитором протеинкиназ, участвующих в клеточной пролиферации и апоптозе.
• Класс тета - его кластер включает 2 гена (GSTT1 и GSTT2), картированных в локусе 22q11.23. Ген GSTT1 существует в двух аллельных вариантах (активном и нулевом). Ген GSTT2 мало изучен.
• Класс дзета - представлен одним геном GSTZ1, картированным в локусе 14q24.3. Ген экспрессируется в клетках печени и в меньшей степени - в клетках скелетных мышц и тканей мозга. Участвует в обмене фенилаланина и тирозина.
Следует отметить, что ферменты GST-комплекса, синтезируемые всеми указанными классами генов, функционируют на основе многочисленных механизмов, среди которых:
• каталитическая инактивация ксенобиотика через его соединение с глутатионом или путь замещения по электрофильным атомам углерода (галоген и нитроалканы), азота (тринитроглицерин), серы (тиоцианаты и дисульфиты) и фосфора (метилпаратионин);
• некаталитическая конъюгация (связывание) с субстратом; классическим субстратом считается 1-хлоро-2,4-динитробензол; этот путь также характерен для конъюгации оксиаренов, эпоксидов алкенов, ионов нитрония и карбония, а также свободных радикалов;
• восстановление органических гидроперекисей (липид- и ДНКгидрококсипероксиды) до спиртов через экспрессию активности GSH-пероксидазы или восстановленного глутамина;
• изомеризация простагландинов и стероидов;
• участие в метаболизме других экзогенных соединений.
Восстановленный глутатион (GSH) относится к низкомолекулярным тиолам, доминирующим в большинстве пролиферирующих клеток. Этот трипептид (L-гамма-глутамил-L-цистеинилглицин) участвует в глутамильном цикле и обезвреживает различные токсические соединения путем их преобразования в тиоэфиры (при этом атакуются атомы азота, кислорода, серы и углерода). В ходе дальнейшего метаболизма глутатионовые конъюгаты переходят в меркаптуровые кислоты (меркаптаны) и выводятся из организма (со скоростью около 0,1 ммоль в сутки).
Значение GSH можно проследить у онкологических больных, у которых концентрация свободного глутамина зависит от свойств цитостатиков, которые истощают его запас, вызывая лизис опухолевых клеток. Кроме того, при пролиферации клеток и опухолевом росте снижение концентрации тиолов и дисульфитов зависит от поддержания баланса метаболизма, синтеза глутатионзависимых ферментов и удаления гидроперекисей фосфолипидов.
Детоксикация LOOH протекает по схемам, предусматривающим действие:
• пероксид-Са2+-стимулируемой PLA2 и глутатион-пероксидазы по пути «гидролиз-восстановление-репарация»;
• ФЛ-пероксид-глутатион-пероксидазы и фосфолипазы А2 по пути «восстановление-гидролиз-репарация».
Обе схемы ведут к реацилированию лизофосфолипидов.
Вместе с тем, в условиях дисбаланса между эндогенными оксидантами и антиоксидантами может возникнуть избыток АФК и последующий за ним окислительный стресс. Механизм такого стресса, именуемого «окислительно-стрессорным сигналингом», сопровождает реакции ПОЛ в ответ на угрожающе высокий или низкий уровень оксидантов.
Окислительно-стрессорный сигналинг
С помощью окислительно-стрессорного сигналинга (ОСС) клетка продуцирует избыток антиоксидантов и активирует один или сразу несколько классов ферментов: восстановленный глутатион (см. выше), гемоксигеназу-1, глутатионпероксидазу, каталазу, СОД и ферритин.
Показано, что ОСС стимулирует экспрессию генов, контролирующих апоптоз, цитопротекцию и другие клеточные эффекты.
В ОСС участвуют протеинкиназа С (ПК С),МАРК, гидролазы, а также фосфолипазы С (PL C) и А2(PLA2), активируемые ионами Са2+. Ранними медиаторами этих ферментов служат LOOH (см. выше), считающиеся «миметиками» эффектов факторов роста (TNF-альфа), цитокинов и других агонистов, что указывает на роль оксидантных производных как вторичных мессенджеров (см. главу 8).
Например, оксидантная активация фосфолипаз через высвобождение арахидоновой кислоты инициирует образование эйкозаноидных липидных медиаторов и лизофосфолипидов, выступающих в роли соединений, дающих прямые эффекты либо метаболизирующихся до PAF и других эффекторов.
После действия оксидантов, которые особенно сильно повреждают клеточные мембраны, судьба клетки двояка: либо выживание, либо гибель через апоптоз или некроз - это зависит от выраженности «окислительного стресса». Например, с помощью эндоили экзогенных пероксидов можно запустить апоптоз в лейкемических клетках. Возможен также механизм активации под действием цитозольной фосфолипазы (см. главу 9), влияющей на арахидоноил-фосфолипиды, включающий катализируемое ПКС фосфорилирование фермента и его транслокацию в мембране (через активацию МАРК). Этот механизм мало зависит от Са2+ и, следовательно, включается только при относительно низком уровне ПОЛ.
Система супероксиддисмутазы
Фермент СОД катализирует реакцию взаимодействия двух супероксидных радикалов с образованием перекиси водорода (Н2О2) и молекулярного кислорода (О2). Эта реакция получила название реакции дисмутации (см. главы 6 и 9).
Ген СОД 1 локализован на хромосоме 21, и такая его локализация многократно обсуждалась в литературе для объяснения причин и механизмов развития синдрома Дауна (как тройная доза гена). Однако это не было подтверждено. Оказалось, что в митохондриях нормальных клеток, служащих источником АТФ и АФК, допустимый
уровень последних поддерживается защитной ферментной системой, включающей наряду с СОД еще и цитохромоксидазу, глутатионпероксидазу и некоторые другие ферменты.
Антиоксидантная роль крови
Как отмечено в главах 8 и 9, в регуляции активности мембранных ферментов важную роль играют механизмы сигнализации. Большая часть этих механизмов реализуется через кровь, которая обладает собственной антиоксидазной активностью и непосредственно контактирует со структурными компонентами стенок кровеносных сосудов, в основном представленных эндотелиальными клетками.
Регуляцию активности ферментов с помощью структурнофункциональных элементов крови можно продемонстрировать на примере «тканевого фактора», или трансмембранного гликопротеина, обнаруженного при атеросклерозе в адвентиции кровеносных сосудов и внутренней области атеросклеротической бляшки. Этот фактор экспрессируется на мембранах моноцитов и макрофагов и участвует в воспалении и дестабилизации бляшки; он особенно чувствителен к действию ингибиторов, синтезируемых эндотелиальными клетками кровеносных сосудов в ходе сигнализации.
Важно отметить, что через кровь транспортируется кислород, осуществляется бактерицидное действие фагоцитов, перемещаются ионы металлов переменной валентности, являющиеся катализаторами или ингибиторами процессов окисления-восстановления. Вместе с тем, кровь в определенной мере является лимитирующим звеном системы антиоксидантной защиты, так как по сравнению с внутриклеточным содержимым в ней мало высокомолекулярных антиоксидантов, что способствует усилению окислительных реакций и не благоприятствует восстановительным реакциям.
Механизмы восстановления клеточных мембран
Биохимиками давно высказано предположение об адаптации клеточных мембран к повреждениям. В пользу этого, например, свидетельствуют данные о восстановительной работе ферментов за счет реакций, осуществляемых ПК С, МАРК и митохондриальными АТР-зависимыми кальциевыми каналами. В частности, открытие кальциевых каналов в мембранах митохондрий вызывает их деполяризацию, снижая избыточное накопление Са2+.
Именно такой механизм способствует регенерации клеток при инфаркте миокарда.
Экспериментальным путем показано восстановление активности ферментов in vitro поврежденных мембран микросом в печени крыс при добавлении к ним ФХ или смеси ФХ и лизоФХ. Добавление этих фосфолипидов восстанавливало активность глюкозо-6-фосфатазы, Са2+-, Na+-, K+-ATPаз, стеароил-КоА-десатуразы, липазы, UDP- глюкуронилтрансферазы, фенилаланингидроксилазы, цитохром Ь5 -редуктазы.
Схожие результаты были получены для сфингомиелиназ мозга, бета-оксибутиратдегидрогеназы митохондрий сердца и ацетилхолинэстеразы эритроцитов быка.
В связи с этими данными было предположено, что восстановление фосфолипидами активности мембранных белков носит неспецифический характер, так как у большинства ферментов нет потребности в определенных типах фосфолипидов, и поэтому восстановительную функцию могут выполнять для них разные типы последних (или их смеси).
Интересен уже сам факт участия мембранных фосфолипидов в восстановлении активности белков-ферментов. Вместе с тем, для сохранения (а возможно, и для восстановления) активности мембранных ферментов важным является жирнокислотный состав фосфолипидов, добавляемых в клетки. Например, это было показано для Са2+-АТРазы саркоплазматического ретикулума, когда замена собственных фосфолипидов на ДПФХ (фосфатидилхолин с высоким содержанием насыщенных жирных кислот) в 8 раз снижала активность по сравнению с частично делипидированным ферментом, а при замене собственных фосфолипидов на диолеил-ФХ скорость реакции, наоборот, резко возрастала.
Кроме того, отмечено значение высокой подвижности углеводородных цепей фосфолипидов для восстановления активности ферментов и наличия на мембранах определенного поверхностного заряда.
Схожие результаты были получены в отношении:
• кислых фосфолипидов (ФС, ФИ и ФК) при их действии на фосфатазу миозина гортани;
• анионных фосфолипидов (ФС) - при действии на 5-монодегидрогеназу плаценты человека.
Таким образом, в настоящее время можно говорить о бесконечном многообразии и значении еще не открытых, но, по-видимому, реально существующих механизмов восстановления структурных и функциональных нарушений клеточных мембран.
Ингибиторы мутагенеза
Как сказано в главе 5, мутагенез - это процесс образования мутаций в наследственном материале, индуцированный действием различных мутагенных факторов.
Еще в середине XX в. А. Новик и Л. Сцилард показали, что апуриновые рибонуклеозиды снижают уровень спонтанных и индуцированных мутаций у E. coli, что позволило им выделить новый класс химических соединений, получивших название антимутагенов.
В конце XX в. С де Флора и С. Рэмел разделили антимутагены на два класса: внеклеточные (дисмутагены) и внутриклеточные.
Внеклеточные антимутагены включают три подгруппы.
• Ингибиторы поглощения антимутагенов и их предшественников (ароматические аминокислоты, жирные кислоты и др.). Они препятствуют проникновению и ускоряют выведение из организма мутагенов.
• Ингибиторы эндогенного формирования мутагенов (аскорбиновая кислота, токоферол, фенолы, ферментированные молочные продукты). Они предотвращают или тормозят реакции нитрозирования или изменяют внутрикишечную флору.
• Дезактиваторы мутагенов в результате физических и/или химических реакций (антиоксиданты, вещества, поддерживающие уровень рН в биологических жидкостях, и тиолы).
Внутриклеточные антимутагены также включают три подгруппы.
• Модуляторы метаболизма (тиолы и фенолы). Они ускоряют переход мутагенов в клетки, не являющиеся мишенями, и индуцируют механизм детоксикации.
• Инактиваторы реакционноспособных молекул. Они взаимодействуют с электрофилами, защищают нуклеофильные участки ДНК, улавливают кислородные радикалы.
• Модуляторы репликации и репарации ДНК (арсенит натрия, ванилин, ингибиторы протеаз, кумарин, тиолы, хлорид кобальта). Они увеличивают точность репликации, повышают эффективность репарации, ингибируют ошибки репарации.
Как следует из этой классификации, одно и то же соединение может относиться к нескольким группам, например тиолы.
Помимо внеклеточных и внутриклеточных антимутагенов, Б. Ставрик выделил в 1992 г. из разных типов пищевых продуктов более 25 содержащихся в них антимутагенов или химиопревентеров. В эту группу вошли витамины, жирные кислоты, кальций, кароти-
ноиды, кумарины, пищевые волокна, растительные кислоты, селен, флавоноиды и хлорофилл.
К антимутагенам растительного происхождения относятся зеленый перец, капуста, листья мяты, лук, семена растений, яблоки.
Действие антимутагенов специфично: оно проявляется с высокой избирательностью и зависит от дозы. При этом одни антимутагены могут быть ингибиторами мутагенов, оказывать противоположное комутагенное действие, либо их действие может вообще не проявиться. В частности, к таким антимутагенам относятся витамины С,
В2 и Е.
Не исключена возможность защиты с помощью антимутагенов клеток одних тканей с одновременным потенцированием мутагеннных эффектов в клетках других тканей.
В целом вопрос об эффективности экзогенных и эндогенных корректоров мутагенеза до сих пор остается открытым.
В связи с этим перейдем к рассмотрению более известных и широко обсуждаемых в научной и учебной литературе восстановительных механизмов в поврежденной клетке.
Восстановление структуры ДНК с помощью механизмов репарации
Как известно, клетки обладают восстановительной способностью или способностью исправлять и устранять (репарировать) повреждения молекулы ДНК, восстанавливая ее исходную структуру. Благодаря этому лишь ограниченное число мутаций сохраняется в процессе репликации, транскрипции и трансляции.
Вместе с тем, если мутация не распознана, извращенная информация транскрибируется в мРНК и экспрессируется в форме неполноценного протеина. Последствия такого события для клетки часто бывают несущественными, но иногда они крайне нежелательны, и это зависит от функций, выполняемых неполноценным протеином.
В настоящее время хорошо изучены многочисленные репарационные механизмы как известные со времен классической генетики (фотореактивация, репарация тиминовых димеров; эксцизионная репарация; SOS-репарация), так и открытые в последние годы (см. ниже).
Обобщив особенности этих механизмов, можно заключить, что репарация разного рода повреждений в молекуле ДНК идет в несколько этапов:
• первый этап - это идентификация повреждения и определение его типа;
• второй этап - это активация ферментов, которые или напрямую преобразуют повреждение до исходного состояния, или (если прямое восстановление невозможно) вырезают поврежденный участок, формируя брешь.
В последнем случае прибавляются еще два этапа:
• третий этап - это синтез нового участка молекулы ДНК (взамен поврежденного);
• четвертый этап - это встраивание нового участка в брешь.
Фотореактивация или репарация тиминовых димеров
Под действием УФО в молекуле ДНК может произойти ковалентное сшивание двух рядом стоящих пиримидинов (двух тиминов), находящихся в разных нитях молекулы. При этом образуются тиминовые димеры (циклобутановое кольцо), блокирующие репликацию ДНК. В ходе репарации тиминовых димеров «узнающий» их фермент - фотолиаза соединяется с ними, образуя единый комплекс. УФО активирует этот фермент, и циклобутановое кольцо разрывается с образованием двух отдельно стоящих тиминов. Данный механизм А. Кельнер в 1949 г. назвал фотореактивацией.
Дезаминирование (метилирование) и репарация ошибочно спаренных оснований
Как сказано в главе 6, в ходе дезаминирования аденин превращается в гипоксантин, который образует водородные связи с цитозином. Гуанин преобразуется в ксантин, который образует водородные связи с тимином. Тимин не может быть дезаминирован (единственное азотистое основание в ДНК). При метаболизме цитозина образуется урацил. Если процессы дезаминирования этих азотистых оснований нарушаются, в молекуле ДНК появляются ошибочно или неправильно спаренные основания. Так, вместо АТ-пар в цепи ДНК образуются ГТ-пары, а вместо ГЦ-пар образуются ГА-пары - это ошибки спаривания. Они устраняются с помощью двух механизмов: ГТ-мисмэтчрепарации и ГА-мисмэтч-репарации соответственно. Участниками этих механизмов репарации могут быть:
• белковые продукты четырех генов семейства Mut: H, L, S и U;
• белки-хеликазы;
• ДНК-полимеразы, обладающие свойством «делать шаг назад» после постановки очередного нуклеотида в растущую нить ДНК и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной цепи ДНК, т.е. способные корректиро-
вать ошибки спаривания;
• аденозинтрифосфатазы (ATP);
• дезоксинуклеотидфосфатазы (dNTP).
Следует отметить, что механизмы мисмэтч-репарации оперируют на дочерней нити и производят замену некомплементарных оснований только в ней.
Вскоре после окончания репликации ферменты-метилазы присоединяют метильные группы к аденинам в последовательностях ГАТЦ (гуанин-аденин-тимин-цитозин).
Во время следующей репликации нити ДНК оказываются различимыми: материнская нить содержит метилированные аденины, а в дочерних нитях до окончания репликации аденины еще не метилированы. Их метилирование начнется только после окончания репликации. Поэтому пока аденины не метилированы, клетки должны успеть «отрепарировать» мисмэтчи. Репарация неправильно спаренных оснований может происходить в ходе дезаминирования ДНК, когда фермент N-гликозилаза узнает такое основание, разрывает ковалентную N-гликозидную связь и удаляет его. Кроме того, мисмэтч-репарация может проводиться в ходе метилирования ДНК (см. главу 7).
Если образование классических «уотсон-криковских» пар оснований вообще затруднено, то во время репликации могут происходить ошибки спаривания (ошибки репликации) и также возникают мисмэтчи. Для их устранения привлекаются уже другие ферменты: сначала эндонуклеаза разрывает одну цепь ДНК в местах, где не успели сформироваться АТили ГЦ-пары, затем фосфодиэстераза отщепляет в этих местах разрывов те сахаро-фосфатные группы (АП-сайты), к которым не присоединены основания. Появившиеся в цепочке молекулы бреши (размером в один нуклеотид) застраиваются ДНК-полимеразой I, после чего фермент-лигаза сшивает концы ДНК, восстанавливая исходное состояние молекулы.
Алкилирование и репарация О6-алкилированного (метилированного) гуанина и О4-алкилированного тимина
Алкилирование - это добавление алкильных боковых групп (метиловые, этиловые, пропиловые или бутиловые) в пуриновые или пиримидиновые основания молекулы ДНК под действием ряда химических мутагенов (алкилирующих агентов). Например, метилнитрозо-гуанит алкилирует (метилирует) гуанин, присоединяя к нему метиловую группу.
В ходе репарации О6-алкилированного гуанина (О6меГ) метиловая группа отщепляется от гуанина благодаря кислороду, связанному с шестым атомом, и в этой точке происходит восстановление структуры ДНК. Этот механизм был открыт И.А. Рапопортом в 1944 г.
Как установлено, в ходе алкилирования в клетках синтезируются белки - метилтрансферазы, которые захватывают у модифицированного гуанина его метиловые группы, восстанавливая исходную структуру ДНК. Причем метилтрансферазы, захватившие такие группы, уже не могут от них избавиться, что свидетельствует о том, что они не относятся к классу ферментов, которые не изменяются в ходе многочисленных реакций. Кроме этого механизма выделена репарация О4-алкилированного тимина (О4-алТ). Следовательно, если допустить, что для каждого акта прямой репарации ДНК нужны новые белковые молекулы, то в случае повреждения алкилирующими агентами клетка вынуждена организовать их синтез в соотношении: одна молекула на одно повреждение. Поэтому процессы образования повреждений ДНК и их репарации взаимосвязаны. Как правило, внутри клетки накапливаются тысячи таких молекул. Например, за один клеточный цикл, протекающий у кишечной палочки в течение 30 мин, может накопиться около 3000 метилтрансфераз, способных нейтрализовать 3000 повреждений ДНК.
Апуринизация и эксцизионная репарация
Апуринизация - это образование АП-сайтов в нуклеотидной цепи
ДНК.
Как известно, каждая соматическая клетка при функционировании теряет за сутки примерно 10 тыс. пуринов и пиримидинов, и в результате в ее молекуле ДНК образуются апуриновые сайты или сахарофосфатные группы без оснований (АП-сайты). Если бы АП-сайты не исправлялись, то произошла бы катастрофа.
В ходе устранения АП-сайтов ферменты-инсертазы разрывают ковалентную N-гликозидную связь между основанием и дезоксирибозой, и после этого осуществляется прямая вставка пуринов. Этот механизм открыт Т. Линдалом в 1979 г.
Причины апуринизации: повышение температуры, изменение рН, ионизирующее излучение.
Если клетка не справляется с повреждениями оснований и нуклеотидов в молекуле ДНК с помощью перечисленных выше восстановительных механизмов, тогда в дело вступают более сложные механизмы репарации, одним из которых служит эксцизионная репарация,
осуществляемая путем вырезания (эксцизии) поврежденного основания в нуклеотиде или более протяженного участка молекулы.
Эксцизионная репарация поврежденных оснований происходит с помощью ДНК-гликозилаз, которые узнают повреждения оснований, возникающие при метилировании, окислении, восстановлении, дезаминировании, присоединении формидных групп и других реакциях.
Семейство ДНК-гликозилаз включает 11 типов ферментов, соединяющихся с субстратами или поврежденными мишенями: ura- (содержит урацил); hmu-(оксиметилурацил); 5-tС-(метилцитозин); Hx-(гипоксантин); 3ntA-, тип I (3-метиладенин) и тип II (содержит метиладенин, 7-метилгуанин или 3-метилгуанин); FaPy-(остатки формидопиримидинов или 8-оксигуанина); 5, 6-HT или эндонуклеаза III (5,6 гидратированные остатки тимина); PD-(димеры пиримидинов); тиминовый мисмэтч (содержит некомплементарную ГТ-пару оснований); субстрат mutY (содержит некомплементарную ГА-пару).
ДНК-гликозилазы присоединяются к повреждениям, рвут гликозидные связи между модифицированным основанием и дезоксирибозой, за счет чего образуются АП-сайты.
Образовавшиеся АП-сайты распознаются ферментом АП-эндонуклеазой (способна разорвать цепь внутри молекулы ДНК или РНК). После появления разрыва вступает в действие фермент фосфодиэстераза, которая отщепляет от ДНК ту сахарофосфатную группу, к которой уже не присоединено основание.
В результате появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной цепи ДНК расположен неповрежденный нуклеотид, и уже другой фермент (ДНКполимераза I) вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному 3' ОН-концу. Этот конец нити ДНК и ранее образовавшийся при разрыве нити 5'-конец соединяются между собой под действием полинуклеотидлигазы. После этого вся структура считается полностью восстановленной: удалено неправильное основание, вырезан сахарофосфат, к которому было присоединено это основание, брешь заполнена правильным нуклеотидом и однонитевой разрыв восстановлен.
Эксцизионная репарация поврежденных нуклеотидов
Механизм эксцизионной репарации является более сложным и более энергозатратным механизмом, связанным с вырезанием не просто поврежденного основания, а значительного участка цепи
ДНК перед повреждением и после него. У кишечной палочки такую репарацию осуществляет мультиферментный комплекс из эндонуклеаз, кодируемых тремя генами ультрафиолетовой репарации или генами uvr (A, B и С) и называемый комплексом - эксцинуклеаза (рис. 50). Этот механизм был описан Р. Сетлоу и В.Н. Сойфером в 1970 г. Он включает следующие этапы:
• распознавание повреждения белками uvr A и B;
• изгиб молекулы ДНК и изменение конформации белка uvr В;
• внесение двух однонитевых надрезов ДНК с обеих сторон от повреждения с помощью белков uvr В и С;
• расплетение ДНК в участке между двумя надрезами с помощью белка uvr D (хеликаза II);
• отсоединение содержащего дефект фрагмента длиной 12 нуклеотидов (12-мер) с образованием бреши, при этом расходуется энергия одной молекулы АТФ;
• застройка образовавшейся бреши с помощью ДНК-полимеразы;
• соединение свободных концов сахарофосфатного остова ДНК с помощью ДНК-лигазы.
Аналогичный механизм существует у человека. Вместе с тем, у него комплекс эксцинуклеазы состоит из 17 белков, застройка бреши
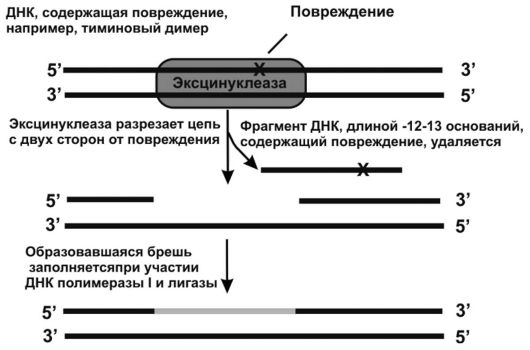 Рис. 50. Механизм эксцизионной репарации у E.Coli. (по Эллиот В., Эллиот Д., 2002)
Рис. 50. Механизм эксцизионной репарации у E.Coli. (по Эллиот В., Эллиот Д., 2002)
идет с участием ДНК-полимераз ОиЕ, а участок, вырезаемый из поврежденной цепи ДНК, имеет длину 29 нуклеотидов (вместо 12 у кишечной палочки).
Репарация поврежденных нуклеотидов включает мисмэтчрепарацию или репарацию, некомплементарных (неканонических) или не «уотсон-криковских» пар оснований - это так называемая репарация ошибочно спаренных оснований (см. выше).
Репарация однонитевых и двухнитевых разрывов ДНК
Помимо рассмотренных выше механизмов репарации известны механизмы восстановления однонитевых разрывов (разрывы связей между основаниями в одной нити молекулы ДНК) и двухнитевых разрывов (разрывы связей между основаниями в двух нитях молекулы ДНК).
Репарация однонитевых разрывов ДНК
Репарация однонитевых разрывов ДНК - эта прямая репарация. Она вызывается в ответ на действие ионизируюущей радиации и обеспечивается последовательным действием ферментов: 3'-фосфодиэстеразы, ДНК-полимеразы-b и ДНК-лигазы (ДНКполинуклеотидлигазы). Восстановление такого разрыва идет с использованием в качестве матрицы неповрежденной комплементарной цепочки ДНК.
Репарация двухнитевых разрывов ДНК
Двухнитевые разрывы молекулы ДНК являются самым опасным для клетки типом повреждений ДНК. Они, как правило, приводят к развитию генетической нестабильности, появлению точковых мутаций и хромосомных аберраций и последующей гибели клеток.
Известны два механизма репарации двухнитевых разрывов ДНК: негомологичное воссоединение разорванных концов и гомологичная рекомбинация.
Негомологичное воссоединение разорванных концов ДНК
Негомологичное воссоединение разорванных концов ДНК происходит между концами молекулы, которые имеют негомологичные последовательности нуклеотидов разной длины или очень короткие гомологичные участки. Этот механизм репарации не безошибочен и часто служит источником точковых мутаций, так как восстановление исходной структуры молекулы ДНК возможно только при воссоединении концов одной и той же нити. Если же это условие не соблюдается, то формируются хромосомные аберрации: делеции, дупликации,
инверсии, инсерции и транслокации (см. главу 5). У млекопитающих негомологичное воссоединение происходит с участием белка Rad50, родственных ему белков, факторов Ku, ДНК-лигазы IV и факторов сайленсинга.
Гомологичная рекомбинация
Механизм гомологичной рекомбинации был изучен у Drosophila melanogaster. Предполагается, что он должен существовать в клетках человека, однако убедительных доказательств этого до сих пор не получено. Считается, что в ходе гомологичной рекомбинации на одной из нитей ДНК образуется брешь, по размеру равная удаляемому у бактерий элементу (Р-элемент). Восстановление бреши происходит с участием копии P-элемента, находящейся на сестринской хроматиде и используемой в качестве матрицы для репаративного синтеза.
Вместе с тем, во время репликации возможно образование одноцепочечной бреши напротив нерепарированного участка, и эта ситуация не может быть исправлена безошибочно без привлечения другой молекулы ДНК.
Поэтому данный механизм обеспечивает восстановление только в тех случаях, когда повреждены обе цепи ДНК.
Белки Альбертса и их роль в репликации и репарации ДНК
В 1968 г. были обнаружены белки Альбертса, или белки SSB, принимающие участие в репарации ДНК. Эти белки благодаря организации их третичной структуры обладают способностью электростатически связываться с ДНК. Белки SSB содержат кластер положительно заряженных аминокислотных остатков, но при этом их общий заряд остается отрицательным, благодаря чему они имеют повышенное сродство к одноцепочечной ДНК.
Если при нарушениях вторичной структуры двухцепочечной ДНК в отдельных нитях ее спирали образуются «расплавленные участки», то белки Альбертса связываются с ними, легко на них садятся и их «выпрямляют». При этом белки SSB, сидящие на комплементарных цепях молекулы, не дают им «схлопнуться», так как за счет электростатических взаимодействий они имеют мощный отрицательный заряд, проявляя сродство друг к другу и покрывая «расплавленный участок» сплошным слоем - это стехиометрическое количество белка. Иными словами, эти белки не денатурируют молекулу ДНК, а лишь фиксируют ее одноцепочечное состояние.
Участие белков SSB в репликации молекулы ДНК абсолютно необходимо для клетки: они удерживают в репликативной вилке в одноцепочечном состоянии обе матричные нити, защищая каждую нить от действия нуклеаз и избирательно стимулируя работу ДНКполимеразы (РНК-полимераза не использует одноцепочечную ДНК, покрытую SSB).
Таким образом, роль белков SSB в репарации одно- и двухнитевых разрывов ДНК сегодня вполне доказана.
Пострепликативная (рекомбинационная) репарация ДНК
В 1968 г. У. Рапп и П. Ховард-Фландерс обнаружили у обработанных УФО бактерий пострепликативную репарацию или рекомбинационную репарацию матричной нити ДНК, в которой содержалось множество невырезанных димеров тимина, и в момент, когда ДНКполимераза, ведущая репликацию, доходила до первого димера, она «застывала» в этой точке на 10 с, затем перебиралась за димер тимина (каким-то непонятным образом) и возобновляла синтез позади дефекта до тех пор, пока не «натыкалась» на очередной димер. Таким образом, участки дочерней нити содержали бреши (неудвоенные при синтезе ДНК), а в участках матричной нити напротив брешей сохранялись незалеченные дефекты. Затем следовала пострепликативная репарация поврежденных участков, в которой принимали участие белки rec A, лигазы и ДНК-полимеразы. Этот механизм напоминал механизм рекомбинации: сначала молекула белка rec A присоединялась к зоне бреши, где под его контролем происходила рекомбинация, в ходе которой участок комплементарной цепи сестринской нити переносился в зону бреши, брешь застраивалась в ходе репликативного синтеза, и лигаза соединяла концы новой и старой нитей молекулы.
SOS-репарация ДНК
SOS-репарация ДНК - это последняя возможность для ДНК клетки, которая подошла к репликации, имея повреждения, не устраненные с помощью всех перечисленных выше механизмов репарации. В таком случае клетка может погибнуть, так как репликация на первом же неустраненном повреждении может «застопориться».
Вместе с тем, клетка имеет предназначенный для таких целей крайне рискованный механизм, получивший название SOS-репарации ДНК. Этот механизм был впервые обнаружен в 1953 г. Дж. Уэйглом и
в 1974 г. назван М. Радманом W-реактивацией (возможность для димеров тимина «дожить» до следующей репликации). В ходе механизма SOS-репарации индуцируется синтез белков, присоединяющихся к ДНК-полимеразному комплексу и «загрубляющих» его работу таким образом, что подпорченный комплекс становится способным строить дочернюю нить ДНК напротив дефектных звеньев матричной нити, и при этом на дочерней нити появляется много ошибок (мутаций). В результате клетка спасается от гибели на данном этапе и может обеспечить митоз, хотя будут ошибки и высокий риск гибели клетки.
Следует отметить, что перечисленные выше механизмы репарации молекулы ДНК относятся в основном к достижениям классической генетики. Вместе с тем, в последние десятилетия благодаря достижениям международной научной программы «Геном человека» (см. главу 1) общий список механизмов репарации ДНК был существенно дополнен другими ранее малоизвестными и новыми механизмами.
Восстановление молекулы ДНК с помощью механизмов, открытых в последние годы
Механизм репарации с участием фермента поли-АДФ-рибозаполимеразы
Белок-фермент поли-АДФ-рибоза-полимераза (ПАРП) относится к одному из ядерных факторов, первым распознающим повреждение ДНК. Этот фактор управляет запуском механизма репарации ДНК в живых клетках, начиная с места повреждения ДНК, и входит в мультипротеиновый комплекс (МР-комплекс), включающий еще фактор XRCC1, ДНК-лигазу III и бета-ДНК-полимеразу.
Присутствие ПАРП в этом комплексе обеспечивает направление всех участников репарации ДНК к сайтам повреждения ДНК in vivo, что облегчает восстановление молекулы ДНК.
Входящий в состав МР-комплекса фактор XRCC1 условно относится к «строительным лесам», индивидуально взаимодействующим с каждым компонентом комплекса в качестве опорной молекулярной структуры. С тех пор, как было обнаружено полиАДФ-рибозилирование этого фактора in vitro, было предположено, что ПАРП способен регулировать активность МР-комплекса путем модифицирования XRCO-белка in vivo, что нарушает его взаимодействие с другими компонентами комплекса. В пользу такого предположения свидетельствовали данные, что сверхэкспрессия фактора XRCC1 подавляет активность ПАРП in vivo.
В настоящее время эта гипотеза продолжает изучаться; ее подтверждают данные, что входящая в МП-комплекс ДНК-лигаза III ингибирует активность ПАРП in vitro, когда ее количество превышает количество ПАРП.
Модель репарации с антирекомбинационным эффектом фермента поли-АДФ-рибоза-полимеразы
В последние годы предложена модель репарации ДНК с антирекомбинационным эффектом ПАРП (Satoh and Lindahl, 1992). Согласно этой модели, ПАРП взаимодействует с разрывами ДНК и совместно с реакциями поли-АДФ-рибозилирования соседних белков специфически защищает концы ДНК от действия нуклеаз и/ или блокирует процесс рекомбинации. Это подтверждается на примере экспериментальных животных, дефицитных по гену ПАРП. Показано, что отсутствие ПАРП стимулирует процесс рекомбинации и ведет к увеличению у них частоты образования лимфом. Кроме того, ПАРП может «рекрутировать» факторы репарации ДНК путем модификации хроматиновых белков.
Репарация ДНК с участием метилтрансфераз
При помощи поддерживающих ферментов цитозин-ДНКметилтрансфераз (М-таз) можно проводить de novo метилирование остатков цитозина в ДНК с образованием 5-метилцитозина (5-mC), а также метилирование олигонуклеотидов, содержащих ошибочно спаренные основания.
Репарация ДНК с участием хеликаз
Среди ферментов, участвующих в репарации ДНК, большое внимание уделяется группе ДНК-хеликаз (хилаз). Это филогенетически устойчивые ферменты, способные разделять цепи молекулы ДНК, переводя ее из нативного состояния в одноцепочечное. Хеликазы участвуют во всех фундаментальных генетических процессах с разделением родительских цепей молекулы ДНК или основанных на таком разделении процессах: репликации, транскрипции, рекомбинации, репарации, сегрегации хромосом, процессинга и сплайсинга пре-мРНК, транспорта мРНК в цитоплазму и ее трансляции на рибосомах (см. главы 2 и 3). В ходе этих процессов хилазы обеспечивают доступ к открываемым ими одноцепочечным участкам молекулы ДНК для действия других ферментов. Хилазы отличаются друг от друга направлениями активности (3' - 5' и 5' - 3') цепи ДНК, предпочтительным сродством с 3'- и 5'-концами цепи ДНК, сродством с кофакторами - нуклеотидтрифосфатами. Эти энергозависимые фер-
менты расходуют энергию, образующуюся при гидролизе нуклеотид- 5'-трифосфатов (обычно это АТФ), и действуют в присутствии ионов Mg2+. При проведении какого-либо генетического процесса хилазы, как правило, объединяются в комплексы.
По сродству к субстрату хилазы делятся на группы: ДНК-хеликазы, РНК-хеликазы и хеликазы, работающие на гибридных молекулах РНК/РНК. Первые участвуют в инициации транскрипции, рекомбинации, репарации и сегрегации хромосом. Вторые участвуют в биогенезе рибосом, транскрипции мРНК, сплайсинге пре-мРНК, созревании и транспорте мРНК в цитоплазму и ее трансляции на рибосомах.
Хилазы классифицируются по активности (способности двигаться вдоль молекулы ДНК, разделяя ее на отдельные цепи), наличию 7 специфических мотивов последовательностей аминокислот, присущих всему семейству хилаз, но не обязательных для отдельных из них. Эти мотивы обозначаются цифрами: I, Ia, II, III, IV, V и VI (они обеспечивают связи хилаз с ДНК и координацию движения во время катализа). И хотя эти мотивы специфичны для хилаз, они также обнаруживаются у белков, использующих нуклеотидтрифосфаты в качестве кофактора (подобно хилазам). Мутации этих мотивов вызывают дефицит АТФ-зависимой активности хилаз. Наряду с хилазами выделены белки с мотивами, не обладающие хилазной активностью. Их также оказалось 7, и они получили название белков-претендентов в хилазы. Полагают, что такие белки должны также участвовать в регуляции внутриклеточных генетических процессов.
Кроме того, были выделены 2 механизма перемещения хилаз с разной скоростью по нуклеотидной цепи молекулы ДНК: активно катящаяся модель и постепенно скользящая модель.
Первый механизм осуществляется димером ДНК-хеликазы, который за один цикл (поворот молекулы) разъединяет определенное число н.п.
Второй механизм осуществляется мономером ДНК-хеликазы, движущимся с определенной скоростью.
Количество и свойства генов, кодирующих хеликазы в геноме человека, окончательно не определены, но некоторые гены хорошо изучены. Это гены хеликаз, входящие в семейства TFIIH и RecQ. Причем первое семейство является основным транскрипционным фактором, состоящим из девяти субъединиц, включающих две хилазы (XPB и XPD), 4 белка (p62, p52, p44 и p34), САК-комплекс, акти-
вирующий киназу (CDK-activating-kinase), и 2 циклина (Н и Cdk7).
TFIIH обладает АТФ-зависимой хеликазной и киназной активностью, за которую отвечают соответственно субъединицы XPB и XPD. Киназная активность обеспечивается еще и комплексом САК.
Показано также, что TFIIH участвует в репарации ДНК («узнает» участок ДНК длиной 20-30 н.п., содержащий повреждение, и вырезает его) и служит фактором транскрипции (взаимодействует с промоторной областью, раскручивая участок ДНК длиной 11-13 н.п. вокруг сайта инициации транскрипции).
Репарация нонсенс-транскриптов мРНК
Примерно одна треть наследственных болезней и многие формы рака обусловлены нонсенс-транскриптами или мутациями сдвига рамки считывания (см. главу 5). В результате этих мутаций возникают ПСК и появляются неполноценные белки.
Вместе с тем в клетках существуют системы, распознающие и разрушающие большинство нонсенс-транскриптов. Две такие (универсальные для эукариот) системы получили название: NMD и SMD (см. главу 7).
Завершая рассмотрение клеточных систем репарации ДНК, следует отметить, что восстановление дефектов, возникающих в молекуле ДНК в результате воздействия на нее мутагенных факторов, является важнейшим свойством всех живых организмов.
Среди увеличивающегося количества механизмов репарации ДНК есть механизмы простые, запускаемые сразу после повреждения молекулы ДНК, и сложные, растянутые во времени и требующие синтеза целого ряда ферментов. К последним относятся механизмы, связанные с разными этапами жизненного цикла клетки, а также спасением клетки в SOS-порядке или порядке введения новых мутаций в молекуле ДНК. Все восстановительные механизмы имеют общие патогенетические особенности и тесно переплетаются с процессами канцерогенеза, мутагенеза, тератогенеза и старения клетки и организма.
БОЛЕЗНИ ГЕНОМА
Болезни генома (генетической нестабильности) представлены во всех областях молекулярной медицины. Еще со времен классической генетики наиболее известными из них считаются болезни репарации
ДНК.
В России в 80-90-е годы XX в. болезни репарации ДНК изучались под названием болезней генетической (хромосомной) нестабильности, что соответствовало их ведущему признаку - повышенной ломкости хромосом.
В настоящее время спектр этих болезней значительно расширен. Наряду с классическими болезнями репарации ДНК, такими, как атаксия-телеангиэктазия (АТ), анемия Фанкони (АФ), пигментная ксеродерма (ПК), прогерия Хатчинсона-Гилфорда (ПРХГ), синдром Блума (СБ), к этому классу принадлежат следующие группы заболеваний:
• аутоиммунные заболевания: системная красная волчанка, склеродермия, ревматоидные артриты и др.;
• наследственные ферментопатии: Кнаппа-Комровера, Леша- Найана, Пендреда и др.;
• хромосомные синдромы: Дауна, Клайнфельтера, Патау, Шерешевского-Тернера и Эдвардса; ретинобластома, обусловленная делецией хромосомы 13 (13q14);
• моногенные болезни: атаксия Фридрейха, болезнь Дарье-Уайта, синдромы Гарднера, базально-клеточного невуса, Марфана, Ротмунда-Томсона, Корнелии де Ланге, тестикулярная феминизация, фотодерматоз и др.;
• полигенные болезни: псориаз, системный склероз и др. Генетическая нестабильность проявляется также у практически
здоровых носителей сбалансированных перестроек хромосом, например, при транслокации робертсоновского типа между хромосомами
14 и 21.
Общими клиническими проявлениями болезней генома служат: выраженные неврологические проявления, снижение продолжительности жизни, симптомы преждевременного старения, повышенная частота развития злокачественных опухолей.
В первую очередь рассмотрим примеры классических болезней генома, или болезней репарации ДНК.
Моногенные болезни, связанные с повышенной фоточувствительностью и нарушением эксцизионной репарации ДНК
Наиболее известным заболеванием этого класса является ПК. Ее частота в популяции составляет 1:40-250 тыс. человек. ПК - это первая болезнь репарации ДНК, описанная у человека. Она гетерогенна: имеет 7 групп комплементации - А, В, С, D, E, F и G. В частности,
группа A широко распространена в Японии, где она составляет примерно 20% от всех больных ПК, и ее связывают с дефектом в системе пострепликативной репарации (ХРта1). Группы комплементации B и C распространены в странах Европы, а группы D, E, F и G - в других странах мира.
Ген ПК группы А локализован в локусе 9q34.1. Его продуктом служит ДНК-связывающий белок, имеющий два мотива типа «цинковые пальцы» (см. главу 8).
Ген ПК группы В картирован в локусе 2q21, его белковым продуктом служит геликаза, входящая в состав TFIIH-фактора транскрипции (см. выше).
Ген ПК группы С картирован на хромосоме 3, он кодирует белок р125. Функция этого белка окончательно не определена, хотя известно, что совместно с белком р58 он участвует в восстановлении репарационной активности.
Ген ПК группы D картирован в локусе 19q13.2-q13.3, его белковый продукт (подобно продукту гена ПК группы В) характеризуется геликазной активностью. Полагают, что оба генных продукта - это две субъединицы одного TFIIH-фактора.
Ген ПК группы F картирован в локусе 16р13.13, он продуцирует эндонуклеазу, надрезающую ДНК с 5'-стороны.
Ген ПК группы G картирован в локусе 13q33 и также продуцирует эндонуклеазу, но надрезающую ДНК уже с противоположной 3 '-стороны.
Основными симптомами этой болезни являются: высокая чувствительность к действию УФО, пигментация, сухость, изъязвление и рубцы кожи. У больных развивается рак кожи и слизистых оболочек (меланомы, карциномы).
В каждом втором-третьем случае выражена неврологическая симпоматика (связана с ранней апоптотической гибелью нейронов).
В последние годы установлено, что 3 из 7 групп комплементации ПК (группы В, D и G) могут проявляться как генокопии другой болезни репарации ДНК - синдрома Коккейна (СК), обусловленного дефектами эндонуклеаз системы эксцизионной репарации.
В подобных случаях у больных ПК можно выделить общие с СК клинические признаки, включая повышенную чувствительность к УФО. Поэтому и диагнозы у таких больных обозначаются как ПКВ/ СК, ПKD/СК, ПKG/СК.
Вместе с тем, СК - это второе заболевание (после ПК), описанное как болезнь эксцизионной репарации. Данный синдром проявляется карликовостью (при нормальном уровне гормона роста), кальцификацией костей черепа, атрофией зрительных нервов, глухотой и ускоренным старением. При этом синдроме выявлены две группы комплементации: А и В. Ген СК группы А локализован в локусе 5р12-р14, он кодирует белок, входящий в состав транскрипционного комплекса TFIIH (cм. выше). Ген СК группы В локализован в локусе 10q11.2, он кодирует белок, имеющий общие последовательности нуклеотидов с фактором, контролирующим транскрипцию и репарацию у E. coli, а у человека он, по-видимому, привлекает белки эксцизионной репарации в район остановившейся транскрипции.
Третья болезнь репарации ДНК - это трихотнодистрофия (ТХД). При этом заболевании гиперчувствительность к УФО проявляется примерно у половины больных.
Болезнь сопровождается повышенной ломкостью волос, что связано с уменьшением концентрации в них серосодержащих белков, имеющих дефицит цистеина.
К основному симптомокомплексу относятся: аномалии развития зубов и кожи, ихтиоз, задержка полового развития, физическая и умственная отсталость, предрасположенность к раку кожи.
В ряде случаев установлено соответствие дефекта репарации ДНК при ТХД дефектам репарации, отмеченным при всех группах комплементации ПК, кроме группы В.
Особенно часто такое соответствие характерно для гена ПК группы D. В связи этим было предположено, что ген ПК D полифункционален и его белковый продукт принимает участие в эксцизионной репарации и транскрипции, зависимой от РНК-полимеразы П. Кроме того, в клетках больных с ТХД производятся не две, а четыре субъединицы фактора транскрипции TFIIH.
Четвертое заболевание, связанное с повышенной фоточувствительностью и нарушенной репарацией ДНК, - это синдром Блума (СБ).
Ген СБ, или ген BLM (Bloom-мутация), картирован в локусе 15q26 рядом с протонкогеном fes. Предполагается, что этот ген имеет ДНК-зависимую АТРазную и ДНК-зависимую геликазную активность, причем с первой связано поддержание стабильности хромосом в соматических клетках, а вторая играет ключевую роль в репарации ДНК.
Симптоматика СБ: пропорциональная пре- и постнатальная задержка роста, гиперили гипопигментация кожи, краснота на
лице в виде «бабочки», предрасположенность к опухолям, высокий уровень спонтанных хромосомных аберраций и СХО.
Моногенные болезни, связанные с двухнитевыми разрывами ДНК при полном отсутствии эксцизионной репарации
Единственный пример заболевания, связанного с двухнитевыми разрывами ДНК при полном отсутствии механизмов эксцизионной репарации, - АТ, или синдром Луи-Бар. Болезнь встречается с частотой 1:40-100 тыс. человек, характеризуется мозжечковой атаксией, телеангиэктазиями, иммунодефицитом, высокой ломкостью хромосом и предрасположенностью к злокачественным опухолям (см. главу 5).
В последние три десятилетия был изучен ряд генетических особенностей этого заболевания. Оказалось, что хромосомы больных с АТ имеют укороченные почти в 3 раза теломеры, они (хромосомы) высоко чувствительны к действию ионизирующей радиации и химических радиомиметиков, что проявляется в увеличении выхода хромосомных нарушений (двухнитевых разрывов) и снижении выживаемости соматических клеток, для которых характерна радиорезистентность синтеза ДНК, что проявляется в отсутствии синтеза белка р53, в норме отвечающего за задержку (остановку) митотического цикла на стадиях G1-S и G2-M, необходимую для репарации повреждений ДНК. Иными словами, клетки больных с АТ «просто не имеют времени» для восстановления нормальной структуры ДНК с помощью механизмов эксцизионной репарации. Поэтому для ликвидации двухнитевых разрывов ДНК в таких клетках используются механизмы пострепликативной репарации.
Моногенные болезни с нарушением эксцизионной репарации вне связи с фоточувствительностью и двухнитевыми разрывами ДНК
К болезням с нарушением эксцизионной репарации вне связи с фоточувствительностью и двухнитевыми разрывами ДНК относятся: анемия Фанкони (АФ) и прогероидные синдромы Хатчинсона- Гилфорда и Вернера.
Анемия Фанкони
АФ - это семейная гипоили апластическая анемия с врожденной недостаточностью гемопоэтического ростка костного мозга, нарушениями пигментации кожи, телеангиэктазиями, БАР и МАР
(см. главу 23), предрасположенностью к миелоидной лейкемии и другой симптоматикой.
Постоянным признаком заболевания служит спонтанная хромосомная нестабильность, выявляемая в клетках костного мозга, кожи и лимфоцитов.
АФ - это гетерогенная болезнь, имеющая 8 групп комплементации (А, В, С, D, E, F , G и H), в том числе для групп А и С гены картированы в локусе 9q22.3, однако их белковые продукты недостаточно изучены. Следует отметить противоречивость данных, относящихся к отсутствию у больных с АФ повышенной фоточувствительности ДНК, хотя такие данные ранее были получены (Higurashi M., Cohen P.E., 1975).
Прогерия Хатчинсона-Гилфорда
ПРХГ - это редко встречающееся заболевание (частота 1:1 млн человек). Продолжительность жизни больных обычно не превышает 15 лет. Ген болезни не локализован.
Основная симптоматика: низкий рост, «птичий профиль» лица, преобладание мозговой части черепа над лицевой, венозная сеть на коже головы и лба, сухая источенная кожа, отсутствие бровей и ресниц, часто тотальная алопеция, дефекты количества и формы зубов, полное отсутствие подкожно-жировой клетчатки, задержка физического, психомоторного и умственного развития; в моче - высокое содержание гиалуроновой кислоты. Больные, как правило, бесплодны.
Причины ранней смерти: инфаркт миокарда с генерализованным атеросклерозом и фиброзом, жировое перерождение тканей мозга и паренхиматозных органов.
В клетках больных ПРХГ установлены дефекты репарации сшивок ДНК-белок, индуцированных химическими соединениями; резко сниженное число Хейфлика и его взаимосвязь с врожденным укорочением теломер.
По аналогии с СК (см. выше) для детской прогерии (ХГ) предполагается аутосомно-рецессивный тип наследования, хотя возможна вновь возникшая аутосомно-доминантная мутация, обусловливающая укорочение теломер.
Синдром Вернера
Синдром Вернера (СВ) или прогерия взрослых, характеризуется преждевременным старением, проявляющимся только после периода половой зрелости организма. Больные рано седеют и лысеют (до 20 лет).
Ген болезни (ген WRN) локализован в локусе 8р12-р21, продуцирует фермент геликазу, но не входит в состав основного транскрипционного комплекса TFIIN. Именно эта особенность отличает СВ от ПК групп В и D и СК группы B, при которых активность геликазы имеет прямое отношение к репарации, связанной с транскрипцией.
Основная симптоматика: «стареющая кожа» (гиперпигментация, гиперкератоз, морщинистость, сухость, телеангиэктазии), глухой голос, изменения внутренних органов, характерные для стареющего организма (атеросклероз сердца и сосудов, катаракта, остеопороз, сахарный диабет; доброкачественные или злокачественные опухоли), в моче - высокое содержание гиалуроновой кислоты. Число Хейфлика резко ограничено не только по количеству делений, но и по продолжительности клеточного цикла (в 3-5 раз ниже нормы). В отличие от ситуации при ПРХГ, при СВ хромосомы больных не имеют укороченных теломер.
Онкологические заболевания, связанные с нарушением репарации
После описания ретинобластомы, обусловленной делецией хромосомы 13 (13q14; см. главы 17 и 25), начались интенсивные исследования роли генных мутаций при наследственно обусловленных формах рака. Было показано, что при многих формах рака генные мутации ведут к нарушению репарации неправильно спаренных оснований, возникающих как ошибки репликации (вследствие небольших делеций или инсерций). Такие мутации аналогичны мутации в гене mutS у E. coli, приводящей к нарушениям репарации неправильно спаренных оснований.
У человека мутация в одной из копий гена MSN2 обусловливает (с высокой вероятностью) развитие семейного неполипозного рака толстого кишечника (HNPCC) и рака эндометрия. Установлено также, что при этих заболеваниях в опухолевых клетках отсутствует вторая копия гена и отмечается крайне высокая частота микросателлитных повторов (в 100 раз выше нормы). Кроме того, у человека выявлены формы рака грудной железы, связанные с генами BRC1 и BRC2, формы болезни Альцгеймера, связанные с четырьмя генами (PS1-PS4) и геном прионного белка, а также другие примеры генокопирования ряда моногенных и полигенных заболеваний, ассоциированных с опухолями (см. главы 17 и 25).