Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 16 ОНТОГЕНЕЗ РЕПРОДУКТИВНОЙ СИСТЕМЫ И ЕГО НАРУШЕНИЯ
Общие данные
Репродуктивный процесс или воспроизводство человека осуществляется многозвеньевой системой репродуктивных органов, которые обеспечивают способность гамет к оплодотворению, зачатие, преимплантацию и имплантацию зиготы, внутриутробное развитие зародыша, эмбриона и плода, детородную функцию женщины, а также подготовку организма новорожденного к встрече с новыми условиями существования в окружающей внешней среде.
Онтогенез репродуктивных органов - это составная часть генетической программы общего развития организма, направленная на обеспечение оптимальных условий для воспроизводства потомства, начиная с формирования гонад и производимых ими гамет, их оплодотворения и кончая рождением здорового ребенка.
В настоящее время идентифицируется общая генная сеть, ответственная за онтогенез и формирование органов репродуктивной системы. В нее входят: 1200 генов, участвующих в развитии матки, 1200 генов простаты, 1200 генов яичек, 500 генов яичников и 39 генов, контролирующих дифференцировку зародышевых клеток. Среди них выделены гены, определяющие направление дифференцировки бипотенциальных клеток либо по мужскому, либо по женскому типу.
Все звенья репродуктивного процесса крайне чувствительны к отрицательному воздействию факторов среды, приводящему к нарушениям репродуктивной функции, мужскому и женскому бесплодию, появлению генетических и негенетических заболеваний.
ОНТОГЕНЕЗ ОРГАНОВ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Ранний онтогенез
Онтогенез репродуктивных органов начинается с появления первичных половых клеток или гоноцитов, которые выявляются уже на
стадии двухнедельного эмбриона. Гоноциты мигрируют из области кишечной эктодермы через энтодерму желточного мешка в область зачатков гонад или половых валиков, где делятся путем митоза, формируя пул будущих зародышевых клеток (вплоть до 32 дня эмбриогенеза). Хронология и динамика дальнейшей дифференцировки гоноцитов зависят от пола развивающегося организма, при этом онтогенез гонад сопряжен с онтогенезом органов мочевыводящей системы и надпочечников, совместно формирующих пол.
В самом начале онтогенеза у трехнедельного эмбриона в области нефрогенного тяжа (производное промежуточной мезодермы) формируется зачаток канальцев первичной почки (предпочки) или пронефрос. На 3-4 нед развития каудальнее канальцев пронефроса (область нефротома) формируется зачаток первичной почки или мезонефрос. К концу 4 нед на вентральной стороне мезонефроса начинают формироваться зачатки гонад, развивающиеся из мезотелия и представляющие собой индифферентные (бипотенциальные) клеточные образования, а пронефротические канальцы (протоки) соединяются с канальцами мезонефроса, которые называются вольфовыми протоками. В свою очередь парамезонефральные, или мюллеровы протоки формируются из участков промежуточной мезодермы, которые обособляются под влиянием вольфова протока.
На дистальном конце каждого из двух вольфовых протоков в зоне их вхождения в клоаку формируются выросты в виде зачатков мочеточников. На 6-8 нед развития они прорастают в промежуточную мезодерму и формируют канальцы метанефроса - это вторичная или окончательная (дефинитивная) почка, образуемая клетками, производными задних частей вольфовых каналов и нефрогенной ткани задней части мезонефроса.
Теперь рассмотрим онтогенез биологического пола человека.
Формирование мужского пола
Формирование мужского пола начинается на 5-6 нед развития эмбриона с преобразований вольфовых протоков и завершается к 5-му месяцу развития плода.
На 6-8 нед развития эмбриона из производных задних частей вольфовых каналов и нефрогенной ткани задней части мезонефроса по верхнему краю первичной почки прорастает мезенхима, формирующая половой тяж (шнур), который разделяется, соединяясь с канальцами первичной почки, впадающими в ее проток, и дает
начало семенным трубочкам семенников. Из вольфовых же протоков формируются выводящие пути. Средняя часть вольфовых протоков удлиняется и преобразуется в выносящие протоки, а из нижней части образуются семенные пузырьки. Верхняя часть протока первичной почки становится придатком семенника (эпидидимис), а нижняя часть протока превращается в выносящий канал. После этого редуцируются (атрофируются) мюллеровы протоки, и от них остаются только верхние концы (морганья гидатида) и нижние концы (мужская маточка). Последняя находится в толще предстательной железы (простаты) у места впадения семявыносящего протока в мочеиспускательный канал. Простата, семенники и куперовы (бульбоуретральные) железы развиваются из эпителия стенки мочеполового синуса (мочеиспускательного канала) под влиянием тестостерона, уровень которого в крови 3-5-мес плода достигает такового в крови половозрелого мужчины, что обеспечивает маскулинизацию половых органов.
Под контролем тестостерона из вольфовых протоков и канальцев верхнего мезонефроса развиваются структуры внутренних мужских половых органов, а при воздействии дигидротестостерона (производное тестостерона) формируются наружные мужские половые органы. Мышечные и соединительнотканные элементы простаты развиваются из мезенхимы, а просветы простаты формируются уже после рождения в пубертатном периоде. Половой член формируется из зачатка головки члена в половом бугорке. При этом половые складки срастаются и образуют кожную часть мошонки, в которую через паховый канал врастают выпячивания брюшины, в которые затем смещаются яички. Смещение яичек в область таза к месту будущих паховых каналов начинается у 12-недельного эмбриона. Оно зависит от действия андрогенов и хорионического гормона и происходит за счет смещения анатомических структур. Яички проходят через паховые каналы и достигают мошонки только на 7-8 мес развития. В случае задержки опускания яичек в мошонку (из-за разных причин, включая генетические) развивается одноили двусторонний крипторхизм.
Формирование женского пола
Формирование женского пола происходит при участии мюллеровых протоков, из которых на 4-5 нед развития образуются зачатки внутренних женских половых органов: матка, фаллопиевы трубы,
верхние две трети влагалища. Канализация влагалища, образование полости, тела и шейки матки происходят только у 4-5-месячного плода путем развития мезенхимы из основания тела первичной почки, что способствует уничтожению свободных концов половых шнуров.
Мозговая часть яичников образуется из остатков тела первичной почки, а из полового валика (зачаток эпителия) продолжается врастание половых шнуров в корковую часть будущих яичников. В результате дальнейшего прорастания эти тяжи делятся на примордиальные фолликулы, каждый из которых состоит из гоноцита, окруженного слоем фолликулярного эпителия, - это резерв для образования в ходе овуляции будущих зрелых ооцитов (около 2 тыс.). Врастание половых тяжей продолжается после рождения девочки (до конца первого года жизни), но новые примордиальные фолликулы уже не образуются.
В конце первого года жизни мезенхима отделяет начало половых шнуров от половых валиков, и этот слой формирует соединительнотканную (белочную) оболочку яичника, поверх которой сохраняются остатки половых валиков в виде неактивного зачаткового эпителия.
Уровни дифференцировки пола и их нарушения
Пол человека тесно связан с особенностями онтогенеза и репродукции. Выделяют 8 уровней дифференцировки пола:
• генетический пол (молекулярный и хромосомный), или пол на уровне генов и хромосом;
• гаметный пол, или морфогенетическая структура мужских и женских гамет;
• гонадный пол, или морфогенетическая структура семенников и яичников;
• гормональный пол, или баланс мужских или женских половых гормонов в организме;
• соматический (морфологический) пол, или антропометрические и морфологические данные о половых органах и вторичных половых признаках;
• психический пол, или психическое и сексуальное самоопределение индивида;
• социальный пол, или определение роли индивида в семье и обществе;
• гражданский пол, или пол, регистрируемый при выдаче паспорта. Его также называют полом воспитания.
При совпадении всех уровней дифференцировки пола и нормализации всех звеньев репродуктивного процесса развивается человек с нормальным биологическим мужским или женским полом, нормальными половыми и генеративными потенциями, половым самосознанием, психосексуальной ориентацией и поведением.
Схема взаимосвязей между разными уровнями дифференцировки пола у человека приведена на рис. 56.
Началом дифференцировки пола следует считать 5 нед эмбриогенеза, когда путем разрастания мезенхимы формируется половой бугорок, потенциально представляющий собой либо зачаток головки полового члена, либо зачаток клитора - это зависит от формирования будущего биологического пола. Примерно с этого времени половые складки преобразовываются либо в мошонку, либо в половые губы. Во втором случае между половым бугорком и половыми складками открывается первичное половое отверстие. Любой уровень дифференцировки пола тесно связан с формированием как нормальной репродуктивной функции, так и ее нарушений, сопровождающихся полным или неполным бесплодием.
Генетический пол
Генный уровень
Генный уровень дифференцировки пола характеризуется экспрессией генов, определяющих направление половой дифференцировки бипотенциальных клеточных образований (см. выше) либо по мужскому, либо по женскому типу. Речь идет о целой генной сети, включающей гены, расположенные как на гоносомах, так и на аутосомах.
По состоянию на конец 2001 г.к генам, контролирующим онтогенез репродуктивных органов и дифференцировку зародышевых клеток, были отнесены 39 генов (Черных В.Б., Курило Л.Ф., 2001). По-видимому, теперь их стало еще больше. Рассмотрим наиболее важные из них.
Несомненно, что центральное место в сети генетического контроля дифференцировки пола по мужскому типу принадлежит гену SRY. Этот однокопийный, не имеющий интронов ген, локализован в дистальной части короткого плеча Y-хромосомы (Yp11.31-32). Он продуцирует фактор детерминации яичек (TDF), обнаруженный также у ХХ-мужчин и XY-женщин.
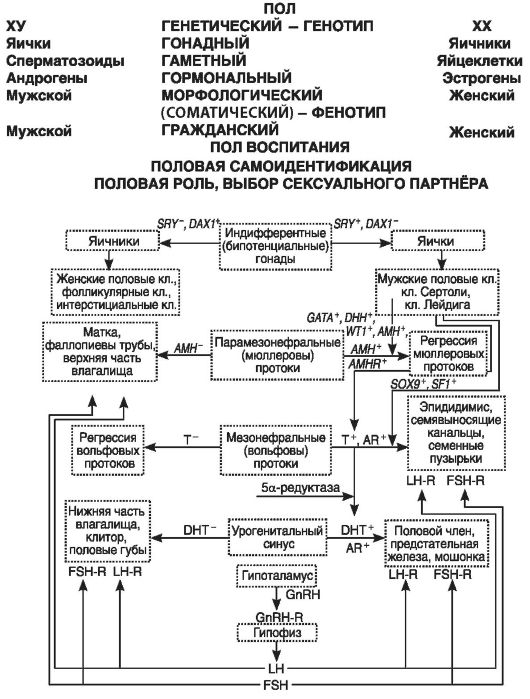 Рис. 56. Схема
взаимосвязей между разными уровнями дифференцировки пола у человека (по
Черных В.Б. и Курило Л.Ф., 2001). Гены, участвующие в дифференнцировке
гонад и онтогенезе половых органов: SRY, SOX9, DAX1, WT1, SF1, GATA4,
DHH, DHT. Гормоны и рецепторы к гормонам: FSH (фолликулостимулирующий
гормон), LH (лютеинизирующий гормон), АМН (антимюллеров гормон), AMHR
(ген рецептора AMHR), T, AR (ген андрогенного рецептора), GnRH (ген
гонадотропин-рилизинг-гормона), GnRH-R (ген рецептора GnRH), LH-R (ген
рецептора LH), FSH-R (ген рецептора FSH). Знаки: «-» и «+» обозначают
отсутствие и наличие эффекта
Рис. 56. Схема
взаимосвязей между разными уровнями дифференцировки пола у человека (по
Черных В.Б. и Курило Л.Ф., 2001). Гены, участвующие в дифференнцировке
гонад и онтогенезе половых органов: SRY, SOX9, DAX1, WT1, SF1, GATA4,
DHH, DHT. Гормоны и рецепторы к гормонам: FSH (фолликулостимулирующий
гормон), LH (лютеинизирующий гормон), АМН (антимюллеров гормон), AMHR
(ген рецептора AMHR), T, AR (ген андрогенного рецептора), GnRH (ген
гонадотропин-рилизинг-гормона), GnRH-R (ген рецептора GnRH), LH-R (ген
рецептора LH), FSH-R (ген рецептора FSH). Знаки: «-» и «+» обозначают
отсутствие и наличие эффекта
Изначально активация гена SRY происходит в клетках Сертоли, продуцирующих антимюллеров гормон, воздействующий на чувствительные к нему клетки Лейдига, что индуцирует развитие семенных канальцев и регрессию мюллеровых протоков в формирующемся мужском организме. В этом гене обнаружено большое количество точковых мутаций, связанных с дизгенезией гонад и/или инверсией пола.
В частности, ген SRY может быть делетирован на Y-хромосоме, а при конъюгации хромосом в профазе первого мейотического деления может транслоцироваться на Х-хромосому или какую-либо аутосому, что также ведет к дисгенезии гонад и/или инверсии пола.
Во втором случае развивается организм XY-женщины, имеющей тяжевидные стрек-гонады при женских наружных гениталиях и феминизации телосложения (см. ниже).
Вместе с тем, вероятно формирование организма ХХ-мужчины, характеризующегося мужским фенотипом при женском кариотипе - это синдром де ля Шапелля (см. ниже). Транслокация гена SRY на Х-хромосому во время мейоза у мужчин встречается с частотой 2% и сопровождается тяжелыми нарушениями сперматогенеза.
В последние годы отмечено, что в процесс половой дифференцировки по мужскому типу вовлечен целый ряд генов, расположенных вне зоны локуса SRY (их несколько десятков). Например, для нормального сперматогенеза требуется не только наличие гонад, дифференцированных по мужскому типу, но и экспрессия генов, контролирующих развитие зародышевых клеток. К таким генам относится ген фактора азооспермии AZF (Yq11), микроделеции которого вызывают нарушения сперматогенеза; при них отмечаются и почти нормальное количество сперматозоидов, и олигозооспермия. Важная роль принадлежит генам, расположенным на Х-хромосоме и аутосомах.
В случае локализации на Х-хромосоме это ген DAX1. Он локализован в Хр21.2-21.3, в так называемом доза-чувствительном локусе инверсии пола (DDS). Считается, что этот ген в норме экспрессируется у мужчин и участвует в контроле развития их семенников и надпочечников, что может привести к адреногенитальному синдрому (АГС). Например, обнаружено, что дупликация DDS-участка ассоциируется с инверсией пола у XY-индивидов, а его утрата сопровождается мужским фенотипом и Х-сцепленной врожденной недостаточностью коры надпочечников. Всего в гене DAX1 выделены три типа мутаций: крупные делеции, однонуклеотидные делеции и замены оснований. Все они ведут к гипоплазии коры надпочечников и гипоплазии яичек вследствие нарушения диффе-
ренцировки стероидогенных клеток в ходе онтогенеза надпочечников и гонад, что проявляется АГС и гипогонадотропным гипогонадизмом из-за дефицита глюкокортикоидов, минералокортикоидов и тестостерона. У таких больных наблюдаются тяжелые нарушения сперматогенеза (вплоть до полного его блока) и дисплазия клеточной структуры яичек. И хотя у больных развиваются вторичные половые признаки, однако часто наблюдается крипторхизм вследствие дефицита тестостерона во время миграции яичек в мошонку.
Другим примером локализации гена на Х-хромосоме служит ген SOX3, принадлежащий к семейству SOX и относящийся к генам раннего развития (см. главу 12).
В случае локализации генов на аутосомах это, во-первых, ген SOX9, родственный гену SRY и содержащий HMG-бокс. Ген локализован на длинном плече хромосомы 17 (17q24-q25). Его мутации вызывают кампомелическую дисплазию, проявляющуюся множественными аномалиями скелета и внутренних органов. Кроме того, мутации гена SOX9 приводят к XY-инверсии пола (больные с женским фенотипом и мужским кариотипом). У таких больных наружные половые органы развиты по женскому типу или имеют двойственное строение, а их дисгенетические гонады могут содержать единичные половые клетки, но чаще представлены стрик-структурами (тяжами).
Следующие гены - это группа генов, регулирующих транскрипцию в ходе дифференцировки клеток, участвующих в онтогенезе гонад. Среди них гены WT1, LIM1, SF1 и GATA4. Причем первые 2 гена участвуют в первичной, а вторые два гена - во вторичной детерминации пола.
Первичная детерминация гонад по полу начинается с 6-недельного возраста эмбриона, а вторичная дифференцировка обусловлена гормонами, которые вырабатываются семенниками и яичниками.
Рассмотрим некоторые из этих генов. В частности, ген WT1, локализованный на коротком плече хромосомы 11 (11р13) и ассоциированный с опухолью Вилмса. Его экспрессия обнаружена в промежуточной мезодерме, дифференцирующейся мезенхиме метанефроса и гонадах. Показана роль этого гена как активатора, коактиватора или даже репрессора транскрипции, необходимого уже на стадии бипотенциальных клеток (до стадии активации гена SRY).
Предполагается, что ген WT1 ответственен за развитие полового бугорка и регулирует выход клеток из целомического эпителия, дающего начало клеткам Сертоли.
Также считается, что мутации гена WT1 могут вызвать инверсию пола при дефиците регуляторных факторов, участвующих в половой дифференцировке. Нередко такие мутации связаны с синдромами, характеризующимися аутосомно-доминантным типом наследования, включая WAGR-синдром, синдром Денис-Дрэша и синдром Фрэзье.
Например, WAGR-синдром обусловлен делецией гена WT1 и сопровождается опухолью Вилмса, аниридией, врожденными пороками развития мочеполовой системы, умственной отсталостью, дисгенезией гонад и предрасположенностью к гонадобластомам.
Синдром Денис-Дрэша обусловлен миссенс-мутацией в гене WT1 и только иногда сочетается с опухолью Вилмса, но для него почти всегда характерны ранняя манифестация тяжелой нефропатии с потерей белка и нарушениями полового развития.
Синдром Фрэзье обусловлен мутацией в донорном сайте сплайсинга экзона 9 гена WT1 и проявляется дисгенезией гонад (женский фенотип при мужском кариотипе), поздним началом нефропатии и очаговым склерозом клубочков почек.
Рассмотрим также ген SF1, локализованный на хромосоме 9 и действующий как активатор (рецептор) транскрипции генов, участвующих в биосинтезе стероидных гормонов. Продукт этого гена активирует синтез тестостерона в клетках Лейдига и регулирует экспрессию ферментов, контролирующих биосинтез стероидных гормонов в надпочечниках. Кроме того, ген SF1 регулирует экспрессию гена DAX1, у которого в промоторе обнаружен SF1-сайт. Предполагается, что в ходе морфогенеза яичников ген DAX1 предотвращает транскрипцию гена SOX9 через репрессию транскрипции гена SF1. И наконец, ген CFTR , известный как ген муковисцидоза, наследуемый по аутосомно-рецессивному типу. Этот ген локализован на длинном плече хромосомы 7 (7q31) и кодирует белок, отвечающий за трансмембранный перенос ионов хлора. Рассмотрение этого гена уместно, так как у мужчин - носителей мутантного аллеля гена CFTR часто наблюдаются двустороннее отсутствие семявыносящих протоков и аномалии придатков яичек, приводящие к обструктивной азооспермии.
Хромосомный уровень
Как известно, яйцеклетка всегда несет одну Х-хромосому, тогда как сперматозоид несет либо одну Х-хромосому, либо одну Y-хромосому (их соотношение примерно одинаковое). Если яйцеклетка оплодот-
воряется сперматозоидом с Х-хромосомой, то у будущего организма формируется женский пол (кариотип: 46, ХХ; содержит две одинаковые гоносомы). Если яйцеклетка оплодотворяется сперматозоидом с Y-хромосомой, то формируется мужской пол (кариотип: 46, XY; содержит две разные гоносомы).
Таким образом, формирование мужского пола в норме зависит от наличия в хромосомном наборе одной Х- и одной Y-хромосомы. В дифференцировке пола решающая роль принадлежит Y-хромосоме. Если ее нет, то дифференцировка пола идет по женскому типу независимо от числа Х-хромосом. В настоящее время на Y-хромосоме идентифицированы 92 гена. Помимо генов, формирующих мужской пол, на длинном плече этой хромосомы локализованы:
• GBY (ген гонадобластомы) или онкоген, инициирующий опухоль в дисгенетичных гонадах, развивающихся при мозаичных формах с кариотипом 45,X/46,XY у лиц с мужским и женским фенотипом;
• GCY (локус контроля роста), находящийся проксимальнее части Yq11; его утрата или нарушение последовательностей обусловливает низкорослость;
• SHOX (локус псевдоаутосомного региона I), участвующий в контроле роста;
• ген белка клеточных мембран или H-Y-антиген гистосовместимости, ранее ошибочно считавшийся главным фактором детерминации пола.
Теперь рассмотрим нарушения генетического пола на хромосомном уровне. Такого рода нарушения, как правило, связаны с неправильным расхождением хромосом в анафазе митоза и профазе мейоза, а также с хромосомными и геномными мутациями, в результате которых вместо наличия двух одинаковых или двух разных гоносом и аутосом могут быть:
• Числовые аномалии хромосом, при которых в кариотипе выявляются одна и более дополнительные гоносомы или аутосомы, отсутствие одной из двух гоносом или их мозаичные варианты. Среди примеров таких нарушений: синдромы Клайнфельтера - полисомия по Х-хромосоме у мужчин (47, XXY), полисомия по Y-хромосоме у мужчин (47, XYY), синдром трипло-Х (полисомия по Х-хромосоме у женщин (47, ХХХ), синдром Шерешевского -Тернера (моносомия по Х-хромосоме у женщин, 45, Х0), мозаичные случаи анеуплоидии по гоносомам; маркерные
• или мини-хромосомы, происходящие от одной из гоносом (ее дериваты), а также синдромы трисомии по аутосомам, в том числе синдром Дауна (47, ХХ,+21), синдром Патау (47, XY,+13) и синдром Эдвардса (47, ХХ,+18)). Структурные аномалии хромосом, при которых в кариотипе выявляется часть одной гоносомы или аутосомы, что определяется как микро- и макроделеции хромосом (потеря отдельных генов и целых участков соответственно). К числу микроделеций относятся: делеция участка длинного плеча Y-хромосомы (локус Yq11) и связанная с ней потеря локуса AZF или фактора азооспермии, а также делеция гена SRY, приводящая к нарушениям сперматогенеза, дифференцировки гонад и инверсии пола XY. В частности, в локусе AZF имеется ряд генов и генных семейств, ответственных за определенные стадии сперматогенеза и фертильность у мужчин. В локусе три активных субрегиона: а, b и с. Локус присутствует во всех клетках, кроме эритроцитов. Однако локус активен только в клетках Сертоли.
Считается, что частота мутаций локуса AZF в 10 раз выше, чем частота мутаций в аутосомах. Причиной мужского бесплодия служит высокий риск передачи сыновьм Y-делеций, затрагивающих этот локус. В последние годы исследование локуса стало обязательным правилом при экстракорпоральном оплодотворении (ЭКО), а также у мужчин с показателем сперматозоидов менее 5 млн/мл (азооспермия и олигоспермия тяжелой степени).
К числу макроделеций относятся: синдром де ля Шапелля (46,ХХ-мужчина), синдром Вольфа-Хиршхорна (46, ХХ,4р-), синдром «кошачьего крика» (46, XY,5p-), синдром частичной моносомии хромосомы 9 (46, XX, 9р-). Например, синдром де ля Шапелля - это гипогонадизм при мужском фенотипе, мужской психосоциальной ориентации и женском генотипе. По клинике имеет сходство с синдромом Клайнфельтера, сочетается с гипоплазией яичек, азооспермией, гипоспадией (дефицит тестостерона вследствие внутриутробной недостаточности его синтеза клетками Лейдига), умеренно выраженной гинекомастией, глазной симптоматикой, нарушением сердечной проводимости и задержкой роста. Патогенетические механизмы тесно связаны с механизмами истинного гермафродитизма (см. ниже). И та, и другая патологии развиваются спорадически, часто в одних и тех же семьях; большинство случаев SRY - негативные.
Кроме микро- и макроделеций, выделяют пери- и парацентрические инверсии (участок хромосомы переворачивается на 180° внутри хромосомы с вовлечением центромеры или внутри плеча без вовлечения центромеры). По последней номенклатуре хромосом, инверсия обозначается символом Ph. У больных с бесплодием и невынашиванием беременности часто выявляются мозаичный сперматогенез и олигоспермия, связанные с инверсиями следующих хромосом:
• хромосома 1; часто наблюдается Ph 1p34q23, вызывающая полный блок сперматогенеза; реже выявляется Ph 1p32q42, приводящая к блоку сперматогенеза на стадии пахитены;
• хромосомы 3, 6, 7, 9, 13, 20 и 21.
Реципрокные и нереципрокные транслокации (взаимный равный и неравный обмен между негомологичными хромосомами) встречаются между хромосомами всех классифицированных групп. Примером реципрокной транслокации является Y-аутосомная транслокация, сопровождающаяся нарушением дифференцировки пола, репродукции и бесплодием у мужчин вследствие аплазии сперматогенного эпителия, торможения или блока сперматогенеза. Другой пример - редкие транслокации между гоносомами X-Y, Y-Y. Фенотип у таких больных может быть женским, мужским или двойственным. У мужчин с транслокацией Y-Y наблюдается олигоили азооспермия в результате частичного или полного блока сперматогенеза на стадии образования сперматоцита I.
Особый класс - это транслокации робертсоновского типа между акроцентрическими хромосомами. Они встречаются у мужчин с нарушением сперматогенеза и/или бесплодием чаще, чем реципрокные транслокации. Например, робертсоновская транслокация между хромосомами 13 и 14 приводит либо к полному отсутствию сперматогониев в семенных канальцах, либо к незначительным изменениям их эпителия. Во втором случае мужчины могут сохранять фертильность, хотя чаще всего у них обнаруживается блок сперматогенеза на стадии сперматоцитов. К классу транслокаций относятся также полицентрические или дицентрические хромосомы (с двумя центромерами) и кольцевые хромосомы (центрические кольца). Первые возникают в результате обмена двух центрических фрагментов гомологичных хромосом, они выявляются у пациентов с нарушением репродукции. Вторые представляют собой замкнутые в кольцо структуры с вовлечением центромеры. Их образование связано с повреждением обоих плеч хромосомы, в результате чего свободные концы ее фрагмента,
содержащего центромеру, соединяются между собой. Носители центрических колец, как правило, бесплодны вследствие нарушения конъюгации хромосом в мейозе, что вызывает остановку сперматогенеза на стадии сперматоцитов.
Гаметный пол
Для иллюстрации возможных причин и механизмов нарушений гаметного уровня дифференцировки пола рассмотрим на основе данных электронной микроскопии процесс образования гамет в ходе нормального мейоза. На рис. 57 приведена модель синаптонемного комплекса (СК), отражающая последовательность событий при синапсисе и десинапсисе хромосом, участвующих в кроссинговере.
На начальной стадии первого деления мейоза, соответствующей окончанию интерфазы (стадия пролептотены), гомологичные родительские хромосомы деконденсированы, и в них видны начинающие формироваться осевые элементы. Каждый из двух элементов включает две сестринские хроматиды (соответственно 1 и 2, а также 3 и 4). На этой и следующей (второй) стадии - лептотене - происходит непосредственное формирование осевых элементов гомологичных хромосом (видны петли хроматина). Начало третьей стадии - зиготены - характеризуется подготовкой к сборке центрального элемента СК, а в конце зиготены начинается синапсис или конъюгация (слипание по
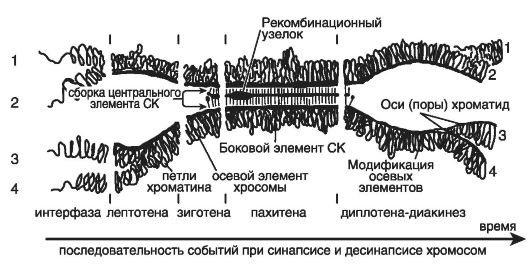 Рис. 57. Модель
синаптонемного комплекса (по Preston D., 2000). Цифры 1, 2 и 3, 4
обозначают сестринские хроматиды гомологичных хромосом. Другие
разъяснения приведены в тексте
Рис. 57. Модель
синаптонемного комплекса (по Preston D., 2000). Цифры 1, 2 и 3, 4
обозначают сестринские хроматиды гомологичных хромосом. Другие
разъяснения приведены в тексте
длине) двух боковых элементов СК, совместно формирующих центральный элемент, или бивалент, включающий четыре хроматиды.
При прохождении зиготены гомологичные хромосомы ориентируются теломерными концами к одному из полюсов ядра. Формирование центрального элемента СК полностью завершается на следующей (четвертой) стадии - пахитене, когда в результате процесса конъюгации образуется гаплоидное число половых бивалентов. В каждом биваленте четыре хроматиды - это так называемое хромомерное строение. Начиная со стадии пахитены, половой бивалент постепенно смещается к периферии ядра клетки, где преобразуется в плотное половое тельце. В случае мужского мейоза это будет сперматозоид I порядка. На следующей (пятой) стадии - диплотене - завершается синапсис гомологичных хромосом и происходит их десинапсис или взаимное отталкивание. При этом СК постепенно редуцируется и сохраняется лишь в участках хиазм или зонах, в которых непосредственно происходит кроссинговер или рекомбинационный обмен наследственным материалом между хроматидами (см. главу 5). Такие зоны называются рекомбинационными узелками.
Таким образом, хиазма - это участок хромосомы, в котором две из четыре хроматид полового бивалента вступают между собой в кроссинговер. Именно хиазмы удерживают гомологичные хромосомы в одной паре и обеспечивают расхождение гомологов к разным полюсам в анафазе I. Наступившее в диплотене отталкивание продолжается на следующей (шестой) стадии - диакинезе, когда происходит модификация осевых элементов с разделением осей хроматид. Диакинез завершается конденсацией хромосом и разрушением ядерной мембраны, что соответствует переходу клеток в метафазу I.
На рис. 58 приведено схематическое изображение осевых элементов или двух боковых (овальных) тяжей - стержней центрального пространства СК с формированием тонких поперечных линий между ними. В центральном пространстве СК между боковыми стержнями видна плотная зона наложения поперечных линий, и видны петли хроматина, отходящие от боковых стержней. Более светлый эллипс в центральном пространстве СК - это рекомбинационный узелок. В ходе дальнейшего мейоза (например, мужского) в наступившей анафазе II расходятся четыре хроматиды, формирующие униваленты по отдельным гоносомам Х и Y, и таким образом из каждой делящейся клетки образуются четыре сестринские клетки, или сперматиды. Каждая сперматида имеет гаплоидный набор
хромосом (редуцирована вдвое) и содержит перекомбинированный генетический материал.
В периоде половой зрелости мужского организма сперматиды вступают в сперматогенез и благодаря серии морфофизиологических трансформаций превращаются в функционально активные сперматозоиды.
Нарушения гаметного пола - это либо результат нарушенного генетического контроля миграции первичных половых клеток (ППК) в закладки гонад, что приводит к снижению количества или даже полному отсутствию клеток Сертоли (синдром клеток Сертоли), либо результат возникновения мейотических мутаций, обусловливающих нарушение конъюгации гомологичных хромосом в зиготене.
Как правило, нарушения гаметного пола вызваны аномалиями хромосом в самих гаметах, что, например, в случае мужского мейоза проявляется олиго-, азоо- и тератозооспермией, отрицательно сказывающейся на репродуктивной способности мужчины.
Показано, что аномалии хромосом в гаметах ведут к их элиминации, гибели зиготы, эмбриона, плода и новорожденного, обусловливают абсолютное и относительное мужское и женское бесплодие, являются причинами спонтанных абортов, замерших беременностей, мертворождений, рождений детей с пороками развития и ранней детской смертности.
Гонадный пол
Дифференцировка гонадного пола предусматривает создание в организме морфогенетической структуры гонад: или семенников, или яичников (см. выше рис. 54).
При изменениях гонадного пола, вызванных действием генетических и средовых факторов, основными нарушениями являются: аге-
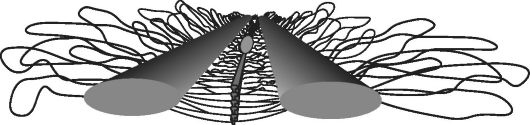 Рис. 58. Схематическое изображение центрального пространства синаптонемного комплекса (по Сорокиной Т.М., 2006)
Рис. 58. Схематическое изображение центрального пространства синаптонемного комплекса (по Сорокиной Т.М., 2006)
незия или дисгенезия гонад (включая смешанный тип) и истинный гермафродитизм. Половая система обоих полов развивается в начале внутриутробного онтогенеза по единому плану параллельно с развитием выделительной системы и надпочечников - так называемая индифферентная стадия. Первая закладка половой системы в виде целомического эпителия происходит у зародыша на поверхности первичной почки - вольфово тело. Затем наступает стадия гонобластов (эпителий половых валиков), из которых развиваются гоноциты. Их окружают клетки фолликулярного эпителия, обеспечивающие трофику.
В строму первичной почки из половых валиков идут тяжи, состоящие из гоноцитов и фолликулярных клеток, и одновременно от тела первичной почки к клоаке идет мюллеров (парамезонефральный) проток. Далее идет раздельное развитие мужских и женских гонад. Происходит следующее.
А. Мужской пол . По верхнему краю первичной почки прорастает мезенхима, формирующая половой тяж (шнур), который разделяется, соединяясь с канальцами первичной почки, впадающими в ее проток, и дает начало семенным трубочкам семенников. При этом из почечных канальцев формируются выносящие канальцы. В дальнейшем верхняя часть протока первичной почки становится придатком семенника, а нижняя превращается в семявыносящий канал. Семенники и простата развиваются из стенки мочеполового синуса.
Действие гормонов мужских гонад (андрогенов) зависит от действия гормонов передней доли гипофиза. Выработка андрогенов обеспечивается совместной секрецией интерстициальных клеток семенников, сперматогенного эпителия и поддерживающих клеток.
Простата - это железисто-мышечный орган, состоящий из двух боковых долек и перешейка (средняя долька). В простате около 30-50 желез, их секрет выбрасывается в семявыносящий проток в момент эякуляции. К продуктам, секретируемым семенными пузырьками и простатой (первичная сперма), по мере их продвижения по семявыносящему и мочеиспускательному каналам добавляется (в верхней части мочеиспускательного канала) мукоид и схожие с ним по составу продукты бульбоуретральных желез или куперовых клеток. Все эти продукты перемешиваются и выходят в виде дефинитивной спермы - жидкости со слабощелочной реакцией, в которой находятся сперматозоиды и содержатся необходимые для их функционирования вещества: фруктоза, лимонная кислота,
цинк, кальций, эрготонин, ряд ферментов (протеиназы, глюкозидазы и фосфатазы).
Б. Женский пол. Происходит развитие мезенхимы у основания тела первичной почки, что приводит к уничтожению свободных концов половых шнуров. При этом проток первичной почки атрофируется, а мюллеров проток, наоборот, дифференцируется. Его верхние части становятся маточными (фаллопиевыми) трубами, концы которых раскрываются в виде воронок и охватывают яичники. Нижние части мюллеровых протоков сливаются и дают начало матке и влагалищу.
Мозговой частью яичников становятся остатки тела первичной почки, а от полового валика (зачаток эпителия) продолжается врастание половых шнуров в корковую часть будущих яичников. Продукты женских гонад - это фолликулостимулирующий гормон (эстроген) или фолликулин и прогестерон.
Рост фолликулов, овуляция, циклические изменения желтого тела, чередование продукции эстрогена и прогестерона определяются соотношениями (сдвигами) между гонадотропными гормонами гипофиза и специфическими активаторами адреногипофизотропной зоны гипоталамуса, контролирующей гипофиз. Поэтому нарушения регуляторных механизмов на уровне гипоталамуса, гипофиза и яичников, развившиеся, например, в результате опухолей, черепно-мозговых травм, инфицирования, интоксикаций или психоэмоциональных стрессов, расстраивают половую функцию и становятся причинами преждевременного полового созревания или нарушений менструального цикла.
Гормональный пол
Гормональный пол - это поддержание в организме баланса мужских и женских половых гормонов (андрогенов и эстрогенов). Детерминирующим началом развития организма по мужскому типу служат два андрогенных гормона: антимюллеров гормон, или АМН (MIS-фактор), вызывающий регрессию мюллеровых протоков, и тестостерон. MIS-фактор активируется под действием гена GATA4, локализованного в 19р13.2-33 и кодирующего белок - гликопротеин. Его промотор содержит сайт, распознающий ген SRY, с которым связывается консенсусная последовательность - AACAAT/A.
Секреция гормона АМН начинается на 7 нед эбриогенеза и продолжается до пубертатного возраста, затем резко падает у взрослых (с сохранением очень низкого уровня).
Предполагают, что АМН необходим для развития яичек, созревания сперматозоидов и ингибирования роста опухолевых клеток. Под контролем тестостерона из вольфовых протоков формируются внутренние мужские половые органы. Этот гормон превращается в 5-альфатестостерон, и с его помощью из мочеполового синуса формируются наружные мужские половые органы.
Биосинтез тестостерона активируется в клетках Лейдига под действием активатора транскрипции, кодируемого геном SF1 (9q33).
Оба этих гормона оказывают и местное, и общее действие на маскулинизацию экстрагенитальных тканей-мишеней, чем обусловливают половой дисморфизм ЦНС, внутренних органов и размеров тела.
Таким образом, важная роль в окончательном формировании наружных мужских половых органов принадлежит андрогенам, вырабатываемым в надпочечниках и яичках. Причем необходимы не только нормальный уровень андрогенов, но их нормально функционирующие рецепторы, так как в противном случае развивается синдром нечувствительности к андрогенам (ATS).
Андрогенный рецептор кодируется геном AR, локализованным в Xq11. В этом гене идентифицировано свыше 200 точковых мутаций (в основном однонуклеотидных замен), связанных с инактиваций рецептора. В свою очередь, эстрогены и их рецепторы играют важную роль во вторичной детерминации пола у мужчин. Они необходимы для улучшения их репродуктивной функции: созревания сперматозоидов (повышения их качественных показателей) и костной ткани.
Нарушения гормонального пола происходят вследствие дефектов биосинтеза и метаболизма андрогенов и эстрогенов, участвующих в регуляции строения и функционирования органов репродуктивной системы, что обусловливает развитие ряда врожденных и наследственных заболеваний, таких, как АГС, гипергонадотропный гипогонадизм и др. Например, наружные гениталии у мужчин формируются по женскому типу при дефиците или полном отсутствии андрогенов независимо от наличия или отсутствия эстрогенов.
Соматический пол
Нарушения соматического (морфологического) пола могут быть вызваны дефектами образования рецепторов половых гормонов в тканях (органах) - мишенях, что связано с развитием женского фенотипа с мужским кариотипом или синдрома полной тестикулярной феминизации (синдрома Морриса).
Синдром характеризуется Х-сцепленным типом наследования и является наиболее частой причиной ложного мужского гермафродитизма, проявляющегося в полной и неполной формах. Это больные с женским фенотипом и мужским кариотипом. У них яички расположены внутрибрюшинно или по ходу паховых каналов. Наружные гениталии имеют разную степень маскулинизации. Производные мюллеровых протоков - матка, фаллопиевы трубы - отсутствуют, вагинальный отросток укорочен и слепо заканчивается.
Производные вольфовых протоков - семявыносящий проток, семенные пузырьки и придатки семенников - гипоплазированы в разной степени. В пубертате у больных отмечается нормальное развитие грудных желез, за исключением бледности и уменьшения диаметра ареол сосков, скудное оволосение лобка и подмышечных впадин. Иногда вторичное оволосение отсутствует. У больных нарушено взаимодействие андрогенов и их специфических рецепторов, поэтому генетические мужчины чувствуют себя как женщины (в отличие от транссексуалов). При гистологическом исследовании у них выявляются гиперплазия клеток Лейдига и клеток Сертоли, а также отсутствие сперматогенеза.
Примером неполной тестикулярной феминизации является синдром Рейфенштейна. Это, как правило, мужской фенотип с гипоспадией, гинекомастией, мужским кариотипом и бесплодием. Вместе с тем, может быть мужской фенотип со значительными дефектами маскулинизации (микропенис, промежностная гипоспадия и крипторхизм), а также женский фенотип с умеренной клитеромегалией и незначительным сращением половых губ. Кроме того, у фенотипических мужчин с полной маскулинизацией выделяют мягкую форму синдрома тестикулярной феминизации с гинекомастией, олигозооспермией или азооспермией.
Психический, социальный и гражданский пол
Рассмотрение нарушений психического, социального и гражданского пола у человека не является задачей этого учебного пособия, так как подобного рода нарушения касаются отклонений в половом самосознании и самовоспитании, половой ориентации и половой роли индивида и тому подобных психических, психологических и других социально значимых факторов полового развития.
Рассмотрим пример транссексуализма (одного из частых нарушений психического пола), сопровождающегося патологическим стремлением индивида к изменению своего пола. Нередко этот синдром
называют сексуально-эстетической инверсией (эолизмом) или психическим гермафродитизмом.
Аутоидентификация и половое поведение индивида закладываются еще во внутриутробном периоде развития организма через созревание структур гипоталамуса, что в некоторых случаях может обусловить развитие транссексуальности (интерсексуальности), т.е. двойственности строения наружных гениталий, например, при АГС. Такая двойственность приводит к неправильной регистрации гражданского (паспортного) пола. Ведущие симптомы: инверсия половой идентичности и социализации личности, проявляющаяся в отвергании своего пола, психосоциальной дизадаптации и аутодеструктивном поведении. Средний возраст больных, как правило, составляет 20-24 года. Мужской транссексуализм встречается значительно чаще женского (3:1). Описаны семейные случаи и случаи транссексуализма среди монозиготных близнецов.
Природа болезни неясна. Психиатрические гипотезы в целом не подтверждаются. В некоторой степени объяснением может быть гормональнозависимая дифференцировка мозга, происходящая параллельно с развитием гениталий. Например, показана связь уровня половых гормонов и нейротрансмиттеров во время критических периодов развития ребенка с половой идентификацией и психосоциальной ориентацией. Кроме того, предполагается, что генетической предпосылкой женского транссексуализма может быть недостаточность 21-гидроксилазы у матери или плода, вызванная пренатальным стрессом, частота которого значительно выше у больных по сравнению с обычной популяцией.
Причины транссексуализма можно рассматривать с двух позиций.
• Первая позиция - это нарушение дифференцировки психического пола вследствие несоответствия между дифференцировкой наружных гениталий и дифференцировкой полового центра мозга (опережение первой и отставание второй дифференцировки).
• Вторая позиция - это нарушение дифференцировки биологического пола и формирования последующего полового поведения в результате дефекта рецепторов половых гормонов или их аномальной экспрессии. Не исключено, что эти рецепторы могут быть расположены в структурах мозга, необходимых для формирования последующего полового поведения. Следует также отметить, что транссексуализм противоположен синдрому тестикулярной
феминизации, при котором у пациентов никогда не возникает сомнений в их принадлежности к женскому полу. Кроме того, этот синдром следует отличать от синдрома трансвестизма как психиатрической проблемы.
Классификации генетических нарушений репродукции
В настоящее время имеется множество классификаций генетических нарушений репродукции. Как правило, в них учитываются особенности дифференцировки пола, генетический и клинический полиморфизм при нарушениях полового развития, спектр и частота генетических, хромосомных и гормональных нарушений и другие особенности. Рассмотрим одну из последних, наиболее полных классификаций (Grumbach M. et al., 1998). В ней выделяют следующее.
I. Нарушения дифференцировки гонад.
• Истинный гермафродитизм.
• Дисгенезия гонад при синдроме Клайнфельтера.
• Синдром дисгенезии гонад и его варианты (синдром Шерешевского-Тернера).
• Полная и неполная формы ХХ-дисгенезии и XY-дисгенезии гонад. В качестве примера рассмотрим дисгенезию гонад при кариотипе 46,ХУ Если ген SRY определяет дифференцировку гонад в яички, то его мутации приводят к дисгенезии гонад у XY-эмбрионов. Это лица с женским фенотипом, высоким ростом, мужским телосложением и кариотипом. У них выявляются женское или двойственное строение наружных гениталий, отсутствует развитие молочных желез, проявляется первичная аменорея, скудное половое оволосение, гипоплазия матки и фаллопиевых труб и самих гонад, которые представлены соединительнотканными тяжами, расположенными высоко в малом тазу. Нередко этот синдром называют чистой формой дисгенезии гонад с кариотипом 46,XY.
II. Женский ложный гермафродитизм.
• Андрогениндуцированный.
- Врожденная гипоплазия коры надпочечников или АГС. Это распространенное аутосомно-рецессивное заболевание, которое в 95% случаев является результатом дефицита фермента 21-гидроксилазы (цитохром P45 С21). Подразделяется на «классическую» форму (частота в популяции 1:5000-10000 новорожденных) и «неклассическую» форму (частота 1:27-333) в зависимости от клинического проявления. Ген 21-гидроксилазы
(CYP21B) картирован на коротком плече хромосомы 6 (6р21.3). В этом локусе выделены два тандемно расположенных гена - функционально активный ген CYP21B и псевдоген CYP21A, неактивный вследствие либо делеции в экзоне 3, либо инсерции со сдвигом рамки считывания в экзоне 7, либо нонсенс-мутации в экзоне 8. Наличие псевдогена ведет к нарушениям спаривания хромосом в мейозе и, следовательно, к конверсии гена (перемещению фрагмента активного гена на псевдоген) или делеции части смыслового гена, что нарушает функцию активного гена. На долю конверсии гена приходится 80% мутаций, на долю делеций - 20% мутаций.
- Недостаточность ароматазы или мутация гена CYP 19, ARO (ген P450 - ароматазы), локализован в сегменте 15q21.1.
- Поступление андрогенов и синтетических прогестагенов от матери.
• Неандрогениндуцированный, вызванный тератогенными факторами и связанный с пороками развития кишечника и мочевыводящих путей.
III. Мужской ложный гермафродитизм.
• 1. Нечувствительность ткани яичек к ХГ и ЛГ (агенезия и гипоплазия клеток).
• 2. Врожденные дефекты биосинтеза тестостерона.
- 2.1. Дефекты ферментов, влияющих на биосинтез кортикостероидов и тестостерона (варианты врожденной гиперплазии коры надпочечников):
■ дефект STAR (липоидная форма врожденной гиперплазии коры надпочечников);
■ недостаточность 3 бета-HSD (3 бетагидрокортикоиддегидрогеназы);
■ недостаточность гена CYP 17 (ген цитохрома P450C176) или 17альфа-гидроксилазы-17,20-лиазы.
- 2.2. Дефекты ферментов, первично нарушающие биосинтез тестостерона в яичках:
■ недостаточность CYP 17 (ген цитохрома P450C176);
■ недостаточность 17 бета-гидростероиддегидрогеназы, тип 3 (17 бета-HSD3).
- 2.3. Дефекты чувствительности тканей-мишеней к андрогенам.
■ 2.3.1. Нечувствительность (резистентность) к андрогенам:
синдром полной тестикулярной феминизации (синдром
Морриса);
синдром неполной тестикулярной феминизации (болезнь Рейфенштейна);
нечувствительность к андрогенам у фенотипически нормальных мужчин.
■ 2.3.2. Дефекты метаболизма тестостерона в периферических тканях - дефицит 5 гамма-редуктазы (SRD5A2) или псевдовагинальная перинеоскротальная гипоспадия.
■ 2.3.3. Дисгенетический мужской псевдогермафродитизм :
неполная XY-дисгенезия гонад (мутация гена WT1) или синдром Фрэзье;
X/XY-мозаицизм и структурные аномалии (Хр+, 9р-,
10q-);
миссенс-мутация гена WT1 или синдром Денис-Дрэша; делеция гена WT1 или синдром WAGR; мутация гена SOX9 или кампомелическая дисплазия; мутация гена SF1;
Х-сцепленная тестикулярная феминизация или синдром Морриса.
■ 2.3.4. Дефекты синтеза, секреции и ответа на антимюллеров гормон - синдром персистенции мюллеровых протоков
(СПМП).
■ 2.3.5. Дисгенетический мужской псевдогермафродитизм, вызванный материнскими прогестагенами и эстрогенами.
■ 2.3.6. Дисгенетический мужской псевдогермафродитизм, вызванный воздействием химических факторов среды.
IV. Неклассифицированные формы аномалий полового развития у мужчин: гипоспадия, двойственное развитие гениталий у XY-мужчин c мВПР.
ГЕНЕТИЧЕСКИЕ ПРИЧИНЫ БЕСПЛОДИЯ
В качестве генетических причин бесплодия выделяют: синаптические и десинаптические мутации, аномальный синтез и сборку компонентов СК (см. выше гаметный пол).
Определенную роль играет аномальная конденсация гомологов хромосом, приводящая к маскировке и исчезновению точек инициации конъюгации и, следовательно, ошибкам мейоза, возникающим в любых его фазах и стадиях. Незначительная часть нарушений приходится на синаптические дефекты в профазе первого деления в
виде асинаптических мутаций, тормозящих сперматогенез до стадии пахитены в профазе I, что приводит к превышению числа клеток в лептотене и зиготене, отсутствию полового пузырька в пахитене, обусловливает наличие неконъюгирующего сегмента бивалента и не полностью сформированного синаптонемного комплекса.
Более частыми являются десинаптические мутации, которые блокируют гаметогенез до стадии метафазы I, вызывая дефекты СК, включая его фрагментацию, полное отсутствие или нерегулярность, а также асимметрию конъюгации хромосом.
Вместе с тем, могут наблюдаться частично синаптированные би- и мультисинаптонемные комплексы, их ассоциации с половыми XY-бивалентами, не смещающиеся на периферию ядра, а «заякоревающиеся» в его центральной части. В таких ядрах не образуются половые тельца, и клетки с этими ядрами подвергаются селекции на стадии пахитены - это так называемый пахитенный арест.
Классификация генетических причин бесплодия
В 2001 г. была опубликована наиболее полная классификация генетических причин бесплодия (Foresta D. et al., 2001). Согласно этой классификации, бесплодие у мужчин вызывают:
1. Гоносомные синдромы (включая мозаичные формы): синдромы Клайнфельтера (кариотипы: 47,XXY и 47, XYY); YY-анеуплоидии; инверсии пола (46,ХХ и 45,Х - мужчины); структурные мутации Y-хромосомы (делеции, инверсии, кольцевые хромосомы, изохромосомы).
2. Аутосомные синдромы, обусловленные: реципрокными и робертсоновскими транслокациями; другими структурными перестройками (включая маркерные хромосомы).
3. Синдромы, обусловленные трисомией хромосомы 21 (болезнь Дауна), частичными дупликациями или делециями.
4. Хромосомные гетероморфизмы: инверсия хромосомы 9, или Ph (9); семейная инверсия Y-хромосомы; увеличенный гетерохроматин Y-хромосомы (Ygh+); увеличенный или уменьшенный перицентромерный конститутивный гетерохроматин; увеличенные или дуплицированные сателлиты акроцентрических хромосом.
5. Хромосомные аберрации в сперматозоидах: тяжелые первичные тестикулопатии (последствия лучевой терапии или химиотерапии).
6. Мутации Y-сцепленных генов (например, микроделеция в локусе AZF).
7. Мутации Х-сцепленных генов: синдром нечувствительности к андрогенам; синдромы Кальмана и Кеннеди. Рассмотрим синдром Кальмана - это врожденное (часто семейное) нарушение секреции гонадотропинов у лиц обоего пола. Синдром обусловлен дефектом гипоталамуса, проявляющимся дефицитом гонадотропин-рилизинг-гормона, что ведет к снижению выработки гонадотропинов гипофизом и развитию вторичного гипогонадотропного гипогонадизма. Сопровождается дефектом обонятельных нервов и проявляется аносмией или гипосмией. У больных мужчин наблюдается евнухоидизм (яички по размерам и консистенции остаются на пубертатном уровне), отсутствует цветовое зрение, имеются врожденная глухота, расщелина губы и нёба, крипторхизм и костная патология с укорочением IV пястной кости. Иногда проявляется гинекомастия. При гистологическом исследовании выявляются незрелые семенные канальцы, выстланные клетками Сертоли, сперматогониями или первичными сперматоцитами. Клетки Лейдига отсутствуют, вместо них мезенхимальные предшественники, которые при введении гонадотропинов развиваются в клетки Лейдига. Х-сцепленная форма синдрома Кальмана вызвана мутацией гена KAL1, кодирующего аносмин. Этот белок играет ключевую роль в миграции секретирующих клеток и росте обонятельных нервов к гипоталамусу. Также описано аутосомно-доминантное и аутосомнорецессивное наследование этого заболевания.
8. Генетические синдромы, при которых бесплодие является ведущим симптомом: мутации гена муковисцидоза, сопровождающиеся отсутствием vas deferens; CBAVD- и CUAVD-синдромы; мутации генов, кодирующих бета-субъединицу ЛГ и ФСГ; мутации генов, кодирующих рецепторы к ЛГ и ФСГ.
9. Генетические синдромы, при которых бесплодие не является ведущим симптомом: недостаточность активности ферментов стероидогенеза (21-бета-гидроксилаза и др.); недостаточность редуктазной активности; анемия Фанкони, гемохроматоз, бетаталассемия, миотоническая дистрофия, мозжечковая атаксия с гипогонадотропным гипогонадизмом; синдромы Барде-Бидля, Нунан, Прадера-Вилли и Прюна-Белли.
Бесплодие у женщин бывает при следующих нарушениях. 1. Гоносомные синдромы (включая мозаичные формы): синдром Шерешевского-Тернера; дисгенезия гонад с низким ростом -
кариотипы: 45,Х; 45Х/46,ХХ; 45,Х/47,ХХХ; Xq-изохромосома; del (Xq); del (Xp); r(X).
2. Дисгенезии гонад с линией клеток, несущих Y-хромосому: смешанная дисгенезия гонад (45,X/46,XY); дисгенезия гонад при кариотипе 46,XY (синдром Свайера); дисгенезия гонад при истинном гермафродитизме с линией клеток, несущих Y-хромосому или имеющих транслокации между Х-хромосомой и аутосомами; дисгенезия гонад при синдроме трипло-Х (47,ХХХ), включая мозаичные формы.
3. Аутосомные синдромы, обусловленные инверсиями или реципрокными и робертсоновскими транслокациями.
4. Хромосомные аберрации в ооцитах женщин в возрасте старше 35 лет, а также в ооцитах женщин с нормальным кариотипом, у которых 20% ооцитов и более могут иметь хромосомные аномалии.
5. Мутации в Х-сцепленных генах: полная форма тестикулярной феминизации; синдром ломкой Х-хромосомы (FRAXA, синдром fraX); синдром Кальмана (см. выше).
6. Генетические синдромы, при которых бесплодие является ведущим симптомом: мутации в генах, кодирующих субъединицу ФСГ, рецепторы к ЛГ и ФСГ и рецептор гонадолиберина; синдромы BPES (блефарофимоз, птоз, эпикант), Денис-Дрэша и Фрэзье.
7. Генетические синдромы, при которых бесплодие не является ведущим симптомом: недостаточность ароматической активности; недостаточность ферментов стероидогенеза (21-бета- гидроксилаза, 17-бета-гидроксилаза); бета-талассемия, галактоземия, гемохроматоз, миотоническая дистрофия, муковисцидоз, мукополисахаридозы; мутации гена DAX1; синдром Прадера- Вилли.
Однако эта классификация не учитывает ряд наследственных заболеваний, связанных с мужским и женским бесплодием. В частности, в нее не вошла гетерогенная группа болезней, объединенных общим названием «аутосомно-рецессивный синдром Картагенера», или синдром неподвижности ресничек клеток реснитчатого эпителия верхних дыхательных путей, жгутиков сперматозоидов, фибрий ворсинок яйцеводов. Например, к настоящему времени идентифицировано более 20 генов, контролирующих формирование жгутиков сперматозоидов, включая ряд мутации генов
DNA11 (9р21-р13) и DNAH5 (5р15-р14). Этот синдром характеризуется наличием бронхоэктазов, синуситов, полным или частичным обратным расположением внутренних органов, пороками развития костей грудной клетки, врожденным пороком сердца, полиэндокринной недостаточностью, легочным и сердечным инфантилизмом. Мужчины и женщины с этим синдромом часто, но не всегда бесплодны, так как бесплодие у них зависит от степени повреждения двигательной активности жгутиков сперматозоидов или фибрий ворсинок яйцеводов. Кроме того, у больных наблюдаются вторично развившиеся аносмия, умеренное снижение слуха, полипы носовой полости.
ЗАКЛЮЧЕНИЕ
Как составная часть общей генетической программы развития, онтогенез органов репродуктивной системы - это многозвеньевой процесс, крайне чувствительный к действию широкого спектра мутагенных и тератогенных факторов, обусловливающих развитие наследственных и врожденных заболеваний, нарушений репродуктивной функции и бесплодия. Поэтому онтогенез органов репродуктивной системы - это наиболее наглядная демонстрация общности причин и механизмов развития и становления как нормальных, так и патологических функций, связанных с основными регуляторными и защитными системами организма.
Его характеризует ряд особенностей.
• В генной сети, участвующей в онтогенезе репродуктивной системы человека, насчитывается: в женском организме - 1700+39 генов, в мужском организме - 2400+39 генов. Не исключено, что в ближайшие годы вся генная сеть органов репродуктивной системы выйдет по количеству генов на второе место после сети нейроонтогенеза (где 20 тыс. генов).
• Действие отдельных генов и генных комплексов в составе указанной генной сети тесно связано с действием половых гормонов и рецепторов к ним.
• Выделены многочисленные хромосомные нарушения дифференцировки пола, связанные с нерасхождением хромосом в анафазе митоза и профазе мейоза, числовыми и структурными аномалиями гоносом и аутосом (или их мозаичными вариантами).
• Выделены нарушения развития соматического пола, связанные с дефектами образования рецепторов половых гормонов в тканяхмишенях и развитием женского фенотипа с мужским кариотипом - синдром полной тестикулярной феминизации (синдром Морриса).
• Выделены генетические причины бесплодия и опубликована их наиболее полная классификация.
Таким образом, в последние годы в исследованиях онтогенеза репродуктивной системы человека произошли существенные перемены и достигнуты успехи, реализация которых, безусловно, позволит усовершенствовать методы лечения и профилактики нарушений репродукции, а также мужского и женского бесплодия.