Клиническая генетика. Геномика и протеомика наследственной патологии : учеб. пособие. - 3-е изд., перераб. и доп. - Мутовин Г.Р. 2010. - 832 с. : ил
|
|
|
|
ГЛАВА 13 ОНТОГЕНЕЗ НЕРВНОЙ СИСТЕМЫ И ЕГО НАРУШЕНИЯ
ХАРАКТЕРИСТИКА НЕРВНОЙ ТКАНИ
Морфологический субстрат
Нервная система организма интегрирует работу эндокринной, иммунной, мышечной, репродуктивной и других систем и является главной регуляторной системой (после молекулы ДНК), построенной на основе нервной ткани, - это нервные клетки (нейроны), обширная сеть нервных окончаний и клетки глии. Из нервной ткани сформированы головной и спинной мозг - это центральная нервная система.
Другие морфологические элементы нервной ткани - нервные узлы, сплетения, стволы, волокна и окончания - это периферическая нервная система.
Нейрон имеет тело и отростки: один аксон (передает молекулярную информацию) и один или несколько дендритов (принимают молекулярную информацию).
По количеству отростков нейроны делятся на униполярные (один отросток); биполярные (2 отростка), например нейроны сетчатки глаз или спирального ганглия внутреннего уха; мультиполярные (3 отростка и более) - большинство нейронов.
Нейроны имеют разную форму, например, среди нейронов коры головного мозга выделены звездчатые, веретенообразные, паукообразные, пирамидные и горизонтальные.
Специфическая особенность нейронов заключается в том, что в постнатальном онтогенезе они не делятся - их размножение происходит внутриутробно, и к моменту рождения организма создается необходимый резерв, включающий 150 млрд нейронов (так же, как резерв из 2000 яйцеклеток - см. главу 9). Подсчитано, что в среднем за 70 лет жизни утрачиваются (гибнут) только 3% нейронов (и около 20% яйцеклеток)*.
* Ответ на вопрос, зачем нужны резервные нейроны, дается в конце этой главы.
Обширная сеть нервных окончаний , пронизывающих все ткани и органы, представлена огромным количеством окончаний нервных волокон. По функциональному назначению эти окончания делятся на три группы: эффекторы, рецепторы и синапсы.
К эффекторам относятся двигательные (моторные) и секреторные окончания. Моторные заканчиваются в мышечных тканях моторными бляшками (аксоно-мышечные синапсы) - это окончания моторных ядер головного мозга и нейронов передних рогов спинного мозга.
К рецепторам относятся чувствительные окончания или концевые части дендритов, рассеянные по всему организму и воспринимающие внешние и внутренние средовые воздействия. Среди них выделяют механорецепторы, барорецепторы, хеморецепторы, терморецепторы и др. Рецепторы могут быть как свободными (состоят только из мелких окончаний осевого цилиндра), так и несвободными (имеют все компоненты нервного волокна). И те, и другие могут быть покрыты оболочками (инкапсулированные) или не покрыты ими (неинкапсулированные). Формы рецепторов разнообразны: пластинчатые и осязательные тельца, генитальные глыбки, температурные колбы, нервно-мышечные веретена.
Синапсы представляют собой соединения (контакты) между окончаниями аксонов и клетками-мишенями.
В составе синапса выделяют пресинаптический полюс (окончание аксона), контактирующий с аксоном, дендритом или телом другого нейрона, формирующего на своей поверхности постсинаптический полюс. Оба полюса покрыты мембранами (пре- и постсинаптическая мембраны соответственно), которые содержат мукополисахариды. Между полюсами расположена синаптическая щель.
Терминальная часть аксона представляет собой тонкие нити или веточки с концами в виде пуговок или колечек, которые находятся на поверхности другого нейрона. Она содержит множество митохондрий и мелких пузырьков. Эти пузырьки выходят через пресинаптическую мембрану в синаптическую щель и поэтому называются синаптическими пузырьками. В них находятся нейромедиаторы (ацетилхолин, норадреналин, серотонин и др.). Число синапсов, приходящихся на 1 нейрон, достигает 10 тыс.
Синапсы делятся на аксо-соматические (аксон-тело), аксодендрические (аксон-дендрит) и аксо-аксональные (аксон-аксон). Могут встречаться синаптические гломерулы (1 аксон - 2 дендрита или
2 аксона - 2 дендрита). Общее количество синапсов у человека достигает 1014.
Эффективность работы синапсов обширной межнейронной сети зависит от сохранения стабильности механизмов и времени прохождения нервных импульсов (см. ниже) и от числа контактов у одного нейрона. Неполноценные нейроны имеют меньше контактов и поэтому утрачиваются. Их функции переходят к полноценным нейронам.
Клетки нейроглии делятся на два класса: микроглия или глиальные макрофаги (обеспечивают фагоцитоз), и макроглия или глиоциты. Макроглия включает астроциты, олигодендроглиоциты и эпендимациты.
Астроциты делятся на два типа: плазматические (расположены в сером веществе мозга, богаты митохондриями - они выполняют трофическую и обменную функции) и волокнистые (расположены в белом веществе мозга, выполняют опорную функцию).
Эпендимациты выстилают желудочки головного мозга и спинномозговой канал, где выполняют разграничительную и опорную функции, а некоторые из них - еще и секреторную функцию. Например, клетки субкомиссурального слоя задней комиссуры выделяют секрет, участвующий в регуляции водного обмена в желудочках мозга.
Самая многочисленная группа глиальных клеток - олигодендроглиоциты.
Они окружают тела нейронов, входят в состав оболочек нервных волокон и окончаний, принимают участие в их регенерации и дегенерации, восприятии и проведении нервных импульсов, а также выполняют трофическую и защитную функции.
Функциональный субстрат
В функционировании нервной системы принимают участие нейроны и межнейрональные связи, сформированные на основе обширной сети нервных окончаний, пронизывающих все тело и внутренние органы человека. В зависимости от выполняемой функции выделяют чувствительные нейроны (рецепторные или аффекторные), ассоциативные нейроны (вставочные) и эффекторные нейроны (двигательные или моторные). Первые генерируют нервные импульсы, вторые (их достаточно много) связывают между собой чувствительные и эффекторные нейроны, а третьи проводят нервные импульсы на ткани рабочих органов (мышцы и железы).
Кроме этих нейронов выделяют секреторные нейроны, например крупные нейроны ядер гипоталамуса. Их цитоплазма содержит гранулы и капли секрета, включающего белки, липиды и полисахариды.
Физиологическое устройство нервной системы включает цереброспинальную соматическую часть (иннервирует все тело, кроме внутренних органов, сосудов и желез) и вегетативную автономную часть (иннервирует внутренние органы, сосуды и железы). Основное отличие соматической части от автономной заключается в наличии у последней вместо одного двух афферентных нейронов.
Центральная нервная система, макро- и микросистемы
Центральная нервная система (цереброспинальная часть) - это головной мозг или сверхсистема, объединяющая макросистемы и микросистемы организма, которые сформировались в ходе эволюции на основе обширной сети межнейронных связей.
Макросистемы - это морфофункциональные образования высокого уровня.
Основной макросистемой является кора больших полушарий головного мозга, которая делится на новую (96% всей коры), древнюю, старую и промежуточную.
Новая кора представлена слоем серого вещества толщиной 3-5 мм. Она содержит около 15 млрд мультиполярных нейронов, и в ней выделяют 6 этажей (пластинок): верхний молекулярный, наружный зернистый, пирамидный, внутренний зернистый, ганглионарный и полиморфный.
В коре два полушария. В каждом полушарии имеются борозды (центральная, латеральная, теменно-затылочная и др.), которые разделяют их на доли (лобная, височная, теменная и затылочная), и многочисленные извилины. В этих частях коры и под ними расположены корковые, корково-подкорковые, подкорковые (стволовые) сети нейронов, отличающиеся особенностями строения (цитоархитектоника) и расположением отростков нейронов (миелоархитектоника).
Функциональная роль коры огромна. Благодаря ассоциативным связям между всеми ее образованиями она интегрирует и контролирует все процессы жизнедеятельности организма. В частности, задние отделы коры принимают молекулярную информацию, а передние и средние отделы ее анализируют (обрабатывают) и организуют сложные формы поведения человека.
К высшим психическим функциям головного мозга относятся: гнозис (узнавание), мышление, память, праксис (целенаправленность действия), речь и др.
К основным нервным функциям относятся: двигательные, интеллектуальные, коммуникативные, перцептивные и др. Другие, меньшие по объему и значению макросистемы, - это подкорковые образования головного мозга, функционирование которых интегрирует кора больших полушарий.
Ствол головного мозга включает центры жизненно важных функций, как то: поддержание общего тонуса и контроль потребностей и мотивации организма, побуждение его к действию (голод, жажда, оборона, речь, стресс и др.), а также другие функции.
Особая роль в регуляции функций принадлежит лимбической макросистеме, основными образованиями которой являются гипоталамус (гиппокамп) и миндалевидное ядро, а также структуры, условно относящиеся к другим морфофункциональным системам, включая подкорковые и подкорково-корковые образования (поясная и грушевидная извилины, передние ядра таламуса, обонятельные луковицы, тракт и бугорок, гипоталамус, ретикулярная формация, участки лобных, височных и теменных долей коры больших полушарий). Иными словами, это те образования, которые тесно связаны между собой и другими морфофункциональными системами, но в составе лимбической макросистемы они интегрируют вегетативные функции с высшими поведенческими реакциями. Среди этих функций: адаптационное воздействие окружающей среды на рецепторный и синаптический аппарат, бодрствование, инстинкты, мотивации, мочеиспускание, обмен веществ, потоотделение, слезотечение, слюнотечение, сон, терморегуляция, тонус сердечно-сосудистой и эндокринной систем, дефекация, эмоции и др.
Спинной мозг - это второй по значимости компонент цереброспинальной соматической части нервной системы. Эта макросистема обеспечивает прохождение нервных импульсов через проводящие пути, восходящие к коре головного мозга (афферентные или центростремительные пути), и пути, нисходящие от него к ядрам спинного мозга (эфферентные или центробежные пути). Здесь также имеются собственные проводящие пути, связывающие между собой различные сегменты спинного мозга.
Микросистемы в отличие от макросистем регулируют только определенные отдельные функции.
Вегетативная нервная система
Вегетативная нервная система является автономной макросистемой, объединяющей две микросистемы: симпатическую и парасимпатическую. Первая тормозит, а вторая усиливает проведение молекулярной информации. К первой относятся тораколюмбальные ядра, ко второй - краниобульбарные и сакральные ядра.
Вегетативная нервная система имеет центральные и периферические отделы. Центральные отделы включают ядра среднего и продолговатого мозга, ядра боковых рогов грудных, поясничных и сакральных сегментов спинного мозга, а к периферическим отделам принадлежат нервные стволы, узлы, сплетения, волокна и окончания.
В сплетениях расположены нейроны с большим количеством ядер (до 15-ти в одной клетке). Эти ядра ограничены от цитоплазмы двумя мембранами, расположенными на расстоянии 200 A друг от друга и имеющими поры. В каждом ядре находятся 2-3 ядрышка с высоким содержанием РНК, что, например, характерно для клеток сетчатки глаз, предстательной железы и шейки матки.
Периферическая нервная система
К периферической нервной системе (помимо периферических структур вегетативной системы) относится нервная ткань в составе нейронов головного мозга, чувствительных ганглиев спинного мозга и идущих от них нервных узлов, стволов, волокон и окончаний.
Ганглии спинного мозга состоят из скоплений псевдоуниполярных нейронов, одетых в соединительнотканную капсулу, тонкие прослойки которой проникают в паренхиму узла, образуя остов с проходящими в нем сосудами. Их аксоны и дендриты образуют белое вещество спинного мозга - это преимущественно миелиновые волокна.
Нервные стволы или собственно нервы состоят из пучков нервных волокон, представляющих собой аксоны и/или дендриты (так называемые осевые цилиндры), сверху покрытые соединительнотканными капсулами (оболочками). Если одна оболочка покрывает одно нервное волокно - это эндоневрий. Если в одну оболочку «одеты» несколько нервных волокон (у каждого свой эндоневрий) - это периневрий или 5-6 плотных чередующихся слоев клеток и тонких фибрилл. Если в одну оболочку «одет» весь нервный ствол - это эпиневрий, содержащий фибробласты, клетки макроглии, жировые клетки, кровеносные и лимфатические сосуды и нервные окончания.
Аксоны и дендриты нейронов могут образовывать смешанные волокна.
Нервные волокна покрыты либо миелиновыми, либо безмиелиновыми оболочками.
Сверху нервное волокно покрыто базальной мембраной, состоящей из двух слоев леммоцитов - клеток с овальными ядрами и вытянутой цитоплазмой (условно напоминают изоляционную ленту для электропроводки).
Миелиновые оболочки значительно толще безмиелиновых и имеют внутренний, прилегающий к осевому цилиндру (толстый) слой, состоящий из шванновских клеток (леммоциты, содержащие миелин - жироподобное вещество из липидов и белков).
Миелиновый слой - это цепочка из отдельных клеток в виде узловых сегментов (каждый сегмент представлен одним леммоцитом) и межузловых сужений - перетяжек Ранвье (границы между двумя леммоцитами).
Сразу за миелиновым слоем идет внешний (тонкий) слой, состоящий из леммоцитов, не содержащих миелина, и плотных коллагеновых фибрилл, не прерывающихся в перетяжках Ранвье.
ХАРАКТЕРИСТИКА НЕЙРООНТОГЕНЕЗА
Онтогенез нервной системы или нейроонтогенез - это генетически детерминированные структурные и функциональные преобразования нервной ткани с момента рождения до момента смерти организма. Этапы нейроонтогенеза соответствуют этапам общего онтогенеза и также представляют собой два параллельно идущих процесса: прогресс и регресс (см. предыдущую главу).
Нейроонтогенез начинается и продолжается антенатально, затем прерывается в перинатальном периоде на период родов, восстанавливается в раннем постнатальном этапе (после неонатального периода), продолжается и наиболее интенсивно протекает в первое десятилетие жизни. В это время нервная система проходит основной адаптационный период с момента начала структурного, а затем функционального созревания нервной ткани под действием факторов окружающей среды.
Созревание нервной ткани продолжается в течение длительного времени, хотя условно можно считать, что оно идет до тех пор, пока в нервной системе не начнутся сначала медленные, но постепенно
ускоряющиеся и, наконец, преобладающие инволюционные процессы. Например, известно, что желтый пигмент нейронов - липофусцин впервые появляется у ребенка 7-10 лет, и его нормальное содержание (типичное для взрослого организма) сохраняется до 30-летнего возраста, и только потом оно превышает нормативные значения.
Основные события антенатального этапа
Для антенатального этапа нейроонтогенеза характерны:
• миграция нейронов ПВО к местам своего назначения;
• начало роста аксонов к клеткам-мишеням и образование синапсов;
• начало роста дендритов и их ветвление. Эти процессы наблюдаются за несколько недель до начала родов и останавливаются в случае патологического действия факторов среды (см. гомеорез в главе 12);
• начало миелинизации нервных волокон и окончаний;
• глиальная дифференцировка, трофическое и иммунное обеспечение сформировавшихся структур нервной системы.
Формирование основных структур
Нервная ткань зародыша развивается на антенатальном этапе из дорсального утолщения эктодермы - нервной пластинки, которая прогибается и превращается в желобок, а затем замыкается в нервную трубку, обособляющуюся от кожной части эктодермы. Нервная трубка является эмбриональным зачатком всей нервной системы - это стадия нейруляции.
Начиная с 25-го дня беременности, головной конец нервной трубки последовательно проходит стадии трех и пяти мозговых пузырей.
На 3-м месяце беременности из мозговых пузырей образуются основные структуры головного мозга.
Первоначально головной мозг - это утолщенные стенки мозговых пузырей. Из них развиваются продолговатый, задний (мост и мозжечок), промежуточный (диэнцефальная область) и конечный мозг (ствол головного мозга и кора больших полушарий), а полости мозговых пузырей становятся полостями мозговых желудочков. Обращенная к полости внутренняя зона мозговых пузырей вместе с околожелудочковой зоной (стенки полости) называется перивентрикулярной областью мозга.
Утолщение стенок мозговых пузырей обусловлено форсированным размножением нейронов ПВО, их радиальной миграцией и размещением в краевой (наружной) зоне стенок мозговых желудочков - будущей коре больших полушарий. При этом краевая зона как бы отодвигается молодыми нейронами кнаружи, образуя слои субвентрикулярной зоны, в которой начинается и интенсивно протекает размножение глиальных клеток. В это время в краевой зоне уже прекращен митоз нейронов, она постепенно сужается и в ней формируется корковая пластинка, состоящая из нейронов определенной степени зрелости.
Краевая зона мозга вместе с корковой пластинкой образуют серое (корковое) вещество мозга - это поверхностные слои коры больших полушарий и коры мозжечка, а также центральные ядра мозжечка и ядра ствола головного мозга в составе чувствительных, ассоциативных и двигательных нейронов. Одновременно с формированием серого вещества между корковой пластинкой с наружной стороны и субвентрикулярной зоной с внутренней стороны мозговых желудочков образуется промежуточная зона, в которой постепенно уменьшается количество нейронов и их место занимают нервные волокна, формирующие белое вещество головного мозга.
Нейроны серого вещества спинного мозга развиваются из нейробластов. На поперечном срезе спинного мозга - это внутренняя (центральная) часть, содержащая ядра передних и задних рогов в составе афферентных нейронов и пучковых клеток. Компоненты белого вещества спинного мозга - это его периферическая часть (на поперечном разрезе выделяется в виде буквы Н или «бабочки»).
Периферическая часть включает продольно ориентированные миелиновые волокна - это проводящие пути (передние, боковые и задние), связывающие между собой различные отделы нервной системы.
На 3-м месяце беременности из средних отделов нервной трубки формируются ствол мозга и ганглиозная пластинка. Нервная трубка дает начало трем слоям клеток: внутреннему (эпендима), среднему (мантия или плащ) и наружному (краевая вуаль).
Краевая вуаль - это отростки клеток, расположенных во внутреннем и среднем слоях.
В дальнейшем из эпендимы образуются глиальные клетки, а из мантии - нейробласты (предшественники нейронов) и спонгиобласты (астроциты и олигодендроглиоциты).
Ствол мозга объединяет продолговатый, средний и промежуточный мозг, а также базальную часть конечного мозга.
В центре продолговатого мозга расположена ретикулярная субстанция (формация), распространяющаяся до промежуточного мозга и состоящая из мелких мультиполярных нейронов. Как макросистема ретикулярная формация связана с корой больших полушарий, корой мозжечка, гипоталамической областью мозга и спинным мозгом (см. выше).
Нейробласты передних столбов спинного мозга дифференцируются в моторные нейроны передних рогов, их аксоны выходят из спинного мозга и образуют его передние корешки.
В задних столбах и промежуточной зоне развиваются вставочные (ассоциативные) нейроны, и их аксоны вступают в белое вещество спинного мозга, образуя проводящие пути. В задние рога входят аксоны клеток спинальных ганглиев.
Ганглиозная пластинка развивается из средних отделов нервной трубки, ее основу составляют две группы клеток, расположенных по краям нервных валиков перед их окончательным смыканием в нервную трубку. Клетки ганглиозной пластинки служат исходным материалом для чувствительных краниальных нервных узлов (многочисленные ядра мультиполярных нейронов ствола мозга, предназначенные для переключения нервных импульсов, восходящих к коре и нисходящих от нее на ствол и спинной мозг), а также спинальных нервных узлов вегетативной нервной системы, иннервирующей внутренние органы, сосуды и железы.
Миграция и размещение нейронов
Уникальной особенностью нервной системы является высокая точность формирования общей сети межнейронных связей. Эта особенность обеспечивается генетическим предназначением каждого нейрона, который «знает» то конкретное место, куда растет его аксон (только к своей клетке-мишени), игнорируя другие клетки и создавая синапсы не в любом, а «заранее определенном» месте и при этом проходя путь, нередко равный 50 см.
В основе столь точного пути лежит химическое сродство, выражающееся в наличии на поверхности клеток-мишеней своеобразных химических меток (хапотаксических ориентиров), позволяющих аксонам их узнавать. Полагают, что в этом процессе важная роль принадлежит топографическим взаимоотношениям нейронов и хро-
нологической последовательности созревания их функциональных связей.
Миграция молодых нейронов в кору головного мозга осуществляется центробежно к краевой (наружной) зоне по глиальным волокнам, располагающимся в толще стенки мозгового желудочка, - это основной путь миграции. Молодые нейроны не имеют аксона и дендритов, но у них на месте будущего аксона есть конус роста, находящийся в постоянном «ощупывающем пространство» движении и определяющий направление миграции. Конус роста аксона имеет аппарат узнавания химических ориентиров, находящихся в стенке мозгового желудочка - это гликопротеидные (хапотаксические) факторы.
Мигрируя по стволу радиальной глии, молодые нейроны один за другим отправляются к будущей коре больших полушарий, собираясь в конце пути в нейронные модули или колонки. Чем позже добрался до своей колонки нейрон, тем более поверхностное место на ней он занимает над ранее пришедшими нейронами, пробираясь сквозь их слои вверх.
В соответствии с послойным размещением нейронов в коре больших полушарий в дальнейшем будут различаться функции ее «этажей». Для других отделов нервной трубки, из которых формируются структуры ствола головного и спинного мозга, характерны миграция и размещение нейронов с их концентрацией не в колонках, а пластах, например, располагающихся в краниальных и спинальных ганглиях.
Таким образом, размещение нейронов в строго определенных местах не является случайным - оно генетически детерминировано. В связи с этим возникает возможность создания аксонами нейронов ложных межнейронных связей, и тогда появляются неполноценные нейроны, занимающие не «свои места». Такие нейроны утрачиваются. Механизмы их гибели различны - это либо некроз, либо апоптоз нейрона (см. главу 10).
Рост аксонов и дендритный спраунинг
Рост аксона нейрона начинается с движения конуса роста к клеткемишени. Скорость этого роста определяется скоростью роста (перемещения) цитоскелета аксона, которая не превышает 2 мм в сутки. Одновременно к встрече с конусом роста готовится клетка-мишень, формирующая на своей поверхности рецепторное поле для образования точечного контакта при этой встрече.
Время роста аксона к клетке-мишени соответствует времени созревания на ее поверхности рецепторного поля, т.е. это генетически контролируемый синхронный процесс. В случае образования точечного контакта одного из щупальцев конуса роста с клеткой-мишенью в этом месте формируется терминальное утолщение, участвующее в образовании полноценного синапса.
Дендритный спраунинг - это арборизация (ветвление) дендритов нейронов и образование дендритного дерева (сети). Первые дендритные отростки появляются в начале перинатального периода вскоре после завершения миграции и размещения нейронов в коре и подкорковых структурах мозга. Затем рост дендритов прерывается на период родов и восстанавливается в раннем постнатальном нейроонтогенезе (после неонатального периода). В это время расширение дендритной сети идет в основном за счет процесса ветвления, а не увеличения количества дендритов, так как один нейрон имеет 1-3 таких отростка.
Наиболее интенсивный дендритный спраунинг происходит в постнатальном нейроонтогенезе, когда постепенно увеличивается действие факторов окружающей среды на мозг ребенка. Подтверждением этому служит рост массы головного мозга. Если мозг новорожденного весит 350-400 г, то в 9 мес его масса удваивается, в 3-5 лет утраивается, 18-20 лет мозг весит 1500-1600 г., а у взрослого человека его масса даже достигает 2000 г.
Следует отметить, что именно возобновлением строительства дендритного дерева, формированием нервных окончаний и следующим за ними синаптогенезом головной мозг начинает последовательно отражать нарастающее действие на него факторов окружающей среды и таким образом адаптироваться к ним. Иными словами, это отражение перенесено из антенатального в постнатальный нейроонтогенез, т.е. отсрочено во времени.
Миелинизация нервных волокон
Миелинизация нервных волокон - это их обволакивание (одевание) в миелиновые оболочки, состоящие из особых глиальных (шванновских) клеток, содержащих миелин - жироподобный пигмент из липидов и пептидов. Как сказано выше, начало миелинизации нервных волокон и окончаний приходится на антенатальный этап. Миелинизация значительной части нервных волокон и окончаний завершается в первом десятилетии жизни.
Среди причин, нарушающих миелинизацию, следует привести перивентрикулярную энцефалопатию и лейкомаляцию, в ходе которой активируются факторы некроза опухолей (ФНО), инициирующие аутоиммунный процесс в белом веществе с дисмиелинизацией и атрофией нервной ткани.
Переход к постнатальному этапу
Мозг плода перед родами значительно увеличивается в объеме, достигая 350-400 г. Это происходит благодаря росту аксонов. Параллельно увеличению массы мозга растет масса тела, достигающая у новорожденного 3,0-3,5 кг. Соответственно растет потребность мозга в кислороде, и плацента постепенно начинает не справляться с ее удовлетворением, что приводит к усилению физиологической гипоксии плода, которая служит сигналом к завершению внутриутробного этапа развития и вызывает роды.
Непосредственно перед родами в материнском организме повышается концентрация биологически активных веществ гормональной, пептидной и липидной природы. Этот «материнский коктейль» проникает через плаценту в организм плода и вызывает в нем состояние готовности к рождению: снижение температуры тела, трофики и обмена веществ, замедление нервной, эндокринной и иммунной активности, уменьшение частоты сердечных сокращений, ослабление дыхания и активных движений. В результате действия «материнского коктейля» снижается потребность плода в кислороде и повышается его устойчивость к гипоксии во время родов.
Постнатальный этап
В сравнении с другими органами и системами организма, мозг новорожденного считается наиболее подготовленным к условиям существования в постнатальной жизни. Однако это относится не столько к непосредственному функционированию мозговых структур, сколько к их дальнейшему развитию и обучению навыкам работы в окружающей среде, т.е. речь идет об адаптации мозга к абсолютно новым для него условиям внешней среды. Такая адаптация возникает не сразу: сначала ей предшествует первая «стрессовая» неделя, или неонатальный период жизни. Адаптация начинается с периода первичной настройки жизненно важных функций (дыхание, кровообращение, пищеварение).
Период первичной настройки жизненно важных функций
Сразу после рождения на мозг новорожденного обрушивается мощный поток воздействия факторов окружающей среды. В первые секунды и минуты жизни выключаются старые механизмы дыхания и кровообращения через плаценту и включаются новые механизмы дыхания и кровообращения через легкие. Резко изменяются условия гравитации (после нахождения организма в околоплодных водах). Появляются и быстро нарастают потоки афферентной (сенсорной) информации в виде зрительных, слуховых и тактильных раздражителей. При этом в течение 1-2 ч жизни у новорожденного нейтрализуется действие «материнского коктейля» (см. главу 12).
В первые 12 ч жизни (или к концу первых суток) начинают подавляться, а затем постепенно утрачиваются (как правило, в течение первой недели жизни) базовые врожденные автоматизмы (кроме автоматизмов сосания и шагового), а также исчезают врожденные способности удерживать голову, имитировать движения матери или врача (например, показывать язык), т.е. развивается «феномен обнуления». Вместе с тем частично сохраняются остаточные функциональные возможности «уходящего» этапа онтогенеза, и на их фоне формируются новые (или обновленные) функции. Например, при сохранении автоматизма сосания развиваются и закрепляются функции захвата материнского соска, активного сосания, жевания и проглатывания. Таким образом, начало постнатального этапа нейроонтогенеза связано с первичной настройкой жизненно важных функций организма и «прощанием» с внутриутробными функциями.
Долговременный адаптационный период
После первичной настройки жизненно важных функций следует долговременный адаптационный период, в ходе которого мозг ребенка медленно приспосабливается к новым условиям окружающей среды и постепенно увеличивается в объеме. Начиная со второй недели жизни возобновляется (после «консервации» на период родов) рост аксонов и дендритов. Их рост служит базой для последующего развития межнейронных сетей (спраунинга), в ходе которого будут совершенствоваться («повышать функциональное мастерство») нервная система и смежные с ней другие системы организма. При этом продолжается миелинизация аксонов и дендритов, идет глиальная дифференцировка, трофическое и иммунное обеспечение нервной ткани.
В первые 2 мес жизни в ходе аксоно-дендритного спраунинга первыми начинают ветвиться отростки пространственно отдаленных нейронов. За ними постепенно объединяются в общую межнейронную сеть нервные окончания ранее разветвившихся раздельно отростков нейронов, в которых в дальнейшем происходит синаптогенез.
В течение 3-18 мес жизни происходит интенсивное развитие связей сенсорной системы и двигательных навыков ребенка, необходимых для активных контактов с внешней средой, т.е. начинается процесс «обучения». В это время ребенок последовательно осваивает активное видение и слух, навыки держания головы, ползания, сидения, стояния, хождения, понимание обращенной речи, произношение отдельных слов и т.д. (см. главу 12). Благодаря отсроченному и последовательному спраунингу, масса каждого нейрона возрастает в 3-5 раз, что является причиной увеличения массы мозга. Ощутимый вклад в это увеличение вносит миелинизация нейронов, нервных стволов и волокон, а также пролиферация глиальных клеток. Далее постепенно формируются центральные отделы зрительного, слухового, двигательного, вкусового и тактильного анализаторов, и на их основе начинаются длительный период обучения и приобретения мозгом ребенка персонального опыта общения с окружающей средой, включающий первые 1,5-3 года жизни, дошкольный и школьный возрастные периоды. Окончательное формирование нервной системы завершается в 18-20 лет.
Апоптоз неполноценных нейронов
Апоптоз неполноценного нейрона - это его программированная гибель или «альтруистическое самоубийство». Как сказано выше, путем апоптоза уничтожаются около 5 млрд (3%) нейронов.
В апоптозе участвуют особые информационные молекулы - ФНО и интерлейкины, относящиеся к классу цитокинов, выполняющих роль переносчиков информации (нейротрансмиттеров). С их помощью регулируются метаболические, трофические, иммунные и другие процессы в нейронах (см. главу 8). ФНО продуцируются в ПВО и гипоталамусе при участии микроглии и астроцитов. Эти цитокины обладают крайне важными для клеток свойствами, выступая как факторы роста, факторы отторжения и как нейроиммуномодуляторы. Во многих случаях их влияние становится пусковым механизмом развития патологии ПВО мозга.
В частности, их высокое содержание вызывает тяжелые нарушения трофики нервной ткани (вплоть до необратимого повреждения, проявляющегося некрозом, некротическим шоком и кахексией), приводит к угнетению (и реже к усилению) пролиферации нейронов, но при этом не влияет на деление трансформированных клеток.
Нередко посредниками действия ФНО могут быть интерфероны. Кроме того, в конце внутриутробного периода ФНО стимулируют синтез простагландинов и могут вызвать преждевременные роды.
Цепочка молекулярных событий, происходящих при апоптозе, до конца не ясна, но, по-видимому, в их основе лежит механизм получения нейроном информации о несоответствии генетической программе.
Молекулярные механизмы формирования межнейронных связей
Известно, что генная сеть, участвующая в формировании и функционировании нервной системы человека, включает около 20 тыс. генов.
В нейронах одновременно экспрессируется не менее 2500 генов (среди них охарактеризовано всего 125 генов или около 5%). Причем эта часть генов резко превышает часть генов, работающих в клетках других органов. Например, из всех молекул мРНК, выделенных из клеток печени или почек, только 4-6% клеток вступают в ДНК-РНКгибридизацию, что крайне мало, так как их должно быть не менее
30%.
Кроме того, высказано предположение, что в нейронах филогенетически молодых отделов головного мозга (у человека они обеспечивают функции, отсутствующие у других биологических видов) экспрессируется больше генов, чем в старых отделах могза. Например, в пользу этого свидетельствуют данные, что в нейронах ассоциированных зон коры больших полушарий экспрессировались 35,6% генов, а в нейронах проекционных зон - 30,8%.
Эти различия, по-видимому, лежат в основе специализации разных отделов мозга при развитии разных функций. Иными словами, благодаря такой специализации в ходе нейроонтогенеза растет объем активной генетической информации.
В свою очередь, об этом свидетельствуют данные о ДНК-РНКгибридизации, согласно которым по мере увеличения интенсивно-
сти функционирования ПВО усиливаются активность и сложность генетических эффектов в нервной ткани: у 22-недельного эмбриона в нейронах мозга активны только 8% генов, тогда как у взрослых людей их более 25%.
Реализация экспрессии генов в различных областях мозга обусловливает развитие широкой сети межнейронных связей (см. ниже). Основными механизмами развития таких связей являются генерация и проведение нервного импульса и внутриклеточный транспорт структурных элементов цитоплазмы.
Генерация и проведение нервного импульса
Механизм генерации (возбуждения) и проведения нервного импульса в системе межнейронных связей заключается в появлении и быстром распространении (перемещении) реакции локальной деполяризации мембраны осевого цилиндра по длине нервного волокна.
В ходе деполяризации участка мембраны (условно назовем его первым участком) ионы Na+ меняют отрицательный заряд на положительный путем повышения проводимости этих ионов в смежном участке мембраны (второй участок), что обеспечивает выход ионов К+ на поверхность мембраны первого участка, в котором восстанавливается исходный уровень разности потенциалов, и так далее по всей мембране осевого цилиндра нервного волокна.
Нервный импульс - это быстрая реакция. Скорость деполяризации мембраны осевого цилиндра определяет скорость передачи нервного импульса, и она тем выше, чем толще осевой цилиндр. В среднем для толстых волокон она составляет 5-120 м/с, а для тонких - 1-2 м/с. При передаче нервного импульса через миелиновые волокна скорость выше, чем при передаче через безмиелиновые волокна.
Локальная деполяризация мембраны также происходит при мышечном сокращении. В этом случае прохождение нервного импульса открывает каналы, обычно закрытые для пассивного транспорта ионов Са2+, и впускает эти ионы в миофибриллы. В результате в нервно-мышечном синапсе освобождается ацетилхолин, что вызывает локальную деполяризацию мембраны. Выход ионов Са2+ из сократившихся миофибрилл происходит путем их обмена на ионы Na+ и зависит от натриевого градиента, поскольку существует другая система, обеспечивающая транспорт ионов натрия внутрь, а ионов кальция наружу мембраны (см. главу 6).
Молекулярная организация работы синаптического аппарата сложна. Нейроны, способные выделять в синаптическую щель один и тот же медиатор, объединяются в эргические системы, которые связаны между собой особыми путями - трактами, соединяющими специфические синапсы. С молекулярных позиций хорошо изучена схема работы норадреналинергического синапса (см. главу 8). В этом случае пусковым фактором служит импульс, пришедший из пресинаптической мембраны аксона в постсинаптическую мембрану клетки-мишени, в которой в ответ на импульс возбуждается сигнал, распространяющийся по аксону в пресинаптическую мембрану и в виде пузырьков с медиатором поступающий в синаптическую щель, а потом в постсинаптическую мембрану другой клеткимишени, - это прерывистый межклеточный аксоно-аксональный контакт. Прерывистость контактов необходима для поддержания быстрой скорости распространения импульса, так как возбуждение может распространяться по мембране нейрона от тела клетки и обратно.
Аксональный транспорт
Наряду с проведением нервного импульса через систему прерывистых межнейронных связей (синапсов) существует второй механизм прохождения молекулярной информации - внутриклеточный транспорт. Для нейрона, основная цитоплазма которого сконцентрирована в аксонах и дендритах, простирающихся на значительные расстояния от ядра клетки, внутриклеточный транспорт или движение элементов цитоплазмы имеет большое значение.
Аксональный транспорт в целом хорошо изучен. Среди транспортируемых элементов:
• лизосомы и пероксисомы - большие, средние и мелкие вакуоли с гидролитическими и окислительными ферментами, представляющие собой емкости для переработки отходов, или своеобразные «очистные сооружения»;
• митохондрии, производящие энергию в виде АТР, - своеобразные «электростанции»;
• микротрубочки, представленные нестабильным белком определенной полярности - тубулином, выполняющим роль транспортных путей;
• синаптические пузырьки с различными медиаторами и регуляторными ферментами;
• «строительные материалы» - белковые, липидные и другие молекулы;
• продукты распада молекул и др.
В отличие от нервного импульса, аксональный транспорт - это медленные реакции. Их средняя скорость не превышает 2 мм в сутки. Вместе с тем, у разных органелл и элементов цитоплазмы скорости транспорта разные. Так, синаптические пузырьки могут перемещаться со скоростью свыше 400 мм в сутки.
С одинаковой скоростью антеградно (к терминальной части) перемещаются «строительные материалы», а ретроградно (к ядру) - продукты их распада. При этом поддерживается баланс их перемещения: поступает ровно столько, сколько расходуется.
Митохондрии совершают маятниковые движения, двигаясь то антеградно, то ретроградно. Благодаря такому движению обеспечивается энергетическое снабжение по всей длине аксона (дендрита) нейрона.
В аксональном транспорте также принимают участие активированные нервными импульсами сократительные единицы - белки (актин, миозин, тубулин, некоторые ферменты), микротрубочки и другие элементы.
Закономерности информационного обеспечения и основное свойство коры больших полушарий мозга
Информационное обеспечение коры больших полушарий мозга базируется на следующих закономерностях:
• многоуровневое (многоэтажное) прохождение информации; основано на особенностях миграции и размещения нервных клеток при формировании нейронных модулей (колонок), являющихся структурными единицами коры больших полушарий;
• прерывистость прохождения информации в синапсах между этажами, характерная для всей сети межнейронных связей;
• постоянство активности коры мозга; обеспечивается ретикулярной субстанцией, контролирующей прохождение информации между этажами и ее прерывистость в синапсах; при избытке информации эта субстанция ее аккумулирует, создавая резервы, а при недостатке - добавляет из резервов, поддерживая равномерную интенсивность потоков и, следовательно, постоянную активность коры;
• дублирование информационных каналов; основанное на межнейронных связях, формирующих единую сеть рецепторных оконча-
ний, расположенных во всех частях организма; рецепторы этой сети воспринимают разную по содержанию и назначению информацию, в том числе одной направленности; например, положение тела в пространстве контролируется с помощью потоков информации, поступающей в кору головного мозга одновременно от зрительного, вестибулярного и слухового анализаторов, а также рецепторов мышц, кровеносных сосудов, рук, ног, туловища и головы; поэтому в случае ошибок приема и переключения информации кора мозга все-таки получает необходимую информацию и дает правильный ответ. Указанные закономерности позволяют коре больших полушарий анализировать восходящие к ней потоки информации, переключать их в синапсах, изменять скорости проведения, фильтровать (отсеивать) наименее значимую, пропускать и доставлять по месту назначения наиболее значимую информацию, увеличивать или уменьшать ее объемы, поддерживать равномерную интенсивность потоков, адаптироваться к окружающей среде, принимать своевременные и адекватные решения, реализуемые в разнообразных функциях, и, следовательно, поддерживать постоянную активность коры.
Вместе с тем, эти закономерности обеспечивают развитие основного свойства коры больших полушарий - способность отражать (запечатлять) результаты действия факторов окружающей среды.
В случае нормального нейроонтогенеза это свойство проявляется на морфологическом уровне как специфическая картина зрелой межнейронной сети с особенностями цитоархитектоники и миелоархитектоники (при УЗИ, КТ- и ЯМР-томографии). На физиологическом уровне это свойство выражается как проявление обычного сознания и реализация основных нервных и высших психических функций.
Признаками отражения и адаптации коры к окружающей среде являются:
• готовность к функциональным переменам и последовательной смене старых функций на новые функции и навыки в критические периоды развития;
• полноценное развитие функций и навыков при минимальных энергетических затратах (см. предыдущую главу);
• восполнение утрачиваемых элементов нервной ткани и выбор наиболее эффективных межнейронных сетей при их интенсивной работе;
• пластичность (компенсаторность) функционирования структур мозга в изменяющихся условиях среды при одновременном сохранении их автономности. Важно подчеркнуть особое значение этих признаков при проведении терапии заболеваний, проявляющихся патологией ПВО мозга.
Нарушения нейроонтогенеза как результат первичного поражения перивентрикулярной области мозга
Нарушения нейроонтогенеза относятся к одной из нерешенных проблем нейрогенетики. Их систематизация представляет значительные трудности, объясняемые участием нервной системы практически во всех патологических процессах. Это относится как к наследственной, так и к ненаследственной патологии.
Нервная система поражается не только первично, но и вторично, на фоне поражения других систем организма, либо одновременно с ними в результате общих механизмов.
На ранних этапах нейроонтогенеза мозг эмбриона почти исключительно представлен ПВО, к сфере деятельности которой относятся: миграция и размещение нейронов, образование нейронных колонок, рост аксонов и дендритов, формирование синапсов. ПВО регулирует эти процессы на основе химического узнавания своих нейронов среди множества чужих, что сближает ее с иммунной системой.
Находясь на границах капиллярного кровотока и цереброспинальной жидкости, ПВО выполняет защитные (барьерные) функции, что также сближает ее с иммунной системой. В качестве барьеров выступают астроцитарные клетки, играющие роль рецепторов, воспринимающих молекулярную информацию из капиллярного кровотока и при циркуляции ликвора.
Таким образом, ПВО является особой системой мозга. Она обеспечивает медленные процессы его развития, выполняя формообразующую (ростовую) функцию, сохраняя трофический и иммунный гомеостаз нервной ткани и выступая в роли «стража» (гематоэнцефалический и ликвороэнцефалический барьеры) на границах между капиллярным кровотоком или ликвором с одной стороны и мозгом, с другой стороны.
При патологии ПВО все эти медленные процессы тормозятся и останавливаются, приводя к неврологической патологии. На рис. 51 показана роль ПВО мозга в развитии такой патологии.
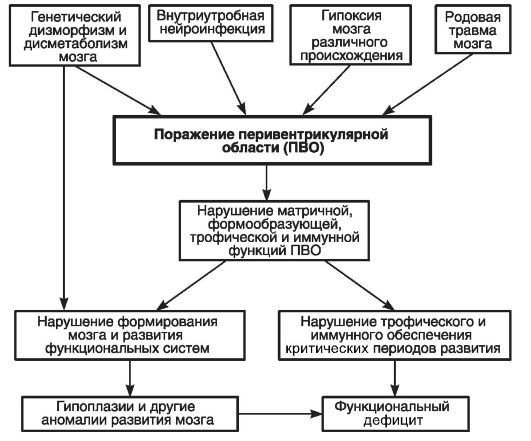 Рис. 51. Роль ПВО мозга в нарушении матричной, формообразующей, трофической и иммунной функций (по Скворцову И.А., 2000)
Рис. 51. Роль ПВО мозга в нарушении матричной, формообразующей, трофической и иммунной функций (по Скворцову И.А., 2000)
ПВО поражается при морфогенетических нарушениях и нарушениях метаболизма мозговых структур, нейроинфекции, гипоксии мозга и родовой травме. Поражение ПВО, возникшее в результате этих причин, ведет к нарушениям формообразования структур мозга, гипоплазии и другим его аномалиям, нарушениям трофического и иммунного обеспечения критических периодов нейроонтогенеза и как следствие - к функциональному дефициту мозга. На рис. 52 представлена схема взаимосвязи основных причин и результатов поражения ПВО мозга.
Функционирование ПВО зависит от гестационной незрелости (влияние эндотоксинов, ФНО и других цитокинов), а также от перинатального неблагополучия (гипоксия и родовая травма). Наряду с этими причинами в перечне причин такой зависимости
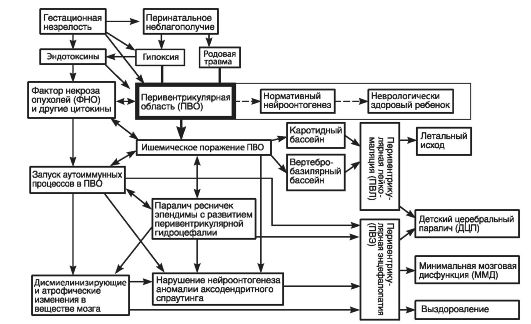 Рис. 52. Примерная схема взаимосвязи основных причин и результатов поражения ПВО мозга (по Скворцову И.Α., 2001)
Рис. 52. Примерная схема взаимосвязи основных причин и результатов поражения ПВО мозга (по Скворцову И.Α., 2001)
значатся недоношенная беременность, фетоплацентарная недостаточность в результате инфицирования матери во время беременности, инфаркты плаценты, внутриутробное инфицирование плода, повышенное давление ликвора в желудочках мозга, малый вес и артериальная гипертензия на фоне дыхательных расстройств у новорожденного, НБО, хромосомные синдромы, первичные нейрогенетические заболевания нейрона и глиальных элементов, болезни рецепторов, трансмембранного транспорта разных ионов и нейромедиаторов.
Все перечисленные причины нарушают формообразование, трофику и иммунную защиту мозга и даже при слабо выраженных изменениях ведут к гипоплазии и/или незначительному функциональному дефициту, а при изменениях средней и тяжелой степени - к перивентрикулярной энцефалопатии (ПВЭ) и лейкомаляции соответственно.
В ряде случаев изменения ПВО имеют общие механизмы. Например, внутриутробная нейроинфекция и/или гипоксия плода могут вызвать паралич ресничек эпендимы, выстилающей стенки желудочков мозга и спинномозгового канала, что обусловит развитие врожденной (вентрикулярной) гидроцефалии, повышение внутричерепного давления, нарушение циркуляции ликвора и таким образом приведет к задержке аксонального и дендритного спраунинга, синаптогенеза, дистрофическим или деструктивным изменениям в коре и подкорковых образованиях.
Среди тяжелых перинатальных поражений ПВО следует отметить действие эндотоксинов кишечника, стимулирующих у плода и новорожденного продукцию ФНО, интерлейкинов и других цитокинов, приводящих к расстройствам микроциркуляции, апоптозу и аутоиммунным нарушениям в тканях мозга. При этом аутоиммунные механизмы реализуются путем возникновения ишемических и геморрагических очагов в бассейнах каротидной и вертебробазилярной сосудистых систем ПВО, коре больших полушарий, подкорковых и стволово-мозжечковых структурах с последующими дистрофическими или деструктивными изменениями в них в виде дисмиелинизации и атрофии, что может привести к смерти. Однако значительно чаще в ПВО развиваются не грубые деструктивные процессы (лейкомаляция), а дистрофия, в основе которой лежат долговременные метаболические, трофические и иммунные нарушения (энцефалопатия).
Вместе с тем, если основные формообразующие процессы в мозге уже завершились, то эти изменения ограничиваются незначительными нарушениями трофики и иммунного обеспечения нервной ткани.
СОЧЕТАННЫЕ ПОРАЖЕНИЯ ФУНКЦИОНАЛЬНЫХ СТРУКТУР МОЗГА
В ходе эволюции в структурах мозга наряду с медленной функциональной системой были сформированы и объединены быстрые системы. В этом случае речь идет о таких областях мозга, нейроны которых образуют лимбическую и стриопаллидарную системы, ретикулярную субстанцию и диэнцефальную область.
Эти функциональные образования (так же, как ПВО) отвечают за реализацию жизненно важных функций и обеспечивают постоянную активность коры больших полушарий. Поэтому их поражение обусловливает нарушения развития психических и нервных функций.
В связи с этим у больных с поражением ПВО часто наблюдается сочетание нарушений развития психоневрологических функций с разными формами ДЦП, ранним детским аутизмом, изолированными дисфазиями и другими нарушениями речевого развития, умственной отсталостью (УО) и олигофренией, врожденной перинатальной слепотой и тугоухостью.
Сочетающиеся с другой патологией поражения ПВО наблюдаются при:
• врожденных болезнях нервной системы (анэнцефалия, прозэнцефалия с дефицитом мозгового вещества и межнейронных сетей, дефекты нервной трубки, тканевые и органные дисплазии);
• хромосомных синдромах, обусловленных структурными мутациями;
• факоматозах (туберозный склероз, атаксия-телеангиэктазия и
др.);
• синдромах Ангельмана , Мартина-Белл, Прадера-Вилли , Ретта и Фара;
• ФКУ, сочетающейся с УО;
• аутистических синдромах, сочетающихся с УО;
• болезнях, связанных с нетрадиционным наследованием генов и признаков (болезни накопления, митохондриальные и перокси-
сомные болезни, болезни импринтинга, экспансии числа нуклео-
тидных повторов). Основными причинами нарушений нейроонтогенеза являются геномные мутации, обусловливающие наследственные дефекты метаболизма в нервной системе и экстраневральных системах, а также хромосомные нарушения и пороки развития. Наряду с ними существенную роль играют факторы среды, включающие гипоксические, травматические, сосудистые и инфекционные поражения мозга во внутриутробном, перинатальном и постнатальном периодах развития.
Все эти причины ведут к болезням нейрона, нарушениям развития психоневрологических функций, болезням и аномалиям развития, связанным с недостижением мозгом «критической массы». В их основе лежит нарушение аксоно-дендритного спраунинга и формирования единой сети межнейронных связей, большая часть которой (до 80%) приходится на головной и спинной мозг.
Синдром нарушений развития психоневрологических функций
Данный синдром отражает отклонения в развитии мозговых структур от генетической программы нейроонтогенеза. Эти нарушения включают 5 групп изменений психоневрологических функций: двигательных (например, ДЦП), перцептивных (тугоухость и снижение зрения), интеллектуальных (УО и олигофрения), речевых (дизартрия и дисфазия) и коммуникативных (замкнутость, привязчивость, эмоциональная расторможенность, аутистические проявления).
Указанные изменения могут быть транзиторными и проявляться как временная задержка и десинхронизация темпов развития, но могут трансформироваться в постоянные изменения. При этом важную роль играют критические периоды нейроонтогенеза, в которые реализуются генетические и негенетические причины.
Классификация и примеры первичных нейрогенетических болезней
Первичные нейрогенетические заболевания (ПНГЗ) делятся на две группы.
Первая группа ПНГЗ - болезни нейрона и элементов его цитоплазмы, дефекты которых нарушают механизмы возбуждения и проведе-
ния нервного импульса в мембранах нейронов и внутриклеточного транспорта в аксонах и дендритах.
Вторая группа ПНГЗ - болезни клеток нейроглии, нарушающие гематоэнцефалический и ликвороэнцефалический барьеры, а также опорную, трофическую, иммунную и секреторную функции.
К ПНГЗ относятся болезни:
• метаболизма и катаболизма белков, липидов и углеводов, формирующих клетки-предшественники, сами нейроны и клетки глии;
• структуры и функционирования лизосом, митохондрий и пероксисом, обеспечивающих хранение и переработку «отходов» и энергоснабжение клетки;
• структуры и функционирования ЭР и аппарата Гольджи, контролирующих формообразующие, регенеративные, трофические, секреторные и другие процессы, связанные с синтезом, сортировкой и рассылкой разных молекул по назначению («молекулярная почта»).
Следует отметить, что это всего лишь рабочая классификация ПНГЗ, не претендующая на полноту охвата всего их спектра, т.е. она достаточно условна.
Вместе с тем, эта классификация учитывает возможность неограниченного ее дополнения новыми группами заболеваний, например болезнями синаптогенеза, болезнями, связанными с нарушениями переработки внутриклеточных отходов и последующим производством из них «строительных материалов», болезнями рецепции информации, болезнями кринирования нейромедиаторов и т.д.
Кроме того, в последние годы многочисленными примерами ПНГЗ стали:
• болезнь Альцгеймера , старческое слабоумие (4 генокопии: 1q31- q42; 17q11.2; 19q13.2 и 21q21.3-q22.05 и вариант прионной болезни) - см. главу 29;
• псевдогипертрофические мышечные дистрофии Дюшенна и Беккера (Хр21.2, ген DMD);
• болезни «центрального стержня»: отсутствие митохондрий и саркоплазматической сети в сердцевине мышечных волокон, немалиновая дистрофия (дефекты нитеобразного и палочковидного стержней или Z-линий);
• центронуклеарная или миотубулярная миопатия (отсутствие миофибрилл и центрального расположения ядер);
• аксональная полиневропатия (аномалии белков и структур цито-
скелета, нарушения антеградного и ретроградного транспорта, мембранного транспорта и дефекты митохондрий);
• болезни трех рецепторов соединительной ткани, включая дефекты фактора роста фибробластов - синдромы Апера и Бира-Стивенсона (10q25.3-q26), синдром Пфайффера (8р12), ахондроплазию, томатоформную дисплазию и изолированный краниостеноз (4р16.3);
• болезни рецепторов андрогенов (Xq11-q12), включая синдром тестикулярной феминизации Морриса, синдром Ренфейнштейна с мужским псевдогермафродитизмом, болезнь Кеннеди с нейропатией и нарушениями половой дифференцировки (см. главы 16
и 23);
• болезни гликокортикоидных рецепторов (5q31), включая гомозиготный вариант болезни Аддисона с отсутствием реакции на АКТГ (18р11.2);
• болезни ацетилхолиновых рецепторов мышц, объединенных общим названием - «миастения«.
Безусловно, к ПНГЗ следует отнести ряд заболеваний материнского наследования: гликогенозы, мукополисахаридозы, муколипидозы, а также болезни, связанные с нарушениями трансмембранного транспорта разных ионов, включая гипокалиемический (1q31-q32) и гиперкалиемический (17q23.1-q25.3) периодический паралич, парамиотонию Эйленбурга (тот же локус 17q23.1-q25.3), врожденную миотонию Томсена (7q35) и др.
К болезням нейроглии относится синдром Картагенера (14q32; ген DNECL) или болезнь неподвижных ресничек, для которой характерно обратное расположение внутренних органов.
Другими примерами заболеваний этого класса являются разные типы моторно-сенсорных нейропатий и, в частности, нейропатия IX типа, в основе которой лежат множественные мутации гена GJB1, контролирующего синтез белка - коннектина 32 (Сх32), участвующего в образовании щелевых соединений и ионных каналов в леммоцитах (шванновских клетках) миелиновых оболочек. Всего было идентифицировано свыше 230 мутаций гена GJB1, приводящих к нарушению проведения нервного импульса по периферическим волокнам.
Как причины тяжелого поражения ПВО мозга были выделены транзиторные ишемии с дистрофическими изменениями нейронов, а также макро- и микроглии.
Оказалось, транзиторные ишемии глиальных элементов могут компенсироваться и не вызывать отрицательных последствий, но могут и привести к запуску пролиферации клеток, усилению активности макрофагов и других реакций гуморального иммунитета, приводящих к тяжелым изменениям вплоть до расширения желудочков мозга, атрофии коры больших полушарий, червя и коры мозжечка, а также ствола головного мозга.
ЗАКЛЮЧЕНИЕ
Развитие и функционирование нервной системы, реализация высших психических и основных нервных функций человека базируются на особенностях строения и функционирования его генома.
В настоящее время из-за отсутствия совершенных геномных и протеомных технологий невозможен глубокий молекулярный анализ нарушений ПВО мозга, а также нарушений развития психоневрологических функций. Вместе с тем, имеются определенные достижения в изучении способности нейрона генерировать нервный импульс и передавать его по системе межнейронных связей на ткани рабочих органов и высшие структуры мозга.
Биохимическими посредниками при передаче нервного импульса служат нейромедиаторы (их известно около 30), которые могут возбуждать (стимулировать) или угнетать (тормозить) его проведение.
Большим достижением молекулярной медицины явилось открытие химической специализации нейронов. Разные нейроны обрабатывают разную, но всегда соответствующую только их функциональному назначению молекулярную информацию, оценивают ее и адекватно на нее реагируют, потребляя ресурсы специфических химических веществ (медиаторов), содержащихся в клетке и организме.
Очевидно, что для эффективного функционирования нейронов необходим синтез конкретных (только для них) химических веществ, что, безусловно, контролируется генотипом. Если учесть, что число всех синапсов у человека составляет 1014, а генов в генотипе только 40 тыс., то химическая (медиаторная) специализация нейронов, по-видимому, каждый раз кодируется каким-то одним или несколькими генами, тогда как целенаправленный рост аксона нейрона к своей клетке-мишени обусловлен общими регуляторными механизмами.
Закодированная в генах морфологическая, функциональная и химическая специализация нейронов проявляется при образовании
специфических рецепторов на поверхности мембран, обладающих избирательной чувствительностью к конкретным медиаторам.
Медиаторная специализация нейронов проявляется в строении их секреторного аппарата, обеспечивающего синтез белков-ферментов, соответствующих поступающей к ним информации. Соотношение медиаторов в разных нейронах в разные периоды нейроонтогенеза определяет точные сроки экспрессии нейрональных генов.
Выделена особенность нейроонтогенеза: избыточность (резерв) нейронов. В ходе нейроонтогенеза нейроны, оказавшиеся незадействованными либо функционально неполноценными, постепенно утрачиваются путем апоптоза (резерв остается), а их отростки и контакты элиминируются и (благодаря этому) постоянно уточняется генетическая программа нейроонтогенеза. Иными словами, гибель нейронов как бы исключает дальнейший постнатальный рост их числа.
Избыточность и элиминация нейронов - это два сопряженных механизма функционирования коры мозга. Интенсивный и избыточный синаптогенез происходит в течение первых 10-15 лет жизни. Параллельно (по мере «выбраковки» неполноценных нейронов) уменьшается общее количество контактов между ними, достигая количества, типичного для взрослого организма. При этом сохраняются именно те контакты, которые были непосредственно вовлечены в проведение молекулярной информации, т.е. это прямой результат отражения корой мозга «накопленного ею» опыта взаимодействия с окружающей средой или результат ее обучения (адаптации) такому взаимодействию.
Избыточность межнейронных контактов особенно заметна у детей, наиболее приспособленных к обучению. Именно поэтому следует учитывать компенсаторные возможности головного мозга детей при назначении им корректирующей терапии различных психоневрологических нарушений. Если при некоторых первичных генетических неврологических заболеваниях, например при врожденном гипотиреозе или ФКУ, своевременно (до 3-6 мес жизни ребенка) заблокировать образование вредных метаболитов, то грубого повреждения мозга не будет, и у ребенка не проявится задержка психомоторного и физического развития, а впоследствии не разовьется интеллектуальный дефицит. Также эффективно можно избежать повышения уровня ганглиозидов, предшествующих развитию интеллектуальнопознавательной недостаточности, а при снижении их уровня - развитию ДЦП.