Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ТЕМА I. МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
На изучение темы отводятся три занятия, включающие краткое рассмотрение основных теоретических положений, решение задач по теме и экспериментальную часть.
Цель изучения темы
На основе знаний теории метода кислотно-основного титрования научиться обоснованно использовать метод для определения кислот, оснований, солей; приобрести навыки практической работы с лабораторным оборудованием при проведении титриметрического анализа; научиться строить кривые кислотно-основного титрования и выбирать индикатор для титрования; научиться выполнять количественные расчеты содержания определяемого вещества в анализируемом растворе по результатам титрования.
Целевые задачи
1. Знакомство с правилами работы в химико-аналитической лаборатории и освоение техники выполнения титриметрического анализа преимущественно полумикрометодом.
2. Проведение количественного определения массы щелочей, карбонатов и солей аммония в анализируемых растворах.
3. Проведение расчетов, необходимых для построения кривых кислотно-основного титрования, индикаторных ошибок, расчетов количественного содержания определяемых веществ в растворе по результатам титрования, проведение статистической обработки полученных результатов анализа.
4. Оформление протокола проведенной лабораторной работы.
Общая характеристика методов
Кислотно-основное титрование - метод определения кислот и оснований, основанный на использовании протолитических реакций между определяемым веществом и титрантом.
Титрантами метода являются растворы сильных кислот (обычно серной и хлороводородной) и сильных оснований (обычно натрия гидроксида, калия гидроксида). Концентрацию растворов титрантов устанав-
ливают путем их стандартизации по первичным стандартам, в качестве которых чаще всего используют декагидрат натрия тетрабората, безводный натрия карбонат, дигидрат щавелевой кислоты.
Для определения веществ, обладающих кислотными свойствами, в качестве титранта применяют растворы сильных оснований (алкалиметрия). При этом в процессе титрования в растворе протекает реакция, которую в общем случае можно записать в виде:
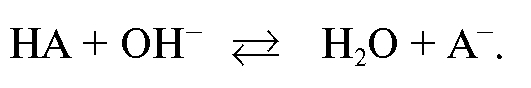
При титровании веществ, обладающих основными свойствами, в качестве титранта применяют растворы сильных кислот (ацидиметрия). В растворе протекает реакция, которую в общем случае можно записать в виде: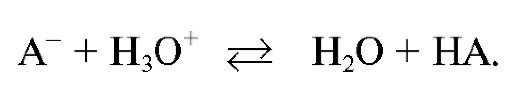
В Государственной фармакопее этот метод рекомендован для определения хлороводородной кислоты, аммиака, натрия гидрокарбоната, натрия тетрабората, ароматических кислот (бензойной, салициловой) и их производных (натрия бензоата, натрия салицилата, ацетилсалициловой кислоты и др.). Методом кислотно-основного титрования также определяют уксусную кислоту, щелочи в биологических материалах при проведении судебно-химического анализа.
Занятие 1. Приготовление раствора хлороводородной кислоты и его стандартизация
Цель занятия
Приготовить титрант - раствор хлороводородной кислоты - и стандартизовать его.
Целевые задачи
1. Приготовление раствора хлороводородной кислоты путем разбавления концентрированного раствора.
2. Приготовление стандартного раствора натрия тетрабората
по навеске с точно известной массой и расчет его концентрации.
3. Стандартизация раствора хлороводородной кислоты по натрия тетраборату.
4. Освоение техники выполнения титриметрического анализа.
Задание для самоподготовки
К занятию необходимо знать
1. Сущность титриметрических методов анализа.
2. Способы выражения концентраций растворов, применяемые в титриметрическом анализе.
3. Сущность метода кислотно-основного титрования, методику стандартизации раствора хлороводородной кислоты по натрия тетраборату.
Уметь
1. Брать навеску с точно известной массой на аналитических весах. Готовить растворы веществ с заданной концентрацией.
2. Рассчитывать молярную массу эквивалента кислот, солей, оснований по уравнениям реакций.
3. Связывать разные способы выражения концентрации вещества в растворе, переходить от массовой доли вещества к молярной концентрации эквивалента вещества и наоборот с использованием справочных данных.
4. Рассчитывать рН растворов сильных и слабых кислот, оснований.
5. Составлять ионные уравнения реакций нейтрализации, ионизации слабых кислот и слабых оснований.
Список литературы
1. Лекция «Титриметрический анализ. Основные понятия. Классификация методов титриметрического анализа. Кислотно-основное титрование».
2. Учебник. - Книга 2, глава 3. - С. 68-128.
3. Справочник.
Вопросы для самопроверки
1. Перечислите виды мерной химической посуды, используемой в титриметрическом анализе.
2. Сформулируйте закон, который лежит в основе расчетов в титриметрическом анализе. Напишите его математическое выражение.
3. Перечислите основные способы выражения концентрации растворов, применяемые в титриметрическом анализе.
4. Дайте определения понятий: «титрование», «титрант», «аликвотная доля», «точка эквивалентности», «конечная точка титрования».
5. Какие требования предъявляются к химическим реакциям, применяемым в титриметрическом анализе?
6. Перечислите требования, предъявляемые к стандартным веществам.
7. Какие растворы называются стандартными? Что такое стандартизация раствора?
8. Что такое интервал перехода окраски индикатора, показатель титрования рТ? Для чего используют индикаторы при титровании?
9. Какие вещества можно определять методом кислотно-основного титрования? Что такое ацидиметрия и алкалиметрия?
10. Какие титранты применяют в методе кислотно-основного титрования?
11. Назовите основные стандартные вещества метода кислотноосновного титрования и напишите их формулы. Чем объясняется щелочная реакция раствора натрия тетрабората?
12. Назовите наиболее часто применяемые индикаторы метода кислотно-основного титрования. Укажите интервалы перехода окраски и рТ для этих индикаторов.
13. В чем состоит сущность методики стандартизации раствора хлороводородной кислоты по натрия тетраборату? Напишите соответствующие уравнения реакций.
Лабораторная работа
Реактивы
1. Натрия тетраборат декагидрат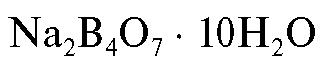 (ч.д.а).
(ч.д.а).
2. Концентрированная хлороводородная кислота с известной плотностью.
3. Водный раствор индикатора метилового оранжевого (0,1%).
4. Смешанный индикатор: смесь равных объемов водных растворов метилового оранжевого (0,10%) и индигокармина (0,25%).
Учебные таблицы
1. Приспособления для титриметрического анализа.
2. Техника работы с пипетками.
3. Техника работы с бюретками, отсчеты объемов по бюретке.
4. Техника титрования.
1. Приготовление раствора хлороводородной кислоты
Для выполнения работы готовят 500 мл раствора хлороводородной кислоты с примерной молярной концентрацией 0,1 моль/л. Раствор готовят путем разбавления концентрированного раствора хлороводородной кислоты с известной плотностью. Молярную концентрацию исходного раствора кислоты находят по табл. 17 «Справочника».
Необходимый объем концентрированного раствора кислоты вычисляют из соотношения (2.7), которое в данном случае имеет вид:
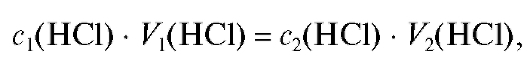
где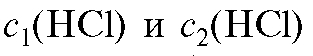 - значения молярных концентраций раствора кислоты
- значения молярных концентраций раствора кислоты
до и после разбавления соответственно;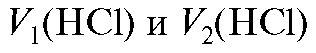 - объемы исходного
- объемы исходного
и конечного растворов кислоты соответственно.
Рассчитанный объем концентрированной хлороводородной кислоты отмеряют с помощью мерного цилиндра или градуированной пробирки и переносят в склянку вместимостью 0,5-0,1 л, прибавляют до 500 мл дистиллированной воды, перемешивают и закрывают пробкой. На склянку наклеивают этикетку с указанием содержимого и номера студенческой группы.
2. Приготовление стандартного раствора натрия тетрабората
Для выполнения работы готовят 250 мл стандартного раствора натрия тетрабората с молярной концентрацией эквивалента 0,1 моль/л. Раствор натрия тетрабората готовят по навеске с точно известной массой из декагидрата натрия тетрабората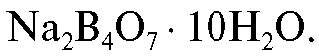 Необходимую теоретиче-
Необходимую теоретиче-
скую массу навески кристаллогидрата рассчитывают по формуле (2.10), которая в данном случае имеет вид:
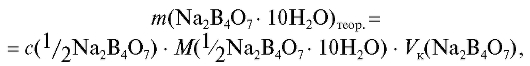
где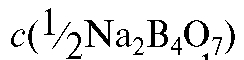 - молярная концентрация эквивалента натрия тетрабората
- молярная концентрация эквивалента натрия тетрабората
в растворе;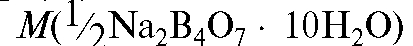 - молярная масса эквивалента натрия те-
- молярная масса эквивалента натрия те-
трабората декагидрата, которую находят в соответствии с уравнением реакции
натрия тетрабората с сильной кислотой (см. ниже) и по табл. 4 «Справочника»; 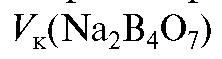 - объем приготавливаемого раствора натрия тетрабората.
- объем приготавливаемого раствора натрия тетрабората.
Навеску декагидрата натрия тетрабората с рассчитанной массой взвешивают на аптечных весах, затем переносят ее в стеклянный бюкс и бюкс с навеской взвешивают на аналитических весах. Записывают результаты взвешивания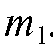 . Содержимое бюкса через сухую воронку осторожно переносят в мерную колбу на 250 мл.
. Содержимое бюкса через сухую воронку осторожно переносят в мерную колбу на 250 мл.
Бюкс с остатками буры вновь взвешивают на аналитических весах и записывают результаты взвешивания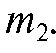 Точную массу навески соли, взятую для приготовления раствора, определяют по разности масс бюкса до и после его опорожнения:
Точную массу навески соли, взятую для приготовления раствора, определяют по разности масс бюкса до и после его опорожнения: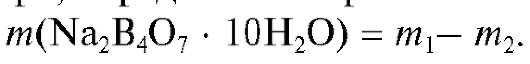 Воронку
Воронку
в мерной колбе обмывают струей горячей воды из промывалки, после чего заполняют колбу водой до половины объема. Содержимое колбы перемешивают вращательным движением до полного растворения соли, охлаждают до комнатной температуры и доливают водой до метки (последние капли добавляют с помощью пипетки). Колбу закрывают пробкой и тщательно перемешивают раствор, переворачивая колбу вверх дном несколько раз.
Концентрацию приготовленного раствора натрия тетрабората вычисляют по формулам (2.2) и (2.3), которые в данном случае имеют вид:
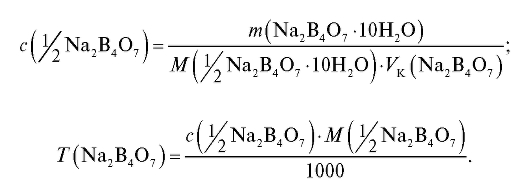
На этикетке колбы обозначают ее содержимое, фамилию студента, номер группы.
3. Стандартизация раствора хлороводородной кислоты по натрия тетраборату
Сущность методики
Стандартизацию проводят путем титрования стандартного раствора натрия тетрабората раствором хлороводородной кислоты.
Приготовленный раствор натрия тетрабората имеет щелочную реакцию вследствие гидролиза соли по аниону:
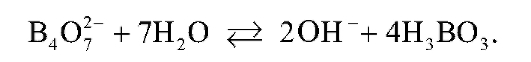
При титровании этого раствора соляной кислотой происходит связывание гидроксид-ионов в молекулы воды. Суммарное ионное уравнение взаимодействия натрия тетрабората с сильной кислотой имеет следующий вид:
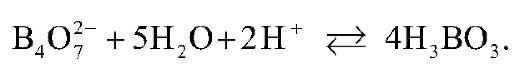
Тетраборат-ион в процессе титрования принимает два протона, поэтому фактор эквивалентности натрия тетрабората равен 1/2. Фактор эквивалентности хлороводородной кислоты равен 1.
Рассчитаем примерное значение величины рН раствора в ТЭ, в котором в соответствии с молекулярным уравнением реакции:
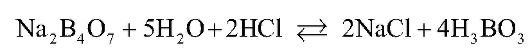
находится только натрия хлорид и слабая борная кислота. Натрия хлорид не подвергается гидролизу, поэтому рН раствора в ТЭ определяется процессом ионизации борной кислоты:
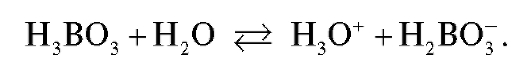
Учитывая, что молярная концентрация эквивалента натрия тетрабората и молярная концентрация хлороводорордной кислоты одинаковы и равны примерно по 0,1 моль/л, в процессе титрования до ТЭ происходит разбавление раствора примерно в два раза. Молярная концентрация натрия тетрабората в соответствии с его фактором эквивалентности равна 0,05 моль/л. Из суммарного уравнения реакции, протекающей в процессе титрования, следует, что из 1 моль натрия тетрабората образуется 4 моль борной кислоты. Именно поэтому молярная концентрация борной кислоты в ТЭ с учетом разбавления раствора при титровании равна:
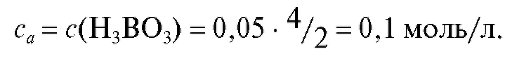
Следовательно, рН раствора в ТЭ равен:
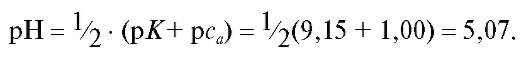
Из этого следует, что данное титрование необходимо проводить с кислотно-основными индикаторами с показателями титрования рТ, близкими к 5, т.е. с метиловым красным (рТ = 5), метиловым оранжевым (рТ = 4) или со смешанным индикатором (рТ = 4,1) («Справочник», табл. 19).
3.1. Титрование стандартного раствора натрия тетрабората раствором хлороводородной кислоты
Методика
В колбу для титрования отбирают пипеткой 2 мл стандартного раствора натрия тетрабората, добавляют 1 каплю индикатора метилового оранжевого и титруют раствором хлороводородной кислоты из бюретки вместимостью 5 мл. Перед работой пипетку ополаскивают раствором натрия тетрабората, бюретку - хлороводородной кислотой, колбу для титрования - дистиллированной водой. Титрование заканчивают при изменении окраски титруемого раствора из желтой на золотистооранжевую.
Для более точного установления конца титрования следует применять «свидетель». Для его приготовления к 10 мл воды добавляют 1 каплю раствора хлороводородной кислоты и 1 каплю индикатора. В конце титрования окраска раствора должна совпадать с окраской «свидетеля».
Вначале проводят ориентировочное титрование, добавляя титрант к раствору натрия тетрабората порциями по 0,1 мл. После этого проводят точное титрование аликвотной доли раствора натрия тетрабората, осторожно, по каплям прибавляя кислоту вблизи точки эквивалентности. Перед каждым новым титрованием раствор кислоты доливают в бюретку до «0» деления. Объем титранта отсчитывают с точностью 0,025 мл (половина маленького деления на бюретке).
Часть студентов проводит титрование со смешанным индикатором. Титрование заканчивают при переходе окраски раствора из зеленой в фиолетовую.
Титрование проводят не менее трех раз до получения воспроизводимых результатов. Результаты параллельных титрований считают воспроизводимыми, если они отличаются между собой не более чем на 0,05 мл. Полученные значения объемов титранта при проведении параллельных титрований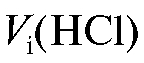 заносят в табл. 2-3.
заносят в табл. 2-3.
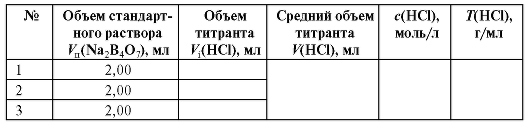
Таблица 2-3. Результаты стандартизации раствора хлороводородной кислоты
3.2. Расчет молярной концентрации и титра раствора хлороводородной кислоты
По данным табл. 2-3 рассчитывают средний объем хлороводородной кислоты V (HCl), который пошел на титрование стандартного раствора натрия тетрабората, как среднее арифметическое объемов кислоты в трех параллельных титрованиях.
Закон эквивалентов (2.11) для титрования натрия тетрабората хлороводородной кислотой имеет вид:
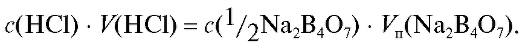
Отсюда концентрация приготовленного раствора хлороводородной кислоты равна: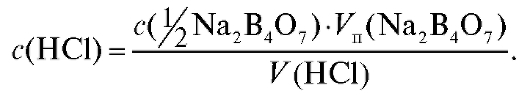
Титр хлороводородной кислоты рассчитывают по формуле (2.3), которая в данном случае имеет вид: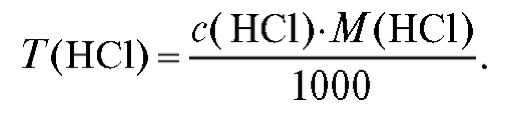
Молярную массу хлороводородной кислоты находят по «Справочнику», табл. 4. Результаты расчетов заносят в табл. 2-3.
Контрольные вопросы
1. Как рассчитать массу навески соли, необходимую для приготовления раствора с заданной концентрацией?
2. Как приготовить разбавленный раствор кислоты из более концентрированного раствора с известной плотностью?
3. Как рассчитать концентрацию стандартного раствора натрия тетрабората, приготовленного по навеске декагидрата натрия тетрабората с точно известной массой?
4. Какие индикаторы и почему можно использовать при титровании натрия тетрабората хлороводородной кислотой?
5. Почему нельзя приготовить раствор хлороводородной кислоты с точной концентрацией, а необходимо стандартизовать раствор кислоты с приблизительно известной концентрацией?
6. С какой точностью измеряют объем титранта при титровании?
7. Почему титрование натрия тетрабората хлороводородной кислотой лучше проводить со «свидетелем»? Как приготовить «свидетель» для этого анализа?
8. Напишите уравнение реакции взаимодействия раствора натрия тетрабората с серной кислотой. Чему равна молярная масса эквивалента натрия тетрабората в этой реакции?
9. Почему для титрования рекомендуется использовать растворы титранта и определяемого вещества с молярной концентрацией эквивалента по 0,1 или 0,05 моль/л?
10. Какие вещества можно использовать для стандартизации хлороводородной кислоты?
11. Как рассчитывают концентрацию хлороводородной кислоты по результатам титрования?
12. Какую окраску имеет метиловый оранжевый в растворах с рН,равным 2, 4, 7 и 11?
Занятие 2. Определение массы щелочи в растворе. Определение массы карбонатов в растворе. Определение массы щелочи и карбоната в растворе при совместном присутствии
Цель занятия
Определить массу щелочи в растворе, массу карбоната в растворе, массу щелочи и карбоната при совместном присутствии в растворе.
Целевые задачи
1. Титрование анализируемого раствора щелочи стандартизованным раствором хлороводородной кислоты и расчет содержания щелочи по результатам титрования.
2. Титрование анализируемого раствора натрия карбоната стандартизованным раствором хлороводородной кислоты и расчет содержания соли по результатам титрования.
3. Титрование раствора, содержащего смесь щелочи и карбоната, стандартизованным раствором хлороводородной кислоты и расчет содержания определяемых веществ по результатам титрования.
4. Статистическая обработка полученных результатов анализа.
Задание для самоподготовки
К занятию необходимо знать
1. Принцип построения кривых кислотно-основного титрования.
2. Принцип выбора индикатора для титрования, виды ошибок титрования.
3. Сущность методики определения массы щелочи, карбоната в растворе, массы щелочи и карбоната при совместном присутствии в растворе методом кислотно-основного титрования.
Уметь
1. Выполнять основные операции титриметрического анализа.
2. Выполнять все виды расчетов массы определяемого вещества по результатам титрования.
3. Рассчитывать молярные массы эквивалента кислот, оснований, солей в реакциях нейтрализации.
4. Рассчитывать рН растворов солей, сильных и слабых кислот и оснований, буферных растворов различного состава.
Список литературы
1. Лекции «Теория индикаторов, построение кривых титрования в методе кислотно-основного титрования. Индикаторные ошибки».
2. Учебник. - Книга 2, глава 3. - С. 68-128.
3. Справочник.
Вопросы для самопроверки
1. Дайте определение понятиям: «кривая титрования», «скачок титрования».
2. От каких факторов зависит интервал скачка титрования?
3. В каком интервале значений рН лежат скачки титрования при титровании сильного основания сильной кислотой, слабого основания сильной кислотой и слабой кислоты сильным основанием, если молярные концентрации эквивалента используемых растворов равны по 0,1 моль/л?
4. Почему при титровании слабого основания сильной кислотой (и наоборот) точка эквивалентности и точка нейтральности не совпадают?
5. По каким формулам рассчитывают рН растворов сильных и слабых кислот и оснований?
6. По каким формулам рассчитывают рН растворов средних и кислых солей, слабых одно- и двухосновных кислот?
7. Перечислите виды индикаторных ошибок.
8. В чем состоит сущность методики определения массы щелочи в растворе методом кислотно-основного титрования?
9. В чем состоит сущность методики определения массы щелочи и карбонатов в растворе при совместном присутствии?
10. Напишите в ионной форме уравнения реакций, протекающих при титровании натрия карбоната хлороводородной кислотой с индикаторами фенолфталеином и метиловым оранжевым.
Лабораторная работа
Реактивы
1. Хлороводородная кислота с (НСl) = 0,1 моль/л, стандартизованная на предыдущем занятии.
2. Водный раствор метилового оранжевого 0,1%.
3. Спиртовый раствор фенолфталеина 0,1%. Учебные таблицы
1. Кривая титрования сильной кислоты сильным основанием.
2. Кривая титрования раствора
1. Определение массы щелочи в анализируемом растворе
Сущность методики
Определение массы щелочи в анализируемом растворе проводят путем его титрования стандартным раствором хлороводородной кислоты:
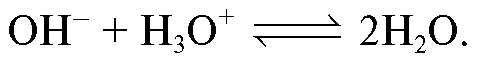
В точке эквивалентности в растворе присутствует только соль сильной кислоты и сильного основания, поэтому рН = 7,0. Скачок титрования при титровании сильного основания сильной кислотой при обычно используемых концентрациях лежит в интервале значений рН от 10 до 4, поэтому титрование можно проводить с индикаторами («Справочник», табл. 19) метиловым оранжевым (рТ = 4) или фенолфталеином (рТ = 9).
1.1. Титрование раствора щелочи хлороводородной кислотой
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают.
В колбу для титрования отбирают пипеткой аликвотную долю приготовленного раствора объемом 2 мл, добавляют 1 каплю раствора индика-
тора метилового оранжевого и титруют из бюретки раствором хлороводородной кислоты до перехода окраски из желтой в золотисто-оранжевую. При титровании используют раствор «свидетеля».
Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований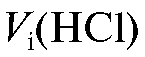 заносят в табл. 2-4.
заносят в табл. 2-4.
Таблица 2-4. Результаты титрования раствора гидроксида натрия
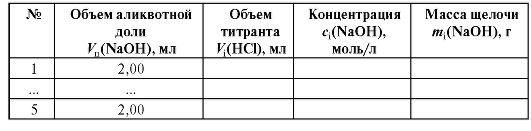
1.2. Расчет массы щелочи в анализируемом растворе
Массу щелочи в анализируемом растворе рассчитывают по результатам каждого титрования двумя способами.
1.2.1. Расчет с использованием титриметрического фактора пересчета титранта
Рассчитывают теоретический титриметрический фактор пересчета раствора соляной кислоты по натрию гидроксиду (2.4):
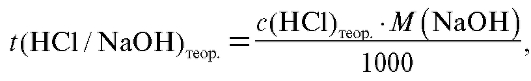
где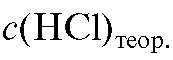 = 0,1000 моль/л.
= 0,1000 моль/л.
Рассчитывают поправочный коэффициент титранта (2.5):
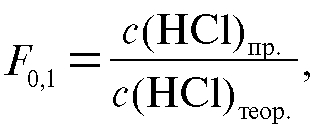
где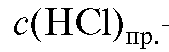 - практическая молярная концентрация кислоты, используемой
- практическая молярная концентрация кислоты, используемой
в анализе.
Значение массы щелочи в анализируемом растворе рассчитывают по формуле для прямого титрования (2.18), которая для данного случая с учетом величины поправочного коэффициента имеет вид:

где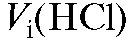 - объем титранта хлороводородной кислоты, затраченный на i-е
- объем титранта хлороводородной кислоты, затраченный на i-е
титрование.
1.2.2. Расчет с использованием молярной концентрации титранта Молярную концентрацию щелочи в анализируемом растворе рассчитывают по результатам титрования из закона эквивалентов по формуле (2.12), которая в данном случае имеет вид:
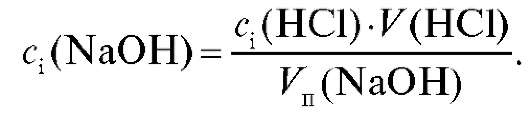
Значение массы щелочи в анализируемом растворе рассчитывают для каждого i-го титрования по формуле для прямого титрования (2.15), которая в данном случае имеет вид:
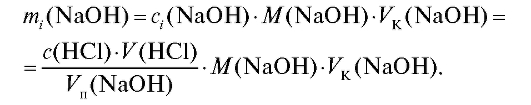
Молярную массу натрия гидроксида находят по «Справочнику» (табл. 4). По данным табл. 2-4 проводят статистическую обработку полученных результатов анализа по массе щелочи.
2. Определение массы натрия карбоната в анализируемом растворе
Сущность методики
Определение массы карбонатов в анализируемом растворе проводят путем его титрования стандартным раствором хлороводородной кислоты с индикатором метиловым оранжевым.
Количественное определение карбонатов в растворе основано на реакции превращения карбонат-ионов в угольную кислоту:
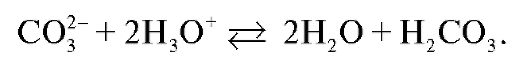
При этом в титруемом растворе в КТТ присутствует только угольная кислота. рН такого раствора определяется процессом ионизации слабой кислоты по первой ступени:
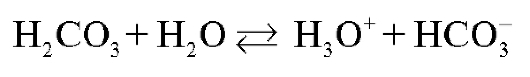
и рассчитывается по формуле:
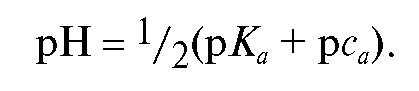
Оценим примерное значение молярной концентрации угольной кислоты в титруемом растворе в КТТ. Обычно в титриметрическом анализе используют растворы с молярной концентрацией эквивалента веществ 0,1 моль/л. Поэтому молярную концентрацию натрия карбоната в ана-
лизируемом растворе примем равной 0,05 моль/л (карбонатный ион при титровании принимает два протона, и фактор эквивалентности соли равен 1/2). В соответствии со стехиометрией реакции титрования из 1 моль натрия карбоната образуется 1 моль угольной кислоты, поэтому молярная концентрация угольной кислоты в КТТ с учетом разбавления раствора в процессе титрования примерно в два раза равна:
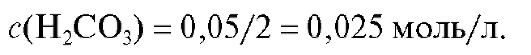
Молярная концентрация угольной кислоты в КТТ может несколько отличаться от полученного значения, однако это не вносит большой ошибки в расчет величины рН. Отсюда рН титруемого раствора в КТТ равен: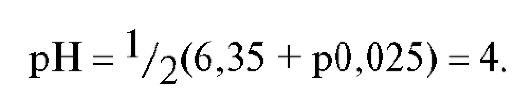
В связи с этим для индикации КТТ при титровании карбонат-иона сильной кислотой следует использовать индикатор метиловый оранжевый (рТ = 4, табл. 19 «Справочника»).
2.1. Титрование раствора натрия карбоната хлороводородной кислотой
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают.
В колбу для титрования отбирают пипеткой аликвотную долю приготовленного раствора объемом 2 мл, добавляют 1 каплю раствора индикатора метилового оранжевого и титруют из бюретки раствором хлороводородной кислоты до перехода окраски из желтой в золотисто-оранжевую. При титровании используют раствор «свидетеля».
Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов при проведении пяти параллельных титрований заносят в табл. 2-5.
заносят в табл. 2-5.
Таблица 2-5. Результаты титрования раствора натрия карбоната

2.2. Расчет массы натрия карбоната в анализируемом растворе
По данным табл. 2-5 рассчитывают массу натрия карбоната в анализируемом растворе для каждого i-го титрования по формуле для прямо-
го титрования определяемого вещества (2.15), которая в данном случае имеет вид:
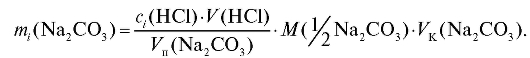
Молярную массу эквивалента натрия карбоната находят по «Справочнику» (табл. 4). По данным табл. 2-5 проводят статистическую обработку полученных результатов анализа.
3. Определение массы щелочи и карбоната при совместном присутствии
Сущность методики
Твердые щелочи и их растворы обычно содержат примеси соответствующих карбонатов. Эти вещества могут быть раздельно определены титрованием раствора стандартным раствором хлороводородной кислоты с двумя индикаторами. Сначала оттитровывают щелочь и половину карбоната (до гидрокарбоната):
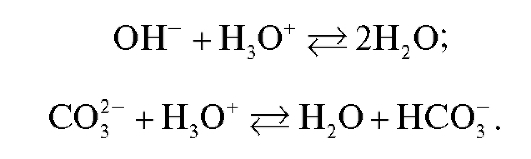
Величина рН полученного раствора, как это следует из вышеприведенных реакций, определяется присутствием только гидрокарбонатионов и равна:
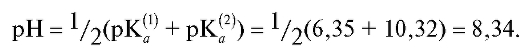
Именно поэтому для индикации КТТ при первом титровании следует использовать индикатор фенолфталеин (рТ = 9, табл. 19 «Справочника»).
Карбонатный ион является слабым двухкислотным основанием, при его взаимодействии с сильной кислотой он может присоединять один или два протона. При проведении данного титрования он присоединяет только один протон, поэтому израсходованный объем титранта при этом титровании эквивалентен всей щелочи и половине карбоната,
эквивалентен всей щелочи и половине карбоната,
присутствующих в растворе.
При дальнейшем добавлении кислоты происходит превращение гидрокарбонат-иона в угольную кислоту. Затраченный при этом объем титранта эквивалентен второй половине карбоната, содержащегося в растворе:
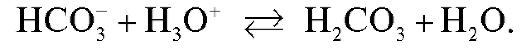
В полученном растворе присутствует только угольная кислота. Величина рН этого раствора определяется процессом ионизации угольной кислоты и равна 4 (см. предыдущую работу). В соответствии с этим второе титрование проводят с индикатором метиловым оранжевым (рТ = 4).
Объем титранта, израсходованный при титровании с двумя индикаторами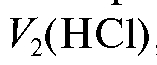 , эквивалентен щелочи и всему карбонату, присутствующим в растворе. Именно поэтому объем титранта
, эквивалентен щелочи и всему карбонату, присутствующим в растворе. Именно поэтому объем титранта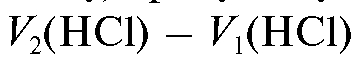 эквивалентен половине карбоната, а объем титранта
эквивалентен половине карбоната, а объем титранта 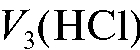 , эквивалентный всему карбонату, присутствующему в растворе, будет в два раза больше:
, эквивалентный всему карбонату, присутствующему в растворе, будет в два раза больше:
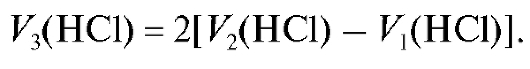
Отсюда объем титранта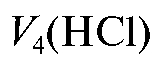 , эквивалентный щелочи в анализи-
, эквивалентный щелочи в анализи-
руемом растворе, равен:
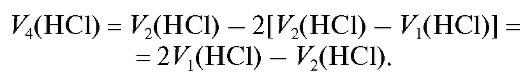
В соответствии с уравнениями реакций титрования фактор эквивалентности натрия гидроксида равен 1, а для натрия карбоната (карбонатион принимает в процессе титрования два протона) равен 1/2.
3.1. Титрование анализируемого раствора хлороводородной кислотой
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и перемешивают. В колбу для титрования отбирают пипеткой аликвотную долю приготовленного раствора объемом 2 мл, добавляют 1 каплю раствора фенолфталеина и титруют раствором хлороводородной кислоты до исчезновения розовой окраски. Записывают объем кислоты, затраченный при титровании с индикатором фенолфталеином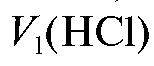 . Затем в ту же колбу для титрования добавляют 1 каплю раствора метилового оранжевого и продолжают титровать до перехода окраски раствора из желтой в золотисто-оранжевую. Записывают суммарный объем кислоты
. Затем в ту же колбу для титрования добавляют 1 каплю раствора метилового оранжевого и продолжают титровать до перехода окраски раствора из желтой в золотисто-оранжевую. Записывают суммарный объем кислоты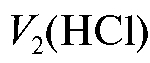 , затраченный на титрование с двумя индикаторами. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов при проведении параллельных титрований
, затраченный на титрование с двумя индикаторами. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов при проведении параллельных титрований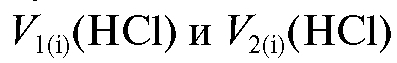 заносят в табл. 2-6.
заносят в табл. 2-6.
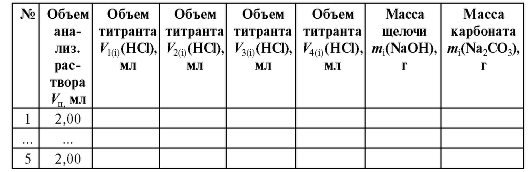
Таблица 2-6. Результаты титрования раствора натрия гидроксида и натрия карбоната при совместном присутствии
3.2. Расчет массы щелочи и карбоната в анализируемом растворе
Примечание. При определении щелочи и карбонатов при совместном присутствии массу натрия гидроксида рассчитывают с точностью до третьей цифры после запятой, а массу карбоната - до второй цифры после запятой.
По полученным результатам титрования аликвотных долей анализируемого раствора с двумя индикаторами рассчитывают объемы титранта, израсходованные в каждом титровании на щелочь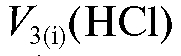 и на карбо-
и на карбо-
нат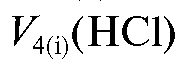 ; полученные данные заносят в табл. 2-6.
; полученные данные заносят в табл. 2-6.
Массу щелочи в анализируемом растворе рассчитывают для каждого i-го титрования по формуле для прямого титрования (2.15), которая в данном случае имеет вид:
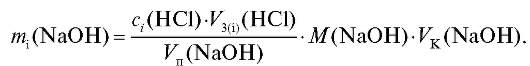
Массу натрия карбоната в анализируемом растворе также рассчитывают для каждого i-го титрования по формуле для прямого титрования
(2.15):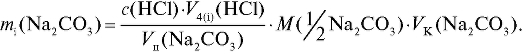
Молярную массу натрия гидроксида и молярную массу эквивалента натрия карбоната находят по табл. 4. «Справочника». По данным табл. 2-6 проводят статистическую обработку полученных результатов анализа по массе щелочи и по массе карбоната.
Контрольные вопросы
1. Какие индикаторы можно использовать при титровании раствора щелочи раствором хлороводородной кислоты?
2. Какие индикаторы применяют при титровании слабого основания сильной кислотой?
3. Почему при титровании сильной кислоты щелочью можно использовать в качестве индикатора метиловый оранжевый, метиловый красный?
4. Какие индикаторные ошибки допускают при титровании натрия гидроксида хлороводородной кислотой с метиловым оранжевым и фенолфталеином?
5. Какие индикаторные ошибки допускают при титровании уксусной кислоты раствором натрия гидроксида в присутствии фенолфталеина и метилового оранжевого?
6. Как находят фактор эквивалентности определяемых веществ при проведении кислотно-основного титрования?
7. По какой формуле рассчитывают содержание щелочи по результатам титрования аликвотной доли раствора стандартным раствором хлороводородной кислоты?
8. По каким формулам рассчитывают содержание щелочи и карбонатов при совместном присутствии по результатам титрования аликвотной доли раствора стандартным раствором хлороводородной кислоты в присутствии индикаторов фенолфталеина и метилового оранжевого?
9. По какой формуле рассчитывают содержание карбонатов по результатам титрования аликвотной доли раствора стандартным раствором хлороводородной кислоты в присутствии индикатора метилового оранжевого?
10. По какой формуле рассчитывают стандартное отклонение результатов единичного измерения? Что характеризует эта величина?
11. По какой формуле рассчитывают стандартное отклонение среднего значения?
12. По какой формуле рассчитывают доверительный интервал среднего значения?
Занятие 3. Определение массы аммиака в растворах аммониевых солей
Цель занятия
Определить массу аммиака в растворах солей аммония.
Целевые задачи
1. Определение массы аммиака в растворе аммониевой соли обратным и косвенным (заместительным) титрованием.
2. Тестовый контроль 1 по теме «Методы кислотно-основного титрования».
Задание для самоподготовки
К занятию необходимо знать
1. Сущность методов косвенного (заместительного) и обратного титрования.
2. Сущность методики определения массы аммиака в растворах аммониевых солей.
3. Теорию и практику кислотно-основного титрования. Уметь
1. Выполнять все виды операций, применяемых в титриметрическом анализе при проведении кислотно-основного титрования.
2. Решать типовые расчетные задачи по теме «Методы кислотноосновного титрования».
Список литературы
1. Лекции по теме «Метод кислотно-основного титрования».
2. Учебник. - Книга 2, глава 3. - С. 68-128.
3. Справочник.
Вопросы для самопроверки
1. Как проводят стандартизацию раствора натрия гидроксида?
2. В чем сущность метода обратного титрования? Разберите на примере определения массы аммиака в солях аммония.
3. В чем сущность метода косвенного (заместительного) титрования? Разберите на примере формальдегидного метода определения массы аммиака в солях аммония.
4. Напишите реакцию взаимодействия иона аммония с раствором щелочи.
5. Как рассчитать водородную и гидроксидную ошибки титрования?
Лабораторная работа
Реактивы
• Хлороводородная кислота с (НС1) = 0,1 моль/л, стандартизированная на предыдущем занятии.
• Стандартизованный раствор натрия гидроксида с (NаОН) = = 0,1 моль/л.
• Водный раствор формальдегида (40%), не содержащий примеси органических кислот.
• Красная лакмусовая бумага.
Прямые методы количественного определения аммиака в водных растворах солей аммония отсутствуют. Существует несколько косвенных способов определения аммиака в аммониевых солях. Для количественного анализа солей аммония, не содержащих примесей кислот и мешающих соединений, наиболее пригодными считают метод обратного титрования и формальдегидный метод.
1. Определение массы аммиака в солях аммония обратным титрованием
Сущность методики
К анализируемому раствору соли аммония, например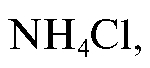 добав-
добав-
ляют точно известный избыток стандартного раствора натрия гидроксида (титрант 1). После удаления аммиака кипячением раствора:
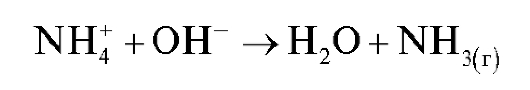
избыток щелочи оттитровывают стандартным раствором хлороводородной кислоты (титрант 2) в присутствии индикатора метилового оранжевого: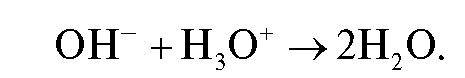
Молярную концентрацию соли аммония в анализируемом растворе рассчитывают из закона эквивалентов, связывающего реагирующие вещества в обеих реакциях (факторы эквивалентности всех участников титрования равны 1):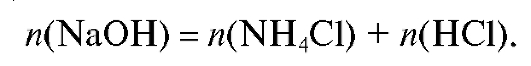
Перепишем закон эквивалентов, выразив количество вещества через соответствующие объемы и молярные концентрации веществ (2.7):
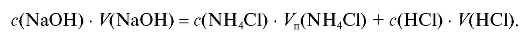
Отсюда молярная концентрация соли в анализируемом растворе, рассчитанная по результатам обратного титрования (2.19), равна:
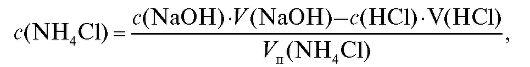
где - объем аликвотной доли раствора соли аммония, взятый для ти-
- объем аликвотной доли раствора соли аммония, взятый для ти-
трования;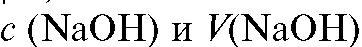 - концентрация и объем раствора щелочи (ти-
- концентрация и объем раствора щелочи (ти-
трант 1), взятого в избытке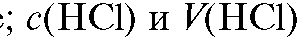 - концентрация и объем хлорово-
- концентрация и объем хлорово-
дородной кислоты (титрант 2), затраченной на титрование избыточной щелочи после удаления аммиака из раствора.
Количество вещества аммиака в анализируемом растворе равно количеству вещества соли аммония хлорида в этом растворе:

где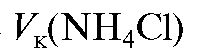 - объем анализируемого раствора.
- объем анализируемого раствора.
Отсюда масса аммиака в анализируемом растворе равна:
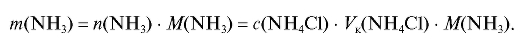
Понятно, что указанное соотношение справедливо только для солей одноосновных кислот.
1.1. Разложение соли аммония и удаление аммиака с последующим титрованием избытка натрия гидроксида раствором хлороводородной кислоты
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования отбирают мерной пипеткой аликвотную долю приготовленного раствора объемом 1 мл, добавляют из бюретки 2 мл раствора натрия гидроксида (титрант 1), предварительно стандартизованного по хлороводородной кислоте. Колбу нагревают на асбестовой сетке пламенем газовой горелки до кипения, после чего раствор осторожно кипятят еще 5-10 мин, не допуская разбрызгивания, до полного удаления аммиака из раствора.
Полноту удаления аммиака проверяют, держа над паром полоску влажной красной лакмусовой бумаги, которая не должна синеть, если весь аммиак улетучился. Содержимое колбы охлаждают, обмывают стенки колбы водой до восстановления первоначального объема раствора 3 мл, добавляют 1 каплю индикатора метилового оранжевого и титруют стандартизованным раствором хлороводородной кислоты (титрант 2) до появления золотисто-оранжевой окраски раствора. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта 2 при проведении параллельных титрований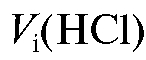 заносят в табл. 2-7.
заносят в табл. 2-7.
Таблица 2-7. Результаты титрования раствора аммония хлорида методом обратного титрования
1.2. Расчет массы аммиака в растворе соли аммония
По данным табл. 2-7 рассчитывают для каждого i-го титрования массу аммиака в анализируемом растворе аммониевой соли по формуле для обратного титрования (2.20), которая в данном случае имеет вид:
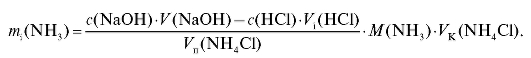
По полученным данным можно рассчитать ошибку титрования. При титровании натрия гидроксида хлороводородной кислотой с индикатором метиловым оранжевым допускается положительная водородная ошибка, которую рассчитывают по формуле:
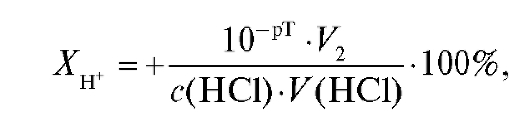
где V2 - объем титруемого раствора в КТТ, л.
По данным табл. 2-7 проводят статистическую обработку полученных результатов анализа по массе аммиака. Молярную массу аммиака находят по табл. 4 «Справочника».
2. Определение массы аммиака в растворе соли аммония формальдегидным методом (косвенное титрование)
Сущность методики
При взаимодействии солей аммония с избытком формальдегида в водном растворе образуется гексаметилентетрамин (уротропин) и выделяется эквивалентное количество сильной кислоты:
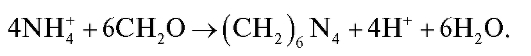
Выделившуюся кислоту (заместитель) титруют стандартным раствором натрия гидроксида с индикатором фенолфталеином (гексаметилентетрамин - основание, поэтому в точке эквивалентности титруемый
раствор должен иметь щелочную среду). Объем щелочи, который пошел на титрование кислоты, эквивалентен содержанию аммиака в соли аммония.
2.1. Замещение иона аммония эквивалентным количеством сильной кислоты и титрование последней раствором натрия гидроксида
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования отбирают аликвотную долю объемом 2 мл анализируемого раствора, добавляют 1 мл раствора формальдегида, выдерживают в течение 1-2 мин, затем добавляют 1 каплю фенолфталеина и титруют стандартизованным раствором щелочи до появления бледно-розовой окраски, не исчезающей в течение 30 с.
Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований Vi (NaOH) заносят в табл. 2-8.
Таблица 2-8. Результаты титрования раствора аммония хлорида методом косвенного титрования

2.2. Расчет массы аммиака в растворе соли аммония по результатам косвенного титрования
По данным табл. 2-8 рассчитывают для каждого i-го титрования массу аммиака в анализируемом растворе по формуле для заместительного титрования (2.15) с использованием молярной концентрации титранта:
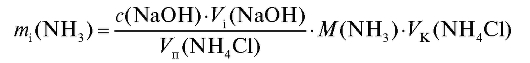
или с использованием титриметрического фактора пересчета титранта по определяемому веществу по формуле (2.18), которая в данном случае с учетом величины поправочного коэффициента имеет вид:
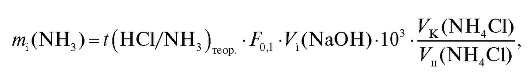
где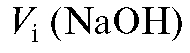 - объем титранта, затраченный на титрование аликвотной доли
- объем титранта, затраченный на титрование аликвотной доли
анализируемого раствора, л.
Теоретический титриметрический фактор пересчета титранта натрия гидроксида по аммиаку рассчитывают по формуле (2.4), которая в данном случае имеет вид:
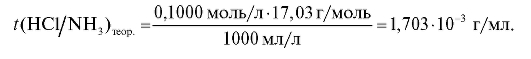
По полученным данным можно рассчитать ошибку титрования. При титровании сильной кислоты раствором натрия гидроксида с индикатором фенолфталеином допускается положительная гидроксидная ошибка, которую рассчитывают по формуле:
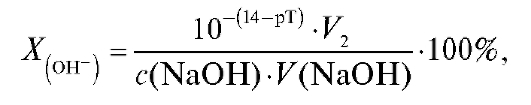
где V2 - объем титруемого раствора в КТТ, л.
По данным табл. 2-8 проводят статистическую обработку полученных результатов анализа.
Контрольные вопросы
1. Можно ли использовать формальдегидный метод определения аммиака в растворе солей аммония, содержащем примесь кислот? Ответ мотивируйте.
2. Можно ли использовать обратное титрование для определения аммиака в растворе солей аммония, содержащих посторонние соли и кислоты? Ответ мотивируйте.
3. Объясните, почему титрование раствора кислоты раствором щелочи в присутствии уротропина необходимо проводить с индикатором фенолфталеином, но нельзя проводить с метиловым оранжевым?
4. Почему раствор формальдегида нейтрализуют щелочью перед использованием в работе?
5. Как удаляют аммиак из раствора соли аммония?
6. Как определяют полноту удаления аммиака из раствора соли аммония?
7. По какой формуле рассчитывают массу аммиака в растворе при обратном титровании?
8. Почему при титровании хлороводородной кислоты щелочью в присутствии фенолфталеина через некоторое время после окончания титрования розовая окраска раствора исчезает?
9. По какой формуле рассчитывают массу аммиака в соли аммония при косвенном титровании (формальдегидном методе)?
10. С каким индикатором - фенолфталеином или с метиловым оранжевым - индикаторная ошибка при определении аммиака обратным титрованием больше?
Примеры тестовых пунктов текущего контроля
по теме I
I. Тестовые пункты с одним правильным ответом
Инструкция. Из следующих за утверждением ответов выберите один правильный.
Задание. 0,1 моль/л раствор натрия гидроксида титруют 0,1 моль/л соляной кислотой с индикатором метиловым оранжевым (рТ = 4).
1. Укажите окраску раствора в начальный момент титрования:
а) бесцветная;
б) желтая;
в) красная;
г) малиновая;
д) фиолетовая. Ответ: б.
2. Укажите окраску раствора в КТТ:
а) бесцветная;
б) желтая;
в) оранжевая;
г) красная;
д) фиолетовая. Ответ: г.
3. Укажите среду в ТЭ:
а) слабокислая;
б) сильнокислая;
в) сильнощелочная;
г) слабощелочная;
д) нейтральная. Ответ: д.
4. Укажите интервал скачка титрования:
а) 10-8;
б) 10-6;
в) 10-4;
г) 8-6;
д) 6-4.
Ответ: в.
5. Укажите индикаторную ошибку, допускаемую при титровании:
а) гидроксидная;
б) основная;
в) кислотная;
г) водородная;
д) нет ошибки. Ответ: г.
6. Рассчитайте и укажите рН 0,01 моль/л раствора натрия гидроксида без учета ионной силы раствора:
а) 10,5;
б) 11,0;
в) 11,5;
г) 12,0;
д) 12,5.
Ответ: г.
7. Рассчитайте и укажите молярную концентрацию соляной кислоты, полученной сливанием 1 л 0,2 моль/л и 1 л 0,1 моль/л растворов кислоты:
а) 0,11;
б) 0,13;
в) 0,15;
г) 0,17;
д) 0,19. Ответ: в.
8. Рассчитайте титр раствора, содержащего в 1 л 11,8 г янтарной кислоты (Н2С4Н4О4):
Ответ: б.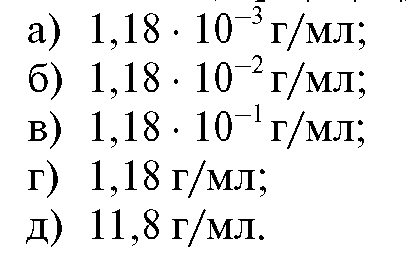
9. Рассчитайте и укажите молярную массу эквивалента натрия карбоната в растворе при титровании его соляной кислотой с индикатором метиловым оранжевым. Напишите соответствующее уравнение протекающей реакции в ионном виде.
а) 212,0 г/моль;
б) 159,0 г/моль;
в) 106,0 г/моль;
г) 84,0 г/моль;
д) 53,0 г/моль. Ответ: д.
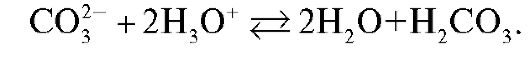
II. Задание на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько раз или не использован совсем.
Задание. Укажите значение рН раствора в КТТ при проведении следующих титрований.

Ответы: 10 - б, 11 - а, 12 - д, 13 - д, 14 - а.
III. Задания с выбором одного или нескольких правильных ответов
Инструкция. Для каждого незаконченного утверждения один или несколько ответов являются правильными. Выберите номера правильных ответов.
15. Стандартизацию 0,1 моль/л соляной кислоты проводят по:
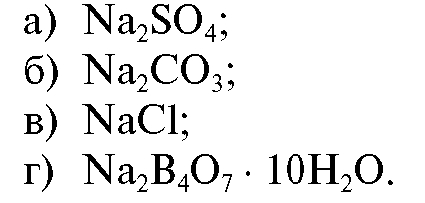
• Напишите уравнение реакции в молекулярном и ионном виде для
стандартизации титранта по натрия тетраборату. Ответ: б, г.
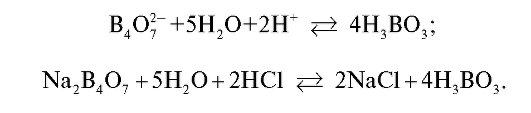
16. Для отбора точного объема анализируемого раствора используют:
а) мерную пипетку;
б) мерную колбу;
в) мерную бюретку;
г) мерный цилиндр. Ответ: а, в.
IV. Тестовые пункты на определение причинноследственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
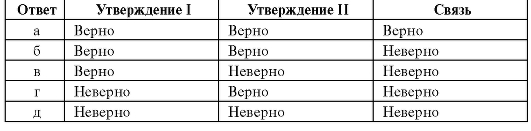
17. При титровании раствора аммиака хлороводородной кислотой с индикатором метиловым оранжевым допускается водородная ошибка, потому что рТ индикатора больше рН раствора в КТТ.
Ответ: в.
18. Титрование уксусной кислоты щелочью проводят в присутствии индикатора метилового оранжевого, потому что рТ индикатора лежит внутри скачка на кривой титрования.
Ответ: д.
19. Фактор эквивалентности натрия карбоната при титровании хлороводородной кислотой в присутствии фенолфталеина равен 1/2, потому что карбонат-ион является двухкислотным основанием и может принять максимально 2 протона.
Ответ: г.
Содержание письменной контрольной работы
по теме I
1. Введение в титриметрический анализ
Основные понятия: аликвотная доля, титрование, индикаторы, стандартные вещества, точка эквивалентности, конечная точка титрования, скачок титрования. Требования, предъявляемые к реакциям и реагентам в титриметрическом анализе. Стандартизация растворов. Способы выражения концентрации, применяемые в титриметрическом анализе, связь между ними. Ошибки титрования.
Расчеты в титриметрическом анализе. Расчет концентрации титранта при его стандартизации. Расчет массы навески стандартного вещества, необходимой для приготовления заданного объема раствора с известной концентрацией. Расчет концентрации раствора, приготовленного по навеске с точно известной массой или путем разбавления. Расчет массы определяемого вещества при титровании навески или аликвотной доли с использованием молярной концентрации эквивалента определяемого вещества или титриметрического фактора пересчета.
Способы титрования, применяемые в титриметрическом анализе: прямое, обратное, косвенное (заместительное). Методы установления конечной точки титрования.
Классификация методов титриметрического анализа по типам химических реакций.
Посуда и оборудование, применяемые в титриметрическом анализе. Приемы и техника работы. Проверка вместимости мерных колб, пипеток, проверка правильности градуировки бюреток.
2. Теоретические основы метода кислотно-основного титрования
Сущность метода. Основные реакции метода, применяемые титранты.
Стандартные вещества (натрия тетраборат, натрия карбонат, щавелевая кислота). Стандартизация титрантов. Виды кислотно-основного титрования: ацидиметрия и алкалиметрия.
Индикаторы методов кислотно-основного титрования (фенолфталеин, метиловый оранжевый, смешанный индикатор), требования к ним. Ионная, хромофорная и ионно-хромофорная теории индикаторов. Интервал перехода окраски индикаторов, рК и рТ индикаторов. Титрование со «свидетелем». Холостое титрование.
Кривые титрования. Построение кривых титрования сильной кислоты сильным основанием, слабого основания сильной кислотой, слабой кислоты сильным основанием. Скачок титрования и его зависимость от концентрации и природы реагирующих веществ. Выбор индикатора по кривой титрования. Общая характеристика кривых титрования фосфорной и угольной кислот. Индикаторные ошибки титрования: водородная, кислотная, гидроксидная, основная - и их расчет.
3. Примеры количественного определения веществ методом кислотно-основного титрования
Определение сильных кислот и оснований в растворах. Определение массы щелочей, карбонатов, гидрокарбонатов, щелочи и карбоната при совместном присутствии в растворе. Определение аммиака в растворе солей аммония обратным и косвенным титрованием.
4. Решение типовых расчетных задач
4.1. Расчет рН растворов при построении кривых титрования хлороводородной кислоты - раствором натрия гидроксида и наоборот; аммиака - раствором хлороводородной кислоты; уксусной кислоты - раствором натрия гидроксида.
4.2. Расчеты по приготовлению титрантов, растворов стандартных веществ.
4.3. Расчеты по результатам прямого, обратного и косвенного (заместительного) титрования.
Пример билета письменной контрольной работы (дневное отделение)
1. Построение кривой титрования слабого основания сильной кислотой. Выбор индикатора.
2. Определение массы аммиака в солях аммония формальдегидным методом.
3. Задача. Рассчитайте объем раствора хлороводородной кислоты с плотностью 1,120 г/мл, который необходимо взять для приготовления 600 мл раствора кислоты с титриметрическим фактором пересчета по натрия тетраборату, равным 2,012 • 10-2 г/мл.
4. Задача. Рассчитайте массу навески калия карбоната, если на ее титрование с индикатором фенолфталеином было израсходовано 10,15 мл соляной кислоты с молярной концентрацией 0,1200 моль/л.
Пример билета письменной контрольной работы (вечернее отделение)
1. Построение кривой титрования сильного основания сильной кислотой. Выбор индикатора.
2. Определение массы щелочи в растворе.
3. Задача. Вычислите массу навески калия карбоната, если на ее титрование с индикатором метиловым оранжевым было израсходовано 5,15 мл соляной кислоты с молярной концентрацией 0,1005 моль/л.