Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ТЕМА III. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Введение
Применение электрохимических методов в количественном анализе базируется на использовании зависимостей величин измеряемых параметров электрохимических процессов (разности электрических потенциалов, тока, количества электричества) от содержания определяемого вещества в анализируемом растворе, участвующего в данном электрохимическом процессе. Электрохимические процессы - процессы, которые сопровождаются одновременным протеканием химических реакций и изменением электрических свойств системы, которую в подобных случаях можно назвать электрохимической системой. В аналитической практике электрохимическая система обычно содержит электрохимическую ячейку, включающую сосуд с электропроводящим анализируемым раствором, в который погружены электроды.
Классификация электрохимических методов анализа
Электрохимические методы анализа классифицируют по-разному. • Классификация, основанная на учете природы источника электрической энергии в системе. Различают две группы методов. -Методы без наложения внешнего (постороннего) потенциала. Источником электрической энергии служит сама электрохимическая система, представляющая собой гальванический элемент (гальваническую цепь). К таким методам относятся потенциометрические методы; электродвижущая сила (ЭДС) и электродные потенциалы в такой системе зависят от содержания определяемого вещества в растворе. - Методы с наложением внешнего (постороннего) потенциала. К таким методам относятся:
о кондуктометрический анализ - основан на измерении электрической проводимости растворов как функции их концентрации;
о вольтамперометрический анализ - основан на измерении тока как функции приложенной известной разности потенциалов и концентрации раствора;
о кулонометрический анализ - основан на измерении количества электричества, прошедшего через раствор, как функции его концентрации;
о электрогравиметрический анализ - основан на измерении массы продукта электрохимической реакции.
• Классификация по способу применения электрохимических методов. Различают прямые и косвенные методы.
- Прямые методы. Измеряют электрохимический параметр как известную функцию концентрации раствора и по показанию соответствующего измерительного прибора находят содержание определяемого вещества в растворе.
- Косвенные методы. Методы титрования, в которых окончание титрования фиксируют на основании измерения электрических параметров системы.
В соответствии с данной классификацией различают, например, прямую кондуктометрию и кондуктометрическое титрование, прямую потенциометрию и потенциометрическое титрование и т.д.
В данном пособии приведены лабораторные работы только по следующим электрохимическим методам:
• прямой потенциометрией;
• потенциометрическому титрованию;
• кулонометрическому титрованию.
Все эти методы - фармакопейные и применяются для контроля качества лекарственных средств.
Общая характеристика потенциометрического анализа
Принцип метода
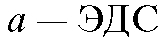
Потенциометрический анализ (потенциометрия) основан на измерении ЭДС и электродных потенциалов как функции концентрации анализируемого раствора.
Если в электрохимической системе - в гальваническом элементе - на электродах протекает реакция:
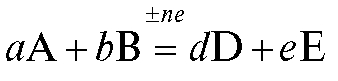
с переносом n электронов, то уравнение Нернста для ЭДС E этой реакции имеет вид:
где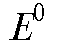 - стандартная ЭДС реакции (разность стандартных электродных потенциалов); R - универсальная газовая постоянная; T - абсолютная температура, при которой протекает реакция; F - число Фарадея;
- стандартная ЭДС реакции (разность стандартных электродных потенциалов); R - универсальная газовая постоянная; T - абсолютная температура, при которой протекает реакция; F - число Фарадея;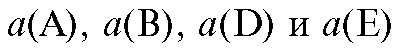 -
-
активности реагентов - участников реакции.
Уравнение (1) справедливо для ЭДС обратимо работающего гальванического элемента.
Для комнатной температуры уравнение (1) можно представить в форме:
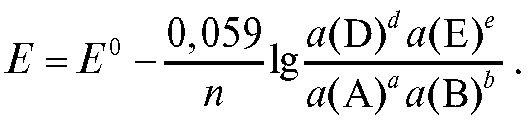 (2)
(2)
В условиях, когда активность реагентов приблизительно равна их концентрации, уравнение (1) переходит в уравнение (3):
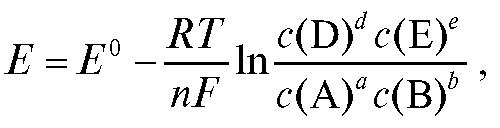 (3)
(3)
где 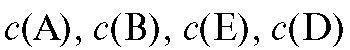 - концентрации реагентов.
- концентрации реагентов.
Для комнатной температуры это уравнение можно представить в виде:
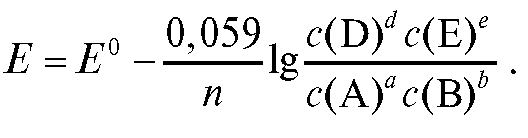 (4)
(4)
При потенциометрических измерениях в электрохимической ячейке используют два электрода:
• индикаторный электрод, потенциал которого зависит от концентрации определяемого (потенциалопределяющего) вещества в анализируемом растворе;
• электрод сравнения, потенциал которого в условиях проведения анализа остается постоянным.
Именно поэтому величину ЭДС, определяемую уравнениями (14), можно рассчитать как разность реальных потенциалов этих двух электродов.
В потенциометрии используют электроды следующих типов: электроды первого, второго рода, окислительно-восстановительные, мембранные.
Электроды первого рода. Это электроды, обратимые по катиону, общему с материалом электрода. Различают три разновидности электродов первого рода:
а) Металл M, погруженный в раствор соли того же металла. На поверхности таких электродов протекает обратимая реакция:
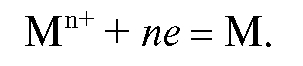
Реальный потенциал такого электрода первого рода зависит от активности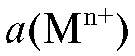 катионов металла и описывается уравнениями (5-8). В общем случае для любой температуры:
катионов металла и описывается уравнениями (5-8). В общем случае для любой температуры:
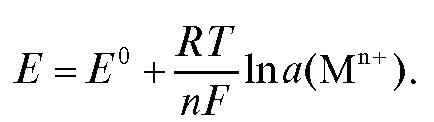 (5)
(5)
Для комнатной температуры:
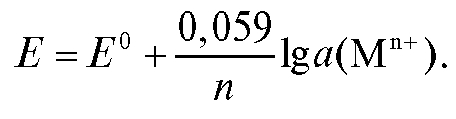 (6)
(6)
При малых концентрациях 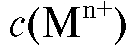 , когда активность
, когда активность 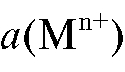 катионов
катионов
металла приблизительно равна их концентрации,
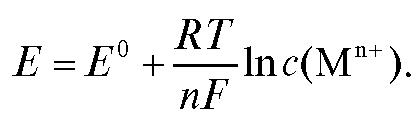 (7)
(7)
Для комнатной температуры:
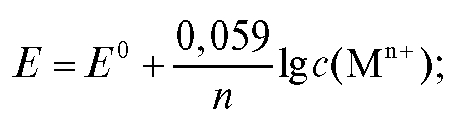 (8)
(8)
б) Газовые электроды, например, водородный электрод, в том числе и стандартный водородный электрод. Потенциал обратимо работающего газового водородного электрода определяется активностью ионов водорода, т.е. величиной рН раствора, и при комнатной температуре равен:
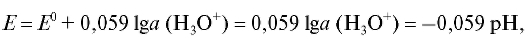
поскольку для водородного электрода стандартный потенциал принимается равным нулю 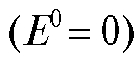 , а в соответствии с электродной реакцией
, а в соответствии с электродной реакцией
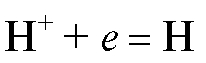
число электронов, участвующих в этой реакции, равно единице: n = 1;
в) Амальгамные электроды, представляющие собой амальгаму металла, погруженную в раствор, содержащий катионы того же металла. Потен-
циал таких электродов первого рода зависит от активности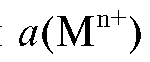 ка-
ка-
тионов металла в растворе и активности a(M) металла в амальгаме:
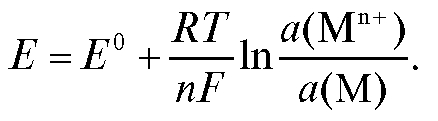
Амальгамные электроды обладают высокой обратимостью. Электроды второго рода обратимы по аниону. Различают следующие виды электродов второго рода:
А. Металл, поверхность которого покрыта малорастворимой солью этого же металла, погруженный в раствор, содержащий анионы, входящие в состав этой малорастворимой соли. Примером могут служить хлорсеребряный электрод 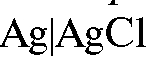 ,
,  или каломельный электрод
или каломельный электрод 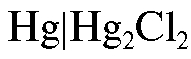 ,
,
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой малорастворимой в воде солью 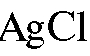 , погруженной в водный раствор хлорида калия. На хлорсеребряном электроде протекает обратимая реакция:
, погруженной в водный раствор хлорида калия. На хлорсеребряном электроде протекает обратимая реакция:
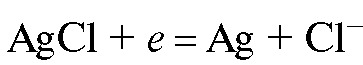
Каломельный электрод состоит из металлической ртути, покрытой пастой малорастворимого хлорида ртути(I)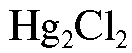 - каломели, контак-
- каломели, контак-
тирующей с водным раствором хлорида калия. На каломельном электроде протекает обратимая реакция:
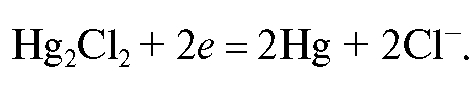
Реальный потенциал электродов второго рода зависит от активности анионов и для обратимо работающего электрода, на котором протекает реакция
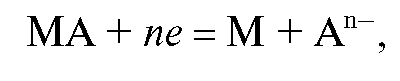
описывается уравнениями Нернста (9-12).
В общем случае при любой приемлемой температуре T:
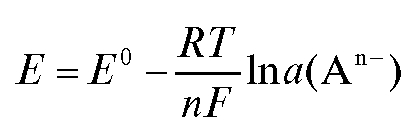 . (9)
. (9)
Для комнатной температуры:
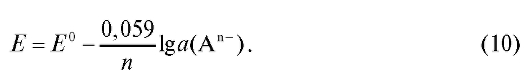
Для условий, в которых активность анионов приблизительно равна их концентрации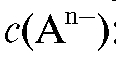 :
:
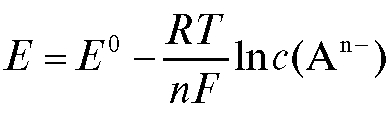 . (11)
. (11)
Для комнатной температуры:
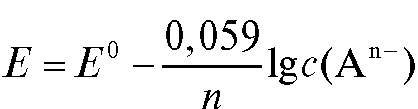 (12)
(12)
Например, реальные потенциалы и
и соответственно хлорсеребряного и каломельного электродов при комнатной температуре можно представить в виде:
соответственно хлорсеребряного и каломельного электродов при комнатной температуре можно представить в виде:
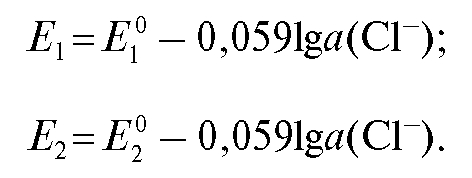
В последнем случае в электродной реакции участвуют 2 электрона (n = 2) и образуются также 2 хлорид-иона, поэтому множитель при логарифме равен также 0,059.
Электроды второго рода рассмотренного вида обладают высокой обратимостью и стабильны в работе, поэтому их часто используют в качестве электродов сравнения, способных устойчиво поддерживать постоянное значение потенциала;
б) газовые электроды второго рода, например, хлорный электрод 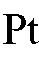 ,
, Газовые электроды второго рода в количественном потен-
Газовые электроды второго рода в количественном потен-
циометрическом анализе применяются редко.
Окислительно-восстановительные электроды. Состоят из инертного материала (платины, золота, вольфрама, титана, графита и др.), погруженного в раствор, содержащий окисленную Ox и восстановленную Red формы данного вещества. Существуют две разновидности окислительновосстановительных электродов:
1) электроды, потенциал которых не зависит от активности ионов водорода, например 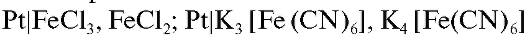 и т.д.;
и т.д.;
2) электроды, потенциал которых зависит от активности ионов водорода, например, хингидронный электрод.
На окислительно-восстановительном электроде, потенциал которого не зависит от активности ионов водорода, протекает обратимая реакция:
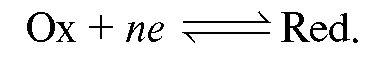
Реальный потенциал такого окислительно-восстановительного электрода зависит от активности окисленной и восстановленной формы данного вещества и для обратимо работающего электрода описывается, в зависимости от условий (по аналогии с вышерассмотренными потенциалами), уравнениями Нернста (13-16):
(13) (14) (15) 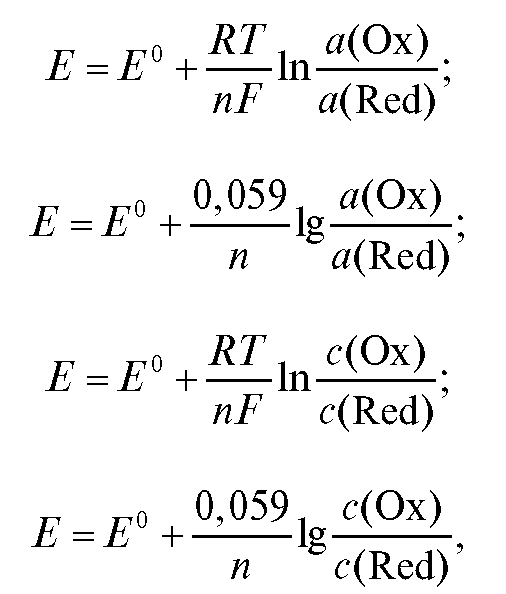 (16)
(16)
где все обозначения - традиционные.
Если в электродной реакции участвуют ионы водорода, то их активность (концентрацию) учитывают в соответствующих уравнениях Нернста для каждого конкретного случая.
Мембранные, или ион-селективные, электроды - электроды, обратимые по тем или иным ионам (катионам или анионам), сорбируемым твердой или жидкой мембраной. Реальный потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной.
Мембранные электроды с твердой мембраной содержат очень тонкую мембрану, по обе стороны которой находятся разные растворы, содержащие одни и те же определяемые ионы, но с неодинаковой концентрацией: раствор (стандартный) с точно известной концентрацией определяемых ионов и анализируемый раствор с неизвестной концентрацией определяемых ионов. Вследствие различной концентрации ионов в обоих растворах ионы на разных сторонах мембраны сорбируются в неодинаковых количествах, неодинаков и возникающий при сорбции ионов электрический заряд на разных сторонах мембраны. Как результат возникает мембранная разность потенциалов.
Определение ионов с применением мембранных ион-селективных электродов называют ионометрией.
Как уже говорилось выше, при потенциометрических измерениях электрохимическая ячейка включает два электрода - индикаторный
и электрод сравнения. Величина ЭДС, генерируемой в ячейке, равна разности потенциалов этих двух электродов. Поскольку потенциал электрода сравнения в условиях проведения потенциометрического определения остается постоянным, ЭДС зависит только от потенциала индикаторного электрода, т.е. от активности (концентрации) тех или иных ионов в растворе. На этом и основано потенциометрическое определение концентрации данного вещества в анализируемом растворе.
Для потенциометрического определения концентрации вещества в растворе применяют как прямую потенциометрию, так и потенциометрическое титрование, хотя второй способ используют намного чаще первого.
Прямая потенциометрия
Определение концентрации вещества в прямой потенциометрии. Проводят обычно методом градуировочного графика или методом добавок стандарта.
• Метод градуировочного графика. Готовят серию из 5-7 эталонных растворов с известным содержанием определяемого вещества. Концентрация определяемого вещества и ионная сила в эталонных растворах не должны сильно отличаться от концентрации и ионной силы анализируемого раствора: в этих условиях уменьшаются ошибки определения. Ионную силу всех растворов поддерживают постоянной введением индифферентного электролита. Эталонные растворы последовательно вносят в электрохимическую (потенциометрическую) ячейку. Обычно эта ячейка представляет собой стеклянный химический стакан, в который помещают индикаторный электрод и электрод сравнения.
Измеряют ЭДС эталонных растворов, тщательно промывая дистиллированной водой электроды и стакан перед заполнением ячейки каждым эталонным раствором. По полученным данным строят градуировочный график в координатах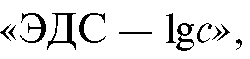 где с - концентрация определяемо-
где с - концентрация определяемо-
го вещества в эталонном растворе. Обычно такой график представляет собой прямую линию.
Затем в электрохимическую ячейку вносят (после промывания ячейки дистиллированной водой) анализируемый раствор и измеряют ЭДС ячейки. По градуировочному графику находят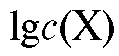 , где
, где 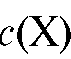 - концентрация определяемого вещества в анализируемом растворе.
- концентрация определяемого вещества в анализируемом растворе.
• Метод добавок стандарта. В электрохимическую ячейку вносят известный объем V(X) анализируемого раствора с концентрацией 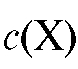 и измеряют ЭДС ячейки. Затем в тот же раствор прибавляют точно измеренный небольшой объем стандартного раствора
и измеряют ЭДС ячейки. Затем в тот же раствор прибавляют точно измеренный небольшой объем стандартного раствора 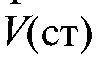 с известной, до-
с известной, до-
статочно большой концентрацией 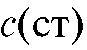 определяемого вещества и снова определяют ЭДС ячейки.
определяемого вещества и снова определяют ЭДС ячейки.
Рассчитывают концентрацию 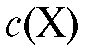 определяемого вещества в анализируемом растворе по формуле (17):
определяемого вещества в анализируемом растворе по формуле (17):
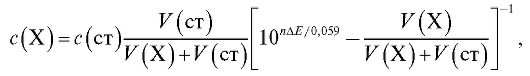 (17)
(17)
где 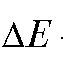 - разность двух измеренных значений ЭДС;
- разность двух измеренных значений ЭДС;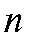 - число электронов, участвующих в электродной реакции.
- число электронов, участвующих в электродной реакции.
Применение прямой потенциометрии. Метод применяется для определения концентрации ионов водорода (рН растворов), анионов, ионов металлов (ионометрия).
Большую роль при использовании прямой потенциометрии играет выбор подходящего индикаторного электрода и точное измерение равновесного потенциала.
При определении рН растворов в качестве индикаторных используют электроды, потенциал которых зависит от концентрации ионов водорода: стеклянный, водородный, хингидронный и некоторые другие. Чаще применяют мембранный стеклянный электрод, обратимый по ионам водорода. Потенциал такого стеклянного электрода определяется концентрацией ионов водорода, поэтому ЭДС цепи, включающей стеклянный электрод в качестве индикаторного, описывается при комнатной температуре уравнением:
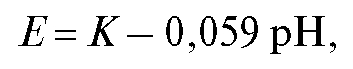
где постоянная K зависит от материала мембраны, природы электрода сравнения.
Стеклянный электрод позволяет определять рН в интервале рН 0-10 (чаще в диапазоне рН 2-10) и обладает высокой обратимостью и стабильностью в работе.
Хингидронный электрод, часто применявшийся ранее, - окислительно-восстановительный электрод, потенциал которого зависит от концентрации ионов водорода. Он представляет собой платиновую проволоку, погруженную в раствор кислоты (обычно НС1), насыщенный хингидроном - эквимолекулярным соединением хинона с гидрохиноном состава 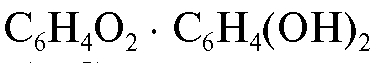 (темно-зеленый порошок, малорастворимый в воде). Схематическое обозначение хингидронного электрода:
(темно-зеленый порошок, малорастворимый в воде). Схематическое обозначение хингидронного электрода:
На хингидронном электроде протекает окислительно-восстановительная реакция:
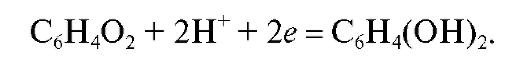
Потенциал хингидронного электрода при комнатной температуре описывается формулой:
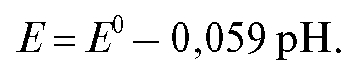
Хингидронный электрод позволяет измерять рН растворов в интервале рН 0-8,5. При рН < 0 хингидрон гидролитически расщепляется; при рН >8,5 гидрохинон, являющийся слабой кислотой, вступает в реакцию нейтрализации.
Хингидронный электрод нельзя применять в присутствии сильных окислителей и восстановителей.
Мембранные ион-селективные электроды используют в ионометрии в качестве индикаторных для определения различных катионов
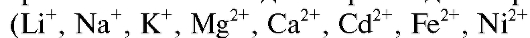 и др.) и анионов
и др.) и анионов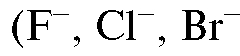 ,
,
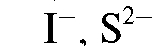 и др.).
и др.).
К достоинствам прямой потенциометрии относятся простота и быстрота проведения измерений. Для измерений требуются небольшие объемы растворов.
Потенциометрическое титрование
Потенциометрическое титрование - способ определения объема титранта, затраченного на титрование определяемого вещества в анализируемом растворе, путем измерения ЭДС (в процессе титрования) с помощью гальванической цепи, составленной из индикаторного электрода и электрода сравнения. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя конец титрования по резкому изменению ЭДС измеряемой цепи - потенциала индикаторного электрода, который зависит от концентрации соответствующих ионов и резко изменяется в точке эквивалентности.
Измеряют изменение потенциала индикаторного электрода в процессе титрования в зависимости от объема прибавленного титранта. По полученным данным строят кривую потенциометрического титрования и по этой кривой определяют объем израсходованного титранта в ТЭ.
При потенциометрическом титровании не требуется использование индикаторов, изменяющих окраску вблизи ТЭ.
Электродную пару (электрод сравнения и индикаторный электрод) составляют так, чтобы потенциал индикаторного электрода зависел от концентрации ионов, участвующих или образующихся в реакции, протекающей при титровании. Потенциал электрода сравнения во время титрования должен оставаться постоянным. Оба электрода устанавливают непосредственно в электрохимической ячейке или же помещают в отдельные сосуды с токопроводящими растворами (индикаторный электрод - в анализируемый раствор), которые соединяют электролитическим мостиком, заполненным индифферентным электролитом.
Титрант прибавляют равными порциями, каждый раз измеряя разность потенциалов. В конце титрования (вблизи ТЭ) титрант прибавляют по каплям, также измеряя разность потенциалов после прибавления очередной порции титранта.
Разность потенциалов между электродами измеряют, используя высокоомные потенциометры.
Кривые потенциометрического титрования
Кривая потенциометрического титрования - графическое изображение изменения ЭДС электрохимической ячейки в зависимости от объема прибавленного титранта.
Кривые потенциометрического титрования строят в различных координатах:
• кривые титрования в координатах 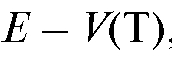 , иногда такие кривые называют интегральными кривыми титрования;
, иногда такие кривые называют интегральными кривыми титрования;
• дифференциальные кривые титрования - в координатах
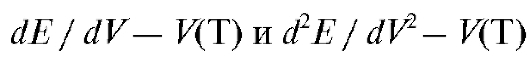
• кривые титрования по методу Грана - в координатах
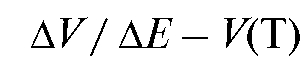
где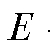 - ЭДС потенциометрической ячейки,
- ЭДС потенциометрической ячейки,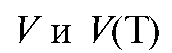 - объем прибавленно-
- объем прибавленно-
го титранта, 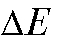 - изменение потенциала, соответствующее прибавлению
- изменение потенциала, соответствующее прибавлению 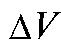 титранта.
титранта.
На рис. 3-8 приведены схематически различные типы кривых потенциометрического титрования.
По построенным кривым титрования определяют объем титранта
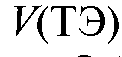 в ТЭ, как это показано на рис. 3-8. Объем титранта
в ТЭ, как это показано на рис. 3-8. Объем титранта 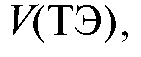 прибавленного в ТЭ, можно определить
прибавленного в ТЭ, можно определить
не только графически, но и расчетным путем по формуле (18):
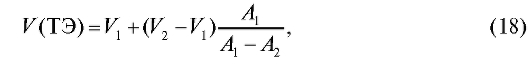
где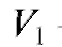 - объем прибавленного титранта, соответствующий последнему измерению до ТЭ;
- объем прибавленного титранта, соответствующий последнему измерению до ТЭ;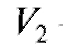 - объем прибавленного титранта, соответствующий первому измерению после ТЭ;
- объем прибавленного титранта, соответствующий первому измерению после ТЭ;
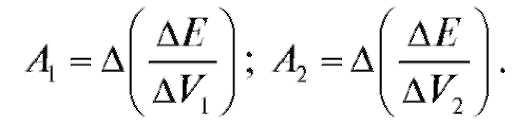
Рис. 3-8. Типы кривых потенциометрического титрования (Е - измеряемая ЭДС,  - объем прибавленного титранта,
- объем прибавленного титранта,  - объем титранта, при-
- объем титранта, при-
бавленного в точке эквивалентности): а - кривая титрования в координатах 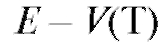 ; б, в - дифференциальные кривые титрования; г - кривая титрования по методу Грана
; б, в - дифференциальные кривые титрования; г - кривая титрования по методу Грана
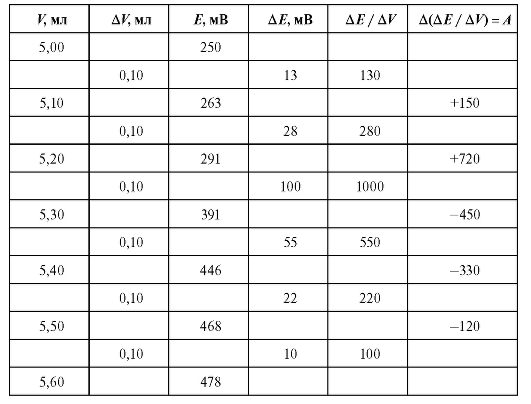
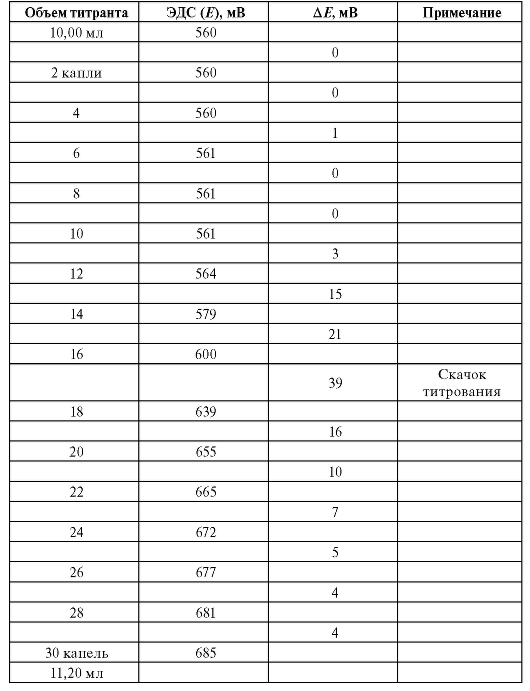
В таблице 3-9 в качестве примера (фармакопейного) приведены результаты определений и расчетов при потенциометрическом титровании.
Рассчитаем по формуле (18) величину V(ТЭ) с использованием данных табл. 3-9. Очевидно, что максимальное значение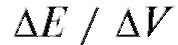 = 1000. Следовательно,
= 1000. Следовательно,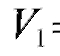 = 5,20 и
= 5,20 и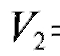 = 5,30;
= 5,30;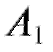 = 720, .
= 720, .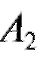 = -450. Отсюда:
= -450. Отсюда:
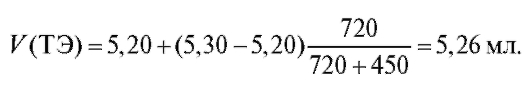
Таблица 3-9. Пример обработки результатов потенциометрического титрования
Применение потенциометрического титрования. Метод - универсальный, его можно применять для индикации конца титрования во всех типах титрования: кислотно-основном, окислительновосстановительном, комплексиметрическом, осадительном, при титровании в неводных средах. В качестве индикаторных используют стеклянный, ртутный, ион-селективные, платиновый, серебряный электроды, а в качестве электродов сравнения - каломельный, хлорсеребряный, стеклянный.
Метод обладает высокой точностью, большой чувствительностью; позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе, например, раздельно определять хлорид- и иодид-ионы при аргентометрическом титровании.
Методами потенциометрического титрования анализируют многие лекарственные вещества, например, аскорбиновую кислоту, сульфамидные препараты, барбитураты, алкалоиды и др.
Задание для самоподготовки к лабораторным занятиям по теме «Потенциометрический анализ»
Цель изучения темы
На основе знания теории потенциометрического анализа и выработки практических умений научиться обоснованно выбирать и практически применять методы прямой потенциометрии и потенциометрического титрования для количественного определения вещества; уметь проводить статистическую оценку результатов потенциометрического анализа.
Целевые задачи
1. Научиться проводить количественное определение содержания фторид-иона в растворе методом прямой потенциометрии с применением фторид-селективного электрода.
2. Научиться проводить количественное определение массовой доли новокаина в препарате методом потенциометрического титрования.
3. Решение типовых расчетных задач.
На изучение темы отводятся два лабораторных занятия. На одном занятии студенты выполняют первую лабораторную работу и решают типовые расчетные задачи по основным разделам потенциометрического анализа; на другом занятии студенты выполняют вторую лабораторную работу. Последовательность проведения занятий особого значения не имеет.
Список литературы
1. Учебник. - Книга 2, глава 10. - С. 447-457; 493-507; 510-511.
2. Харитонов Ю.Я. Григорьева В.Ю. Примеры и задачи по аналитической химии.- М.: ГЭОТАР-Медиа, 2007. - С. 214-225; 245-259; 264-271.
3. Лекции по теме: «Потенциометрический анализ».
4. Ефременко О.А. Потенциометрический анализ.- М.: ММА им. И.М. Сеченова, 1998.
Занятие 1. Прямая потенциометрия
К занятию необходимо знать
1. Принцип методов потенциометрического анализа. Уравнение Нернста.
2. Разновидности методов потенциометрического анализа.
3. Схему установки для прямой потенциометрии.
4. Индикаторные электроды и электроды сравнения, применяемые в прямой потенциометрии.
5. Сущность определения концентрации вещества методом прямой потенциометрии с помощью градуировочного графика.
6. Сущность определения содержания фторид-иона в растворе методом прямой потенциометрии с применением фторидселективного электрода.
К занятию необходимо уметь
1. Рассчитывать массу навески для приготовления стандартного раствора вещества.
2. Готовить стандартные растворы методом разбавления.
3. Строить градуировочные графики и использовать их для количественного определения вещества.
Вопросы для самопроверки
1. Какой принцип лежит в основе метода прямой потенциометрии?
2. Каким уравнением выражается зависимость электродного потенциала от концентрации (активности) потенциалопределяющих компонентов в растворе?
3. Какой электрохимический параметр измеряют при определении вещества методом прямой потенциометрии?
4. Приведите схему установки для определения вещества методом прямой потенциометрии.
5. Какие электроды называют индикаторными? Назовите наиболее употребительные индикаторные ион-селективные электроды.
6. Какие электроды называют электродами сравнения? Какой электрод сравнения принят в качестве международного стандарта? Как он устроен? Назовите наиболее часто применяемые электроды сравнения. Как устроены:
а) насыщенный каломельный электрод;
б) насыщенный хлорсеребряный электрод?
7. В чем сущность потенциометрического определения вещества методом градуировочного графика?
8. Назовите диапазон определяемых концентраций и процентную (относительную) погрешность определения вещества методом прямой потенциометрии.
9. Какой принцип лежит в основе определения фторид-иона методом прямой потенциометрии? Перечислите основные этапы анализа.
Лабораторная работа «Определение содержания фторид-иона в растворе с применением фторидселективного электрода»
Цель работы
Научиться применять метод прямой потенциометрии с использованием ион-селективного электрода для количественного определения вещества методом градуировочного графика.
Целевые задачи
1. Приготовление стандартного раствора натрия фторида, концентрация которого точно равна заданной.
2. Приготовление методом разбавления серии стандартных растворов натрия фторида, по составу и ионной силе близких к анализируемому раствору.
3. Измерение электродвижущей силы (ЭДС) гальванического элемента, составленного из индикаторного фторид-селективного электрода и хлорсеребряного электрода сравнения, как функции концентрации фторид-иона.
4. Построение градуировочного графика в координатах: «ЭДС - показатель концентрации фторид-иона».
5. Определение содержания фторид-иона в анализируемом растворе с помощью градуировочного графика.
Материальное обеспечение
Реактивы
1. Натрия фторид, х.ч.
2. Раствор буферный ацетатный, рН ~6.
3. Вода дистиллированная. Лабораторная посуда
1. Колба мерная на 100 мл - 1 шт.
2. Колба мерная на 50 мл - 6 шт.
3. Пипетка мерная на 5 мл - 1 шт.
4. Стакан химический на 200-250 мл - 1 шт.
5. Стакан химический на 50 мл - 2 шт.
6. Бюкс - 1 шт.
7. Воронка - 1 шт.
8. Палочка стек лянная - 1 шт.
9. Промывалка на 250 или 500 мл - 1 шт.
Приборы
1. Иономер универсальный ЭВ-74 или аналогичный.
2. Электрод индикаторный, фторид-селективный. Перед эксплуатацией фторидный электрод выдерживают в 0,01 моль/л растворе натрия фторида в течение 1-2 ч.
3. Электрод сравнения, вспомогательный лабораторный хлорсеребряный ЭВЛ-IМЗ или аналогичный. Перед эксплуатацией хлорсеребряный электрод наполняют через боковое отверстие концентрированным, но ненасыщенным, примерно 3 моль/л, раствором калия хлорида. При применении насыщенного раствора калия хлорида возможна кристаллизация соли непосредственно вблизи контактной зоны электрода с измеряемым раствором, что препятствует прохождению тока и приводит к невоспроизводимым показаниям измерительного прибора. После заполнения электрода 3 моль/л раствором калия хлорида боковое отверстие закрывают резиновой пробкой, электрод погружают в раствор калия хлорида той же концентрации и выдерживают в этом растворе в течение ~48 ч. В процессе работы пробка из бокового отверстия электрода должна быть удалена. Скорость истечения раствора калия хлорида через электролитический ключ электрода при температуре 20±5 °C составляет 0,3-3,5 мл/сут.
4. Штатив для закрепления двух электродов.
5. Мешалка магнитная.
6. Весы аналитические с разновесом.
Прочие материалы
1. Полоски фильтровальной бумаги 3 5 см.
2. Бумага миллиметровая 912 см.
3. Линейка.
Сущность работы
Определение фторид-иона методом прямой потенциометрии основано на измерении электродвижущей силы гальванического элемента, в котором индикаторным электродом служит фторид-селективный электрод, а электродом сравнения - хлорсеребряный или каломельный, как функции концентрации фторид-ионов в растворе.
Чувствительной частью фторидного электрода (рис. 3-9) является мембрана из монокристалла лантана(III) фторида, активированного европием(II).
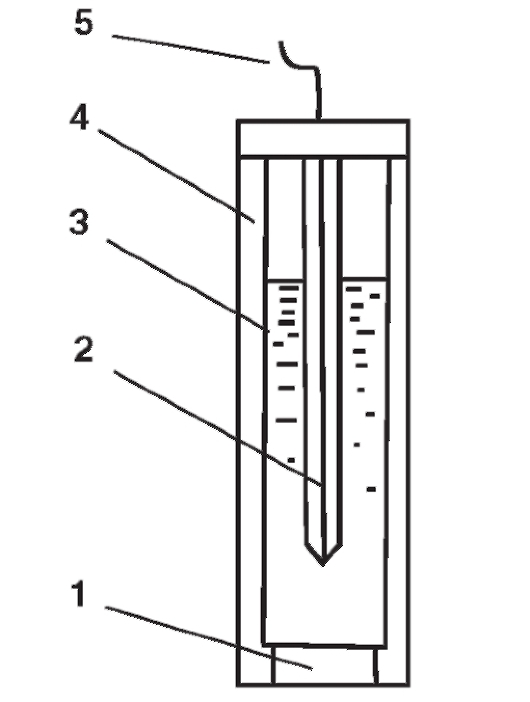
Рис. 3-9. Схема устройства фторид-селективного электрода: 1 - мембрана из монокристалла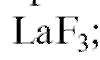 2 - внутренний полуэлемент (обычно хлорсеребря-
2 - внутренний полуэлемент (обычно хлорсеребря-
ный); 3 - внутренний раствор с постоянной активностью ионов (0,01 моль/л 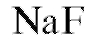 и
и моль/л
моль/л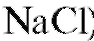 ); 4 - корпус электрода; 5 - провод для подключения электрода к измерительному прибору
); 4 - корпус электрода; 5 - провод для подключения электрода к измерительному прибору
Равновесный потенциал фторидного электрода в соответствии с уравнением Нернста для анион-селективных электродов зависит от активности (концентрации) фторид-иона в растворе:
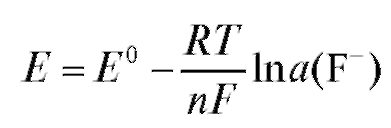 (19) или при 25 °C:
(19) или при 25 °C:
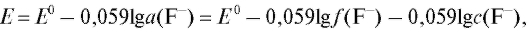 (20)
(20)
где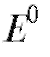 - стандартный потенциал фторидного электрода, В;
- стандартный потенциал фторидного электрода, В;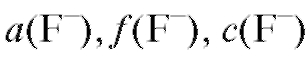 -
-
соответственно активность, коэффициент активности, молярная концентрация фторид-иона в растворе.
Первый член правой части уравнения (20)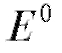 - величина постоянная. Для растворов с примерно одинаковой ионной силой коэффициент активности фторид-иона, а следовательно, и второй член правой части уравнения (20) также является постоянной величиной. Тогда уравнение Нернста можно представить в виде:
- величина постоянная. Для растворов с примерно одинаковой ионной силой коэффициент активности фторид-иона, а следовательно, и второй член правой части уравнения (20) также является постоянной величиной. Тогда уравнение Нернста можно представить в виде:
Е = const - 0,0591gc (F-) = const + 0,059pF, (21)
где pF = -1gc(F-) - показатель концентрации фторид-иона в растворе.
Таким образом, при постоянной ионной силе растворов равновесный потенциал фторидного электрода находится в линейной зависимости от показателя концентрации фторид-иона. Существование такой зависимости позволяет проводить определение концентрации фторид-иона с помощью градуировочного графика, который строят в координатах 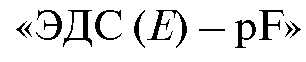 для серии стандартных растворов натрия фторида, по составу и ионной силе близких анализируемому раствору.
для серии стандартных растворов натрия фторида, по составу и ионной силе близких анализируемому раствору.
Фторидный электрод применяют в диапазоне значений рН 5-9, так как при рН < 5 наблюдается неполная ионизация  или образование
или образование 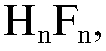 а при рН > 9 - взаимодействие материала электрода с гидроксидионом:
а при рН > 9 - взаимодействие материала электрода с гидроксидионом:
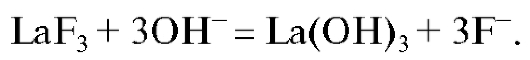
Для поддержания постоянного значения рН и создания в стандартных и анализируемых растворах постоянной ионной силы обычно используют буферный раствор (например, ацетатный или цитратный). При анализе растворов со сложным солевым составом буферный раствор служит также для устранения мешающего влияния посторонних катионов путем связывания их в устойчивые ацетатные, цитратные или другие комплексные соединения. С этой же целью в буферный раствор вводят дополнительные комплексообразующие реагенты (например, ЭДТА).
Селективность определения с помощью фторидного электрода очень высокая; мешают только гидроксид-ионы и те немногие катионы, которые образуют с фторид-ионом более устойчивые комплексные соединения, чем с компонентами буферного раствора 
Диапазон определяемых концентраций фторид-иона очень широкий: от 10-6 до 1 моль/л; при этом процентная погрешность определения составляет ±2%.
Фторид-селективный электрод широко применяется в анализе разнообразных объектов: питьевой воды, фармацевтических препаратов, биологических материалов, при контроле за загрязнением окружающей среды и т.д.
Поскольку в настоящей работе анализируют растворы натрия фторида, не содержащие посторонних ионов, буферный раствор можно не применять. В таком случае следует ожидать небольшого отклонения градуировочного графика от линейной зависимости, так как в стандартных растворах с увеличением концентрации фторид-иона увеличивается ионная сила, и коэффициент активности фторид-иона не сохраняется постоянным.
Порядок выполнения работы
1. Знакомство с «Инструкцией по технике безопасности при работе с электроприборами» (см. приложение 1).
2. Знакомство с назначением, принципом работы и «Инструкцией по эксплуатации универсального иономера ЭВ-74» (или аналогичного прибора) (см. приложения 2, 3).
3. Подготовка иономера к измерениям.
ВНИМАНИЕ! В данной работе предусмотрено использование иономера типа ЭВ-74. При использовании приборов другого типа необходимо давать дополнительно их описание.
3.1. Собирают гальванический элемент из индикаторного фторидселективного электрода и хлорсеребряного электрода сравнения.
ВНИМАНИЕ! При работе с ион-селективными электродами необходимо соблюдать осторожность, чтобы не повредить рабочей поверхности электрода - мембраны, которая должна быть гладкой, без царапин и отложений.
Перед установкой фторидный электрод энергично встряхивают, как медицинский термометр, держа его в вертикальном положении мембраной вниз. Это делают для того, чтобы удалить невидимые снаружи пузырьки воздуха, которые могут образовываться между поверхностью мембраны и внутренним раствором электрода (см. рис. 3-9) и приводить к нестабильности показаний измерительного прибора.
Фторидный электрод закрепляют в штативе рядом с электродом сравнения.
ВНИМАНИЕ! Держатели, предназначенные для закрепления в штативе электродов, обычно заранее установлены надлежащим образом; не рекомендуется изменять их положение. Для того чтобы закрепить фторидный электрод или поменять раствор в ячейке, следует сначала осторожно убрать из-под ячейки магнитную мешалку.
При закреплении фторидный электрод подводят в лапку штатива снизу так, чтобы его нижний конец оказался на одном уровне с нижним концом электрода сравнения. Электрод подключают к иономеру через гнездо «Изм.», находящееся на задней панели прибора (приложение 3, п. 1.1). Электрод сравнения должен быть подключен к иономеру через гнездо «Всп.».
Электроды многократно промывают дистиллированной водой из промывалки над стаканом вместимостью 200-250 мл, после чего под электроды подводят стакан вместимостью 50 мл с дистиллированной водой, который устанавливают в центре столика магнитной мешалки. Правильно закрепленные электроды не должны касаться стенок и дна
стакана, а также магнитного стержня, применяемого в дальнейшем для перемешивания раствора.
3.2. Иономер включают в сеть под наблюдением преподавателя, руководствуясь инструкцией по эксплуатации прибора (приложение 3, п.п. 1.2-1.7). Дают прибору прогреться в течение 30 мин.
4. Приготовление стандартного 0,1000 моль/л раствора натрия фторида. Рассчитывают с точностью до 0,0001 г массу навески натрия фторида, требуемую для приготовления 100 мл 0,1000 моль/л раствора по формуле:
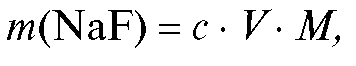
где с,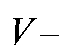 - соответственно молярная концентрация (моль/л) и объем (л) стандартного раствора натрия фторида;
- соответственно молярная концентрация (моль/л) и объем (л) стандартного раствора натрия фторида;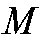 - молярная масса натрия фторида, г/моль.
- молярная масса натрия фторида, г/моль.
На аналитических весах с точностью до ±0,0002 г взвешивают сначала чистый и сухой бюкс, а затем в этом бюксе взвешивают навеску х.ч. натрия фторида, масса которого должна быть точно вычисленной.
Взятую навеску количественно переносят в мерную колбу вместимостью 100 мл через сухую воронку, смывая частицы соли со стенок бюкса и воронки ацетатным буферным раствором (рН ~6). Раствор из бюкса сливают в колбу по стеклянной палочке, прислонив ее к краю бюкса. Добиваются полного растворения соли, после чего буферным раствором доводят объем раствора до метки колбы. Содержимое колбы перемешивают.
5. Приготовление серии стандартных растворов натрия фторида с постоянной ионной силой. Серию стандартных растворов с концентрацией фторид-иона, равной 10-2, 10-3, 10-4, 10-5 и 10-6 моль/л, готовят в мерных колбах вместимостью 50 мл из стандартного 0,1000 моль/л раствора натрия фторида путем последовательного разбавления буферным раствором.
Так, для приготовления 10-2 моль/л раствора в мерную колбу на 50 мл помещают пипеткой 5 мл 0,1000 моль/л раствора натрия фторида, предварительно ополоснув пипетку небольшим количеством этого раствора 2-3 раза, буферным раствором доводят объем раствора до метки, содержимое колбы перемешивают. Таким же способом из 10-2 моль/л раствора готовят 10-3 моль/л раствор и т.д. вплоть до 10-6 моль/л раствора натрия фторида.
6. Измерение электродвижущей силы гальванического элемента как функции концентрации фторид-иона. В стакан вместимостью 50 мл последовательно помещают приготовленные стандартные растворы на-
трия фторида, начиная с самого разбавленного, предварительно ополоснув стакан измеряемым раствором 2-3 раза. Осторожно осушают поверхность фторидного и хлорсеребряного электродов фильтровальной бумагой, после чего электроды погружают в измеряемый раствор, опускают магнитный стержень и устанавливают ячейку в центре столика магнитной мешалки. Если на то будет указание преподавателя, открывают боковое отверстие хлорсеребряного электрода, удалив из него резиновую пробку. Включают магнитную мешалку и измеряют ЭДС элемента (положительный потенциал фторидного электрода) с помощью иономера ЭВ-74 на узком диапазоне измерений - 1 4 так, как указано в Приложении 3, п.п. 2.1-2.5. Результаты измерений заносят в табл. 3-10.
4 так, как указано в Приложении 3, п.п. 2.1-2.5. Результаты измерений заносят в табл. 3-10.
Таблица 3-10. Результаты измерения электродвижущей силы гальванического элемента как функции концентрации фторид-иона

7. Построение градуировочного графика. По данным табл. 3-10 на миллиметровой бумаге строят градуировочный график, откладывая по оси абсцисс показатель концентрации фторид-иона 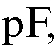 а по оси ординат - ЭДС элемента в милливольтах (Е, мВ). Если выполняется зависимость (21), то получается прямая, тангенс угла наклона которой к оси абсцисс составляет 59±2 мВ (при 25 °C). График подклеивают в лабораторный журнал.
а по оси ординат - ЭДС элемента в милливольтах (Е, мВ). Если выполняется зависимость (21), то получается прямая, тангенс угла наклона которой к оси абсцисс составляет 59±2 мВ (при 25 °C). График подклеивают в лабораторный журнал.
8. Определение содержания фторид-иона в анализируемом растворе с помощью градуировочного графика. Анализируемый раствор, содержащий фторид-ион, получают от преподавателя в мерной колбе на 50 мл. Объем раствора доводят до метки ацетатным буферным раствором. Содержимое колбы перемешивают и в полученном растворе измеряют ЭДС элемента, составленного из фторидного и хлорсеребряного электродов.
По окончании измерений закрывают отверстие хлорсеребряного электрода резиновой пробкой и выключают прибор, как указано в Приложении 3, п. 2.6.
По градуировочному графику находят показатель концентрации фторид-иона, соответствующий ЭДС элемента в анализируемом растворе, затем определяют молярную концентрацию и рассчитывают содержание фторид-иона в растворе по формуле:
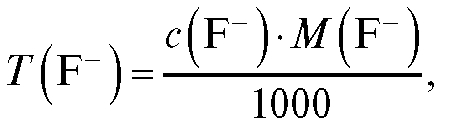
где 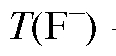 - титр фторид-иона в анализируемом растворе, г/мл;
- титр фторид-иона в анализируемом растворе, г/мл; 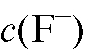 - моляр-
- моляр-
ная концентрация фторид-иона, найденная с помощью градуировочного графика, моль/л; 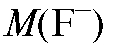 - молярная масса фторид-иона, г/моль.
- молярная масса фторид-иона, г/моль.
Расчет титра проводят с точностью до трех значащих цифр.
9. Определение содержания фторид-иона в анализируемом растворе по уравнению градуировочного графика. Значение рF для анализируемого раствора можно найти по уравнению градуировочного графика, что представляется более точным, чем с помощью градуировочного графика. Это уравнение имеет вид:
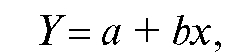
где 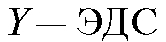 цепи с испытуемым раствором
цепи с испытуемым раствором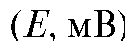 ;
; цепи при
цепи при 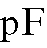 = 0 -
= 0 -
отрезок, отсекаемый прямой по оси ординат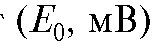 ;
;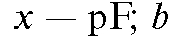 - тангенс угла
- тангенс угла
наклона прямой к оси абсцисс:
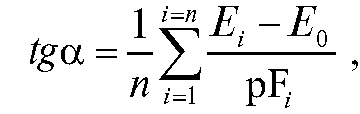
где n - количество эталонных растворов. Таким образом:
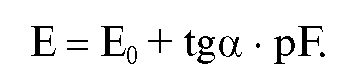
Определив по графику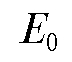 и рассчитав
и рассчитав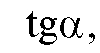 рассчитывают
рассчитывают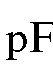
по формуле:
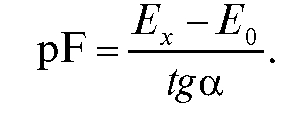
Затем определяют молярную концентрацию и рассчитывают содержание фторид-иона в растворе по формуле, указанной выше.
Контрольные вопросы
1. Назовите составные части гальванического элемента, служащего для определения концентрации (активности) фторид-иона в растворе методом прямой потенциометрии.
2. Какая математическая зависимость лежит в основе определения концентрации (активности) фторид-иона в растворе методом прямой потенциометрии?
3. Опишите устройство фторид-селективного электрода. От каких факторов зависит его потенциал?
4. Почему при определении концентрации фторид-иона методом прямой потенциометрии в анализируемом и стандартных растворах необходимо создавать одинаковую ионную силу?
5. Какой диапазон значений рН является оптимальным для определения фторид-иона с помощью фторид-селективного электрода?
6. Каким образом при определении фторид-иона в растворах со сложным солевым составом поддерживают оптимальное значение рН и постоянную ионную силу?
7. Какие ионы мешают определению фторид-иона в растворе с помощью фторид-селективного электрода? Как устраняют их мешающее влияние?
8. Перечислите основные этапы определения концентрации фторид-иона в растворе потенциометрическим методом с применением градуировочного графика.
9. В каких координатах строят градуировочный график при определении концентрации фторид-иона методом прямой потенциометрии?
10. Чему должен быть равен угловой коэффициент (тангенс угла наклона) градуировочного графика, построенного в координатах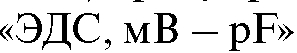 , для стандартных растворов натрия фторида с одинаковой ионной силой при 25 °C?
, для стандартных растворов натрия фторида с одинаковой ионной силой при 25 °C?
11. Как рассчитать концентрацию фторид-иона в растворе с использованием данных градуировочного графика, построенного в координатах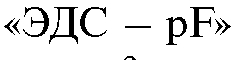 , если известна ЭДС элемента в анализируемом растворе?
, если известна ЭДС элемента в анализируемом растворе?
12. Как приготовить из кристаллического вещества натрия фторида стандартный раствор с концентрацией, точно равной заданной, например 0,1000 моль/л?
13. Как приготовить стандартный раствор натрия фторида из более концентрированного раствора?
14. Назовите диапазон определяемых концентраций и процентную погрешность определения фторид-иона с помощью фторидселективного электрода методом градуировочного графика.
15. Назовите области применения фторид-селективного электрода.
Занятие 2. Потенциометрическое титрование
К занятию необходимо знать
1. Принцип методов потенциометрического анализа. Уравнение Нернста. Разновидности методов потенциометрического анализа.
2. Принципиальную схему установки для потенциометрического титрования.
3. Индикаторные электроды, применяемые в потенциометрическом титровании в зависимости от типа реакции титрования; электроды сравнения.
4. Способы индикации точки эквивалентности в потенциометрическом титровании.
5. Преимущества потенциометрического титрования перед титриметрическим анализом с визуальной индикацией точки эквивалентности.
6. Сущность определения новокаина методом потенциометрического титрования.
К занятию необходимо уметь
1. Готовить анализируемый раствор растворением навески испытуемого образца с точно известной массой.
2. Рассчитывать массовую долю вещества в анализируемом образце на основе результатов титрования.
3. Писать уравнение реакции, протекающей при титровании.
Вопросы для самопроверки
1. Какой принцип лежит в основе метода потенциометрического титрования?
2. Каким уравнением выражается зависимость электродного потенциала от концентрации (активности) потенциалопределяющих компонентов в растворе?
3. Какой электрохимический параметр измеряют при определении вещества методом потенциометрического титрования?
4. Дайте определение понятиям «индикаторный электрод», «электрод сравнения».
5. В чем причина резкого изменения электродвижущей силы гальванического элемента (потенциала индикаторного электрода) в титруемом растворе вблизи точки эквивалентности?
6. Назовите известные способы определения точки эквивалентности на основе данных потенциометрического титрования.
7. Для каких типов химических реакций можно использовать метод потенциометрического титрования? Какие электроды применяются при этом?
8. В чем преимущество потенциометрического титрования перед титриметрическим анализом с визуальной индикацией точки эквивалентности?
9. Назовите диапазон определяемых концентраций и процентную (относительную) погрешность определения вещества методом потенциометрического титрования.
10. Какая химическая реакция лежит в основе определения вещества, содержащего первичную ароматическую аминогруппу, методом нитритометрического титрования? Каковы условия ее проведения? Применяемые индикаторы?
11. Какой принцип лежит в основе определения новокаина методом потенциометрического титрования? Перечислите основные этапы анализа.
Лабораторная работа «Определение массовой доли новокаина в препарате»
Цель работы
Научиться применять метод потенциометрического титрования для количественного определения вещества.
Целевые задачи
1. Ориентировочное потенциометрическое титрование новокаина раствором натрия нитрита.
2. Точное потенциометрическое титрование новокаина раствором натрия нитрита.
3. Нахождение конечной точки потенциометрического титрования.
4. Расчет массовой доли новокаина в препарате.
Материальное обеспечение
Реактивы
1. Натрия нитрит, стандартный ~0,1 моль/л раствор.
2. Новокаин, порошок.
3. Калия бромид, порошок.
4. Кислота соляная концентрированная ( = 1,17 г/мл).
= 1,17 г/мл).
5. Вода дистиллированная. Лабораторная посуда
1. Колба мерная на 100 мл.
2. Колба мерная на 20 мл.
3. Бюретка на 25 мл.
4. Цилиндр мерный на 20 мл.
5. Цилиндр мерный на 100 мл.
6. Стакан для титрования на 150 мл.
7. Бюкс.
8. Воронка.
9. Промывалка на 250 или 500 мл.
Приборы
1. Иономер универсальный ЭВ-74 или аналогичный.
2. Электрод индикаторный платиновый ЭТПЛ-01 М или аналогичный.
3. Электрод сравнения, вспомогательный лабораторный хлорсеребряный ЭВЛ-1МЗ или аналогичный.
Подготовка хлорсеребряного электрода к эксплуатации - см. выше, предыдущую лабораторную работу.
4. Штатив для закрепления двух электродов и бюретки.
5. Мешалка магнитная.
6. Весы аналитические с разновесом.
7. Весы технохимические с разновесом.
Прочие материалы: см. «Материальное обеспечение» в предыдущей работе.
Сущность работы
Потенциометрическое титрование основано на индикации точки эквивалентности по резкому изменению (скачку) потенциала индикаторного электрода в процессе титрования.
Для определения новокаина - вещества, содержащего первичную ароматическую аминогруппу, - применяют метод нитритометрического титрования, согласно которому новокаин титруют стандартным 0,1 моль/л раствором натрия нитрита в солянокислой среде в присутствии калия бромида (ускоряет протекание реакции) при температуре не выше 18-20 °C. В таких условиях реакция титрования протекает количественно и достаточно быстро:
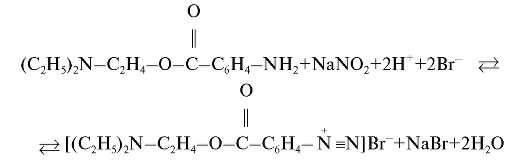
За ходом реакции диазотирования наблюдают с помощью индикаторного платинового электрода, который в паре с подходящим электродом сравнения (хлорсеребряным или каломельным) погружают в титруемый раствор, и измеряют электродвижущую силу 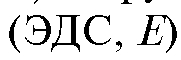 элемента в зави-
элемента в зави-
симости от объема прибавленного титранта 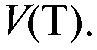
Потенциал индикаторного электрода согласно уравнению Нернста зависит от концентрации (активности) веществ, участвующих в реакции титрования. Вблизи точки эквивалентности (ТЭ) концентрация потенциалопределяющих веществ резко изменяется, что сопровождается резким изменением (скачком) потенциала индикаторного электрода. ЭДС элемента определяется разностью потенциалов между индикаторным электродом и электродом сравнения. Поскольку потенциал электрода сравнения сохраняется постоянным, скачок потенциала индикаторного электрода вызывает резкое изменение ЭДС элемента, что указывает на достижение ТЭ. Для большей точности определения ТЭ титрант в конце титрования прибавляют по каплям.
Графические способы, обычно применяемые для нахождения ТЭ, в данном случае применять вряд ли целесообразно, так как кривая титрования, построенная в координатах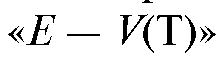 , асимметрична относительно ТЭ; установить ТЭ с достаточно высокой точностью довольно сложно.
, асимметрична относительно ТЭ; установить ТЭ с достаточно высокой точностью довольно сложно.
Процентная погрешность определения новокаина в препарате методом потенциометрического титрования не превышает 0,5%.
Аналогично определению новокаина методом потенциометрического титрования можно определять многие другие органические соединения и лекарственные препараты, содержащие первичную ароматическую аминогруппу, например, сульфацил, норсульфазол, производные n-аминобензойной кислоты и др.
Примечание. Реакция диазотирования протекает медленно. На скорость ее протекания влияют различные факторы. Увеличение кислотности приводит к уменьшению скорости реакции, поэтому при титровании стараются избегать большого избытка соляной кислоты. Для ускорения реакции в реакционную смесь вводят калия бромид. Температура оказывает обычное влияние
на скорость реакции: повышение температуры на 10 °C приводит к увеличению скорости примерно в 2 раза. Однако титрование, как правило, проводят при температуре не выше 18-20 °C, а во многих случаях еще ниже, при охлаждении реакционной смеси до 0-10 °C, так как образующиеся в результате реакции диазосоединения неустойчивы и при более высокой температуре разлагаются.
Титрование с применением реакции диазотирования проводят медленно: сначала со скоростью 1-2 мл/мин, а в конце титрования - 0,05 мл/мин.
Порядок выполнения работы
ВНИМАНИЕ! В данной работе предусмотрено применение универсального иономера ЭВ-74. При использовании приборов другого типа необходимо дополнительно давать их описание в лабораторных методических указаниях.
1. Знакомство с «Инструкцией по технике безопасности при работе с электроприборами» (см. Приложение 1).
2. Знакомство с назначением, принципом работы и «Инструкцией по эксплуатации универсального иономера ЭВ-74» (см. Приложения 2, 3) или аналогичного прибора.
3. Подготовка иономера к измерениям.
3.1. Собирают гальванический элемент из индикаторного платинового электрода и хлорсеребряного электрода сравнения.
Платиновый электрод закрепляют в штативе рядом с электродом сравнения.
ВНИМАНИЕ! Держатели, предназначенные для закрепления в штативе электродов и бюретки, обычно заранее установлены надлежащем образом. Их положение изменять не рекомендуется. Для того чтобы закрепить платиновый электрод или заменить раствор в ячейке, следует сначала осторожно убрать из-под ячейки магнитную мешалку.
Для закрепления платиновый электрод подводят в лапку штатива снизу так, чтобы его нижний конец оказался несколько выше (примерно на 0,5 см) нижнего конца электрода сравнения. Индикаторный электрод подключают к иономеру через гнездо «Изм.», находящееся на задней панели прибора (см. Приложение 3, п. 1.1). Электрод сравнения должен быть подключен к иономеру через гнездо «Всп.».
Электроды многократно промывают дистиллированной водой из промывалки над стаканом на 200-250 мл, после чего под электроды подводят стакан на 150 мл с дистиллированной водой, который устанавливают в центре столика магнитной мешалки. Правильно закрепленные электроды не должны касаться стенок и дна стакана, а также магнитного стержня, применяемого в дальнейшем для перемешивания раствора.
3.2. Иономер включают в сеть под наблюдением преподавателя, руководствуясь инструкцией по эксплуатации прибора (Приложение 3, п.п. 1.2-1.7). Дают прибору прогреться в течение 30 мин.
4. Приготовление анализируемого раствора новокаина. Готовят примерно 0,05 моль/л раствор новокаина в 2 моль/л растворе соляной кислоты. Для этого около 0,9 г препарата (навеску взвешивают в бюксе на аналитических весах с точностью до ±0,0002 г) помещают в мерную колбу на 100 мл, добавляют 20-30 мл дистиллированной воды, 16,6 мл концентрированного раствора соляной кислоты (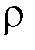 = 1,17 г/мл). Смесь перемешивают до полного растворения препарата, доводят объем раствора до метки дистиллированной водой, содержимое колбы перемешивают.
= 1,17 г/мл). Смесь перемешивают до полного растворения препарата, доводят объем раствора до метки дистиллированной водой, содержимое колбы перемешивают.
5. Ориентировочное титрование. В стакан вместимостью 150 мл пипеткой помещают 20 мл анализируемого раствора новокаина, прибавляют 60 мл дистиллированной воды с помощью цилиндра и около 2 г калия бромида. Электроды - индикаторный платиновый и вспомогательный хлорсеребряный - погружают в титруемый раствор, опускают магнитный стержень и устанавливают ячейку в центре столика магнитной мешалки. Если на то будет указание преподавателя, открывают боковое отверстие хлорсеребряного электрода, удалив из него резиновую пробку. Бюретку на 25 мл наполняют стандартным 0,1 моль/л раствором натрия нитрита и закрепляют в штативе так, чтобы нижний конец бюретки был опущен в стакан на 1-2 см ниже его края. Включают магнитную мешалку. Перемешивание не прекращают в течение всего процесса титрования.
Прибор включают в режим милливольтметра для измерения положительных потенциалов (+мВ). При ориентировочном титровании измерение ЭДС системы производят на широком диапазоне (-1 19) так, как указано в Приложении 3, п.п. 2.1-2.5, раствор титранта прибавляют порциями по 1 мл, каждый раз измеряя ЭДС системы после того, как показание прибора примет установившееся значение.
19) так, как указано в Приложении 3, п.п. 2.1-2.5, раствор титранта прибавляют порциями по 1 мл, каждый раз измеряя ЭДС системы после того, как показание прибора примет установившееся значение.
Наблюдают резкое изменение ЭДС (скачок титрования), а затем прибавляют еще 5-7 мл титранта порциями по 1 мл и убеждаются в незначительном изменении измеряемой величины. По окончании титрования выключают магнитную мешалку. Результаты измерений заносят в табл. 3-11.
На основании результатов ориентировочного титрования устанавливают объем титранта, после добавления которого наблюдается скачок титрования. Этот объем считают близким к объему, соответствующему конечной точке титрования (КТТ).
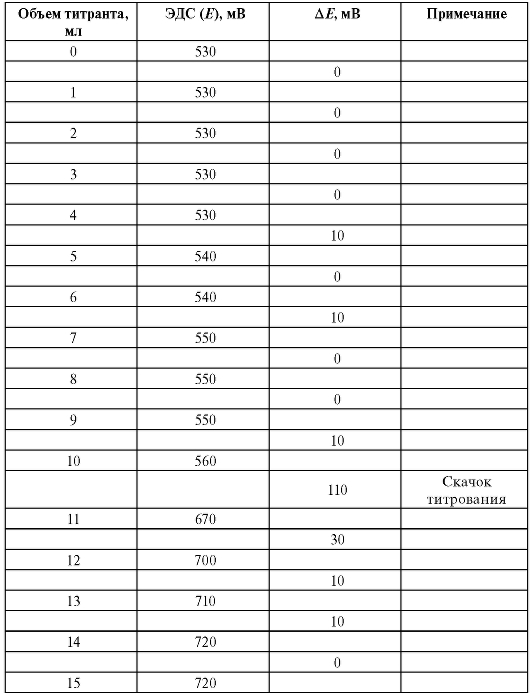
В приведенном в табл. 3-11 примере объем титранта, затраченный на ориентировочное титрование, составляет 11 мл.
Таблица 3-11. Ориентировочное титрование (пример)
По результатам ориентировочного титрования строят кривую титрования в координатах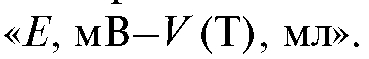 Отмечают асимметричный характер кривой, затрудняющий определение КТТ графическим способом с надлежащей точностью.
Отмечают асимметричный характер кривой, затрудняющий определение КТТ графическим способом с надлежащей точностью.
6. Точное титрование. В чистый стакан на 150 мл помещают новую порцию анализируемого раствора новокаина, дистиллированную воду, калия бромид в тех же количествах, что и при ориентировочном титровании. В раствор погружают электроды, предварительно промытые дистиллированной водой, опускают магнитный стержень и включают магнитную мешалку. При точном титровании измерение ЭДС проводят на узком диапазоне (4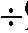 9) так, как указано в приложении 3, п. 2.5.
9) так, как указано в приложении 3, п. 2.5.
Сначала к титруемому раствору со скоростью 1 мл/мин прибавляют такой объем титранта, который должен быть на 1 мл меньше объема, затраченного на ориентировочное титрование, после чего измеряют ЭДС элемента. В приведенном примере объем прибавленного титранта составляет: 11 - 1 = 10 мл.
Затем титрант прибавляют порциями по 2 капли, каждый раз измеряя ЭДС после того, как показание прибора примет установившееся значение. Наблюдают резкое изменение ЭДС (скачок титрования), а затем продолжают титрование порциями по 2 капли и убеждаются в уменьшении и небольшом изменении 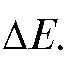 По окончании титрования отмечают общий объем добавленного титранта с точностью до сотых долей миллилитра.
По окончании титрования отмечают общий объем добавленного титранта с точностью до сотых долей миллилитра.
Выключают магнитную мешалку. Результаты титрования заносят в табл. 3-12.
Точное титрование проводят не менее трех раз. По окончании измерений закрывают отверстие хлорсеребряного электрода резиновой пробкой и выключают прибор, как указано в Приложении 3, п. 2.6.
7. Расчет результата анализа. На основании данных точного титрования вычисляют сначала объем одной капли 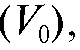 а затем объем титранта, соответствующий
а затем объем титранта, соответствующий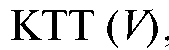 по формулам:
по формулам:
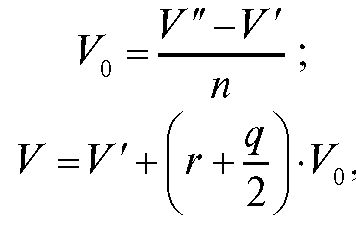
где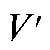 - объем титранта, после прибавления которого титрование продолжают по каплям, мл;
- объем титранта, после прибавления которого титрование продолжают по каплям, мл;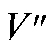 - объем титранта в конце титрования, мл; n - общее число добавленных капель титранта;
- объем титранта в конце титрования, мл; n - общее число добавленных капель титранта; - число капель титранта, добавленных до появления скачка титрования;
- число капель титранта, добавленных до появления скачка титрования;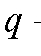 - число капель, составляющих порцию раствора титранта, вызвавшую скачок титрования.
- число капель, составляющих порцию раствора титранта, вызвавшую скачок титрования.
Таблица 3-12. Точное титрование (пример)
Пример. Расчет по данным табл. 3-12.
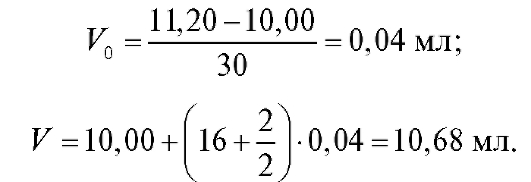
Объем титранта 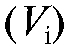 , затраченный на титрование, определяют для каждого i-го титрования.
, затраченный на титрование, определяют для каждого i-го титрования.
Массовую долю (в процентах) новокаина в препарате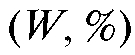 рассчи-
рассчи-
тывают с точностью до сотых долей процента по формуле:
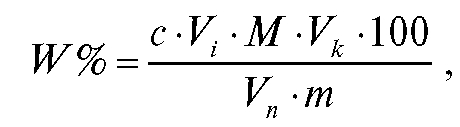
где с - молярная концентрация титранта: стандартного раствора натрия нитрита, моль/л; 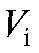 - объем титранта, затраченный на i-е точное титрование, мл;
- объем титранта, затраченный на i-е точное титрование, мл;
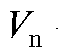 - объем аликвотной доли раствора новокаина, мл;
- объем аликвотной доли раствора новокаина, мл; 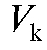 - общий объем анализируемого раствора новокаина, мл; M - молярная масса новокаина, равная 272,78 г/моль; m - масса навески препарата, содержащего новокаин, г.
- общий объем анализируемого раствора новокаина, мл; M - молярная масса новокаина, равная 272,78 г/моль; m - масса навески препарата, содержащего новокаин, г.
Полученные значения массовой доли новокаина в препарате обрабатывают методом математической статистики, представляя результат анализа в виде доверительного интервала для доверительной вероятности 0,95.
Контрольные вопросы
1. В чем состоит принцип определения новокаина методом потенциометрического титрования?
2. Какая химическая реакция лежит в основе определения новокаина методом потенциометрического титрования?
3. С помощью каких электродов можно следить за ходом реакции диазотирования в процессе титрования новокаина раствором натрия нитрита?
4. Чем вызван скачок ЭДС (скачок потенциала индикаторного электрода) в области точки эквивалентности при титровании новокаина раствором натрия нитрита?
5. В каких условиях реакция диазотирования (с участием новокаина) протекает количественно и достаточно быстро?
6. С какой скоростью проводят потенциометрическое титрование новокаина раствором натрия нитрита?
7. Какой вид имеет кривая титрования новокаина раствором натрия нитрита, построенная в координатах «ЭДС - объем титранта»?
8. Целесообразно ли применять графические способы определения точки эквивалентности при потенциометрическом титровании новокаина?
9. По какой формуле можно рассчитать массовую долю новокаина в препарате при его определении методом потенциометрического титрования?
10. Чему равна процентная (относительная) погрешность определения новокаина в препарате методом потенциометрического титрования?
11. Какие преимущества имеет потенциометрический способ индикации точки эквивалентности по сравнению с визуальным при определении новокаина методом нитритометрического титрования?
12. Какие вещества можно определять методом потенциометрического титрования по аналогии с определением новокаина?
Приложение 1
Инструкция по технике безопасности при работе с электроприборами
1. Запрещается:
- работать с незаземленными приборами;
- оставлять включенный прибор без присмотра;
- перемещать включенный прибор;
- работать вблизи открытых токонесущих частей прибора;
- включать и выключать прибор влажными руками.
2. В случае перерыва в подаче электроэнергии немедленно выключить прибор.
3. В случае загорания проводов или электроприбора необходимо немедленно их обесточить и гасить огонь с помощью сухого огнетушителя, покрывала из асбеста, песком, но не водой.
Приложение 2
Назначение и принцип работы универсального иономера ЭВ-74
1. Назначение прибора
Универсальный иономер ЭВ-74 предназначен для определения в комплекте с ионселективными электродами активности (показателя активности - рХ) одно- и двухзарядных ионов (например,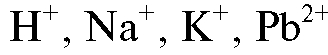 ,
, 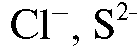 и др.), а также для измерения окислительно-восстановительных потенциалов (электродвижущей силы) -
и др.), а также для измерения окислительно-восстановительных потенциалов (электродвижущей силы) -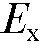 соответствующих электродных систем в водных растворах электролитов.
соответствующих электродных систем в водных растворах электролитов.
Иономер можно использовать также в качестве высокоомного милливольтметра.
2. Принцип работы прибора
Работа иономера основана на преобразовании электродвижущей силы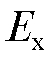 электродной системы в постоянный ток, пропорциональный измеряемой величине. Преобразование осуществляется с помощью высокоомного преобразователя автокомпенсационного типа.
электродной системы в постоянный ток, пропорциональный измеряемой величине. Преобразование осуществляется с помощью высокоомного преобразователя автокомпенсационного типа.
Электродвижущая сила 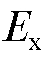 электродной системы сравнивается с противоположным по знаку падением напряжения
электродной системы сравнивается с противоположным по знаку падением напряжения 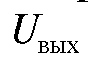 на прецизионном сопротивлении R, через которое протекает ток усилителя
на прецизионном сопротивлении R, через которое протекает ток усилителя 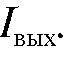 На вход усилителя подается напряжение:
На вход усилителя подается напряжение:
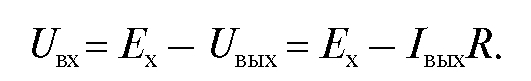
При достаточно большом коэффициенте усиления напряжение 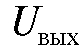 мало отличается от электродвижущей силы
мало отличается от электродвижущей силы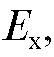 и благодаря этому ток, протекающий через электроды в процессе измерения, весьма мал, а ток
и благодаря этому ток, протекающий через электроды в процессе измерения, весьма мал, а ток 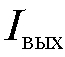 , протекающий через сопротивление R, пропорционален электродвижущей силе
, протекающий через сопротивление R, пропорционален электродвижущей силе 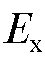 электродной системы:
электродной системы:
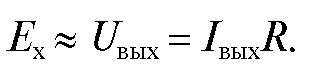
Измерив ток 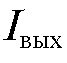 с помощью микроамперметра А, можно определить
с помощью микроамперметра А, можно определить 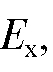 а также
а также 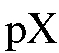 в исследуемом растворе.
в исследуемом растворе.
Приложение 3
Инструкция по эксплуатации универсального иономера ЭВ-74 для измерения окислительно-восстановительных потенциалов (ЭДС) электродных систем
Измерения могут проводиться как в милливольтах, так и в единицах рХ по шкале прибора. При измерении ЭДС поправка на температуру испытуемого раствора не вводится.
1. Подготовка иономера ЭВ-74 к измерениям.
1.1. Выбирают необходимые электроды и закрепляют их в штативе. Индикаторный электрод подключают к гнезду «Изм.» непосредственно или с помощью переходного штекера, а электрод сравнения - к гнезду «Всп.» на задней панели прибора. Электроды промывают и погружают в стакан с дистиллированной водой.
1.2. Проверяют наличие заземления корпуса прибора.
1.3. Устанавливают механический ноль показывающего прибора, для чего, поворачивая отверткой корректор нуля, устанавливают стрелку на нулевую (начальную) отметку шкалы.
1.4. Нажимают нижнюю кнопку «t°» выбора рода работы и верхнюю кнопку «-1 19» выбора диапазона измерения.
19» выбора диапазона измерения.
1.5. Подключают прибор к сети 220 В с помощью шнура.
1.6. Включают прибор с помощью тумблера «Сеть». При подаче напряжения загорается глазок индикации включения.
1.7. Прибор прогревается в течение 30 мин.
2. Измерение окислительно-восстановительных потенциалов (ЭДС) электродных систем.
2.1. Электроды погружают в стакан с испытуемым раствором, предварительно удалив с поверхности электродов избыток дистиллированной воды фильтровальной бумагой.
2.2. Включают магнитную мешалку.
2.3. Нажимают кнопку 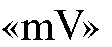 и кнопку выбранного диапазона измерения.
и кнопку выбранного диапазона измерения.
2.4. Оставляют отжатой кнопку «анион | катион; +|-», если измеряют положительные потенциалы, и нажимают при измерении отрицательных потенциалов.
2.5. Дают установиться показаниям прибора и проводят отсчет значения потенциала в милливольтах по соответствующей шкале показывающего прибора, умножая показание прибора на 100:
• при измерении на широком диапазоне «-1 19» отсчет проводят по нижней шкале с оцифровкой от -1 до 19;
19» отсчет проводят по нижней шкале с оцифровкой от -1 до 19;
• при измерении на узком диапазоне «-1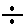 4» отсчет проводят по верхней шкале с оцифровкой от -1 до 4;
4» отсчет проводят по верхней шкале с оцифровкой от -1 до 4;
• при измерении на одном из узких диапазонов «4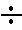 9», «9
9», «9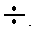 14», «14
14», «14 19» отсчет проводят по верхней шкале с оцифровкой от 0 до 5, причем показание прибора суммируют со значением нижнего предела выбранного диапазона.
19» отсчет проводят по верхней шкале с оцифровкой от 0 до 5, причем показание прибора суммируют со значением нижнего предела выбранного диапазона.
Пример. Переключатель диапазонов установлен в положение «4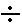 9», а стрелка прибора установилась на значении 3,25. В этом случае измеряемая величина равна: (4 + 3,25) • 100=725 мВ.
9», а стрелка прибора установилась на значении 3,25. В этом случае измеряемая величина равна: (4 + 3,25) • 100=725 мВ.
2.6. По окончании измерений нажимают на кнопку «t°» и «-1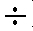 19», выключают прибор с помощью тумблера «Сеть» и отключают прибор и магнитную мешалку от сети. Электроды и стержень магнитной мешалки промывают дистиллированной водой и сдают лаборанту.
19», выключают прибор с помощью тумблера «Сеть» и отключают прибор и магнитную мешалку от сети. Электроды и стержень магнитной мешалки промывают дистиллированной водой и сдают лаборанту.
Занятие 3. Кулонометрический анализ Принцип метода
Кулонометрический анализ (кулонометрия) основан на использовании зависимости между массой m вещества, прореагировавшего при электролизе в электрохимической ячейке, и количеством электричества Q, прошедшего через электрохимическую ячейку при электролизе только этого вещества. В соответствии с объединенным законом электролиза М. Фарадея масса m (в граммах) связана с количеством электричества Q (в кулонах) соотношением:
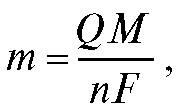 (1)
(1)
где M - молярная масса вещества, прореагировавшего при электролизе, г/моль; n - число электронов, участвующих в электродной реакции; F = 96 487 Кл/моль - число Фарадея.
Количество электричества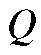 (в кулонах), прошедшее при электролизе через электрохимическую ячейку, равно произведению электрического тока
(в кулонах), прошедшее при электролизе через электрохимическую ячейку, равно произведению электрического тока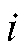 (в амперах) на время электролиза
(в амперах) на время электролиза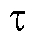 (в секундах):
(в секундах):
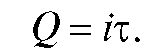 (2)
(2)
Если измерено количество электричества 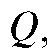 то согласно (1) можно рассчитать массу m. Это справедливо в том случае, когда все количество электричества
то согласно (1) можно рассчитать массу m. Это справедливо в том случае, когда все количество электричества 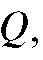 прошедшее при электролизе через электрохимическую ячейку, израсходовано только на электролиз данного вещества; побоч-
прошедшее при электролизе через электрохимическую ячейку, израсходовано только на электролиз данного вещества; побоч-
ные процессы должны быть исключены. Другими словами, выход (эффективность) по току должен быть равен 100%.
Поскольку в соответствии с объединенным законом электролиза М. Фарадея (1) для определения массы m (г) прореагировавшего при электролизе вещества необходимо измерить количество электричества Q, затраченное на электрохимическое превращение определяемого вещества, в кулонах, то метод и назван кулонометрией. Главная задача кулонометрических измерений - как можно более точно определить количество электричества Q.
Кулонометрический анализ проводят либо в амперостатическом (гальваностатическом) режиме, т.е. при постоянном электрическом токе i = const, либо при контролируемом постоянном потенциале рабочего электрода (потенциостатическая кулонометрия), когда электрический ток изменяется (уменьшается) в процессе электролиза.
В первом случае для определения количества электричества Q достаточно как можно более точно измерить время электролиза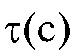 , постоянный ток
, постоянный ток 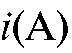 и рассчитать величину Q по формуле (2). Во втором случае величину Q определяют либо расчетным способом, либо с помощью химических кулонометров.
и рассчитать величину Q по формуле (2). Во втором случае величину Q определяют либо расчетным способом, либо с помощью химических кулонометров.
Различают прямую и косвенную кулонометрию (кулонометрическое титрование).
Прямая кулонометрия
Сущность метода
Прямую кулонометрию при постоянном токе применяют редко. Чаще используют кулонометрию при контролируемом постоянном потенциале рабочего электрода или прямую потенциостатическую кулонометрию.
В прямой потенциостатической кулонометрии электролизу подвергают непосредственно определяемое вещество. Измеряют количество электричества, затраченное на электролиз этого вещества, и по уравнению (1) рассчитывают массу m определяемого вещества.
В процессе электролиза потенциал рабочего электрода поддерживают постоянным, 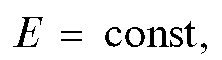 для чего обычно используют приборы - потенциостаты.
для чего обычно используют приборы - потенциостаты.
Постоянное значение потенциала E выбирают предварительно на основании рассмотрения вольтамперной (поляризационной) кривой, построенной в координатах «ток i - потенциал Е», полученной в тех же условиях, в которых будет проводиться электролиз. Обычно выбирают
значение потенциала Е, соответствующее области предельного тока для определяемого вещества и несколько превышающее его потенциал полуволны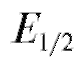 (на ~0,05-0,2 B). При этом значении потенциала фоновый электролит не должен подвергаться электролизу.
(на ~0,05-0,2 B). При этом значении потенциала фоновый электролит не должен подвергаться электролизу.
В качестве рабочего электрода чаще всего применяют платиновый электрод, на котором происходит электрохимическое восстановление или окисление определяемого вещества. Кроме рабочего электрода электрохимическая ячейка включает 1 или 2 других электрода - электрод сравнения, например, хлорсеребряный, и вспомогательный электрод, например, из стали.
По мере протекания процесса электролиза при постоянном потенциале электрический ток в ячейке уменьшается, так как понижается концентрация электроактивного вещества, участвующего в электродной реакции. При этом электрический ток уменьшается со временем по экспоненциальному закону от начального значения 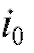 в момент времени
в момент времени 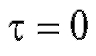 до значения
до значения 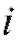 в момент времени
в момент времени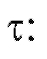
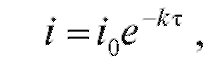 (3)
(3)
где коэффициент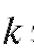 зависит от природы реакции, геометрии электрохимической ячейки, площади рабочего электрода, коэффициента диффузии определяемого вещества, скорости перемешивания раствора и его объема.
зависит от природы реакции, геометрии электрохимической ячейки, площади рабочего электрода, коэффициента диффузии определяемого вещества, скорости перемешивания раствора и его объема.
График функции (3) схематически показан на рис. 3-10.
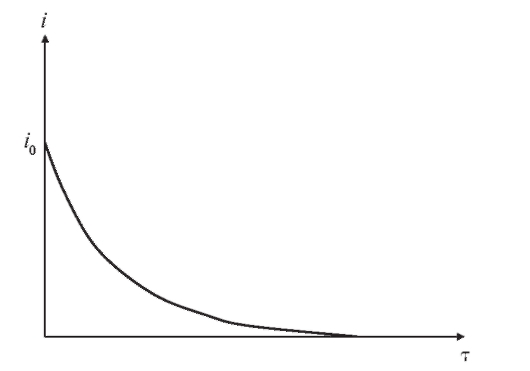
Рис. 3-10. Изменение тока со временем
со временем в прямой потенциостатической кулонометрии
в прямой потенциостатической кулонометрии
Выход по току будет количественным, когда ток 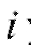 уменьшится до нуля, т.е. при бесконечно большом времени
уменьшится до нуля, т.е. при бесконечно большом времени 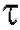 . На практике электролиз
. На практике электролиз
определяемого вещества считают количественным, когда ток достигнет очень малой величины, не превышающей ~0,1% значения 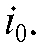 При этом ошибка определения составляет около ~0,1%.
При этом ошибка определения составляет около ~0,1%.
Поскольку количество электричества определяется как произведение тока на время электролиза, очевидно, что общее количество электричества Q, затраченное на электролиз определяемого вещества, равно:
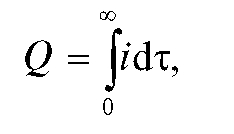 (4)
(4)
т.е. определяется площадью, ограниченной осями координат и экспонентой на рис. 3-10.
Для нахождения массы m прореагировавшего вещества требуется согласно (1) измерить или рассчитать количество электричества Q.
Способы определения количества электричества, прошедшего через раствор, в прямой потенциостатической кулонометрии
Величину Q можно определить расчетными способами либо с помощью химического кулонометра.
• Расчет величины Q по площади под кривой зависимости i от 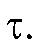 Измеряют площадь, ограниченную осями координат и экспонентой (3) (см. рис. 3-10). Если ток i выражен в амперах, а время
Измеряют площадь, ограниченную осями координат и экспонентой (3) (см. рис. 3-10). Если ток i выражен в амперах, а время 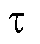 - в секундах, то измеренная площадь равна количеству электричества Q в кулонах.
- в секундах, то измеренная площадь равна количеству электричества Q в кулонах.
Для определения Q без заметной ошибки способ требует практически полного завершения процесса электролиза, т.е. длительного времени. На практике измеряют площадь при значении т, соответствующем i = 0,001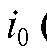 (0,1% от
(0,1% от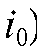 .
.
• Расчет величины Q на основе зависимости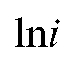 от
от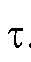 В соответствии с (3) и (4) имеем:
В соответствии с (3) и (4) имеем:
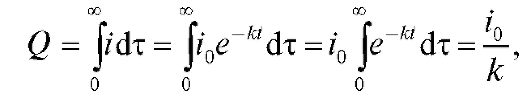
поскольку:
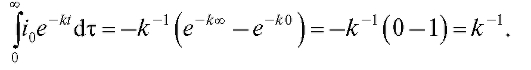
Таким образом, 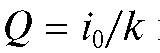 и для определения величины Q необходимо
и для определения величины Q необходимо
найти значения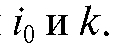
Согласно (3)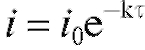 . После логарифмирования этого уравнения по-
. После логарифмирования этого уравнения по-
лучаем линейную зависимость 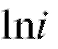 от
от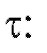
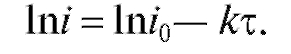 (5)
(5)
Если измерить несколько значений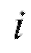 в различные моменты времени
в различные моменты времени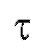 (например, воспользовавшись кривой типа представленной на рис. 3-10 или непосредственно опытным путем), можно построить график функции (5), схематически показанный на рис. 3-11 и представляющий собой прямую линию.
(например, воспользовавшись кривой типа представленной на рис. 3-10 или непосредственно опытным путем), можно построить график функции (5), схематически показанный на рис. 3-11 и представляющий собой прямую линию.
Отрезок, отсекаемый прямой линией на оси ординат, равен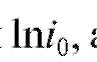 а тангенс угла
а тангенс угла 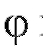 наклона прямой к оси абсцисс равен:
наклона прямой к оси абсцисс равен: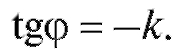
Зная значения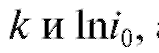 а следовательно,
а следовательно,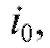 можно рассчитать величи-
можно рассчитать величи-
ну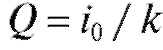 , а затем и массу m по формуле (1).
, а затем и массу m по формуле (1).
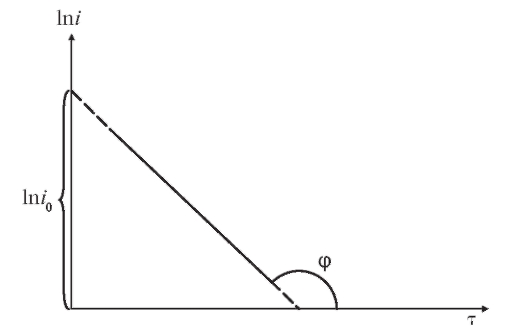
Рис. 3-11. Зависимость от времени электролиза
от времени электролиза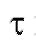 в прямой потенциостатической кулонометрии
в прямой потенциостатической кулонометрии
• Определение величины Q с помощью химического кулонометра. При этом способе в электрическую цепь кулонометрической установки включают химический кулонометр последовательно с электрохимической ячейкой, в которой проводят электролиз определяемого вещества. Количество электричества Q, проходящее через последовательно соединенные кулонометр и электрохимическую ячейку, одинаково. Конструкция кулонометра позволяет экспериментально определить величину Q.
Чаще всего применяют серебряный, медный и газовые кулонометры, реже некоторые другие. Использование серебряного и медного кулонометров основано на электрогравиметрическом определении массы серебра или меди, осаждающейся на платиновом катоде при электролизе.
Зная массу металла, выделившегося на катоде в кулонометре, можно по уравнению (1) рассчитать количество электричества Q.
Кулонометры, особенно серебряный и медный, позволяют определять количество электричества Q с высокой точностью, однако работа с ними довольно трудоемка и продолжительна.
В кулонометрии применяют также электронные интеграторы, позволяющие регистрировать количество электричества Q, затраченное на электролиз, по показаниям соответствующего прибора.
Применение прямой кулонометрии
Метод обладает высокими селективностью, чувствительностью (до 10-8-10-9 г или до ~10-5 моль/л), воспроизводимостью (до ~1-2%), позволяет определять содержание микропримесей. К недостаткам метода относится большая трудоемкость и длительность проведения анализа, необходимость наличия дорогостоящей аппаратуры.
Прямую кулонометрию можно применять для определения ионов металлов, органических нитро- и галогенпроизводных, хлорид-, бромид-, иодид-, тиоцианат-анионов, ионов металлов в низших степенях окисления при переводе их в более высокие состояния окисления, например:
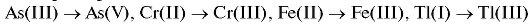 и т.д.
и т.д.
В фармацевтическом анализе прямую кулонометрию применяют для определения аскорбиновой и пикриновой кислот, новокаина, оксихинолина и в некоторых других случаях.
Прямая кулонометрия довольно трудоемка и продолжительна. Кроме того, в ряде случаев начинают заметно протекать побочные процессы еще до завершения основной электрохимической реакции, что снижает выход по току и может привести к значительным ошибкам анализа. Именно поэтому чаще применяют косвенную кулонометрию - кулонометрическое титрование.
Кулонометрическое титрование
Сущность метода
При кулонометрическом титровании определяемое вещество X, находящееся в растворе в электрохимической ячейке, реагирует с титрантом T - веществом, непрерывно образующимся (генерируемым) на генераторном электроде при электролизе вспомогательного вещества, также присутствующего в растворе. Окончание титрования - момент, когда все определяемое вещество X полностью прореагирует с генерируемым титрантом T, фиксируют либо визуально индикаторным мето-
дом, вводя в раствор соответствующий индикатор, меняющий окраску вблизи ТЭ, либо с помощью инструментальных методов - потенциометрически, амперометрически, фотометрически.
Таким образом, при кулонометрическом титровании титрант не прибавляется из бюретки в титруемый раствор. Роль титранта играет вещество T, непрерывно генерируемое при электродной реакции на генераторном электроде. Очевидно, имеется аналогия между обычным титрованием, когда титрант вводится извне в титруемый раствор и по мере его прибавления реагирует с определяемым веществом, и генерацией вещества T, которое по мере своего образования также реагирует с определяемым веществом, поэтому рассматриваемый метод и получил название «кулонометрическое титрование».
Кулонометрическое титрование проводят в амперостатическом (гальваностатическом) или в потенциостатическом режиме. Чаще кулонометрическое титрование проводят в амперостатическом режиме, поддерживая электрический ток постоянным в течение всего времени электролиза.
Вместо объема прибавленного титранта в кулонометрическом титровании измеряют время т и ток i электролиза. Процесс образования вещества T в кулонометрической ячейке во время электролиза называется генерацией титранта.
Кулонометрическое титрование при постоянном токе
При кулонометрическом титровании в амперостатическом режиме (при постоянном токе) измеряют время в течение которого проводился электролиз, и количество электричества Q, израсходованное при электролизе, рассчитывают по формуле (2), после чего находят массу определяемого вещества X по соотношению (1).
в течение которого проводился электролиз, и количество электричества Q, израсходованное при электролизе, рассчитывают по формуле (2), после чего находят массу определяемого вещества X по соотношению (1).
Так, например, стандартизацию раствора хлороводородной кислоты  методом кулонометрического титрования проводят путем титрования ионов водорода
методом кулонометрического титрования проводят путем титрования ионов водорода 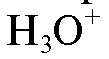 стандартизуемого раствора, содержащего HCl, электрогенерируемыми на платиновом катоде гидроксид-ионами OH- при электролизе воды:
стандартизуемого раствора, содержащего HCl, электрогенерируемыми на платиновом катоде гидроксид-ионами OH- при электролизе воды:
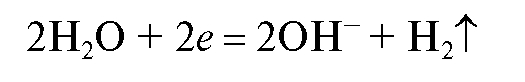
Образовавшийся титрант - гидроксид-ионы - реагирует с ионами 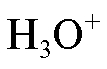 в растворе:
в растворе:
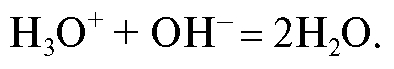
Титрование ведут в присутствии индикатора фенолфталеина и прекращают при появлении светло-розовой окраски раствора.
Зная величину постоянного тока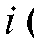 в амперах) и время
в амперах) и время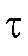 (в секундах), затраченное на титрование, рассчитывают по формуле (2) количество электричества Q (в кулонах) и по формуле (1) - массу (в граммах) прореагировавшей HCl, содержавшуюся в аликвоте стандартизуемого раствора HCl, внесенного в кулонометрическую ячейку (в генераторный сосуд).
(в секундах), затраченное на титрование, рассчитывают по формуле (2) количество электричества Q (в кулонах) и по формуле (1) - массу (в граммах) прореагировавшей HCl, содержавшуюся в аликвоте стандартизуемого раствора HCl, внесенного в кулонометрическую ячейку (в генераторный сосуд).
На рис. 3-12 схематически показан один из вариантов электрохимической ячейки для кулонометрического титрования с визуальной (по изменению окраски индикатора) индикацией окончания титрования, с генераторным катодом и вспомогательным анодом.
Генераторный платиновый электрод 1 (в рассматриваемом случае - анод) и вспомогательный платиновый электрод 2 (в рассматриваемом случае - катод) помещены соответственно в генерационный (генераторный) сосуд 3 и вспомогательный сосуд 4. Генерационный сосуд 3 заполнен испытуемым раствором, содержащим определяемое вещество X, фоновый электролит с вспомогательным электроактивным веществом и индикатором. Вспомогательное вещество и само может играть роль фонового электролита; в таких случаях нет необходимости вводить в раствор другой фоновый электролит.
Генерационный и вспомогательный сосуды соединены электролитическим (солевым) мостиком 5, заполненным сильным индифферентным электролитом для обеспечения электрического контакта между электродами. Концы трубки электролитического мостика закрыты пробками из фильтровальной бумаги. В генерационном сосуде имеется магнитный стержень 6 для перемешивания раствора посредством магнитной мешалки.
Электрохимическая ячейка включается в электрическую цепь установки для кулонометрического титрования, способную поддерживать ток постоянным и требуемой величины (например, используют универсальный источник питания типа лабораторного прибора УИП-1 и подобную аппаратуру).
До кулонометрического титрования электроды тщательно промывают дистиллированной водой, в генерационный сосуд вносят раствор с вспомогательным электроактивным (в данных условиях) веществом, при необходимости - фоновый электролит и индикатор.
Поскольку приготовленный таким путем фоновый раствор может содержать электровосстанавливающиеся или электроокисляющиеся примеси, то вначале проводят предэлектролиз фонового раствора в целях электровосстановления или электроокисления примесей. Для этого замыкают электрическую цепь установки и ведут электролиз в течение
некоторого (обычно небольшого) времени до изменения окраски индикатора, после чего цепь размыкают.
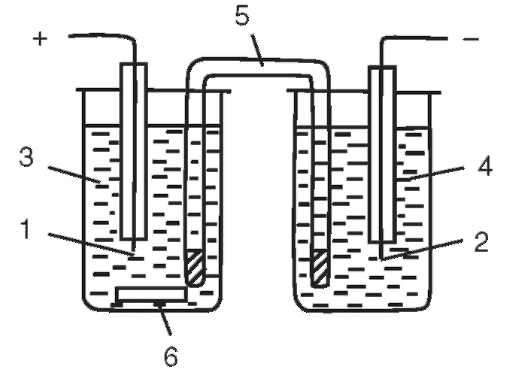
Рис. 3-12. Схема электрохимической ячейки для кулонометрического титрования с визуальной индикаторной фиксацией окончания титрования: 1 - рабочий генераторный платиновый электрод; 2 - вспомогательный платиновый электрод; 3 - генерационный сосуд с испытуемым раствором; 4 - вспомогательный сосуд с раствором сильного индифферентного электролита; 5 - электролитический мостик; 6 - стержень магнитной мешалки
После завершения предэлектролиза в генерационный сосуд вносят точно измеренный объем анализируемого раствора, включают магнитную мешалку, замыкают электрическую цепь установки, одновременно включая секундомер, и ведут электролиз при постоянном токе до момента резкого изменения окраски индикатора (раствора), когда сразу же останавливают секундомер и размыкают электрическую цепь установки.
Если анализируемый раствор, вводимый в кулонометрическую ячейку для титрования, содержит примеси электровосстанавливающихся или электроокисляющихся веществ, на превращения которых затрачивается при электролизе некоторое количество электричества, то после предэлектролиза (до прибавления в ячейку анализируемого раствора) проводят холостое титрование, вводя в кулонометрическую ячейку вместо анализируемого раствора точно такой же объем раствора, который содержит все те же вещества и в тех же количествах, что и прибавленный анализируемый раствор, за исключением определяемого вещества X. В простейшем случае к фоновому раствору прибавляют дистиллированную воду в объеме, равном объему аликвоты анализируемого раствора с определяемым веществом.
Время, затраченное на холостое титрование, в дальнейшем вычитают из времени, затраченного на титрование испытуемого раствора с определяемым веществом.
Условия проведения кулонометрического титрования. Должны обеспечить 100% выход по току. Для этого необходимо выполнять, по крайней мере, следующие требования.
1. Вспомогательный реагент, из которого на рабочем электроде генерируется титрант, должен присутствовать в растворе в большом избытке по отношению к определяемому веществу (~1000-кратный избыток). В этих условиях обычно устраняются побочные электрохимические реакции, основная из которых - окисление или восстановление фонового электролита, например, ионов водорода:
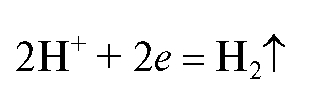
2. Величина постоянного тока i = const при проведении электролиза должна быть меньше величины диффузионного тока вспомогательного реагента во избежание протекания реакции с участием ионов фонового электролита.
3. Необходимо как можно точнее определять количество электричества, израсходованное при проведении электролиза, для чего требуется точно фиксировать начало и конец отсчета времени и величину тока электролиза.
Индикация конца титрования. При кулонометрическом титровании ТЭ определяют либо визуальным индикаторным, либо инструментальными (спектрофотометрическими, электрохимическими) методами.
Например, при титровании раствора тиосульфата натрия электрогенерированным йодом в кулонометрическую ячейку прибавляют индикатор - раствор крахмала. После достижения ТЭ, когда в растворе оттитрованы все тиосульфат-ионы, первая же порция электрогенерированного йода окрашивает раствор в синий цвет. Электролиз прерывают.
При электрохимической индикации ТЭ в испытуемый раствор (в генерационный сосуд) помещают еще пару электродов, входящих в дополнительную индикаторную электрическую цепь. Окончание титрования можно фиксировать с помощью дополнительной индикаторной электрической цепи потенциометрически (рН-метрически) или биамперометрически.
При биамперометрической индикации ТЭ строят кривые титрования в координатах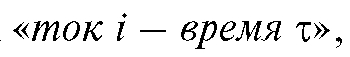 измеряя ток i в дополнительной инди-
измеряя ток i в дополнительной инди-
каторной электрической цепи как функцию времени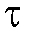 электролиза в кулонометрической ячейке.
электролиза в кулонометрической ячейке.
Кулонометрическое титрование при постоянном потенциале
Потенциостатический режим в кулонометрическом титровании используется реже.
Кулонометрическое титрование в потенциостатическом режиме ведут при постоянном значении потенциала, соответствующем потенциалу разряда вещества на рабочем электроде, например, при катодном восстановлении катионов металлов Mn+ на платиновом рабочем электроде. По мере протекания реакции потенциал остается постоянным до тех пор, пока прореагируют все катионы металла, после чего он резко уменьшается, поскольку в растворе уже нет потенциалопределяющих катионов металла.
Применение кулонометрического титрования. В кулонометрическом титровании можно использовать все типы реакций титриметрического анализа: кислотно-основные, окислительно-восстановительные, осадительные, реакции комплексообразования.
Малые количества кислот (до ~10-4-10-5 моль/л) можно определять кулонометрическим кислотно-основным титрованием электрогенерированными  -ионами, образующимися при электролизе воды на катоде:
-ионами, образующимися при электролизе воды на катоде:
Можно титровать и основания ионами водорода 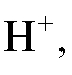 генерируемыми на аноде при электролизе воды:
генерируемыми на аноде при электролизе воды:
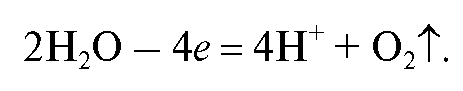
При окислительно-восстановительном бромометрическом кулонометрическом титровании можно определять соединения мышьяка(III), сурьмы(III), иодиды, гидразин, фенолы и другие органические вещества. В роли титранта выступает электрогенерируемый на аноде бром:
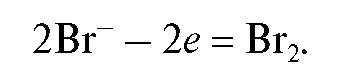
Осадительным кулонометрическим титрованием можно определять галогенид-ионы и органические серосодержащие соединения электрогенерированными катионами серебра 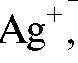 катионы цинка
катионы цинка 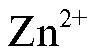 - электрогенерированными ферроцианид-ионами и т.д.
- электрогенерированными ферроцианид-ионами и т.д.
Комплексонометрическое кулонометрическое титрование катионов металлов можно проводить анионами ЭДТА, электрогенерированными на катоде из комплексоната ртути(II).
Кулонометрическое титрование обладает высокой точностью, широким диапазоном применения в количественном анализе, позволяет определять малые количества веществ, малостойкие соединения (поскольку они вступают в реакции сразу же после их образования), например, меди(I), серебра(II), олова(II), титана(III), марганца(III), хлора, брома и др.
К достоинствам метода относится также и то, что не требуется приготовления, стандартизации и хранения титранта, так как он непрерывно образуется при электролизе и сразу же расходуется в реакции с определяемым веществом.
Недостатком метода можно считать необходимость использования сравнительно сложной и дорогостоящей аппаратуры.
Цели изучения темы
На основе знания теоретических основ метода кулонометрического титрования и выработки практических умений научиться обоснованно выбирать и практически применять данный метод анализа для количественного определения вещества; уметь проводить статистическую оценку результатов кулонометрического титрования.
Целевые задачи
1. Научиться проводить количественное определение массы натрия тиосульфата в растворе методом кулонометрического титрования.
2. Научиться проводить стандартизацию раствора хлороводородной кислоты методом кулонометрического титрования.
3. Решение типовых расчетных задач.
На изучение темы отводится одно лабораторное занятие из двух, описанных в данном пособии. Рекомендуется проводить лабораторную работу «Определение массы натрия тиосульфата в растворе методом кулонометрического титрования».
Задание для самоподготовки
К занятию необходимо знать
1. Принцип методов кулонометрии.
2. Сущность метода кулонометрического титрования при определении:
а) натрия тиосульфата;
б) хлороводородной кислоты.
Необходимо уметь
1. Писать уравнения электрохимических реакций, протекающих на электродах при кулонометрическом титровании:
а) натрия тиосульфата;
б) хлороводородной кислоты.
2. Писать уравнения электрохимических реакций, протекающих в растворе при кулонометрическом титровании:
а) натрия тиосульфата;
б) хлороводородной кислоты.
3. Рассчитывать количество электричества и массу (концентрацию) вещества по результатам кулонометрического титрования.
4. Обрабатывать результаты параллельных определений вещества методом математической статистики.
Список литературы
1. Учебник. - Книга 2, глава 10. - С. 481-492; 507-509; 512-513.
2. Харитонов Ю.Я., Григорьева В.Ю. Примеры и задачи по аналитической химии.- М.: ГЭОТАР-Медиа, 2009.- С. 240-244; 261-264; 277-281.
3. Лекции по теме: «Кулонометрический анализ».
4. Ефременко О.А. Кулонометрическое титрование.- М.: 1-й ММИ им. И.М. Сеченова, 1990.
Вопросы для самопроверки
1. Напишите математическое выражение для закона Фарадея.
2. В чем различие между прямым и косвенным кулонометрическим анализом?
3. Как получают титрант в кулонометрическом титровании при постоянном токе?
4. Как определяют количество электричества, затраченное на кулонометрическое титрование при постоянном токе?
5. Какие условия необходимы для кулонометрического титрования?
6. Как обеспечивают 100% выход по току в кулонометрическом титровании?
7. Какие электрохимические реакции на электродах и химические реакции в растворе протекают при кулонометрическом титровании:
а) тиосульфат-иона;
б) иона гидроксония?
8. Как устанавливают момент окончания химической реакции в кулонометрическом титровании?
9. Что такое предэлектролиз? С какой целью его проводят?
10. Охарактеризуйте принципиальную схему установки для кулонометрического титрования с визуальной индикацией конечной точки титрования.
11. В чем заключаются преимущества метода кулонометрического титрования по сравнению с методами классического титриметрического анализа?
12. Назовите возможные источники систематических погрешностей в кулонометрическом титровании.
Установка для кулонометрического титрования с визуальной индикацией конечной точки титрования
1. Принципиальная схема установки для кулонометрического титрования
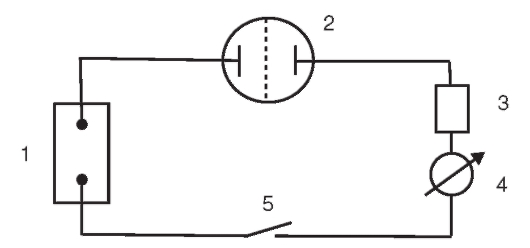
Рис. 3-13. Схема установки для кулонометрического титрования с визуальной индикацией конечной точки титрования
В простейшую установку для кулонометрического титрования (рис. 3-13) с визуальной индикацией конечной точки титрования входят соединенные последовательно:
1 - регулируемый источник постоянного тока с напряжением не менее 100 В;
2 - электролитическая ячейка;
3 - высокоомное стандартное сопротивление порядка 20 кОм;
4 - миллиамперметр для измерения тока от 0 до 50 мА;
5 - тумблер для замыкания цепи.
Такая установка способна давать ток порядка 20 мА и поддерживать его постоянным с точностью до ±0,5%.
Время электролиза в процессе титрования измеряют с помощью секундомера, который включают или выключают одновременно с замыканием или размыканием цепи.
2. Электролитическая ячейка
Схема ячейки для кулонометрического титрования с визуальной индикацией КТТ приведена на рис. 3-12.
Генераторный электрод должен иметь относительно большую поверхность. Его обычно изготавливают из платины в форме прямоугольной пластинки или спирали. Вспомогательный электрод может быть изготовлен из платины, вольфрама или другого подходящего материала.
Поскольку продукты, образующиеся на вспомогательном электроде, могут осложнять процесс титрования (например, взаимодействовать с генерированным титрантом), во избежание этого генераторный и вспомогательный электроды вносят в два отдельных сосуда: генерационный и вспомогательный соответственно.
В качестве генерационного сосуда обычно используют стакан, в который помещают анализируемый раствор, вспомогательный реагент, из которого генерируется титрант, и индикатор.
В качестве вспомогательного сосуда используют стакан, в который помещают раствор инертного сильного электролита.
Для обеспечения электролитического контакта между электродами применяют электролитический мостик (5) (см. рис. 3-12). Последний представляет собой 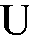 -образную трубку, заполненную раствором инертного сильного электролита и закрытую пробками из фильтровальной бумаги.
-образную трубку, заполненную раствором инертного сильного электролита и закрытую пробками из фильтровальной бумаги.
Перемешивание раствора в генерационном сосуде осуществляют с помощью магнитной мешалки (6) (см. рис. 3-12).
3. Источник постоянного тока
В качестве регулируемого источника потоянного тока можно использовать, например, универсальный источник питания - прибор УИП-1 или аналогичный. Однако его можно заменить двумя или более батареями высокой емкости (45 В) и реостатом. Прибор УИП-1 питается от сети переменного тока 220 В и обеспечивает на выходе стабилизированное выпрямленное напряжение от 20 до 600 В и от 0 до 400 В при токе нагрузки до 600 и 5 мА соответственно.
В лабораторных работах, приведенных в настоящем пособии, используется стабилизированное выпрямленное напряжение от 20 до 600 В при токе нагрузки до 600 мА.
Управление прибором выведено на переднюю панель, на которой расположены: гнездо кабеля питания, выключатель сети, индикаторная лампочка, переключатель диапазонов вольтметра, вольтметр, миллиамперметр постоянного тока, переключатель поддиапазонов напряжения от 20 до 600 В, потенциометр плавной регулировки напряжения от 20 до 600 В, тумблер включения высокого напряжения «Анод», четыре гнезда (верхние) для выходного напряжения от 20 до 600 В, клемма заземления.
4. Порядок выполнения кулонометрического титрования с визуальной индикацией конечной точки титрования
4.1. Подготавливают к работе установку для кулонометрического титрования. Для отбора аликвотных долей анализируемого растора рекомендуется применять бюретку.
ВНИМАНИЕ! Держатели, предназначенные для закрепления в штативе генераторного электрода и бюретки, установлены заранее надлежащим образом. Не рекомендуется изменять их положение.
При закреплении в штативе генераторного электрода сначала из-под генерационного сосуда (стакана вместимостью 50-150 мл) осторожно убирают магнитную мешалку, а затем подводят электрод в лапку штатива снизу так, чтобы нижний конец электрода оказался на несколько миллиметров выше конца электрического мостика. Генераторный электрод и конец мостика промывают дистиллированной водой из промывалки, после чего под них подводят стакан с дистиллированной водой, который устанавливают в центр столика магнитной мешалки. Правильно закрепленный генераторный электород не должен касаться стенок и дна сосуда, а также магнитного стержня, применяемого для перемешивания раствора.
Вспомогательный электрод и другой конец соединительного мостика должны быть опущены в стакан с 10% раствором натрия сульфата. Соединительный мостик, заполненный тем же раствором, не должен содержать пузырьков воздуха.
После установки генераторного электрода тумблер (5) (см. рис. 3-13) переводят в положение «Выключено» (генераторная цепь разомкнута) и подключают электроды ячейки к верхней паре гнезд (для выходного напряжения от 20 до 600 В прибора УИП-1), соблюдая полярность подключения: анод подключают к гнезду со знаком «+», а катод - к гнезду со знаком «-».
ВНИМАНИЕ! Анодом называют электрод, на котором происходит электроокисление, а катодом - электрод, на котором происходит электровосстановление вещества.
4.2. Подготавливают к работе прибор УИП-1. Заземляют прибор с помощью клеммы.
Переключатель вольтметра устанавливают в крайнее правое положение.
Переключатель поддиапазонов напряжения устанавливают в положение «20-150 В».
Ручку потенциометра плавной регулировки напряжения устанавливают в крайнее левое положение.
Тумблер «анод» переключают в нижнее положение («Выключено»).
Подсоединяют прибор к сети с помощью кабеля питания, штепсель которого вставляют в гнездо питания.
Включают прибор, переводя тумблер в верхнее положение, при этом загорается индикаторная лампочка.
Дают прибору прогреться 20 мин.
4.3. Полученный от преподавателя в мерной колбе анлизируемый раствор разбавляют дистиллированной водой до метки, содержимое колбы перемешивают. Бюретку ополаскивают небольшим количеством полученного раствора 2-3 раза, после чего ее заполняют этим раствором и укрепляют в штативе так, чтобы конец носика бюретки был опущен в генерационный сосуд примерно на 0,5-1 см ниже края сосуда.
4.4. Проводят сначала ориентировочное титрование (с целью приблизительной оценки времени электролиза и установления постоянного, строго определенного значения тока электролиза при последующем точном титровании).
По истечении 20 мин после включения прибора УИП-1 в сеть устанавливают ручку переключателя диапазонов напряжения в положение «150-300 В» (или «300-400 В»).
Включают высокое напряжение, переводя тумблер «Анод» в верхнее положение.
Из-под генерационного сосуда (стакана) убирают магнитную мешалку и выливают из него дистиллированную воду. В стакан опускают магнитный стержень, промытый дистиллированной водой, наливают необходимые растворы и устанавливают стакан в прежнее положение. Затем в стакан из бюретки вводят аликвотную долю анализируемого раствора. Если при этом окажется, что рабочая (активная) часть генераторного электрода погружена в раствор не полностью, добавляют дистиллированную воду.
Включают магнитную мешалку. Перемешивание раствора не прекращают на протяжении всего процесса титрования.
Подготавливают к работе секундомер и держат его наготове в левой руке.
Через 1-2 мин перемешивания раствора одновременно (!) правой рукой замыкают тумблером (5) (см. рис. 3-13) генерационную цепь, а левой рукой включают секундомер.
Вращением ручки плавной регулировки напряжения устанавливают строго определенное значение тока, которое фиксируют по миллиамперметру (3) (см. рис. 3-13), включенному в генерационную цепь. Во время электролиза следят, чтобы значение тока было постоянным, и при необходимости корректируют его потенциометром.
Конец титрования устанавливают по резкому изменению окраски индикатора. Для облегчения наблюдения за изменением окраски под генерационный сосуд заблаговременно подкладывают лист белой бумаги. В момент достижения КТТ одновременно (!) размыкают генерационную цепь и останавливают секундомер.
По показаниям секундомера определяют ориентировочное время проведения электролиза.
Если окажется, что на электролиз идет меньше 100 с, при проведении точного титрования увеличивают аликвотную долю анализируемого раствора. Расчет искомой аликвотной доли проводят на основании линейной зависимости между количеством вещества и временем электролиза при постоянном значении тока в соответствии с законом Фарадея.
4.5. Прежде чем приступить к точному титрованию, при установленном ранее строго определенном значении тока проводят предэлектролиз фонового раствора. Это делают для электроокисления (или электровосстановления) примесей, содержащихся в фоновом растворе.
Для приготовления фонового раствора в чистый генерационный сосуд помещают все необходимые растворы, кроме анализируемого. Смесь перемешивают 1-2 мин и, не прекращая перемешивания, замыкают генерационную цепь. По миллиамперметру (4) (см. рис. 3-13) фиксируют значение тока. Если значение тока отличается от ранее установленного, его корректируют с помощью потенциометра.
Момент окончания предэлектролиза определяют по резкому изменению окраски индикатора. В этот момент генерационную цепь размыкают.
4.6. Приступают к точному титрованию. К фоновому раствору, в котором проведен предэлектролиз, прибавляют из бюретки рассчитанный
(с учетом результата ориентировочного титрования) объем анализируемого раствора. Смесь перемешивают 1-2 мин и, не прекращая перемешивания, снова замыкают генерационную цепь и одновременно (!) включают секундомер. По миллиамперметру (4) (см. рис. 3-13) фиксируют значение тока, которое должно быть точно равно ранее установленному. В процессе проведения электролиза не забывают следить за постоянством значения тока.
Электролиз заканчивают в момент резкого изменения окраски индикатора; при этом интенсивность окраски раствора должна быть такой же, как и в момент окончания предэлектролиза. По достижении КТТ одновременно (!) размыкают генерационную цепь и останавливают секундомер.
Время электролиза измеряют с точностью до ±0,2 с.
Точное титрование повторяют не менее 5 раз, по возможности с различными порциями анализируемого раствора, причем очередную порцию раствора прибавляют в тот же стакан, не удаляя смесь, оставшуюся от предыдущего титрования.
4.7. В случае необходимости для учета количества электричества, которое расходуется на электроокисление (или электровосстановление) примесей, содержащихся непосредственно в анализируемом растворе, проводят холостое титрование.
Для этого сначала готовят фоновый раствор и проводят его предэлектролиз, как описано выше (см. 4.5). Затем, не выливая фоновый раствор из генерационного сосуда, вместо аликвотной доли анализируемого раствора добавляют из бюретки точно такой же объем заранее приготовленного раствора, который должен содержать, за исключением определяемого вещества, те же компоненты и в тех же количествах, что и анализируемый раствор.
В самом простом случае, когда анализируется водный раствор вещества, вместо него к фоновому раствору приливают из бюретки соответствующий объем дистиллированной воды.
Холостое титрование выполняют в тех же условиях, что и точное титрование (см. 4.6), и повторяют столько раз, сколько раз проводилось точное титрование; при этом смесь, оставшуюся от предыдущего холостого титрования, из генерационного сосуда не удаляют.
При расчете результата анализа время, затраченное на холостое титрование, вычитают из времени, затраченного на точное титрование соответствующей порции анализируемого раствора.
4.8. Результаты титрования записывают в лабораторный журнал по форме, приведенной в табл. 3-13. Предварительно в журнале кратко
излагают сущность определения и записывают уравнения реакций, протекающих на электродах и в растворе.
4.9. По окончании титрования выключают прибор УИП-1, для чего ручку потенциометра вращают против часовой стрелки до упора, переключатель устанавливают в положение «20-150 В», тумблер «Анод», а затем тумблер сетевого напряжения переводят в нижнее положение и вынимают вилку кабеля питания прибора из сети.
Генерационный платиновый электрод и магнитный стержень ополаскивают дистиллированной водой из промывалки и сдают лаборанту. Конец соединительного мостика, который находился в титруемом растворе, промывают дистиллированной водой и погружают в стакан с дистиллированной водой. Вспомогательный электрод и стакан с раствором инертного электролита оставляют закрепленными в штативе.
Таблица 3-13. Форма записи результатов кулонометрического титрования
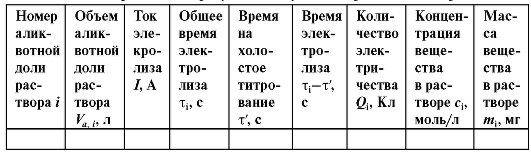
4.10. Вычисляют (см. 4.8, табл. 3-13) количество электричества, затраченное на титрование i-й аликвотной доли анализируемого раствора,
молярную концентрацию эквивалента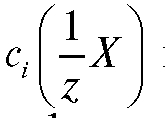 и массу определяемого
и массу определяемого
вещества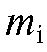 в анализируемом растворе по формулам:
в анализируемом растворе по формулам:
Принятые обозначения: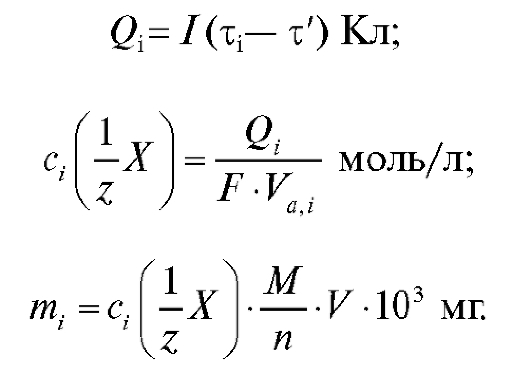
 - ток электролиза, А;
- ток электролиза, А; - время электролиза при титровании i-й аликвотной доли анализируемого раствора, с;
- время электролиза при титровании i-й аликвотной доли анализируемого раствора, с;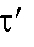 - время электролиза при соответствующем холостом титровании, с;
- время электролиза при соответствующем холостом титровании, с;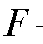 - число Фарадея, равное 96485 Кл/моль;
- число Фарадея, равное 96485 Кл/моль;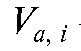 - объ-
- объ-
ем i-й аликвотной доли анализируемого раствора, л; M - молярная масса определяемого вещества, г/моль; n - число электронов в электрохимической реакции, отдаваемых (или принимаемых) одной частицей (молекулой, атомом, ионом) определяемого вещества; V - общий объем анализируемого раствора, л.
4.11. Полученные результаты обрабатывают методом математической статистики. Обработке подлежат результаты параллельных определений либо концентрации, либо массы вещества в анализируемом растворе.
Лабораторная работа «Определение массы натрия тиосульфата в растворе методом кулонометрического титрования»
Цель работы
Научиться практически применять метод кулонометрического титрования с визуальной индикацией КТТ для определения миллиграммовых количеств натрия тиосульфата в растворе.
Целевые задачи
1. Ориентировочное титрование тиосульфат-иона электрогенерированным на платиновом аноде йодом с индикацией КТТ с помощью крахмала.
2. Предэлектролиз фонового раствора с последующим точным титрованием тиосульфат-иона в тех же условиях.
3. Расчет массы натрия тиосульфата в растворе.
4. Статистическая обработка результатов параллельных определений массы натрия тиосульфата в растворе.
Материальное обеспечение
Реактивы (квалификации «ч.д.а.» или «х.ч.»)
1. Калия йодид, 0,2 моль/л раствор.
2. Крахмал, 1% раствор свежеприготовленный.
3. Натрия сульфат, 10% раствор. Лабораторная посуда
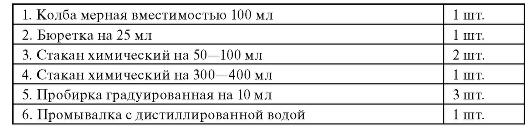
Приборы
1. Кулонометрическая установка с универсальным источником питания - прибором УИП-1 или аналогичным.
2. Электрод генераторный платиновый.
3. Электрод вспомогательный платиновый или вольфрамовый.
4. Мешалка магнитная.
5. Секундомер.
Прочие материалы: полоски фильтровальной бумаги 3x5 см. Инструкция по технике безопасности при работе с электроприборами.
Сущность лабораторной работы
Для определения массы тиосульфата натрия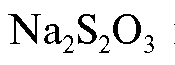 в анализиру-
в анализиру-
емом растворе аликвотную часть этого раствора вносят в генерационный сосуд (стакан) для титрования, в котором имеется фоновый раствор, содержащий вспомогательный реагент - иодид калия KI в большом ~1000-кратном избытке, индикатор - крахмал и в который помещен платиновый генераторный электрод (анод). Получают испытуемый раствор в генерационном сосуде.
Вспомогательный электрод - платиновый катод - погружают в другой (вспомогательный) сосуд с индифферентным сильным электролитом. Оба сосуда соединяют электролитическим мостиком, заполненным раствором сильного электролита. Генераторный анод и вспомогательный катод подключают в электрическую цепь установки для кулонометрического титрования в амперостатическом (гальваностатическом) режиме - ток электролиза постоянный (3-10 мА).
При электролизе иодид-ионы вспомогательного реагента разряжаются на платиновом аноде: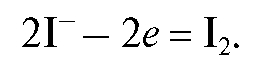
При этом генерируется титрант - йод, вступающий в реакцию с тиосульфат-ионами, присутствующими в растворе:
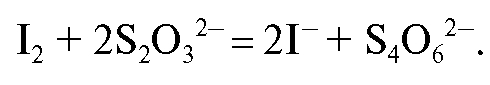
На вспомогательном платиновом катоде протекает электродная реакция: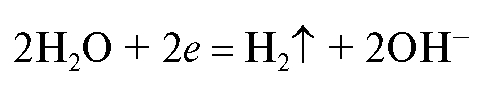
с образованием газообразного водорода.
После того как все тиосульфат-ионы прореагируют с генерированным иодом, первая же порция избыточного иода, образование которого продолжается на генераторном аноде, взаимодействует с крахмалом,
вследствие чего раствор окрашивается в синий цвет. При появлении синей окраски раствора титрование прекращают - электрическую цепь размыкают.
Зная время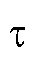 (в секундах), затраченное на титрование, и величину постоянного тока
(в секундах), затраченное на титрование, и величину постоянного тока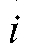 (в амперах), рассчитывают количество электричества
(в амперах), рассчитывают количество электричества 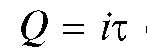 (в кулонах) и массу m тиосульфата натрия (в граммах), соответствующую взятой аликвоте анализируемого раствора, по формулам (2) и (1), учитывая, что число электронов, приходящихся в окислительновосстановительной реакции на один тиосульфат-ион, равно: n = 1. Пример расчета
(в кулонах) и массу m тиосульфата натрия (в граммах), соответствующую взятой аликвоте анализируемого раствора, по формулам (2) и (1), учитывая, что число электронов, приходящихся в окислительновосстановительной реакции на один тиосульфат-ион, равно: n = 1. Пример расчета
Пусть ток 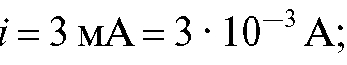 время, затраченное на титрование алик-
время, затраченное на титрование алик-
воты 2 мл анализируемого раствора, равно 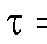 = 120 с; время, затраченное на холостое титрование, равно:
= 120 с; время, затраченное на холостое титрование, равно: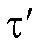 = 10 с; общий объем анализируемого раствора: V = 100 мл. Требуется рассчитать массу m тиосульфата натрия в анализируемом растворе.
= 10 с; общий объем анализируемого раствора: V = 100 мл. Требуется рассчитать массу m тиосульфата натрия в анализируемом растворе.
Решение. Рассчитаем по формуле (2) количество электричества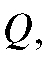 затраченное на электролиз тиосульфат-ионов:
затраченное на электролиз тиосульфат-ионов:
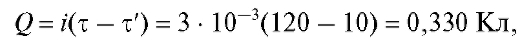
где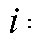 = 3 мА = 3 • 10-3 А,
= 3 мА = 3 • 10-3 А,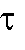 = 120 с,
= 120 с,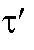 = 10 с.
= 10 с.
Вычислим массу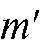 тиосульфата натрия, соответствующую 2 мл прибавленного анализируемого раствора, по формуле (1):
тиосульфата натрия, соответствующую 2 мл прибавленного анализируемого раствора, по формуле (1):
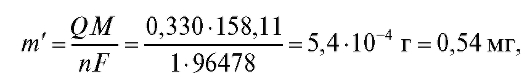
где M = 158,11 г/моль - молярная масса тиосульфата натрия.
Найдем массу m тиосульфата натрия в исходном анализируемом растворе объемом 100 мл. Поскольку в 2 мл анализируемого раствора содержится 0,54 мг тиосульфата натрия, 100 мл анализируемого раствора содержат:
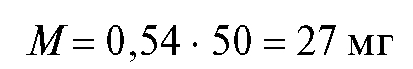
тиосульфата натрия.
Для электровосстановления или электроокисления возможных примесей в растворе йодида калия с крахмалом предварительно проводят предэлектролиз этого раствора, к которому затем, после окончания предэлектролиза, прибавляют анализируемый раствор и проводят кулонометрическое титрование полученного таким путем испытуемого раствора.
При необходимости проводят также холостое титрование для того, чтобы учесть расход электричества на электровосстановление (или электроокисление) возможных примесей, содержащихся в аликвоте прибавляемого анализируемого раствора.
Для холостого титрования готовят фоновый раствор иодида калия с крахмалом, проводят его предэлектролиз, после чего к нему прибавляют точно такой же объем холостого раствора, который соответствует аликвоте анализируемого раствора тиосульфата натрия, содержит все те же компоненты и в тех же количествах, что и анализируемый раствор, но не содержит тиосульфат натрия. Затем включают магнитную мешалку, одновременно с включением секундомера замыкают электрическую цепь установки и ведут электролиз до появления синей окраски раствора, одновременно останавливая секундомер и размыкая электрическую цепь установки.
Время, затраченное на холостое титрование, вычитают в дальнейшем из общего времени, в течение которого проводили электролиз испытуемого раствора.
Вначале, как указывалось выше, проводят ориентировочное титрование испытуемого раствора в целях оценки времени, требуемого на его титрование, после чего проводят точное титрование, повторяя его не менее 5 раз и прибавляя очередную аликвоту анализируемого раствора в тот же генерационный сосуд, не удаляя раствор, оставшийся от предыдущего титрования. Объем аликвоты прибавляемого анализируемого раствора может быть различным.
Порядок выполнения работы
1. Читают инструкцию по технике безопасности при работе с электроприборами.
2. Знакомятся с описанием установки для кулонометрического титрования.
3. Подготавливают установку к работе. При подключении ячейки к прибору УИП-1 обращают внимание на то, что при титровании тиосульфат-иона электрогенерированным йодом платиновый генераторный электрод является анодом.
4. Получают от преподавателя в мерной колбе на 100 мл анализируемый раствор натрия тиосульфата, разбавляют его водой до метки, перемешивают и полученным раствором заполняют бюретку (см. 4.3).
5. Проводят ориентировочное титрование тиосульфат-иона в анализируемом растворе (см. 4.4). В стакан для титрования (генерационный сосуд) помещают 10 мл 0,2 моль/л раствора калия
йодида и 1 мл 1% раствора крахмала, после чего приливают из бюретки 2 мл анализируемого раствора натрия тиосульфата и добавляют столько воды, сколько необходимо для того, чтобы рабочая часть генераторного электрода была полностью погружена в раствор. Титрование проводят при постоянном значении тока 3 мА до появления синей окраски раствора.
6. При установленном постоянном значении тока (3 мА) проводят предэлектролиз фонового раствора (см. 4.5). Для приготовления последнего в чистый генерационный сосуд помещают 10 мл 0,2 моль/л раствора калия йодида, 1 мл 1% раствора крахмала и столько воды, сколько необходимо для покрытия рабочей части генераторного электрода.
7. Проводят точное титрование тиосульфат-иона в анализируемом растворе (см. 4.6).
8. Результаты титрования записывают в лабораторный журнал (см. 4.8), выключают установку (см. 4.9) и выполняют необходимые расчеты (см. 4.10).
9. Проводят статистическую обработку результатов параллельных определений массы натрия тиосульфата в растворе (см. 4.11).
Контрольные вопросы
1. В чем состоит принцип определения натрия тиосульфата методом кулонометрического титрования?
2. Назовите вспомогательный реагент, используемый при кулонометрическом титровании тиосульфат-иона.
3. Каким образом из вспомогательного реагента образуется титрант при кулонометрическом титровании тиосульфат-иона?
4. Почему при кулонометрическом титровании тиосульфат-иона калия йодид добавляют в большом избытке?
5. Какие электрохимические реакции протекают на генераторном и вспомогательном электродах при кулонометрическом титровании тиосульфат-иона?
6. Какая химическая реакция протекает в растворе при кулонометрическом титровании тиосульфат-иона?
7. Какие способы индикации момента окончания химической реакции применяются при кулонометрическом титровании тиосульфат-иона?
8. Какой электролит служит в качестве фона для повышения электрической проводимости раствора при кулонометрическом титровании тиосульфат-иона?
9. С какой целью проводится предэлектролиз фонового раствора при кулонометрическом титровании тиосульфат-иона?
10. Каким образом рассчитывают количество электричества и массу натрия тиосульфата по результатам кулонометрического титрования?
11. Перечислите возможные источники погрешностей при определении натрия тиосульфата методом кулонометрического титрования.
12. Какие преимущества при определении натрия тиосульфата имеет метод кулонометрического титрования по сравнению с классическим методом йодиметрического титрования?
13. Назовите основные части установки для кулонометрического титрования с визуальной индикацией КТТ.
14. Перечислите основные правила техники безопасности при работе с установкой для кулонометрического титрования.
Лабораторная работа «Стандартизация раствора хлороводородной кислоты методом кулонометрического титрования»
Цель работы
Научиться практически применять метод кулонометрического титрования с визуальной индикацией КТТ для стандартизации разбавленных (~10-3 моль/л) растворов хлороводородной кислоты.
Целевые задачи
1. Ориентировочное титрование хлороводородной кислоты электрогенерированным на платиновом катоде гидроксид-ионом с индикацией КТТ с помощью фенолфталеина.
2. Предэлектролиз фонового раствора с последующим точным титрованием хлороводородной кислоты в тех же условиях.
3. Предэлектролиз фонового раствора с последующим холостым титрованием в тех же условиях.
4. Расчет молярной концентрации эквивалента хлороводородной кислоты в растворе.
5. Статистическая обработка результатов параллельных определений молярной концентрации эквивалента хлороводородной кислоты в растворе.
Материальное обеспечение
Реактивы (квалификации «ч.д.а.» или «х.ч.»)
1. Фенолфталеин, 1% раствор.
2. Натрия сульфат, 10% раствор.
Прочие материалы - см. предыдущую лабораторную работу.
Сущность работы
Стандартизация разбавленного ~10-3 моль/л раствора хлороводородной кислоты методом кулонометрического титрования основана на титровании иона гидроксония электролитически генерированным гидроксид-ионом. В качестве вспомогательного реагента служит растворитель - вода. Электролиз проводят при постоянном, строго определенном значении тока (от 3 до 10 мА).
На платиновом генераторном катоде параллельно протекают два процесса: электрогенерация титранта и электровосстановление иона гидроксония до молекулярного водорода:
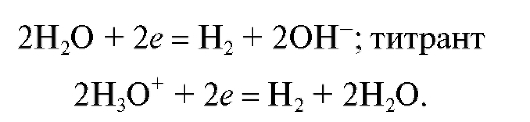
Образующийся на катоде гидроксид-ион реагирует в растворе с ионом гидроксония:
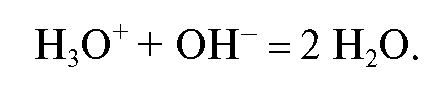
Момент окончания реакции устанавливают визуально по изменению окраски фенолфталеина.
В качестве фона для повышения электрической проводимости раствора используют инертный сильный электролит - раствор калия сульфата.
Для того чтобы устранить ошибки, связанные с присутствием в фоновом растворе примесей кислотного характера (главным образом растворенного диоксида углерода), проводят предварительный электролиз фонового раствора.
Происходящую на катоде электрохимическую реакцию можно выразить следующим уравнением:
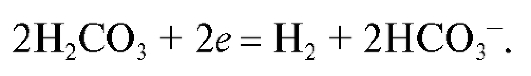
В то же время, чтобы устранить ошибки, связанные с присутствием растворенного диоксида углерода непосредственно в анализируемом растворе, проводят холостое титрование. При этом к фоновому раствору, в котором предварительно был проведен электролиз, вместо аликвотной
доли анализируемого раствора кислоты прибавляют точно такой же объем воды.
При расчете результата анализа время, затраченное на холостое титрование, вычитают из времени, затраченного на титрование анализируемого раствора.
В процессе электролиза на вспомогательном электроде - аноде образуется ион гидроксония: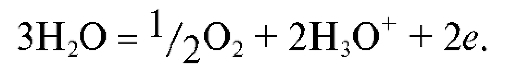
Продукт анодной реакции мешает протеканию кислотно-основной реакции в титруемом растворе хлороводородной кислоты. В связи с этим при выполнении определения вспомогательный электрод должен быть обязательно изолирован от генераторного электрода.
Примечания
1. При титровании иона гидроксония электрогенерированным гидроксидионом визуальную индикацию КТТ можно заменить индикацией с применением метода потенциометрического титрования.
2. Аналогично стандартизации разбавленных растворов хлороводородной кислоты методом кулонометрического титрования можно проводить определение небольшого количества хлорной, а также уксусной, хлоруксусной, бензойной и других кислот, константа ионизации которых составляет: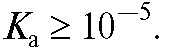
Порядок выполнения работы
1. Знакомятся с инструкцией по технике безопасности при работе с электроприборами.
2. Знакомятся с описанием установки для кулонометрического титрования.
3. Подготавливают установку к работе. При подключении ячейки к прибору УИП-1 обращают внимание на то, что при титровании иона гидроксония электрогенерированным гидроксидионом платиновый генераторный электрод является катодом.
4. Получают от преподавателя в мерной колбе на 100 мл анализируемый раствор хлороводородной кислоты, разбавляют его водой до метки, перемешивают и полученным раствором заполняют бюретку.
5. Проводят ориентировочное титрование иона гидроксония в анализируемом растворе. В стакан для титрования (генерационный сосуд) помещают 10 мл 10% раствора калия сульфата и 7 капель 1% раствора фенолфталеина, после чего приливают из бюретки 2 мл анализируемого раствора хлороводородной кислоты и добавляют столько воды, сколько необходимо для того, чтобы
рабочая часть генераторного электрода была полностью погружена в раствор. Титрование проводят при постоянном значении тока 5 мА до появления светло-розовой окраски раствора.
6. При установленном постоянном значении тока (5 мА) проводят предэлектролиз фонового раствора. Для приготовления последнего в чистый генерационный сосуд помещают 10 мл 10% раствора калия сульфата, 7 капель 1% раствора фенолфталеина и столько воды, сколько необходимо для покрытия рабочей части генераторного электрода.
7. Проводят точное титрование иона гидроксония в анализируемом растворе.
8. Проводят холостое титрование, причем вместо аликвотных долей анализируемого раствора кислоты из бюретки последовательно прибавляют точно такие же объемы воды.
9. Результаты точного и холостого титрования записывают в лабораторный журнал и выполняют необходимые расчеты.
10. Проводят статистическую обработку результатов параллельных определений молярной концентрации эквивалента хлороводородной кислоты в растворе.
Контрольные вопросы
1. В чем состоит принцип определения хлороводородной кислоты методом кулонометрического титрования?
2. Назовите вспомогательный реагент, используемый при кулонометрическом титровании хлороводородной кислоты.
3. Каким образом из вспомогательного реагента образуется титрант при кулонометрическом титровании хлороводородной кислоты?
4. Каким образом обеспечивается 100% выход по току при кулонометрическом титровании хлороводородной кислоты?
5. Какие электрохимические реакции протекают на генераторном и вспомогательном электродах при кулонометрическом титровании хлороводородной кислоты? К каким полюсам источника постоянного тока подключают эти электроды?
6. Почему при кулонометрическом титровании хлороводородной кислоты генераторный и вспомогательный электроды необходимо изолировать друг от друга?
7. Какая химическая реакция протекает в растворе при кулонометрическом титровании хлороводородной кислоты?
8. Какие способы индикации момента окончания химической реакции применяются при кулонометрическом титровании хлороводородной кислоты?
9. Каким образом повышается электрическая проводимость раствора при кулонометрическом титровании хлороводородной кислоты?
10. С какой целью проводится предэлектролиз фонового раствора при кулонометрическом титровании хлороводородной кислоты?
11. С какой целью проводится холостое титрование при кулонометрическом титровании хлороводородной кислоты?
12. Каким образом рассчитывают количество электричества и молярную концентрацию эквивалента хлороводородной кислоты при стандартизации последней методом кулонометрического титрования? Каким образом учитывается поправка на холостое титрование?
13. Перечислите возможные источники погрешностей при стандартизации разбавленных растворов хлороводородной кислоты методом кулонометрического титрования.
14. Какие кислоты, кроме хлороводородной, можно определять методом кулонометрического титрования?
15. Какие преимущества при определении кислот имеет метод кулонометрического титрования по сравнению с классическим методом кислотно-основного титрования?
16. Назовите основные части установки для кулонометрического титрования с визуальной индикацией КТТ.
17. Перечислите основные правила техники безопасности при работе с установкой для кулонометрического титрования.
Содержание письменной контрольной работы по разделу 3 «Физико-химические методы анализа»
Общая характеристика физических и физико-химических методов анализа.
1. Оптические методы анализа
1.1. Молекулярный спектральный анализ. Сущность метода. Цвет и спектр. Закон Бугера-Ламберта-Беера. Оптическая плотность и светопропускание раствора, связь между ними. Коэффициент поглощения света. Молярный и удельный коэффициенты погашения света, связь между ними. Аддитивность оптической плотности. Принципиальная схема получения спектра поглощения.
Фотометрический анализ (фотоколориметрия, спектрофотометрия).
Сущность методов, достоинства и недостатки. Условия количественного фотометрического анализа (выбор фотометрической реакции, аналитической длины волны, концентрации раствора и толщины поглощающего слоя, использование раствора сравнения). Определение концентрации веществ в анализируемом растворе: метод градуировочного графика, метод одного стандарта, с использованием молярного коэффициента погашения, метод добавок стандарта.
Дифференциальный фотометрический анализ. Сущность метода. Способы определения концентраций веществ в растворе.
Погрешности фотометрического анализа, их природа, устранение.
Экстракционно-фотометрический анализ. Сущность метода, условия проведения анализа. Фотометрические реакции в экстракционнофотометрическом методе. Применение метода.
Фотометрическое титрование. Сущность метода. Применение метода.
1.2. Люминесцентный анализ. Сущность метода. Классификация различных методов люминесценции.
Флуоресцентный анализ. Природа флуоресценции. Основные характеристики и закономерности люминесценции: спектр флуоресценции, закон Стокса-Ломмеля, правило Левшина, квантовый выход флуоресценции, закон С.И. Вавилова.
Количественный флуоресцентный анализ: принципы анализа, условия проведения анализа, люминесцентные реакции. Способы определения концентрации веществ (методом градуировочного графика, методом одного стандарта). Применение флуоресцентного анализа.
Экстракционно-флуоресцентный анализ.
2. Хроматографические методы анализа
2.1. Ионообменная хроматография. Сущность метода. Иониты, характеристика и состав. Ионообменные равновесия на катионитах и анионитах. Методы ионообменной хроматографии. Применение ионообменной хроматографии.
2.2. Газожидкостная хроматография. Сущность метода. Понятие о теории метода. Параметры удерживания. Параметры разделения (степень разделения, коэффициент разделения, количество теоретических тарелок). Практика метода. Методы количественного анализа состава анализируемых смесей: абсолютной калибровки, внутренней нормализации, внутреннего стандарта.
2.3. Высокоэффективная жидкостная хроматография. Сущность метода. Применение метода в фармации.
3. Электрохимические методы анализа
Потенциометрия, кондуктометрия, полярография, амперометрия, кулонометрия. Сущность методов. Применение. Валидация фармакопейных методов анализа.
Пример билета письменной контрольной работы по разделу 3 «Физико-химические методы анализа»
Вопросы
1. Количественный флуоресцентный анализ. Способы определения концентрации вещества. Условия выполнения анализа. Аппаратура для флуоресцентного анализа.
2. Амперометрическое титрование. Сущность метода. Кривые титрования. Применение амперометрического титрования.
3. Сущность метода ГЖХ. Понятие о теории метода (параметры удерживания и разделения, эффективность колонки).
Задачи
1. Рассчитайте предел обнаружения (в мкг) меди(II) для реакции с аммиаком, если определение меди(II) с помощью данной реакции проводят фотометрическим методом при длине волны 620 нм, толщине поглощающего слоя 5,00 см и минимальном объеме окрашенного раствора 2,5 мл. Молярный коэффициент погашения комплекса меди(II) с аммиаком при 620 нм равен: 1,2 • 102 . Минимальное значение оптической плот-
. Минимальное значение оптической плот-
ности, измеряемое прибором, равно 0,005.
2. Вычислите количество теоретических тарелок и высоту, эквивалентную теоретической тарелке, для колонки длиной 1 м по следующим данным газохроматографического разделения смеси ацетона с бензолом

3. Кулонометрическое титрование калия перманганата проводили электрогенерированным ионом железа(II) при постоянном токе, равном 50,0 мА, в присутствии индикатора ферроина. Окраска индикатора изменилась через 386 с. Рассчитайте молярную концентрацию калия перманганата в анализируемом растворе, если для титрования взято 4,00 мл этого раствора.