Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ВВЕДЕНИЕ
1. Определение гравиметрического анализа
Гравиметрический (весовой) анализ - метод количественного химического анализа, основанный на определении массы искомого компонента анализируемого образца путем измерения (точного взвешивания) массы устойчивого конечного вещества известного состава, в которое полностью переведен данный определяемый компонент. По найденной массе вычисляют содержание определяемого компонента в анализируемом образце.
Подробно теория и практика гравиметрического анализа изложены в учебнике [1] (книга 2, с. 38-67); краткое описание принципов и задачи представлены в учебном пособии [2].
2. Классификация методов гравиметрического анализа
По способу отделения определяемого компонента различают методы осаждения, отгонки, выделения, термографические методы (термографию).
Методы осаждения. Анализируемый образец переводят в раствор, определяемый компонент анализируемого образца осаждают из раствора в виде осадка, прибавляя реагент-осадитель. Осадок отделяют от маточного раствора, промывают, высушивают (при необходимости прокаливают), взвешивают и рассчитывают массу определяемого компонента в анализируемом образце.
Методы отгонки. Определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества (прямой метод), либо массу остатка (косвенный метод).
Методы выделения. Определяемый компонент выделяют (обычно из раствора), например, при электролизе на одном из электродов (электрогравиметрический метод). Электрод с выделенным веществом промывают, высушивают и взвешивают. По увеличению массы электрода с веществом находят массу выделившегося на электроде вещества.
Термогравиметрические методы. Основаны на измерении массы анализируемого вещества при его непрерывном нагревании в заданном температурном интервале (чаще всего от комнатной температуры до заданной). Измерения проводят на специальных приборах - дериватографах, снабженных весами непрерывного взвешивания, электропечью для нагревания анализируемой пробы, термопарами для измерения температуры, эталоном сравнения и самописцем, который непрерывно записывает изменение массы нагреваемого вещества вследствие его термического разложения.
3. Метод осаждения
3.1. Основные этапы гравиметрического определения методом осаждения
К основным этапам гравиметрического анализа в методе осаждения относятся следующие.
1. Расчет массы навески исходной анализируемой пробы и объема раствора (или массы) осадителя.
2. Взвешивание (взятие) навески анализируемого образца (пробы) на аналитических весах.
3. Растворение навески анализируемого образца.
4. Осаждение, т.е. получение осаждаемой формы определяемого компонента в виде осадка.
5. Фильтрование (отделение осадка от маточного раствора).
6. Промывание осадка.
7. Высушивание, озоление (превращение фильтра в золу) и при необходимости прокаливание осадка до постоянной массы, т.е. получение гравиметрической формы; взвешивание гравиметрической формы на аналитических весах.
8. Расчет результатов анализа, их статистическая обработка и представление.
3.1.1. Расчет массы навески анализируемой пробы При расчете оптимальной массы навески анализируемой пробы учитывают возможную массовую долю определяемого компонента в анализируемой пробе и в гравиметрической форме, массу гравиметрической формы, систематическую ошибку взвешивания на аналитических весах (обычно ±0,0002 г), характер получаемого осадка - аморфный, мелкокристаллический, крупнокристаллический.
Часто исходят из того, чтобы относительная ошибка е гравиметрического анализа не превышала ±0,2%: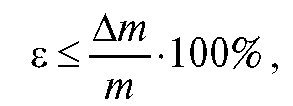
где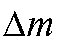 = 0,0002 г (ошибка взвешивания на обычных аналитических весах); m - масса анализируемой пробы в граммах.
= 0,0002 г (ошибка взвешивания на обычных аналитических весах); m - масса анализируемой пробы в граммах.
При этом условии оптимальная масса m навески пробы должна быть обычно не меньше 0,1 г; масса гравиметрической формы также должна быть не меньше 0,1 г.
Рекомендуется задавать оптимальную массу гравиметрической формы следующей:
• для объемных аморфных осадков - около 0,1 г;
• для кристаллических осадков - 0,1-0,5 г (для легких осадков - 0,1-0,2 г, для тяжелых осадков - 0,4-0,5 г).
Обычно масса исходной навески указывается в методике анализа.
Пример. Рассчитать оптимальную массу исходной навески сульфата натрия Na2SO4 для гравиметрического определения сульфат-ионов в виде BaSO4 (гравиметрической формы) с относительной ошибкой определения не выше ±0,2%. Осаждаемая форма - кристаллический осадок.
Решение
Для кристаллического осадка масса гравиметрической формы составляет, как указано выше, 0,1-0,5 г. Если массу гравиметрической формы принять равной m(BaSO4) = 0,5 г, то соответствующая ей масса исходной навески m(Na2SO4) будет равна:
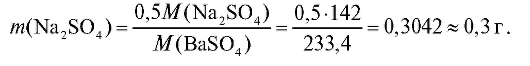
Если же принять m(BaSO4) = 0,1 г, тогда
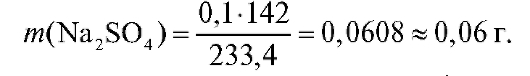
Следовательно, масса исходной навески сульфата натрия должна составлять 0,06-0,3 г. В данном случае предпочтительнее выбрать массу исходной навески около 0,3 г, поскольку при более высокой массе навески относительная ошибка определения ниже, а в условии примера верхний предел выбора массы навески ничем не ограничен.
В общем случае нижний предел оптимальной массы исходной навески анализируемого вещества (в граммах) рассчитывают по формуле:
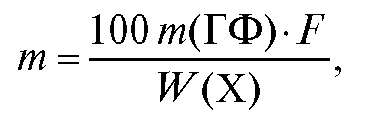
где m (ГФ) - масса гравиметрической формы в граммах; F - гравиметрический фактор (фактор пересчета, аналитический множитель); W(X) - массовая доля (в процентах) определяемого компонента в анализируемом веществе.
Гравиметрический фактор F численно равен массе определяемого компонента в граммах, соответствующей одному грамму гравиметрической формы. Его рассчитывают по формуле как отношение молярной массы М(Х) определяемого компонента Х к молярной массе М(ГФ) гравиметрической формы, умноженное на число n молей определяемого компонента, из которого получается один моль гравиметрической формы: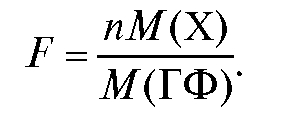
Например, если из двух молей FeCl3 • 6H2O получается один моль гравиметрической формы Fe2O3, то n = 2. Если из одного моля Ba(NO3)2 получают один моль гравиметрической формы BaCrO4, то n = 1.
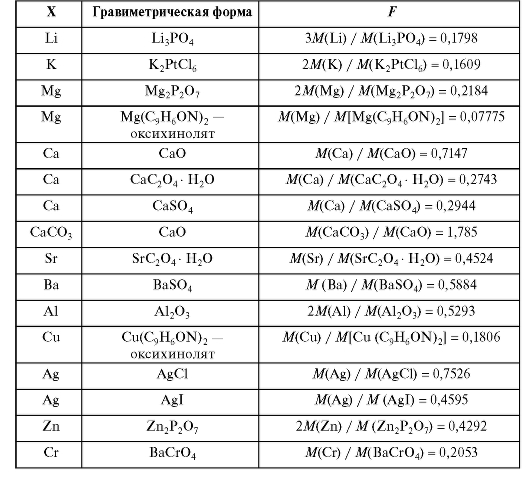
В табл. 1-1 приведены величины гравиметрического фактора для ряда гравиметрических форм.
3.1.2. Расчет объема или массы осадителя
Расчет ведут с учетом предполагаемого содержания определяемого компонента в анализируемой пробе. Для повышения полноты выделения осадка применяют умеренный избыток осадителя по сравнению со стехиометрическим количеством. Большой избыток осадителя брать не рекомендуется во избежание загрязнения осадка избыточным осадителем. Если осадитель летуч - удаляется при нагревании осадка (например, осадитель - раствор HCl), то берут двух-трёхкратный его избыток по сравнению со стехиометрическим количеством. Если осадитель неле-
туч (например, раствор хлорида бария ВаС12), берут меньший его избыток - примерно полуторакратный.
Расчет объема раствора осадителя проводят, исходя из требуемого количества осадителя и его концентрации. Масса осаждаемого вещества, оставшаяся в растворе вследствие некоторой (пусть и незначительной) его растворимости, не должна, как правило, превышать 0,0002 г, т.е. ошибки взвешивания на аналитических весах. В противном случае необходимо вносить поправки на потери определяемого компонента вследствие частичного растворения осадка.
Таблица 1-1. Гравиметрические (аналитические) факторы F для пересчета массы гравиметрической формы m(ГФ) в массу m(X) определяемого компонента X: m(X) = Fxm(ГФ)
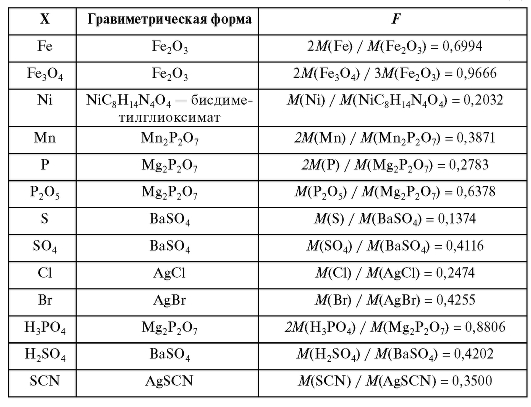 Окончание табл. 1-1
Окончание табл. 1-1
3.1.3. Расчет результатов анализа
Содержание определяемого компонента в анализируемой пробе рассчитывают, зная состав гравиметрической формы. Если известно значение гравиметрического фактора F (см. табл. 1-1), массу определяемого компонента m (X) в анализируемом растворе рассчитывают по формуле:
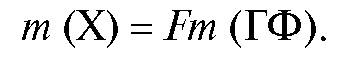
В оптимальном случае рекомендуют проводить не менее пяти параллельных определений с тем, чтобы иметь объем выборки не менее пяти вариант (варианта - результат единичного определения). При таком объеме выборки можно делать статистическую обработку результатов количественного анализа в рамках применения распределения Стьюдента.
Подробно основы и методики статистической обработки результатов количественного анализа изложены в учебнике [1] (книга 2, глава 1, с. 7-37), а также в учебном пособии [2] (с. 8-46).
Задание для самоподготовки к занятию по разделу 1 «Гравиметрический анализ»
К занятию необходимо знать
• Принцип гравиметрических методов анализа.
• Классификация методов.
• Сущность метода осаждения.
• Механизм образования осадков.
• Загрязнение осадков.
• Виды соосаждения.
• Разновидности метода отгонки.
• Сущность способов гравиметрического определения:
а) серной кислоты в растворе;
б) железа в растворимых солях железа(II) и железа(III);
в) кальция(II) в растворе;
г) никеля(II) в растворе;
д) кристаллизационной воды в кристаллогидрате бария хлорида.
• Правильность и воспроизводимость результата гравиметрического анализа. Систематические и случайные погрешности. Параметры, характеризующие воспроизводимость результата анализа.
К занятию необходимо уметь
• Взвешивать на аналитических и технохимических (аптечных) весах.
• Писать уравнения реакций, лежащих в основе способов гравиметрического определения:
а) серной кислоты в растворе;
б) железа в растворимых солях железа(II) и железа(III);
в) кальция(II) в растворе;
г) никеля(II) в растворе.
• Рассчитывать по уравнению реакции массу или объем раствора известной концентрации одного из исходных веществ, необходимых для получения продуктов реакции известной массы.
• Рассчитывать растворимость малорастворимого сильного электролита в условиях его осаждения.
• Обрабатывать результаты многократных измерений методом математической статистики: рассчитывать среднее, дисперсию, стандартное отклонение, относительное стандартное отклонение, доверительный интервал, процентную ошибку среднего. Рассчитывать процентную (относительную) погрешность взвешивания на аналитических весах.
Список литературы
1. Лекции по темам: «Статистическая обработка результатов количественного анализа», «Гравиметрический анализ».
2. Учебник. - Книга 2, глава 1, с. 7-37; глава 2, с. 38-67.
3. Харитонов Ю.Я., Григорьева В.Ю. Примеры и задачи по аналитической химии.- М.: ГЭОТАР-Медиа, 2009.- С. 8-71.
4. Лурье Ю.Ю. Справочник по аналитической химии.- М.: Химия, 1989.
Вопросы для самопроверки по теме «Гравиметрический анализ»
1. Измерение какого характерного параметра лежит в основе гравиметрического анализа?
2. Какие разновидности гравиметрического анализа вы знаете?
3. В чем состоит принцип метода осаждения?
4. Перечислите основные этапы анализа вещества методом осаждения.
5. Дайте определение понятиям: «навеска», «осаждаемая форма», «гравиметрическая форма». Укажите соответствующие формы для гравиметрического определения:
а) серной кислоты в растворе:
б) железа в растворимых солях железа(II) и железа(III);
в) кальция(II) в растворе;
г) никеля(II) в растворе.
6. Напишите формулы для расчета гравиметрического фактора, массы или массовой доли определяемого вещества в образце для соответствующих гравиметрических определений:
а) серной кислоты в растворе;
б) железа в растворимых солях железа(II) и железа(III);
в) кальция(II) в растворе;
г) никеля(II) в растворе.
7. Какие имеются практические рекомендации по расчету оптимальной массы навески при получении в качестве осаждаемой формы:
а) кристаллического осадка;
б) аморфного осадка?
8. Каким образом подбирают осадитель в гравиметрическом анализе?
9. Каким образом рассчитывают объем раствора осадителя известной концентрации, требуемый для практически полного осаждения определяемого вещества?
10. Какие требования предъявляются к осаждаемой форме?
11. Что такое относительное пересыщение (степень пересыщения) раствора? Как эта величина влияет на структуру осадка?
12. Какие условия осаждения приводят к невысокой степени пересыщения раствора и способствуют образованию более крупных частиц кристаллического осадка?
13. Что происходит в процессе «созревания» (рекристаллизации) кристаллического осадка?
14. В каких условиях проводят осаждение аморфных осадков?
15. Какие процессы приводят к загрязнению осадка? Что такое «соосаждение»?
16. Какими соображениями руководствуются при выборе жидкости для промывания:
а) кристаллических осадков;
б) аморфных осадков?
17. Какие фильтры используются в гравиметрическом анализе для отделения осадка от маточного раствора?
18. В каких случаях применяют стеклянные фильтрующие тигли?
19. Как получить из осаждаемой формы гравиметрическую?
20. Перечислите требования, предъявляемые к гравиметрической форме. Почему необходимо, чтобы гравиметрическая форма имела точно известный и постоянный химический состав?
21. Какие нежелательные явления возможны при прокаливании осадков:
а) бария сульфата;
б) железа(III) гидроксида?
22. Каким образом можно определить содержание кристаллизационной воды в кристаллогидрате? Какой метод гравиметрического анализа применяется при этом?
23. Перечислите достоинства и недостатки гравиметрического анализа.
24. Какие типы погрешностей возможны при проведении количественного анализа?
25. Что понимают под правильностью и воспроизводимостью результата анализа? С какими типами погрешностей связаны эти понятия?
26. Назовите источники систематических погрешностей в гравиметрическом анализе. Какая из систематических погрешностей вносит основной вклад в суммарную погрешность анализа?
27. Чему равна погрешность (точность) взвешивания на обычных аналитических весах?
28. От чего зависит процентная (относительная) погрешность взвешивания? Какова должна быть масса вещества, чтобы процентная (относительная) погрешность определения не превышала ±0,1%?
29. Чему равна допустимая систематическая погрешность анализа (в граммах), возникающая при осаждении и последующем промывании осадка вследствие его частичной растворимости?
30. Сколько параллельных определений обычно проводят при выполнении анализа? С чем это связано?
31. С помощью каких статистических критериев можно определить наличие «промаха» (грубой погрешности) в результатах параллельных определений?
32. Какие параметры служат для характеристики воспроизводимости результата анализа?
33. Как правильно представить результат анализа?
34. Как установить на личие или отсутствие систематической погрешности, если известно действительное содержание определяемого компонента и найден доверительный интервал для результата анализа?