Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ТЕМА I. ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
На изучение темы отводятся три занятия, включающие краткое рассмотрение основных теоретических положений, решение задач по теме и экспериментальную часть. По этой теме проводят два занятия по фотометрическим методам и одно занятие по флуоресцентным методам анализа.
Цель изучения темы
На основе знания теоретических основ и законов фотометрических методов научиться обоснованно выбирать и практически применять спектрофотометрические и фотоэлектроколориметрические методы анализа количественного определения веществ.
На основе знания сущности явления и основных законов люминесценции научиться обоснованно выбирать и практически применять методы флуоресцентного анализа для количественного определения веществ в растворе.
Целевые задачи
1. Научиться проводить количественное определение соединений в растворе спектрофотометрическим методом.
2. Научиться проводить количественное определение соединений в растворе при их совместном присутствии фотоэлектроколориметрическим методом.
3. Научиться проводить количественное определение веществ, обладающих или не обладающих собственной флуоресценцией, с применением метода флуоресцентного анализа.
4. Научиться проводить количественное определение веществ с применением экстракционно-флуориметрического анализа.
5. Статистическая обработка результатов анализа, оформление протокола выполненной лабораторной работы.
6. Решение расчетных задач.
Общая характеристика фотометрических методов анализа
Фотометрические методы количественного анализа основаны на зависимости оптических свойств вещества (испускания, поглощения, рас-
сеяния, отражения, преломления, поляризации света), проявляющихся при взаимодействии электромагнитного излучения с веществом, от концентрации этого вещества в анализируемой системе.
В определенном интервале концентраций вещества и при постоянных условиях эксперимента зависимость интенсивности светопоглощения от количества вещества выражается в виде объединенного основного закона светопоглощения (основного закона фотометрии), который в логарифмической форме имеет вид:
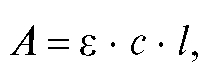
где А - оптическая плотность (экстинкция, погашение - absorbance) - безразмерная величина; е - молярный коэффициент или показатель погашения (коэффициент экстинции - absorptivity),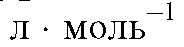 .
.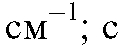 - молярная (обычно) концентрация светопоглощающего вещества в анализируемом растворе, моль/л;
- молярная (обычно) концентрация светопоглощающего вещества в анализируемом растворе, моль/л; 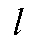 - длина (толщина) светопоглощающего слоя, см.
- длина (толщина) светопоглощающего слоя, см.
Оптическая плотность растворов измеряется при аналитической длине волны 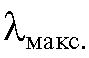 , при которой величина оптической плотности раствора в его спектре поглощения имеет максимальное значение.
, при которой величина оптической плотности раствора в его спектре поглощения имеет максимальное значение.
Если концентрацию анализируемого раствора выразить в г/100 мл раствора и обозначить ее буквой W, основной закон светопоглощения будет иметь вид:
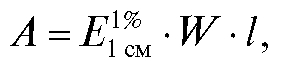
где 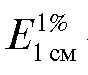 - удельный коэффициент погашения.
- удельный коэффициент погашения.
Иногда удельный коэффициент погашения обозначают буквой Е без индексов.
При проведении фотометрических определений обычно используют спектрофотометрические и фотоэлектроколориметрические методы анализа.
Методы спектрофотометрии основаны на использовании световых потоков, проходящих через анализируемый раствор, с высокой степенью монохроматизации. Методы фотоэлектроколориметрии основаны на использовании немонохроматических световых потоков, сформированных специальными светофильтрами, которые имеют максимальное светопропускание при различных длинах волн.
При выполнении фотометрического анализа растворов сложных смесей, компоненты которых поглощают при одной и той же длине волны (но не взаимодействуют между собой и подчиняются основному закону светопоглощения), используют закон аддитивности оптической плотности: оптическая плотность раствора при определенной длине волны
складывается из оптических плотностей отдельных компонентов смеси, поглощающих при этой длине волны.
При проведении фотометрического анализа концентрацию вещества в анализируемом растворе определяют различными методами.
Метод градуировочного графика (калибровочных кривых). Готовят серию эталонных растворов определяемого вещества с концентрациями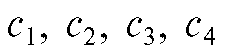 и т.д. Измеряют оптическую плотность А каждого эталонного раствора при аналитической длине волны по отношению к раствору сравнения и по полученным данным строят график в координатах
и т.д. Измеряют оптическую плотность А каждого эталонного раствора при аналитической длине волны по отношению к раствору сравнения и по полученным данным строят график в координатах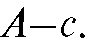 Затем в тех же условиях измеряют оптическую плотность анализируемого раствора и по градуировочному графику определяют концентрацию определяемого вещества
Затем в тех же условиях измеряют оптическую плотность анализируемого раствора и по градуировочному графику определяют концентрацию определяемого вещества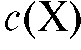 в анализируемом растворе.
в анализируемом растворе.
Метод одного стандарта. Готовят эталонный раствор определяемого вещества с концентрацией с(ст.), близкой к концентрации анализируемого раствора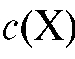 , и измеряют оптическую плотность стандартного раствора А(ст.) при аналитической длине волны по отношению к раствору сравнения. Затем в тех же условиях измеряют оптическую плотность А(Х) анализируемого раствора и рассчитывают его концентрацию с(Х) из соотношения:
, и измеряют оптическую плотность стандартного раствора А(ст.) при аналитической длине волны по отношению к раствору сравнения. Затем в тех же условиях измеряют оптическую плотность А(Х) анализируемого раствора и рассчитывают его концентрацию с(Х) из соотношения: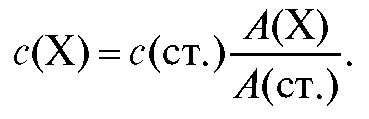
Определение концентрации по молярному или удельному коэффициенту погашения. Значение соответствующего коэффициента погашения при аналитической длине волны должно быть известно или определяется в процессе эксперимента.
Измеряют оптическую плотность А(Х) анализируемого раствора с концентрацией с(Х) при аналитической длине волны в кювете с толщиной поглощающего слоя /. Концентрации вещества в анализируемом растворе рассчитывают по формулам:
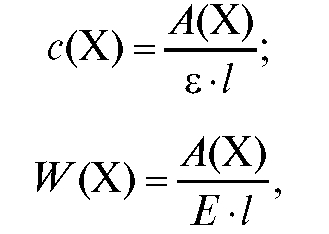
где концентрация с(Х) анализируемого раствора выражена в моль/л, а концентрация W (Х) выражена в г/100 мл раствора.
Фотоэлектроколориметрия применяется при анализе таких лекарственных препаратов, как левомицетин, ментол, новокаин, стрептомицин, рутин и многие другие.
Занятие 1. Спектрофотометрическое
определение никеля(II) реакцией с диметилглиоксимом в присутствии окислителей
Цель занятия
Количественное определение содержания никеля в анализируемом растворе методом спектрофотометрии.
Целевые задачи
1. Приготовление серии эталонных растворов соли никеля.
2. Построение спектра поглощения раствора комплексной соли никеля и выбор аналитической длины волны.
3. Расчет значений молярных коэффициентов погашения для приготовленных растворов соли никеля.
4. Построение градуировочного графика для определения концентрации никеля в растворе.
5. Расчет содержания никеля в растворе по градуировочному графику и с использованием молярного коэффициента погашения.
Задание для самоподготовки
К занятию необходимо знать
1. Сущность фотометрических методов анализа и их возможности.
2. Классификацию фотометрических методов анализа в зависимости от степени монохроматизации используемых световых потоков.
3. Зависимость оптической плотности раствора от различных факторов.
4. Основной закон светопоглощения.
5. Физический смысл величин молярного и удельного коэффициентов погашения растворов и возможности их использования для определения массы веществ в анализируемых растворах.
6. Принципиальную оптическую схему фотометрических приборов.
Уметь
1. Готовить растворы по навеске с точно известной массой и методом разбавления.
2. Строить градуировочные графики и использовать их для определения концентрации веществ.
3. Рассчитывать значения молярных коэффициентов погашения для приготовленных растворов соли никеля и уметь использовать их для определения массы никеля в анализируемых растворах.
Список литературы
1. Лекция «Оптические методы анализа».
2. Учебник. - Книга 2, глава 8, разд. 8.1-8.2. - С. 303-356.
Вопросы для самопроверки
1. Как классифицируются оптические методы анализа по области используемого электромагнитного спектра?
2. Как классифицируются оптические методы анализа по природе энергетических переходов?
3. На каком законе основан количественный фотометрический анализ и каковы условия его применения?
4. Что характеризует средний молярный коэффициент погашения и от каких факторов он зависит?
5. Какие параметры характеризуют индивидуальную полосу поглощения вещества в спектре поглощения?
6. Как выбирают аналитическую длину волны, если спектр поглощения имеет несколько максимумов?
7. Перечислите причины кажущихся отклонений от основного закона светопоглощения.
Лабораторная работа «Спектрофотометрическое
определение никеля(II) реакцией
с диметилглиоксимом в присутствии окислителей»
Сущность работы
Водные растворы солей никеля имеют обычно слабую окраску, обладают малым значением величины молярного коэффициента погашения.
Применение фотометрического метода ввиду его малой чувствительности в данном случае невозможно. Для получения оптимальных результатов предварительно проводят фотометрическую реакцию никеля(II) с диметилглиоксимом в щелочной среде в присутствии окислителя (йода, брома, водорода пероксида и др.). В условиях проведения реакции происходят окисление никеля(II), вероятно, до трехвалентного состояния, образование комплексного соединения с диметилглиоксимом с максимумом поглощения при 470 нм и высоким значением молярного коэффициента погашения комплекса. Определение никеля основано на зависимости оптической плотности растворов полученных комплексов от концентрации соединения никеля в исходных водных растворах. Реактивы
1. Никеля сульфат гептагидрат (ч.д.а.).
2. Раствор йода 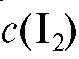 = 0,05 моль/л.
= 0,05 моль/л.
3. Диметилглиоксим, 1% раствор в 20% растворе натрия гидроксида.
4. Раствор натрия гидроксида 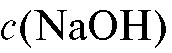 = 1,0 моль/л.
= 1,0 моль/л.
5. Раствор хлороводородной кислоты концентрированный.
6. Кислота серная концентрированная.
Учебная таблица: принципиальная схема спектрофотометра. Лабораторная посуда
1. Колбы мерные на 100 мл.
2. Пипетки градуированные на 10 мл.
3. Бюретки на 25 мл. Приборы
1. Спектрофотометр (например, Spectrumlab SS 1207 или другого типа).
2. Кюветы с толщиной поглощающего слоя 1 см.
3. Весы аналитические.
Методика работы
1. Приготовление 100 мл эталонного раствора, содержащего 0,4000 мг/мл никеля (раствора А)
Навеску никеля сульфата гептагидрата в граммах, необходимую для приготовления заданного раствора, рассчитывают по формуле:
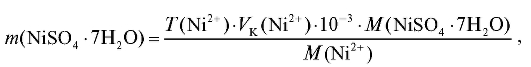
где 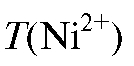 = 0,4000 мг/мл;
= 0,4000 мг/мл;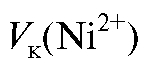 = 100 мл.
= 100 мл.
Взятую на аналитических весах навеску количественно переносят в мерную колбу, растворяют в небольшом объеме дистиллированной воды, добавляют 0,2 мл концентрированной серной кислоты, доводят объем раствора водой до метки и получают раствор А.
2. Приготовление 100 мл эталонного раствора, содержащего 0,0400мг/мл никеля (раствора Б)
В мерную колбу на 100 мл помещают 10 мл раствора А, доводят объем дистиллированной водой до метки и получают раствор Б.
3. Приготовление эталонных растворов никеля(П)
В пять мерных колб на 100 мл вносят 2,0; 4,0; 6,0; 8,0; 10,0 мл эталонного раствора Б. Затем в каждую колбу добавляют по 2-3 капли концентрированной хлороводородной кислоты, 1,0 мл раствора йода, 1,0 мл раствора диметилглиоксима, 5,0 мл раствора натрия гидроксида. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают.
4. Приготовление раствора сравнения
В мерную колбу на 100 мл вносят 5 мл дистиллированной воды, 2-3 капли концентрированной хлороводородной кислоты, 1,0 мл раствора йода, 1,0 мл раствора диметилглиоксима, 5,0 мл раствора натрия гидроксида. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают.
5. Выбор аналитической длины волны
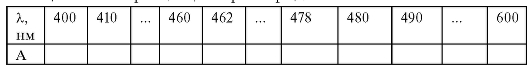
Если используют спектрофотометр без автоматической записи спектра поглощения, записывают оптическую плотность А эталонного раствора № 3 в области длин волн 400-600 нм с интервалом 10 нм. Вблизи максимума поглощения интервал уменьшают до 2 нм. Для этого измеряют оптическую плотность раствора на спектрофотометре в кюветах с толщиной поглощающего слоя 1 см по отношению к раствору сравнения. Полученные данные вносят в табл. 3-1.
Таблица 3-1. Спектр поглощения раствора № 3
По полученным данным на миллиметровой бумаге строят спектр поглощения раствора комплексного соединения никеля с диметилглиоксимом в координатах оптическая плотность раствора А - длина волны Для дальнейшего анализа выбирают аналитическую волну, соответству-
Для дальнейшего анализа выбирают аналитическую волну, соответству-
ющую максимальной оптической плотности в полученном спектре поглощения 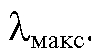
6. Измерение оптических плотностей эталонных растворов
Оптическую плотность эталонных растворов никеля(II) измеряют при выбранной длине волны на спектрофотометре в кюветах с толщиной поглощающего слоя 1 см относительно раствора сравнения. Измерение проводят не менее двух раз и определяют среднее значение оптической плотности A для каждого раствора.
Рассчитывают титр приготовленных эталонных растворов в пересчете на никель (мкг/мл) по правилу разбавления и их молярные концентрации (моль/л) по формуле (2.3) и с учетом единиц измерения используемых величин.
Рассчитанные значения концентраций эталонных растворов и измеренные оптические плотности A этих растворов вносят в табл. 3-2.
Таблица 3-2. Характеристики эталонных растворов никеля(II)
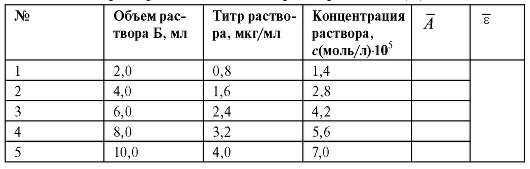
7. Построение градуировочного графика
По данным табл. 3-2 строят градуировочный график, откладывая по оси абсцисс титр раствора (в мкг/мл) в пересчете на никель, а по оси ординат - среднюю оптическую плотность эталонных растворов A. При соблюдении основного закона светопоглощения получают прямую линию, выходящую из начала координат.
8. Расчет молярного коэффициента погашения
Среднее значение молярного коэффициента погашения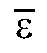 диметилглиоксимата никеля рассчитывают по данным табл. 3-2 по формуле:
диметилглиоксимата никеля рассчитывают по данным табл. 3-2 по формуле:
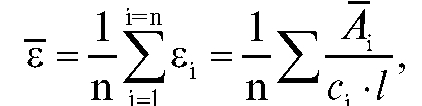
где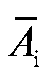 - средняя оптическая плотностьго эталонного раствора
- средняя оптическая плотностьго эталонного раствора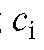 - молярная
- молярная 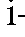 концентрация i-го эталонного раствора, моль/л;
концентрация i-го эталонного раствора, моль/л;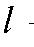 - толщина поглощающего слоя, см; n - количество эталонных растворов.
- толщина поглощающего слоя, см; n - количество эталонных растворов.
Рассчитанное значение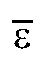 вносят в табл. 3-2.
вносят в табл. 3-2.
9. Определение массы никеля в анализируемом растворе соли никеля(II)
9.1. Приготовление анализируемого раствора соли никеля(II)
К полученной контрольной задаче в мерной колбе на 100 мл добавляют 2-3 капли концентрированной хлороводородной кислоты, 1,0 мл раствора йода, 1,0 мл раствора диметилглиоксима и 5,0 мл раствора натрия гидроксида. Полученный раствор разбавляют дистиллированной водой до метки и тщательно перемешивают. Измеряют оптическую плотность приготовленного раствора 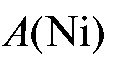 в тех же условиях, что и для
в тех же условиях, что и для
эталонных растворов.
9.2. Определение массы никеля в анализируемом растворе с помощью градуировочного графика
По градуировочному графику находят титр анализируемого раствора 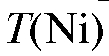 (мкг/мл), соответствующий измеренной оптической плотности раствора, и рассчитывают массу никеля (мг) в анализируемом растворе по формуле:
(мкг/мл), соответствующий измеренной оптической плотности раствора, и рассчитывают массу никеля (мг) в анализируемом растворе по формуле:
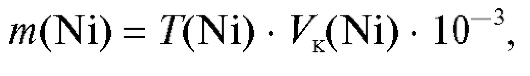
где 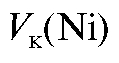 - объем анализируемого раствора, мл.
- объем анализируемого раствора, мл.
9.3. Определение массы никеля в анализируемом растворе по величине среднего молярного коэффициента погашения
Расчет массы никеля в растворе (мг) проводят по формуле (2.1), которая для данного случая имеет вид:
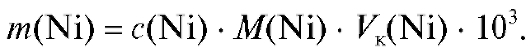
Из основного закона светопоглощения молярная концентрация ионов никеля равна: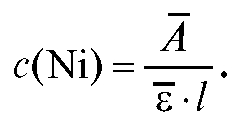
Объединяем два последних выражения и получаем формулу для расчета массы никеля в анализируемом растворе (мг):
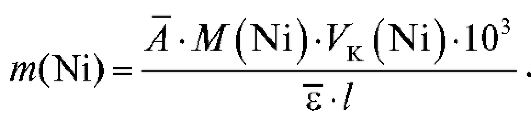
Контрольные вопросы
1. Что такое фотометрическая реакция и в каких случаях она проводится?
2. Можно ли заменить кварцевые кюветы стеклянными при определении никеля с диметилглиоксимом в данной работе?
3. Как используют молярный коэффициент погашения при определении неизвестной концентрации вещества?
4. Чем характеризуется чувствительность фотометрического анализа?
5. Укажите интервал значений оптических плотностей раствора, при которых относительная систематическая ошибка фотометрического анализа минимальна.
6. В каких случаях применяется экстракционно-фотометрический анализ?
7. Приведите пример применения фотометрического титрования для количественного определения анализируемого вещества в растворе.
Занятие 2. Фотоэлектроколориметрическое определение дихромат- и перманганат-ионов в растворе при их совместном присутствии
Цель занятия
Количественное определение содержания дихромат- и перманганатионов в растворе при их совместном присутствии в анализируемом растворе методом фотоэлектроколориметрии.
Целевые задачи
1. Приготовление серии эталонных растворов калия дихромата.
2. Приготовление серии эталонных растворов калия перманганата.
3. Измерение оптической плотности растворов калия дихромата и калия перманганата.
4. Расчет значений молярных коэффициентов погашения растворов калия дихромата и калия перманганата.
5. Построение градуировочных графиков для расчета концентрации определяемых ионов в растворе.
6. Расчет концентрации калия дихромата и калия перманганата в растворе по градуировочному графику и с использованием молярных коэффициентов погашения.
Задание для самоподготовки
К занятию необходимо знать
1. Сущность фотометрических методов анализа и их возможности.
2. Основной закон светопоглощения.
3. Физический смысл величины молярного коэффициента погашения растворов и возможность его использования для определения массы веществ в анализируемых растворах.
4. Закон аддитивности оптической плотности и условия его применения.
5. Принципиальную оптическую схему фотоэлектроколориметра.
Уметь
1. Готовить эталонные растворы веществ методом разбавления.
2. Строить градуировочные графики и использовать их для определения концентрации веществ.
3. Рассчитывать значения молярных коэффициентов погашения приготовленных эталонных растворов и использовать их для определения массы веществ в анализируемых растворах.
Список литературы
1. Лекция «Оптические методы анализа».
2. Учебник. - Книга 2, глава 8, разд. 8.1-8.2. - С. 303-356.
Вопросы для самопроверки
1. Сформулируйте основной закон светопоглощения и условия его применения.
2. Какие параметры характеризуют индивидуальную полосу поглощения вещества в спектре поглощения?
3. Сформулируйте закон аддитивности оптической плотности.
Лабораторная работа
Сущность работы
Определение дихромат- и перманганат-ионов в растворе при их совместном присутствии основано на различии спектров поглощения
определяемых компонентов и использовании закона аддитивности оптической плотности. Этот закон можно применять в данном случае потому, что дихромат- и перманганат-ионы не взаимодействуют между собой и для них выполняется закон Бугера-Ламберта-Беера в используемых в работе пределах концентраций ионов.
При длине волны 528 нм, соответствующей максимуму светопоглощения перманганат-ионов, светопоглощением дихромат-ионов можно пренебречь. При длине волны 350 нм, соответствующей максимуму светопоглощения дихромат-ионов, свет поглощают оба иона; оптическая плотность раствора при этой длине определяется концентрацией обоих компонентов.
Для определения содержания дихромат- и перманганат-ионов измеряют оптическую плотность анализируемого раствора на фотоэлектроколориметре (например, типа КФК-2) с двумя светофильтрами, имеющими максимумы светопропускания при 364 и 540 нм, что примерно соответствует максимумам поглощения дихромат- и перманганатионов.
Оптическая плотность анализируемого раствора при 540 нм определяется практически только присутствием перманганат-ионов, поэтому по измеренному значению оптической плотности раствора при этой длине волны можно рассчитать концентрацию перманганат-ионов в исследуемом растворе. Зная концентрацию перманганат-ионов, можно рассчитать вклад этих ионов в оптическую плотность анализируемого раствора при 364 нм и на основе закона аддитивности оптической плотности можно рассчитать вклад в оптическую плотность раствора дихромат-ионов при этой длине волны и, следовательно, концентрацию дихромат-ионов в растворе.
Расчеты проводят с использованием градуировочного графика и значений средних молярных коэффициентов погашения определяемых ионов. Средние молярные коэффициенты погашения исследуемых компонентов определяют экспериментально, измерив оптические плотности растворов калия дихромата только с одним светофильтром при 364 нм, а растворов калия перманганата - с двумя светофильтрами при
364 и 540 нм.
Реактивы
1. Эталонный раствор калия дихромата с концентрацией 5,00 • 10-4 моль/л.
2. Эталонный раствор калия перманганата с концентрацией 5,00 • 10-4 моль/л.
Лабораторная посуда
1. Колбы мерные на 25 мл.
2. Бюретки на 25 мл.
3. Цилиндр мерный на 10 мл. Приборы
1. Колориметр фотоэлектрический (например, марки КФК-2).
2. Кюветы с толщиной поглощающего слоя 1 см.
Методика работы
1. Приготовление эталонных растворов калия дихромата
В пять мерных колб на 25 мл помещают из бюретки 2,5; 5; 7,5; 10 и 12,5 мл эталонного 5 • 10-4 моль/л раствора калия дихромата; содержимое каждой колбы доводят до метки дистиллированной водой и тщательно перемешивают.
2. Приготовление эталонных растворов калия перманганата
Серию эталонных растворов калия перманганата готовят аналогично путем разбавления эталонного 5 • 10-4 моль/л раствора калия перманганата.
3. Измерение оптической плотности эталонных растворов калия дихромата и калия перманганата
Оптическую плотность эталонных растворов измеряют в кюветах с толщиной поглощающего слоя 1 см, используя в качестве раствора сравнения воду.
Оптическую плотность растворов калия дихромата измеряют с одним светофильтром с максимумом светопропускания при 364 нм.
Оптическую плотность растворов калия перманганата измеряют последовательно с двумя светофильтрами с максимумами светопропускания при 364 и 540 нм.
Рассчитывают молярные концентрации приготовленных эталонных растворов калия перманганата и калия дихромата по правилу разбавления по формуле (2.3).
Рассчитанные значения концентраций эталонных растворов и измеренные оптические плотности этих растворов заносят в табл. 3-3.
4. Расчет средних молярных коэффициентов погашения По данным табл. 3-3 рассчитывают значения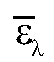 средних молярных коэффициентов погашения перманганат-ионов при 364 и 540 нм, а дихромат-ионов - только при 364 нм по формуле:
средних молярных коэффициентов погашения перманганат-ионов при 364 и 540 нм, а дихромат-ионов - только при 364 нм по формуле:
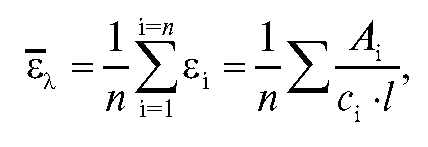
где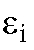 - молярный коэффициент погашения для
- молярный коэффициент погашения для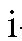 -го эталонного раствора этого иона при длине волны
-го эталонного раствора этого иона при длине волны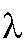 ;
;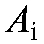 - оптическая плотность i-го эталонного раствора при длине волны
- оптическая плотность i-го эталонного раствора при длине волны ;
;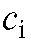 - концентрация i-го эталонного раствора, моль/л; - толщина кюветы, см; n - число эталонных растворов.
- концентрация i-го эталонного раствора, моль/л; - толщина кюветы, см; n - число эталонных растворов.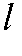
Полученные значения молярных коэффициентов погашения растворов перманганат-ионов и дихромат-ионов при соответствующих длинах волн вносят в таблицу.
Таблица 3-3. Характеристики эталонных растворов калия перманганата и калия дихромата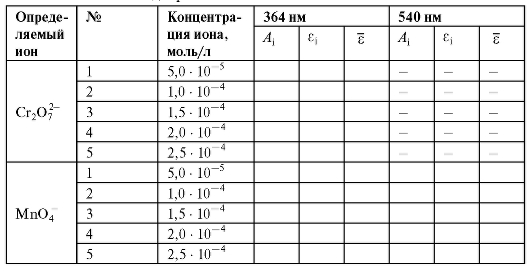
5. Измерение оптической плотности анализируемого раствора, содержащего калия дихромат и калия перманганат
Контрольную задачу, содержащую смесь калия дихромата и калия перманганата, получают в мерной колбе на 25 мл, разбавляют водой до метки. Затем перемешивают и измеряют оптическую плотность приготовленного раствора на фотоэлектроколориметре с двумя светофильтрами 364 и 540 нм в кюветах с толщиной поглощающего слоя 1 см относительно воды. Каждое измерение проводят два раза и записывают средние значения оптических плотностей анализируемых растворов при соответствующих длинах волн.
6. Расчет концентрации дихромат- и перманганат-ионов в анализируемом растворе с использованием молярных коэффициентов погашения
Молярную концентрацию перманганат-ионов в анализируемом растворе рассчитывают на основе основного закона светопоглощения
по известной величине оптической плотности анализируемого раствора при 540 нм по формуле:
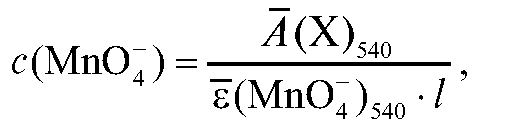
где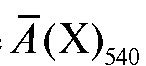 - средняя оптическая плотность анализируемого раствора при
- средняя оптическая плотность анализируемого раствора при
540 нм;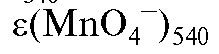 - среднее значение молярного коэффициента погашения
- среднее значение молярного коэффициента погашения
раствора калия перманганата при 540 нм.
Согласно закону аддитивности оптическая плотность 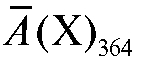 анали-
анали-
зируемого раствора при 364 нм равна:
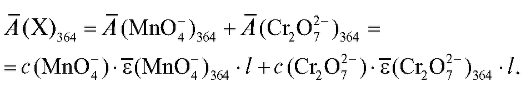
Подставляя в это выражение значение концентрации перманганатионов в анализируемом растворе, получаем:
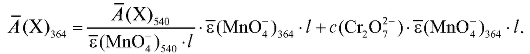
Отсюда концентрация дихромат-ионов в анализируемом растворе равна:
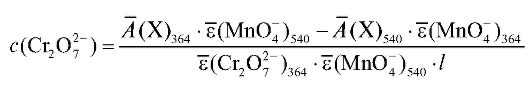
где 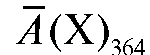 - средняя оптическая плотность анализируемого раствора при
- средняя оптическая плотность анализируемого раствора при
364 нм; 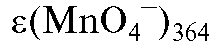 - среднее значение молярного коэффициента погашения
- среднее значение молярного коэффициента погашения
перманганат-ионов при 364 нм; 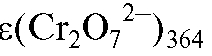 - среднее значение молярного ко-
- среднее значение молярного ко-
эффициента погашения дихромат-ионов при 364 нм.
7. Определение концентрации дихромат- и перманганат-ионов в анализируемом растворе методом градуировочного графика 7.1. Построение градуировочных графиков
По данным таблицы строят градуировочные графики зависимости оптических плотностей эталонных растворов от концентрации для перманганат-ионов при 540 нм (график 1) и 364 нм (график 2) и для дихромат-ионов при 364 нм (график 3). По оси абсцисс откладывают молярные концентрации определяемых ионов в эталонных растворах, а по оси ординат - соответствующие значения оптических плотностей.
При соблюдении закона Бугера-Ламберта-Беера получают прямые, исходящие из начала координат.
7.2. Расчет концентрации дихромат- и перманганат-ионов в анализируемом растворе
Расчет концентраций ведут следующим образом.
A. По значению оптической плотности анализируемого раствора при 540 нм с использованием графика 1 находят концентрацию перманганат-ионов в растворе.
Б. По графику 2 определяют значение оптической плотности анализируемого раствора при 364 нм, создаваемой за счет присутствия перманганат-ионов в этом растворе (концентрация этих ионов определена по графику 1).
B. Из оптической плотности анализируемого раствора при 364 нм вычитают оптическую плотность, создаваемую перманганатионами при той же длине волны, и получают оптическую плотность, обусловленную присутствием дихромат-ионов в этом растворе:
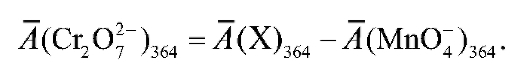
Г. По найденной величине оптической плотности с помощью графика 3 находят молярную концентрацию дихромат-ионов в анализируемом растворе.
Контрольные вопросы
1. Почему концентрации перманганат-ионов и дихромат-ионов при их совместном присутствии в анализируемом растворе можно определять на основе закона аддитивности оптической плотности?
2. Почему концентрацию перманганат-ионов в анализируемом растворе можно определить по значению оптической плотности этого раствора при 540 нм?
3. Как рассчитать концентрации перманганат-ионов и дихроматионов при их совместном присутствии в анализируемом растворе с использованием молярных коэффициентов погашения этих веществ?
4. Как рассчитать концентрации перманганат-ионов и дихроматионов при их совместном присутствии в анализируемом растворе с использованием градуировочных графиков?
Занятие 3. Фотоэлектроколориметрическое определение концентрации перманганатионов в растворе
Цель занятия
Количественное определение содержания перманганат-ионов в растворе методом фотоэлектроколориметрии.
Целевые задачи
1. Приготовление серии эталонных растворов калия перманганата.
2. Измерение оптической плотности растворов калия перманганата.
3. Расчет значений молярных коэффициентов погашения растворов калия перманганата.
4. Построение градуировочного графика для расчета концентрации калия перманганата в анализируемом растворе.
5. Расчет концентрации калия перманганата в анализируемом растворе по градуировочному графику и с использованием молярного коэффициента погашения.
Лабораторная работа
Сущность работы
В основе фотометрического определения концентрации перманганатионов в растворе лежит линейная зависимость оптической плотности раствора от концентрации перманганат-ионов.
Водные растворы калия перманганата (рН < 1) имеют максимум светопоглощения при 528 нм и характеризуются большим значением молярного коэффициента погашения при этой длине волны.
Оптическую плотность растворов измеряют со светофильтром, имеющим максимум светопропускания в области 540 нм, что примерно соответствует максимуму светопоглощения перманганат-ионов. Выполнение закона Бугера-Ламберта-Беера наблюдается для растворов перманганат-ионов с концентрацией от 4 • 10-5 до 3,6 • 10-4 моль/л.
Концентрацию перманганат-ионов в исследуемом растворе находят двумя способами: методом градуировочного графика и с помощью
среднего молярного коэффициента погашения, который определяют экспериментально.
Реактивы
1. Эталонный раствор калия перманганата с молярной концентрацией 5,00 • 10-4 моль/л. Лабораторная посуда
1. Колбы мерные на 25 мл.
2. Бюретка на 25 мл.
Приборы
1. Колориметр фотоэлектрический (например, типа КФК-2).
2. Кюветы с толщиной поглощающего слоя 1 см.
Методика работы
1. Приготовление эталонных растворов калия перманганата
В пять мерных колб на 25 мл помещают из бюретки соответственно 2,0; 6,0; 10,0; 14,0 и 18,0 мл эталонного 5 • 10-4 моль/л раствора калия перманганата, содержимое каждой колбы доводят до метки дистиллированной водой и тщательно перемешивают.
2. Измерение оптической плотности эталонных растворов калия перманганата
Оптическую плотность эталонных растворов измеряют на фотоэлектроколориметре (например, типа КФК-2) со светофильтром с максимумом светопропускания при 540 нм в кюветах с толщиной поглощающего слоя 1 см, используя в качестве раствора сравнения воду.
Рассчитывают молярные концентрации приготовленных эталонных растворов калия перманганата по правилу разбавления по формуле
(2.3).
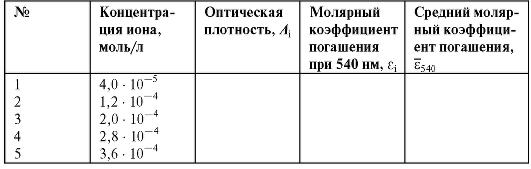
Рассчитанные значения концентраций эталонных растворов и измеренные оптические плотности этих растворов вносят в табл. 3-4.
3. Вычисление среднего молярного коэффициента погашения раствора калия перманганата
По данным таблицы рассчитывают значение 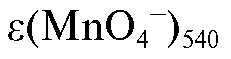 среднего
среднего
молярного коэффициента погашения раствора калия перманганата при длине волны 540 нм по формуле:
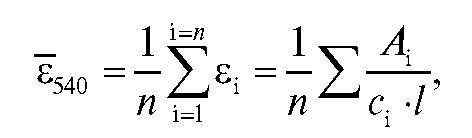
где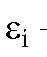 - молярный коэффициент погашения для i-го эталонного раствора калия перманганата;
- молярный коэффициент погашения для i-го эталонного раствора калия перманганата;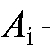 - оптическая плотность i-го эталонного раствора;
- оптическая плотность i-го эталонного раствора;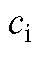 - концен
- концен
трация i-го эталонного раствора, моль/л; l - толщина кюветы, см, n - количество эталонных растворов.
Полученные значения молярных коэффициентов погашения растворов калия перманганата вносят в табл. 3-4.
Таблица 3-4. Характеристики эталонных растворов калия перманганата
4. Построение градуировочного графика
По данным таблицы строят градуировочный график, откладывая по оси абсцисс молярные концентрации перманганат-ионов в эталонных растворах, а по оси ординат - соответствующие им значения оптических плотностей этих растворов.
При соблюдении закона Бугера-Ламберта-Беера получают прямую, исходящую из начала координат.
5. Измерение оптической плотности анализируемого раствора калия перманганата
Контрольную задачу (анализируемый раствор калия перманганата) в мерной колбе на 25 мл доводят дистиллированной водой до метки, перемешивают и измеряют оптическую плотность приготовленного раствора при 540 нм в кюветах с толщиной поглощающего слоя 1 см относительно воды.
6. Определение концентрации перманганат-ионов в анализируемом растворе с использованием среднего молярного коэффициента погашения
Молярную концентрацию перманганат-ионов в анализируемом растворе рассчитывают на основе закона Бугера-Ламберта-Беера по формуле: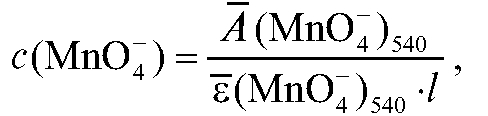
где 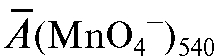 - средняя оптическая плотность анализируемого раствора при
- средняя оптическая плотность анализируемого раствора при
540 нм;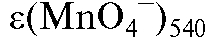 - среднее значение молярного коэффициента погашения
- среднее значение молярного коэффициента погашения
раствора калия перманганата при 540 нм.
7. Определение концентрации перманганат-ионов в анализируемом растворе методом градуировочного графика
Молярную концентрацию перманганат-ионов в анализируемом растворе находят также по градуировочному графику.
Контрольные вопросы
1. Как практически определить и рассчитать значение молярного коэффициента погашения раствора анализируемого вещества?
2. Как рассчитать концентрацию перманганат-ионов в анализируемом растворе с использованием молярного коэффициента погашения калия перманганата?
3. Как рассчитать концентрации перманганат-ионов в анализируемом растворе с использованием градуировочного графика?
Общая характеристика флуориметрических методов анализа
Люминесценция - свечение вещества, вызванное действием на него различных видов энергии.
Флуоресценция - свечение вещества, которое сразу заканчивается после прекращения действия источника возбуждения. В аналитической химии наиболее часто используется флуоресценция, возбуждаемая энергией излучения в УФ или видимой части спектра.
В основе качественного люминесцентного метода анализа лежит зависимость характера свечения от природы люминесцирующего вещества. В основе количественного люминесцентного метода анализа лежит зависимость интенсивности люминесценции (свечения, вторичной эмиссии) от концентрации анализируемого вещества в растворе.
В определенном интервале концентраций флуоресцирующего вещества и при постоянных условиях эксперимента интенсивность люминесценции линейно зависит от концентрации этого вещества в растворе:
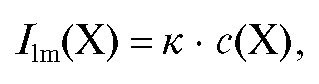
где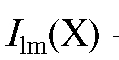 - интенсивность люминесценции раствора анализируемого вещества
- интенсивность люминесценции раствора анализируемого вещества
Х; к - коэффициент пропорциональности, который при проведении эксперимента на данном приборе и неизменных условиях является величиной постоянной; с(Х) - концентрация вещества в анализируемом растворе; измеряется обычно в мкг/мл.
Флуориметрия применяется в фармакопейном анализе, например при контроле качества фолиевой кислоты, хинина гидрохлорида, резерпина, тиамина хлорида и бромида, рибофлавина и др.
1. Способы определения концентрации вещества в растворе
Концентрацию вещества в анализируемом растворе определяют по градуировочному графику или рассчитывают методом одного стандарта (см. тему «Фотометрические методы анализа»).
2. Выбор оптимальных условий проведения флуоресцентного анализа
Метод флуоресцентного анализа позволяет количественно определять не только вещества, способные к собственному свечению, но и ряд веществ, которые не способны к флуоресценции. Многие органические вещества обладают собственной флуоресценцией и могут быть количественно определены путем измерения интенсивности флуоресценции непосредственно анализируемых растворов.
При определении неорганических веществ, большинство из которых не обладает собственной флуоресценцией, предварительно проводят аналитические реакции, в результате которых образуются способные к флуоресценции комплексные соединения. В том случае, когда в результате такой реакции образуется малорастворимое в воде комплексное соединение, его экстрагируют из водной фазы органическим растворителем.
При анализе раствора, в котором присутствуют мешающие анализу примеси, проводят аналитическую реакцию с определяемым ионом, и образующийся комплекс экстрагируют из водной фазы в органическую фазу. Мешающие ионы остаются в водной фазе.
Полученный экстракт определяемого вещества, существующего в составе флуоресцирующего комплекса, анализируют далее обычным образом.
3. Принципиальная схема аппаратуры для флуоресцентного анализа
Для проведения флуоресцентного анализа используют различные электрофлуориметры, принципиальная схема которых приведена на рис. 3-1.
Излучение от источника (1) проходит через отверстие в диафрагме (2), первичный светофильтр (3), кварцевую линзу (4) и попадает в анализируемый раствор в пробирке (5). Флуоресцентное излучение раствора собирается кварцевыми линзами (6), проходит через вторичные
светофильтры (7) и попадает на фотоэлементы (8). Фотоэлемент преобразует световую энергию в электрический ток, который усиливается и регистрируется микроамперметром. Показания микроамперметра прямо пропорциональны интенсивности флуоресцентного излучения и концентрации флуоресцирующего вещества в растворе.
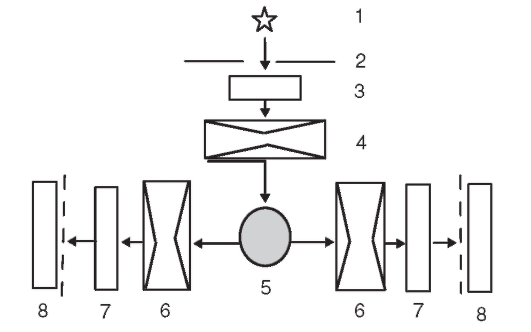
Рис. 3-1. Оптическая схема прибора (пояснения см. в тексте)
Занятие 4. Определение неорганических и органических веществ флуоресцентными методами анализа
Цель занятия
Количественное определение содержания витамина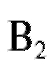 и солей алюминия в растворе методом флуоресцентного анализа.
и солей алюминия в растворе методом флуоресцентного анализа.
Целевые задачи
1. Приготовление серии эталонных растворов рибофлавина.
2. Приготовление серии эталонных растворов соли алюминия в виде комплекса.
3. Освоение техники работы на флуориметре.
4. Построение градуировочного графика для определения концентрации рибофлавина в растворе.
5. Расчет содержания рибофлавина в растворе по градуировочному графику и методом одного стандарта.
6. Построение градуировочного графика для определения концентрации ионов алюминия в растворе.
7. Расчет содержания ионов алюминия в анализируемом растворе по градуировочному графику и методом одного стандарта.
Задание для самоподготовки
К занятию необходимо знать
1. Сущность люминесцентного анализа и его возможности.
2. Классификацию люминесцентных методов анализа по видам возбуждающей энергии.
3. Природу люминесцентного излучения, правило Стокса-Ломмеля.
4. Зависимость интенсивности флуоресценции от различных факторов.
5. Принципы использования явления флуоресценции для качественного и количественного анализа.
6. Оптическую схему флуориметра. Уметь
1. Готовить эталонные растворы по точной навеске и методом разбавления.
2. Готовить эталонные растворы определяемых веществ в виде комплексных соединений.
3. Готовить эталонные органические экстракты определяемых веществ в виде комплексных соединений.
4. Строить градуировочные графики и использовать их для определения концентрации веществ.
Список литературы
1. Лекция «Люминесцентный анализ».
2. Учебник. - Книга 2, глава 8, разд. 8.3. - С. 356-369.
Вопросы для самопроверки
1. Что такое стоксово смещение, в чем оно выражается?
2. Что такое энергетический выход люминесценции и что он характеризует?
3. Что такое квантовый выход люминесценции и что он характеризует?
4. Сформулируйте условия проведения флуориметрического анализа.
5. Что такое концентрационное тушение флуоресценции и чем оно объясняется?
6. Что такое температурное тушение флуоресценции?
7. Что такое флуоресцентные реакции и в каких случаях при проведении флуориметрического анализа они проводятся?
Лабораторная работа «Флуориметрическое определение рибофлавина (витамина В2) в растворе»
Сущность работы
Нейтральный раствор рибофлавина в водных растворах окрашен в желтый цвет и имеет максимум поглощения при 450 нм. Рибофлавин флуоресцирует желто-зеленым светом с максимумом излучения при 535 нм. Количественное определение основано на линейной зависимости интенсивности флуоресценции от концентрации рибофлавина в растворе, которая хорошо соблюдается до концентрации рибофлавина 0,4 мкг/мл.
Реактив: эталонный раствор рибофлавина с концентрацией 8 мкг/мл (раствор А).
Учебная таблица: принципиальная схема лабораторного флуориметра.
Лабораторная посуда
1. Колбы мерные на 100 мл.
2. Колбы мерные на 50 мл.
3. Пипетки градуированные на 10 мл.
4. Бюретки на 25 мл.
Методика выполнения
1. Подготовка прибора к работе
Работу выполняют на флуориметре (например, типа ЭФ-3-МА) обычно с ртутной кварцевой лампой в качестве источника возбуждения УФ-излучения, снабженном несколькими светофильтрами: синий - область пропускания - 400-480 нм; фиолетовый (310-400 нм); голубой (400-600 нм) и желто-зеленый (510-575 нм).
Подготовку прибора к работе и измерение на нем проводят в соответствии с лабораторной инструкцией.
2. Приготовление серии эталонных растворов рибофлавина
В мерную колбу на 100 мл вносят 5,0 мл стандартного раствора А рибофлавина, добавляют до метки дистиллированную воду и тщательно перемешивают. Рассчитывают концентрацию рибофлавина в полученном растворе В. Готовят 10 эталонных растворов рибофлавина разбавлением полученного раствора водой с использованием бюреток в 10 чистых специальных кюветах и в соответствии с нижеприведенной таблицей. Рассчитывают концентрации рибофлавина в приготовленных растворах, и полученные данные вносят в табл. 3-5.
Таблица 3-5. Приготовление эталонных растворов рибофлавина и их характеристика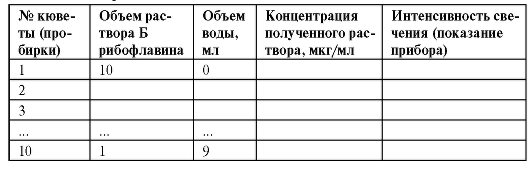
3. Выбор светофильтров
Первичный светофильтр должен пропускать ту часть спектра, которую поглощает определяемое вещество. Нейтральный раствор рибофлавина в воде окрашен в желтый цвет и поглощает синюю часть спектра, поэтому в работе используют первичный светофильтр синего цвета.
Вторичный светофильтр должен пропускать ту часть спектра, которую испускает определяемое вещество в результате флуоресценции. Нейтральный раствор рибофлавина в воде флуоресцирует желто-зеленым светом, поэтому в работе используют вторичные светофильтры желтозеленого цвета.
4. Проведение измерений интенсивности излучения эталонных растворов
Помещают в соответствующие гнезда прибора первичный и вторичный светофильтры и измеряют интенсивность флуоресценции приготовленных стандартных растворов рибофлавина, начиная с самого концентрированного. Не следует допускать длительного попадания из-
лучения в анализируемый раствор, так как это приводит к его нагреванию и к уменьшению интенсивности флуоресценции. Записывают полученные показания прибора в табл. 3-5.
5. Построение градуировочного графика
По данным табл. 3-5 строят на миллиметровой бумаге градуировочный график в координатах «интенсивность флуоресценции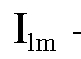 - концентрация рибофлавина в растворе С, мкг/мл». График подклеивают в лабораторный журнал.
- концентрация рибофлавина в растворе С, мкг/мл». График подклеивают в лабораторный журнал.
6. Определение содержания рибофлавина в растворе
Полученную задачу в мерной колбе на 50 мл доводят дистиллированной водой до метки, тщательно перемешивают, переносят часть раствора в кювету и измеряют интенсивность свечения полученного раствора. Концентрацию рибофлавина в анализируемом растворе определяют двумя способами: по градуировочному графику и методом одного стандарта с использованием табличных данных. При этом в качестве стандарта выбирают эталонный раствор с наиболее близким к анализируемому раствору значением интенсивности флуоресценции. По полученным значениям концентраций рассчитывают массу рибофлавина в задаче в микрограммах.
Лабораторная работа «Флуориметрическое определение алюминия(III) реакцией с салицилаль-о-аминофенолом»
Сущность работы
Соли алюминия не обладают собственной флуоресценцией, поэтому ионы алюминия предварительно переводят действием салицилаль-оаминофенола (манганон) во внутрикомплексное соединение, способное флуоресцировать зеленым светом при возбуждении ультрафиолетовыми лучами. Максимум спектра флуоресценции этого соединения лежит в интервале длин волн 520-530 нм. Линейная зависимость интенсивности вторичной эмиссии от концентрации наблюдается при концентрациях ионов алюминия в анализируемом растворе до 0,1 мкг/мл. Чувствительность реакции составляет 5 • 10-3 г/мл.
Реактивы
1. Эталонный раствор алюминия сульфата с концентрацией ионов алюминия 1,0 мкг/мл.
2. Салицилаль-о-аминофенол (манганон) - 0,01% раствор в ацетоне.
Лабораторная посуда
1. Колбы мерные на 100 мл.
2. Градуированные пробирки на 10 мл.
3. Пипетки градуированные на 1 мл.
Методика выполнения
1. Приготовление серии эталонных растворов
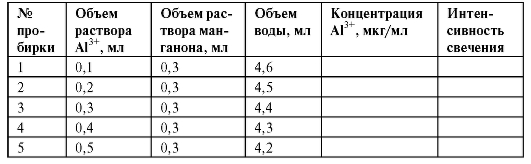
В пять градуированных пробирок на 10 мл вносят 0,1; 0,2; 0,3; 0,4 и 0,5 мл эталонного раствора соли алюминия соответственно, прибавляют по 0,3 мл раствора манганона, объем раствора в каждой пробирке доводят водой до 5 мл. Рассчитывают концентрации полученных растворов в пересчете на ионы алюминия и заносят их в табл. 3-6.
Таблица 3-6. Приготовление эталонных растворов соли алюминия и их характеристика
Интенсивность флуоресценции комплекса в растворе увеличивается со временем и становится постоянной через ~10-15 мин после приготовления раствора.
2. Выбор светофильтров
Нейтральный водный раствор полученного комплекса окрашен в желтый цвет, поэтому в работе используют первичный светофильтр фиолетового цвета.
Нейтральный раствор комплекса в воде флуоресцирует зеленым светом, поэтому в работе используют вторичные светофильтры желто-зеленого цвета, обладающие наиболее близкими к требуемым спектральными характеристиками.
3. Проведение измерений интенсивности излучения эталонных растворов
Помещают выбранные светофильтры в соответствующие гнезда прибора. Через ~15 мин после приготовления эталонных растворов настраивают шкалу прибора (см. инструкцию) и измеряют интенсивность эмиссии приготовленных эталонных растворов, начиная с раствора
с максимальной концентрацией ионов алюминия. Не следует допускать длительного попадания излучения в анализируемый раствор, так как это приводит к его нагреванию и к уменьшению интенсивности флуоресценции. Записывают полученные показания прибора в табл. 3-6.
4. Построение градуировочного графика
По данным табл. 3-6 строят на миллиметровой бумаге градуировочный график, откладывая по оси абсцисс концентрацию ионов алюминия в эталонных растворах (мкг/мл), а по оси ординат - интенсивность флуоресценции (показания прибора). График подклеивают в лабораторный журнал.
5. Определение содержания алюминия в растворе
Полученную задачу в мерной колбе на 100 мл доводят дистиллированной водой до метки, тщательно перемешивают. С помощью мерной пипетки отбирают 2 мл полученного раствора, переносят его в градуированную пробирку, добавляют 0,3 мл раствора манганона и 2,7 мл воды. Раствор перемешивают. Через ~15 мин после приготовления раствора измеряют интенсивность его эмиссии и полученное показание заносят в табл. 3-6. Концентрацию ионов алюминия в анализируемом растворе определяют по градуировочному графику и рассчитывают методом одного стандарта с использованием табличных данных. В качестве стандарта выбирают эталонный раствор с наиболее близким к анализируемому раствору значением интенсивности флуоресценции. По полученным значениям концентраций рассчитывают массу алюминия в задаче в микрограммах.
Лабораторная работа «Экстракционнофлуориметрическое определение алюминия реакцией с 8-оксихинолином»
Сущность работы
При взаимодействии солей алюминия с 8-оксихинолином в водных растворах при рН = 6,5-9,5 образуется внутрикомплексное соединение 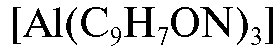 , плохо растворимое в воде и хорошо растворимое в органических растворителях. Раствор этого соединения в хлороформе окрашен в желтый цвет, имеет максимум поглощения в спектре при 390 нм и флуоресцирует зеленым светом с максимумом излучения при 520 нм. Измеряя интенсивность излучения этого экстракта, можно определить содержание алюминия в анализируемом растворе.
, плохо растворимое в воде и хорошо растворимое в органических растворителях. Раствор этого соединения в хлороформе окрашен в желтый цвет, имеет максимум поглощения в спектре при 390 нм и флуоресцирует зеленым светом с максимумом излучения при 520 нм. Измеряя интенсивность излучения этого экстракта, можно определить содержание алюминия в анализируемом растворе.
Реактивы
1. Эталонный раствор алюминия хлорида с концентрацией ионов алюминия 2,0 мкг/мл.
2. Раствор 8-оксихинолина в уксусной кислоте (2%).
3. Буферный раствор, содержащий аммиак и ацетат аммония.
4. Хлороформ (х.ч.). Лабораторная посуда
1. Делительные воронки на 25 мл.
2. Колба мерная на 100 мл.
3. Пробирки на 10 мл.
4. Пипетки градуированные на 10 мл.
Методика выполнения
1. Приготовление серии эталонных растворов
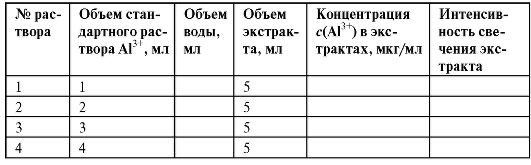
В 4 делительные воронки на 25 мл вносят 1, 2, 3 и 4 мл эталонного раствора соли алюминия соответственно. В каждую делительную воронку прибавляют по 2 мл раствора 8-оксихинолина, 3 мл буферного раствора и доливают дистиллированную воду до общего объема 15 мл. Затем в каждую воронку вносят по 5 мл хлороформа и энергично встряхивают в течение 1 мин. После разделения фаз сливают нижний хлороформный слой в сухие и чистые кюветы. Получают эталонные экстракты. Рассчитывают концентрации приготовленных экстрактов в пересчете на ионы алюминия и вносят их в табл. 3-7.
Таблица 3-7. Приготовление эталонных экстрактов комплексов алюминия и их характеристика
2. Выбор светофильтров
Полученные экстракты комплекса окрашены в желтый цвет, поэтому в работе используют первичный светофильтр синего цвета.
Экстракты комплекса в хлороформе флуоресцируют зеленым светом, поэтому в работе используют вторичные светофильтры желто-зеленого
цвета, обладающие наиболее близкими к требуемым спектральными характеристиками.
3. Проведение измерений интенсивности излучения эталонных растворов
Помещают выбранные светофильтры в соответствующие гнезда прибора и измеряют интенсивность эмиссии эталонных экстрактов, начиная с экстракта с максимальной концентрацией комплекса алюминия. Не следует допускать длительного попадания излучения в анализируемый раствор, так как это приводит к его нагреванию и уменьшению интенсивности флуоресценции. Записывают полученные показания прибора в табл. 3-7.
4. Построение градуировочного графика
По данным табл. 3-7 строят на миллиметровой бумаге градуировочный график, откладывая по оси абсцисс концентрацию ионов алюминия в эталонных экстрактах (мкг/мл), а по оси ординат - интенсивность флуоресценции соответствующих хлороформных экстрактов (показания прибора). График подклеивают в лабораторный журнал.
5. Определение содержания алюминия в анализируемом растворе Полученный анализируемый раствор количественно переносят
в мерную колбу на 100 мл, доводят дистиллированной водой до метки и тщательно перемешивают. Отбирают с помощью пипетки 10 мл полученного раствора  и переносят в делительную воронку. Добавляют 2 мл раствора 8-оксихинолина, 3 мл буферного раствора и 5 мл хлороформа. Энергично встряхивают содержимое воронки в течение 1 мин, отделяют хлороформный слой, переносят его в пробирку на 10 мл и измеряют интенсивность его флуоресценции. Концентрацию ионов алюминия в хлороформном экстракте определяют по градуировочному графику и рассчитывают массу алюминия в анализируемом растворе в миллиграммах по формуле:
и переносят в делительную воронку. Добавляют 2 мл раствора 8-оксихинолина, 3 мл буферного раствора и 5 мл хлороформа. Энергично встряхивают содержимое воронки в течение 1 мин, отделяют хлороформный слой, переносят его в пробирку на 10 мл и измеряют интенсивность его флуоресценции. Концентрацию ионов алюминия в хлороформном экстракте определяют по градуировочному графику и рассчитывают массу алюминия в анализируемом растворе в миллиграммах по формуле:
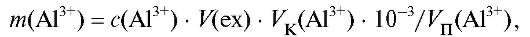
где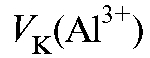 - общий объем анализируемого раствора соли алюминия, мл;
- общий объем анализируемого раствора соли алюминия, мл;
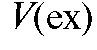 - объем экстракта, мл.
- объем экстракта, мл.
Контрольные вопросы
1. На чем основан количественный флуоресцентный анализ?
2. Как выбирают первичные и вторичные светофильтры?
3. В каких случаях можно применять метод градуировочного графика?
4. Как определяют содержание солей алюминия в растворе прямым флуориметрическим методом?
5. Почему измерение интенсивности флуоресценции некоторых растворов проводят через некоторое время после их приготовления?
6. Для чего применяют буферный раствор при определении алюминия с 8-оксихинолином?