Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
Раздел 2. ХИМИЧЕСКИЕ ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. ВВЕДЕНИЕ
Титриметрический, или объемный, анализ - метод количественного анализа, основанный на измерении объема (или массы) реагента Т, затраченного на реакцию с определяемым веществом Х. Другими словами, титриметрический анализ - анализ, основанный на титровании.
Цель лабораторных занятий по титриметрическим методам анализа - выработка практических навыков по технике выполнения титриметрического анализа и овладение методами статистической обработки результатов анализа на примере конкретных количественных определений, а также закрепление теоретических знаний путем решения типовых расчетных задач по каждой теме.
Знание теории и практики методов титриметрического анализа необходимо для последующего изучения инструментальных методов анализа, других химических и специальных фармацевтических дисциплин (фармацевтической, токсикологической химии, фармакогнозии, фармацевтической технологии). Изучаемые методы титриметрического анализа являются фармакопейными и широко применяются в практической деятельности провизора для контроля качества лекарственных препаратов.
Условные обозначения
А, Х, Т - любое вещество, определяемое вещество и титрант соответственно;
m(A), m(Х), т(Т) - масса любого вещества, определяемого вещества и титранта соответственно, г;
М(А), М(Х), М(Т) - молярная масса любого вещества, определяемого вещества и титранта соответственно, г/моль;
n(А), n(Х), n(Т) - количество любого вещества, определяемого вещества и титранта соответственно, моль;
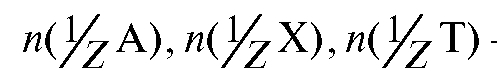 - количество вещества эквивалента любого вещества, определяемого вещества и титранта соответственно, моль;
- количество вещества эквивалента любого вещества, определяемого вещества и титранта соответственно, моль;
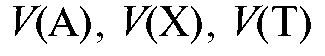 - объем раствора любого вещества, определяемого вещества и титранта соответственно, л;
- объем раствора любого вещества, определяемого вещества и титранта соответственно, л;
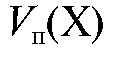 - объем аликвотной доли определяемого вещества, равный вместимости пипетки, л;
- объем аликвотной доли определяемого вещества, равный вместимости пипетки, л;
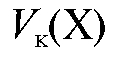 - объем анализируемого раствора определяемого вещества, равный вместимости колбы, л.
- объем анализируемого раствора определяемого вещества, равный вместимости колбы, л.
1. Основные понятия титриметрического
анализа
1.1. Титрование - процесс определения вещества Х постепенным прибавлением небольших количеств вещества Т, при котором какимнибудь способом обеспечивают обнаружение точки (момента), когда все вещество Х прореагировало. Титрование позволяет найти количество вещества Х по известному количеству вещества Т, прибавленного до этой точки (момента), с учетом того, что соотношение, в котором реагируют Х и Т, известно из стехиометрии или как-то иначе.
1.2. Титрант - раствор, содержащий активный реагент Т, с помощью которого проводят титрование. Обычно титрование проводят, прибавляя титрант из калиброванной бюретки в колбу для титрования с анализируемым раствором. В эту колбу перед титрованием вносят аликвотную долю анализируемого раствора.
1.3. Аликвотная доля (аликвота) - точно известная часть анализируемого раствора, взятая для анализа. Часто она отбирается калиброванной пипеткой, и ее объем обычно обозначается символом Vss.
1.4. Точка эквивалентности (ТЭ) - такая точка (момент) титрования, в которой количество прибавленного титранта Т эквивалентно количеству титруемого вещества Х. Синонимы ТЭ: стехиометрическая точка, теоретическая конечная точка.
1.5. Конечная точка титрования (КТТ) - точка (момент) титрования, в которой некоторое свойство раствора (например, его окраска) показывает заметное (резкое) изменение. КТТ соответствует более или менее ТЭ, но чаще всего не совпадает с ней.
1.6. Индикатор - вещество, которое проявляет видимое изменение в ТЭ или вблизи нее. В идеальном случае индикатор присутствует в достаточно малой концентрации, чтобы в интервале его перехода не затра-
чивалось существенное количество титранта Т. Резкое видимое изменение индикатора (например, его окраски) соответствует КТТ.
1.7. Интервал перехода индикатора - область концентрации ионов водорода, металла или других ионов, в пределах которой глаз способен обнаружить изменение в оттенке, интенсивности окраски, флуоресценции или другого свойства визуального индикатора, вызванное изменением соотношения двух соответствующих форм индикатора. Эту область обычно выражают в виде отрицательного логарифма концентрации, например: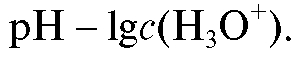 Для окислительно-восстановительного индикатора интервал перехода представляет собой соответствующую область окислительно-восстановительного потенциала.
Для окислительно-восстановительного индикатора интервал перехода представляет собой соответствующую область окислительно-восстановительного потенциала.
1.8. Степень оттитрованности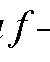 - отношение объема V (Т) добавленного титранта к объему V (ТЭ) титранта, соответствующему ТЭ. Другими словами, степень оттитрованности раствора - отношение количества оттитрованного вещества к его исходному количеству в анализируемом растворе:
- отношение объема V (Т) добавленного титранта к объему V (ТЭ) титранта, соответствующему ТЭ. Другими словами, степень оттитрованности раствора - отношение количества оттитрованного вещества к его исходному количеству в анализируемом растворе:
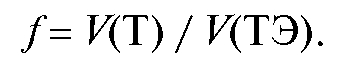
1.9. Уровень титрования - порядок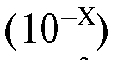 концентрации используемого раствора титранта, например, 10-1, 10-2, 10-3 и т.д.
концентрации используемого раствора титранта, например, 10-1, 10-2, 10-3 и т.д.
1.10. Кривая титрования - графическое изображение зависимости изменения концентрации с(Х) определяемого вещества Х или некоторого связанного с ним свойства системы (раствора) от объема V (Т) прибавленного титранта Т. Величина с(Х) в ходе титрования изменяется на несколько порядков, поэтому кривая титрования часто строится в координатах: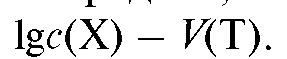 По оси абсцисс откладывают объем прибавленного титранта V (Т) или степень оттитрованности /. Если по оси ординат откладывать равновесную концентрацию с(Х) или интенсивность пропорционального ей свойства, то получают линейную кривую титрования. Если по оси ординат откладывать
По оси абсцисс откладывают объем прибавленного титранта V (Т) или степень оттитрованности /. Если по оси ординат откладывать равновесную концентрацию с(Х) или интенсивность пропорционального ей свойства, то получают линейную кривую титрования. Если по оси ординат откладывать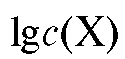 или логарифм интенсивности свойства, пропорционального с(Х), то получают логарифмическую (или монологарифмическую) кривую титрования. Для более четкого выявления особенностей процесса титрования и в прикладных целях иногда строят дифференциальные кривые титрования, откладывая по оси абсцисс объем прибавленного титранта V (Т), а по оси ординат - первую производную от логарифма концентрации (или интенсивности пропорционального ей свойства) по объему прибавляемого титранта:
или логарифм интенсивности свойства, пропорционального с(Х), то получают логарифмическую (или монологарифмическую) кривую титрования. Для более четкого выявления особенностей процесса титрования и в прикладных целях иногда строят дифференциальные кривые титрования, откладывая по оси абсцисс объем прибавленного титранта V (Т), а по оси ординат - первую производную от логарифма концентрации (или интенсивности пропорционального ей свойства) по объему прибавляемого титранта: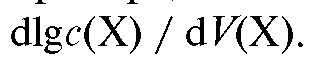 Такие кривые титрования обычно используют в физико-химических методах анализа, например, при потенциометрическом титровании.
Такие кривые титрования обычно используют в физико-химических методах анализа, например, при потенциометрическом титровании.
1.11. Стандартный раствор - раствор, имеющий известную концентрацию активного вещества.
1.12. Стандартизация - процесс нахождения концентрации активного реагента в растворе (чаще всего путем титрования его стандартным раствором соответствующего вещества).
1.13. Скачок титрования - интервал резкого изменения какоголибо физического или физико-химического свойства раствора вблизи точки эквивалентности, обычно наблюдается тогда, когда добавлено 99,9-100,1% титранта по сравнению с его стехиометрическим количеством.
1.14. Холостое титрование - титрование раствора, идентичного анализируемому раствору по объему, кислотности, количеству индикатора и т.д., но не содержащего определяемого вещества.
2. Основные операции титриметрического анализа
2.1. Очистка, мытье, хранение мерной посуды.
2.2. Проверка вместимости мерной посуды.
2.3. Взятие навески с точно известной массой по разности результатов двух взвешиваний (обычно - на аналитических весах).
2.4. Количественное перенесение навески вещества в мерную колбу и растворение вещества.
2.5. Заполнение мерной посуды (колб, бюреток, пипеток) раствором.
2.6. Опорожнение пипеток, бюреток.
2.7. Отбор аликвотной доли анализируемого раствора.
2.8. Титрование и расчеты по результатам титрования.
3. Калибровка мерной посуды
При титриметрическом анализе точные объемы раствора отмеривают с помощью измерительной посуды, в качестве которой используют мерные колбы вместимостью 1000, 500, 250, 100, 50 и 25 мл, пипетки и градуированные пипетки вместимостью 10, 5, 3, 2 и 1 мл. Вместимость колбы и пипетки при 20 °C выгравирована на шейке колбы или на боковой поверхности пипетки (номинальный объем). При массовом изготовлении мерной посуды действительная (истинная) вместимость мерных колб, бюреток, пипеток может отличаться от номинальных значений, указанных на посуде. Для достижения необходимой точности получаемых результатов титриметрического анализа
рекомендуется проводить калибровку применяемой при проведении анализа посуды.
Калибровка мерной посуды основана на определении точной массы вливаемой или выливаемой дистиллированной воды, которая определяется по результатам взвешивания посуды до и после вливания или выливания воды. Объем воды в калибруемой посуде (ее вместимость) и масса воды связаны соотношением:
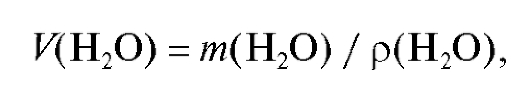
где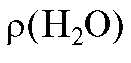 - плотность воды при температуре опыта, г/мл.
- плотность воды при температуре опыта, г/мл.
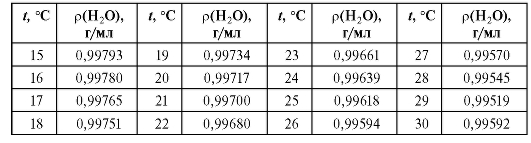
Плотность воды зависит от температуры, поэтому при проведении расчетов следует использовать данные табл. 2-1.
Таблица 2-1. Значения плотности воды при соответствующей температуре
Мерные колбы калибруются на вливание, а бюретки и пипетки - на выливание, так как небольшие количества жидкости при выливании всегда остаются на стенках посуды.
3.1. Проверка вместимости мерных колб
Колбу тщательно моют, высушивают и взвешивают на аналитических весах с точностью до ±0,002 г. Затем заполняют ее водой (здесь и далее - дистиллированной) по нижнему мениску, удаляют фильтровальной бумагой капли воды в верхней части горлышка колбы и снова взвешивают. Каждое взвешивание пустой колбы и колбы с водой проводят не менее двух раз, при этом расхождение между двумя взвешиваниями не должно превышать ±0,005 г. Разность между массой колбы с водой и массой пустой колбы равна массе воды, вмещаемой колбой при данной температуре. Истинную вместимость колбы рассчитывают делением среднего значения массы воды на ее плотность при температуре опыта (см. табл. 2-1).
Например, пусть при калибровке мерной колбы с номинальным объемом 100 мл среднее значение массы воды при 18 °C равно 99,0350 г. Тогда истинная вместимость мерной колбы равна:
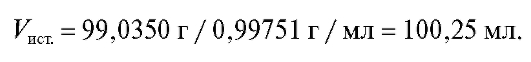
3.2. Проверка вместимости бюреток
Бюретка представляет собой стеклянный цилиндр, внутренний диаметр которого может несколько изменяться по длине бюретки. Равным делениям на бюретке в различных ее частях соответствуют неравные объемы раствора. Именно поэтому при калибровке бюретки рассчитывают истинные объемы для каждого выбранного участка бюретки.
Чистую и высушенную бюретку заполняют водой до нулевой отметки по нижнему мениску и удаляют с помощью фильтровальной бумаги капли воды с внутренней поверхности верхней части бюретки. Затем под бюретку подставляют бюкс, предварительно взвешенный с крышкой на аналитических весах. В бюкс медленно сливают из бюретки определенный объем воды (например, 5 мл). После этого бюкс закрывают крышкой и снова взвешивают. Разность массы бюкса с водой и пустого бюкса равна массе воды, вмещаемой в бюретке между делениями 0 и 5 мл при температуре опыта. Затем бюретку снова заполняют водой до нулевой отметки по нижнему мениску, медленно сливают 10 мл воды в пустой бюкс и аналогичным методом определяют массу воды, вмещаемую в бюретке между делениями 0 и 10 мл. При калибровке бюретки, например, на 25 мл такую операцию проводят 5 раз и рассчитывают массу воды, соответствующую указанным на бюретке номинальным объемам 5, 10, 15, 20 и 25 мл. Каждое взвешивание пустого бюкса и бюкса с водой повторяют не менее двух раз, при этом расхождение между двумя взвешиваниями не должно превышать ±0,005 г.
Затем по табл. 2-1 определяют плотность воды при температуре опыта и рассчитывают истинную вместимость бюретки для каждого указанного на ней значения номинального объема.
На основе полученных данных рассчитывают величину поправки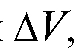 равную разности между рассчитанным значением истинной вместимости и соответствующим значением номинального объема бюретки:
равную разности между рассчитанным значением истинной вместимости и соответствующим значением номинального объема бюретки:
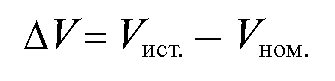
и затем вычерчивают кривую ошибок вместимости бюретки в координатах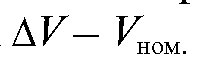 (рис. 2-1).
(рис. 2-1).
Например, пусть при калибровке бюретки вместимостью 25 мл при температуре 20 °C получены следующие экспериментальные данные, которые вместе с результатами соответствующих расчетов представлены в табл. 2-2.
На основе полученных табличных данных вычерчивают кривую поправок вместимости для данной бюретки, с использованием которой можно уточнить результаты отсчета по бюретке.
Таблица 2-2. Результаты калибровки бюретки вместимостью 25 мл
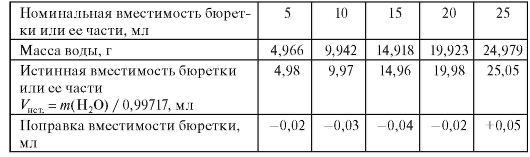
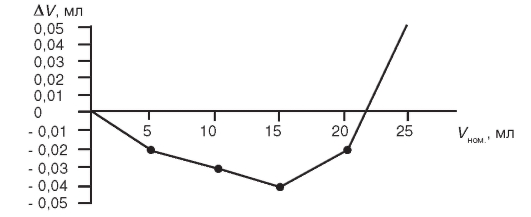
Рис. 2-1. Кривая поправок вместимости бюретки
Например, пусть на титрование аликвотной доли определяемого вещества по результатам отсчета по бюретке израсходовано 7,50 мл титранта. В соответствии с графиком (см. рис. 2-1) величина поправки, соответствующая этому номинальному объему, равна 0,025 мл, истинный объем израсходованного титранта равен: 7,50 - 0,025 = 7,475 мл.
3.3. Проверка вместимости пипеток
Чистую и взвешенную на аналитических весах пипетку заполняют водой до нулевой отметки по нижнему мениску и затем воду медленно
сливают по стенке в предварительно взвешенный бюкс. Бюкс закрывают крышкой и взвешивают вместе с водой. Каждое взвешивание пустого бюкса и бюкса с водой повторяют не менее двух раз, при этом расхождение между двумя взвешиваниями не должно превышать ±0,005 г. Разность массы бюкса с водой и пустого бюкса равна массе воды, вмещаемой пипеткой. Истинную вместимость пипетки рассчитывают делением средней массы воды на плотность воды при температуре опыта (см. табл. 2-1).
4. Типовые расчеты в титриметрическом анализе
4.1. Способы выражения концентраций, применяемые для расчетов в титриметрическом анализе
4.1.1. Молярная концентрация вещества с(А), моль/л - количество вещества А в моль, содержащееся в 1 л раствора:
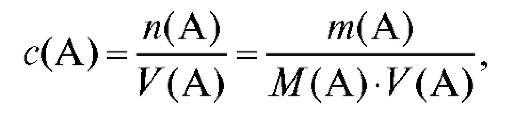 (2.1)
(2.1)
где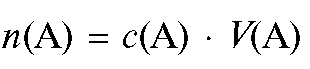 - количество вещества А в моль, растворенное в V (А) л
- количество вещества А в моль, растворенное в V (А) л
раствора.
4.1.2. Молярная концентрация эквивалента вещества 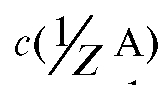 , моль/л - количество вещества эквивалента А в моль, содержащееся в 1 л раствора (прежнее название - «нормальность» раствора):
, моль/л - количество вещества эквивалента А в моль, содержащееся в 1 л раствора (прежнее название - «нормальность» раствора):
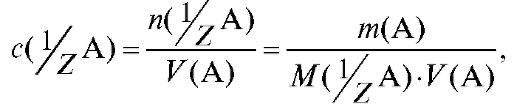 (2.2)
(2.2)
где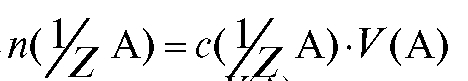 - количество вещества эквивалента А в моль,
- количество вещества эквивалента А в моль,
растворенное в V (А) л раствора; 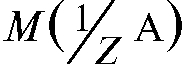 - молярная масса эквивалента ве-
- молярная масса эквивалента ве-
щества А, г/моль;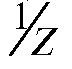 - фактор эквивалентности вещества.
- фактор эквивалентности вещества.
4.1.3. Титр вещества T (А), г/мл - масса растворенного вещества А в граммах, содержащаяся в 1 мл раствора:
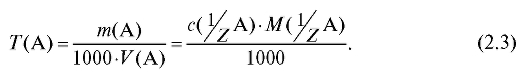
4.1.4. Титриметрический фактор пересчета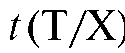 I, г/мл - масса определяемого вещества в граммах, взаимодействующая с 1 мл титранта:
I, г/мл - масса определяемого вещества в граммах, взаимодействующая с 1 мл титранта:
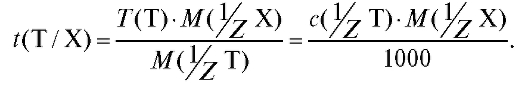 (2.4)
(2.4)
4.1.5. Поправочный коэффициент F - величина, показывающая, во сколько раз практические концентрации титранта отличаются от соответствующих теоретических значений, заданных в методике:
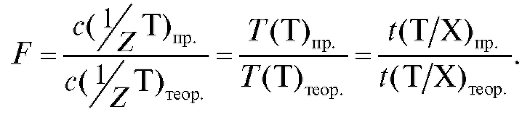 (2.5)
(2.5)
4.2. Вычисление молярной массы эквивалента веществ в реакциях, применяемых в титриметрическом анализе
Эквивалентом называется реальная или условная частица, которая может присоединять или отдавать один ион водорода Н+ (или быть другим образом эквивалентной ему в кислотно-основных реакциях) либо присоединять или отдавать один электрон в окислительновосстановительных реакциях.
Фактор эквивалентности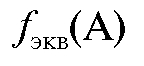 - число, обозначающее, какую
- число, обозначающее, какую
долю эквивалент составляет от реальной частицы вещества А. Фактор эквивалентности рассчитывается на основании стехиометрии данной реакции: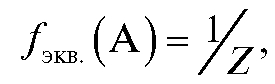
где Z - число протонов, отдаваемых или присоединяемых одной реагирующей частицей (молекулой или ионом) в кислотно-основной реакции, или число электронов, отдаваемых или принимаемых одной реагирующей частицей (молекулой или ионом) в полуреакции окисления или восстановления.
Молярная масса эквивалента вещества - масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества, г/моль. Она может быть рассчитана по формуле:
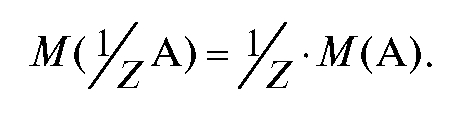 (2.6)
(2.6)
4.3. Приготовление раствора методом разбавления более концентрированного раствора с известной концентрацией
При проведении титриметрического анализа в ряде случаев требуется приготовить раствор вещества А объемом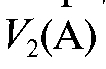 с примерно известной концентрацией путем разбавления более концентрированного раствора.
с примерно известной концентрацией путем разбавления более концентрированного раствора.
При разбавлении раствора водой количество вещества А или количество вещества эквивалента А не меняется, поэтому в соответствии с выражениями (2.1) и (2.2) можно записать:
(2.7) 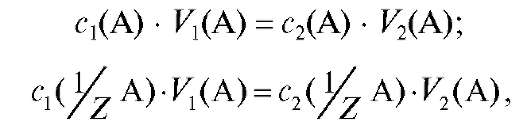 (2.8)
(2.8)
где индексы 1 и 2 относятся к растворам до и после разбавления соответственно.
Из полученных соотношений рассчитывают объем более концентрированного раствора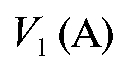 , который необходимо отмерить для приготовления заданного раствора.
, который необходимо отмерить для приготовления заданного раствора.
4.4. Приготовление заданного объема раствора по навеске с точно известной массой
4.4.1. Расчет массы навески
Теоретическая масса навески стандартного вещества А, необходимая для приготовления заданного объема раствора с известной концентрацией, рассчитывается из выражений (2.1) и (2.2). Она равна:
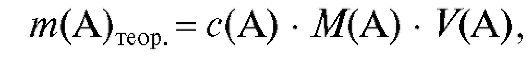 (2.9)
(2.9)
если используется молярная концентрация вещества в растворе, и:
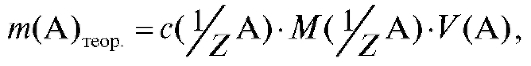 (2.10)
(2.10)
если используется молярная концентрация эквивалента вещества в растворе.
4.4.2. Расчет точной концентрации приготовленного раствора
Концентрацию раствора вещества А, приготовленного по точной навеске массой m (А), рассчитывают из соотношений (2.1-2.3), где т(А) - практическая масса вещества А, взятая по разности двух взвешиваний на аналитических весах.
4.5. Расчет концентрации титранта при его стандартизации
Известный объем стандартного раствора объемом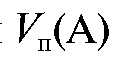 с концентрацией
с концентрацией 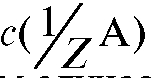 титруют раствором титранта объемом V (Т) (или наоборот). В этом случае для реакции, протекающей в растворе в процессе титрования
титруют раствором титранта объемом V (Т) (или наоборот). В этом случае для реакции, протекающей в растворе в процессе титрования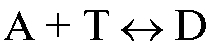 , закон эквивалентов имеет вид:
, закон эквивалентов имеет вид:
и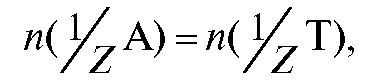
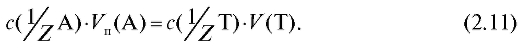
Отсюда получают выражение для расчета молярной концентрации эквивалента титранта по результатам титрования:
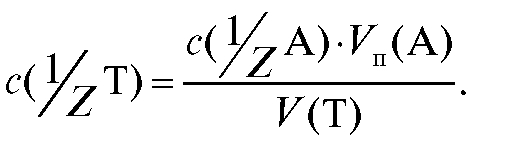 (2.12)
(2.12)
4.6. Расчет массы определяемого вещества в анализируемом растворе 4.6.1. Прямое титрование
Определяемое вещество в анализируемом растворе титруется непосредственно титрантом.
4.6.1.1. Расчет с использованием молярной концентрации эквивалента титранта
Аликвотную долю раствора определяемого вещества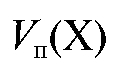 титруют
титруют
раствором титранта объемом V(T). В этом случае для реакции, протекающей в растворе в процессе титрования:
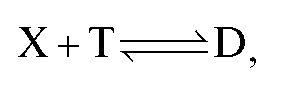
закон эквивалентов имеет вид: 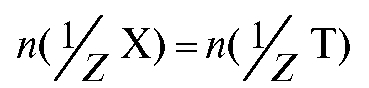 и
и
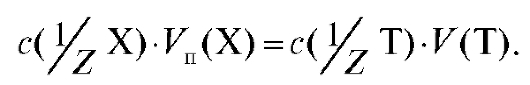 (2.13)
(2.13)
Отсюда молярная концентрация эквивалента определяемого вещества, рассчитанная по результатам титрования, равна:
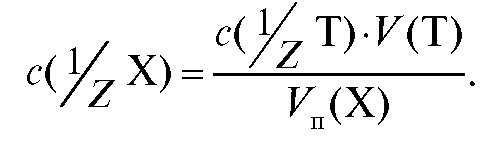 (2.14)
(2.14)
Полученное выражение подставляют в уравнение (2.2) и получают формулу для расчета массы определяемого вещества в колбе объемом 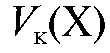 по результатам прямого титрования:
по результатам прямого титрования:
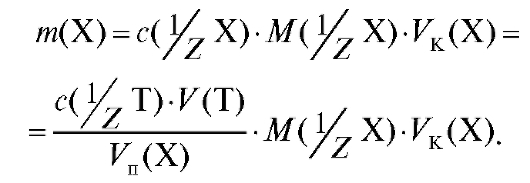 (2.15)
(2.15)
Если при титровании часть титранта расходуется на реакцию с индикатором, проводят «холостой опыт» и определяют объем титранта V' (Т),
израсходованный на титрование индикатора. При расчетах этот объем вычитают из объема титранта, который пошел на титрование раствора определяемого вещества. Такая поправка вносится при проведении «холостого опыта» во все расчетные формулы, применяемые в титриметрическом анализе. Например, формула (2.15) для расчета массы определяемого вещества с учетом «холостого опыта» будет иметь вид:
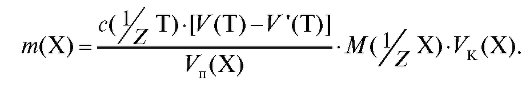 (2.16)
(2.16)
4.6.1.2. Расчет с использованием титриметрического фактора пересчета
Имеем анализируемый раствор объемом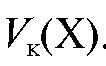 На титрование алик-
На титрование алик-
вотной доли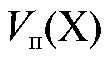 раствора определяемого вещества израсходован объем титранта V (Т) с теоретическим титриметрическим фактором пересчета
раствора определяемого вещества израсходован объем титранта V (Т) с теоретическим титриметрическим фактором пересчета 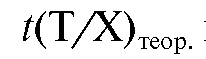 и поправочным коэффициентом F. Тогда масса определяемого вещества в аликвотной доле равна:
и поправочным коэффициентом F. Тогда масса определяемого вещества в аликвотной доле равна:
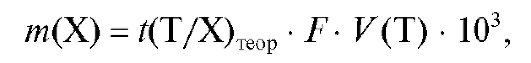 (2.17)
(2.17)
а во всем анализируемом объеме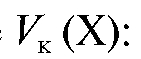
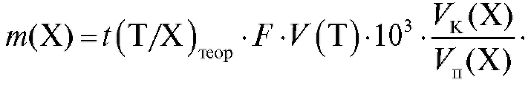 (2.18)
(2.18)
4.6.2. Заместительное титрование
К аликвотной доле определяемого вещества добавляют заведомый избыток реагента А и выделяется заместитель В в количестве, эквивалентном определяемому веществу:
добавляют заведомый избыток реагента А и выделяется заместитель В в количестве, эквивалентном определяемому веществу:
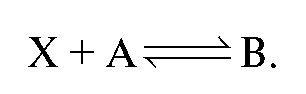
Заместитель В титруется подходящим титрантом:
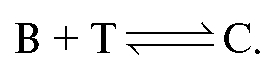
Закон эквивалентов для заместительного титрования:
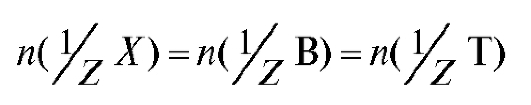
с использованием соотношения (2.8) можно записать в виде:
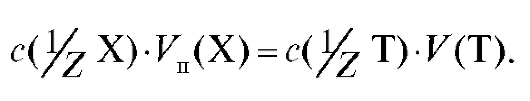
Отсюда получают формулу для расчета молярной концентрации эквивалента определяемого вещества в растворе по результатам заместительного титрования:
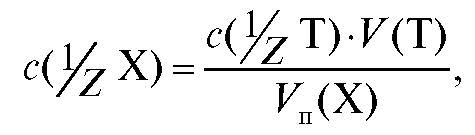
которая имеет такой же вид, как и при прямом титровании (2.14). Именно поэтому все расчеты массы определяемого вещества в анализируемой задаче при заместительном титровании производят по формулам (2.15- 2.18) для прямого титрования. 4.6.3. Обратное титрование
К аликвотной доле определяемого вещества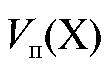 добавляют известный избыток первого титранта
добавляют известный избыток первого титранта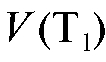 :
:
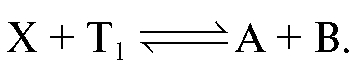
Затем избыток непрореагировавшего первого титранта оттитровывают вторым титрантом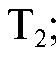 при этом расходуется объем
при этом расходуется объем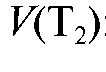 :
:
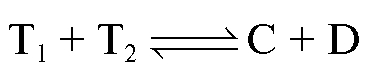
Закон эквивалентов в данном случае можно записать в виде:
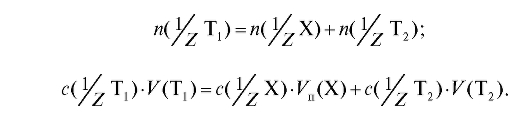
Отсюда рассчитывают молярную концентрацию эквивалента вещества Х в растворе:
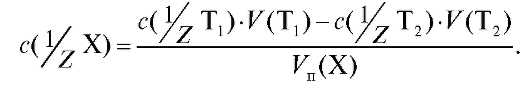 (2.19)
(2.19)
Подставляют полученное выражение в уравнение (2.2) и получают формулу для расчета массы определяемого вещества в анализируемом растворе, равном объему колбы, по результатам обратного титрования:
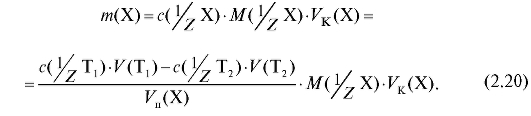
5. Выполнение и обеспечение практических работ по титриметрическому анализу
5.1. Общие положения
При изучении раздела «Титриметрический анализ» предусмотрено проведение работ по следующим темам.
Тема I. Методы кислотно-основного титрования.
Тема II. Методы окислительно-восстановительного титрования.
Тема III. Методы осадительного титрования.
Тема IV. Методы комплексонометрического титрования.
При проведении занятий рекомендуется следующая последовательность лабораторных работ, тест-контролей и контрольных работ.
Занятие 1. Приготовление раствора хлороводородной кислоты и его стандартизация.
Занятие 2. Определение массы щелочи в растворе. Определение массы карбонатов в растворе. Определение массы щелочи и карбоната в растворе при совместном присутствии.
Занятие 3. Определение массы аммиака в растворах аммониевых солей.
а) Тест-контроль 1.
б) Определение массы аммиака в растворах аммониевых солей. Занятие 4. Перманганатометрическое титрование.
а) Письменная контрольная работа 1.
б) Определение массы водорода пероксида в растворе.
в) Определение массы железа(II) в растворе соли. Определение массовой доли железа(II) в образце соли.
Занятие 5. Йодометрическое титрование.
а) Определение массы водорода пероксида в растворе.
б) Определение массы меди(II) в растворе. Занятие 6. Йодиметрическое титрование.
Занятие 7. Броматометрическое титрование. Определение массы мышьяка(III) в растворе.
Занятие 8. Бромометрическое титрование. Определение массовой доли натрия салицилата в препарате.
Занятие 9. Нитритометрическое титрование.
а) Тест-контроль 2.
б) Определение массовой доли новокаина в препарате. Занятие 10. Аргентометрическое титрованиеи гексацианоферратоме-
трическое титрование.
а) Письменная контрольная работа 2.
б) Определение массы калия бромида и калия йодида в растворе методами аргентометрического титрования.
в) Определение массы цинка в растворе методом гексацианоферратометрического титрования.
Занятие 11. Комплексонометрическое определение массы цинка и свинца в растворе.
а) Тест-контроль 3.
б) Определение массы цинка и свинца в растворе.
Занятие 12. Комплексонометрическое определение железа(III) и кальция в растворе.
а) Письменная контрольная работа 3.
б) Определение массы железа(III) и кальция в растворе.
В зависимости от конкретной ситуации допускается проведение некоторых работ в течение не одного, а двух занятий. Возможно также смещение сроков проведения тест-контролей и письменных контрольных работ.
В конце каждой темы приводятся примеры тестовых пунктов для промежуточного контроля знаний студентов, содержание итоговой письменной контрольной работы, пример билета письменной контрольной работы.
В конце каждого занятия студент оформляет протокол, который включает дату и название выполненной работы, сущность методики, порядок выполнения работы, полученные экспериментальные данные, расчеты, таблицы, выводы. Все расчеты результатов анализа (концентрация раствора, масса определяемого вещества) студенты выполняют с точностью до четвертой значащей цифры, за исключением случаев, особо оговоренных по тексту.
Промежуточный контроль практических навыков и теоретических знаний осуществляется с помощью тестового контроля и письменных контрольных работ.
5.2. Материальное обеспечение занятий по титриметрическому анализу
Лабораторная посуда: бюретки вместимостью 5 мл, мерные пипетки вместимостью 2 и 5 мл, мерные колбы вместимостью 25, 50, 100 и 250 мл, конические колбы вместимостью 10-25 мл, стеклянные бюксы, стеклянные воронки диаметром 20-30 мм, склянки из обычного или темного стекла вместимостью 100, 200 и 500 мл, мерные цилиндры вместимостью 10, 100 мл.
Реактивы: в работе применяются реактивы квалификации «х.ч.» и «ч.д.а.», индикаторная бумага.
Приборы: весы аналитические с разновесами, весы технические с разновесами, сушильный шкаф, лабораторный термометр со шкалой 20-100 °C, штативы с лапками для закрепления бюреток и кольцами для асбестовых сеток, газовые горелки, водяные бани.
Вспомогательные материалы и принадлежности: моющие средства (сода, моющие порошки, хромовая смесь), ерши для мытья посуды, резиновые груши, асбестовые сетки, канцелярский клей, карандаши по стеклу, фильтровальная бумага.
Список литературы
1. Лекции для студентов по разделу «Титриметрический анализ».
2. Харитонов Ю.Я. Аналитическая химия (аналитика): В 2 т.- изд. 5-е - М.: Высшая школа, 2010 (далее именуется «Учебник»).
3. Лурье Ю.Ю. Справочник по аналитической химии.- М.: Химия, 1989 (далее именуется «Справочник»).
4. Джабаров Д.Н. Сборник упражнений и задач по аналитической химии.- М.: Русский врач, 2007.