Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА 2. "ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ЖЕЛЕЗА В РАСТВОРИМЫХ СОЛЯХ ЖЕЛЕЗА(II) ИЛИ ЖЕЛЕЗА(III)"
Цель работы
Научиться применять метод осаждения для определения массовой доли компонента в образце путем получения в качестве осаждаемой формы аморфного осадка и прокаливания последнего до постоянной массы.
Целевые задачи
1. Доведение тигля до постоянной массы.
2. Расчет оптимальной массы навески образца. Расчет оптимального объема осадителя - раствора аммиака.
3. Взятие навески образца.
4. Растворение навески. Окисление железа(II) до железа(III) азотной кислотой.
5. Получение осаждаемой формы в виде аморфного осадка железа(III) гидроксида.
6. Отделение осадка железа(III) гидроксида от маточного раствора фильтрованием.
7. Промывание осадка железа(III) гидроксида.
8. Получение гравиметрической формы железа(III) оксида путем прокаливания осадка железа(III) гидроксида до постоянной массы.
9. Расчет массовой доли железа в образце.
10. Статистическая обработка результатов параллельных определений массовой доли железа в образце.
Задание для самоподготовки
К занятию необходимо знать: см. выше п.п. 1-4, 6 б, 7. К занятию необходимо уметь: см. выше п.п. 1, 2 б, 3, 5. Вопросы для самопроверки: см. выше п.п. 1-4, 5 б, 6 б, 7-11, 14, 15, 16 б, 17, 19, 20, 21 б, 23-34.
Материальное обеспечение
Посуда (в расчете на 1 студента)
Остальное - см. выше лабораторную работу 1. Реактивы (квалификации «ч.д.а.» или «х.ч.»)
1. Растворимые соли железа(III) или железа(II): железоаммонийные квасцы, соль Мора и др.
2. Кислота азотная концентрированная.
3. Аммиак 10% раствор водный.
4. Аммония нитрат 1% раствор.
5. Бария хлорид 0,2 моль/л раствор. Приборы: см. выше лабораторную работу 1.
Другое необходимое оборудование: фильтры беззольные «красная лента».
Остальное - см. выше лабораторную работу 1 (кроме п. 6). Учебные таблицы.
Методика определения массовой доли железа в растворимых солях железа(II) или железа(III)
1. Сущность методики
Определение железа в растворимых солях железа(II) или железа(III) основано на предварительном окислении железа(II) до железа(III), осаждении железа(III) гидроксида (осаждаемая форма), прокаливании и взвешивании железа(III) оксида (гравиметрическая форма).
Железо(III) осаждают в виде практически нерастворимого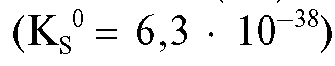 аморфного осадка железа(III) гидроксида действием аммиака:
аморфного осадка железа(III) гидроксида действием аммиака:
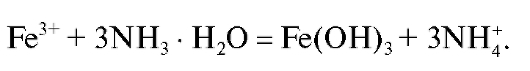
Вместо аммиака для осаждения не следует применять едкие щелочи, так как осадок железа(III) гидроксида адсорбирует заметное количество щелочей, которые плохо удаляются при промывании осадка.
При осаждении раствором аммиака необходимо, чтобы железо в растворе было в окисленной форме. Ион железа(II) количественно не осаждается аммиаком, поскольку наряду с образованием труднорастворимо-
го гидроксида образуются также растворимые комплексы железа(II). В связи с этим после растворения навески анализируемого образца в воде железо(II) окисляют до железа(III) действием концентрированного раствора азотной кислоты (или раствора пероксида водорода) при нагревании: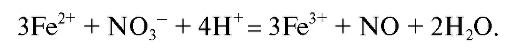
Обработке азотной кислотой подлежат как соли железа(II), так и соли железа(III), так как в последних в результате попадания органической пыли из воздуха может происходить частичное восстановление железа(II) до железа(III).
Следует отметить, что азотная кислота служит не только для окисления железа(II), но и для предотвращения гидролиза солей железа, который протекает с образованием труднорастворимых основных солей этого элемента: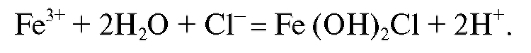
Если железо(II) не полностью окислилось до железа(III), при действии аммиака вместо красно-коричневого осадка железа(III) гидроксида образуется черный осадок железа(II) и железа(III) гидроксида неопределенного состава, очень устойчивый при прокаливании. Именно поэтому, если получается черный осадок, его растворяют в разбавленном растворе азотной кислоты при нагревании и повторяют осаждение аммиаком.
Осаждаемая форма - железа(III) гидроксид - в силу своей природы образует объемистые аморфные осадки, для которых характерна ярко выраженная адсорбционная способность. Количество адсорбированных примесей зависит от размера поверхности осадка, поэтому осаждение железа(III) гидроксида проводят в условиях, обеспечивающих получение хорошо скоагулированного компактного осадка с наименьшей поверхностью. Осаждение проводят при большом пересыщении раствора относительно осаждаемой формы в следующих условиях:
а) осаждение ведут из концентрированного раствора концентрированным раствором осадителя;
б) раствор осадителя добавляют быстро;
в) для предотвращения образования коллоидных частиц осаждение ведут из горячего раствора, желательно в присутствии электролита-коагулянта.
После осаждения раствор с аморфным осадком немедленно разбавляют горячей водой (для уменьшения загрязнения осадка адсорбированными примесями) и сразу же фильтруют.
При фильтровании аморфного осадка используют неплотный беззольный фильтр «красная лента». Осадок можно промывать горячей водой (при этом потери вещества вследствие очень малой растворимости осадка ничтожны, а использование горячей воды предупреждает пептизацию осадка). Однако для более эффективного предупреждения пептизации рекомендуется промывание осадка проводить горячим разбавленным раствором электролита-коагулянта. В качестве последнего следует использовать аммония нитрат, но не аммония хлорид, так как использование аммония хлорида может привести к потерям вещества в результате улетучивания железа(III) хлорида при последующем прокаливании осадка.
Гравиметрическая форма - железа(III) оксид получается путем прокаливания осаждаемой формы при температуре 800-900 °C:
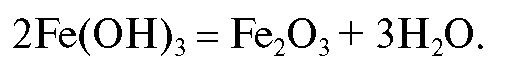
Прокаливание при более высокой температуре проводить не следует во избежание частичного термического разложения железа(III) оксида:
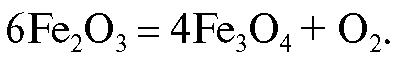
Газы, образующиеся при озолении фильтра, а также продукты неполного сгорания газа в горелке могут восстанавливать железа(III) оксид до железа(II) и железа(III) оксида, до железа(II) оксида и даже до металлического железа. Для того чтобы избежать этого, необходимо при прокаливании обеспечить к осадку достаточный доступ воздуха.
Массовую долю (в процентах) железа в образце рассчитывают по массам гравиметрической формы и взятой навески образца.
Основные источники погрешностей при определении железа обусловлены содержанием в растворе аммиака кремниевой кислоты, которая соосаждается с железа(III) гидроксидом. Именно поэтому нельзя пользоваться раствором аммиака, который долго хранился в стеклянной посуде. Если железа(III) гидроксид осаждается из раствора, содержащего хлориды, недостаточно промытый осадок может содержать значительное количество соосажденного железа(III) хлорида, которое улетучивается при прокаливании осадка. Примесь кремниевой кислоты дает завышенные результаты, а примесь железа(III) хлорида и превращение оксида железа(III) в железа(II) и железа(III) оксид дает заниженное содержание железа.
2. Предварительные расчеты 2.1. Расчет массы навески
Оптимальную массу навески образца рассчитывают в соответствии с рекомендациями, приведенными ранее. Примерное значение массо-
вой доли (в процентах) железа в образце указывает преподаватель. Гравиметрический фактор для определения железа по массе железа(III) оксида находят по «Справочнику». Массу навески рассчитывают приблизительно с точностью до второй значащей цифры.
2.2. Расчет объема раствора осадителя
В качестве осадителя железа(III) используют 10% водный раствор аммиака.
1. Массовая доля (в процентах) железа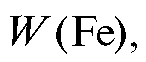 % в образце рассчитывается по формуле:
% в образце рассчитывается по формуле:
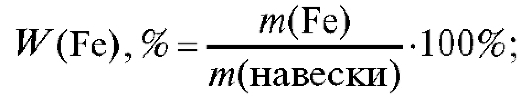
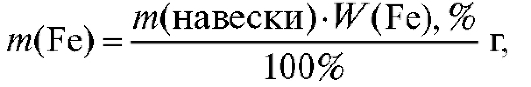
где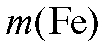 - масса железа в навеске образца, г; m(навески) - масса навески об-
- масса железа в навеске образца, г; m(навески) - масса навески об-
разца, г;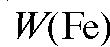 , % - примерная массовая доля железа в образце, %.
, % - примерная массовая доля железа в образце, %.
2. Для расчета массы осадителя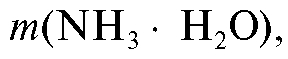 необходимой для осаждения железа(III), составляют пропорцию, исходя из уравнения реакции, согласно которой на 1 моль железа(III) затрачиваются 3 моля осадителя:
необходимой для осаждения железа(III), составляют пропорцию, исходя из уравнения реакции, согласно которой на 1 моль железа(III) затрачиваются 3 моля осадителя:
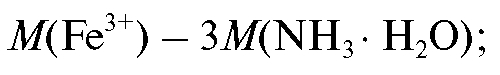
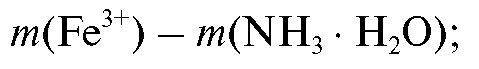
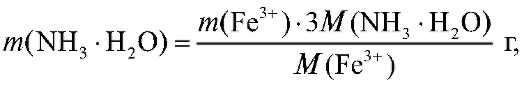
где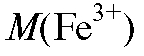 и
и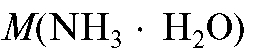 - молярные массы железа(III) и осадителя соот-
- молярные массы железа(III) и осадителя соот-
ветственно, г/моль.
3. Для определения объема раствора осадителя V необходимо знать его плотность р (см. «Справочник»). Тогда, учитывая, что массовая доля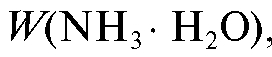 % показывает количество граммов осадителя, содержащееся в 100 г раствора, нетрудно вычислить объем раствора аммиака, в котором содержится
% показывает количество граммов осадителя, содержащееся в 100 г раствора, нетрудно вычислить объем раствора аммиака, в котором содержится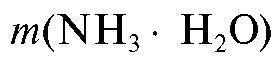 граммов осадителя:
граммов осадителя:
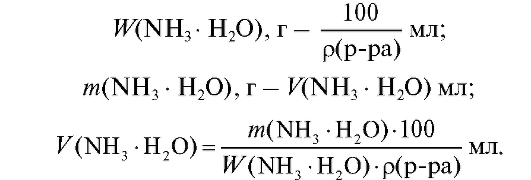
4. Поскольку аммиак - летучий осадитель, рекомендуется двухили троекратный избыток его по сравнению с рассчитанным стехиометрическим количеством.
5. Окончательно формула для расчета объема раствора осадителя имеет вид:
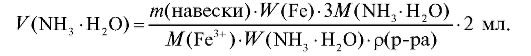
Объем раствора осадителя рассчитывают приблизительно с точностью до второй значащей цифры.
3. Доведение тигля до постоянной массы
Прокаливание тигля до постоянной массы проводят в муфельной печи при температуре 800-900 °С (см. лабораторную работу 1).
4. Взятие навески образца
Навеску образца с массой, близкой к вычисленной, взвешивают сначала на аптечных весах (с точностью до ±0,05 г), затем переносят в чистый и сухой бюкс и взвешивают на аналитических весах (с точностью до ±0,0002 г). Содержимое бюкса осторожно высыпают в химический стакан вместимостью 300-400 мл, предназначенный для осаждения в нем железа(III). Бюкс с остатками образца снова взвешивают с той же точностью. Массу навески образца рассчитывают как разность между первым и вторым результатами взвешивания на аналитических весах.
5. Растворение навески образца
В стакан с навеской образца, масса которой точно известна, опускают чистую стеклянную палочку с резиновым наконечником наружу и обрабатывают навеску 10-15 мл дистиллированной воды, отмеренной мерным цилиндром. Воду добавляют, избегая разбрызгивания, по стеклянной палочке, прислонив к ней носик цилиндра.
ВНИМАНИЕ! Стеклянную палочку не вынимают из стакана до окончания определения.
Содержимое стакана перемешивают стеклянной палочкой и добавляют по стенке стакана соответствующее количество концентрированного раствора азотной кислоты: 1,0-1,5 мл, если анализируется соль железа(II), и 0,5-1,0 мл, если анализируется соль железа(III). Содержимое стакана вновь перемешивают, после чего ставят стакан на асбестовую сетку и нагревают на газовой горелке (или на электроплитке с закрытой спиралью) до состояния раствора, близкого к кипению (кипятить нельзя, так как пар может увлекать капельки жидкости из стакана).
ВНИМАНИЕ! Перед нагреванием следует убедиться, что внешняя поверхность стакана совершенно сухая.
Нагревание продолжают до тех пор, пока навеска образца полностью растворится и раствор сделается желтым вследствие полного окисления железа(II) в железо(III).
Одновременно с анализируемым раствором нагревают также колбу с дистиллированной водой и промывалку с 1% раствором аммония нитрата в целях их использования в дальнейшей работе.
6. Получение осаждаемой формы
К горячему анализируемому раствору соли железа(III) желтого цвета прибавляют по палочке при перемешивании определенный объем 10% раствора аммиака. Этот объем должен быть равен сумме двух объемов раствора аммиака:
1) объема, необходимого для нейтрализации содержащейся в анализируемом растворе азотной кислоты;
2) объема, необходимого для практически полного осаждения железа(III) в виде железа(III) гидроксида.
Первый объем должен быть в 2-2,5 раза больше объема концентрированного раствора азотной кислоты, добавленного ранее к анализируемому раствору. Второй объем предварительно вычислен (см. выше). Если объем раствора аммиака определен правильно, после его добавления к анализируемому раствору должен ощущаться слабый запах аммиака.
Для уменьшения соосаждения примесей аморфным осадком железа(III) гидроксида к раствору с полученным красно-бурым осадком сразу же после осаждения прибавляют 100-150 мл горячей дистиллированной воды.
Содержимое стакана перемешивают, осадку дают отстояться (3-5 мин), после чего проверяют полноту осаждения железа(III), осторожно добавляя по стенке стакана 2-3 капли раствора аммиака. Осаждение считают полным, если при этом не наблюдается образование красно-бурых хлопьев осадка. На практически полное осаждение указывает также то, что первоначально желтый раствор в конце осаждения становится бесцветным. После осаждения немедленно приступают к фильтрованию и промыванию аморфного осадка.
7. Отделение осадка от раствора фильтрованием
Для отделения аморфного осадка используют беззольный бумажный фильтр «красная лента». Перенесение осадка на фильтр и фильтрование проводят, как описано выше в лабораторной работе 1.
8. Промывание осадка
В качестве промывной жидкости используют горячий 1% раствор аммония нитрата. Техника и приемы промывания осадка - см. лабораторную работу 1.
Последние порции промывной жидкости, вытекающей из воронки, проверяют на полноту отмывания осадка от примеси сульфат-иона или хлорид-иона в зависимости от того, какую соль железа анализируют. Для проверки полноты отмывания от сульфат-иона в полумикропробирку собирают около 1 мл фильтрата и добавляют к нему несколько капель 0,2 моль/л раствора бария хлорида. Отсутствие мути (белого осадка) при добавлении реагента указывает на практически полное удаление сульфат-иона. В противном случае промывание осадка на фильтре повторяют до отрицательной реакции на сульфат-ион. Реагентом на хлорид-ион служит 0,1 моль/л раствор серебра нитрата.
9. Получение гравиметрической формы
Высушивание осадка, озоление фильтра - см. лабораторную работу 1. Прокаливание осадка до постоянной массы проводят в муфельной печи при температуре 800-900 °C.
10. Расчет результата анализа
Массовую долю (в процентах) железа в образце рассчитывают по формуле: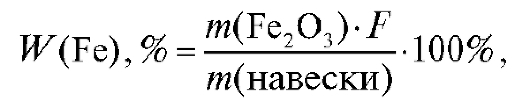
где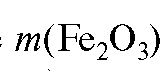 - масса гравиметрической формы - железа(III) оксида, г; m (на-
- масса гравиметрической формы - железа(III) оксида, г; m (на-
вески) - масса навески образца, г; гравиметрический фактор
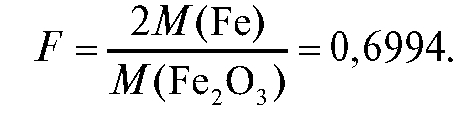
11. Статистическая обработка результатов параллельных определений
Для n результатов параллельных определений массовой доли (в процентах) железа в образце 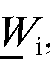 , % рассчитывают среднее
, % рассчитывают среднее 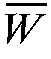 , %, доверительный интервал среднего
, %, доверительный интервал среднего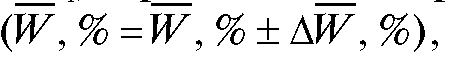 относительное стандартное отклонение sr и процентную погрешность определения
относительное стандартное отклонение sr и процентную погрешность определения 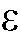 , %.
, %.
12. Проверка результата анализа
Проводят, как было описано выше.
Контрольные вопросы
1. Как рассчитать оптимальную массу навески анализируемого образца соли железа при гравиметрическом определении железа по массе железа(III) оксида?
2. Как предотвратить гидролиз солей железа при их растворении в воде?
3. Почему при гравиметрическом определении железа навеску анализируемого образца обрабатывают концентрированным раствором азотной кислоты?
4. Аргументируйте выбор осадителя при определении железа в железоаммонийных квасцах. Как рассчитать оптимальное количество осадителя?
5. Каковы должны быть условия осаждения при получении в качестве осаждаемой формы железа(III) гидроксида?
6. Как проверить полноту осаждения железа(III) гидроксида?
7. Почему после осаждения аморфного осадка железа(III) гидроксида раствор с осадком немедленно разбавляют водой и только после этого фильтруют?
8. Почему после осаждения осадок железа(III) гидроксида следует сразу же отделить от маточного раствора?
9. Какие фильтры используют для отделения осадка железа(III) гидроксида?
10. Как предотвратить пептизацию осадка железа(III) гидроксида при его промывании?
11. Как проверить полноту отмывания осадка железа(III) гидроксида от примеси сульфатили хлорид-иона?
12. Как получить из осаждаемой формы железа(III) гидроксида гравиметрическую форму?
13. Назовите возможные источники систематических погрешностей при гравиметрическом определении железа по массе железа(III) оксида.