Детская неврология : учебник : в двух томах / А. С. Петрухин. - Т. 2. - 560 с. : ил.
|
|
|
|
ГЛАВА 8. АУТОИММУННЫЕ ДЕМИЕЛИНИЗИРУЮЩИЕ ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫ
8.1. Острые диссеминированные энцефаломиелиты
Острые диссеминированные энцефаломиелиты характеризуются диффузным поражением нервной системы вследствие острой монофазной иммунной реакции. Выделяют псевдотуморозное течение с клиникой объемного образования задней черепной ямки, острый рассеянный энцефаломиелит с многоочаговым поражением спинного и головного мозга и панэнцефалит.
Заболевание развивается на фоне респираторной инфекции или гнойных синуситов у детей с отягощенным перинатальным анамнезом (гипоксия-ишемия мозга, родовая травма), после вакцинаций; крайне редко - у здорового ребенка.
Псевдотуморозный энцефалит характеризуется подострым началом: выраженная вялость, сонливость, головная боль, повторная рвота. Постепенно (5-7 дней) происходит изменение состояния сознания, нарастает дезориентация во времени и пространстве. Преобладают симптомы поражения мозжечка в виде атаксии, дисметрии, скандированной речи, отмечаются пирамидные расстройства в виде тран- зиторного гемипареза. В остром периоде наблюдаются преходящие нарушения функций глазодвигательного и лицевого нервов. Как правило, МРТ не выявляет изменений.
Рассеянный энцефаломиелит также характеризуется постепенным началом в течение 7-9 дней. Больные отмечают упорные головные боли, повторную рвоту. Затем развиваются генерализованные клоникотонические судороги, кома или выраженные расстройства психики. Нарушаются ориентация во времени и пространстве, эмоциональноволевые и интеллектуальные функции. Двигательные расстройства характеризуются центральными парезами или гиперкинезами в мышцах лица, рук; выражены расстройства в виде опсоклонуса. Мозжечковая атаксия наблюдаются редко. Миелит проявляется нарушением мочеиспускания по центральному типу (задержка мочи) и нижним спастическим парапарезом. МРТ в остром периоде выявляет отек, сглаженность борозд и извилин большого мозга, а также понижение плотности белого вещества. Спустя 6 нед от начала заболевания на МРТ визуализируются очаги в лобных долях, мозжечке, мозолистом теле, базальных ядрах и спинном мозге. В дальнейшем у детей развивается атрофия головного мозга.
Панэнцефалит манифестирует тонико-клоническими судорогами на 4-7-й день от начала острого респираторного заболевания. Затем развивается коматозное состояние, продолжающееся не более 3 сут. При выходе из комы развиваются двигательные нарушения в виде преходящих спастических парезов или анизорефлексии. Течение этой формы, как правило, благоприятное.
Диагностика основана на клинической картине заболевания. Лабораторные исследования выявляют неспецифичные изменения: умеренный лейкоцитоз и повышение СОЭ в крови; умеренное повышение содержания белка в ЦСЖ. Нарастание титра IgG-антиантител к общему белку миелина в сыворотке крови свидетельствует о хронизации процесса.
Лечение симптоматическое. Для терапии отека мозга назначают дегидратационные средства (маннитол, фуросемид), кортикостероиды (метилпреднилон) курсом не менее 4 нед. В дальнейшем необходима поддерживающая терапия преднизолоном до снижения уровня IgG-антиантител в крови. Возможно сочетание иммуносупрессивной терапии с иммуномодулирующей (интерфероны и иммуноглобулины).
8.2. Рассеянный склероз
Рассеянный склероз (РС) - хроническое заболевание головного и спинного мозга, характеризующееся развитием рассеянных во времени и пространстве очагов демиелинизации и проявляющееся рассеянной неврологической симптоматикой.
Эпидемиология. Распространенность заболевания различна в разных географических зонах. Самая низкая заболеваемость регистрируется в экваториальных странах. С удалением от экватора частота заболевания нарастает в любом полушарии. Особенно это проявляется у жителей Северной Европы и в наибольшей степени - у скандинавов. В северных штатах США распространенность заболевания превышает 100 случаев на 100 000 населения, в то время как в южных - только 20 на 100 000 жителей. Точные данные о частоте заболевания на территории РФ отсутствуют, в некоторых регионах частота составляет 35-70 случа- ев на 100 000 населения. У детей РС встречается редко - в 6-9 % всех случаев заболевания. С 1980-х гг. отмечено увеличение показателей распространенности и заболеваемости РС. Это увеличение может быть связано как с улучшением диагностики благодаря внедрению новых методов подтверждения диагноза, так и с истинным повышением числа заболевших.
Этиология и патогенез. Рассеянный склероз считается полиэтиологичным заболеванием. Предложено несколько теорий, объясняющих происхождение РС:
• вирусная инфекция (прямое повреждение олигодендроглии ретровирусами, вирусом простого герпеса 6 типа);
• бактерии (наличие перекрестных антигенов);
• дефект функции олигодендроглии;
• особенности диеты (изменение мембранного состава, функции макрофагов, гиперпродукция простагландинов);
• генетическая предрасположенность к иммунным реакциям против антигенов мозга.
Многие исследователи предполагали инфекционное происхождение РС. В этой связи изучались все известные микроорганизмы, включая простейшие, спирохеты, риккетсии, бактерии, вирусы и прионы. Наиболее убедительными являются данные о возможном участии вирусов в патогенезе РС. К вирусам, вероятно, вызывающим или провоцирующим РС, относят: парамиксовирусы (корь, собачья чума), герпес-вирусы (1, 2 и 6 типов, а также цитомегаловирус), коронавирусы, ретровирусы, аденовирусы. Особое значение в этиопатогенезе РС придают вирусу кори, поскольку в сыворотке большинства больных РС выявляют повышение антител к этому вирусу; также известно, что он индуцирует демиелинизирующие заболевания.
В основе патогенеза РС лежат аутоиммунные реакции, преимущественно клеточно-опосредованные, которые приводят к развитию хронического воспалительного процесса в ЦНС, сопровождающегося разрушением миелина (демиелинизацией).
Патоморфология. Многочисленные склеротические бляшки обнаруживаются по всему головному и спинному мозгу, преимущественно в белом веществе. Наиболее часто бляшки расположены в перивентрикулярной области, боковых и задних канатиках шейного и грудного отделов спинного мозга, мозжечке и стволе мозга. Серое вещество поражается в меньшей степени. Склеротические бляшки имеют разный возраст в отличие от монофазного повреждения при постинфекционном и поствакцинальном энцефаломиелите; они распространяются от посткапиллярных венул.
Кроме демиелинизации, имеется умеренное повреждение аксонов, приводящее к атрофии. Когда интенсивность иммунных реакций стихает, натриевые каналы перераспределяются вдоль аксона и происходит частичная ремиелинизация. При этом возникает «теневая
склеротическая бляшка» с резкой демиелинизацией в центре и меньшей - по краям. Старая, неактивная бляшка сероватого цвета, плотная на ощупь, характеризуется реактивной пролиферацией астроцитов, уменьшением олигодендроцитов. В некоторых случаях по краям старой бляшки могут наблюдаться новые зоны отека и периваскулярной инфильтрации, что указывает на возможность роста старых очагов.
Клиническая картина отражает особенности многоочагового деми- елинизирующего процесса. В типичных случаях при ремиттирующем РС симптоматика постепенно развивается в течение нескольких дней, стабилизируется, а затем подвергается полному или частичному регрессу в течение нескольких недель. В большинстве случае заболевание проявляется различными сочетаниями симптомов поражения двигательных и чувствительных проводящих путей, мозжечка, черепных нервов, нарушений функций тазовых органов, аффективных и когнитивных расстройств.
Наиболее частая жалоба - повышенная утомляемость (синдром «хронической усталости»). Обычно она провоцируется физической нагрузкой. Температура тела при этом несколько повышается. Эта чрезвычайная чувствительность к перегреванию (феномен Ухтоффа) отражает непрочность демиелинизированных аксонов. К типичным жалобам относится изменение походки.
Поражения пирамидного пути. В зависимости от локализаций бляшек на протяжении аксонов пирамидного пути могут наблюдаться гемипарезы и парапарезы, реже монопарезы. Может отмечаться синдром БроунСекара (половинное поражение спинного мозга). Характерен нижний парапарез, развивающийся вследствие расположения склеротических бляшек в боковых столбах спинного мозга. Мышечный тонус повышен по спастическому типу, больше в ногах. Спастичность возрастает при наполнении мочевого пузыря или на холоде. Характерно изменение степени пареза в течение дня: некоторые больные отмечают усиление слабости мышц к вечеру, другие - утром. Сухожильные и периостальные рефлексы асимметрично повышены, выражены патологические стопные рефлексы. Рефлексогенные зоны резко расширены, выявляются клонусы стоп и коленных чашечек. Снижение брюшных рефлексов, особенно асимметричное, является ранним симптомом поражения пирамидного пути.
Иногда пирамидные симптомы сочетаются с периферическим парезом. Например, в острейшем периоде образования массивных очагов наблюдается снижение сухожильных рефлексов на стороне пареза, что связано с сочетанным поражением корешка. При длительном
тяжелом течении заболевания развиваются сгибательные контрактуры и атрофии мышц от бездействия; тогда сухожильные рефлексы также снижены.
Нарушение чувствительности. Жалобы пациентов эмоциональны и разнообразны: покалывание, снижение чувствительности, гиперестезия, «скрепки и иглы», «чувство мертвой кожи», «лед внутри ноги», «положение на разбитом стекле», «что-то не так» и т.д. Типичны парестезии в руке или ноге, дальнейшее их распространение и через несколько дней наличие во всем теле с постепенным исчезновением в течение нескольких недель. С головной боли часто начинается обострение процесса. При сгибании шеи у больных РС возникает чувство про- хождения электрического тока вдоль спины или в конечностях (симптом Лермитта). Хроническая корешковая боль в спине возникает из-за гемипареза или спазма, вынужденного положения и дегенеративных изменений в диске. Она усиливается ночью и при жаркой погоде.
При неврологическом осмотре выявляется нарушение глубокой чувствительности в конечностях, снижение болевой и тактильной чувствительности в дистальных отделах конечностей, болевая гипере- стезия и гиперпатия.
При локализации очагов в области ствола развиваются симптомы поражения черепных нервов, чаще всего глазодвигательного, отводящего, лицевого и тройничного, а также заднего продольного пучка. Характерно поражение и зрительного нерва.
Нарушения зрения при РС вариабельны. Оптический (ретробульбарный) неврит часто является первым симптомом РС. Его диагностируют при остром или подостром снижении остроты зрения одного глаза, сопровождающемся болезненностью при движении глазных яблок. Длительность нарушений составляет не менее 24 ч, в дальнейшем происходит полное или частичное восстановление зрения. Возможно развитие повторных ретробульбарных невритов. Потере зрения обычно предшествует боль внутри или позади глаза, возникающая в покое, при движении глазных яблок и при давлении на них. Может возникать центральная скотома в виде «слепого» пятна. Нарушаются цветовое восприятие и контрастность. Зрение начинает восстанавливаться через 2 нед от начала неврита, а полное восстановление возможно не ранее чем через несколько месяцев. Другие зрительные нарушения («пятна», преобладание серых оттенков и нарушения цветовосприятия - побледнение красного и синего цветов) сохраняются дольше. Яркие огни вызывают длительное
«послесвечение», «полет цветов». Нарушение восприятия глубины объектов ухудшается при их перемещении. Повышенная температура тела провоцирует снижение остроты зрения (феномен Ухтоффа). При впервые возникшем оптическом неврите в первые недели на глазном дне изменений, как правило, не отмечается.
Картина глазного дна зависит от: 1) локализации процесса в зрительном нерве; 2) интенсивности воспалительных изменений; 3) давности процесса. Диски зрительных нервов могут быть не изме- нены, но в ряде случаев отмечаются гиперемия и стушеванность их границ (при локализации процесса вблизи глазного яблока). Уже в острой фазе может развиваться нисходящая частичная атрофия дисков зрительного нерва: побледнение височных половин диска, сужение артерий, дистрофические изменения в макуле. При распространенном процессе бледнеет весь диск. Иногда отмечаются изменения сетчатки в виде периферического увеита и воспаления перивенозной оболочки.
При РС выявляют различные изменения на глазном дне. Для объективизации применяют зрительные вызванные потенциалы, компьютерную периметрию и хронопериметрию. Большую помощь в диагностике оптических невритов оказывает МРТ. При оптическом неврите МРТ в 40-70% случаев выявляет очаги демиелинизации в других отделах мозга (рис. 8.1).
Глазодвигательные нарушения. Тотальная офтальмоплегия - ограничение движений глазного яблока на стороне пораженного заднего продольного пучка. У молодых людей она почти патогномонична для рассеянного склероза.
Двусторонняя невралгия тройничного нерва - патогномоничный симптом рассеянного склероза. Невралгия тройничного нерва является следствием появления бляшки в ядре V черепного нерва или в зоне входа волокон нерва.
Периферический парез мышц лица и косоглазие возникают при сочетанном повреждении VII и VI нервов соответственно.
Нарушения слуха возникают редко. Головокружение иногда столь выражено, что больные не могут встать с постели. Выявляется нистагм, обычно асимметричный, с ротаторным компонентом.
Мозжечок или его связи повреждаются у 50% пациентов с рассеянным склерозом. Классическая триада Шарко при поражении мозжечка включает нистагм, скандированную речь и интенционный тремор. При поражении путей мозжечка нарушаются походка и
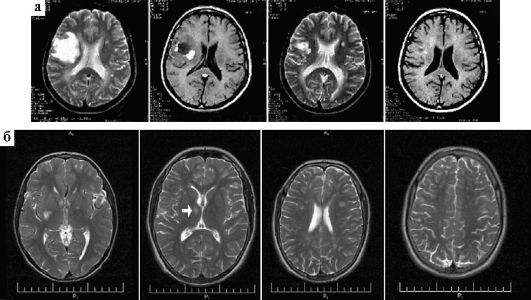
Рис. 8.1. Склеротические бляшки (МРТ головного мозга): а - изменения МРТ на фоне гормональной терапии; б - последовательность
равновесие, наблюдаются дисметрия, гиперметрия, асинергия, интенционное дрожание, мимопопадание при выполнении координаторных проб, мегалография. В тяжелых случаях может появиться дрожание рук, головы и туловища, которое иногда наблюдается и в покое. Тремор обу- словлен очагами в стволе мозга в области путей от мозжечка к красным ядрам и таламусу. Для РС характерно резкое нарастание атаксии вплоть до невозможности ходить, мозжечковой гипотонии.
Расстройства функции тазовьх органов - частое проявление РС. В ранних стадиях больные отмечают императивные позывы или задержку мочеиспускания, запор. По мере прогрессирования возможно развитие недержания мочи и кала. У большинства больных развивается импотенция, которая обусловлена не только спинальными механизмами, но и психосоциальными факторами.
Аффективные нарушения представлены депрессией, маниакальнодепрессивным синдромом. Внешняя эйфория, или «настроение веселого самодовольства», может появляться на фоне внутренней депрессии при осознании своей болезни. Пациенты с РС эмоционально лабильны, раздражительны, апатичны, но некоторые личностные реакции остаются неизмененными. Поведение меняется при новых атаках забо- левания, стойкие изменения сохраняются при хроническом прогрессирующем течении.
Когнитивные функции. Деменция при РС развивается редко (5% случаев). Однако нейропсихологические тесты выявляют те или иные нарушения у 34-65% больных: страдают абстрактное мышление, кратковременная память и внимание.
Типично для РС ухудшение симптоматики при повышении температуры тела (например, после приема горячей ванны, питья горячего чая).
Эпилептические приступы при РС бывают редко (2-3% случаев). Экстрапирамидные нарушения (ригидность, хорея, атетоз) непродолжительны.
Стволовые и мозжечковые симптомы более характерны в детском возрасте.
Классификация. Выделяют 4 варианта течения РС.
Ремиттирующее течение характеризуется обострениями, сменяющимися ремиссиями с полным исчезновением симптоматики. В периодах между обострениями заболевание не прогрессирует. Длительность течения широко варьирует, но в среднем составляет 10-15 лет. Обострение (острая атака, экзацербация) - это появление нового симптома или симптомов, а также отчетливое ухудшение уже имевшихся ранее у больного симптомов после того, как неврологическое состояние его было стабильным или улучшалось на протяжении не менее 1 месяца.
Первично-прогрессирующее течение характеризуется постоянным прогрессированием без четко очерченных обострений, возможна временная стабилизация симптоматики.
Вторично-прогрессирующее течение обычно сменяет ремиттирующее течение, характеризуется нарастающей необратимой инвалидизацией.
Дополнительно выделяют доброкачественный и злокачественный РС. При доброкачественном РС не наблюдается нарастания симптоматики, а имеет место лишь минимальный неврологический дефицит на протяжении многих лет.
При злокачественном РС заболевание характеризуется быстрым прогрессированием, приводящим к значительной инвалидизации или к смерти через относительно короткий период времени. Обычно пациенты умирают в течение года от начала заболевания.
Диагноз РС устанавливается на основании характерных клинических симптомов, диссеминированных во времени и пространстве. Выделяют триаду Шарко и пентаду Марбурга, при которой отсут- ствуют брюшные рефлексы, имеются тазовые нарушения, характерно побледнение височных половин диска зрительного нерва.
Типичные изменения при МРТ головного мозга выявляют у 90% пациентов, а при МРТ спинного мозга - у 70%. В типичных случаях при МРТ в режиме Т2 выявляют очаги повышенной интенсивности овальной формы в перивентрикулярной области, мозолистом теле, реже - в белом веществе полушарий, стволе и мозжечке. Свежие очаги хорошо усиливает контрастирование.
Типичные МР-признаки склеротических бляшек в спинном мозге: располагаются на уровне 1-2 сегментов, диаметром не менее 3 мм, чаще в области задних и боковых столбов, без отечности спинного мозга.
Необходимо помнить, что типичный паттерн многоочагового поражения белого вещества с участками гиперинтенсивного сиг- нала на Т2-взвешенных изображениях не является специфичным; у некоторых больных на МРТ не выявляется изменений. Согласно современным представлениям, нормальная МРТ-картина головного мозга не противоречит диагнозу РС, хотя и наблюдается редко.
ЗВП позволяют подтвердить наличие субклинического поражения зрительных нервов. При РС выявляется увеличение латентности, но оно не патогномонично для РС.
В ЦСЖ увеличена концентрация белка за счет IgG, легкий лимфоцитарный плеоцитоз (до 30-50 клеток в мм3). Характерно наличие не менее двух олигоклональных групп иммуноглобулинов.
Таким образом, данные МРТ или спинномозговой пункции подтверждают диагноз и делают его достоверным более чем в 95% случа- ев, хотя на сегодня не существует какого-либо одного лабораторного теста, патогномоничного для РС.
Дифференцировать РС необходимо с заболеваниями, сходными по клиническим, КТ- и МРТ-критериям, а также изменениям ЦСЖ (синдром Шегрена, узелковый периартериит, системная красная волчанка, болезнь Бехчета, нейроборрелиоз, саркоидоз, адренолейкодистрофия, острый рассеянный энцефаломиелит, зрительная атрофия Лебера).
Лечение. Весь комплекс лечебных воздействий при РС под- разделяют на две основные группы: средства патогенетической и симптоматической терапии. Патогенетическая терапия направлена на предупреждение деструкции ткани мозга активированными клетками иммунной системы и токсичными веществами. Симптоматическая терапия направлена на коррекцию и поддержание функций.
Лечение обострений РС. Препараты выбора - кортикостероиды и препараты адренокортикотропного гормона (АКТГ). Кортикостероиды ограничивают воспалительный процесс и степень разрушения миелина, сокращают длительность обострения и предупреждают развитие стойких неврологических последствий. Противовоспалительный и иммуносупрессивный эффект достигается при введении больших доз кортикостероидов внутривенно в течение ограниченного времени (строго в острую стадию). Кортикостероиды внутривенно вводят в дозе 10-20 мг/кг массы тела (максимальная суточная доза - 1 г) 1 раз в день утром, в течение 3-5 дней. Затем пациент переходит на пероральный прием в дозе 2 мг/кг (максимальная суточная доза - 80 мг) преднизолона или метилпреднизолона в течение еще 3 нед с последующим снижением дозы.
Если обострение РС проявляется изолированным ретробульбарным невритом, то достаточно ввести дексаметазон ретробульбарно до 1 мл в течение 7 дней. При нетяжелом обострении и отсутствии метипреда можно вводить дексаметазон внутримышечно, реже внутривенно. Противовоспалительный и иммуносупрессивный эффект дексаметазона более выражен, но быстрее развивается угнетение собственной продукции кортикостероидов. Препарат вводят через день. Рекомендуемая схема введения: 1-й день - по 2 мг 1 раз, 3-й день - по 2 мг 2 раза, 5-й день - по 4 мг 2 раза, 7-й и 9-й дни - по 8 мг 2 раза, затем нужно снижать дозу по этой же схеме. Допускается возможность проведения курса преднизолона per os (1-1,5 мг на 1 кг массы тела через день, 2/3 дозы утром, остальное - днем, в течение 15-20 дней, затем постепенно снижают дозу по 5-10 мг каждые 2-3 дня с полной отменой на протяжении месяца). Этот курс существенно менее эффективен, чем введение метилпреднизолона внутривенно.
При обострении РС также используют препараты адренокортикотропного гормона (АКТГ). Наиболее распространенная схема введения - по 40-100 ЕД АКТГ внутримышечно (разбивают на 2 дозы в день), 10-14 дней в зависимости от тяжести обострения. Возможен более длительный курс с постепенным снижением дозы с 80-100 до 20 ЕД АКТГ на протяжении 2-3 нед. Применяют синтетические аналоги АКТГ, например синактен-депо, обладающий пролонгированным действием. Препарат наиболее эффективен у больных с нетяжелым обострением или прогрессированием заболевания. Рекомендуемая схема введения - по 1 мл внутримышечно 1 раз в день 3 дня подряд, затем по 1 мл 1 раз в 3 дня (на курс 10-20 мл). В зависимости от тяжести обострения частоту
инъекций можно увеличивать или уменьшать. Синактен-депо назначают в сочетании с препаратами калия и диуретиками. Положительные эффекты стероидных гормонов более продолжительны при применении в сочетании с интерфероном.
Частично-специфическая иммуносупрессия и иммуномодуляция. С 1993 г. для лечения ремиттирующе-рецидивирующего РС применяют препараты интерферона - бета-интерферон, бета-интерферон-1а (авонекс) и кополимер-1 (копаксон). Они обладают антипролиферативной активностью и тормозят репликацию лимфоцитов, чем уменьшают частоту и тяжесть обострений, замедляют нарастание инвалидизации, имеют относительно немного побочных эффектов. Лечебное действие длится по крайней мере в течение 5 лет. Все интерфероны стимулируют нейтрализацию антител. Курс бета-интерферона носит преимущественно профилактический характер, так как не восстанавливают функции, нарушенные в результате предшествующих обострений. Важным ограничением в использовании этих препаратов пока является их высокая стоимость.
У детей и подростков лучше использовать гликолизированный бета-интерферон, который вводят 1 раз в неделю; он не вызывает значительных кожных реакций. Копаксон практически не вызывает побочных реакций, но вводится ежедневно, поэтом требует постоянного контроля за состоянием кожи.
Генерализованная иммуносупрессия. При выраженном обострении РС, злокачественном течении заболевания используют иммуносупрессоры, например цитостатики: азатиоприн, циклофосфамид, циклоспорин А, кладрибин, метотрексат. Препаратом выбора при неуклонном прогрессировании, особенно при первично-прогрессирующем течении РС, является азатиоприн в дозе от 1,5 до 3 мг/кг массы тела с возможным увеличением дозы на 25 мг каждый месяц. Курс азатиоприна прекращают при снижении количества лейкоцитов в крови до 4х109/л. При злокачественном РС возможно комбинирование азатиоприна с курсами метилпреднизолона или АКТГ.
Циклофосфамид является более сильным цитостатиком, чем азатиоприн, но и более токсичным. Его вводят по 400-800 мг в день внутривенно (разделяя на 4 дозы) 2-7 раз в неделю в зависимости от активности заболевания. У детей и подростков он используется в случаях с частыми тяжелыми обострениями, заканчивающимися тяжелой инвалидизацией. У некоторых детей длительный прием препарата приводит к положительной динамике.
Иммуносупрессор циклоспорин-А при хорошей переносимости назначают 3-месячным курсом (по 3-5 мг/кг массы тела в сутки). Основные осложнения связаны с нефротоксичностью препарата. Циклоспорин-А рекомендуют при злокачественном РС. У детей и подростков он применяется мало. При медленно прогрессирующем течении заболевания, например при вторично-прогрессирующем, более обосновано использование метаболических препаратов, комплексного симптоматического и реабилитационного лечения.
При обострении можно сочетать курсы бета-интерферона и кортикостероидов или препаратов АКТГ.
Симптоматическая терапия может применяться в отношении многих симптомов РС. Она условно делится на две большие группы: 1) медикаментозная терапия; 2) методы физиотерапии, диета, эрготерапия, физическая и психологическая реабилитация.
Среди целей симптоматической медикаментозной терапии выделяют коррекцию:
- двигательных нарушений (спастичности; патологической утомляемости; координаторных нарушений);
- расстройств чувствительности;
- нарушений функций тазовых органов;
- двигательных и чувствительных пароксизмальных синдромов;
- нейропсихологических нарушений.
Спастичность уменьшают баклофен, мидокалм, тизанидин (сирдалуд). Их побочными эффектами являются сухость во рту, сонли- вость, слабость. Валиум и дандролен - препараты резерва, поскольку вызывают привыкание и эффект выскальзывания. При локальной спастичности применяют препараты ботулотоксина.
Усталость уменьшается у 30-50% пациентов после применения амантадина по 100 мг 2 раза в день. В некоторых случаях лучший эффект наблюдается при назначении пемолина (по 37,5 мг 3 или 4 раза в день), тербуталина (1,25 мг 2 раза в день) или метилфенидата (от 5 до 10 мг 2 или 3 раза в день). Антидепрессанты из группы СИОЗС иногда уменьшают проявления усталости. Следует избегать перегревания. Пациентам, чувствительным к высокой температуре, назначают эффективное средство от усталости - стакан ледяной воды или прохладную ванну. Эффективен массаж.
Проприоцептивная чувствительность улучшается после ежемесячного применения витамина В12. Карбамазепин, диамокс или бромокриптин предотвращают парестезии. Боль при невралгии тройнич-
ного нерва уменьшается при приеме габапентина, карбамазепина, фенитоина, баклофена в сочетании с амитриптилином и нестероидными противовоспалительными препаратами. Хороший эффект оказывает регулярное применение мизопростола (цитотек) по 200 мг 4 раза в день, даже в случаях, когда больной невосприимчив к другим препаратам.
Обычно уменьшенный в размере, спазмированный мочевой пузырь реагирует на лечение антихолинергическими препаратами типа толтеродина по 2 мг 2 раза в день, оксибутинина по 5 мг 2 или 3 раза в день и амитриптилина по 25 мг перед сном. При этом уменьшается частота мочеиспусканий, но может наступить задержка мочи. Десмопрессин, аналог антидиуретического гормона, уменьшает ночные микции. Напряжение внешнего сфинктера иногда уменьшается с приемом баклофена. При задержке мочи важна своевременная катетеризация. Сексуальную функцию улучшают мази, вакуумные эректоры и интра- корпоральное введение простагландина.
Колебания настроения и псевдобульбарные расстройства уменьшаются при использовании антидепрессантов. Зрительная память улучшается после терапии бета-интерфероном, мышление - после гормо- нальной терапии.
Активное ведение больных с использованием современных возможностей лечения способствует предупреждению осложнений и более благоприятному течению заболевания.
Особым вариантом аутоиммунного поражения мозжечка и его связей в детском возрасте является опсоклонус-миоклонус (энцефалопатия Кинсбурна, миоклоническая энцефалопатия у детей, синдром танцующих глаз, детская полимиоклония, острая мозжечковая энцефалопатия). Заболевание манифестирует в основном в детском возрасте - от 4 мес до 6 лет. Основной симптомокомплекс представлен выраженными изменениями поведения, нарушением координации, тремором, миоклонусом и специфическими движениями глазных яблок. Выделяют 2 формы: параинфекционную и паранеопластическую.
При параинфекционной энцефалопатии Кинсбурна в основе патогенеза лежит аутоиммунная агрессия нейронов мозжечка собственны- ми антителами. Начальные симптомы появляются через 1-2 нед после вирусной инфекции или иммунизации. Длительность неврологической симптоматики при таких формах составляет от 6 до 15 дней, реже - до нескольких месяцев.
Паранеопластическая форма является маркёром нейробластомы и развивается при действии на нейроны мозжечка, имеющие сходный антигенный состав Т-лимфоцитов.
У небольшого числа пациентов заболевание может регрессировать спонтанно, без медикаментозной терапии, у ряда пациентов положительный эффект достигается назначением симптоматической терапии.
Наиболее распространенными схемами терапии являются применение АКТГ или кортикостероидов. В последние годы доказан эффект от применения иммуноглобулина для внутривенного введения.
8.3. Заболевания периферической нервной системы
Заболевания периферической нервной системы характеризуются поражением периферических нервов и сегментарного аппарата (задних, боковых и передних рогов спинного мозга и аналогичных им ядер черепных нервов ствола мозга).
Классификация заболеваний периферической нервной системы По топографо-анатомическому принципу:
• радикулиты;
• фуникулиты;
• плекситы;
• мононевриты;
• полиневропатии. По этиологии.
1. Инфекционные - вирусные [полиневропатия Гийена-Барре, хроническая воспалительная демиелинизирующая полиневропатия (ХВП); при вирусных заболеваниях, гриппе, ангине, инфекционном мононуклеозе и др.]; микробные (при скарлатине, бруцеллезе, сифилисе, лептоспирозе и др.].
2. Инфекционно-аллергические (при детских экзантемных инфекциях: кори, краснухе и др.).
3. Токсические - при хронических интоксикациях (алкоголизм, отравления свинцом и др.):
• при токсикоинфекциях (ботулизм, дифтерия);
• бластоматозные (при раке легких, желудка и др.).
4. Аллергические (вакцинальные, сывороточные и др.).
5. Дисметаболические: при дефиците витаминов, эндокринных заболеваниях (сахарный диабет) и др.
6. Дисциркуляторные: при узелковом периартериите, ревматических и других васкулитах.
7. Идиопатические и наследственные.
8. Травматические.
9. Компрессионно-ишемические поражения отдельных периферических нервов (синдром запястного канала, синдром тарзального канала и др.).
10. Вертеброгенные поражения.
8.3.1. Поражения черепных нервов
Невропатия лицевого нерва. Причинами симптоматических невропатий лицевого нерва являются черепно-мозговые травмы (например, перелом основания черепа), герпетическое поражение коленчатого узла лицевого нерва, средний гнойный отит, бактериальные инфекции, воспаление околоушных желез, опухоли. Чаще других опухолей, приводящих к развитию периферического пареза мышц лица, встречаются шваннома лицевого нерва и опухоли околоушных желез. Они поражают конечные веточки лицевого нерва, что приводит к парезу отдельных мимических мышц (рис. 8.2).
Врожденный парез мимических мышц возможен при синдроме Мебиуса. Синдром Мебиуса - это аномалия развития, характеризующаяся агенезией двигательных ядер черепных нервов, недоразвитием корешков и стволов лицевого, тройничного, добавочного и подъязычного нервов, а иногда и иннервируемых ими мышц.
Идиопатическая невропатия лицевого нерва (паралич Белла) встречается у детей довольно часто. Состояние представляет собой острый односторонний парез мимических мышц, развившийся как самостоятельное заболевание (а не осложнение другой болезни).
Клиническая картина. У больных с идиопатической невропатией лицевого нерва развитию паралича часто предшествуют такие общеинфекционные симптомы, как повышение температуры до субфебрильных цифр, вялость, тошнота. Иногда больные отмечают боль в околоушной области. Слабость мимических мышц возникает внезапно и быстро прогрессирует, нарастая в течение нескольких часов, иногда суток. Лицо становится асимметричным, кожные складки на стороне поражения сглаживаются, угол рта опускается. Больной не может поднять бровь, наморщить лоб, зажмурить глаз, надуть щеку, свистнуть. При оскаливании ротовая щель перетягивается в здоровую сторону; глазная щель на пораженной стороне шире. При зажмуривании веки не смыкаются, и в результате отведения кверху глазного яблока видна белая полоска склеры (лагофтальм - «заячий глаз»). В случае легкого пареза круговой мышцы глаза при сильном зажмуривании ресницы не полностью «прячутся» в глазную щель (симптом ресниц).
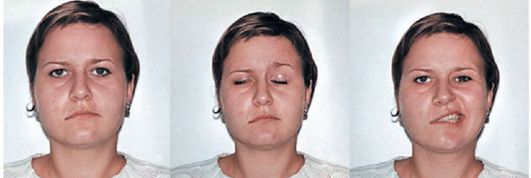
Рис. 8.2. Невропатия лицевого нерва
Из-за пареза мимических мышц речь становится невнятной. Во время жевания больной может прикусывать щеку, пища застревает между щекой и десной, жидкая пища выливается из угла рта.
У половины больных возможно поражение лицевого нерва до ответвления барабанной струны. Тогда, помимо перечисленных симптомов, наблюдается снижение вкуса на передних 2/3 языка. У части больных развивается гиперакузия - обостренный слух вследствие пареза стремянной мышцы, натягивающей барабанную перепонку. Редко возникает сухость глаза - при поражении нерва до отхождения от него волокон к слезным железам.
Диагноз паралича Белла (идиопатической невропатии лицевого нерва) базируется на исключении возможных причин поражения лицевого нерва. В сыворотке больных параличом Белла повышены титры антител к вирусам простого герпеса, вирусу Эпштейна-Барр, гриппа, аденовирусам, что свидетельствует о важной роли вирусной инфекции в генезе этого состояния. Провоцирующим фактором является переохлаждение. Воспаление и отек приводят к сдавлению и ишемии нерва, чему способствует узость костного канала лицевого нерва в пирамиде височной кости. У большинства больных сдавление нерва приводит к повреждению миелиновой оболочки (демиелинизации), что вызывает блокаду проведения, но оставляет сохранными аксоны. В этом случае происходит полный и относительно быстрый регресс симптомов (до 80% случаев) по мере восстановления миелина. При нарушении целостности аксонов восстановление происходит более медленно, путем регенерации поврежденных аксонов или ветвления соседних аксонов, берущих на себя функцию поврежденных, и часто бывает неполным. В последнем случае формируется косметический дефект лица.
Лечение тем эффективнее, чем раньше начато. Терапия направлена прежде всего на уменьшение отека и восстановление микроциркуля-
ции в стволе нерва. Для этого назначают кортикостероиды. Препарат выбора - преднизолон, 60-80 мг/сут, внутрь в течение 5-10 дней с последующей быстрой отменой в течение 1 нед. В тяжелых случаях прибегают к пульс-терапии с применением высоких доз метилпреднизолона (1-2 г/сут в течение 3-5 дней). Вследствие неполного закрытия и сухости глаза возникает угроза изъязвления роговицы, в связи с чем рекомендуется ношение очков, закапывание увлажняющих глазных капель (например, визина) в течение дня, на ночь - закрывание глаза повязкой и закладывание специальной глазной мази. С конца 1-й нед показаны гимнастика мимических мышц (упражнения перед зерка- лом); лейкопластырное вытяжение, предотвращающее перерастяжение паретичных мышц; парафиновые аппликации; со 2-й нед - точечный массаж и рефлексотерапия. Больные должны спать на больной стороне. Через 12 мес при отсутствии восстановления или неполном восстановлении проводят реконструктивные операции.
Прогноз зависит от степени повреждения нервных волокон. При поражении миелиновой оболочки можно ожидать восстановления в течение 3-6 нед, при повреждении аксонов регенерация нерва может продолжаться 3-6 мес. В последнем случае восстановление может быть неполным, резко возрастает вероятность осложнений - контрактур, синдрома «крокодиловых слез». Во время регенерации аксоны образуют отростки, прорастающие к паретичным мышцам. В результате этого появляются патологические синкинезии - одновременное сокращение нескольких мышц, иннервируемых отростками от одного аксона (например, больной закрывает глаз при попытке улыбнуться), «крокодиловы слезы» - слезотечение во время приема пищи, которое представляет собой вегетативную синкинезию, возникающую в результате прорастания слюноотделительных волокон к слезным железам. Чем моложе пациент, тем лучше прогноз. При отсутствии положительной динамики в течение 6 мес необходимо пересмотреть диагноз.
8.3.2. Периферические полиневропатии
Периферические полиневропатии представляют собой группу разных по этиологии, патогенезу и клинике заболеваний периферической нервной системы, характеризующихся диффузным поражением периферических нервных волокон, входящих в состав различных нервов. Соответственно в зоне нарушения иннервации развиваются периферический парез или паралич соответствующих мышц, нарушения чувствительности, вегетативно-сосудистые и трофические расстройства.
К основным патофизиологическим процессам, вовлекающим периферический нерв, относятся: 1) валлеровское перерождение нервного волокна; 2) аксональная дегенерация; 3) сегментарная демиелинизация.
Валлеровское перерождение периферического нерва возникает в результате механического повреждения нервного ствола, например при перерезке, сдавлении или ишемии нерва. При этом дистальнее места поражения нерв подвергается дегенерации, аксон и миелиновая оболочка распадаются. В мышцах, иннервируемых пораженным нервом, развивается атрофический процесс. Впоследствии прокси- мальный отдел аксона регенерирует со скоростью 1 мм в сутки, реиннервируя оставшиеся леммоциты (шванновские клетки). Леммоциты вновь образуют миелиновую оболочку вокруг аксона. Однако сформированный нервный ствол будет тоньше, чем существовавший ранее, и перехваты Ранвье будут встречаться чаще, поэтому скорость проведения по нервному волокну будет снижена.
Патогенетически полиневропатии подразделяют на 2 группы: аксонопатии с преимущественным поражением осевого цилиндра (аксона) и демиелинизирующие невропатии с преимущественным нарушением миелиновой оболочки.
Аксональная дегенерация является наиболее частой причиной метаболических, токсических или наследственных невропатий. При аксональной дегенерации нарушается метаболизм в теле клетки, что приводит к нарушению транспорта питательных веществ по аксону. Аксонопатии поражают как крупные миелинизированные волокна, так и мелкие немиелинизированные или маломиелинизированные вегетативные волокна, волокна болевой и температурной чувствительности. Для аксонопатии характерно постепенное развитие. У таких больных наблюдаются мышечная атрофия дистальных отделов конечностей, полиневритический тип расстройства чувствительности с гипестезией, анестезией по типу «перчаток», «носков».
Функциональные нарушения аксона по данным ЭНМГ характеризуются снижением амплитуды мышечного потенциала действия (М-ответа); значительным снижением числа функциональных двигательных единиц. При аксональной дегенерации скорость проведения нервного импульса не меняется либо снижена незначительно, потому что неповрежденные нервные волокна проводят нервный импульс с нормальной скоростью.
При демиелинизирующих полиневропатиях поражается миелиновая оболочка аксонов, тогда как сам аксон остается интактным.
Наиболее часто это возникает при аутоиммунном процессе (синдром Гийена-Барре) или при наследственных заболеваниях, когда страдает метаболизм в леммоцитах (например, некоторые формы болезни Шарко-Мари-Тута). Демиелинизации подвержены крупные миелинизированные волокна, то есть двигательные волокна и волокна глубокой чувствительности. Характерно снижение сухожильных рефлексов, нарушение суставно-мышечной и вибрационной чувствительности, выраженная сенситивная атаксия при отно- сительной сохранности болевой и температурной чувствительности. Двигательные нарушения проявляются тяжелыми и распространенными парезами, часто проксимальных отделов с умеренной атрофией мышц.
При демиелинизации сегментарного аппарата на ЭНМГ отмечается существенное снижение скорости проведения импульса по нервному волокну. Максимальные значения скорости проведения составляют 60% нормальных возрастных значений (менее 40 м/с в верхних конечностях и менее 30 м/с - в нижних). Характерной чертой острой демиелинизации является блок проведения на ЭНМГ, что означает резкое снижение скорости проводимости по нервному волокну (менее 20 м/с).
Следует помнить, что у здорового новорожденного скорость проведения импульса в моторном волокне в 2 раза меньше, чем у взрослого. По мере миелинизации нервных волокон скорость проведения импульса увеличиваются, достигая к 3-летнему возрасту значений взрослых.
По течению полиневропатия может быть острой (развивается быстрее, чем за 1 нед), подострой (развитие в течение 1 мес), хронической и рецидивирующей, при которой повторные обострения периодически возникают в течение многих лет.
Выраженность демиелинизации и дегенерации аксонов нервных стволов различна в зависимости от этиологии полиневропатии. Выделяют наследственные (генетически детерминированные) и приобретенные полиневропатии, которые встречаются чаще первичных. Среди приобретенных форм условно выделяют токсические, инфекционные, аллергические, бластоматозные, сосудистые, метаболические и обусловленные воздействием физических факторов.
Клиническая картина. Несмотря на многообразие этиологических факторов, клинические проявления полиневропатий стереотипны и определяются тем, какие структурные компоненты нервов преимущественно вовлечены в патологический процесс. Заболевание может возникнуть в любом возрасте, но чаще болеют молодые и люди среднего возраста.
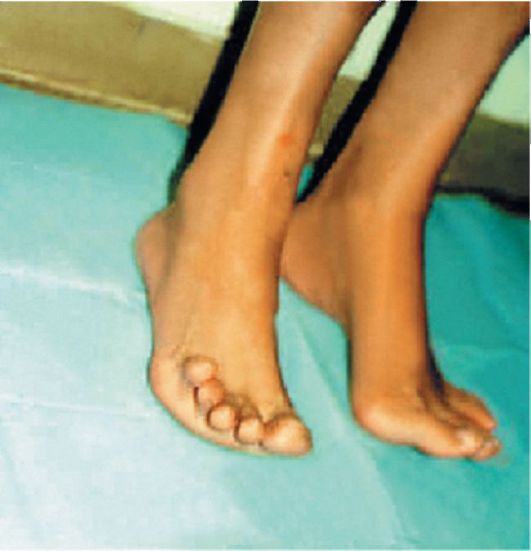
Рис. 8.3. Невозможность тыльного сгибания стопы при парезе нижних конечностей
Развитие болезненных симптомов обычно подострое или хроническое (исключение составляет острая демиелинизирующая полиради- кулоневропатия Гийена-Барре). Основные симптомы обусловлены нарушением проводимости по двигательным, чувствительным и вегетативным волокнам различ- ных нервов. Чаще полиневропатия начинается с ощущения похолодания кистей и стоп, чувства ползания мурашек, онемения или жжения. Конечности на ощупь холодные, кожа с синюшным оттенком или мраморная, влажная вследствие повышенного потоотделения.
Двигательные нарушения. Мышеч-ная слабость вначале проявляется неловкостью при выполнении тонких движений пальцами кисти, в дальнейшем могут развиться парезы или параличи со снижением или выпадением сухожильных рефлексов и атрофией мышц. Наиболее характерна атрофия мышц кистей (особенно мышц возвышения большого пальца и мизинца), а на ногах - атрофия мышц, обеспе- чивающих тыльное сгибание стопы (рис. 8.3, 8.4), вследствие чего своеобразно изменяется походка: стопы свисают и больному приходится высоко поднимать ноги при ходьбе, чтобы не задевать носками пол («петушиная походка»).
Нарушения чувствительности обычно распространяются на кисть и нижнюю часть предплечья, стопу и нижнюю часть голени (полиневритическое расстройство чувствительности по типу «перчаток» или «носков»). При этом больной перестает различать температуру, прикосновение, болевые раздражения (например, укол), но может постоянно ощущать ноющую или стреляющую боль в руках и ногах, отмечается чувство ползания мурашек в кистях и стопах и другие формы парестезий (рис. 8.5). Нарушение глубокой (проприоцептивной) чувствительности и поражение проводников, идущих к мозжечку, приводит к выпадению суставно-мышечного чувства и расстройствам координации движений (сенситивная атаксия) в виде неустойчивости при стоянии и ходьбе, усиливающейся при закры-
тых глазах и в темном помещении. Часто наблюдается дрожание кистей.
Вегетативные нарушения разнообразны, они проявляются сосудистыми и трофическими расстройствами: кожа на стопах и кистях постепенно истончается, начинает шелушиться, приобретает синюшно-багровый оттенок, отечность, ногти становятся тусклыми и ломкими. В тяжелых случаях вяозможно образование трофических язв, развитие остеопороза костей дистальных отделов конечностей.
Течение полиневропатий в значительной мере определяется их причиной. При эндогенных и экзогенных интоксикациях, воз- действиях физических факторов течение имеет неуклонно прогрессирующий характер до устранения причин. При сахарном диабете, тиреотоксикозе, диффузных болезнях соединительной ткани полиневропатия нередко возникает раньше других симптомов основного заболевания (табл. 14). При инфекционных полиневропатих первые симптомы появляются на высоте течения основного инфекционного заболевания, но регрессируют постепенно, иногда сохраняясь в течение нескольких недель после выздоровления. Иногда полиневропатии хронизи- руются.
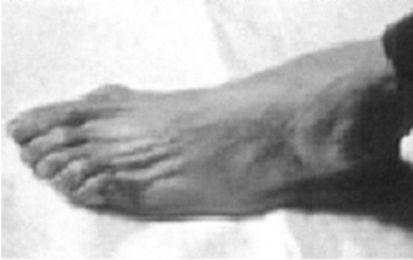
Рис. 8.4. Атрофия мелких мышц стопы при ХВДП
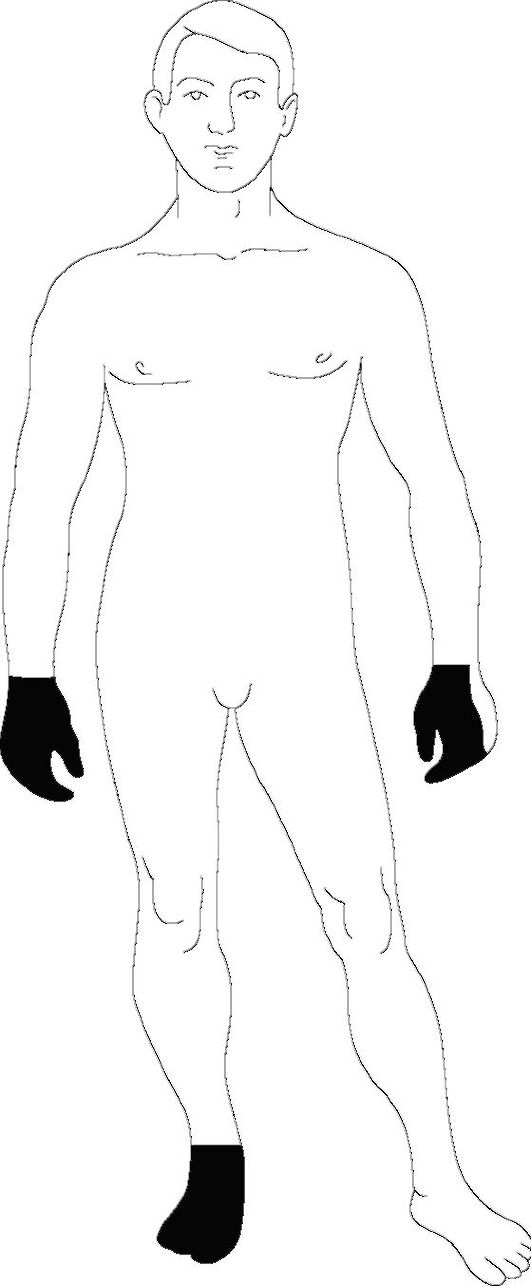
Рис. 8.5. Полиневритический тип расстройств
Таблица 14. Диагностика полиневропатий
Диагностический минимум | Возможный этиологический фактор |
Клинический анализ крови | Воспалительные изменения при постинфекционных полиневропатиях |
Общий анализ мочи | Воспалительные и аутоиммунные процессы |
Биохимическое исследование крови (с определением уровня глюкозы, мочевины, креатинина, кальция, печеночных ферментов) | Диабетическая полиневропатия многие годы может проявляться только выпадением рефлексов на ногах и нарушением глубокой чувствительности |
Электрофорез белков плазмы (определение белковых фракций) | Аутоиммунные процессы |
Рентгенография грудной клетки | Исключения злокачественного новообразования или миеломной болезни |
УЗИ брюшной полости | Исключения злокачественного но- вообразования или миеломной болезни |
Спинномозговая пункция | Повышение содержания белка при одновременном поражении спинного или головного мозга (например, при остром рассеянном энцефаломиелите) |
По показаниям проводят инструментальное исследование желудоч- но-кишечного тракта, мочеполовой системы, тесты на ревматические заболевания, анализ крови на ВИЧ-инфекцию, определяют концентрацию токсических веществ в крови, моче, слюне, волосах и гормо-
нов эндокринной системы; исключают онкологические заболевания. Особая роль в диагностике и динамическом наблюдении полиневропатии принадлежит электромиографии. Для полиневропатий характерно снижение скорости проведения импульса (СПИ) по нервам конечностей. Исключение составляют лишь некоторые формы токсических форм (например, при отравлении мышьяком, ртутью, некоторыми растворителями).
При наследственных формах проводят медико-генетическое консультирование, генетические анализы.
Дифференциальный диагноз включает полимиозит (при котором нет нарушений чувствительности и выпадения рефлексов), полиомиелит и спинную сухотку (отсутствие атрофии, специфические зрачковые симптомы).
Лечение. Этиотропное лечение направлено на прекращение посту- пления в организм токсических веществ, устранение физических воздействий, компенсацию основного заболевания. Независимо от причины назначают средства, улучшающие нервную проводимость (антихолинэстеразные препараты), микроциркуляцию и обмен веществ в нервной и мышечной тканях (препараты никотиновой кислоты, сосудистые и ноотропные препараты, витамины группы В, микроэлементы и др.). Большая роль принадлежит методам двигательной реабилитации.
Прогноз. При своевременном выявлении экзогенной причины болезни возможно полное выздоровление. В некоторых случаях сохраняются резидуальные симптомы. При наследственных формах происходит неуклонное прогрессирование болезни, и задачей терапии является стабилизация процесса и адаптация больного к уже возникшим функциональным дефектам.
8.3.3.Синдром Гийена-Барре
Синдром Гийена-Барре (СГБ) - острая воспалительная демиелинизирующая полирадикулоневропатия одно из самых тяжелых заболеваний периферической нервной системы, характеризующееся острой демиелинизацией спинномозговых и черепных нервов, вероятно, аутоиммунной природы.
СГБ наблюдается у взрослых и детей во всех районах земного шара, с незначительным преобладанием лиц мужского пола (М : Ж = 1,25 : 1). Частота встречаемости составляет в среднем 1-2 случая на 100 000 населения.
Этиология и патогенез СГБ до конца не изучены. За 2 нед развития СГБ у большинства больных отмечаются признаки респираторной или желудочно-кишечной инфекции. Основными провоцирующими
агентами считаются Campylobacter jejuni (обнаруживается в трети случаев СГБ), цитомегаловирус (до 15% случаев) и вирус Эпштейна- Барр (около 10% случаев). Аутоиммунные реакции разрушают шван- новские клетки и миелин. В развитии патологических изменений в нервах принимают участие как клеточные, так и гуморальные механизмы. Первой страдает миелиновая оболочка периферических нервов в области перехватов Ранвье; начинается и бурно нарастает инвазия миелиновой оболочки нервов сенсибилизированными макрофагами. При тяжелых формах заболевания наряду с выраженным распадом миелина возникает дегенерация аксона. Природа антител при СГБ остается неизвестной.
Клиническая картина. В течении заболевания различают три стадии.
Первая стадия - продромальная - характеризуется общим недомо- ганием, умеренным повышением температуры, парестезиями и болями в конечностях, парезами мышц. Первоначально указанные симптомы развиваются в нижних конечностях, а спустя несколько часов или дней распространяются на верхние конечности. Почти всегда наблюдается симметричное диффузное снижение мышечного тонуса; уменьшение, а затем полное выпадение сухожильных рефлексов. Характерно поражение мимической мускулатуры, менее часты нарушения глотания и диплопия (рис. 8.6-8.8). Нарушения тазовых функций в виде задержки мочеиспускания непродолжительны (3-5 дней) и наблюдаются в основном при тяжелых формах заболевания.
Двигательные нарушения:
• парезы различной степени выраженности, часто вплоть до параличей (практически у всех больных, в тяжелых случаях отмечается также поражение мышц туловища, включая мышцы шеи, спины, живота);
• мышечная слабость в конечностях обычно симметрична и больше выражена в ногах, однако возможно небольшое преобладание ее на одной стороне тела;
• слабость дыхательной мускулатуры, приводящая к необходимости ИВЛ (30% случаев);
• поражения черепных нервов - чаще VII, IX и Х (50-90% случаев).
Чувствительные нарушения:
• нарушения поверхностной чувствительности, отмечаемые у большинства больных, симметричны и асимметричны, умеренно выражены («перчатки», «носки»);
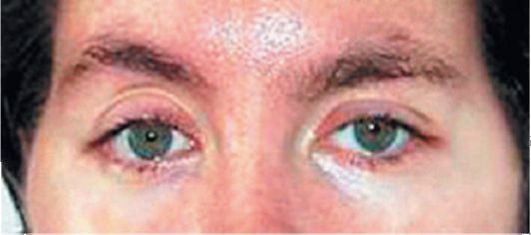
Рис. 8.6. Тотальная офтальмоплегия при синдроме Гийена-Барре
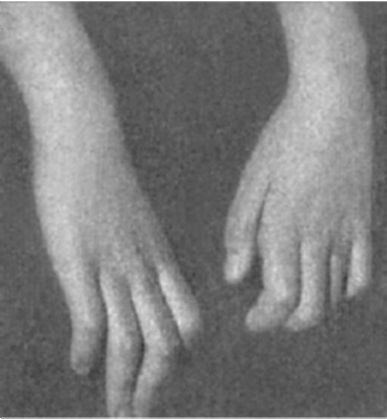
Рис. 8.7. Парез верхних конечностей при синдроме Гийена-Барре
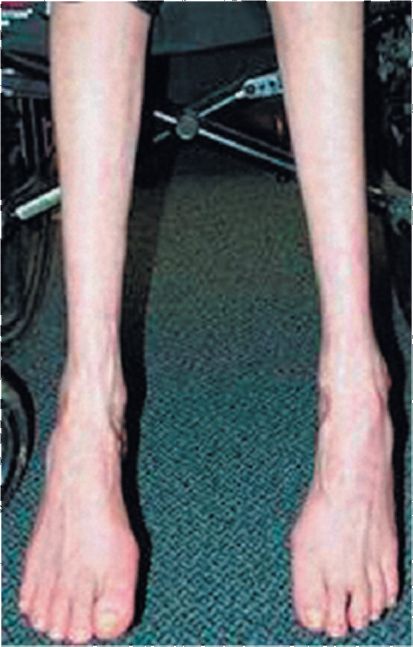
Рис. 8.8. Парез нижних конечностей при синдроме Гийена-Барре
• глубокая чувствительность (суставно-мышечное и вибрационное чувство) страдает в 20-50% случаев;
• болевой корешковый синдром (при симптомах натяжения Кернига, Ласега или изменении положения тела), боли в крупных мышцах спины и бедер в покое.
Вегетативные нарушения: нарушения дыхания и сердечной деятельности, падение артериального давления, гипергидроз туловища, ладоней, стоп.
Вторая стадия - развернутых клинических проявлений - харак- теризуется вялыми парезами или параличами рук и ног и непостоянными расстройствами чувствительности по дистальному типу; в некоторых случаях страдают проксимальные отделы конечностей и черепные нервы. Симптомы симметричны. В СМЖ часто обнаруживают белково-клеточную диссоциацию.
Третья стадия - резидуальная: при отсутствии общих инфекционных симптомов сохраняются параличи и нарушения чувствительности.
Классификация. СГБ бывает легкой, средней (умеренные парезы, болевой синдром и нарушения чувствительности) и тяжелой (развитие нарушений дыхания) степени. В наиболее тяжелых случаях у больных наблюдаются тотальные параличи всех поперечно-полосатых
мышц. Перед глазами врача предстает человек, неподвижно лежащий в постели с закрытыми глазами и не реагирующий движениями, мимикой или словами ни на какие внешние раздражения. Дыхание его под- держивается с помощью аппарата ИВЛ. При пассивном поднимании век больного его глаза могут стоять по средней линии, рефлексы со слизистых (глоточный и нёбный) не вызываются, сухожильные рефлексы отсутствуют. Однако при СГБ никогда не происходит нарушения сознания. Следовательно, пытаться добиться каких-либо ответных реакций у таких больных с помощью приемов, применяемых при обследо- вании пациентов, находящихся в коме (давление на грудину, уколы и другие болевые раздражения), недопустимо.
У подавляющего большинства больных отмечается быстрое и практически полное восстановление, но в трети случаев развиваются нарушения дыхания, требующие проведения ИВЛ; у 5-22% пациентов отмечаются остаточные явления; в 3-10% случаев наблюдаются рецидивы и от 5 до 33% больных с тяжелыми формами заболевания умирают. Правильная тактика лечения непременно дает положительные результаты уже через несколько дней.
Диагностические критерии СГБ (ВОЗ, 1993):
А. Обязательные критерии
• Прогрессирующая мышечная слабость более чем в одной конечности.
• Снижение рефлексов различной степени тяжести. Б. Дополнительные критерии (в порядке значимости)
• Прогрессирование: симптомы двигательных нарушений быстро прогрессируют, достигают плато к концу 4-й нед от начала заболевания.
• Относительная симметричность поражения.
• Чувствительные нарушения.
• Черепные нервы: характерно поражение лицевого нерва.
• Восстановление: обычно начинается через 2-4 нед после прекращения нарастания заболевания.
• Вегетативные нарушения: тахикардия, аритмии, постуральная гипотензия, гипертензия, вазомоторные симптомы.
• Отсутствие лихорадки в начале заболевания (только в редких случаях из-за интеркуррентных инфекций или по другим причинам).
Изменения ЦСЖ: повышение содержания белка, число мононуклеарных лейкоцитов не превышает 10. Если число клеток больше 20, необходимо исключать другие заболевания.
ЭМГ выявляет признаки демиелинизации.
Дифференциальный диагноз. У детей до 1 года следует исключать детский ботулизм, для которого, помимо выраженной мышечной атрофии, характерны нарушения зрачковых реакций (мидриаз), осиплость голоса за счет снижения саливации и сухости голосовых связок, рвота, болезненность при пальпации живота, запоры и парез кишечника. При вирусном миозите у более старших детей в крови повышается уровень креатинфосфокиназы, а показатели ЦСЖ, ЭМГ остаются в пределах нормы. Поражения спинного мозга (опухоли, воспалительные процессы) характеризуются сегментарными чувствительными и двигательными расстройствами, стойкими тазовыми нарушениями, отсутствием поражения мимической и дыхательной мускулатуры при грубом тетрапарезе; в качестве подтверждения проводят КТ или МРТ спинного мозга.
Отличить острый вялый паралич при полиомиелите и полиомиелитоподобных заболеваниях, вызванных энтеровирусами, можно с помощью клинической симптоматики (интоксикация, асимметричность поражения, отсутствие чувствительных расстройств), вирусологических (выделение вируса полиомиелита) и серологических исследований (повышение титра специфических антител в сыворотке). Исключить клещевой энцефалит в эндемичных районах помогает тщательно собранный анамнез (лихорадка после укуса клеща), исследования
ЦСЖ и ЭНМГ.
Лечение. Больные нуждаются в наблюдении с оценкой функции внешнего дыхания, сердечного ритма, АД, состояния бульбарной мускулатуры. При подозрении на развитие дыхательных нарушений ребенка необходимо перевести в палату интенсивной терапии. При бульбарном параличе показаны интубация и установка назогастрального зонда.
Плазмаферез выполняют в объеме не менее 35-40 мл плазмы/кг массы тела за один сеанс, 4-5 сеансов с интервалом не более суток. Показания для плазмафереза: 1) нарастание неврологической симптоматики у больных, находящихся на ИВЛ; 2) неспособность пройти более 5 м с опорой или поддержкой; 3) способность вставать и медленно пройти свыше 5 м самостоятельно.
Внутривенная пульс-терапия иммуноглобулинами класса G. Стандарт- ный курс лечения - внутривенное введение препарата из расчета 0,4 г/кг массы тела больного ежедневно в течение 5 сут.
Исключительно важны для выздоровления мероприятия, направленные на уход за больным и купирование осложнений - дыхательных
и бульбарных расстройств, зондовое питание; контроль за состоянием мочевого пузыря и кишечника; пассивная гимнастика и ежедневный массаж; психологическая поддержка. Кортикостероиды при СГБ неэффективны.
Прогноз у детей с синдромом Гийена-Барре в целом благоприятный. Однако достаточно высок процент остаточных явлений, к которым относятся сохраняющаяся мышечная слабость в дистальных отделах конечностях, постуральный тремор и т.д. Восстановление может продолжаться 1,5-2 года. Резидуальные нарушения более выражены у детей старше 5 лет и чаще наблюдаются у мальчиков. Смертность больных с СГБ в настоящее время определяется прежде всего квалификацией медицинского персонала клиник. Наиболее частыми причинами смерти являются бронхопневмонии и респираторный дистресс-синдром взрослых, связанный с тромбоэмболией легочной артерии, сепсисом, аспирацией.
8.3.4. Хроническая воспалительная демиелинизирующая полиневропатия
Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) характеризуется медленным началом; прогредиентным, прогредиентно-ремиттирующим и стационарным течением вялых парезов конечностей; легкими дистальными нарушениями чувствительности, белково-клеточной диссоциацией и дизиммуноглобулинемией. У ряда больных поражаются черепные нервы, появляются вестибуломозжечковые расстройства. Общность клинических, иммунологических, лабораторных и электрофизиологических данных позволяет считать ХВДП и синдром Гийена-Барре аутоиммунным заболеванием.
В отличие от синдрома Гийена-Барре ХВДП характеризуется более медленным развитием (фаза прогрессирования обычно продол- жается не менее 2 мес), отсутствуют указания на предшествующую инфекцию, отмечаются более выраженные нарушения чувствительности, в том числе глубокой, но реже встречается болевой синдром. Возможно рецидивирующее течение, но чаще наблюдается неуклонное или ступенчатое прогрессирование. Лечение начинают с плазмафереза или кортикостероидов. При недостаточной эффективности или плохой переносимости кортикостероидов добавляют азатиоприн или проводят лечение иммуноглобулином.
8.3.5. Другие полиневропатии
Дифтерийная полирадикулоневропатия возникает под действием экзотоксина, который, проникая в периферические нейроны, нарушает
синтез белка миелина, что по истечении латентного периода приводит к демиелинизации черепных нервов и нервных корешков. Страдают преимущественно передние корешки, в меньшей степени - задние. Вероятность развития и тяжесть полиневропатии зависят от тяжести дифтерии в начальном периоде. Неврологические симптомы осложняют дифтерию в 3-5% случаев.
Ранние параличи развиваются одновременно или через короткие промежутки времени после ангины, возникают поблизости от инфекционного очага в результате непосредственного контактного связывания токсина нервными волокнами, находящимися в пораженных тканях. Паралич мягкого нёба, нарушение чувствительности в области глотки, снижение глоточного рефлекса появляются на 3-4-й нед от начала заболевания. На 4-5-й нед появляется нарушение аккомодации, на 5-7-й нед - паралич мышц глотки, гортани, диафрагмы. Возможно поражение лицевого, слухового нервов, двигательной порции тройничного, добавочного и подъязычного нервов.
Вовлечение в патологический процесс диафрагмального нерва приводит к параличу диафрагмы, который осложняется аспирационной пневмонией в результате анестезии зева, гортани, паралича надгортанника, дисфагии.
При ранних формах часто поражаются сердечные ветви блуждающего нерва, появляются брадикардия, затем тахикардия, аритмия; возникают изменения миокарда (причина возможной внезапной смерти). Несколько позже могут присоединиться параличи глазных мышц. Чаще всего избирательно поражаются волокна III черепного нерва, идущие к аккомодационным мышцам, главным образом m.ciliaris. Клинически это выражается нарушением процесса чтения при сохранении реакции зрачков на свет, реже наблюдается поражение отводящего и блокового нервов.
Поздние параличи развиваются спустя 1-2 мес после начала заболевания (чаще на 50-й день) с вовлечения дистальных отделов нижних конечностей. В последующем параличи распространяются на проксимальные отделы ног, мышцы рук и туловища, дыхательную мускулатуру. В части случаев преобладают нарушения глубокой чувствительности с развитием сенситивной атаксии. В ЦСЖ отмечается значительное повышение содержания белка, иногда легкий лимфоцитарный плеоци- тоз. Смертельные исходы связаны с параличом дыхательных мышц и поражением сердца. У выживших больных восстановление начинается спустя несколько дней или недель от момента появления первых сим-
птомов и обычно занимает от нескольких недель до нескольких месяцев. Общая продолжительность заболевания колеблется от нескольких месяцев до года и более. Восстановление происходит быстрее при атаксии и медленнее при параличе. Прогноз становится исключительно серьезным при поражении блуждающего и диафрагмального нервов.
В острой стадии инфекции вводят антитоксическую сыворотку, которая при условии раннего введения (особенно в первые 48 ч) уменьшает вероятность и тяжесть неврологических осложнений. Однако в тот период, когда появляются неврологические симптомы, специфическая терапия уже неэффективна. Основу лечения составляет симптоматическая терапия. В период восстановления проводят лечебную гимнастику, массаж, электростимуляцию.
Гриппозная полиневропатия. Возможность проникновения вируса гриппа в периферические нервы не доказана. Однако описаны полиневриты, развивающиеся обычно спустя 7-14 дней после острого периода гриппа. Появляются ощущения онемения и боли в дистальных отделах конечностей с постепенным распространением на проксимальные отделы. Наиболее характерны сенсорные формы без парезов, со снижением рефлексов и поверхностной чувствительности по полиневритическому типу. Иногда обнаруживаются легкие вялые тетрапарезы с чувствительными нарушениями по дистальному типу. Отмечаются вегетативные нарушения: сухость или влажность кожи кистей и подошв, похолодание конечностей, изменение кожной температуры. В крови повышена СОЭ, лейкоцитоз. Состояние больных улучшается через 2-3 нед заболевания, а полное восстановление происходит через 1-2 мес.
Ботулиническая полиневропатия сопровождается блокадой нервномышечного синапса с развитием мышечной слабости и нарушением движений. Ботулинический токсин при приеме внутрь не проникает через гематоэнцефалический барьер. Клинические симптомы разворачиваются через несколько часов после употребления недобро- качественных консервов, колбас, в которых размножается бактерия ботулизма. Появляются рвота, понос, боли в животе, сухость слизистых оболочек и кожи. Вскоре присоединяются паралич аккомодации, мидриаз, диплопия, расстройства фонации, глотания, слабость мышц шеи. Без лечения в 50-60% случаев наступает смерть. После специфической терапии (введение сыворотки) начинается регресс симптомов. В начальной стадии болезни решающим фактором для диагностики служит исследование крови для выявления токсина и
его типа. Брать кровь у больных надо до введения антитоксической сыворотки. Дифференциальный диагноз следует проводить с некоторыми энцефалитами, другими полиневропатиями. Особый интерес представляет дифференциальный диагноз с миастенией, проявляющейся синдромом «бульбарного паралича».
Полиневропатии при диффузных заболеваниях соединительной ткани. Эта группа заболеваний связана с патологией соединительной такни, которая составляет важную часть сосудистой стенки и входит в состав периферических нервов. Поэтому коллагенозы нередко сопровождаются поражением периферической нервной системы. Полиневропатии при узелковом периартериите возникают в 25-27% случаев. В начале заболевания появляются стреляющие, жгучие боли в мышцах и фиброзных тканях. Затем присоединяются двигательные нарушения.
Полиневропатии при системной красной волчанке (СКВ) наблюдаются у 10-13% больных вследствие поражения главным образом сосудов с нарушением кровообращения. Обычно во время обострения СКВ появляются ощущения покалывания, жжения, ползания мурашек в дистальных областях конечностей. Эти ощущения не сопровождаются болями и выраженными двигательными расстройствами. Могут отмечаться слабость дистальных отделов конечностей, повышенная утомляемость при ходьбе. Развиваются легкая атрофия мелких мышц кистей, стоп, иногда мышц голени, снижение сухожильных рефлексов.
Порфирии - заболевания, при которых частично или полностью снижена активность ферментов биосинтеза гема. Периферическая полиневропатия наблюдается при «печеночных» порфириях, которые наследуются по аутосомно-доминантному типу. Характерно острое начало с развитием тахикардии, гипертензии, постуральной гипотензии. В большинстве случаев наблюдается двигательная полиневропатия, которой иногда могут предшествовать боли в конечностях, спине. Верхние конечности поражаются в большей степени, чем нижние. Нередко возникает парез лицевых и глазных мышц. По данным ЭНМГ выявляют признаки аксональной дегенерации с незначительным снижением скорости проведения импульса по нервному волокну.
Диабетическая полиневропатия - частое осложнение сахарного диабета. Поражение периферических нервов протекает бессимптомно, но тщательное клиническое обследование позволяет выявить
снижение мышечной силы в дистальных отделах нижних конечностей, снижение или отсутствие глубоких рефлексов, атрофию мышц ладоней и стоп. По данным ЭНМГ у больных сахарным диабетом выявляется демиелинизация нервов, значительное снижение скорости проведения нервного импульса. Оно происходит уже в первые 2 года заболевания, нередко при отсутствии клинических проявлений. Гистологическое исследование мышц и нервов при сахарном диабете выявляет дистрофические изменения в виде демиелинизации и фрагментации осевых цилиндров. Различают невропатию черепных и спинномозговых нервов (дистальная невропатия). При сахарном диабете преобладают чувствительные невропатии. Чаще страдают чувствительные функции I, II, V, IX, X нервов, что проявляется умеренным двусторонним снижением обоняния, вкуса, слуха, зрения. Лишь в редких случаях вовлекаются двигательные (III, V, XI, XII) черепные нервы. При поражении спинномозговых нервов развивается дистальная полиневропатия с гиперестезиями и гипестезиями сначала в ногах, затем в руках. Двигательные расстройства развиваются реже и позже чувствительных. Вегетативные нарушения при диабетической полиневропатии весьма различны по характеру и тяжести (от сухости, шелушения и истончения кожи до выпадения зубов и волос, возникновения трофических язв, гангрен и мутиляций пальцев). Степень выраженности клинических проявлений диабетической полиневропатии зависит от стажа и адекватного лечения сахарного диабета. В лечении диабетической полиневропатии на первом месте стоит нормализация уровня глюкозы в крови, то есть коррекция основного заболевания. Больным также назначают препараты группы В (нейромультивит, мильгамма) и липоевой кислоты (тиогамма, тиоктацид), ЛФК, массаж. Лечение проводят курсами длительностью 1-1,5 мес по 2-3 раза в год.
Экзогенно-токсические невропатии. При отравлениях ядами основную роль в поражении периферических нервов отводят аллергическим реакциям, инактивации ферментов или взаимодействию яда с коферментами и нарушению метаболизма липидов. Токсины поражают и ЦНС с развитием миелополиневропатии или энцефаломиелополира- дикулоневропатии. При этом в одних случаях преобладают поражения головного или спинного мозга, в других - периферических нервов.
При отравлении различными токсинами преобладают двигательные, чувствительные или вегетативные нарушения. Примером преимущественно двигательной полиневропатии могут служить пора-
жения при отравлении хлорофосом, свинцом, триортокрезилфосфатом. Преимущественно чувствительная и вегетативная полиневропатия развивается при отравлении органическими соединениями мышьяка, а также при хроническом алкоголизме. При отравлении ртуть-содержащими веществами, кроме полиневропатии с грубыми двигательными, чувствительными и трофическими нарушениями, нередко формируются явления энцефалопатии.
Отравление мышьяком. Первые симптомы неспецифичны: тошнота, рвота, диарея, боли в животе, потливость и тахикардия, иногда сопровождающиеся резким снижением артериального давления. Явления периферической полиневропатии присоединяются через 2-3 нед. Развивается сенсорная невропатия, при которой в большей степени страдают суставно-мышечное чувство, чувство вибрации. При более обширном поражении наблюдается мотосенсорная невропатия в дистальных отделах конечностей. Тяжесть состояния зависит от дозы мышьяка. Восстановление длительное - от нескольких месяцев до нескольких лет. При хроническом отравлении мышьяком, причиной которого может быть прием ребенком ряда лекарственных препаратов, содержащих мышьяк, возникают жалобы на недомогание, повышенную утомляемость, мышечную слабость, отсутствие аппетита, чувство тошноты. В клинической картине отмечаются гиперкератоз, пигментация кожных покровов, появление отечности, а также парестезии и чувство онемения в конечностях. Диагноз подтверждают с помощью лабораторных методов исследования: определения концентрации мышьяка в крови, моче, его содержания в волосах, ногтях. Лечение отравлений мышьяком проводится комплексонами - пеницилламином или британским антилюизитом.
Отравление свинцом происходит у детей при глотании или вдыхании краски, инородных тел, содержащих свинец (рыболовные грузила, части игрушек). В отличие от взрослых, у детей чаще развивается энцефалопатия, чем периферическая полиневропатия. Хроническое отравление свинцом у детей проявляется бледностью кожных покровов, апатичностью, повышенной утомляемостью. При осмотре на ног- тях выявляется поперечная исчерченность белыми полосками. В более тяжелых случаях появляются тошнота, повторная рвота, атактическая походка, судороги, нарушение сознания. Присоединившаяся периферическая полиневропатия больше моторная, чем сенсорная, сопровождается развитием вялого дистального пареза в нижних конечностях, формированием степпажа («петушиной походки»). Для подтверждения
диагноза определяют концентрацию свинца, выделенного с мочой в 1-й день терапии комплексонами (хелатообразующими соединениями). В лечении отравлений свинцом также применяется комплексон - сукцимер, увеличивающий выделение свинца с мочой.
Алкогольная полиневропатия вызвана дефицитом витамина В1 и фолиевой кислоты или непосредственным токсическим действием алкоголя. Подостро развиваются слабость, боли и парестезии в дистальных отделах ног, которые постепенно переходят на руки и проксимальные отделы. Характерны выпадение ахилловых рефлексов, чувство похолодания или жжения в стопах, болезненные спазмы мышц голени (крампи), болезненность мышц и нервных стволов, выраженные вегетативные нарушения (усиленное потоотделение на стопах, истончение и цианоз кожных покровов, импотенция, дисфункция желудочнокишечного тракта). При отказе от алкоголя, назначении витаминов группы В, а также фолиевой кислоты возможно полное восстановление в течение нескольких месяцев. К быстрому восстановлению приводит парентеральное введение тиамина (витамин В1) в высоких дозах - до 1000 мг/сут (20 ампул 5% раствора). Выздоровлению способствуют лечебная физкультура, массаж и физиотерапевтические процедуры.
8.3.6. Наследственные моторно-сенсорные полиневропатии (НМСН)
Гетерогенная группа генетически детерминированных заболеваний, которые проявляются множественным поражением двигательных и чувствительных волокон периферических нервов. НМСН характеризуются различными клиническими проявлениями и течением, а также характером ЭНМГ и морфологических изменений. Известно несколько типов НМСН. Наиболее частые из них обусловлены демиелинизацией или дегенерацией аксона. Выделяют несколько типов наследственных полиневропатий.
I тип - демиелинизирующие НМСН, развиваются вследствие демиелинизации нервов в результате различных специфических мутаций генов синтеза миелиновых белков. При ЭНМГ выявляется значительное снижение скорости проведения импульсов (СПИ).
II тип - аксональные НМСН. Их морфологической основой служит аксональная дегенерация при сохранности миелиновых оболочек периферических нервов. Установлено несколько локусов генетического сцепления на разных хромосомах. При ЭНМГ, как правило, СПИ в норме, тогда как амплитуда мышечных ответов значительно снижена.
Описаны тяжелая ранняя детская форма НМСН, характеризующаяся быстрым прогрессированием, значительными костными дефор-
мациями конечностей и грудной клетки (гипертрофический неврит Дежерина-Сотта), болезнь Рефсума (нарушение обмена фитановой кислоты, избыток которой токсически действует на периферические нервы и ЦНС), НМСН с пирамидными симптомами, НМСН с поражением сетчатки и зрительного нерва.
Клиническая картина. Первые клинические признаки заболевания появляются чаще в детском возрасте - в 5-12 лет. Срок дебюта и тип течения зависят от типа наследования НМСН. При аутосомнорецессивных формах НМСН и I, и II типов, как правило, наблюдаются раннее начало болезни в 5-10 лет жизни и высокая скорость прогрессирования, тогда как при аутосомно-доминантном наследовании первые проявления возникают позже, а течение относительно доброкачественное.
Двигательно-рефлекторные нарушения. В типичных случаях заболевание начинается с симметричной мышечной слабости, чаще в перонеальной группе мышц. Слабость разгибателей стопы приводит к тому, что при ходьбе пациент высоко поднимает бедра, чтобы не задеть пальцами стопы о землю. При каждом шаге возникает громкий звук, поэтому такой тип походки называется «степпаж». У большинства больных отмечается атрофия передних мышц голени, иннервируемых n. peroneus. Вследствие атрофии мышц голеней постепенно формируется «полая стопа» с высоким сводом, или pes equinum. Деформация стоп развивается почти у всех больных с НМСН I типа и у половины больных с НМСН II типа. В развернутой ста- дии НМСН ноги могут приобретать форму «опрокинутых бутылок» или «галифе». По мере прогрессирования денервационных амиотрофий развиваются ретракции ахилловых сухожилий и формируются сгибательные контрактуры голеностопных суставов. В некоторых случаях симптомы НМСН начинаются атипично - с изолирован- ных амиотрофий мышц кистей и предплечий. Слабость бульбарных и лицевых мышц для НМСН нехарактерна. У подавляющего числа больных НМСН I типа снижены сухожильные рефлексы, причем в 60% случаев они отсутствуют. Наиболее рано выпадают ахилловы рефлексы. При НМСН II типа изменения со стороны сухожильных рефлексов выражены в значительно меньшей степени, чем при I типе. В развернутой стадии исчезают и поверхностные рефлексы.
Чувствительные нарушения включают полиневритический тип расстройств поверхностных и глубоких видов чувствительности. Частота чувствительных нарушений при НМСН I типа достигает
70%. На первом месте стоят нарушения вибрационной чувствительности, затем - болевой и температурной в виде гиперестезий, гипестезий и иногда гиперпатий. Для НМСН II типа, особенно доминантных форм, чувствительные нарушения менее типичны, они встречаются приблизительно у 50% больных.
Вегетативно-трофические нарушения. Хотя НМСН характеризуются преимущественным вовлечением в патологический процесс двигательных и чувствительных волокон, в большинстве случаев выявляются вегетативные расстройства различной степени выраженности, что указывает на заинтересованность периферических звеньев вегетативной нервной системы. Могут быть выявлены гиперили ангидроз кистей и стоп, дистальная гипотермия конечностей, деколорация кожи, локальный гипотрихоз вследствие выпадения волос на ногах. Иногда возникают тяжелые вегетативно-трофические рас- стройства в виде язв пальцев стоп.
Атаксия и другие симптомы. Атаксия - довольно частый клинический синдром, сопутствующий НМСН, особенно в случаях аутосомнодоминантной НМСН I типа (в 30% случаев). Атаксия при НМСН, как правило, носит сенситивный, «заднестолбовой» характер. Случаи НМСН I типа с выраженной атаксией и тремором смешанного (интенционного и фасцикулярного) характера ранее называли «синдром Руси-Леви». Клинические особенности синдрома включают отсутствие выраженных атрофий, доброкачественное течение с компенса- цией двигательных нарушений. На ЭНМГ выявляют парадоксально низкую СПИ по периферическим нервам, что свидетельствует о грубой сегментарной демиелинизации. Синдром Руси-Леви в настоящее время рассматривается как один из вариантов аутосомно-доминантной
НМСН I типа.
Наследственные сенсорные и вегетативные невропатии. Существует как минимум 5 клинических форм наследственных сенсорных и вегетативных полиневропатий, которые характеризуются преимущественным поражением периферических и чувствительных нервов. Распространенность этих состояний составляет 1 на 25 000, что приблизительно в 10 раз меньше, чем НМСН I типа.
Клиническая картина. При дегенерации афферентных волокон большого диаметра преимущественно нарушается чувствительность. Если страдают мелкие афферентные и вегетативные волокна, снижается болевая и температурная чувствительность, что сопровождается вегетативными и трофическими нарушениями. Наиболее частым заболе-
ванием из всех наследственных сенсорно-вегетативных невропатий является наследственная сенсорная радикулярная невропатия, тип I. Она наследуется по аутосомно-доминантному типу и характеризуется чувствительными нарушениями в дистальных отделах нижних конечностей, хроническим изъязвлением стоп и прогрессирующей деструкцией костей этой же области. При аутопсии обнаруживают дегенерацию спинальных ганглиев и задних корешков тех сегментов спинного мозга, которые иннервируют нижние конечности.
Заболевание начинается после 10 лет с прогрессирующего снижения чувствительности в нижних конечностях, которое сочетается с возникновением безболезненных ран и трофических язв. При неврологическом осмотре выявляются нарушение болевой чувствительности, извращение потоотделения. В процесс могут вовлекаться и дистальные отделы верхних конечностей. Бывают непродолжительные приступы боли, напоминающие прострел при спинной сухотке. Большинство случаев сопровождается невральной глухотой. При гистологическом исследовании выявляют уменьшение числа немиелинизированных волокон. Скорости проведения импульса не нарушены, но потенциалы действия чувствительных нервов отсутствуют.
Лечение. В настоящее время этиотропная терапия наследственных невропатий не разработана. Симптоматическая терапия направлена на стабилизацию состояния и профилактику осложнений. Назначают физиотерапию, лечебную физкультуру и массаж, ортопедическую коррекцию, медикаментозную терапию.