Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА 3. "ОПРЕДЕЛЕНИЕ МАССЫ КАЛЬЦИЯ(II) В РАСТВОРЕ"
Цель работы
Научиться применять метод осаждения для определения массы вещества в растворе.
Целевые задачи
1. Доведение тигля до постоянной массы.
2. Расчет массы кальция(II), необходимой для выполнения анализа с допустимой погрешностью.
3. Получение осаждаемой формы в виде мелкокристаллического осадка кальция оксалата. «Созревание» осадка.
4. Отделение осадка кальция оксалата от маточного раствора фильтрованием.
5. Промывание осадка кальция оксалата.
6. Получение гравиметрической формы кальция сульфата путем прокаливания осадка кальция оксалата, превращения продуктов термического разложения последнего в кальция сульфат и прокаливания полученного осадка до постоянной массы.
7. Расчет массы кальция(II) в растворе.
8. Статистическая обработка результатов параллельных определений массы кальция(II) в растворе.
Задание для самоподготовки
К занятию необходимо знать: см. выше п.п. 1-4, 6 в, 7.
К занятию необходимо уметь: см. выше, п.п. 1, 2 в, 3, 5.
Вопросы для самопроверки: см. выше п.п. 1-4, 5 в, 6 в, 10-13, 15, 16 а,
17-20, 23-34.
Материальное обеспечение
Посуда (в расчете на 1 студента): бюретка вместимостью 25 мл - 1 шт.
Остальное - см. выше лабораторную работу 1.
Реактивы (квалификации «ч.д.а.» или «х.ч.»)
1. Соли кальция: нитрат или хлорид.
2. Кислота соляная, 6 моль/л (1:1) раствор.
3. Кислота серная, 4 моль/л раствор
3. Аммиак, 10% раствор.
4. Аммония оксалат, 5% раствор.
5. Метиловый оранжевый, 0,1% раствор.
Приборы
1. Бани водяные.
2. Баня песчаная.
Остальное - см. выше лабораторную работу 1.
Учебные таблицы.
Методика определения массы кальция(II) в растворе методом осаждения
1. Сущность методики
Кальций(II) осаждают в виде мелкокристаллического осадка моногидрата кальция оксалата:
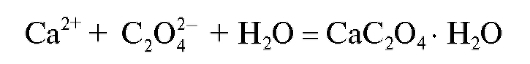
при минимальном пересыщении раствора относительно осаждаемой формы.
Согласно методике осадитель аммония оксалат вводят в сильнокислый раствор соли кальция, в котором осадок кальция оксалата не образуется благодаря протеканию конкурирующей реакции протонизации оксалат-иона:
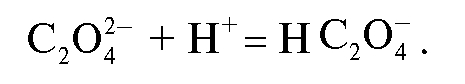
Затем к прозрачному раствору медленно, по каплям добавляют раствор аммиака до рН 4 (индикатор - метиловый оранжевый). При этом концентрация оксалат-иона постепенно повышается и происходит осаждение моногидрата кальция оксалата - осаждаемой формы. Для понижения растворимости осадка в кислой среде вводят большой избыток осадителя. В данном случае кальция оксалат образует мелкокристаллический осадок, поэтому после осаждения раствор с осадком оставляют на некоторое время для укрупнения и совершенствования кристаллов осаждаемой формы («созревания» осадка).
4 (индикатор - метиловый оранжевый). При этом концентрация оксалат-иона постепенно повышается и происходит осаждение моногидрата кальция оксалата - осаждаемой формы. Для понижения растворимости осадка в кислой среде вводят большой избыток осадителя. В данном случае кальция оксалат образует мелкокристаллический осадок, поэтому после осаждения раствор с осадком оставляют на некоторое время для укрупнения и совершенствования кристаллов осаждаемой формы («созревания» осадка).
Для отделения полученного мелкокристаллического осадка кальция оксалата от маточного раствора используют плотный беззольный бумажный фильтр «синяя лента». Вследствие довольно заметной растворимости кальция оксалата (KS0 = 2,3 • 10-9) осадок отмывают от примесей разбавленным раствором аммония оксалата (летучим электролитом, содержащим одноименный с осадком ион). Из одной и той же осаждаемой формы - моногидрат кальция оксалата - можно получить несколько гравиметрических форм (ГФ), в различной степени пригодных для цели анализа (см. «Справочник»).

Первые две гравиметрические формы (ГФ1 и ГФ2) трудно получить с точным стехиометрическим составом. Кроме того, эти формы гигроскопичны, поэтому их редко используют на практике.
ГФ3 (кальция карбонат) обладает некоторыми преимуществами перед ГФ4 (кальция оксидом): эта форма, в отличие от последней, не гигроскопична и имеет меньший гравиметрический фактор (0,4004 против 0,7147). Однако для ее получения необходимо поддерживать температуру в очень узких пределах (450-550 °C), что на газовой горелке или в муфельной печи трудно осуществить. Именно поэтому обычно при прокаливании получают смесь кальция карбоната и кальция оксида.
В связи с этим более надежным считают получение в качестве ГФ кальция оксида путем прокаливания осадка при температуре выше 900 °C, при которой происходит практически полное превращение кальция карбоната в кальция оксид.
В настоящей работе в качестве ГФ используется кальция сульфат (ГФ5). Преимуществом использования этой формы перед кальция оксидом является меньший гравиметрический фактор (0,2944) и устойчивость к углекислому газу.
К сожалению, кальция сульфат, так же как и кальция оксид, гигроскопичен, поэтому при измерении массы кальция сульфата требуется принимать определенные меры предосторожности.
Для получения ГФ5 продукты термического разложения кальция оксалата (смесь кальция карбоната и кальция оксида) обрабатывают серной кислотой:
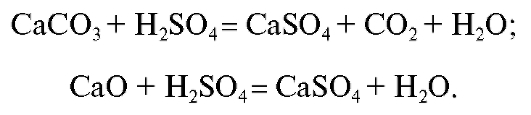
Затем полученный осадок высушивают и прокаливают до постоянной массы при температуре 900 °C.
2. Предварительные расчеты
Расчет массы кальция, необходимой для выполнения анализа с допустимой погрешностью ±0,2%. Для того, чтобы процентная погрешность определения не превышала ±0,2%, масса гравиметрической формы должна быть не менее 0,1 г. Для кристаллических осадков оптимальная масса ГФ ~0,1-0,5 г. В данном случае она принята за 0,3 г. Тогда масса кальция, подлежащая анализу, должна быть равна примерно
0,1 г:
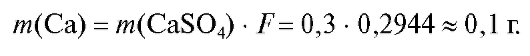
3. Доведение тигля до постоянной массы
Прокаливание тигля до постоянной массы проводят в муфельной печи при температуре около 900 °C (см. лабораторную работу 1).
4. Получение осаждаемой формы
Полученный от преподавателя анализируемый раствор в стакане вместимостью 300-400 мл, содержащий около 0,1 г кальция(II), разбавляют 150-200 мл дистиллированной воды и приливают к нему по стеклянной палочке 40 мл 5% раствора аммония оксалата. Выделившийся осадок сразу же растворяют в минимальном объеме 6 моль/л раствора соляной кислоты, добавляя его по каплям при перемешивании. Полученный раствор нагревают до 60-70 °C на водяной бане, добавляют 2 капли индикатора метилового оранжевого и медленно, по каплям, из бюретки приливают 10% раствор аммиака до изменения окраски из розовой в желтую (рН 4). Осадок настаивают под маточным раствором не менее двух часов.
4). Осадок настаивают под маточным раствором не менее двух часов.
5. Отделение осадка от раствора фильтрованием
Для отделения осадка от раствора используют плотный беззольный фильтр «синяя лента». (Техника и приемы фильтрования - см. лабораторную работу 1)
6. Промывание осадка
В качестве промывной жидкости используют 1% раствор аммония оксалата. (Техника и приемы промывания осадка - см. лабораторную работу 1) Промывание заканчивают, когда осадок будет полностью отмыт от хлорид-иона.
7. Получение гравиметрической формы
Осадок на фильтре подсушивают в сушильном шкафу, переносят в доведенный до постоянной массы фарфоровый тигель и озоляют (см. лабораторную работу 1). Прокаливание тигля с осадком проводят на газовой горелке до полного выгорания углерода, после чего тигель охлаждают, осторожно смачивают осадок в тигле несколькими каплями воды из пипетки, а затем 2-3 мл 4 моль/л раствора серной кислоты. Для удаления избытка серной кислоты тигель помещают на горячую песчаную баню под тягой и нагревают до прекращения выделения белых паров. Полученный осадок кальция сульфата доводят до постоянной массы прокаливанием на газовой горелке или в муфельной печи при температуре
около 900 °С.
8. Расчет результата анализа
Массу гравиметрической формы определяют, вычитая
определяют, вычитая
из постоянной массы тигля с осадком постоянную массу тигля. Массу кальция рассчитывают по формуле:
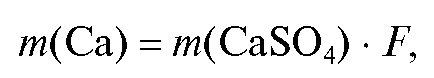
где гравиметрический фактор пересчета:
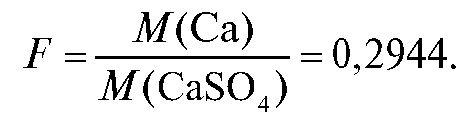
9. Статистическая обработка результатов параллельных определений массы кальция(II) в растворе
Статистическую обработку проводят по массе кальция m(Са), как описано выше.
10. Проверка результата анализа
См. выше.
Контрольные вопросы
1. В чем состоит сущность гравиметрического метода осаждения? Разберите на примере осаждения кальция(II) в виде кальция(II) оксалата.
2. Какие реакции протекают при прокаливании осадка кальция оксалата? Укажите температурный интервал, в котором протекает та или иная реакция.
3. Какие гравиметрические формы можно использовать для определения кальция(II) при получении в качестве осаждаемой формы моногидрата кальция оксалата?
4. Какую гравиметрическую форму вы использовали при определении кальция(II)? Как вы ее получали?
5. Как рассчитать массу кальция(II), необходимую для выполнения гравиметрического определения с погрешностью не более
чем ±0,2%?
6. Почему при осаждении кальция по приведенной в работе методике необходимо добавлять большой избыток осадителя?
7. Какую промывную жидкость и почему именно ее используют для промывания осадка кальция оксалата?