Аналитическая химия. Количественный анализ. Физико-химические методы анализа: учебное пособие / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева. - 2012. - 368 с.: ил.
|
|
|
|
ТЕМА IV. МЕТОДЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
На изучение темы отводят два занятия, включающие краткое рассмотрение основных теоретических положений, решение задач по теме и экспериментальную часть.
Цель изучения темы
На основе знаний теории равновесных процессов в растворах комплексных соединений, сущности метода комплексонометрии и навыков работы по титриметрическому анализу научиться выполнять комплексонометрическое титрование и обосновывать условия его проведения; научиться строить кривые комплексонометрического титрования и выбирать индикатор для титрования; научиться выполнять количественные расчеты содержания определяемого вещества в анализируемом растворе по результатам титрования.
Целевые задачи
1. Научиться проводить количественное определение катионов металлов в растворе с использованием метода комплексонометрического титрования.
2. Научиться проводить расчеты количественного содержания определяемых веществ в растворе по результатам титрования и статистическую обработку результатов анализа.
3. Оформление протокола выполненной лабораторной работы.
Общая характеристика методов
Комплексонометрическое титрование - метод, основанный на использовании реакций образования комплексонатов - комплексных соединений катионов металлов с комплексонами. Для определения конечной точки титрования используют металлохромные индикаторы или органические вещества, образующие окрашенные комплексы с катионами определяемых металлов.
В процессе комплексонометрического титрования в растворе протекает реакция связывания катионов металла в комплексонат, которую в общем случае (без учета зарядов ионов) можно записать в виде:
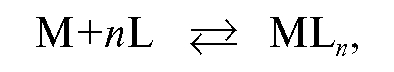
где М - катион определяемого металла; L - анион комплексона.
Комплексонометрически определяют содержание в лекарственных препаратах магния, кальция, свинца, висмута, алюминия. Чаще всего в качестве титранта применяют раствор этилендиаминтетраацетата (ЭДТА) - двунатриевую соль этилендиаминтетрауксусной кислоты
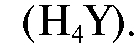
Занятие 11. Комплексонометрическое определение массы цинка и свинца в растворе
Цель занятия
Количественное определение массы цинка и свинца в анализируемом растворе методами прямого и обратного комплексонометрического титрования.
Целевые задачи
1. Приготовление стандартного раствора ЭДТА (комплексон III, трилон Б) и расчет его молярной концентрации.
2. Приготовление раствора магния сульфата и его стандартизация по раствору ЭДТА.
3. Определение массы цинка в растворе прямым титрованием.
4. Определение массы свинца в растворе прямым и обратным титрованием.
5. Статистическая обработка результатов анализа.
Задание для самоподготовки
К занятию необходимо знать
1. Теорию метода комплексонометрического титрования, индикаторы метода, механизм их действия.
2. Сущность определения массы катионов металлов в растворе методами прямого и обратного комплексонометрического титрования.
Уметь
1. Составлять уравнения реакций, лежащих в основе методов прямого и обратного комплексонометрического титрования.
2. Рассчитывать массу определяемых катионов металлов в растворе по результатам прямого и обратного комплексонометрического титрования.
Список литературы
1. Лекции «Комплексиметрическое титрование. Меркуриметрическое титрование. Комплексонометрическое титрование».
2. Учебник. - Книга 2, глава 5. - С. 209-244.
3. Справочник.
Вопросы для самопроверки
1. Перечислите требования, предъявляемые к реакциям комплексообразования в титриметрическом анализе.
2. Какие органические вещества называются комплексонами? Перечислите наиболее известные комплексоны.
3. Дайте химическое название ЭДТА и напишите схематически структурную формулу этого соединения.
4. Напишите в общем виде уравнения реакций взаимодействия ЭДТА с двух- и трехзарядными катионами металлов.
5. Какие органические вещества используют в качестве индикаторов в методе комплексонометрического титрования? Каков принцип их действия?
6. Перечислите требования, предъявляемые к металлохромным индикаторам метода.
7. В каком случае при проведении комплексонометрического титрования используют метод обратного титрования?
8. Какие реакции лежат в основе прямого и обратного методов комплексонометрического определения катионов металлов в растворе?
9. Катионы каких металлов можно определить методом комплексонометрического титрования?
Лабораторная работа «Определение массы цинка и свинца в растворе»
Реактивы
1. ЭДТА (х.ч.).
2. Раствор магния сульфата 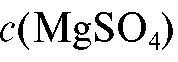 = 0,25 моль/л.
= 0,25 моль/л.
3. Индикаторная смесь эриохрома черного Т с хлоридом натрия
(1:100).
4. Спиртовой раствор ксиленолового оранжевого 0,5%.
5. Аммиачный буферный раствор (рН ~9,5-10).
6. Уротропин.
7. Универсальная индикаторная бумага. Учебные таблицы
1. Металлохромный индикатор эриохром черный Т.
2. Уравнения реакций комплексона III (ЭДТА) с катионами 2-, 3и 4-валентных металлов.
1. Приготовление стандартного раствора этилендиаминтетраацетата
Для выполнения работы готовят 250 мл стандартного раствора ЭДТА 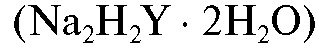 с молярной концентрацией соли 0,025 моль/л. Раствор титранта готовят по навеске с точно известной массой из кристаллического ЭДТА. Необходимую теоретическую массу навески рассчитывают по формуле (2.10), которая в данном случае имеет вид:
с молярной концентрацией соли 0,025 моль/л. Раствор титранта готовят по навеске с точно известной массой из кристаллического ЭДТА. Необходимую теоретическую массу навески рассчитывают по формуле (2.10), которая в данном случае имеет вид:
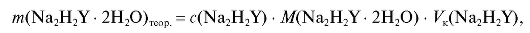
где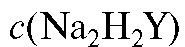 - задаваемая (теоретическая) молярная концентрация ЭДТА
- задаваемая (теоретическая) молярная концентрация ЭДТА
в растворе;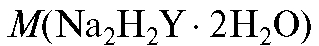 - молярная масса ЭДТА (табл. 4 «Справочника»);
- молярная масса ЭДТА (табл. 4 «Справочника»);
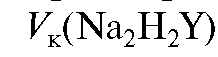 - объем приготавливаемого раствора ЭДТА.
- объем приготавливаемого раствора ЭДТА.
Точную навеску ЭДТА 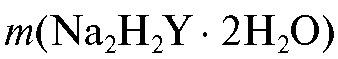 отбирают на аналитических
отбирают на аналитических
весах по разности результатов двух взвешиваний и через сухую воронку осторожно переносят в мерную колбу на 250 мл. Содержимое колбы перемешивают вращательным движением до полного растворения соли и доливают водой до метки (последние капли добавляют с помощью пипетки). Колбу закрывают пробкой и тщательно перемешивают раствор, переворачивая колбу вверх дном несколько раз.
2. Расчет концентрации приготовленного стандартного раствора этилендиаминтетраацетата
Молярную концентрацию соли в приготовленном растворе вычисляют по формуле (2.2), которая в данном случае имеют вид:
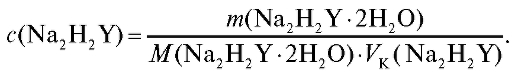
Теоретический титриметрический фактор пересчета приготовленного раствора ЭДТА по свинцу вычисляют по формуле (2.4), которая в данном случае имеет вид:
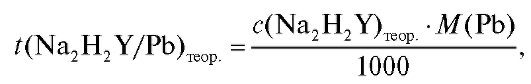
где 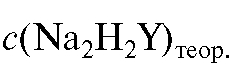 = 0,025 моль/л.
= 0,025 моль/л.
Поправочный коэффициент приготовленного раствора ЭДТА вычисляют по формуле (2.5), которая в данном случае имеет вид:
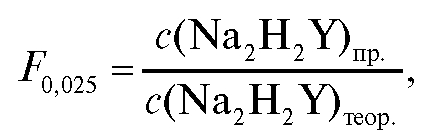
где 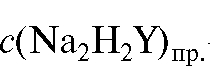 - практическая концентрация раствора ЭДТА, используемого
- практическая концентрация раствора ЭДТА, используемого
в анализе.
3. Приготовление раствора магния сульфата
Для выполнения работы готовят 250 мл раствора магния сульфата с примерной молярной концентрацией: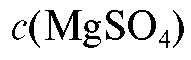 = 0,025 моль/л. Рас-
= 0,025 моль/л. Рас-
твор готовят путем разбавления концентрированного раствора с молярной концентрацией магния сульфата 0,25 моль/л.
Необходимый объем концентрированного раствора магния сульфата вычисляют из соотношения (2.7), которое в данном случае имеет вид:
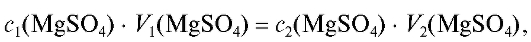
где 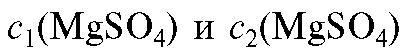 - значения молярных концентраций магния суль-
- значения молярных концентраций магния суль-
фата в растворе до и после разбавления;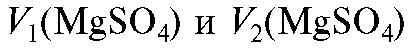 - объемы ис-
- объемы ис-
ходного и конечного растворов.
Рассчитанный объем концентрированного раствора магния сульфата отмеряют с помощью мерного цилиндра или градуированной пробирки и переносят в склянку на 0,5 л, прибавляют до 250 мл дистиллированной воды, перемешивают и закрывают пробкой.
4. Стандартизация раствора магния сульфата по раствору этилендиаминтетраацетата
Сущность методики
В основе стандартизации лежит прямое комплексонометрическое титрование стандартного раствора ЭДТА приготовленным раствором магния сульфата в среде аммиачного буферного раствора с индикатором эриохромом черным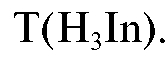 До прибавления титранта в растворе про-
До прибавления титранта в растворе про-
текает реакция взаимодействия ЭДТА и индикатора с аммиаком:
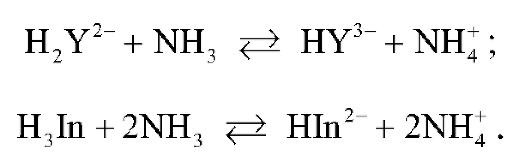
При этом ЭДТА в аммиачном буферном растворе существует в виде анионов 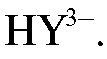 Синяя окраска раствора до титрования обусловлена присутствием ионов
Синяя окраска раствора до титрования обусловлена присутствием ионов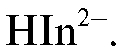
В процессе титрования в растворе протекают реакции образования бесцветного растворимого устойчивого комплекса магния с ЭДТА (комплексоната магния) и связывание ионов водорода с молекулами аммиака:
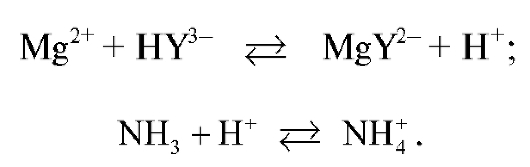
Связывание ионов водорода молекулами аммиака приводит к смещению равновесия образования комплексоната вправо и к более полному связыванию ионов магния в процессе титрования.
В конечной точке титрования первая избыточная капля магния сульфата реагирует с индикатором с образованием комплекса магния с индикатором 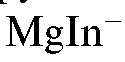 , и раствор окрашивается в красно-фиолетовый цвет:
, и раствор окрашивается в красно-фиолетовый цвет:
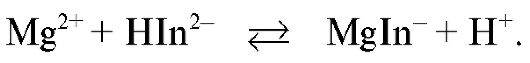
Титрование заканчивают при переходе окраски титруемого раствора из синей в красно-фиолетовую.
4.1. Титрование раствором магния сульфата
Методика
В колбу для титрования отбирают мерной пипеткой 2 мл приготовленного стандартного раствора ЭДТА, добавляют при перемешивании 1 мл аммиачного буферного раствора и вносят на кончике шпателя 4-5 мг индикаторной смеси эриохрома черного Т до появления синей окраски раствора. Раствор медленно титруют раствором магния суль-
фата до появления красно-фиолетовой окраски. Титрование проводят не менее трех раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований  заносят в табл. 2-27.
заносят в табл. 2-27.
Таблица 2-27. Результаты стандартизации раствора магния сульфата

4.2. Расчет молярной концентрации магния сульфата в растворе
По данным табл. 2-27 рассчитывают средний объем раствора магния сульфата  который пошел на титрование раствора ЭДТА, как
который пошел на титрование раствора ЭДТА, как
среднее арифметическое объемов титранта в трех параллельных титрованиях. Полученное значение заносят в табл. 2-27.
Молярную концентрацию раствора магния сульфата рассчитывают из соотношения (2.11), которое для данного титрования имеет вид:
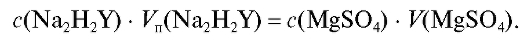
Отсюда концентрация приготовленного раствора магния сульфата равна:
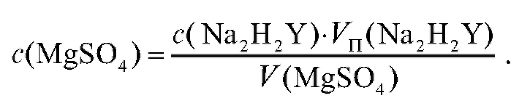
5. Определение массы цинка в анализируемом растворе
Сущность методики
Количественное определение массы цинка в анализируемом растворе проводят методом прямого комплексонометрического титрования в присутствии аммиачного буфера и индикатора эриохрома черного Т. При этом до прибавления титранта в растворе протекают реакции взаимодействия индикатора с аммиаком, образование комплексного соединения иона цинка с индикатором и связывание ионов водорода с молекулами аммиака:
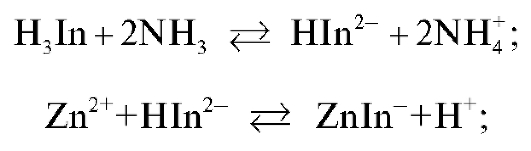
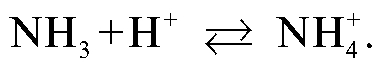
Красно-фиолетовая окраска раствора до титрования обусловлена присутствием ионов 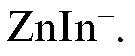
В процессе титрования в растворе протекают реакции образования растворимого, устойчивого комплекса цинка с ЭДТА (комплексоната цинка). При этом титрант в аммиачном буфере существует в виде анионов 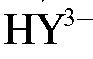 :
:
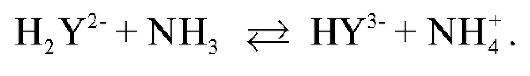
При титровании протекают реакции:
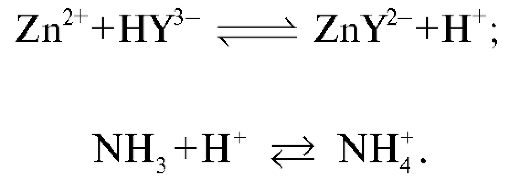
Связывание ионов водорода молекулами аммиака приводит к смещению равновесия образования комплексоната вправо и к более полному связыванию ионов цинка в процессе титрования.
В конечной точке титрования менее устойчивый комплекс ионов цинка с индикатором разрушается с образованием более устойчивого комплексоната цинка и ионов индикатора 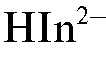 синего цвета:
синего цвета:
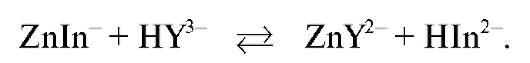
Титрование заканчивают при переходе окраски титруемого раствора из красно-фиолетовой в синюю.
5.1. Титрование раствора соли цинка
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой, доводят до метки и перемешивают. В колбу для титрования отбирают мерной пипеткой 2 мл приготовленного раствора соли цинка, добавляют при перемешивании 1 мл аммиачного буферного раствора и вносят на кончике шпателя 4-5 мг индикаторной смеси эриохрома черного Т до появления красно-фиолетовой окраски раствора. Раствор медленно титруют стандартным раствором ЭДТА до появления сине-голубой окраски. Титрование проводят не менее пяти раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований 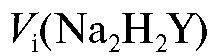 заносят
заносят
в табл. 2-28.
Таблица 2-28. Результаты титрования раствора соли цинка

5.2. Расчет массы цинка в анализируемом растворе
По данным табл. 2-28 рассчитывают массу цинка в анализируемом растворе для каждого титрования по формуле для прямого титрования определяемого вещества (2.15), которая в данном случае имеет вид:
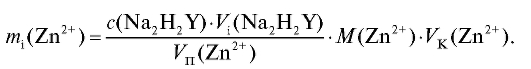
Молярную массу цинка определяют по табл. 4 «Справочника». По данным табл. 2-28 проводят статистическую обработку полученных результатов анализа.
6. Определение массы свинца в анализируемом растворе прямым титрованием
Сущность методики
Раствор соли свинца титруют стандартным раствором ЭДТА в слабокислой среде (рН 5) с индикатором ксиленоловым оранжевым
5) с индикатором ксиленоловым оранжевым 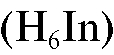 . При этом до прибавления титранта в растворе протекает реакция образования растворимого красно-фиолетового комплексного иона свинца с индикатором
. При этом до прибавления титранта в растворе протекает реакция образования растворимого красно-фиолетового комплексного иона свинца с индикатором 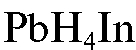 :
:
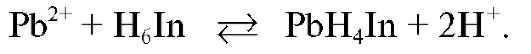
В процессе титрования в растворе протекают реакции образования бесцветного, растворимого, устойчивого комплекса свинца с ЭДТА (комплексоната свинца). Титрант в условиях титрования существует в растворе в виде анионов 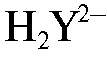 . При титровании протекает реакция:
. При титровании протекает реакция:
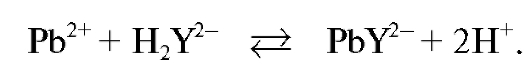
В конечной точке титрования менее устойчивый комплекс свинца с индикатором разрушается с образованием более устойчивого комплексоната свинца:
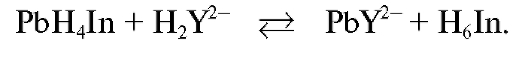
В растворе образуются молекулы индикатора, окрашивающие титруемый раствор в желтый цвет. Титрование заканчивают при переходе окраски титруемого раствора из красно-фиолетовой в лимонножелтую.
6.1. Титрование раствора соли свинца
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой, доводят до метки и перемешивают. В колбу для титрования отбирают мерной пипеткой 2 мл приготовленного раствора, добавляют 0,1-0,2 г сухого уротропина до рН = 5,0 (проба с универсальным индикатором), 3 капли индикатора ксиленолового оранжевого и титруют стандартным раствором ЭДТА до перехода фиолетовой окраски в лимонно-желтую. Титрование проводят не менее пяти раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований  заносят в табл. 2-29.
заносят в табл. 2-29.
Таблица 2-29. Результаты титрования раствора соли свинца

6.2. Расчет массы свинца в анализируемом растворе
По данным табл. 2-29 рассчитывают массу свинца в анализируемом растворе двумя способами. С использованием молярной концентрации титранта массу свинца рассчитывают по формуле для прямого титрования определяемого вещества (2.15), которая в данном случае имеет вид:
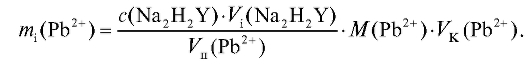
С использованием поправочного коэффициента и титриметрического фактора пересчета раствора ЭДТА по свинцу массу свинца в анализируемом растворе рассчитывают по формуле (2.18), которая в данном случае имеет вид:
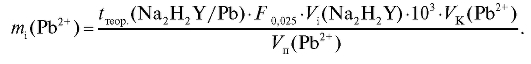
Молярную массу свинца определяют по табл. 4 «Справочника».
По данным табл. 2-29 проводят статистическую обработку полученных результатов анализа.
7. Определение массы свинца в растворе обратным титрованием
Сущность методики
В основе определения лежит метод обратного комплексонометрического титрования раствора соли свинца в среде аммиачного буфера в присутствии индикатора эриохрома черного 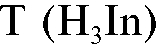 . К анализируе-
. К анализируе-
мому раствору соли свинца прибавляют известный избыток стандартного раствора ЭДТА, который образует с катионом свинца прочный бесцветный растворимый комплексонат:
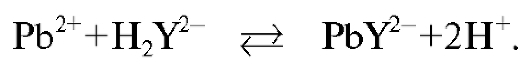
При добавлении к полученному раствору аммиачного буфера аммиак взаимодействует с индикатором и ЭДТА. При этом в растворе протекают реакции:
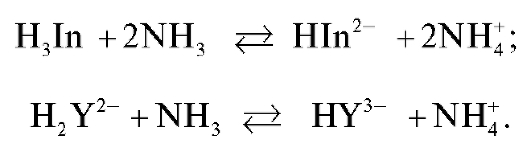
Раствор окрашивается в синий цвет за счет образования ионов HIn2-.
Непрореагировавший ЭДТА оттитровывают стандартным раствором соли магния, при этом в растворе протекают реакции образования бесцветного, растворимого, устойчивого комплекса магния с ЭДТА (комплексоната магния):
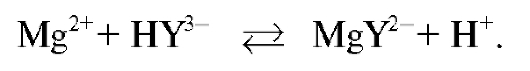
В конечной точке титрования первая избыточная капля титранта магния сульфата взаимодействует с индикатором с образованием комплексного иона 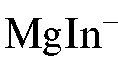 красно-фиолетового цвета:
красно-фиолетового цвета:
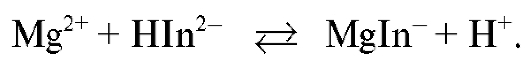
Титрование заканчивают при переходе окраски титруемого раствора из синей в красно-фиолетовую.
7.1. Титрование раствора соли свинца
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой, доводят до метки и перемешивают. В колбу
для титрования отбирают мерной пипеткой 2 мл приготовленного раствора и другой мерной пипеткой добавляют 5 мл стандартного раствора ЭДТА (титрант 1). Затем с помощью мерного цилиндра приливают при перемешивании 1 мл аммиачного буфера и на кончике шпателя вносят 4-5 мг индикаторной смеси эриохрома черного Т до заметной синей окраски раствора. Полученный раствор титруют стандартизованным раствором соли магния (титрант 2) до перехода окраски из синей в красно-фиолетовую. Титрование проводят не менее пяти раз до получения воспроизводимых результатов. Полученные значения объемов титранта 2 при проведении параллельных титрований  заносят
заносят
в табл. 2-30.
Таблица 2-30. Результаты титрования раствора соли свинца
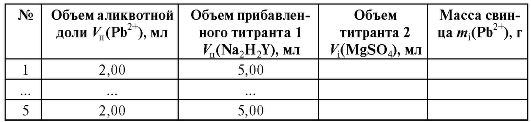
7.2. Расчет массы свинца в анализируемом растворе
По данным табл. 2-30 рассчитывают массу свинца в анализируемом растворе для каждого титрования по формуле для обратного титрования определяемого вещества (2.20), которая в данном случае имеет вид:
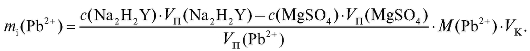
Молярную массу свинца определяют по табл. 4 «Справочника».
По данным табл. 2-30 рассчитывают значения масс свинца в анализируемом растворе по результатам пяти параллельных титрований и проводят статистическую обработку полученных результатов анализа.
Контрольные вопросы
1. Для чего при проведении комплексонометрического титрования применяют буферные растворы?
2. В форме какого аниона преимущественно присутствует ЭДТА в растворе:
а) в слабокислой среде (рН = 3-6);
б) в слабощелочной среде (рН = 8-10)?
3. Катионы каких металлов следует определять прямым комплексонометрическим титрованием в щелочной среде?
4. Катионы каких металлов можно определять прямым комплексонометрическим титрованием в кислой среде?
5. Каков принцип действия металлохромного индикатора при комплексонометрическом титровании?
6. Какое требование к устойчивости комплексных соединений определяемых ионов с индикатором и к устойчивости соответствующих комплексонатов следует выполнять при комплексонометрическом титровании?
7. Почему комплексонометрическое определение свинца с индикатором эриохромом черным Т проводят методом обратного титрования?
8. Можно ли изменить порядок добавления реагентов при определении свинца методом обратного титрования? Дайте обоснование ответа.
9. Как и почему меняется окраска титруемого раствора в КТТ при определении свинца:
а) прямым титрованием;
б) обратным титрованием?
Занятие 12. Комплексонометрическое определение массы железа(III) и кальция в растворе
Цель занятия
Количественное определение массы железа(III) и кальция в растворе методом прямого комплексонометрического титрования.
Целевые задачи
1. Определение массы железа(III) в растворе прямым комплексонометрическим титрованием.
2. Определение массы кальция в растворе прямым комплексонометрическим титрованием.
3. Статистическая обработка результатов анализа.
Задание для самоподготовки
К занятию необходимо знать: сущность метода прямого комплексонометрического определения массы катионов металлов в анализируемом растворе.
Уметь: составлять уравнения реакций, протекающих между всеми веществами, участвующими в процессе прямого комплексонометрического титрования.
Список литературы
1. Лекции «Комплексиметрическое титрование. Меркуриметрическое титрование. Комплексонометрическое титрование».
2. Учебник. - Книга 2, глава 5. - С. 209-244.
3. Справочник.
Вопросы для самопроверки
1. Какой индикатор применяют при определении массы железа(III) в растворе прямым комплексонометрическим титрованием?
2. Какой индикатор применяют при определении массы кальция в растворе прямым комплексонометрическим титрованием?
3. В какой среде проводят комплексонометрическое титрование железа(III) в растворе? Дайте обоснование.
4. В какой среде проводят комплексонометрическое титрование кальция в растворе. Дайте обоснование.
5. Укажите мольное отношение металла и лиганда в комплексонатах кальция и железа(III). Какова их окраска?
6. Укажите цвет комплекса, образуемого железом(III) с сульфосалициловой кислотой в кислой среде.
Лабораторная работа «Определение массы железа(III) и кальция в растворе»
Реактивы
1. Стандартный раствор ЭДТА 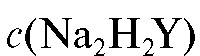 = 0,025 моль/л.
= 0,025 моль/л.
2. Раствор сульфосалициловой кислоты (25%).
3. Раствор соляной кислоты: 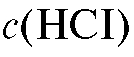 = 2 моль/л.
= 2 моль/л.
4. Индикаторная смесь индикатора мурексида с натрия хлоридом
(1:100).
5. Раствор натрия гидроксида 20%.
6. Универсальная индикаторная бумага. Учебные таблицы
1. Металлохромный индикатор эриохром черный Т.
2. Уравнения реакции комплексона III с катионами 2-, 3- и 4-валентных металлов.
1. Определение массы железа в растворе хлорида железа(III)
Сущность методики
Количественное определение массы железа(III) в анализируемом растворе проводят методом прямого комплексонометрического титрования в кислой среде (рН = 2,0) в присутствии индикатора сульфосалициловой кислоты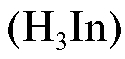 .
.
При этом до прибавления титранта в растворе протекают реакции ионизации молекул индикатора и образования комплексного соединения иона железа(III) с индикатором, по-видимому, состава 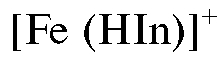 красно-фиолетового цвета:
красно-фиолетового цвета:
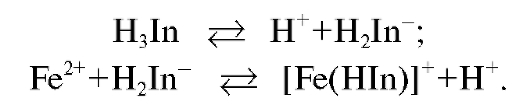
В процессе титрования ионы железа(III) связываются в устойчивый комплекс железа(III) с ЭДТА (комплексонат железа). Титрант при данной кислотности раствора существует в виде анионов  . При титровании в растворе протекает реакция:
. При титровании в растворе протекает реакция:
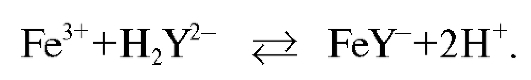
В конечной точке титрования менее устойчивый комплекс железа(III) с индикатором разрушается с образованием более устойчивого комплексоната железа(III) желтого цвета:
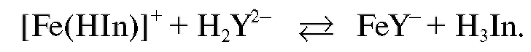
Желтая окраска в конце титрования определяется цветом комплексоната 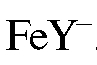 .
.
1.1. Титрование раствора соли железа(III)
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и перемешивают. В колбу для
титрования отбирают мерной пипеткой 2 мл приготовленного раствора соли железа(Ш), добавляют 0,2 мл соляной кислоты до рН 2 (контроль по универсальной индикаторной бумаге), разбавляют дистиллированной водой до 4 мл, нагревают до 70-80 °C, добавляют 1 каплю 25% раствора сульфосалициловой кислоты и титруют раствором ЭДТА до перехода окраски из красно-фиолетовой в желтую. Вблизи точки эквивалентности титрант добавляют медленно, тщательно перемешивая раствор. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований
2 (контроль по универсальной индикаторной бумаге), разбавляют дистиллированной водой до 4 мл, нагревают до 70-80 °C, добавляют 1 каплю 25% раствора сульфосалициловой кислоты и титруют раствором ЭДТА до перехода окраски из красно-фиолетовой в желтую. Вблизи точки эквивалентности титрант добавляют медленно, тщательно перемешивая раствор. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований 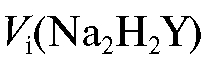 заносят в табл. 2-31.
заносят в табл. 2-31.
Таблица 2-31. Результаты титрования раствора соли железа(III)

1.2. Расчет массы железа в анализируемом растворе
По данным табл. 2-31 рассчитывают массу железа в анализируемом растворе для каждого титрования по формуле для прямого титрования определяемого вещества (2.15), которая в данном случае имеет вид:
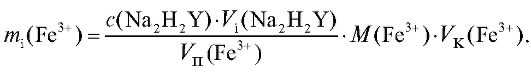
Молярную массу железа определяют по табл. 4 «Справочника». По данным табл. 2-31 проводят статистическую обработку полученных результатов анализа по массе железа(III).
2. Определение массы кальция в растворе кальция хлорида
Сущность методики
Количественное определение массы кальция в анализируемом растворе проводят методом прямого комплексонометрического титрования в щелочной среде (рН 12) в присутствии индикатора мурексида
12) в присутствии индикатора мурексида
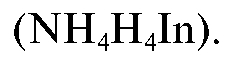
До прибавления титранта в растворе протекают реакции индикатора с гидроксид-ионами:
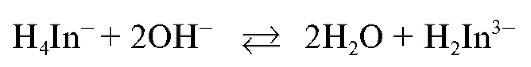
и образования комплексного соединения иона кальция с индикатором состава 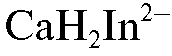 красного цвета:
красного цвета:
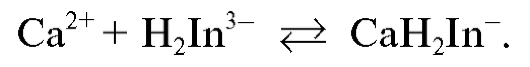
ЭДТА реагирует с гидроксид-ионами и существует при данной кислотности раствора в виде анионов 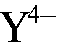 :
:
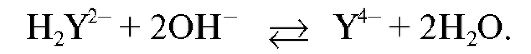
При титровании ионы кальция связываются в устойчивый комплекс (комплексонат кальция):
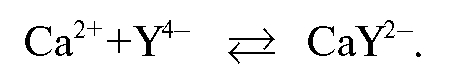
В конечной точке титрования менее устойчивый комплекс кальция с индикатором разрушается с образованием более устойчивого комплексоната кальция и индикатора 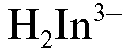 фиолетового цвета:
фиолетового цвета:
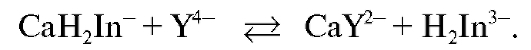
Титрование заканчивают при переходе окраски титруемого раствора из красной в фиолетовую.
2.1. Титрование раствора кальция хлорида
Методика
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой, доводят объем раствора до метки и перемешивают. В колбу для титрования отбирают мерной пипеткой 1 мл полученного раствора, добавляют 1 мл раствора натрия гидроксида до рН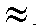 12 (контроль по универсальной индикаторной бумаге), 2 мл дистиллированной воды, несколько кристаллов индикаторной смеси мурексида до появления розовой окраски раствора и титруют раствором ЭДТА до перехода розовой окраски раствора в фиолетовую (или синюю). Титрование проводят не менее пяти раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении пяти параллельных титрований
12 (контроль по универсальной индикаторной бумаге), 2 мл дистиллированной воды, несколько кристаллов индикаторной смеси мурексида до появления розовой окраски раствора и титруют раствором ЭДТА до перехода розовой окраски раствора в фиолетовую (или синюю). Титрование проводят не менее пяти раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении пяти параллельных титрований 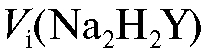 заносят в табл. 2-32.
заносят в табл. 2-32.
Таблица 2-32. Результаты титрования раствора соли кальция

2.2. Расчет массы кальция в анализируемом растворе
По данным табл. 2-32 рассчитывают массу кальция в анализируемом растворе для каждого титрования по формуле для прямого титрования определяемого вещества (2.15), которая в данном случае имеет вид:
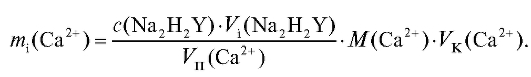
Молярную массу кальция определяют по табл. 4 «Справочника». По данным табл. 2-32 проводят статистическую обработку полученных результатов анализа по массе кальция.
Контрольные вопросы
1. Какая анионная форма ЭДТА преобладает в растворе:
а) в кислой среде (рН = 1 -2);
б) в щелочной среде (рН = 12 -13)?
2. Напишите уравнения реакций, протекающих при титровании железа(III) раствором ЭДТА в солянокислой среде.
3. Напишите уравнение реакции, протекающей при титровании кальция раствором ЭДТА в щелочной среде (рН = 12).
4. Как изменяется окраска раствора в конечной точке титрования при прямом комплексонометрическом титровании Fе(III) в присутствии индикатора сульфосалициловой кислоты? Дайте обоснованный ответ.
5. Как изменяется окраска раствора в конечной точке титрования при прямом комплексонометрическом титровании соли кальция в растворе в присутствии индикатора мурексида? Дайте обоснованный ответ.
Примеры тестовых пунктов текущего контроля по темам III и IV
I. Тестовые пункты с одним правильным ответом
Инструкция. Из следующих за утверждением ответов выберите один правильный.
Задание. 0,1 моль/л раствор серебра нитрата титруют 0,1 моль/л раствором калия тиоцианата в присутствии индикатора железоаммониевых квасцов. Напишите уравнения реакций, протекающих в процессе титрования, и укажите:
1. Среду титрования:
а) уксуснокислая;
б) сернокислая;
в) солянокислая;
г) азотнокислая;
д) аммиачная. Ответ: г.
2. Окраску раствора в начальный момент титрования:
а) бесцветная;
б) желтая;
в) оранжевая;
г) красная;
д) зеленая. Ответ: б.
3. Окраску раствора в КТТ:
а) бесцветная;
б) желтая;
в) оранжевая;
г) красная;
д) зеленая. Ответ: г.
4. Показатель концентрации тиоцианат-ионов в КТТ:
а) 8;
б) 7;
в) 6;
г) 5;
д) 4.
Ответ: в.
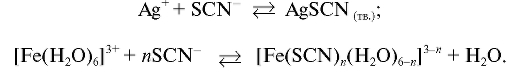
Задание. Для прямого комплексонометрического определения кальция готовят 400 мл 0,025 моль/л раствора титранта ЭДТА. Рассчитайте и укажите:
5. Массу навески ЭДТА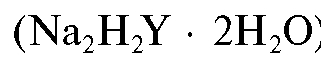 , необходимую для приготовления титранта:
, необходимую для приготовления титранта:
а) 3,0018 г;
б) 3,4621 г;
в) 4,0837 г;
г) 3,7224 г;
д) 4,4430 г.
Ответ: г.
6. Титриметрический фактор пересчета ЭДТА по кальцию:
а) 1,8 • 10-3 г/мл;
б) 1,6 • 10-3 г/мл;
в) 1,4 • 10-3 г/мл;
г) 1,2 • 10-3 г/мл;
д) 1,0 • 10-3 г/мл. Ответ: д.
7. Индикатор титрования (см. «Справочник»):
а) ксиленоловый оранжевый;
б) фенолфталеин;
в) пирогаллоловый красный;
г) дифенилкарбазон;
д) мурексид. Ответ: д.
8. Изменение окраски раствора в КТТ (см. «Справочник»):
а) из желтой в зеленую;
б) из желтой в синюю;
в) из красной в фиолетовую;
г) из фиолетовой в желтую;
д) из синей в желтую. Ответ: в.
II. Задание на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько или не использован совсем.
Задание. Укажите преимущественную форму существования ЭДТА в растворе при указанных значениях рН раствора:

Ответы: 9 - в, 10 - д, 11 - б, 12 - а, 13 - г.
III. Задания с выбором одного или нескольких правильных ответов
Инструкция. Для каждого незаконченного утверждения один или несколько ответов являются правильными. Выберите номера правильных ответов.
14. Для прямого осадительного титрования 0,05 моль/л раствора калия тиоцианата можно использовать титранты:
а) серебра нитрат;
б) калия гексацианоферрат(II);
в) ртути(I) нитрат;
г) натрия хлорид. Ответ: а, в.
15. Для обратного комплексонометрического титрования солей свинца(II) используют титранты:
а) раствор ЭДТА;
б) раствор NaCl;
в) раствор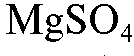 ;
;
г) раствор серебра нитрата. Ответ: а, в.
IV. Тестовые пункты на определение причинно-следственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение
в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
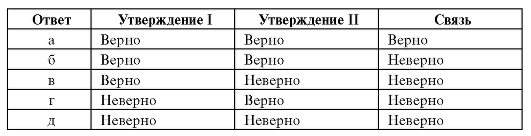
16. При титровании хлорид-ионов по методу Мора сначала выпадает осадок серебра хлорида, а затем осадок серебра хромата, потому что произведение растворимости серебра хлорида больше, чем у серебра хромата.
Ответ: б.
17. Хлорид-ионы можно определять аргентометрическим титрованием в присутствии индикатора эозина, потому что эозин адсорбируется на осадке серебра хлорида раньше, чем хлоридионы.
Ответ: г.
Содержание письменной контрольной работы по темам III и IV
1. Осадительное титрование
1.1. Теоретические основы методов осадительного титрования
Сущность методов осадительного титрования. Требования к реакциям, применяемым в осадительном титровании. Индикаторы метода осадительного титрования. Механизм их действия и условия применения. Классификация методов осадительного титрования. Способы осадительного титрования, примеры. Построение кривой осадительного титрования, выбор индикатора. Влияние концентрации реагентов и растворимости осадка на величину скачка титрования.
1.2. Методы осадительного титрования
Аргентометрическое титрование. Титрант метода, его приготовление и стандартизация. Метод Мора. Условия титрования. Индикатор метода. Определение хлоридов и бромидов.
Метод Фаянса-Фишера-Ходакова. Индикаторы метода. Условия титрования. Определение бромидов и йодидов. Достоинства и недостатки метода.
Метод Фольгарда. Титранты метода, приготовление и стандартизация. Индикаторы метода. Примеры определений галогенид-ионов. Достоинства и недостатки метода.
Меркуриметрическое титрование. Титрант метода, его приготовление и стандартизация. Индикаторы метода. Определение хлоридов и йодидов. Достоинства и недостатки метода.
Гексацианоферратометрическое титрование. Сущность метода. Титрант метода, его приготовление и стандартизация. Индикаторы метода. Определение солей цинка, меди, кадмия, свинца в растворе. Достоинство и недостатки метода.
2. Комплексиметрическое титрование
2.1. Теоретические основы методов комплексиметрического титрования
Сущность метода. Требования к реакциям, используемым в комплексиметрии. Комплексоны. ЭДТА, его свойства. Влияние рН среды на диссоциацию этилендиаминтетрауксусной кислоты в водных растворах. Комплексонаты двух- и трехзарядных катионов металлов, их состав и свойства. Металлохромные индикаторы, механизм их действия. Требования к индикаторам. Интервал перехода окраски индикатора. Эриохром черный Т, мурексид, ксиленоловый оранжевый, условия их применения. Выбор индикатора для титрования.
2.2. Методы комплексиметрического титрования
Комплексонометрическое титрование. Титрант метода, его приготовление и стандартизация. Способы комплексонометрического титрования: прямое, обратное, косвенное. Определение солей кальция, магния, свинца в растворе. Достоинства метода.
Меркуриметрическое титрование. Титрант метода, его приготовление и стандартизация. Индикаторы метода. Определение галогенидов. Достоинства и недостатки метода.
3. Решение типовых расчетных задач
3.1. Расчеты по приготовлению и стандартизации титрантов.
3.2. Расчеты по результатам титрования.
3.3. Расчет точек на кривых осадительного и комплексонометрического титрования.
Список литературы
3. Лекции по теме: «Осадительное титрование и комплексиметрическое титрование».
4. Учебник. - Книга 2, главы 5, 6. - С. 209-271.
5. Настоящее учебно-методическое пособие.
6. Справочник.
Пример билета письменной контрольной работы (дневное отделение)
1. Индикаторы комплексонометрического титрования. Требования к индикаторам, механизм их действия.
2. Метод Мора. Титрант, приготовление и стандартизация. Определение массы калия бромида в растворе. Достоинства и недостатки метода.
3. Какой объем раствора аммония тиоцианата с молярной концентрацией 0,2010 моль/л нужно взять для получения 200,0 мл раствора с титриметрическим фактором пересчета аммония тиоцианата по серебра нитрату, равным 3,500 • 10-3 г/мл?
4. Образец, содержащий соли кальция и магния, массой 2,500 г растворили в воде и получили 500,0 мл раствора. На титрование аликвотной доли полученного раствора объемом 20,00 мл в аммиачной буферной системе при рН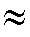 10 затрачено 15,25 мл
10 затрачено 15,25 мл
раствора ЭДТА с молярной концентрацией 0,0523 моль/л. К другой аликвотной доле анализируемого раствора объемом 10,00 мл прибавили щелочь до рН 12; полученный раствор оттитровали 5,34 мл раствора ЭДТА. Рассчитать массовые доли кальция и магния в образце в процентах.
12; полученный раствор оттитровали 5,34 мл раствора ЭДТА. Рассчитать массовые доли кальция и магния в образце в процентах.
Пример билета письменной контрольной работы (вечернее отделение)
1. Индикаторы метода осадительного титрования. Механизм их действия и условия применения.
2. Комплексонометрическое титрование. Титрант метода, его приготовление и стандартизация.
3. На титрование 10,00 мл раствора аммония тиоцианата израсходовано 8,50 мл стандартизованного 0,0512 моль/л раствора серебра нитрата. Вычислить молярную концентрацию раствора аммония тиоцианата и его титриметрический фактор пересчета по серебру.