Патофизиология: учебник / Литвицкий П.Ф. - 4-е изд., - 2009. - 496 с.
|
|
|
|
ГЛАВА 5. ВОСПАЛЕНИЕ
Воспаление - типовой патологический процесс, направленный на уничтожение, инактивацию или ликвидацию повреждающего агента и восстановление повреждённой ткани.
Воспаление - местный процесс. Однако в его возникновении, развитии и исходах принимают участие практически все ткани, органы и системы организма.
Терминология. Для обозначения воспаления в какой-либо ткани или органе используют их латинское или греческое название и добавляют терминологический элемент «ит» (в сочетании с греко-латинским названием ткани или органа - itis). Например, воспаление кожи - дерматит, печени - гепатит, почки - нефрит, оболочек мозга - менингит, миокарда - миокардит, стенки вены - флебит и т.д.
Этиология
Воспаление - ответ организма на воздействие причины - флогогенного (от греч. phlox, phlogos - пламя) фактора, действующего в определенных условиях.
Причины воспаления
• Природа флогогенного фактора может быть физической, химической или биологической.
♦ Физические факторы: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии.
♦ Химические факторы: органические и неорганические кислоты, щёлочи и соли; ЛС, вводимые в ткани.
♦ Биологические агенты: инфекционные (вирусы, риккетсии, бактерии, грибы); иммуноаллергические (комплексы Аг-АТ; денатурированные белки и погибшие участки ткани; инфицированные вирусом и опухолевые клетки); токсины насекомых, животных, растений.
• Происхождение флогогенного фактора. Как повреждающие факторы, флогогенные факторы подразделяют на экзогенные и эндогенные, а в каждой из этих групп выделяют инфекционные и неинфекционные агенты.
• Выраженность воспалительного эффекта флогогенных агентов зависит не только от их природы и происхождения, но и от интенсивности действия: чем она выше, тем, как правило, более остро протекает воспалительная реакция.
Условия, влияющие на возникновение и течение воспаления
• Реактивность организма. Воспаление может иметь нормергическое, гиперергическое и гипоергическое течение, в зависимости от реактивности организма и реактивных свойств ткани или органа в данный момент.
• Регионарные особенности тканей важны для возникновения и характера развития воспаления. Так, хроническая локальная травма тканей, дистрофические процессы, нарушения кровообращения или местного иммунитета облегчают реализацию действия патогенного фактора и нередко усугубляют повреждение тканей в очаге воспаления.
Патогенез
В механизме развития воспаления выделяют несколько компонентов: альтерацию, сосудистые реакции, изменения крово- и лимфообращения, экссудацию жидкости и выход форменных элементов крови в ткань, фагоцитоз и пролиферацию.
АЛЬТЕРАЦИЯ
Альтерация (от лат. alteratio - изменение, повреждение) как компонент механизма развития воспаления включает изменения: клеточных и внеклеточных структур, обмена веществ, физико-химических свойств, а также образование и реализацию эффектов медиаторов воспаления. При этом различают зоны первичной и вторичной альтерации.
• Первичная альтерация реализуется за счёт действия патогенного агента в зоне его внедрения, что сопровождается грубыми, часто необратимыми изменениями.
• Вторичная альтерация вызывается и патогенным агентом и, в основном, продуктами первичной альтерации. Позднее вторичная альтерация приобретает относительно самостоятельный характер. Объём зоны вторичного повреждения всегда больше, чем первичного, а длительность может варьировать от нескольких часов до нескольких лет.
Изменение структур
Степень изменений клеточных и неклеточных структур в очаге воспаления колеблется от минимальных до их разрушения и некроза. Причиной альтерации структур являются на начальном этапе воспаления прямое действие флогогенного фактора, а затем - расстройства обмена веществ, физико-химические, микроциркуляторные и регуляторные расстройства (подробнее причины повреждения структур см. в Главе 4 «Патология клетки»).
Изменения обмена веществ
Биологический смысл изменений обмена веществ заключается в энергетическом и пластическом обеспечении процессов, протекающих в очаге воспаления. На начальном этапе воспаления в тканях преобладают реакции катаболизма, а при активации процессов пролиферации начинают доминировать анаболические реакции. Изменения метаболизма в существенной мере регулируются медиаторами воспаления. В очаге воспаления, а нередко и в организме в целом, происходит перестройка всех видов обмена веществ: углеводного, белкового, жирового и водно-солевого, что приводит к физико-химическим изменениям в очаге воспаления.
• Углеводы
♦ Активируются гликогенолиз и гликолиз, обеспечивающие увеличение выработки макроэргических соединений.
♦ Под влиянием разобщителей окисления и фосфорилирования нарушается образование АТФ в цикле Кребса и энергия выделяется в виде тепла.
♦ Гликолиз в условиях гипоксии в очаге воспаления переходит на анаэробный путь, следствием чего является накопление избытка лактата и пирувата, которые формируют метаболический ацидоз.
♦ Возобновление оксигенации тканей, как правило, сопровождается нормализацией энергетического обеспечения клеточных процессов.
• Липиды
♦ Усиливаются липолиз (он сопровождается накоплением свободных ВЖК) и деструкция липидов за счёт интенсификации реакций СПОЛ (с образованием перекисей и гидроперекисей липидов, кетокислот).
♦ В связи с накоплением в клетках свободных ВЖК отмечаются их разобщающий эффект и снижение эффективности тканевого дыхания в митохондриях. ВЖК обладают также детергентным действием (см. раздел «Повреждение мембран», глава 4).
♦ Накопление избытка кетокислот (ацетоуксусной, β-оксимасляной, β-кетоглутаровой и других) вследствие нарушения окисления ВЖК обусловливает ацидоз и вторичную альтерацию в очаге воспаления.
♦ Образующаяся в избытке арахидоновая кислота служит субстратом для образования Пг, тромбоксанов и лейкотриенов.
• Белки
♦ Активируется протеолиз, продукты которого служат субстратом синтеза клеточных компонентов взамен повреждённых.
♦ Развиваются иммунные (в том числе - иммунопатологические) реакции (в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента). Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур.
• Ионы и вода
♦ Расстраивается энергетическое обеспечение селективного переноса катионов и снижается активность катион-зависимых мембранных АТФаз (?+,К+-АТФазы, Са2+Mg2+-АТФазы). Это вызывает нарушение формирования МП и ПД, развитие стойкой деполяризации мембран возбудимых клеток (например, кардиомиоцитов и нейронов).
♦ Нарушается вне- и внутриклеточное соотношение между отдельными ионами. Происходит потеря клеткой К+, Mg2+ и накопление их в межклеточной жидкости. В клетку поступают Na+ и Са2+.
♦ Высвобождается дополнительное количество катионов (К+, Na+, Са2+, железа, цинка) при гидролизе солей и поступлении большого количества Са2+ из повреждённых внутриклеточных депо (митохондрий и цистерн эндоплазматической сети).
♦ Значительно увеличивается осмотическое давление внутри клеток и их органелл, что сопровождается перерастяжением и разрывом их мембран.
Физико-химические изменения
• Метаболический ацидоз в очаге воспаления обусловлен накоплением избытка различных кислот: молочной, пировиноградной, аминокислот, ВЖК и КТ.
♦ Механизмы развития: нарушение удаления из очага воспаления образующихся в большом количестве кислых продуктов метаболизма. Это вызывает истощение буферных систем (бикарбонатной, фосфатной, белковой) клеток и межклеточной жидкости.
♦ Последствия:
? Повышение проницаемости мембран, в том числе лизосом, что приводит к выходу гидролаз в цитозоль и межклеточное вещество.
? Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны.
? Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+.
? Изменения чувствительности рецепторов клеток (в том числе - стенок сосудов) к регуляторным факторам (нейромедиаторам, гормонам, медиаторам воспаления), что сопровождается расстройством регуляции тонуса сосудистой стенки.
• Гиперосмия - повышенное осмотическое давление в регионе воспаления. Обусловлено накоплением большого количества ионов и низкомолекулярных соединений.
♦ Механизмы развития: повышенное ферментативное и неферментативное разрушение макромолекул, усиленный в условиях ацидоза гидролиз солей и выделение осмотически активных соединений из повреждённых клеток.
♦ Последствия: гипергидратация очага воспаления, стимуляция эмиграции лейкоцитов, изменение тонуса стенок сосудов, формирование чувства боли.
• Гиперонкия - повышенное онкотическое давление в ткани при ее воспалении.
♦ Механизмы развития: увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментативного гидролиза пептидов и выход белков (в основном - альбуминов) из крови в очаг воспаления в связи с повышением проницаемости сосудистой стенки.
♦ Последствия: развитие отёка в очаге воспаления.
• Изменение поверхностного заряда клеток (как правило, снижение). Обусловлено нарушением водно-электролитного баланса в воспаленной ткани.
♦ Механизмы развития: нарушение энергообеспечения трансмембранного переноса ионов и развитие электролитного дисбаланса.
♦ Последствия: изменение порога возбудимости клеток, потенцирование миграции фагоцитов за счёт электрокинеза; стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой.
• Изменения коллоидного состояния межклеточного вещества и гиалоплазмы клеток в очаге воспаления.
♦ Механизмы развития:
? Ферментативный и неферментативный гидролиз макромолекул (гликозаминогликанов, белков, протеогликанов).
? Фазовые изменения микрофиламентов, облегчающие переход их состояния из геля в золь и наоборот.
♦ Последствия (основное): увеличение тканевой проницаемости.
• Уменьшение поверхностного натяжения клеточных мембран. Обусловлено изменениями структуры молекул плазмолеммы.
♦ Механизмы развития: воздействие на клеточные мембраны значительного количества поверхностноактивных веществ (фосфо-
липидов, ВЖК, К+, Са2+).
♦ Последствия: облегчение подвижности клетки и потенцирование адгезии клеток при фагоцитозе.
Медиаторы воспаления
Медиаторы воспаления - биологически активные вещества, под влиянием которых осуществляются закономерное развитие и исходы воспаления, формируются его местные и общие признаки.
Выделяют две группы медиаторов воспаления: клеточные и плазменные.
Клеточные медиаторы воспаления
Основные группы клеточных медиаторов воспаления включают: биогенные амины, пептиды и белки, оксид азота, производные жирных кислот и липидов, нуклеотиды и нуклеозиды. Их источниками являются тучные клетки, нейтрофильные и базофильные гранулоциты, тромбоциты и ряд других клеток в очаге воспаления.
• Биогенные амины. Важнейшими представителями являются гистамин и серотонин.
♦ Гистамин, воздействуя на Н2-рецепторы клеток-мишеней, вызывает дилатацию сосудов микроциркуляторного русла и повышает проницаемость венул, что способствует экссудации. Взаимодействуя с H1-рецепторами, гистамин обусловливает: ощущения боли, жжения, зуда, напряжения.
♦ Серотонин также повышает сосудистую проницаемость и активирует сокращение ГМК венул (что способствует развитию венозной гиперемии), приводит к формированию чувства боли, стимулирует тромбообразование.
• Пептиды и белки
♦ Нейропептиды. Из числа нейропептидов при воспалении наиболее значимую роль выполняет вещество P.
♦ Цитокины регулируют пролиферативную активность, дифференцировку и фенотип клеток-мишеней. К цитокинам отнесены факторы роста, интерлейкины (ИЛ), фактор некроза опухоли
(ФНО), колониестимулирующие факторы, интерфероны (ИФН) и хемокины.
Общий современный термин для всего класса - цитокины, устаревшие наименования подклассов: лимфокины и монокины.
♦ Лейкокины - общее название для различных биологически активных веществ (БАВ), образуемых лейкоцитами, но не относящихся к иммуноглобулинам (Ig) и цитокинам. К группе лейкокинов относятся белки острой фазы, катионные белки, а также фибронектин.
♦ Ферменты. В очаге воспаления обнаруживаются ферменты всех основных групп. Их основным источником являются нейтрофилы и другие фагоциты. В начале воспаления ферменты вызывают разрыхление соединительнотканных муфт вокруг сосудов и разрушение межклеточного вещества сосудистых стенок, способствуя вазодилатации и повышению проницаемости сосудов. На поздних стадиях воспаления благодаря ферментам происходит очищение очага воспаления от погибших клеток и тканей, а также реализуются пролиферативные процессы.
• Оксид азота (эндотелием освобождаемый фактор вазодилатации) - важный медиатор воспаления.
• Липидные медиаторы воспаления
♦ Производными арахидоновой кислоты являются простагландины, тромбоксаны и лейкотриены. Арахидоновая кислота входит в состав фосфолипидов клеточных мембран, откуда и освобождается под влиянием фосфолипаз. Дальнейшие превращения этой кислоты происходят либо по циклооксигеназному (с образованием простагландинов и тромбоксанов), либо по липооксигеназному пути (с образованием лейкотриенов).
? Простагландины обладают широким спектром действия, в том числе повреждают стенки сосудов микроциркуляторного русла и повышают их проницаемость, усиливают хемотаксис и способствуют пролиферации фибробластов. Пг снижают порог болевой чувствительности и способствуют развитию лихорадки.
? Тромбоксаны вызывают вазоконстрикцию, способствуют агрегации клеток крови, стимулируют тромбообразование.
? Лейкотриены вызывают спазм ГМК стенок сосудов, бронхиол и кишечника (длительность эффекта лейкотриенов весьма велика), проявляют положительный хемотаксический эффект по отношению к фагоцитам и повышают проницаемость мембран.
♦ Фактор активации тромбоцитов образуется из мембранных фосфолипидов и является наиболее сильным сосудосуживающим веществом.
♦ Липопероксиды - продукты СПОЛ. Они дестабилизируют мембраны лизосом, способствуя высвобождению ферментов из них, и определяют эффективность заключительных этапов фагоцитоза.
• Нуклеотиды и нуклеозиды
♦ АТФ обеспечивает энергетическую «поддержку» клеток и пластических процессов в них в очаге воспаления.
♦ АДФ стимулирует адгезию, агрегацию и агглютинацию форменных элементов крови. Это вызывает тромбообразование, формирование сладжа, нарушение крово- и лимфотока в сосудах микроциркуляторного русла.
♦ Аденозин, высвобождающийся из клеток, оказывает существенное сосудорасширяющее действие с развитием артериальной гиперемии.
Плазменные медиаторы воспаления
Плазменные медиаторы воспаления, так же как и клеточные, вырабатываются клетками и высвобождаются ими в неактивном состоянии. Они появляются при активации трёх систем крови - кининовой, комплемента и гемостаза. Все компоненты этих систем находятся в крови в виде предшественников и становятся активными после воздействия на них клеточных медиаторов воспаления.
• Медиаторы кининовой системы. Основное значение при воспалении имеют брадикинин и калликреин.
♦ Брадикинин усиливает сосудистую проницаемость, обусловливает чувство боли, обладает выраженным гипотензивным действием.
♦ Калликреин вызывает хемотаксис лейкоцитов, но главное его значение - активация фактора Хагемана.
• Медиаторы системы гемостаза: факторы свертывающей, противосвертывающей и фибринолитической систем. Первично активируется фактор Хагемана. Он инициирует свёртывание белков крови, повышает проницаемость стенок сосудов, усиливает миграцию нейтрофилов и агрегацию тромбоцитов.
• Система комплемента состоит из группы специализированных белков плазмы крови, вызывающих лизис бактерий и клеток. Кроме того, некоторые компоненты комплемента, прежде всего C3b и C5b, повышают проницаемость стенок сосудов, усиливают хемотаксическую активность нейтрофилов и макрофагов.
Антимедиаторы воспаления. На всех этапах развития воспаления образуются и действуют вещества, предупреждающие избыточное накопление или прекращающие действие медиаторов, которые в совокупности могут быть объединены в систему антимедиаторов воспаления. Важнейшими антимедиаторами являются ферменты. Так, гистаминаза разрушает гистамин, карбоксипептидазы - кинины, эс-
теразы - фракции комплемента, простагландиндегидрогеназа - Пг. Большое значение имеют гуморальные влияния. Так, образующийся в гепатоцитах один из видов антитрипсина ингибирует ряд протеаз, участвующих в воспалении, что тормозит образование кининов. Глюкокортикоиды ослабляют сосудистые реакции, стабилизируя мембраны сосудов, уменьшают экссудацию и эмиграцию лейкоцитов, а также ослабляют фагоцитоз. Благодаря наличию антимедиаторов, воспаление прекращается после устранения или инактивации повреждающего агента и репарации повреждённых тканей.
СОСУДИСТЫЕ РЕАКЦИИ, ИЗМЕНЕНИЯ КРОВО-
И ЛИМФООБРАЩЕНИЯ. ЭКССУДАЦИЯ ЖИДКОСТИ.
ВЫХОД ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ В ТКАНЬ
Этот компонент воспаления включает следующие процессы:
♦ изменение тонуса стенок и просвета сосудов;
♦ нарушение гемо- и лимфодинамики;
♦ изменение реологических свойств крови;
♦ увеличение сосудистой проницаемости;
♦ собственно процесс экссудации жидкости из микрососудов;
♦ миграцию в очаг воспаления лейкоцитов и фагоцитоз, выход в ткань тромбоцитов и эритроцитов.
Изменение тонуса стенок и просвета сосудов. Нарушения регионарной гемодинамики
Просвет сосудов, крово- и лимфообращение в очаге воспаления изменяются с момента возникновения и в течение всего процесса воспаления. При этом, в разных его участках и на разных этапах оно, как правило, имеет разный характер.
♦ Ишемия является результатом спазма мышц артериол и прекапилляров за счёт рефлекторного (в ответ на боль) выделения нейромедиаторов (норадреналин). Внешние проявления: бледность, некоторое уменьшение объёма и температуры тканей. Продолжительность - от нескольких секунд до нескольких минут, так как норадреналин быстро расщепляется ферментативными системами.
♦ Артериальная гиперемия обусловлена снижением тонуса мышц стенок и расширением артериол под воздействием медиаторов воспаления. Увеличение кровоснабжения является важным защитным механизмом и способствует энергетическому обеспечению воспаления. Внешние проявления: покраснение, увеличение тургора, незначительное увеличение объёма и температуры тканей.
♦ Венозная гиперемия обусловлена нарушением оттока крови. Этому способствует сдавление венул и капилляров отёчной периваску-
лярной тканью, набухание эндотелия и изменение реологических свойств крови. Венозная гиперемия способствует повышению гидростатического давления в сосудах микроциркуляторного русла и фильтрации в ткани жидкой части крови, а следовательно, - усугублению отёка.
♦ Стаз - временное прекращение тока крови и лимфы в сосудах микроциркуляторного русла. Развивается вследствие значительного сдавления венул отёчной тканью и развитием в них сладж-феномена.
♦ Нормализация регионарного кровотока происходит по мере завершения воспаления.
Изменение реологических свойств крови. В сосудах воспалённой ткани происходит сгущение крови, краевое стояние лейкоцитов, образование сладжа и клеточных агрегатов, что снижает текучесть крови и способствует тромбозу мелких сосудов.
Увеличение сосудистой и тканевой проницаемости
Определяющим фактором экссудации жидкости за пределы сосудов при воспалении является повышение проницаемости сосудистой стенки, с чем связано образование экссудата. На проницаемость стенки сосудов основное влияние оказывают медиаторы воспаления. Повышение сосудистой проницаемости способствует межэндотелиальному и трансэндотелиальному транспорту плазмы и выходу форменных элементов крови из сосудов.
♦ Межэндотелиальные щели образуются за счёт сокращения актомиозина в эндотелиальных клетках и изменения в них структуры цитоскелета.
♦ Трансэндотелиальный транспорт осуществляется с помощью везикул и микроканалов.
Увеличение тканевой проницаемости обусловлено также изменениями коллоидного состояния межклеточного вещества.
ЭКССУДАЦИЯ ЖИДКОСТИ И ВЫХОД ФОРМЕННЫХ ЭЛЕМЕНТОВ
КРОВИ В ОЧАГ ВОСПАЛЕНИЯ
Экссудация (от лат. exsudatum - потеть, пропотевать) - процесс выхода плазмы и форменных элементов крови из сосудов микроциркуляторного русла в ткани и полости тела с образованием экссудата.
Экссудат - жидкость, образующаяся при воспалении и содержащая большое количество белка и форменные элементы крови (в основном лейкоциты).
В организме может образовываться также невоспалительная жидкость- транссудат. Он отличается от экссудата низким содержанием белка, лейкоцитов и других форменных элементов крови.
Причины экссудации
• Основная причина плазморрагии (пассивного выхода плазмы крови в интерстиций) - увеличение сосудистой проницаемости и повышение гидростатического давления крови в сосудах микроциркуляторного русла.
• Основная причина лейкоцитарной инфильтрации ткани - хемо- и электротаксис лейкоцитов.
Виды экссудата. Выделяют несколько видов экссудата: серозный, фибринозный, гнойный, гнилостный, геморрагический и катаральный. Вид экссудата определяет название формы острого экссудативного воспаления.
Значение экссудации. В очаге воспаления процесс экссудации имеет двоякое биологическое значение: адаптивное и патогенное.
• Адаптивное значение заключается в фиксации в очаге воспаления флогогена и создании оптимальных условий его инактивации и элиминации.
• Патогенное значение:
♦ сдавление и смещение органов и тканей экссудатом;
♦ возможно распространение воспалительного процесса в соседние ткани или биологические жидкости (в лимфу, кровь, ликвор и др.);
♦ образование очагов деструкции ткани при гнойном воспалении.
Эмиграция лейкоцитов
Эмиграция лейкоцитов - активный процесс их выхода из просвета сосудов микроциркуляторного русла в межклеточное пространство. Спустя 1-2 ч после воздействия на ткань флогогенного фактора в очаге воспаления обнаруживается большое число эмигрировавших нейтрофилов и других гранулоцитов, позднее - через 15-20 и более часов - моноцитов, а затем и лимфоцитов.
Процесс эмиграции последовательно проходит этапы роллинга (краевого стояния - «качения») лейкоцитов, их адгезии к эндотелию и проникновения через сосудистую стенку, а также - направленного движения лейкоцитов в очаге воспаления (рис. 5-1).
Функции лейкоцитов при воспалении
• Фагоцитоз.
• Синтез и выделение медиаторов воспаления.
• Презентация антигена лимфоцитам. Эта функция фагоцитов реализуется за счёт процессинга (поглощение и трансформация антигенных структур) и представления Аг клеткам иммунной системы (передача информации об Аг лимфоцитам).
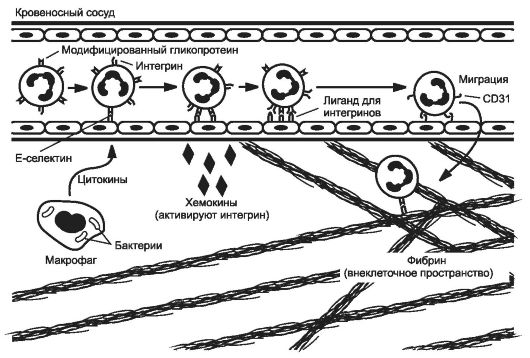 Рис. 5-1. Этапы миграции лейкоцитов через сосудистую стенку (на примере нейтрофилов). [по 4].
Рис. 5-1. Этапы миграции лейкоцитов через сосудистую стенку (на примере нейтрофилов). [по 4].
Позднее значительная часть лейкоцитов, мигрировавших в очаг воспаления, подвергается дистрофическим изменениям и превращается в «гнойные тельца» или подвергается апоптозу. Часть лейкоцитов, выполнив свои функции, возвращается в сосудистое русло и циркулирует в крови.
При значительном повышении проницаемости стенок сосудов микроциркуляторного русла в очаг воспаления «пассивно» выходят также эритроциты и тромбоциты.
ФАГОЦИТОЗ
Фагоцитоз (греч. phagein - поедать, пожирать + греч. kytos - клетка + греч. osis - процесс, состояние) - активный биологический процесс, заключающийся в распознавании, поглощении и внутриклеточной деструкции чужеродного материала специализированными клетками - фагоцитами: микрофагами (полиморфноядерными лейкоцитами) и макрофагами.
В ходе фагоцитоза выделяют несколько основных стадий (рис. 5-2).
 Рис. 5-2. Стадии фагоцитоза: 1
- адгезия частицы (например, бактерии) с помощью Fc-рецептора мембраны
фагоцита; 2 - погружение адгезированной частицы в фагоцит и образование
фагосомы; 3 - приближение и присоединение к фагосоме лизосом; 4 -
слияние мембран фагосомы и лизосом с образованием фаголизосомы; 5 -
разрушение поглощённой частицы. [по 4].
Рис. 5-2. Стадии фагоцитоза: 1
- адгезия частицы (например, бактерии) с помощью Fc-рецептора мембраны
фагоцита; 2 - погружение адгезированной частицы в фагоцит и образование
фагосомы; 3 - приближение и присоединение к фагосоме лизосом; 4 -
слияние мембран фагосомы и лизосом с образованием фаголизосомы; 5 -
разрушение поглощённой частицы. [по 4].
• Распознавание фагоцитом объекта поглощения и адгезия к нему происходит в несколько этапов:
♦ Обнаружение поверхностных детерминант объекта фагоцитоза.
♦ Опсонизация объекта фагоцитоза.
♦ Адгезия фагоцита к объекту фагоцитоза. Этот процесс реализуется с участием рецепторов лейкоцита FcyR (при наличии у объекта соответствующего лиганда) и молекул адгезии (при отсутствии лиганда, например, у неклеточных частиц).
• Поглощение объекта фагоцитом с последующим образованием фаголизосомы. Поглощенный материал погружается в клетку в составе фагосомы - пузырька, образованного плазматической мембраной. К фагосоме приближаются лизосомы, мембраны фагосомы и лизосом сливаются, и образуется фаголизосома.
• Внутриклеточное разрушение объекта фагоцитоза реализуется в результате активации двух сложных механизмов: кислородзависимой и кислороднезависимой цитотоксичности фагоцитов.
♦ Кислородзависимая цитотоксичность играет ведущую роль в деструкции объекта фагоцитоза. Она сопряжена со значительным повышением интенсивности метаболизма с участием кислорода (респираторный взрыв).
♦ Кислороднезависимые механизмы обусловлены действием лизосомальных ферментов фагоцита.
Незавершённый фагоцитоз. При незавершённом фагоцитозе поглощён- ные фагоцитами микроорганизмы не разрушаются. Это способствует персистенции и распространению инфекции в организме. Причины незавершённого фагоцитоза:
• Мембрано- и ферментопатии лизосом фагоцита.
• Повышенная резистентность микробов к ферментам фагоцита.
• Способность некоторых микробов быстро покидать фагосомы и персистировать в цитоплазме фагоцита (риккетсии, хламидии).
• Недостаточный эффект гормонов - регуляторов процесса фагоцитоза.
ПРОЛИФЕРАЦИЯ
Пролиферация - важный компонент механизма развития воспалительного процесса и завершающая его стадия - характеризуется увеличением числа стромальных и паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию или замещение разрушенных тканевых элементов.
♦ При благоприятном течении воспаления наблюдается полная регенерация ткани - восполнение её погибших и восстановление обратимо повреждённых структурных элементов (реституция).
♦ При значительном разрушении участка ткани или органа на месте дефекта паренхиматозных клеток образуется вначале грануляционная ткань, а по мере её созревания - рубец, т.е. наблюдается неполная регенерация.
Неспецифическое и специфическое воспаление
Неспецифическое воспаление не имеет специфических черт и может вызываться различными флогогенными агентами. Специфическое воспаление имеет, наряду с общими, специфические черты и вызывается определённым возбудителем. Выделяют несколько специфических воспалительных заболеваний: туберкулёз, сифилис, лепра, склерома и др.
ОСТРОЕ И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ
По течению различают острое и хроническое воспаление.
Острое воспаление
Острое воспаление характеризуется:
• Интенсивным течением и завершением воспаления, как правило, в течение одной или двух недель.
• Наиболее часто в очаге воспаления преобладают процессы экссудации, и такое воспаление называют «экссудативным».
ЭКССУДАТИВНОЕ ВОСПАЛЕНИЕ
Экссудативное воспаление характеризуется образованием экссудата, состав которого определяется, главным образом, причиной воспаления и реакцией организма на повреждение.
• Серозное воспаление характеризуется формированием мутного экссудата, который содержит небольшое количество лейкоцитов, слущенных эпителиальных клеток и до 2-2,5% белка. Примеры: воспаление при крапивнице или пузырчатке.
• Фибринозное воспаление характеризуется образованием экссудата, содержащего, помимо лейкоцитов, большое количество фибриногена, который выпадает в тканях в виде нитей фибрина. Фибринозный экссудат пропитывает погибшие ткани, образуя светло-серую плён- ку. В зависимости от структуры эпителиальных покровов и особенностей подлежащей соединительной ткани выделяют два вида фибринозного воспаления:
♦ Крупозное воспаление. На однослойном эпителиальном покрове и плотной базальной мембране образуется тонкая, легко снимающаяся фибринозная плёнка. Такое фибринозное воспаление называется крупозным. Оно встречается на слизистых оболочках трахеи и бронхов, серозных оболочках.
♦ Дифтеритическое воспаление. Многослойный плоский неороговевающий эпителий, переходный эпителий и рыхлая широкая соединительнотканная основа органа способствуют развитию глубокого некроза и формированию толстой, трудно снимающейся фибринозной плёнки, после удаления которой остаются глубокие язвы. Такое фибринозное воспаление называется дифтеритическим. Оно развивается в зеве, на слизистых оболочках пищевода, матки и влагалища, кишечника и желудка, мочевого пузыря.
• Гнойное воспаление характеризуется образованием гнойного экссудата. Он представляет собой сливкообразную массу, состоящую из детрита, погибших форменных элементов крови (от 17% до 29%),
микробов. Гной имеет специфический запах, синевато-зеленоватую окраску с различными оттенками, содержание белка в нём составляет 3-7% и более. Основными формами гнойного воспаления являются абсцесс, флегмона, эмпиема, гнойная рана.
♦ Абсцесс - отграниченное гнойное воспаление с образованием полости, заполненной гнойным экссудатом.
♦ Флегмона - разлитое гнойное воспаление, при котором экссудат пропитывает и расслаивает ткани.
♦ Эмпиема - очаговое гнойное воспаление полостей тела или полых органов.
♦ Гнойная рана - возникает либо вследствие нагноения травматической раны, либо в результате вскрытия во внешнюю среду очага гнойного воспаления и образования раневой поверхности.
• Гнилостное воспаление (ихорозное) характеризуется выраженным некрозом тканей.
• Геморрагическое воспаление сопровождается особенно высокой проницаемостью сосудов микроциркуляторного русла, диапедезом эритроцитов и их примесью к уже имеющемуся экссудату (серозногеморрагическое, гнойно-геморрагическое воспаление).
• Катаральное воспаление характеризуется примесью слизи к любому экссудату.
ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИЯ
Признаки острого воспаления подразделяют на местные и общие (системные).
• Местные признаки острого воспаления. В очаге острого воспаления наблюдаются: ❖ покраснение - rubor; ❖ припухлость - tumor;
♦ боль - dolor; ❖ жар (повышение температуры в очаге воспаления) - calor; ❖ нарушение функции - functio laesa.
• Системные изменения при остром воспалении. Вследствие резорбции из очага воспаления в кровь медиаторов воспаления и продуктов распада ткани развивается ряд системных эффектов: лейкоцитоз, лихорадка, диспротеинемия, увеличение скорости оседания эритроцитов, изменение гормонального статуса организма, аллергизация организма.
Таким образом, воспаление, являясь местным процессом, отражает общую, системную реакцию организма на действие флогогенного агента.
Хроническое воспаление
Хроническое воспаление может быть первичным и вторичным.
• Если воспаление после острого периода приобретает затяжной характер, то оно обозначается как «вторично хроническое».
• Если воспаление изначально имеет персистирующее (вялое и длительное) течение, его называют «первично хроническим».
Проявления хронического воспаления. Для хронического воспаления характерен ряд признаков: развитие гранулём, формирование капсул, некроз, инфильтрация ткани моноцитами и лимфоцитами. Активация макрофагов иммунными и неиммунными факторами (рис. 5-3) обусловливает дополнительное повреждение тканей и развитие фиброза. При хроническом воспалении часто преобладает процесс пролиферации, и такое воспаление называют пролиферативным. Причины хронического воспаления многообразны:
• Различные формы фагоцитарной недостаточности.
• Длительный стресс и другие состояния, сопровождающиеся повышенной концентрацией в крови катехоламинов и глюкокортикоидов. Указанные группы гормонов подавляют процессы пролиферации, созревания фагоцитов, потенцируют их разрушение.
 Рис. 5-3. Роль активированных макрофагов в развитии и течении хронического воспаления. Активированные
макрофаги синтезируют арахидоновую кислоту, тромбоцитарные факторы
роста и другие медиаторы воспаления, потенцирующие вторичную альтерацию.
В развитии повреждения тканей принимают участие токсические метаболиты
кислорода, протеазы, факторы хемотаксиса нейтрофилов, факторы
свёртывания, метаболиты арахидоновой кислоты и оксид азота. Для развития
неиммунной активации важны эндотоксины, фибронектин, химические
медиаторы воспаления. Развитие фиброза зависит от перестройки коллагенов
под влиянием разных факторов роста и цитокинов, а также от факторов
ангиогенеза. [по 4].
Рис. 5-3. Роль активированных макрофагов в развитии и течении хронического воспаления. Активированные
макрофаги синтезируют арахидоновую кислоту, тромбоцитарные факторы
роста и другие медиаторы воспаления, потенцирующие вторичную альтерацию.
В развитии повреждения тканей принимают участие токсические метаболиты
кислорода, протеазы, факторы хемотаксиса нейтрофилов, факторы
свёртывания, метаболиты арахидоновой кислоты и оксид азота. Для развития
неиммунной активации важны эндотоксины, фибронектин, химические
медиаторы воспаления. Развитие фиброза зависит от перестройки коллагенов
под влиянием разных факторов роста и цитокинов, а также от факторов
ангиогенеза. [по 4].
• Взаимодействие лимфоцитов и макрофагов, в избытке инфильтрирующих ткани при хроническом воспалении, с высвобождением большого количества повреждающих медиаторов (рис. 5-4).
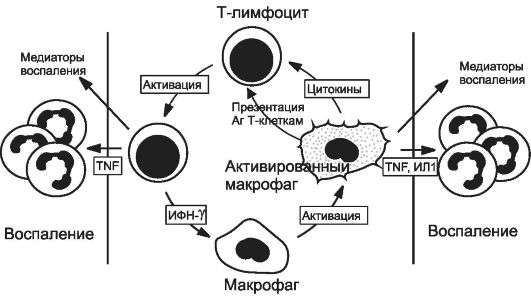 Рис. 5-4. Взаимодействие макрофагов и лимфоцитов при хроническом воспалении. Активированные
лимфоциты и макрофаги оказывают влияние друг на друга, а также выделяют
медиаторы воспаления, которые повреждают окружающие клетки. TNF -
фактор некроза опухоли. [по 4].
Рис. 5-4. Взаимодействие макрофагов и лимфоцитов при хроническом воспалении. Активированные
лимфоциты и макрофаги оказывают влияние друг на друга, а также выделяют
медиаторы воспаления, которые повреждают окружающие клетки. TNF -
фактор некроза опухоли. [по 4].
• Повторное повреждение ткани или органа (например, лёгких компонентами пыли), сопровождающееся образованием чужеродных Аг и развитием иммунопатологических реакций.
• Особенности микроорганизмов (устойчивость к действию факторов системы иммунобиологического надзора организма, мимикрия, образование L-форм).
Принципы терапии воспаления
Этиотропное лечение подразумевает устранение, прекращение, уменьшение силы и длительности действия на ткани и органы флогогенных факторов. С этой целью применяют, например, антибактериальные препараты.
Патогенетическое лечение имеет целью блокирование механизма развития воспаления. При этом воздействия направлены на разрыв звеньев патогенеза воспаления, лежащих в основе, главным образом, процессов альтерации и экссудации. Для этого используют, например,
антигистаминные препараты, глюкокортикоиды, ингибиторы циклооксигеназ.
Саногенетическая терапия направлена на активацию общих и местных механизмов компенсации, регенерации, защиты, восстановления и устранения изменений в тканях и клетках, вызванных флогогенным агентом.
Симптоматическое лечение. Мероприятия, направленные на предупреждение или устранение неприятных, тягостных, усугубляющих состояние пациента симптомов (с этой целью применяют, например, анестезирующие ЛС, вещества, способствующие нормализации функций органов и физиологических систем).