Патофизиология: учебник / Литвицкий П.Ф. - 4-е изд., - 2009. - 496 с.
|
|
|
|
ГЛАВА 16. ИММУНОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ
В организме человека постоянно происходят мутации. Их суммарное количество в расчёте на один клеточный цикл составляет примерно 1х106. Часть мутаций сопровождается синтезом новых белков, обладающих антигенными свойствами. Кроме того, организм постоянно подвергается атаке вирусов, бактерий, риккетсий, грибов, паразитов, способных вызвать различные болезни. В связи с этим в ходе эволюции сформировалась высокоэффективная система клеточных и неклеточных факторов распознавания собственных и чужеродных структур - система иммунобиологического надзора (ИБН).
СИСТЕМА ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА
Биологическая роль системы ИБН заключается в контроле за индивидуальным и однородным клеточно-молекулярным составом организма. Система ИБН включает в себя иммунную систему и комплекс факторов неспецифической защиты.
Обнаружение носителя чужеродной генетической или антигенной информации (молекул, вирусов, клеток или их фрагментов) сопровождается его инактивацией, деструкцией и, как правило, элиминацией. При этом клетки иммунной системы способны сохранять «память» о данном агенте, и при повторном контакте эффективность ответа системы ИБН повышается.
Антигены
Инициальным звеном процесса формирования иммунного ответа является распознавание чужеродного агента - антигена (Аг).
Антиген - вещество экзоили эндогенного происхождения, способное вызывать иммунные реакции.
Учитывая способность Аг вызывать толерантность, иммунный или аллергический ответ антигены называют ещё толерогенами, иммуногенами или аллергенами соответственно.
Иммунитет
В иммунологии термин «иммунитет» применяют в трёх значениях.
• Для обозначения состояния невосприимчивости организма к воздействию носителя Аг.
• Для обозначения реакций иммунной системы в ответ на действие
Аг.
• Для обозначения физиологической формы иммуногенной реактивности организма на Аг.
Иммунная система
Иммунная система - комплекс органов и тканей, содержащих иммунокомпетентные клетки и обеспечивающих антигенную индивидуальность и однородность организма.
Иммунная система состоит из центральных и периферических органов.
• К центральным (первичным) органам относят костный мозг и вилочковую железу. В них происходит антигеннезависимое деление и созревание лимфоцитов, которые впоследствии мигрируют в периферические органы иммунной системы.
• К периферическим (вторичным) органам относят селезёнку, лимфатические узлы, миндалины, лимфоидные элементы ряда слизистых оболочек. В этих органах происходит антигензависимая пролиферация и дифференцировка лимфоцитов.
Иммунокомпетентные клетки
К иммунокомпетентным клеткам относятся T- и B-лимфоциты, а также антигенпредставляющие (антигенпрезентирующие) клетки.
B-лимфоциты
B-лимфоциты проходят антигеннезависимую пролиферацию и дифференцировку в костном мозге, а затем мигрируют в тимус-независимые зоны периферических лимфоидных органов. B-лимфоциты составляют эффекторное звено гуморального иммунного ответа. Зрелые B-лимфоциты (плазматические клетки) вырабатывают АТ - Ig всех известных классов. CD19, CD20 и CD22 - основные маркёры, используемые для идентификации B-клеток.
T-лимфоциты
Антигеннезависимая пролиферация и дифференцировка T-лимфоци- тов происходит под контролем вилочковой железы.
T-лимфоциты узнают Аг, предварительно процессированный и представленный на поверхности антигенпредставляющих клеток. T-лимфо- циты ответственны за клеточный иммунный ответ, а также за регуляцию ответа на Аг стимул B-лимфоцитов при гуморальном иммунном ответе. T-клетки состоят из функциональных подтипов CD4+ и CD8+.
♦ T-хелперы (TH) - CD4+ T-клетки. При активации синтезируют и секретируют цитокины (ИЛ2, ИЛ4, ИЛ5, ИЛ6, γ-ИФН). В ходе иммунного ответа узнают молекулы MHC класса II.
♦ Цитотоксические T-лимфоциты (TC) - CD8+ T-клетки, уничтожают инфицированные вирусом, опухолевые и чужеродные клетки. Взаимодействуют с молекулой MHC класса I.
♦ T-супрессоры (TS) - представители CD8+ T-клеток - регулируют интенсивность иммунного ответа, подавляя активность TH клеток. Защищают организм от нежелательных последствий иммунной реакции, от чрезмерного воспаления и аутоагрессии.
NK-клетки (MHC-нерестригированные киллеры, естественные киллеры) составляют до 15% всех лимфоцитов крови. Они не имеют поверхностных детерминант, характерных для T- и B-лимфоцитов. В типичных NK-клетках экспрессируются дифференцировочные Аг CD2, CD7, CD56 и CD16, а при активации появляется гликопротеин CD69. NK-клетки распознают и уничтожают опухолевые и вирус-инфицированные клетки.
Антигенпредставляющие клетки присутствуют преимущественно в коже, лимфатических узлах, селезёнке и тимусе. К ним относятся макрофаги, дендритные клетки, фолликулярные отростчатые клетки лимфоузлов и селезёнки, клетки Лангерханса, М-клетки в лимфатических фолликулах пищеварительного тракта, эпителиальные клетки вилочковой железы. Эти клетки захватывают, перерабатывают и (в отличие от «обычных» фагоцитов) представляют Аг (эпитоп) на своей поверхности другим иммунокомпетентным клеткам, вырабатывают ИЛ1 и другие цитокины, а также секретируют ПгБ2, угнетающий иммунный ответ.
Взаимодействие клеток при иммунном ответе
Иммунный ответ возможен в результате активации клонов лимфоцитов и состоит из двух фаз. В первой фазе Аг активирует те лимфоциты, которые его распознают. Во второй (эффекторной) фазе эти лимфоциты координируют иммунный ответ, направленный на устранение Аг. Гуморальный иммунный ответ. В гуморальном иммунном ответе эффекторными клетками являются антигенпредставляющие клетки и B-лим- фоциты. Регуляцию антителообразования осуществляют T-хелперы и T-супрессоры.
Клеточный иммунный ответ. В клеточном иммунном ответе эффекторными клетками являются антигенпредставляющие клетки и цитотоксические T-лимфоциты, активность которых регулируют T-хелперы и T-супрессоры.
Неспецифическая защита организма
Помимо иммунокомпетентных клеток, в реакциях обнаружения и устранения чужеродных структур участвуют неспецифические клеточные и гуморальные факторы.
Механические барьеры
Кожные покровы защищены многослойным эпителием, который механически препятствует проникновению чужеродных агентов и устраняет их с поверхности за счёт постоянного слущивания отмерших слоёв эпидермиса. Эта «линия обороны» подкреплена бактерицидными веществами секретов кожных желёз и мощной системой иммунной защиты кожи (лимфоциты, клетки системы мононуклеарных фагоцитов). Слизистые оболочки могут иметь специальные анатомические структуры (например, реснички в мерцательном эпителии трахеи). Погружённые в слизь реснички формируют волны однонаправленных колебаний и перемещают слизь с заключёнными в ней частицами к выходу из дыхательных путей (процесс мукоцилиарного транспорта). Физико-химические факторы. Слизистые оболочки имеют множество защитных факторов - от кислых значений pH желудка до секреции ферментов и АТ.
♦ Слизь. Слизистые оболочки покрыты слоем слизи - организованной гелеобразной гликопротеиновой структуры, задерживающей и фиксирующей различные объекты, в том числе микроорганизмы.
♦ Лизоцим. В слизи содержится лизоцим - фермент, лизирующий клеточные стенки преимущественно грамположительных бактерий. Лизоцим присутствует и в других жидкостях организма (например, в слюне, слёзной жидкости).
♦ Сурфактант. В нижних участках воздухоносных путей и дыхательном отделе лёгкого слизи нет, но поверхность эпителия покрыта слоем сурфактанта - поверхностно-активного вещества, способного фиксировать и уничтожать грамположительные бактерии.
♦ Иммуноглобулины. На поверхность эпителия ЖКТ и респираторного тракта постоянно выделяются молекулы секреторного IgA.
Воспаление способствует элиминации чужеродных агентов за счёт образования экссудата и выхода форменных элементов крови в ткань, фагоцитоза и снижения pH (см. главу 5 «Воспаление»).
Система комплемента - группа из 26 сывороточных белков, опосредующих воспалительные реакции при участии гранулоцитов и макрофагов. Основные функции компонентов комплемента в защитных реакциях - стимуляция фагоцитоза, нарушение целостности клеточных стенок микроорганизмов и индукция синтеза медиаторов воспалительного ответа (например, ИЛ1). Кроме того, система комплемента стимулирует воспалительные реакции, участвует в развитии иммунных и анафилактических реакций.
Фагоциты выполняют не только защитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры организма), а также являются антигенпрезентирующими клетками. Фагоциты представлены клетками миелопоэтического ряда и макрофагально-моноцитарной системы (см. статью «Фагоцитоз» главы 5).
Интерфероны (ИФН) выполняют антивирусную, противоопухолевую, иммуномодулирующую и радиопротективную функции. Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект ИФН не обладает вирусоспецифичностью. Различают три ИФН:
♦ α-ИФН синтезируют лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН);
♦ β-ИФН синтезируют фибробласты (ранее был известен как фибробластный ИФН);
♦ γ-ИФН - продукт стимулированных T-лимфоцитов, NK-клеток и макрофагов (ранее был известен как иммунный ИФН).
Естественные АТ («антигеннезависимые», «неспецифические» АТ) составляют до 7% общего количества иммуноглобулинов в сыворотке крови неиммунизированных людей и животных. Их происхождение связывают с ответом иммунной системы на Аг нормальной микрофлоры. В эту же группу входят АТ, длительно циркулирующие после выздоровления от инфекционного заболевания. Часть пула подобных АТ синтезируется параллельно с образованием специфических АТ. Эти АТ низкоспецифичны, но способны перекрёстно реагировать с широким спектром Аг.
Естественные киллеры. Помимо фагоцитирующих клеток, важную роль в быстром реагировании организма на чужеродные Аг играют естественные киллеры (NK-клетки). Эту популяцию составляют большие зернистые лимфоциты, элиминирующие опухолевые клетки, а также клетки, инфицированные вирусами, бактериями и простейшими.
ИММУНОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ И РЕАКЦИИ
Расстройства механизмов контроля со стороны системы ИБН за индивидуальным и однородным антигенным составом организма проявляются разнообразными иммунопатологическими состояниями и реакциями. Иммунодефицитные состояния, аллергические реакции, болезни и состояния иммунной аутоагрессии, патологическая толерантность, реакции «трансплантат против хозяина» являются следствием дефекта или нарушения деятельности одного или нескольких звеньев системы ИБН, обеспечивающих в норме эффективный иммунный ответ.
ЭТИОЛОГИЯ
Иммунопатологические состояния могут быть первичными или вторичными.
• Причина первичных нарушений - наследственный или врождённый дефект генетической программы иммунокомпетентных клеток, а также клеток, обеспечивающих неспецифическую защиту организма.
• Причиной вторичных нарушений являются расстройства, возникающие после рождения на разных этапах онтогенеза индивида. Они развиваются в результате повреждения клеток системы ИБН под влиянием факторов физической, химической или биологической природы.
ПАТОГЕНЕЗ
Патогенез иммунопатологических состояний сложен и имеет несколько вариантов развития.
• Гипорегенераторный. Этот механизм (например, иммунодефицита и патологической толерантности) заключается в торможении пролиферации стволовых гемопоэтических или других пролиферирующих предшественников клеток иммунной системы.
• Дисрегуляторный. Данный механизм обусловлен расстройствами дифференцировки антигенпредставляющих клеток, T- или B-лим- фоцитов, а также кооперации этих клеток. Причины:
♦ изменение соотношения количества или эффектов разных категорий иммунокомпетентных клеток (например, увеличение числа супрессоров или уменьшение количества хелперов и индукторов);
♦ нарушение содержания БАВ, а также числа или чувствительности рецепторов к ним на мембранах иммуноцитов.
• Деструктивный (цитолитический) механизм обусловлен разрушением иммуноцитов. Причины:
♦ дефект самих иммуных клеток;
♦ действие на иммунокомпетентные клетки цитолитических агентов (например, АТ, мембраноатакующего комплекса комплемента, больших доз цитостатиков, глюкокортикоидов и др.).
Иммунодефициты и иммунодефицитные состояния
В основе развития иммунодефицитных состояний и иммунодефицитов, как правило, лежит недостаток (или отсутствие) клеток иммунной системы или расстройства их функций.
Иммунодефицитные состояния и иммунодефициты - типовые формы патологии системы ИБН, обусловленные снижением эффективности или неспособностью иммунной системы разрушать и элиминировать чужеродные Аг.
Виды
• Первичные иммунодефициты: результат наследуемых и врождённых (генетических) дефектов иммунной системы.
• Вторичные иммунодефициты, или иммунодефицитные состояния: следствие эндо- и экзогенных воздействий на нормальную иммунную систему.
• Избирательные - вызваны селективным поражением отдельных популяций иммунокомпетентных клеток.
• Неспецифические - дефекты механизмов неспецифической резистентности организма.
• Комбинированные - сочетанное поражение клеточных и гуморальных механизмов иммунитета (например, B- и T-лимфоцитов).
В зависимости от преобладания дефекта иммуноцитов того или иного класса, иммунодефициты и иммунодефицитные состояния подразделяют на B-, T-, A-зависимые (относящиеся к антигенпредставляющим клеткам) и смешанные.
Этиология
• Первичные иммунодефициты обусловлены генными и хромосомными дефектами.
• Вторичные иммунодефициты, или иммунодефицитные состояния имеют большое количество причин:
♦ ЛС с иммуносупрессивным действием (например, глюкокортикоиды, цитостатики).
♦ Недостаточность питания, полостного и мембранного пищеварения, а также кишечного всасывания.
♦ Наркотики и токсические вещества.
♦ Лучевые воздействия.
♦ Рост злокачественных опухолей.
♦ Вирусы (например, ВИЧ).
♦ Состояния, приводящие к потере белка (например, нефротический синдром).
♦ Гипоксия, гипотиреоз, уремия, отсутствие селезенки (аспления) и др.
Факторы риска:
♦ Отягощённый семейный анамнез.
♦ Старение.
Примеры иммунодефицитов
Существует множество отдельных нозологических единиц иммунодефицитов. Ниже перечислены некоторые, наиболее клинически значимые, иммунодефициты.
Синдром ретикулярной дисгенезии. При врождённой алейкии врождён- ный агранулоцитоз и лейкопения приводят к развитию тяжёлого иммунодефицита, часто сочетающегося с гипоплазией вилочковой железы. Синдром ретикулярной дисгенезии характеризуется значительным уменьшением в костном мозге количества стволовых кроветворных клеток, блоком созревания из них миело-, лимфо- и моноцитов с развитием комбинированного дефицита А-, B- и T-клеток, а также нейтрофилов. Пациенты с этим синдромом, как правило, погибают вскоре после рождения от различных инфекций (нередко - от сепсиса) или злокачественных опухолей.
Синдром Шедьяка-Хигаси. При аномалии Шедьяка-ШтайнбринкаХигаси происходит блокада пролиферации миелостволовой клетки, что приводит к многочисленным последствиям: дефектам фагоцитоза, гипогаммаглобулинемии, нейтропении, тромбоцитопении. Характерны изменения всех органов и тканей, а также психомоторные дефекты и выраженная предрасположенность к инфекциям. Тяжёлый комбинированный иммунодефицит. В классическом варианте отсутствуют реакции как гуморального (дефицит АТ), так и клеточного иммунитета (значительно уменьшено число T-клеток и NK-клеток); выявляются алимфоплазия и лимфопения. Смерть наступает к концу первого года жизни от инфекций (если не проведена трансплантация костного мозга).
Другие иммунодефициты: синдром Вискотта-Олдрича, атаксия-телеангиэктазия, хронический кандидоз кожи и слизистых оболочек, хронические гранулематозные заболевания, альбинизм, СПИД, агаммаглобулинемии.
Принципы коррекции иммунодефицитов
♦ При тяжёлой патологии T-клеток показана трансплантация костного мозга.
♦ При гуморальных и комбинированных иммунодефицитах проводят заместительную терапию Ig.
♦ Практически при всех формах необходимо назначение антибиотиков (для профилактики и немедленного лечения инфекций) и иммуностимуляторов (для оптимизации функции неспецифических механизмов иммунитета).
Осложнения иммунодефицитов
• Тяжёлые инфекции.
• Злокачественные новообразования (например, при гипогаммаглобулинемии может развиться тимома).
• Аутоагрессивные иммунные заболевания.
Профилактика
При первичных иммунодефицитах необходимо медико-генетическое консультирование и проведение соответствующих профилактических мероприятий.
ВИЧ-ИНФЕКЦИЯ И СПИД
• ВИЧ-инфекция - инфекция, вызываемая вирусами иммунодефицита человека (ВИЧ), поражающими лимфоциты, макрофаги, нервные и многие другие клетки.
• Синдром приобретённого иммунодефицита (СПИД) - вторичный иммунодефицитный синдром, развивающийся в результате ВИЧ-инфекции. СПИД является одним из наиболее клинически значимых иммунодефицитов. Этот синдром был описан в научной литературе в 1981 г. американскими исследователями.
Этиология. Возбудителями являются вирусы иммунодефицита человека рода Retrovirus подсемейства Lentivirinae семейства Retroviridae.
Эпидемиология
• Источник инфекции - человек в любой стадии инфекционного процесса. Вирус выделяют из крови, спермы, влагалищного секрета, материнского молока, слюны.
• Пути передачи - половой, парентеральный, трансплацентарный, через материнское молоко.
Группы риска. Гомосексуальные и бисексуальные мужчины и женщины; наркоманы, использующие наркотики внутривенно; реципиенты крови и её компонентов, трансплантируемых органов.
Патогенез
• ВИЧ поражает активированные CD4+-клетки (T-лимфоциты, особенно TH первого типа; моноциты, макрофаги и некоторые другие клетки), используя молекулу CD4 в качестве рецептора.
• Центральное звено патогенеза СПИДа - иммуносупрессия.
♦ Главная причина уменьшения числа T-клеток - проявление цитопатического эффекта, вызванного репликацией вируса. Аккумуляция неинтегрированной вирусной ДНК в цитоплазме инфицированных клеток обусловливает бурную репликацию ВИЧ и гибель клеток.
♦ Появление вирусных гликопротеинов в мембране заражённых T-клеток - пусковой механизм для аутоиммунных процессов против подобных клеток.
♦ ВИЧ инфицирует клетки-предшественники в тимусе и костном мозге, что приводит к развитию тромбоцито- и лейкопений.
♦ Дефекты гуморального и клеточного иммунитета обусловлены дефицитом T-хелперов. Так, B-клетки продуцируют только АТ с низкой специфичностью к Аг ВИЧ. Иммунодефицит позволяет ВИЧ избегать действия факторов ИБН.
Проявления ВИЧ-инфекции и СПИДа
Стадия сероконверсии (виремии). В течение нескольких недель или месяцев после инфицирования в крови обнаруживают вирус и вирусные Аг при отсутствии специфических АТ в сыворотке, появляющихся у большинства инфицированных ВИЧ через 3-6 мес после заражения. После короткого (2-4 нед) инкубационного периода у 50-90% больных отмечают симптомы, напоминающие инфекционный мононуклеоз или простуду (головная боль, лихорадка, кожная сыпь и лимфаденопатия), спонтанно исчезающие в течение нескольких недель. Бессимптомная стадия. Больной остаётся сероположительным при отсутствии симптомов либо при их минимальной выраженности (обычно диффузная реактивная лимфаденопатия и головная боль). Стадия ранней симптоматики. О переходе бессимптомной ВИЧ-инфекции в заболевание с неспецифическими симптомами свидетельствуют лихорадка, повышенное ночное потоотделение, слабость, хроническая диарея, рассеянная лимфаденопатия и головная боль при отсутствии какой-либо специфической или оппортунистической инфекции. Стадия поздней симптоматики. При прогрессирующем уменьшении CD4+-клеток возрастает риск развития оппортунистических инфекций:
♦ пневмонии, вызванной Pneumocystis carinii;
♦ инфекций, вызванных атипичными микобактериями, например Mycobacterium avium-intracellular;
♦ хронического криптоспоридиоза или изоспориоза;
♦ внекишечного стронгилоидоза.
Отмечается тяжёлое течение, нередко с генерализацией, обычных инфекций: ту- беркулёза, цитомегаловирусной инфекции, токсоплазмоза, кандидоза, нокардиоза, простого и опоясывающего герпеса.
Лечение
• Основной принцип лечения - этиотропный. В настоящее время применяют ингибиторы обратной транскриптазы ВИЧ (зидовудин, залцитабин, диданозин), ингибиторы протеаз (индинавира сульфат), ингибиторы процессов сборки и созревания дочерних популяций (например, α-интерферон).
• Проводят профилактику оппортунистических инфекций. С этой целью используют антибактериальные, противовирусные и противопротозойные препараты.
Патологическая толерантность
Иммунологическая толерантность - состояние, характеризующееся «терпимостью» иммунной системы к чужеродным для неё Аг.
Иммунологическую толерантность подразделяют на физиологическую, патологическую и искусственную.
ФИЗИОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ
Физиологическая толерантность подразумевает «терпимость» системы ИБН к собственным Аг.
Основные механизмы развития физиологической толерантности.
♦ Элиминация в антенатальном периоде тех клонов лимфоцитов, которые подверглись антигенной перегрузке - воздействию собственных Аг.
♦ Изоляция Аг ряда органов от контакта с иммуноцитами структурно-физиологическими (гемато-тканевыми) барьерами. К таким органам относятся мозг, глаза, семенники, щитовидная железа. Эту разновидность толерантности называют изоляционной.
♦ Подавление пролиферации и дифференцировки аутоагрессивных T-лимфоцитов в тимусе. Этот феномен называют центральной селекцией и ликвидацией аутоцитотоксических лимфоцитов.
♦ Апоптоз клонов лимфоцитов, активирующихся аутоантигенами.
♦ Депрессия аутоцитотоксических лимфоцитов T-супрессорами.
ПАТОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ
В этом случае речь идет о «терпимости» системой ИБН чужеродных Аг, чаще всего - бактерий, вирусов, клеток опухолей, чужеродного трансплантата.
Основные причины и механизмы патологической толерантности.
♦ Иммунодефициты. Они приводят к неспособности полноценного ответа системы ИБН на Аг.
♦ Чрезмерная активность T-супрессоров. Характеризуется торможением созревания эффекторных клеток иммунной системы: T-киллеров, естественных киллеров, плазматических клеток.
♦ Ингибирование или блокада цитотоксических реакций клеточного иммунитета на соответствующий Аг (чаще всего клеток опухоли, трансплантата или вируссодержащих клеток).
♦ Перегрузка иммуноцитов избытком образующихся в организме или вводимых в него извне чужеродных Аг. Это может наблюдаться при синтезе аномальных белков в печени, амилоидозе, денатурации белковых молекул при обширных ожогах.
ИСКУССТВЕННАЯ ТОЛЕРАНТНОСТЬ
Индуцированную (искусственную, медицинскую) толерантность воспроизводят путём целенаправленного подавления активности иммунной системы. Обычно с этой целью применяют ионизирующее излучение или высокие дозы иммунодепрессантов. Для создания искусственной толерантности применяют также специальные имплантируемые камеры, непроницаемые для иммуноцитов (например, с фрагментами эндокринной железы для устранения недостатка эндогенного гормона).
Состояние индуцированной толерантности применяют для повышения успеха трансплантации органов и тканей, лечения аллергии, болезней иммунной аутоагрессии, эндокринной недостаточности и некоторых других состояний.
Реакция «трансплантат против хозяина»
Реакция «трансплантат против хозяина» развивается при трансплантации реципиенту («хозяину») тканей донора, содержащих иммуноциты (например, костного мозга, селезёнки, лейкоцитарной массы). Условия развития реакций «трансплантат против хозяина»:
♦ Генетическая чужеродность донора и реципиента.
♦ Наличие в трансплантате большого числа лимфоцитов.
♦ Неспособность реципиента уничтожить или отторгнуть этот трансплантат.
• Проявления реакции «трансплантат против хозяина» обусловлены поражением тканей и органов иммунной системы реципиента и развитием в связи с этим иммунодефицита. Повреждаются также другие ткани и органы: кожа, мышцы, ЖКТ, печень, почки. У взрослых реакция «трансплантат против хозяина» проявляется
трансплантационной болезнью (гомологичной болезнью; термин
происходит от слова «гомотрансплантат»).
• У детей развивается рант-болезнь - болезнь малого роста (от англ. runt, наименьшая особь). Нарушение физического развития ребёнка сочетается с полиорганной недостаточностью, склонностью к развитию инфекций и новообразований.
Аллергические реакции
При обнаружении носителя чужеродной антигенной информации система ИБН, как правило, обеспечивает его нейтрализацию, деструкцию и удаление из организма. Однако, иммунные реакции не всегда протекают по этой схеме. Нередко одновременно происходит повреждение и разрушение собственных клеток и неклеточных структур, что сопровождается расстройством функций многих тканей, органов и их физиологических систем. Такой тип иммунных реакций получил название реакций изменённой или аномально повышенной чувствительности (гиперчувствительности). Австрийский патолог фон Пирке в 1906 г. предложил для обозначения этих реакций термин «аллергия».
Аллергия - типовая патологическая форма иммунной реактивности, при которой ответ на чужеродный Аг сопровождается повреждением собственных структур организма.
Аллергия выявляется у 10-20% населения. Наиболее часто среди аллергических болезней встречаются поллинозы, бронхиальная астма, контактная аллергия, анафилактические реакции.
ОБЩИЕ ПРИЗНАКИ АЛЛЕРГИИ
Аллергические реакции направлены на обнаружение, локализацию (фиксацию), деструкцию и удаление из организма причины аллергии - носителя Аг. Следовательно, при аллергии, как и при нормальной - иммунной реакции, достигается поддержание антигенной индивидуальности и однородности организма путём удаления из него чужеродных структур. Однако, эти механизмы при аллергии не совершенны, и не всегда могут обеспечить ликвидацию чужеродных антигенов, а также имеют ряд отличий от физиологической формы иммунной реактивности:
• Повреждение, наряду с чужеродными, собственных структур организма.
• Неадекватность реакции на Аг. Она проявляется реакцией гиперчувствительности (гиперергическим ответом), часто - генерализованной.
• Развитие, помимо собственно аллергической реакции, других - неиммунных расстройств в организме.
• Снижение адаптивных возможностей организма в целом.
ЭТИОЛОГИЯ
Причина аллергических реакций: Аг, называемые в данном случае аллергенами.
Аллерген - вещество экзоили эндогенного происхождения, вызывающее образование АТ, сенсибилизированных лимфоцитов, а также - медиаторов аллергии, повреждающих как носителей аллергена, так и собственные структуры организма.
Виды аллергенов
Аллергены попадают в организм извне (экзогенные) или образуются в нём самом (эндогенные).
• Экзогенные аллергены проникают в организм одним или несколькими путями: через ЖКТ, дыхательные пути, кожу и слизистые, кровь, лимфу, ликвор, плаценту. Экзогенные аллергены являются наиболее частой причиной реакций гиперчувствительности. К ним относятся:
♦ Продукты питания (наибольшей аллергенностью обладают молоко, яйца, рыба, фрукты и овощи).
♦ Многие ЛС и вакцины.
♦ Пыльца растений, трав, деревьев, кустарников, цветов, компоненты пыли (неорганические и органические).
♦ Синтетические соединения различного происхождения.
• Эндогенные аллергены - белок или белоксодержащие соединения, образующиеся в результате денатурации клеток и неклеточных структур, а также при их модификации под влиянием веществ эндоили экзогенного происхождения.
ВИДЫ АЛЛЕРГИИ
Существует несколько критериев дифференцировки аллергий, в основу которых положены различные критерии.
Механизм гиперчувствительности. Джелл и Кумбс подразделили гиперчувствительность на четыре основных типа (в зависимости от механизмов, участвующих в их реализации). Иммунопатологические процессы опосредованы, как правило, комбинацией нескольких реакций гиперчувствительности.
Природа сенсибилизирующего и разрешающего аллергенов
• Специфическая аллергия обусловлена повторным попаданием в организм или образованием в нём того же аллергена (его называют разрешающим), который при первом воздействии сенсибилизировал этот организм (сенсибилизирующего).
• Нередко развиваются так называемые неспецифические аллергические реакции.
♦ Параллергия. Когда белковые аллергены (как сенсибилизирующий, так и разрешающий) имеют близкую, но не идентичную структуру, развиваются параллергические реакции (например, при проведении вакцинаций от различных болезней с небольшими промежутками времени между ними).
♦ Гетероаллергия возникает в тех случаях, когда разрешающим агентом является какое-либо неантигенное воздействие (например, охлаждение, перегревание, интоксикация, облучение организма). В подобных случаях непосредственным разрешающим агентом являются те вещества, которые образуются в организме под влиянием указанных факторов.
Генез аллергизирующих АТ или сенсибилизированных лимфоцитов
• Активная аллергия. В большинстве случаев аллергическая реакция формируется в организме активно, т.е. в ответ на внедрение в него или образование в организме аллергена. Такую разновидность аллергии называют активной.
• Пассивная аллергия является результатом попадания в организм крови или её компонентов, содержащих аллергические АТ либо лимфоциты из ранее аллергизированного организма.
Сроки развития клинических проявлений
В зависимости от времени начала клинических проявлений аллергии после действия на сенсибилизированный организм разрешающего Аг аллергические реакции подразделяют на немедленные, отсроченные и замедленные.
• Аллергическая реакция немедленного типа клинически проявляется сразу или через несколько минут после контакта организма с аллергеном (например, аллергический ринит, аллергический конъюнктивит, анафилактический шок, атопическая форма бронхиальной астмы).
• Аллергическая реакция отсроченного (позднего) типа выявляется в течение первых 6-12 ч после контакта с разрешающим Аг (например, гемолитические анемии, тромбоцитопении или лейкопении аллергического генеза; отдельные разновидности сывороточной болезни).
• Аллергическая реакция замедленного типа регистрируется обычно через 1-2 сут после воздействия разрешающего аллергена на сенсибилизированный организм (например, туберкулиновая, бруцеллиновая, сифилитическая реакции; контактный дерматит).
СТАДИИ АЛЛЕРГИЧЕСКОЙ РЕАКЦИИ
В динамике любой аллергической реакции можно выделить три последовательно развивающиеся стадии: иммуногенную, патобиохимическую и клинических проявлений.
Иммуногенная стадия
Иммуногенная стадия (сенсибилизации, первичного контакта) заключается в развитии нескольких взаимосвязанных явлений.
• Обнаружение аллергена антигенпредставляющими клетками и передача информации о нём лимфоцитам.
• Синтез плазматическими клетками аллергических пулов Ig или пролиферация сенсибилизированных лимфоцитов.
• Фиксация Ig и сенсибилизированных лимфоцитов.
♦ При развитии местной формы аллергии - преимущественно в регионе локализации сенсибилизирующего аллергена.
♦ При генерализованной форме аллергии - в биологических жидкостях (крови, лимфе, ликворе).
Клинически состояние сенсибилизации практически не проявляется. Вместе с тем можно обнаружить отклонения от нормы реактивных свойств сенсибилизированных органов, активности некоторых ферментов, концентрации Ig, числа отдельных пулов иммуноцитов и некоторые другие изменения в организме.
Патобиохимическая стадия
Патобиохимическая стадия развивается при повторном попадании в организм или образовании в нём того же Аг, которым он был сенсибилизирован. При этом образуются комплексы аллергена со специфическими АТ или сенсибилизированными лимфоцитами. В ряде реакций в этот комплекс включаются и факторы системы комплемента.
• Иммунные комплексы фиксируются в местах наибольшей концентрации аллергена и АТ (при местных аллергических реакциях, например - феномене Артюса) либо в биологических жидкостях (при генерализованной аллергии, например - анафилактическом шоке или сывороточной болезни).
• Под действием указанных комплексов в различных клетках образуются, активируются и высвобождаются БАВ различного спектра действия - медиаторы аллергии.
• Медиаторы аллергии обусловливают как дальнейшее развитие аллергической реакции (её динамику, специфику, выраженность, длительность), так и формирование характерных для неё общих и местных признаков.
Стадия клинических проявлений
Стадия клинических проявлений (патофизиологическая) характеризуется развитием как местных патологических процессов (в клетках- и тканях-мишенях), так и генерализованных расстройств жизнедеятельности организма.
• Патологические процессы местного характера состоят в развитии различных видов дистрофий, воспаления, повышения проницаемости сосудистых стенок, расстройств регионарного кровообращения, гипоксии, отёка тканей.
• Расстройства жизнедеятельности организма в целом. Наблюдаются, например, при аллергической бронхиальной астме, сопровождающейся дыхательной недостаточностью; при аллергическом постинфарктном миокардите (синдроме Дресслера), приводящему к сердечной недостаточности; при диффузном гломерулонефрите, завершающемся почечной недостаточностью и т.д.
ПАТОГЕНЕЗ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
В 1964 г. Джелл и Кумбс предложили выделять четыре типа реакций гиперчувствительности, в основе которых лежат различия в патогенетических механизмах реакций гиперчувствительности. Принадлежность к тому или иному типу определяется локализацией и классом АТ или лимфоцитов, взаимодействующих с аллергеном.
• Первый (I) тип - атонические аллергические реакции (анафилактические или реагиновые) опосредованы преимущественно иммуноглобулинами классов IgE и G4.
• Второй (II) тип - цитотоксическое повреждение, осуществляется при участии IgG или IgM, взаимодействующих с аллергенами, находящимися на клетках собственных тканей индивидуума.
• Третий (III) тип - иммунокомнлексные, нрецинитиновые аллергические реакции с развитием состояний и болезней иммунных комплексов. При этом образуются комплексы аллергенов с IgG и IgM. Не удаляемые из кровотока комплексы антиген+антитело фиксируются в капиллярах, где индуцируют повреждение тканей.
• Четвёртый (IV) тип - гинерчувствительность замедленного тина. Контакт аллергена с Аг-специфическими рецепторами на T-клетках приводит к клональному увеличению и активации этой популяции лимфоцитов.
Ниже приводится характеристика основных звеньев патогенеза аллергических реакций в соответствии с патогенетическим принципом их классификации по Джеллу и Кумбсу. Первые три из них являются реакциями немедленного, а четвёртая - замедленного типа.
Аллергические реакции типа I
При развитии атопических реакций немедленного типа, происходит взаимодействие Аг с АТ (IgE и IgG4), приводящее к высвобождению БАВ - медиаторов аллергии (главным образом, гистамина) из тучных клеток и базофилов (рис. 16-1).
Причиной аллергических реакций типа I чаще всего являются экзогенные агенты (компоненты пыльцы растений, трав, цветов, деревьев, животные и растительные белки, некоторые ЛС, органические и неорганические химические вещества).
Стадия сенсибилизации протекает с формированием специфичных по отношению к Аг клонов плазматических клеток, синтезирующих IgE и IgG4. Эти иммуноглобулины фиксируются преимущественно на поверхности тучных клеток и базофилов.
Патобиохимическая стадия развивается при повторном попадании аллергена в организм и его взаимодействии с фиксированными на поверхности клеток-мишеней IgE, что сопровождается немедленным выбросом содержимого гранул этих клеток (медиаторов аллергии) в межклеточное пространство. Эффекты медиаторов аллергии:
♦ Повышение проницаемости стенок сосудов микроциркуляторного русла и развитие отёка тканей.
♦ Нарушения кровообращения.
♦ Сужение просвета бронхиол, спазм кишечника.
♦ Гиперсекреция слизи.
♦ Прямое повреждение клеток и неклеточных структур.
Стадия клинических проявлений обусловлена развитием вышеуказанных эффектов в органах-мишенях. Чаще всего по описанному механизму развиваются поллинозы, аллергические формы бронхиальной астмы, аллергические конъюнктивит, дерматит, гастроэнтероколит, а также анафилактический шок.
Псевдоаллергические реакции
Сходные с описанными выше патобиохимические и клинические изменения наблюдаются и при так называемых псевдоаллергических реакциях. Последние развиваются вскоре после энтерального или парентерального попадания в организм различных агентов, вызывающих дегрануляцию тучных клеток. Чаще всего этими веществами являются продукты питания (шоколад, цитрусовые, некоторые ягоды и пр.), ЛС, гербициды, пестициды и др.
Важная особенность псевдоаллергических реакций - их развитие без видимого периода сенсибилизации. Проявления псевдоаллергических реакций: крапивница и отёк Квинке, высыпания различного вида, зуд, покраснение кожи, диарея, приступы удушья и даже состояния, напоминающие анафилактический шок.
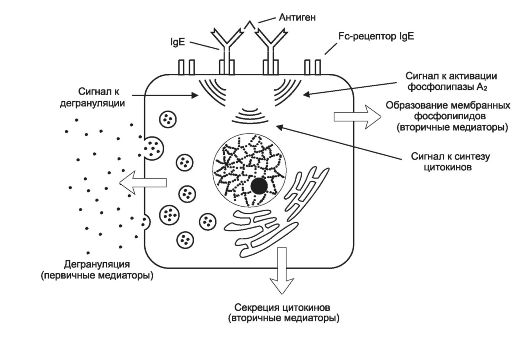 Рис. 16-1. Активация и дегрануляция тучных клеток при анафилактических реакциях (тип I гиперчувствительности по Джеллу и Кумбсу). [по 4].
Рис. 16-1. Активация и дегрануляция тучных клеток при анафилактических реакциях (тип I гиперчувствительности по Джеллу и Кумбсу). [по 4].
Аллергические реакции типа II
При цитотоксических аллергических реакциях иммуноглобулины (обычно IgG или IgM) связываются с Аг на поверхности собственных клеток, что сопровождается разрушением последних фагоцитами, клетками-киллерами или системой комплемента. Причиной аллергических реакций типа II наиболее часто являются вещества со сравнительно небольшой молекулярной массой и высокой химической активностью (например, ЛС, гидролитические ферменты, свободные радикалы и пр.). Указанные агенты изменяют антигенную структуру белковых компонентов клеточных мембран и неклеточных элементов.
Стадия сенсибилизации протекает с активацией B-лимфоцитов и трансформацией их в плазматические клетки, синтезирующие IgG подклассов 1, 2 и 3, а также IgM.
Патобиохимическая стадия развивается при повторном попадании аллергена в организм и изменении под его влиянием структуры собственных Аг. Иммуноглобулины взаимодействуют с изменёнными антигенными детерминантами на поверхности клеток и неклеточных структур организма. При этом реализуются механизмы комплементзависимого и антителозависимого разрушения носителя антигенной информации.
Стадия клинических проявлений обусловлена повреждением изменён- ных структур организма с формированием ряда клинических синдромов аллергического характера: «лекарственных» цитопений (эритро-, лейко-, тромбоцитопений), гемолитической болезни новорождённых; аллергических или инфекционно-аллергических форм нефрита, миокардита, энцефалита, гепатита, тиреоидита, полиневрита и др.
Аллергические реакции типа III
Для иммунокомплексных аллергических реакций характерно повреждение структур организма посредством иммунных комплексов. Причиной аллергических реакций этого типа являются хорошо растворимые экзо- и эндогенные белки (например, при вакцинации, укусах некоторых насекомых, инфицировании микробами или грибами, опухолевом росте).
Стадия сенсибилизации протекает с активацией аллергенами B-лимфо- цитов, что сопровождается продуцированием IgG и IgM, которые при контакте с Аг образуют преципитаты. Эти преципитаты называют иммунными комплексами, а болезни, в патогенезе которых они играют существенную роль, иммунокомплексными.
♦ Если иммунные комплексы образуются в крови или лимфе, а затем фиксируются в различных тканях и органах, то развивает-
ся системная (генерализованная) форма аллергии. Примером её может служить сывороточная болезнь. ♦ В тех случаях, когда иммунные комплексы формируются вне сосудов и фиксируются в определённых тканях, развиваются местные формы аллергии (например, мембранозный гломерулонефрит, васкулиты, периартерииты, альвеолит, феномен Артюса). Патобиохимическая стадия обусловлена активацией реакций по удалению иммунных комплексов. В тканях и крови появляются медиаторы аллергии, которые вызывают повреждение клеток и неклеточных образований. Устранение иммунных комплексов при участии фагоцитов потенцирует и расширяет масштаб и степень аллергической альтерации. Активация проагрегантов и прокоагулянтов создаёт условия для тромбообразования, нарушений микроциркуляции, ишемии тканей, развития в них дистрофии и некроза (рис. 16-2).
Стадия клинических проявлений является следствием прямого действия иммунных комплексов на клетки и ткани, а также эффектов медиаторов аллергии и фагоцитоза. Этот тип аллергической реакции является ключевым звеном патогенеза сывороточной болезни, мембранозного гломерулонефрита, альвеолитов, васкулитов, узелковых периартериитов, феномена Артюса и др.
Аллергические реакции типа IV
В замедленных клеточно-опосредованных аллергических реакциях принимают участие не АТ, а T-клетки. Сенсибилизированные T-лим- фоциты (после презентации им Аг) оказывают как непосредственное цитотоксическое действие на клетки-мишени, так и с помощью лимфокинов.
Причиной аллергических реакций типа IV чаще всего являются компоненты возбудителей инфекций (туберкулёза, лепры, бруцеллёза; паразиты, грибы, вирусы), а также некоторые белки неинфекционной природы (например, изменённый коллаген).
Стадия сенсибилизации включает активацию и антигензависимую дифференцировку T-лимфоцитов в T-хелперы (T-эффекторы реакций гиперчувствительности замедленного типа) и T-киллеры. Патобиохимическая стадия. При повторном контакте иммунокомпетентных клеток с аллергеном происходит пролиферация и созревание большого числа различных T-лимфоцитов, преимущественно цитотоксических. Сенсибилизированные T-киллеры разрушают клеткимишени как непосредственно, так и с помощью выделения медиаторов аллергии и индукции гранулёматозного воспаления. Гранулёмы состоят из лимфоцитов, мононуклеарных фагоцитов, формирующихся из них эпителиоидных и гигантских клеток, фибробластов и волокнистых структур.
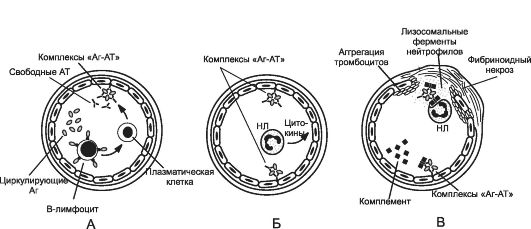 Рис. 16-2. Фазы повреждения сосудов при иммунокомплексных болезнях (тип III гиперчувствительности
по Джеллу и Кумбсу). А - образование иммунного комплекса; Б - фиксация
имунных комплексов; В - воспаление, опосредованное иммунными
комплексами. НЛ - нейтрофильный лейкоцит, [по 4].
Рис. 16-2. Фазы повреждения сосудов при иммунокомплексных болезнях (тип III гиперчувствительности
по Джеллу и Кумбсу). А - образование иммунного комплекса; Б - фиксация
имунных комплексов; В - воспаление, опосредованное иммунными
комплексами. НЛ - нейтрофильный лейкоцит, [по 4].
Стадия клинических проявлений. Наиболее часто реакции манифестируются как инфекционно-аллергические (туберкулиновая, бруцеллиновая, сальмонеллёзная), в виде диффузного гломерулонефрита (инфекционно-аллергического генеза), контактных аллергий - дерматита, конъюнктивита.
ПРИНЦИПЫ ТЕРАПИИ И ПРОФИЛАКТИКИ
Лечение и профилактика аллергических реакций основана на реализации этиотропного, патогенетического, саногенетического и симптоматического принципов.
Этиотропная терапия и профилактика
Этиотропная терапия направлена на устранение аллергена из организма. Проводят мероприятия по удалению из организма микробов, паразитов, грибов, простейших (санация) и выведению из организма аномальных белков и других аллергических соединений. Профилактика подразумевает предотвращение контакта организма с аллергеном: пыльцой, пылью, компонентами шерсти животных, органическими и неорганическими веществами, ЛС и др.
Патогенетическая терапия
Патогенетическая терапия направлена на разрыв основных звеньев патогенеза аллергии, а профилактика - на опережающую блокаду потенциальных механизмов её развития (иммуногенных сенсибилизирующих процессов, образование медиаторов аллергии). С этой целью проводят специфическую или неспецифическую гипосенсибилизацию.
• Специфической гипосенсибилизации достигают путём парентерального введения по определённым схемам сенсибилизирующего аллергена (метод рассчитан на образование комплекса аллергена с АТ и снижение содержания соответствующих Ig).
• Неспецифическую гипосенсибилизацию применяют в тех случаях, когда специфическая по каким-либо причинам невозможна или неэффективна, либо когда не удаётся выявить аллерген. Её можно достичь применением некоторых ЛС (например, антигистаминных и мембраностабилизирующих) при аллергии немедленного типа; иммунодепрессантов (в том числе глюкокортикоидов) и иммуномодуляторов - при аллергии замедленного типа, а также используя некоторые виды физиотерапевтических воздействий.
Саногенетическая терапия направлена на активацию защитных, компенсаторных, репаративных и других адаптивных процессов и реакций в тканях, органах и организме в целом. С этой целью применяют витамины, адаптогены (женьшень, элеутерококк), проводят немеди-
каментозные мероприятия: закаливание, физические нагрузки, лечебное голодание и другие.
Симптоматический принцип подразумевает предотвращение или устранение симптомов, усугубляющих течение аллергии: головной боли, головокружения, чувства тревоги, напряжения, подавленности и т.п.
Болезни иммунной аутоагрессии
Состояния и болезни иммунной аутоагрессии вызваны развитием патогенных иммунных реакций, направленных против неизменённых Аг собственных клеток и неклеточных структур.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Конкретные причины и механизмы отдельных болезней иммунной аутоагрессии сложны и ещё недостаточно изучены. По механизмам происхождения различают заболевания, обусловленные изменениями в системе ИБН (ИБН-зависимые болезни) или вызванные изменениями вне системы ИБН (ИБН-независимые болезни).
ИБН-зависимые болезни иммунной аутоагрессии
В основе их возникновения и развития лежит образование в системе ИБН «запретных» клонов T- и B-лимфоцитов, а также Ig, действующих против собственных интактных структур. При этих болезнях и состояниях, как правило, выявляют признаки наследственной предрасположенности. Варианты патогенеза
• Мутации в пролиферирующих иммуноцитах в результате воздействия агентов физической, химической или биологической природы. В результате появляются иммунокомпетентные клетки с изменённым геномом, воспринимающие антигенные структуры организма как чужеродные и повреждающие их.
Примеры: развитие цитопений (гемолитической анемии, тромбоцито-, лейкоили панцитопении); появление иммуноагрессивных аутоантител после инфицирования B-лимфоцитов лимфотропным вирусом Эпстайна-Барр.
• Нарушение оптимального соотношения количества или активности T-супрессоров и T-хелперов. Это приводит к интенсивной пролиферации эффекторных лимфоцитов (T-киллеров и B-лимфоцитов, созревающих в плазматические клетки), что приводит к разрушению нормальных структур организма.
Примеры: СКВ, ревматоидный артрит, рассеянный склероз.
• Нарушение оптимального соотношения в системе «идиотип-антиидиотип». В норме численность и биохимическая специфика АТ (идиотипов) контролируется посредством образования «надсмотрщиков», специфичных (комплементарных) идиотипам. При воз-
никновении аутоагрессивных АТ происходит синтез «аутоантител к аутоантителам», которые получили название антиидиотипических (или антиидиотипов). При различных экзо- и эндогенных воздействиях могут сложиться условия, благоприятствующие синтезу «за- прещённых» классов Ig и возникновению иммунной аутоагрессии. Примеры: отдельные разновидности гемолитической анемии, тромбоцито- и лейкопении, СКВ, склеродермии, миопатий.
• Отмена анергии T-лимфоцитов к аутоантигенам наблюдается при воздействии на T-лимфоциты избытка костимулирующих факторов (например, ИЛ12).
• Поликлональная антигеннеспецифическая активация T- и B-лим- фоцитов под воздействием продуктов обмена веществ микроорганизмов или ЛПС.
ИБН-независимые болезни иммунной аутоагрессии
Патогенез ИБН-независимых болезней иммунной аутоагрессии не отличается от естественного хода нормальных реакций иммунитета, но иммуноагрессивной атаке подвергаются генетически неизменённые аутологичные структуры собственного организма. Отмена толерантности к Аг организма. Клетки и ткани, в пренатальном онтогенезе изолированные гистогематическими барьерами и не имевшие контакта с иммунокомпетентными лимфоцитами, в постнатальном периоде воспринимаются иммунной системой как «чужие» для неё. К таким «забарьерным», антигенно чужеродным для ИБН структурам относятся сперматозоиды, кристаллин хрусталика, белки миелина, коллоид клеток щитовидной железы. Нарушение барьеров обусловливает иммунную аутоагрессию с повреждением и деструкцией указанных структур.
Наиболее частые причины: травма, воспаление, некроз. Например, при механическом повреждении глаза иммунной аутоагрессии подвергается не только ткань повреждённого глаза, но и другого - неповреждённого. Этот феномен получил название симпатической (т.е. содружественной) офтальмии. Изменение антигенного состава тканей
• Модификация собственных Аг под воздействием веществ инфекционной или неинфекционной природы сопровождается развитием иммунной аутоагрессии.
Примеры:
♦ Развитие иммуноагрессивных вариантов постинфекционного эндо-, мио- и перикардита, нефрита, гепатита, альвеолита.
♦ Патологические состояния, вызванные реакциями иммунной аутоагрессии у пациентов с ожоговой болезнью: гемолитическая анемия, тромбоцито- и лейкопении, нефриты, миокардиты, полиневриты и др.
• Модификация генома клеток вследствие, как правило, интеграции в него вирусной ДНК.
Внедрение в организм Аг, сходных с Аг его тканей (антигенная мимикрия).
• Причины: антигенные детерминанты некоторых инфекционных агентов имеют структуру, подобную структуре отдельных Аг нормальных тканей.
• Механизм: АТ, образующиеся в организме в ответ на внедрение носителя чужеродной антигенной информации, действуют не только против носителя АТ, но и против собственных структур. Этот феномен получил название перекрёстной иммунной аутоагрессии.
• Примеры: развитие аутоагрессивных вариантов различных заболеваний.
♦ Гемолитической анемии при лейшманиозе.
♦ Диффузного гломерулонефрита при инфицировании организма β-гемолитическим стрептококком.
♦ Энтероколита у пациентов с патогенными штаммами кишечной палочки.
♦ Миокардита после перенесённой стрептококковой инфекции - ангины, пневмонии, гайморита.
ВИДЫ БОЛЕЗНЕЙ ИММУННОЙ АУТОАГРЕССИИ
Многочисленные варианты болезней иммунной аутоагрессии человека объединяются в несколько групп с учётом основных отличительных признаков.
• В зависимости от инициального (стартового) звена патогенеза: болезни иммунной аутоагрессии, обусловленные нарушениями в системе ИБН и вне системы ИБН (см. выше).
• В зависимости от доминирующего механизма развития.
♦ Болезни иммунной аутоагрессии, развивающиеся, в основном, с участием иммуноглобулинов (гуморальные, иммуноглобулиновые, B-клеточные). Примеры: тиреоидит Хасимото, гемолитическая анемия, тромбоцитопения, лейкопения, СКВ.
♦ Болезни иммунной аутоагрессии, развивающиеся, в основном, с участием T-киллеров (T-киллерные, T-клеточные). Примеры: отдельные разновидности полимиозита и синдрома Шёгрена.
♦ Болезни иммунной аутоагрессии, развивающиеся с участием обоих звеньев иммунного ответа (кооперативные). Примеры: синдром Шёгрена, проявляющийся поражением глаз (сухой кератоконъюнктивит) и слизистой оболочки рта (ксеростомия); склеродермия; дермато- и полимиозит.
• В зависимости от числа поражённых органов.
♦ Моноорганные болезни иммунной аутоагрессии (органоспецифические). Примеры: тиреоидит Хасимото, анемия АддисонаБирмера.
♦ Полиорганные болезни иммунной аутоагрессии (системные, генерализованные). Примеры: СКВ, склеродермия.