Патофизиология: учебник / Литвицкий П.Ф. - 4-е изд., - 2009. - 496 с.
|
|
|
|
ГЛАВА 22. ПАТОЛОГИЯ СЕРДЕЧНО- СОСУДИСТОЙ СИСТЕМЫ
В норме сердечно-сосудистая система (ССС) оптимально обеспечивает потребности органов и тканей в кровоснабжении. При этом уровень системного кровообращения определяется деятельностью сердца, тонусом сосудов и состоянием крови (величиной её общей и циркулирующей массы, а также её реологическими свойствами). Нарушение в каком-либо звене ССС может привести к недостаточности кровообращения.
НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ
Недостаточность кровообращения - состояние, при котором система кровообращения не обеспечивает потребности тканей и органов в оптимальном кровоснабжении.
Основные причины недостаточности кровообращения: расстройства сердечной деятельности, нарушения тонуса стенок кровеносных сосудов, изменения ОЦК или реологических свойств крови. Виды недостаточности кровообращения дифференцируются на основании таких критериев, как компенсированность расстройств, острота развития и течения, выраженность признаков.
• Компенсированность расстройств: компенсированные (признаки расстройств кровообращения выявляются при нагрузке), некомпенсированные (признаки нарушения кровообращения обнаруживаются в покое).
• Острота развития и течения: острая недостаточность кровообращения (развивается в течение часов и суток); хроническая (развивается на протяжении нескольких месяцев или лет).
• Выраженность признаков.
♦ Стадия I (начальная). Признаки: уменьшение скорости сокращения миокарда, снижение фракции выброса, одышка, сердцебиение, утомляемость при физической нагрузке (в покое отсутствуют).
♦ Стадия II. Недостаточность кровообращения выражена умеренно или значительно. Указанные для начальной стадии признаки не-
достаточности кровообращения обнаруживаются не только при физической нагрузке, но и в покое. ♦ Стадия III (конечная). Характеризуется значительными нарушениями сердечной деятельности и гемодинамики в покое, а также развитием существенных дистрофических и структурных изменений в органах и тканях.
ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ
Различают две группы типовых форм патологии ССС.
• Нарушения центрального кровообращения. Они обусловлены патологией сердечной деятельности и магистральных сосудов.
• Расстройства периферического кровообращения, включая нарушения микроциркуляции.
Большинство расстройств сердечной деятельности относятся к трём группам типовых форм патологии: коронарной недостаточности, аритмиям и сердечной недостаточности.
КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ
Коронарная недостаточность - типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их притоком по венечным артериям, а также нарушением оттока от миокарда продуктов метаболизма.
Ведущий патогенетический фактор коронарной недостаточности - ишемия миокарда.
Клинически коронарная недостаточность проявляется как ишемическая болезнь сердца (ИБС). При поражении венечных артерий может развиться стенокардия, инфаркт миокарда, аритмии, сердечная недостаточность, внезапная сердечная смерть.
Виды коронарной недостаточности
Все разновидности коронарной недостаточности, в зависимости от степени и обратимости поражения миокарда, подразделяют на обратимые и необратимые.
ОБРАТИМЫЕ НАРУШЕНИЯ КОРОНАРНОГО КРОВОТОКА
Обратимые (транзиторные) нарушения коронарного кровотока клинически проявляются различными формами стенокардии и состояниями после реперфузии (реваскуляризации) миокарда, включая состояние оглушённого миокарда.
Стенокардия
Стенокардия - заболевание, обусловленное коронарной недостаточностью, и характеризующееся обратимой ишемией миокарда.
Различают несколько разновидностей стенокардии.
• Стабильная стенокардия напряжения. Обычно является следствием снижения коронарного кровотока до критического уровня, значительного увеличения работы сердца, а чаще - сочетания того и другого.
• Нестабильная стенокардия напряжения. Характеризуется нарастающими по частоте, длительности и тяжести стенокардитическими приступами. Эти эпизоды обычно являются результатом прогрессирующего снижения коронарного кровотока.
• Вариантная стенокардия (стенокардия Принцметала) - результат длительного преходящего спазма ветвей венечных артерий.
Состояния после реперфузии миокарда развиваются у пациентов с ИБС в результате хирургического возобновления или значительного увеличения коронарного кровотока (например, после аортокоронарного шунтирования, стентирования или чрескожной внутрисосудистой ангиопластики), а также медикаментозного и спонтанного восстановления тока крови в венечных артериях (например, вследствие тромболизиса, дезагрегации форменных элементов крови).
НЕОБРАТИМЫЕ НАРУШЕНИЯ КОРОНАРНОГО КРОВОТОКА
Необратимое прекращение или длительное значительное уменьшение притока крови по венечной артерии в каком-либо регионе сердца завершается, как правило, инфарктом миокарда.
Инфаркт миокарда - очаговый некроз сердечной мышцы в результате острого и значительного несоответствия между потребностью миокарда в кислороде и его доставкой.
• Наиболее частая причина инфаркта миокарда - тромбоз венечной артерии, развившийся на фоне атеросклеротических изменений (до 90% всех случаев).
• При инфаркте миокарда возможны опасные для жизни осложнения:
♦ острая сердечная недостаточность (кардиогенный шок, отёк лёг- ких);
♦ разрыв или аневризма сердца;
♦ недостаточность клапанов;
♦ нарушения ритма сердца;
♦ тромбоэмболия.
Если инфаркт не приводит к смерти пациента, то погибший участок сердца замещается соединительной тканью - развивается постинфарктный кардиосклероз.
При длительной гипоперфузии участка миокарда (например, ниже обширной атеросклеротической бляшки в коронарной артерии) может развиться состояние его гибернации (от англ. hibernation - бездействие, спячка). Гибернированный миокард характеризуется стойким снижением его сократительной функции.
Состояние гибернации миокарда обратимо и его функция постепенно восстанавливается при возобновлении адекватного коронарного кровотока.
Этиология коронарной недостаточности
Многочисленные состояния и факторы, способные вызвать коронарную недостаточность, объединяют в три основные взаимосвязанные и взаимозависимые группы.
• Уменьшение или прекращение притока крови к миокарду по венечным артериям.
• Повышение потребности миокарда в кислороде и субстратах обмена веществ.
• Снижение содержания кислорода или субстратов обмена веществ в крови венечных артерий (например, при общей гипоксии).
Уменьшение или прекращение притока крови к миокарду
Основными причинами этого являются:
♦ Атеросклеротическое поражение венечных артерий (наблюдается более чем у 92% пациентов с ИБС).
♦ Агрегация форменных элементов крови и образование тромбов в венечных артериях сердца. Этим процессам в значительной мере способствуют атеросклеротические изменения в стенках сосудов; турбулентный характер кровотока в венечных сосудах; повышение содержания и активности факторов свёртывающей системы крови, высвобождающихся из повреждённых клеток крови и сосудистой стенки.
♦ Спазм венечных артерий (например, под воздействием катехоламинов или тромбоксана).
♦ Уменьшение притока крови к сердцу и снижение в связи с этим перфузионного давления в венечных артериях. К этому приводят значительная брадиили тахикардия, трепетание и мерцание предсердий или желудочков сердца, недостаточность аортальных клапанов, острая артериальная гипотензия, сдавление венечных артерий сердца (опухолью, рубцом, инородным телом).
Повышение потребности миокарда в кислороде и субстратах метаболизма
• Наиболее часто - это результат действия избытка катехоламинов на миокард, обусловливающего развитие их кардиотоксического эффекта по нескольким направлениям:
♦ за счёт положительного хроно- и инотропного эффектов катехоламинов и значительного возрастания в связи с этим работы сердца;
♦ снижение эффективности ресинтеза АТФ в кардиомиоцитах;
♦ уменьшение величины коронарного кровообращения.
• Такой же результат наблюдается при значительной продолжительной гиперфункции сердца, обусловленной чрезмерной физической нагрузкой, длительной тахикардией, артериальной гипертензией, активацией симпатоадреналовой системы, выраженной гемоконцентрацией, гиперволемией.
Уменьшение содержания кислорода или субстратов метаболизма в крови
Это может наблюдаться при общей гипоксии любого генеза (дыхательной, гемической, циркуляторной и др.), а также при дефиците в клетках глюкозы (например, при сахарном диабете).
Патогенез коронарной недостаточности
Выделяют несколько основных типовых механизмов повреждения миокарда:
• Нарушение энергообеспечения кардиомиоцитов.
• Повреждение мембран и ферментов кардиомиоцитов.
• Дисбаланс ионов и жидкости.
• Расстройства механизмов регуляции сердечной деятельности.
Расстройство энергообеспечения кардиомиоцитов
♦ В аэробных условиях основными субстратами для синтеза АТФ служат жирные кислоты (65-70%), глюкоза (15-20%) и МК (10- 15%). Роль аминокислот, кетоновых тел и пирувата в энергообеспечении миокарда сравнительно невелика.
♦ В условиях нарастающей ишемии в миокарде развивается истощение резерва кислорода и снижение интенсивности окислительного фосфорилирования.
♦ Нарушение аэробного синтеза АТФ приводит к активации гликолиза и накоплению в миокарде лактата. Одновременно быстро уменьшаются запасы гликогена, и нарастает ацидоз.
♦ Развитие внутри- и внеклеточного ацидоза существенно изменяет проницаемость мембран для метаболитов и ионов, подавляет
активность ферментов энергообеспечения, синтеза клеточных структур.
♦ Расстройство процессов энергообеспечения кардиомиоцитов обусловливает снижение сократительной функции миокарда, недостаточность кровообращения, развитие сердечных аритмий.
Повреждение кардиомиоцитов. Основные свойства миокарда (автоматизм, возбудимость, проводимость, сократимость), а также их регуляция в значительной мере зависят от состояния мембран и ферментов кардиомиоцитов. В условиях ишемии их повреждение является следствием действия ряда общих факторов. Основные механизмы повреждения клеточных мембран и ферментов рассмотрены в главе 4 «Патология клетки».
Дисбаланс ионов и жидкости
Ионный дисбаланс (см. также раздел «Дисбаланс ионов и воды в клетке» в главе 4 «Повреждение клетки») развивается вследствие расстройств энергообеспечения кардиомиоцитов, повреждения их мембран и ферментов. Особенно важны следующие типичные изменения:
♦ Увеличение [К+] вне кардиомиоцитов является следствием снижения активности Na+,К+-АТФазы и повышения проницаемости плазматической мембраны.
Гиперкалиемия является одним из характерных признаков коронарной недостаточности, особенно при инфаркте миокарда.
♦ Повышение содержания ионов Na+ в кардиомиоцитах, увеличение [Ca2+] в клетках миокарда, расстройство регуляции объёма клеток миокарда.
♦ Указанные факторы приводят к накоплению избытка жидкости в клетках миокарда и существенному увеличению их объёма.
♦ Дисбаланс ионов и жидкости вызывает нарушение фундаментальных процессов в миокарде, прежде всего его сократительной функции и электрогенеза. При ишемии миокарда страдают все процессы мембранного электрогенеза: возбудимость клеток миокарда, автоматизм ритмогенеза и проведение импульсов возбуждения.
В связи с существенным расстройством трансмембранного электрогенеза развиваются аритмии сердца.
Расстройства механизмов регуляции сердца
В значительной мере изменения функции сердца в целом, а также характер и степень повреждения его клеток при коронарной недостаточности обусловлены расстройствами механизмов регуляции сердечной деятельности.
• Коронарная недостаточность характеризуется стадийными изменениями активности симпатического и парасимпатического механизмов регуляции.
♦ На начальном этапе ишемии миокарда, как правило, возникает значительная активация симпатикоадреналовой системы. Вследствие этого развивается тахикардия и увеличивается сердечный выброс.
♦ На более поздних сроках отмечаются признаки доминирования парасимпатических регуляторных влияний: брадикардия, снижение величины сердечного выброса, скорости сокращения и расслабления миокарда.
• В условиях коронарной недостаточности развивается феномен гормоно-нейромедиаторной диссоциации катехоламинов (уменьшение содержания нейромедиатора норадреналина и увеличение уровня гормона адреналина), что потенцирует их кардиотоксическое действие.
Наиболее распространённая форма коронарной недостаточности - стенокардия - характеризуется чередованием периодов ишемии миокарда и периодов возобновления коронарного кровотока (реперфузии).
Возобновление тока крови (реперфузия) - самый эффективный способ прекращения действия патогенных факторов ишемии миокарда и устранения последствий их влияния на сердце (рис. 22-1).
Постокклюзионная реперфузия миокарда
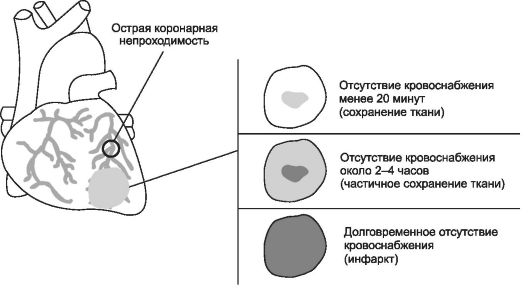 Рис. 22-1. Последствия ишемии миокарда. Чем позже происходит реперфузия, чем более выражено повреждение сердечной мышцы. [по 4].
Рис. 22-1. Последствия ишемии миокарда. Чем позже происходит реперфузия, чем более выражено повреждение сердечной мышцы. [по 4].
Адаптивные эффекты реперфузии:
♦ препятствие развитию инфаркта миокарда;
♦ предотвращение формирования аневризмы;
♦ стимуляция образования соединительной ткани в стенке аневризмы, если она уже развилась;
♦ потенцирование процесса восстановления сократительной функции сердца.
Вместе с тем начальный этап постокклюзионной реперфузии миокарда нередко сопровождается дополнительным повреждением реперфузируемого участка сердца. Таким образом, повреждение при коронарной недостаточности является следствием двух синдромов: ишемического и реперфузионного, а не только одного - ишемического (как считалось ранее).
РЕПЕРФУЗИОННОЕ ПОВРЕЖДЕНИЕ МИОКАРДА
Постокклюзионная реперфузия оказывает патогенное действие на миокард вследствие дополнительной альтерации миокарда факторами реперфузии и реоксигенации. В результате этого может развиться феномен оглушенного миокарда (станнированного, от англ. stun - оглушение, ошеломление). Этот феномен является одним из осложнений, сопровождающих постишемическую реперфузию жизнеспособного миокарда. Особенностью этого феномена является отсутствие или низкий уровень сократительной функции миокарда в условиях восстановленного коронарного кровотока.
Механизмы реперфузионного повреждения миокарда
• Усугубление нарушения энергетического обеспечения миокардиоцитов.
♦ Подавление ресинтеза АТФ. Основные причины: гипергидратация, набухание и разрушение митохондрий, разобщающий эффект избытка Ca2+, выход АДФ, АМФ и других пуриновых соединений из митохондрий кардиомиоцитов в межклеточную жидкость.
♦ Нарушение транспорта АТФ в клетках миокарда и снижение эффективности механизмов утилизации энергии АТФ.
• Нарастание степени повреждения мембран и ферментов клеток и миокарда. Причины: кислородзависимая интенсификации СПОЛ, кальциевая активация протеаз, липаз, фосфолипаз и других гидролаз, а также осмотическое набухание и разрыв мембран клеток миокарда и их органелл.
• Нарастание дисбаланса ионов и жидкости в кардиомиоцитах. Причины: реперфузионные расстройства процессов энергообеспечения и повреждение мембран и ферментов. Это потенцирует накопление
избытка Na+ и Ca2+ в клетках миокарда и, как следствие - жидкости в них.
• Снижение эффективности регуляторных (нервных, гуморальных) воздействий на клетки миокарда (в норме способствующих интеграции и нормализации внутриклеточных процессов).
Изменение функций сердца при коронарной недостаточности
Коронарная недостаточность сопровождается характерными изменениями ЭКГ и показателей сократительной функции сердца.
• Изменения ЭКГ.
♦ В покое характерные отклонения могут отсутствовать.
♦ В момент болевого приступа, как правило, регистрируют снижение или подъём сегмента ST, инверсию зубца T.
• Изменения показателей сократительной функции сердца.
♦ Ударный и сердечный выброс, как правило, снижаются. Причина этого: «выключение» ишемизированного региона миокарда из сократительного процесса. Одним из механизмов компенсации снижения ударного выброса сердца является тахикардия. Она обусловлена главным образом активацией симпатикоадреналовой системы (в ответ на падение величины сердечного выброса), а также - повышением давления крови в полых венах и предсердиях.
♦ Конечное диастолическое давление в полостях сердца обычно возрастает. Основные причины: снижение сократительной функции повреждённого миокарда и уменьшение степени диастолического расслабления миокарда. Это вызвано субконтрактурным состоянием его в связи с избытком Ca2+ в цитозоле и миофибриллах кардиомиоцитов.
♦ Скорость систолического сокращения и диастолического расслабления миокарда существенно снижается. Основные причины: дефицит энергии АТФ, повреждение мембран миофибрилл, саркоплазматической сети и саркоплазмы.
АРИТМИИ СЕРДЦА
Аритмия - типовая форма патологии сердца, характеризующаяся нарушением частоты и периодичности генерации возбуждения или последовательности возбуждения предсердий и желудочков.
Аритмии являются следствием нарушения автоматизма, проводимости или возбудимости, а также их комбинаций. Расстройства сократимости лежат в основе развития сердечной (миокардиальной) недостаточности, и не являются причиной нарушений ритма сердца.
Аритмии в результате нарушения автоматизма
Изменение нормального автоматизма обусловлено нарушением функций синусно-предсердного узла, водителей ритма второго и третьего порядков.
Возникновение патологического автоматизма (эктопической активности) может наблюдаться в предсердиях, желудочках, пучке Гиса, волокнах Пуркинье при частичной деполяризации кардиомиоцитов и клеток проводящей системы.
Виды аритмий
В зависимости от места (топографии) генерации аномального импульса возбуждения, выделяют номотопные и гетеротопные аритмии.
• Номотопные аритмии. Возникают в синусно-предсердном узле. К ним относятся синусовая тахикардия, синусовая брадикардия и синусовая аритмия.
• Гетеротопные аритмии. Они возникают вне синусно-предсердного узла и обусловлены снижением автоматизма вышележащих центров ритмогенеза. Проявления: предсердный, атриовентрикулярный, идиовентрикулярный (желудочковый) ритмы; миграция наджелудочкового водителя ритма; предсердно-желудочковая диссоциация (полный поперечный блок).
НОМОТОПНЫЕ АРИТМИИ
Синусовая тахикардия - увеличение в покое частоты генерации импульсов возбуждения в синусно-предсердном узле более 80 в минуту с одинаковыми интервалами между ними.
• Электрофизиологический механизм: ускорение спонтанной диастолической деполяризации плазмолеммы клеток синусно-предсердного узла.
• Причины:
♦ Активация влияния на сердце симпатикоадреналовой системы. Такая ситуация наиболее часто возникает при стрессе, физических нагрузках, острой артериальной гипотензии, сердечной недостаточности, гипертермии, лихорадке.
♦ Снижение влияния на сердце парасимпатической нервной системы. Это может быть следствием повреждения парасимпатических нервных образований или холинорецепторов миокарда.
♦ Прямое действие повреждающих факторов различной природы на клетки синусно-предсердного узла. Возникает при миокардитах, перикардитах и т.д.
Синусовая брадикардия - уменьшение в покое частоты генерации импульсов возбуждения синусно-предсердным узлом ниже 60 в минуту с одинаковыми интервалами между ними.
• Ведущий электрофизиологический механизм: замедление процесса спонтанной диастолической деполяризации мембран клеток синусно-предсердного узла.
• Причины:
♦ Доминирование эффектов парасимпатической нервной системы на сердце. Возникает при раздражении ядер блуждающего нерва или его окончаний, повышении внутрижелудочкового давления и тонуса миокарда, надавливании на глазные яблоки (рефлекс Ашнера-Даньини), а также в зоне проекции бифуркации сонной артерии (рефлекс Геринга) и в области солнечного сплетения.
♦ Снижение симпатикоадреналовых эффектов на сердце. Наблюдается при повреждении симпатических структур или снижении адренореактивных свойств сердца.
♦ Непосредственное воздействие повреждающих факторов на клетки синусно-предсердного узла. Такими факторами могут быть механическая травма, кровоизлияние или инфаркт в зоне синусно-предсердного узла, токсины и ЛС, метаболиты (непрямой билирубин, жёлчные кислоты).
Синусовая аритмия - нарушение сердечного ритма, характеризующееся неравномерными интервалами между отдельными импульсами возбуждения, исходящими из синусно-предсердного узла.
• Электрофизиологический механизм: колебания скорости (увеличение, снижение) медленной спонтанной диастолической деполяризации пейсмейкерных клеток.
• Наиболее частые причины: флуктуация или нарушение соотношения симпатикоадреналовых и парасимпатических воздействий на сердце.
Синдром слабости синусно-предсердного узла (синдром брадикардии-тахикардии) - неспособность синусно-предсердного узла обеспечивать ритм сердца, адекватный уровню жизнедеятельности организма.
• Электрофизиологические механизмы: нарушение автоматизма синусно-предсердного узла, особенно фаз реполяризации и спонтанной диастолической деполяризации и возникновение на этом фоне гетеротопных (эктопических) очагов ритмической активности.
• Причины:
♦ Расстройство сбалансированности симпатикоадреналовых и парасимпатических влияний на сердце с преобладанием последних.
♦ Гибель или дистрофия клеток синусно-предсердного узла (например, при инфаркте, кровоизлиянии, опухоли, травме, воспалении).
• Главные ЭКГ-проявления: периодическая или постоянная синусовая брадикардия, сменяющаяся синусовой тахикардией, трепета-
нием или мерцанием предсердий, медленное восстановление синусового ритма после прекращения синусовой тахикардии, эпизоды остановки синусно-предсердного узла.
ЭКТОПИЧЕСКИЕ АРИТМИИ
Снижение активности или прекращение деятельности синусно-предсердного узла создаёт условия для включения автоматических центров второго и третьего порядков. Эктопический (по отношению к синусно-предсердному узлу) очаг с его более редким ритмом принимает на себя функцию пейсмейкера.
• Предсердный медленный ритм. Эктопический водитель ритма находится, как правило, в левом предсердии. На ЭКГ выявляются редкие (менее 70 в минуту) импульсы возбуждения.
• Атриовентрикулярный ритм (узловой ритм) наблюдается в тех случаях, когда импульсы в синусно-предсердном узле или вообще не возникают или генерируются с меньшей частотой, чем в клетках атриовентрикулярного (АВ) узла. Источником импульсов возбуждения может быть верхняя, средняя или нижняя часть АВ-узла. Чем выше локализация пейсмейкера, тем более выражено его влияние и тем больше частота генерируемых им импульсов.
• Миграция наджелудочкового водителя ритма. Характеризуется перемещением пейсмейкера из синусно-предсердного узла в нижележащие отделы (преимущественно в АВ-узел) и обратно. Это, как правило, происходит при подавлении автоматизма синусно-предсердного узла в результате преходящего повышения влияний блуждающего нерва. Ритм сердца при этом зависит от нового источника импульсов и потому становится неправильным.
• Идиовентрикулярный желудочковый ритм развивается как замещающий при подавлении активности центров первого и второго порядка. Импульсы генерируются, обычно, в пучке Гиса, в одной из его ножек и, реже, в волокнах Пуркинье.
• Атриовентрикулярная диссоциация - полное прекращение проведения возбуждения от предсердий к желудочкам. При этом предсердия и желудочки сокращаются независимо друг от друга (полный поперечный блок).
Аритмии в результате нарушений проводимости
Проводимость - способность кардиомиоцитов проводить возбуждение. Нарушения проводимости: замедление (блокада) или ускорение проведения импульсов, а также повторный вход волны возбуждения (reentry).
Замедление или блокада проведения импульсов
• Причины:
♦ Повышение эффектов парасимпатических влияний на сердце или его холинореактивных свойств (реализуется отрицательный дромотропный эффект ацетилхолина).
♦ Непосредственное повреждение клеток проводящей системы сердца различными факторами физического, химического и биологического происхождения. Наиболее часто это возникает при инфаркте миокарда, миокардитах, кровоизлияниях, опухолях, рубцах, интоксикациях (в том числе - ЛС), гиперкалиемии.
• Расстройства гемодинамики при нарушениях проводимости. Они зависят от длительности эпизода нарушения, характера основного заболевания и уровня повреждения проводящей системы сердца. Происходит уменьшение сердечного выброса вследствие брадикардии (хотя ударный выброс, как правило, увеличен), снижение АД, развитие недостаточности кровообращения и коронарной недостаточности.
При различных блокадах проведения (чаще при полной АВ-блокаде) может сформироваться синдром Морганьи-Адамса-Стокса (прекращение эффективной работы сердца). Он проявляется внезапной потерей сознания, отсутствием пульса и сердечных тонов. Длительность приступа обычно небольшая (5-20 с, редко 1-2 мин).
Ускорение проведения возбуждения
• Причина: существование дополнительных путей проведения возбуждения. По дополнительным пучкам возбуждение распространяется быстрее и достигает желудочков раньше импульса, проходящего через АВ-узел.
• Расстройства гемодинамики: снижение ударного и сердечного выбросов (обусловлено пониженным наполнением камер сердца кровью в условиях тахикардии, фибрилляции или трепетания предсердий), падение АД, развитие недостаточности кровообращения и коронарной недостаточности.
Комбинированные нарушения ритма
Комбинированные нарушения ритма обусловлены сочетанием изменений свойств возбудимости, проводимости и автоматизма. В качестве ведущих электрофизиологических механизмов развития комбинированных нарушений ритма выделяют циркуляцию импульса возбуждения по замкнутому контуру (возвратного хода возбуждения, reentry) и аномального автоматизма.
ВИДЫ КОМБИНИРОВАННЫХ АРИТМИЙ
Основные группы комбинированных нарушений ритма:
♦ экстрасистолия (синусовая, предсердная, атриовентрикулярная, желудочковая);
♦ пароксизмальная тахикардия (предсердная, из предсердно-желудочкового соединения, желудочковая);
♦ трепетание и мерцание (фибрилляция) желудочков. Экстрасистола - преждевременная деполяризация и, как правило, сокращение сердца или отдельных его камер. Нередко экстрасистолы регистрируются повторно. Если две и более экстрасистол следуют одна за другой, говорят об экстрасистолии. Разновидности экстрасистолии:
• Аллоритмия - сочетание в определённой последовательности нормальных импульсов возбуждения с экстрасистолами. Наиболее частые формы: бигеминия - экстрасистола после каждого очередного импульса, тригеминия - экстрасистола после двух очередных импульсов возбуждения, квадригеминия - экстрасистола после трёх очередных импульсов.
• Парасистолия - сосуществование двух или более независимых, одновременно функционирующих очагов генерации импульсов, вызывающих сокращение всего сердца или отдельных его частей. Один из очагов определяет основной ритм сердца (как правило, синусно-предсердный узел).
Пароксизмальная тахикардия - приступообразное и внезапное увеличение частоты ритмичной импульсации из эктопического очага сердца. О пароксизме тахикардии говорят, когда число эктопических импульсов превышает 3-5, а частота их колеблется от 140 до 220 в минуту.
Трепетание предсердий и желудочков проявляется высокой частотой импульсов возбуждения и, как правило, ритмичных сокращений сердца (обычно 220-350 в минуту). Характеризуется отсутствием диастолической паузы и поверхностными, гемодинамически неэффективными сокращениями миокарда.
При трепетании предсердий, как правило, развивается АВ-блокада, поскольку АВ-узел не способен проводить более 220 импульсов в минуту. Фибрилляция (мерцание) предсердий и желудочков представляет нерегулярную, беспорядочную электрическую активность предсердий и желудочков (с частотой импульсов более 300-400 в минуту), сопровождающуюся прекращением их эффективной насосной функции. При такой частоте возбуждения клетки миокарда не могут ответить синхронным, координированным сокращением, охватывающим весь миокард.
ПРЕДШЕСТВУЮЩИЕ ИЗМЕНЕНИЯ В МИОКАРДЕ
Развитию пароксизмальной тахикардии, трепетанию и фибрилляции предшествуют типичные нарушения метаболизма в миокарде. Степень и сочетание этих нарушений при различных видах аритмий различны.
• Увеличение внеклеточного K+.
♦ Причины: дефицит АТФ и креатинфосфата в кардиомиоцитах, снижение активности K+,Na+-АТФазы плазмолеммы, аномалии мембран кардиомиоцитов.
♦ Аритмогенные эффекты: уменьшение величины потенциала покоя, снижение порога возбудимости кардиомиоцитов, замедление проведения импульса, укорочение рефрактерного периода, увеличение периода аритмогенной уязвимости.
• Накопление в кардиомиоцитах избытка цАМФ.
♦ Причины: активация аденилатциклазы (например, катехоламинами); подавление активности фосфодиэстераз, разрушающих цАМФ (наблюдается при ишемии миокарда, миокардитах, кардиомиопатиях).
♦ Аритмогенные эффекты: стимуляция медленного входящего кальциевого тока.
• Повышение содержания ВЖК в клетках миокарда.
♦ Основные причины: повышение содержания катехоламинов в миокарде (они обладают выраженной липолитической активностью), а также увеличение проницаемости мембран кардиомиоцитов.
♦ Аритмогенные эффекты: разобщение процессов окисления и фосфорилирования (это приводит к увеличению концентрации ионов K+ в межклеточной жидкости).
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Сердечная недостаточность - типовая форма патологии, при которой сердце не обеспечивает потребности органов и тканей в адекватном кровоснабжении.
Сердечная недостаточность - одна из частных причин утраты трудоспособности, инвалидизации и смерти пациентов, страдающих заболеваниями ССС. Сердечная недостаточность - не нозологическая форма. Это синдром, развивающийся при многих болезнях, в том числе - поражающих органы и ткани, не относящиеся к ССС.
ЭТИОЛОГИЯ
Две основных группы причин приводят к развитию сердечной недостаточности: оказывающие непосредственное повреждающее действие на сердце и обусловливающие функциональную перегрузку сердца.
Повреждение сердца могут вызывать факторы физической, химической и биологической природы.
♦ Физические факторы: сдавление сердца (экссудатом, кровью, эмфизематозными лёгкими, опухолью), воздействие электрического тока (при электрической травме, проведении дефибрилляции сердца), механическая травма (при ушибах грудной клетки, проникающих ранениях, хирургических манипуляциях).
♦ Химические факторы: химические соединения (в том числе ЛС в неадекватной дозировке), дефицит кислорода, недостаток субстратов метаболизма.
♦ Биологические факторы: высокие уровни БАВ (например, катехоламинов, T4), недостаток витаминов или ферментов, длительная ишемия или инфаркт миокарда.
Перегрузка сердца может быть обусловлена двумя подгруппами факторов: увеличивающими преднагрузку или увеличивающими посленагрузку.
♦ Увеличивающие преднагрузку: гиперволемия, пороки клапанов сердца, полицитемия, гемоконцентрация.
♦ Увеличивающие постнагрузку: артериальные гипертензии, стенозы клапанных отверстий сердца, сужение аорты или лёгочной артерии.
ВИДЫ
Дифференцировка видов сердечной недостаточности основана на критериях происхождения, скорости развития, преимущественного поражения отдела сердца, преимущественной недостаточности фазы сердечного цикла и первичности поражения миокарда.
По происхождению
• Миокардиальная форма развивается преимущественно в результате непосредственного повреждения миокарда.
• Перегрузочная форма возникает преимущественно в результате перегрузки сердца.
• Смешанная форма - результат сочетания прямого повреждения миокарда и его перегрузки.
По скорости развития
• Острая (развивается в пределах нескольких минут и часов). Является результатом инфаркта миокарда, острой недостаточности клапанов, разрыва стенок сердца.
• Хроническая (формируется в течение длительного периода времени). Является следствием артериальной гипертензии, хронической дыхательной недостаточности, длительной анемии, пороков сердца.
По первичности механизма развития
• Первичная (кардиогенная). Развивается в результате преимущественного снижения сократительной функции сердца. Наиболее часто возникает при ИБС, миокардитах, кардиомиопатиях.
• Вторичная (некардиогенная). Возникает вследствие первичного преимущественного уменьшения венозного притока к сердцу при близкой к нормальной величине сократительной функции миокарда. Наиболее часто встречается при острой массивной кровопотере, коллапсе, эпизодах пароксизмальной тахикардии; нарушении диастолического расслабления сердца и заполнения его камер кровью (например, при гидроперикарде).
По преимущественно поражённому отделу сердца
• Левожелудочковая сердечная недостаточность. Может быть вызвана перегрузкой левого желудочка (например, при стенозе устья аорты) или снижением его сократительной функции (например, при инфаркте миокарда).
• Правожелудочковая сердечная недостаточность. Возникает при механической перегрузке правого желудочка (например, при сужении лёгочной артерии) или при лёгочной гипертензии.
• Тотальная. При этой форме выражена и левожелудочковая и правожелудочковая сердечная недостаточность.
По фазе преимущественного нарушения сердечного цикла
• Диастолическая сердечная недостаточность развивается при нарушении расслабления стенок и наполнения левого желудочка. Обусловлена его гипертрофией или фиброзом. Приводит к увеличению конечного диастолического давления.
• Систолическая сердечная недостаточность обусловлена нарушением нагнетающей функции сердца. Приводит к уменьшению сердечного выброса.
ПАТОГЕНЕЗ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Начальные звенья механизмов развития сердечной недостаточности имеют некоторые отличия, в зависимости от её происхождения.
♦ Миокардиальная форма сердечной недостаточности первично характеризуется снижением развиваемого сердцем напряжения. Это проявляется падением силы и скорости его сокращения и расслабления.
♦ Перегрузочная форма сердечной недостаточности формируется на фоне более или менее длительного периода его гиперфункции. Вторично снижается сила и скорость сокращения и расслабления сердца.
♦ В обоих случаях снижение его сократительной функции сопровождается включением экстра- и интракардиальных механизмов компенсации этого сдвига.
Компенсаторные механизмы
Механизмы экстренной компенсации сниженной сократительной функции сердца приводят к повышению силы и скорости сокращения сердца, а также скорости расслабления миокарда.
• Повышение сократимости миокарда при увеличении его растяжимости (механизм Франка-Старлинга).
• Повышение сократимости сердца при возрастании симпатоадреналовых влияний на него.
• Возрастание сократимости сердца при увеличении частоты его сокращений.
• Увеличение сократимости миокарда при возрастании нагрузки на него (геометрический механизм).
Компенсаторная гиперфункция сердца вследствие названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Компенсаторная гипертрофия сердца обусловлена экспрессией отдельных генов кардиомиоцитов и увеличением интенсивности синтеза нуклеиновых кислот и белков. Значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой.
Механизмы декомпенсации
Потенциальные возможности гипертрофированного миокарда не беспредельны. Если на сердце продолжает действовать повышенная нагрузка или оно дополнительно повреждается, сила и скорость его сокращений падают, а их энергетическая «стоимость» возрастает: развивается декомпенсация гипертрофированного сердца. В основе декомпенсации гипертрофированного сердца лежит нарушение сбалансированности роста различных его структур и ремоделирование.
Ремоделирование сердца представляет собой структурные и метаболические изменения в нем, приводящие к изменению его размеров и формы, дилатации его полостей и снижению сократительной функции миокарда.
Ключевые механизмы ремоделирования сердца:
• Изменения гено- и фенотипа кардиомиоцитов.
• Расстройства метаболизма в клетках миокарда и в строме.
• Эксцентрическая гипертрофия миокарда.
• Гибель (некроз, апоптоз) кардиомиоцитов.
• Диффузный кардиофиброз.
• Продольное проскальзывание кардиомиоцитов. Для ремоделированного миокарда характерно:
♦ Отставание роста сосудов от нарастания массы миокарда, что приводит к относительной коронарной недостаточности.
♦ Отставание биогенеза митохондрий от нарастания массы миофибрилл, вызывающее нарушение энергетического обеспечения кардиомиоцитов.
♦ Отставание скорости синтеза структур кардиомиоцитов от должной, приводящее к нарушению пластических процессов и дистрофии миокарда.
При истощении компенсаторных возможностей миокарда, нарастании признаков ремоделирования и декомпенсации его деятельности развивается сердечная недостаточность.
Клеточно-молекулярные механизмы сердечной недостаточности являются основными в патогенезе сердечной недостаточности. Главные из этих механизмов: недостаточное энергообеспечение кардиомиоцитов; ионный дисбаланс, повреждение мембран кардиомиоцитов, дефекты генов и их экспрессии, расстройства нейрогуморальной регуляции сердца (описаны в данной главе в разделе «Патогенез коронарной недостаточности»).
ПРОЯВЛЕНИЯ
Основными нарушениями функции сердца и гемодинамики являются: уменьшение ударного выброса, снижение сердечного выброса, увеличение остаточного систолического объёма крови в желудочках сердца, повышение конечного диастолического давления в желудочках сердца, увеличение давления в магистральных венах (полых, лёгочных), снижение скорости процесса сокращения.
КЛИНИЧЕСКИЕ РАЗНОВИДНОСТИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Острая сердечная недостаточность
Острая сердечная недостаточность - внезапное нарушение насосной функции сердца, приводящее к невозможности поддержания адекватного кровообращения.
Острая сердечная недостаточность имеет три клинических проявления: сердечная астма и отёк лёгких, а также кардиогенный шок. Сердечная астма (удушье, пароксизмальная ночная одышка) возникает в результате застоя крови в малом круге кровообращения как проявление быстрого увеличения давления крови в сосудах малого круга кровообращения и интерстициального отёка лёгких.
Интерстициальный отёк лёгких - отёк паренхимы лёгких без выхода транссудата в просвет альвеол. Клинически проявляется одышкой и кашлем без мокроты. При прогрессировании процесса возникает альвеолярный отёк. Отёк лёгких, или альвеолярный отёк лёгких является следствием прогрессирования сердечной астмы.
Альвеолярный отёк лёгких характеризуется транссудацией плазмы в просвет альвеол. У больных появляется кашель с отделением пенистой мокроты, удушье, в лёгких выслушиваются влажные хрипы. Кардиогенный шок развивается в результате острого выраженного снижения сердечного выброса. Как правило, он возникает при обширном инфаркте миокарда на фоне множественного поражения венечных артерий.
Хроническая сердечная недостаточность - клинический синдром, осложняющий течение ряда заболеваний. Характеризуется развитием одышки и признаками нарушения функции сердца вначале при физической нагрузке, а затем и в покое; периферическими отёками и развитием изменений во всех органах и тканях. Как правило, первоначально возникает диастолическая сердечная недостаточность (реже изначально нарушается систолическая функция миокарда), а затем процесс приобретает тотальный характер.
ПРИНЦИПЫ НОРМАЛИЗАЦИИ ФУНКЦИИ СЕРДЦА ПРИ ЕГО
НЕДОСТАТОЧНОСТИ
Лечебные мероприятия при сердечной недостаточности проводятся комплексно. Они базируются на этиотропном, патогенетическом, саногенетическом и симптоматическом принципах. Этиотропная терапия направлена на уменьшение преднагрузки (снижение возврата венозной крови к сердцу) и постнагрузки (снижение тонус резистивных сосудов). С этой целью используют венозные вазодилататоры, диуретики, α-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента.
Патогенетический принцип имеет целью повышение сократительной функции сердца, уменьшение нарушения энергообеспечения кардиомиоцитов, защиту мембран и ферментов, снижение дисбаланса ионов и воды в миокарде, коррекцию адрено- и холинергических влияний на сердце. Для этого применяют сердечные гликозиды, ингибиторы фосфодиэстеразы, антигипоксанты, антиоксиданты, коронародилататоры, мембранопротекторы, холиномиметики и другие ЛС.
НАРУШЕНИЯ СИСТЕМНОГО УРОВНЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Изменения системного уровня АД подразделяют на гипертензивные и гипотензивные состояния.
• Гипертензивные состояния характеризуются повышением АД выше нормы. К ним относятся гипертензивные реакции и артериальные гипертензии.
• Гипотензивные состояния проявляются снижением АД ниже нормы. Они включают гипотензивные реакции и артериальные гипотензии.
ТЕРМИНОЛОГИЯ
Важно различать значения терминологических элементов «тония» и «тензия».
• Терминологический элемент «тония» применяется для характеристики тонуса мышц, в том числе - ГМК сосудистой стенки. Гипертония означает избыточное напряжение мышц, проявляющееся увеличением их сопротивления растяжению. Гипотония подразумевает снижение напряжения мышц, проявляющееся уменьшением их сопротивления растяжению.
• Терминологический элемент «тензия» используют для обозначения давления жидкостей в полостях и сосудах, в том числе - кровеносных. Гипертензия означает повышение, а гипотензия - снижение давления в полостях организма, его полых органах и сосудах.
Тем не менее, термины «гипертоническая болезнь» и «гипертонический криз» применяют для обозначения эссенциальной артериальной гипертензии и грозного осложнения артериальной гипертензии соответственно.
• Лекарственные средства (независимо от механизма их действия: на тонус сосудов, сердечный выброс, ОЦК) называют гипотензивными (ЛС, снижающие АД) и гипертензивными (ЛС, повышающие АД).
Артериальные гипертензии
Артериальная гипертензия - состояние, при котором систолическое АД достигает 140 мм. рт.ст. и более, а диастолическое АД 90 мм. рт.ст. и более.
Артериальной гипертензией страдает примерно 25% взрослого населения. С возрастом распространённость увеличивается и достигает 65% у лиц старше 65 лет. До 50-летнего возраста артериальной гипертензией чаще заболевают мужчины, а после 50 лет - женщины.
КЛАССИФИКАЦИЯ
ВОЗ и Международное общество гипертензии в 1999 г. предложили классификацию артериальной гипертензии по уровню АД (табл. 22-1).
Таблица 22-1. Классификация артериальной гипертензии (АГ).
• 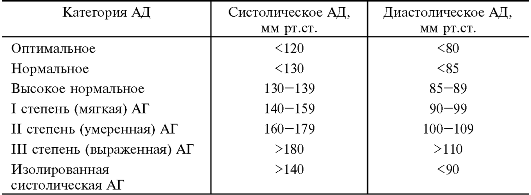 Если удаётся выявить патологию органа, приводящую к артериальной гипертензии, то её считают вторичной (симптоматической).
Если удаётся выявить патологию органа, приводящую к артериальной гипертензии, то её считают вторичной (симптоматической).
• При отсутствии явной патологии какого-либо органа, приводящей к артериальной гипертензии она называется первичной, эссенциальной, идиопатической, в России - гипертонической болезнью.
ВИДЫ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
По критериям инициального патогенетического звена, изменения сердечного выброса, типу повышения АД и характеру клинического течения артериальные гипертензии подразделяют на несколько видов. Инициальное звено механизма развития. По этому критерию выделяют общие и местные артериальные гипертензии.
• Общие (системные) артериальные гипертензии:
♦ Нейрогенные артериальные гипертензии. Среди них различают центрогенные и рефлекторные (рефлексогенные).
♦ Эндокринные (гормональные). Развиваются вследствие эндокринопатий надпочечников, щитовидной железы и т.д.
♦ Гипоксические (метаболические). Выделяют ишемические (почечноишемическая, цереброишемическая), венозно-застойные и гипоксические (без первичного нарушения гемодинамики в органах и тканях).
♦ Гемические («кровяные»). Развиваются вследствие увеличения объёма или вязкости крови.
• Местные (регионарные) артериальные гипертензии. Изменение сердечного выброса. Различают гипер-, гипо- и эукинетические артериальные гипертензии.
• Гиперкинетические. Повышен сердечный выброс (при нормальном или даже пониженном ОПСС).
• Гипокинетические. Понижен сердечный выброс (при значительно увеличенном ОПСС).
• Эукинетические. Нормальный сердечный выброс и повышенное
ОПСС.
Тип повышения АД. Дифференцируют систолические, диастолические и смешанные (систоло-диастолические) артериальные гипертензии.
Характер клинического течения. Выделяют артериальные гипертензии злокачественного и доброкачественного течения.
• «Доброкачественные». Протекают с медленным развитием, повышением как систолического, так и диастолического АД; как правило, эукинетические.
• «Злокачественные». Быстро прогрессируют, с преимущественным повышением диастолического АД; как правило, гипокинетические, реже - гиперкинетические (на начальном этапе).
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Факторы риска артериальных гипертензий: отягощённый семейный анамнез, ожирение, СД, заболевания почек, злоупотребление алкоголем, избыточное употребление поваренной соли, стресс, гиподинамия, курение, тип личности пациента.
Нейрогенные артериальные гипертензии
Эти гипертензии характеризуются либо повышением гипертензивных нейрогенных влияний, либо ослаблением гипотензивных нейрогенных эффектов, либо сочетанием того и другого. Нейрогенные гипертензии составляют примерно половину всех артериальных гипертензий. Их подразделяют на рефлекторные (рефлексогенные) и центрогенные. Центрогенные артериальные гипертензии могут возникать либо при нарушениях ВНД, либо при органических поражениях структур мозга, регулирующих системную гемодинамику.
• Артериальные гипертензии, обусловленные нарушениями ВНД (неврозом) являются результатом повторных и затяжных стрессов с негативной эмоциональной окраской, которые вызывают цепь взаимозависимых прогрессирующих изменений. Наиболее важными являются:
♦ Перенапряжение и срыв основных корковых нервных процессов (возбуждения и активного коркового торможения), нарушение их сбалансированности и подвижности.
♦ Развитие невротического состояния и формирование корковоподкоркового комплекса возбуждения (доминанты возбуждения).
Этот комплекс включает симпатические ядра заднего гипоталамуса, адренергические структуры ретикулярной формации и кардиовазомоторного центра.
♦ Повышение под влиянием катехоламинов тонуса стенок артериальных и венозных сосудов, а также - работы сердца.
♦ Одновременно активируется система «гипоталамус-гипофиз-надпочечники». Это сопровождается увеличением продукции и концентрации в крови гормонов с гипертензивным действием (АДГ, АКТГ и кортикостероидов, катехоламинов, тиреоидных гормонов).
♦ Указанные вещества потенцируют степень и длительность сужения артериол и венул, повышения ОЦК и сердечного выброса. Это ведёт к стойкому повышению АД - развивается артериальная гипертензия.
Описанные выше звенья патогенеза характерны и для инициальных этапов гипертонической болезни.
• Артериальные гипертензии, обусловленные повреждениями структур мозга, участвующих в регуляции АД.
♦ Наиболее частые причины: травма мозга, энцефалиты, инсульты, опухоли мозга или его оболочек, а также нарушение кровоснабжения головного мозга (цереброишемическая гипертензия).
♦ Общий патогенез. Указанные причины непосредственно повреждают структуры, участвующие в регуляции уровня АД (симпатические ядра гипоталамуса, ретикулярную формацию, кардиовазомоторный центр). Последующие звенья патогенеза сходны с механизмами развития артериальной гипертензии при неврозах.
Рефлекторные артериальные гипертензии могут развиваться на основе условных и безусловных рефлексов.
• Условнорефлекторные артериальные гипертензии.
♦ Причина: повторное сочетание индифферентных (условных) сигналов (например, информации о предстоящем публичном выступлении, важном соревновании или событии) с действием агентов, вызывающих повышение АД (например, кофеина, алкоголя или наркотиков). После определённого числа сочетаний увеличение АД регистрируется уже только на индифферентный сигнал и может развиться стойкое повышение АД.
• Безусловнорефлекторные артериальные гипертензии.
♦ Причина: хроническое раздражение экстра- и интрарецепторов, нервных стволов и нервных центров (например, при длительно протекающих каузалгических синдромах, энцефалитах, опухолях мозга). Эти состояния способствуют прекращению «депрессорной» афферентной импульсации к кардиовазомоторному (прессорному) центру. Повышение тонуса последнего обусловливает стойкое увеличение АД.
Эндокринные (эндокриногенные) артериальные гипертензии
Эти гипертензии развиваются в результате гипертензивного эффекта ряда гормонов.
• Артериальная гипертензия при эндокринопатиях надпочечников. Надпочечниковые артериальные гипертензии подразделяют на катехоламиновые и кортикостероидные, а последние - на минералокортикоидные и глюкокортикоидные.
♦ Минералокортикоидные артериальные гипертензии обусловлены избыточным синтезом альдостерона (гиперальдостеронизмом).
♦ Глюкокортикоидные артериальные гипертензии являются результатом гиперпродукции глюкокортикоидов, в основном кортизола (реже кортизона и кортикостерона). Практически все артериальные гипертензии глюкокортикоидного генеза развиваются при болезни и синдроме Иценко-Кушинга.
♦ Катехоламиновые артериальные гипертензии развиваются в связи со значительным увеличением в крови адреналина и норадреналина, вырабатываемых хромафинными клетками. В большинстве случаев такой гипертензии обнаруживают феохромоцитому.
• Артериальная гипертензия при эндокринопатиях щитовидной железы (чаще при гипертиреозе).
♦ Гипертиреоз. Для гипертиреоза характерно - увеличение ЧСС, ударного и сердечного выбросов, преимущественно изолированная систолическая артериальная гипертензия с низким (или нормальным) диастолическим АД. В основе развития артериальной гипертензии при гипертиреозе лежит кардиотонический эффект T3 и T4.
♦ Гипотиреоз. Характеризуется увеличением диастолического АД, снижением ЧСС и сердечного выброса.
• Артериальная гипертензия при расстройствах эндокринной функции гипоталамо-гипофизарной системы.
♦ Гиперпродукция АДГ. Патогенез: активация реабсорбции жидкости из первичной мочи приводит к гиперволемии; повышение тонуса ГМК артериол вызывает сужение их просвета и повышение ОПСС. В совокупности эти механизмы обеспечивают стойкое повышение АД.
♦ Гиперпродукция АКТГ. При этом развивается болезнь ИценкоКушинга.
Артериальные гипертензии, вызванные гипоксией
Артериальные гипертензии, развивающиеся в результате гипоксии органов (особенно мозга и почек), нередко встречаются в клинической практике. К ним относят артериальные гипертензии, в основе
патогенеза которых лежат нарушения метаболизма веществ с гипо- и гипертензивным действием. Возникают эти гипертензии в результате расстройств кровообращения и последующей гипоксии различных внутренних органов. Гипо- и гипертензивные метаболиты
• Метаболиты с гипертензивным (прессорным) действием: ангиотензины (в наибольшей мере - ангиотензин II), биогенные амины (серотонин, тирамин), ПгF, тромбоксан А2, эндотелин, циклические нуклеотиды (в основном цАМФ).
• Метаболиты с гипотензивным (депрессорным) эффектом: кинины (особенно, брадикинин и каллидин), Пг групп E и I, аденозин, ацетилхолин, натрийуретические факторы (в том числе атриопептин), ГАМК, оксид азота (NO).
Общий патогенез гипоксических артериальных гипертензий
♦ Гиперпродукция или активация метаболитов с гипертензивным действием.
♦ Гипопродукция или инактивация метаболитов с гипотензивным действием.
♦ Изменение чувствительности рецепторов сердца и сосудов к этим метаболитам.
Клинические разновидности. Наиболее частыми клиническими разновидностями гипоксических (метаболических) артериальных гипертензий являются: цереброишемическая гипертензия (см. выше) и почечные (вазоренальная и ренопаренхиматозная) гипертензии.
• Вазоренальная (реноваскулярная) артериальная гипертензия вызвана ишемией почки (почек) вследствие окклюзии почечных артерий.
♦ Основные причины: атеросклероз почечных артерий и фибромускулярная дисплазия.
♦ Патогенез. Наибольшее значение имеет активация ренин-ангиотензиновой системы вследствие гипоперфузии почки (почек). Ишемия юкстагломерулярного аппарата приводит к выработке ренина. Повышение уровня ренина ведёт к образованию избытка ангиотензина II и альдостерона. Они вызывают спазм сосудов, задержку ионов натрия и воды, стимуляцию симпатической нервной системы.
• Ренопаренхиматозная (ренопривная, от лат. ren - почка, privo - лишать чего-либо) артериальная гипертензия первично обусловлена повреждением паренхимы почек.
♦ Причины: наследственные, врождённые или приобретённые заболевания почек (гломерулонефрит, диабетическая нефропатия, тубулоинтерстициальный нефрит, поликистоз, пиелонефрит, опухоль, травма, туберкулёз). Наиболее частая причина - гломерулонефрит.
♦ Причина: уменьшение массы паренхимы почек, вырабатывающей БАВ с гипотензивным действием (Пг групп E и I с сосудорасширяющим эффектом, брадикинина и каллидина). «Гемические» артериальные гипертензии. Значительные изменения состояния крови (увеличение её объёма или вязкости) нередко приводят к развитию артериальной гипертензии. Так, при полицитемиях (истинной и вторичных) и гиперпротеинемии в 25-50% случаев регистрируется стойкое повышение АД.
Смешанные артериальные гипертензии. Помимо указанных выше, артериальные гипертензии могут развиваться в результате одновременного включения нескольких механизмов. Например, артериальные гипертензии при повреждении мозга или аллергических реакциях формируются с участием нейрогенного, эндокринного и почечного патологических факторов.
Гипертоническая болезнь
Гипертоническая болезнь - хронически протекающее заболевание, центрогенного нейрогенного происхождения, характеризующееся стойким повышением АД.
Диагноз гипертонической болезни устанавливают методом исключения симптоматических артериальных гипертензий.
Определение «эссенциальная» означает, что стойко повышенное АД при гипертонической болезни составляет сущность этой артериальной гипертензии. Каких-либо изменений в других органах, которые могли бы привести к артериальной гипертензии, не находят. Частота эссенциальной артериальной гипертензии составляет до 90% всех артериальных гипертензий (при тщательном обследовании пациентов в специализированных стационарах эта величина снижается до 75%). Этиология
• Наибольшее причинное значение имеет повторный, как правило, затяжной психоэмоциональный стресс.
• Главные факторы риска: метаболический синдром, стресс, наследственная предрасположенность, избыточное потребление поваренной соли, мембранные нарушения баро- и хеморецепторов, эндотелин, активация ренин-ангиотензиновой системы, нарушение выделения натрия, увеличение активности симпатической нервной системы.
Основные звенья патогенеза гипертонической болезни аналогичны центрогенным артериальным гипертензиям, обусловленных невротическими состояниями.
ПРОЯВЛЕНИЯ АРТЕРИАЛЬНЫХ ГИПЕРТЕНЗИЙ
В зависимости от наличия (отсутствия) изменений органов-мишеней (сердце, почки, артерии, головной мозг и сетчатка глаза) выделяют 3 стадии гипертонической болезни.
• I стадия - транзиторное повышение АД без органических изменений в органах-мишенях.
• II стадия - повышение АД в сочетании с изменениями органовмишеней, обусловленными артериальной гипертензией, но без нарушения их функций (поражение органов-мишеней).
• III стадия - артериальная гипертензия, сочетающаяся с грубыми изменениями органов-мишеней с нарушением их функций (повреждение органов-мишеней).
Стадия I (транзиторной артериальной гипертензии)
На этой стадии отмечается преходящее повышение артериального давления. Это связано с периодическим усилением тонуса симпатической нервной системы, преобладанием эффектов гормонов и метаболитов с гипертензивным действием. Указанные факторы обусловливают развитие гиперволемии, спазма ГМК артериол, гиперфункцию сердца (увеличение ударного и минутного выброса). На этой стадии происходит повторное, более или менее длительное повышение АД выше нормы, но признаки морфологических изменений внутренних органов отсутствуют.
Стадия II (стабильной артериальной гипертензии)
На этой стадии регистрируют постоянно более или менее повышенное АД, а также признаки поражения тканей и внутренних органов.
• Стабильно высокий уровень АД достигается за счёт рефлексогенного, эндокринного и гемического механизмов.
♦ Рефлексогенный (барорецепторный) механизм заключается в нарастающем уменьшении афферентной депрессорной импульсации от барорецепторов дуги аорты, синокаротидной и других зон в адрес сосудодвигательного (прессорного) центра.
♦ Эндокринный фактор характеризуется гиперпродукцией и инкрецией в кровь БАВ (гормонов и метаболитов) с гипертензивным действием.
♦ Гемический механизм заключается в развитии полицитемии (в основном, за счёт эритроцитоза) и повышенной вязкости крови (в связи с полицитемией и диспротеинемией).
• Признаки поражения органов-мишеней:
♦ сердце: гипертрофия миокарда;
♦ сосуды: атеро- и артериосклероз;
♦ почки: нефросклероз;
♦ сетчатка глаза: изменение сосудов глазного дна и др.
Стадия III (дистрофических органных изменений)
Эта стадия гипертонической болезни проявляется грубыми органическими и функциональными изменениями всех органов и тканей с развитием полиорганной недостаточности. АД в эту стадию может быть любым (повышенным, нормальным или даже пониженным). Наиболее часто наблюдают следующие проявления:
♦ сердце: коронарная и хроническая сердечная недостаточность;
♦ сосуды: осложнённый атеросклероз, приводящий к развитию инфарктов в различных органах;
♦ почки: первично сморщенная почка с хронической почечной недостаточностью;
♦ сетчатка глаза: кровоизлияния или экссудаты, отслойка сетчатки;
♦ головной мозг: острые и хронические нарушения мозгового кровообращения;
♦ дистрофические и склеротические изменения в других органах (эндокринных железах, кишечнике, лёгких и др.).
ПРИНЦИПЫ ЛЕЧЕНИЯ АРТЕРИАЛЬНЫХ ГИПЕРТЕНЗИЙ
Целью лечения артериальной гипертензии является снижение высокого АД, предотвращение повреждения органов-мишеней, снижение сердечно-сосудистой заболеваемости и смертности. Лечение артериальной гипертензии у каждого конкретного больного включает контроль АД и факторов риска, изменение образа жизни, лекарственную терапию.
Лекарственная терапия
В настоящее время для лечения артериальной гипертензии применяют следующие основные группы препаратов: блокаторы медленных кальциевых каналов, диуретики, β-адреноблокаторы, ингибиторы АПФ, антагонисты (блокаторы рецепторов) ангиотензина II, α-адреноблокаторы, агонисты имидазолиновых рецепторов.
Лекарственную терапию проводят индивидуально согласно апробированным схемам и официальным рекомендациям.
Артериальные гипотензии
Артериальная гипотензия - снижение АД ниже 100/60 мм рт.ст. (границы нормы при хорошем самочувствии и полной работоспособности).
ВИДЫ АРТЕРИАЛЬНОЙ ГИПОТЕНЗИИ
Различают физиологическую и патологическую артериальные гипотензии.
Физиологическая артериальная гипотензия
• Индивидуальный вариант нормы (т.н. конституционально низкое
АД).
• Артериальная гипотензия высокой тренированности (спортивная артериальная гипотензия).
• Адаптивная (компенсаторная) артериальная гипотензия (характерная для жителей высокогорья, тропиков, Заполярья).
Патологическая артериальная гипотензия
• Острая артериальная гипотензия. Это наблюдается при коллапсе и шоке.
• Хроническая первичная артериальная гипотензия.
♦ Нейроциркуляторная (с нестойким обратимым течением, а также выраженная стойкая форма - гипотоническая болезнь).
♦ Ортостатическая идиопатическая (первичная вегетативная недостаточность).
• Хроническая вторичная (симптоматическая) артериальная гипотензия с ортостатическим синдромом или без него.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
По инициальному звену механизма развития выделяют нейрогенные, эндокринные и метаболические артериальные гипотензии.
Нейрогенные артериальные гипотензии
Среди нейрогенных артериальных гипотензий выделяют гипотензии центрогенные и рефлекторные.
Центрогенные артериальные гипотензии являются результатом либо функционального расстройства ВНД, либо органического повреждения мозговых структур, участвующих в регуляции АД.
• Артериальные гипотензии вследствие нарушений ВНД.
♦ Причина: длительный и повторный стресс, что ведёт к развитию невротического состояния.
♦ Механизм развития. Активация парасимпатических влияний (встречается реже, чем симпатических) на ССС обусловливает снижение сократительной функции миокарда, сердечного выброса крови и тонуса резистивных сосудов.
• Артериальные гипотензии вследствие органических изменений в структурах мозга.
♦ Наиболее частые причины: травмы головного мозга, нарушения мозгового кровообращения, дегенеративные изменения в веществе головного мозга, синдром Шая-Дрейджера.
♦ Патогенез: снижение активности симпатикоадреналовой системы и выраженности её эффектов на ССС ведёт к снижению тонуса стенок артериол, ОПСС, сердечного выброса.
Рефлекторные артериальные гипотензии
• Причина: нарушение проведения эфферентных гипертензивных импульсов от сосудодвигательного центра продолговатого мозга к стенкам сосудов и сердцу. Наиболее часто это развивается при нейросифилисе, боковом амиотрофическом склерозе, сирингомиелии, периферических невропатиях различного генеза.
• Механизм развития заключается в значительном уменьшении или прекращении тонических влияний симпатической нервной системы на стенки сосудов и сердца.
Эндокринные артериальные гипотензии
Различают артериальные гипотензии надпочечникового, гипофизарного и гипотиреоидного генеза.
• Причины:
♦ Надпочечниковая недостаточность развивается при гипотрофии коры надпочечников, опухоли коры надпочечников с разрушением их паренхимы, кровоизлиянии в надпочечник (один или оба), травмах, инфекционных или аутоиммунном поражениях надпочечников. Эти процессы приводят к дефициту катехоламинов, минерало- и глюкокортикоидов.
♦ Питуитарная недостаточность обусловливает развитие артериальной гипотензии вследствие недостаточного эффекта вазопрессина, АКТГ, ТТГ, СТГ.
♦ Гипотиреоз приводит к развитию артериальной гипотензии вследствие дефицита T3 и T4 или их эффектов.
• Патогенез. Указанные выше причины прямо или опосредованно (через уменьшение тонуса симпатической нервной системы) вызывают снижение ОЦК, сердечного выброса и тонуса артериол.
Метаболические артериальные гипотензии встречаются редко. Они развиваются при дистрофических изменениях в органах и тканях, участвующих в синтезе метаболитов с гипертензивным действием.
НАРУШЕНИЯ РЕГИОНАРНОГО КРОВОТОКА
Многочисленные расстройства регионарного (периферического, местного, органно-тканевого) кровотока подразделяют на нарушения кро-
вотока в сосудах среднего диаметра и расстройства крово- и лимфотока в сосудах микроциркуляторного русла.
Нарушения кровотока в сосудах среднего диаметра
К нарушениям кровообращения в сосудах среднего диаметра относятся патологическая артериальная гиперемия, венозная гиперемия, ишемия и стаз.
АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ
Артериальная гиперемия - увеличение кровенаполнения и количества протекающей по сосудам органов и тканей крови в результате расширения артериол и артерий.
Причины . Факторы экзо- и эндогенного происхождения и быть физической, химической или биологической природы. Наибольшее значение имеют физиологически активные вещества, образующиеся в организме: аденозин, ацетилхолин, простациклин, оксид азота, органические кислоты (молочная, пировиноградная, кетоглутаровая).
Механизмы возникновения
Расширение просвета малых артерий и артериол достигается за счёт реализации нейрогенного (нейротонического и нейропаралитического) и гуморального механизмов.
• Нейрогенные механизмы:
♦ Нейротонический механизм заключается в преобладании эффектов парасимпатических нервных влияний (по сравнению с симпатическими) на стенки артериальных сосудов.
♦ Нейропаралитический механизм характеризуется снижением симпатических нервных влияний на стенки артерий и артериол.
• Гуморальный механизм характеризуется местным увеличением содержания или эффектов БАВ с сосудорасширяющим эффектом (аденозина, оксида азота, ПгЕ, ПгI2, кининов).
Виды артериальных гиперемий
Различают физиологическую и патологическую разновидности артериальной гиперемии.
Физиологическая артериальная гиперемия адекватна воздействию и имеет адаптивное значение. Она может быть функциональной и защитно-приспособительной.
• Функциональная развивается в органах и тканях в связи с увеличением уровня их функционирования (например, гиперемия в сокращающейся мышце, в усиленно работающем органе или ткани).
• Защитно-приспособительная развивается при протекании защитных реакций и процессов в тканях (например, в очаге воспаления, см. главу 5).
Патологическая артериальная гиперемия не адекватна воздействию, не связана с изменением функции органа или ткани и играет дезадаптивную - повреждающую роль.
Примеры: патологическая артериальная гиперемия головного мозга при гипертензивном кризе, органов брюшной полости после удаления асцита, в коже и мышцах конечности после снятия жгута; в месте длительного воздействия тепла (солнечного, при использовании грелки, горчичников).
Проявления артериальных гиперемий
♦ Увеличение диаметра артериальных сосудов.
♦ Покраснение, повышение температуры, увеличение объёма и тургора участка органа или ткани.
♦ Возрастание числа и диаметра функционирующих артериол и капилляров, ускорение тока крови.
♦ Увеличение лимфообразования и лимфооттока.
Последствия артериальных гиперемий
• При физиологических разновидностях артериальной гиперемии отмечается активация специфических и потенцирование неспецифических функций органа или ткани.
Примеры: активация местного иммунитета, ускорение пластических процессов; обеспечение гиперфункции и гипертрофии органов и тканей продуктами обмена веществ и кислородом.
• При патологической артериальной гиперемии, как правило, возникает перерастяжение и микроразрывы стенок сосудов микроциркуляторного русла, микро- и макрокровоизлияния в ткани, кровотечения. Устранение или предупреждение этих негативных последствий является целью терапии патологических разновидностей артериальной гиперемии.
ВЕНОЗНАЯ ГИПЕРЕМИЯ
Венозная гиперемия - увеличение кровенаполнения ткани или органа, сочетающееся с уменьшением количества протекающей по их сосудам крови.
Основная причина венозной гиперемии - механическое препятствие оттоку венозной крови от тканей или органа. Это может быть результатом сужения просвета венулы или вены при её компрессии (опухолью, отёчной тканью, рубцом, жгутом, тугой повязкой) и обтурации (тромбом, эмболом, опухолью), сердечной недостаточности, наличия варикозных расширений.
Проявления
♦ Увеличение числа и диаметра функционирующих венозных сосудов и капилляров, маятникообразное движение крови в них.
♦ Цианоз, отёк и снижение температуры участка органа или ткани.
♦ Кровоизлияния и кровотечения.
Патогенные эффекты венозной гиперемии обусловлены местной гипоксией и отёком ткани, кровоизлияниями и кровотечениями. Это вызывает снижение специфической и неспецифических функций органов и тканей; гипотрофию и гипоплазию структурных элементов тканей и органов; некроз паренхиматозных клеток и развитие соединительной ткани (склероза, цирроза) в органах.
ИШЕМИЯ
Ишемия - недостаточное поступление артериальной крови к тканям и органам по сравнению с потребностью в ней.
Причины
• По природе выделяют физические (сдавление артериальных сосудов, сужение или закрытие их просвета изнутри), химические (например, никотин, некоторые ЛС) и биологические факторы (например, БАВ с сосудосуживающими эффектами, экзо- и эндотоксины).
• По происхождению: эндогенные или экзогенные воздействия инфекционной и неинфекционной природы.
Механизмы возникновения ишемии
Механизмы возникновения ишемии можно подразделить на 2 группы: приводящие к абсолютному снижению притока артериальной крови и приводящие к увеличению потребления субстратов обмена и кислорода (т.е. - к относительному их недостатку).
Снижение притока артериальной крови к тканям и органам встречается наиболее часто и может быть обусловлено следующими механизмами: нейрогенным, гуморальным и физическим.
• Нейрогенные механизмы:
♦ Нейротонический механизм характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической.
♦ Нейропаралитический механизм характеризуется устранением или снижением парасимпатических влияний на стенки артериол.
• Гуморальный механизм заключается в увеличении содержания в тканях БАВ с вазоконстрикторным действием (катехоламины, тромбоксан А2, ангиотензин и др.) или чувствительности рецепторов стенок артериол к ним.
• Физический механизм характеризуется наличием механического препятствия движению крови по артериальным сосудам. Причины: сдавление артериального сосуда извне; уменьшение (вплоть до полного закрытия - обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом).
♦ Эмбол - плотное образование, циркулирующее в полостях сердца, кровеносных или лимфатических сосудах в норме в них не встречающееся. Попадая в сосуд, соответствующего ему диаметра, эмбол приводит к ишемии или венозной гиперемии. По происхождению различают эндогенные и экзогенные эмболы.
❖ Экзогенные. Чаще всего - пузырьки воздуха (попадающие в крупные вены при их ранении) и инородные тела (например, ЛС на масляной основе).
❖ Эндогенные: фрагменты тромбов (тромбоэмболы); кусочки жировой ткани или кости, образующиеся при переломах трубчатых костей; опухолевые клетки; микроорганизмы.
♦ Эмболия - циркуляция в кровеносном или лимфатическом русле образования, в норме в нём не встречающегося и закрытие либо сужение им кровеносного или лимфатического сосуда.
Увеличение потребности тканей в кислороде или субстратах обмена веществ наблюдается при значительной гиперфункции органа или ткани. При выраженном атеросклерозе это может приводить к ишемии ткани или участка органа (миокарда, скелетной мышцы и др.).
Основные проявления ишемии при снижении притока крови по артериям
♦ Побледнение и снижение температуры участка ткани или органа.
♦ Снижение пульсации артериальных сосудов.
♦ Уменьшение числа и диаметра функционирующих артериол и капилляров (при снижении притока крови к ткани).
♦ Снижение лимфообразования и лимфооттока.
Последствия ишемии
Основные последствия ишемии, развивающиеся вследствие гипоксии и выделения БАВ: снижение специфических и неспецифических функций, развитие дистрофий, инфарктов, гипотрофии, гипоплазии участка ткани или органа.
Характер, выраженность и масштаб последствий ишемии зависит от многих факторов: скорости развития ишемии, диаметра поражённо- го сосуда, чувствительности ткани или органа к ишемии, значения ишемизированного органа или ткани, а также от степени развития коллатерального кровотока.
Коллатеральный кровоток - система кровообращения в сосудах вокруг ишемизированного участка ткани и в нём самом. Включению (или возрастанию) коллатерального кровообращения способствуют: наличие градиента давления крови выше и ниже суженного участка сосуда; накопление в зоне ишемии БАВ с сосудорасширяющим действием; высокая степень развития сосудистой сети (коллатералей) в поражён- ном органе или ткани.
Выделяют три группы органов и тканей, в зависимости от степени развития артериальных сосудов и анастомозов между ними:
♦ С абсолютно достаточной коллатеральной сетью: скелетная мускулатура, брыжейка кишечника, лёгкие. В них совокупный просвет коллатеральных сосудов равен или превышает диаметр магистральной артерии. В связи с этим прекращение кровотока по ней не вызывает выраженной ишемии тканей в регионе кровоснабжения данной артерии.
♦ С абсолютно недостаточными коллатералями: миокард, почки, головной мозг, селезёнка. Поэтому в этих органах суммарный просвет коллатеральных артерий значительно меньше диаметра магистральной артериальной ветви. Окклюзия её приводит к выраженной ишемии или инфаркту ткани.
♦ С относительно достаточными (недостаточными) коллатералями: кожа, надпочечники, стенки кишечника, желудка, мочевого пузыря. В них совокупный просвет коллатеральных сосудов умеренно меньше диаметра магистральной артерии. Окклюзия крупного артериального ствола в этих органах сопровождается большей или меньшей степенью их ишемии.
СТАЗ
Стаз - значительное замедление или прекращение тока крови или лимфы в сосудах органа или ткани.
Причины стаза: ишемия, венозная гиперемия, агрегация и агглютинация форменных элементов крови.
• Патогенез. Уменьшение притока или оттока крови создаёт условия для замедления её движения в сосудах органа или ткани. На финальном этапе стаза всегда происходит процесс агрегации или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки. Виды стаза. Выделяют стаз первичный и вторичный. Первичный (истинный) стаз начинается с активации форменных элементов крови и выделения ими большого количества проагреган-
тов или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к сосудистой стенке. Это и вызывает замедление или остановку кровотока в сосудах.
• Вторичный стаз (ишемический или венозно-застойный) первоначально обусловлен снижением притока или оттока крови. В последующем развивается агрегация и адгезия клеток крови.
Проявления стаза:
♦ уменьшение внутреннего диаметра сосудов при ишемическом стазе;
♦ увеличение просвета сосудов при венозно-застойном варианте стаза;
♦ образование большого количества агрегатов форменных элементов крови в просвете сосудов и на их стенках;
♦ микрокровоизлияния (чаще при застойном стазе).
Следует помнить, что проявления собственно ишемии или венозной гиперемии могут перекрывать проявления стаза. Последствия стаза. При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений. Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко - к инфаркту участка ткани или органа.
Нарушение крово- и лимфообращения в сосудах микроциркуляторного русла
Микроциркуляция представляет собой упорядоченное движение крови и лимфы по мелким сосудам, транскапиллярный перенос плазмы и форменных элементов крови, перемещение жидкости во внесосудистом пространстве.
Общая этиология
♦ Нарушения центрального и регионарного кровообращения. К наиболее значимым относят сердечную недостаточность, артериальную и венозную гиперемию, ишемию, стаз.
♦ Изменения вязкости и объёма крови и лимфы. Они развиваются вследствие гемо(лимфо)концентрации и гемо(лимфо)дилюции.
♦ Повреждение стенок сосудов микроциркуляторного русла. Обычно наблюдается при артериальной гипертензии, воспалении, циррозах, опухолях и др.
ТИПОВЫЕ ФОРМЫ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ
Выделено три группы типовых форм нарушения микроциркуляции: внутрисосудистые (интраваскулярные), чресстеночные (трансмураль-
ные) и внесосудистые (экстраваскулярные). Расстройства микроциркуляции приводят к капилляро-трофической недостаточности.
Внутрисосудистые нарушения микроциркуляции
• Замедление (вплоть до стаза) тока крови или лимфы (сходно с аналогичными нарушениями кровотока в сосудах среднего калибра при ишемии или венозной гиперемии).
• Чрезмерное ускорение кровотока (например, при патологической артериальной гипертензии, гиперволемии).
• Нарушение ламинарности (турбулентность) тока крови или лимфы обусловлено изменениями вязкости и агрегатного состояния крови, а также повреждением стенок сосудов микроциркуляторного русла с нарушением гладкости их (например, при васкулитах или пристеночных микротромбах).
• Увеличение внекапиллярного тока крови происходит вследствие открытия артериоловенулярных шунтов и сброса крови из артериол в венулы, минуя капиллярную сеть. Причина: спазм ГМК артериол и закрытие прекапиллярных сфинктеров при значительном увеличении уровня катехоламинов в крови (например, при гипертоническом кризе).
Трансмуральные нарушения микроциркуляции
Перемещение через стенку микрососуда относится как к жидкой части крови (в этом случае говорят о проницаемости), так и к клеточным элементам (в этом случае говорят об эмиграции и выходе форменных элементов крови в ткань, т.е. о микрогеморрагии).
• Нарушения проницаемости. При различных патологических состояниях объём перемещения плазмы крови или лимфы через стенку сосуда может возрастать либо уменьшаться.
♦ Увеличение проницаемости сосудистой стенки наблюдается в условиях ацидоза, при активации гидролаз, округлении клеток эндотелия и перерастяжении стенок сосудов микроциркуляции. Перемещение жидкости происходит за счёт фильтрации, трансцитоза (энергозависимого пиноцитоза), диффузии и осмоса.
♦ Уменьшение проницаемости вызвано утолщением или уплотнением стенок сосудов, а также нарушением энергообеспечения внутриклеточных процессов.
• Нарушения эмиграции и выхода в ткань форменных элементов крови. Эмиграция лейкоцитов через стенку микрососудов осуществляется и в норме. В патологии же наблюдается чрезмерная эмиграция лейкоцитов, а также пассивный выход из крови тромбоцитов и эритроцитов с последующим развитием микрогеморрагий.
Экстраваскулярные нарушения микроциркуляции
Внесосудистые (экстраваскулярные) нарушения микроциркуляции сопровождаются увеличением или уменьшением объёма межклеточной жидкости. И то и другое приводит к замедлению оттока её в сосуды микроциркуляторного русла. Увеличение содержания в интерстициальной жидкости продуктов метаболизма и БАВ вызывает нарушение обмена веществ и ионов в тканях. Повреждение клеток происходит и вследствие их сдавления избытком интерстициальной жидкости.
• Увеличение объёма межклеточной жидкости обусловлено местными патологическими процессами (воспаление, аллергические реакции, рост новообразований, склеротические процессы, венозная гиперемия, стаз).
• Уменьшение объёма межклеточной жидкости наблюдается при гипогидратации, ишемии, а также при снижении фильтрации жидкости в прекапиллярах или увеличение реабсорбции её в посткапиллярах.
Капилляро-трофическая недостаточность - состояние, характеризующееся нарушением крово- и лимфообращения в сосудах микроциркуляторного русла, что сопровождается нарушениями обмена веществ в тканях и органах. Длительно существующая капилляро-трофическая недостаточность приводит к различным вариантам дистрофий, нарушениям пластических процессов в тканях, расстройству жизнедеятельности поражённых органов и организма в целом.
Сладж
Сладж - феномен, характеризующийся адгезией, агрегацией и агглютинацией форменных элементов крови с сепарацией её на плазму и конгломераты из эритроцитов, лейкоцитов, тромбоцитов, что обусловливает нарушения микрогемоциркуляции.
• Причины сладжа.
♦ Нарушения центральной гемодинамики.
♦ Повышение вязкости крови.
♦ Повреждение стенок микрососудов.
• Механизмы развития сладжа.
♦ Активация форменных элементов крови, высвобождение ими проагрегантов.
♦ Уменьшение поверхностного заряда форменных элементов крови и их «перезарядка».
♦ Адсорбция мицелл белка на форменных элементах крови, потенцирование процессов их оседания на стенках сосудов и адгезии между собой.
• Последствия сладжа: нарушения микроциркуляции с развитием капилляро-трофической недостаточности.
В целом, феномен сладжа является либо причиной расстройств микроциркуляции (в тех случаях, когда он развивается первично), либо следствием внутрисосудистых нарушений микрогемоциркуляции (при их первичном развитии).