Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
ГЛАВА 24 СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ АТЕРОСКЛЕРОЗЕ
Атеросклероз - нарушение липидного обмена, характеризующееся отложением ХС и его эфиров в интиме сосудов в виде атеросклеротических бляшек. Атеросклеротические изменения чаще всего отме- чают в артериях крупного и среднего калибра (аорта, коронарные, головного мозга, реже - нижних конечностей). В результате развивается существенное ухудшение регионарного кровотока. Атеросклероз приводит к ишемической болезни сердца, нарушениям мозгового кровообращения и другим осложнениям со стороны сердечно-сосудистой системы (рис. 24-1).
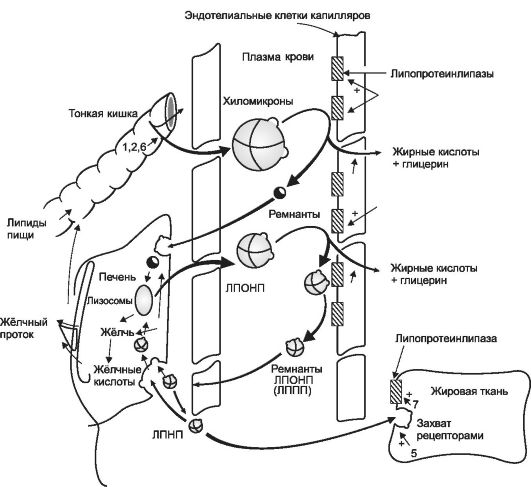
Рис. 24-1. Липидный обмен
ХС, ФЛ и триглицериды (ТГ) - важнейшие субъекты липидного обмена. ФЛ - основной компонент клеточных мембран, ТГ - источник энергии, депонируются они в адипоцитах. ХС используется в организме при синтезе клеточных мембран, из него образуются стероидные гормоны, а также желчные кислоты, участвующие в эмульгировании и всасывании из кишечника алиментарных жиров. Основным органом, регулирующим обмен ХС, служит печень. Аккумулируемый в ней ХС поступает из следующих источников: за счет всасывания экзогенного (алиментарного) ХС из кишечника, синтеза ХС de novo в гепатоцитах, повторного всасывания из кишечника желчных кислот (энтерогепатическая циркуляция желчных кислот), захвата рецепторами гепатоцитов содержащих ХС липопротеинов из плазмы крови. Всасывание экзогенного ХС происходит в энтероцитах при помощи специальной транспортной системы NPC1L1 (белок, подобный белку Нимана - Пика С1), (рис. 24-4). Синтез ХС в печени осуществляется из ацетилкоэнзима А при участии фермента 3-гидрокси-3-метилглутарил-коэнзим А редуктазы (ГМГ-Ко А редуктазы). Захват ХС из плазмы крови происходит путем рецепторозависимого эндоцитоза циркулирующих липопротеинов (рис. 24-3). Этот процесс в мембранах гепатоцитов обеспечивают липопротеиновые рецепторы. Их плотность вариабельна и зависит от потребности гепатоцитов в ХС. При истощении депо ХС в печени плотность липопротеиновых рецепторов в гепатоцитах увеличивается, что активирует захват содержащих ХС липопротеинов из плазмы крови.
Высоколипофильные ХС, ФЛ и ТГ перемещаются в организме с помощью специальных транспортных структур - липопротеинов. Существует несколько типов липопротеинов, которые имеют принципиально сходное строение (рис. 24-2), но обладают неодинаковыми свойствами (табл. 24-1). Различия в свойствах липопротеинов в значительной степени определяются содержащимися на их поверхности аполипопротеинами (Апо), служащими «опознавательными элементами» разных классов липопротеинов.
Хиломикроны транспортируют алиментарные ХС, ТГ и ФЛ из кишечника в лимфу, а затем с кровью в печень. Этот класс липо- протеинов образуется в энтероцитах. ХС попадает в энтероциты при помощи транспортной системы NPC1L1 (см. рис. 24-4). Одновременно в энтероциты поступают алиментарные ТГ. Из ТГ, ХС, Апо B-48, Апо А, Апо E и Апо C в энтероцитах формируются хиломикроны.
Таблица 24-1
Основные липопротеины плазмы крови
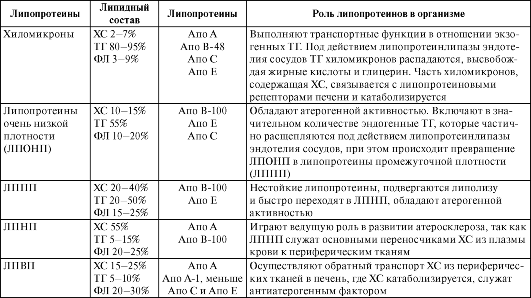
Поскольку хиломикроны содержат редуцированный Апо B-48, а не Апо B-100 (один из основных лигандов периферических липопротеи- новых рецепторов), они не захватываются липопротеиновыми рецепторами периферических тканей и, таким образом, неатерогенны (но взаимодействуют с рецепторами печени). Содержащиеся на поверхности хиломикронов Апо А активируют тканевую липопротеинлипазу мышечной и жировой ткани. В результате хиломикроны оставляют в этих тканях значительную часть ТГ. Остатки (ремнанты) хиломикронов захватываются гепатоцитами путем рецепторзависимого эндоцитоза (скавенджерные рецепторы и рецепторы к липопротеинам В). В печени из хиломикронов высвобождается ХС и ТГ, используемые для синтеза желчных кислот и ЛПОНП.
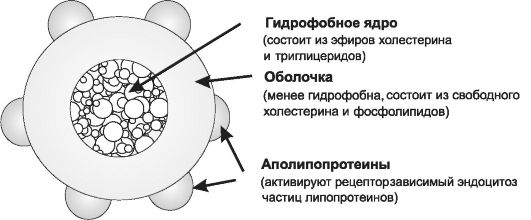
Рис. 24-2. Липопротеины низкой плотности
ЛПОНП содержат Апо B-100 и, таким образом, могут захватываться липопротеиновыми рецепторами периферических тканей, благодаря чему выполняют функцию транспорта ХС к тканям-потребителям, и, как следствие, обладают атерогенностью. ЛПОНП также активируют липопротеинлипазу в мышечной и жировой ткани, что приводит к переходу ФЛ и ТГ из ЛПОНП в указанные ткани. Оставшуяся часть липопротеинов, содержащую ХС, небольшие количества ТГ, Апо B-100 и Апо E, представляют ЛППП. Обычно они легко захватываются печенью и периферическими тканями (благодаря Апо E и Апо B-100), поэтому у здоровых людей в крови не определяются. Кроме того, ЛППП могут преобразовывать- ся в ЛПНП путем отщепления Апо E и остатков ТГ.
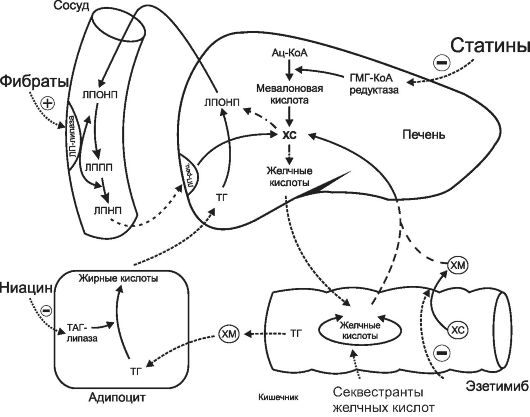
Рис. 24-3. Механизмы действия гиполипидемических средств
ЛПНП доставляют ХС периферическим тканям, где он расходуется на построение клеточных мембран, синтез стероидных гормонов и др. Захват ЛПНП периферическими тканями происходит путем рецепторозависимого эндоцитоза, который активирует содержащийся в ЛПНП Апо B-100 (этим же обусловлена высокая атерогенность ЛПНП). Гепатоциты также могут поглощать ЛПНП в случае недостатка ХС. Все классы липопротеинов, содержащие Апо B-100 и осуществляющие транспорт ХС от печени к периферическим тканям
(ЛПОНП, ЛППП, ЛПНП), атерогенны.
После утилизации ХС периферическими тканями избыток его выводится на поверхность клеточных мембран. В плазме он соединяется с ФЛ, Апо А-1, Апо А-2, Апо E и Апо C. Таким образом формируются ЛПВП - транспортная система, осуществляющая транспорт избытка ХС от периферических тканей к печени. Этот класс липопротеинов содержит Апо Е и Апо С, которые поглощаются печенью, пополняя депо свободного ХС. В то же время ЛПВП не содержат Апо B-100 и, таким образом, не захватываются периферическими тканями. Этими факторами объясняются их так называемые антиатерогенные свойства.
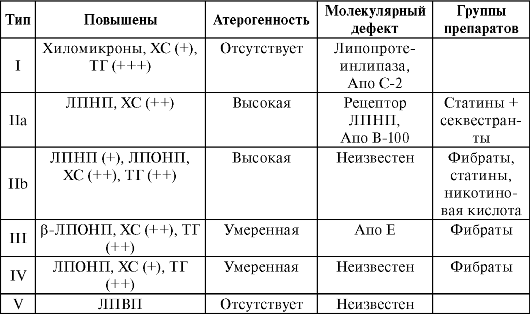
В патогенезе атеросклероза важную роль играет нарушение баланса между доставкой липидов к периферическим тканям и возвратом излишков в печень. Часто отмечают одновременное снижение содержания ЛПВП и увеличение ЛПНП. В результате возникает гиперлипопротеинемия (повышение уровня липопротеинов в плазме крови). Выделяют 5 типов гиперлипопротеинемий, причем не все типы атерогенны (табл. 24-2).
Накопление ЛПНП в сосудистой стенке запускает каскад событий, приводящих к формированию атеросклеротической бляшки. Однослойный эндотелий сосудов, покрывающий интиму сосудов, контактирует с кровью. Гиперлипидемия приводит к накоплению ЛПНП в интиме, где происходит их окисление. Модифицированные липопротеины инициируют воспалительный процесс, который стимулирует миграцию лейкоцитов из крови. Мононуклеарные фагоциты поглощают ЛПНП и превращаются в так называемые «пенистые» клетки, в цитоплазме которых находятся липопротеины. Пенистые клетки погибают, формируя некротический центр бляшки.
Уменьшение концентрации атерогенных липопротеинов в плазме крови возможно при применении гиполипопротеинемических средств. Уменьшение перекисного окисления липопротеинов, а также снижение образования свободных радикалов достигают при при-
менении антиоксидантов. Кроме того, препятствуют повреждению интимы сосудов эндотелиотропные ангиопротекторные средства (см. главу «Ангиопротекторы»). Указанные группы лекарственных препа- ратов применяют в фармакотерапии гиперлипидемий.
Таблица 24-2
Характеристика гиперлипопртеинемий
24.1. ГИПОЛИПИДЕМИЧЕСКИЕ СРЕДСТВА (АНТИГИПЕРЛИПОПРОТЕИНЕМИЧЕСКИЕ СРЕДСТВА)
Группу гиполипидемических средств составляют препараты, снижающие в плазме крови содержание атерогенных липопротеинов. При этом, как правило, происходит компенсаторное увеличение в плазме крови уровня ЛПВП, обладающих антиатерогенным действием.
ЛПОНП синтезируются в печени из ТГ и ХС. Запасы ХС в печени пополняются за счет синтеза ХС, рецепторозависимого эндоцитоза липопротеинов из плазмы крови, энтеро-гепатической циркуляции желчных кислот, алиментарного ХС. Расходуется ХС печени на синтез ЛПОНП, синтез желчных кислот (см. рис. 24-3), синтез стероидных гормонов.
Уменьшение запасов ХС в гепатоцитах приводит к увеличению плотности (экспрессии) липопротеиновых рецепторов и увеличению
рецепторозависимого эндоцитоза липопротеинов из плазмы крови (с целью пополнения запасов ХС в печени), а также снижению син- теза ЛПОНП. Конечным результатом этого становится уменьшение в плазме крови атерогенных липопротеинов.
Гиполипидемические средства представлены следующими группами препаратов:
• средства, угнетающие всасывание ХС в кишечнике;
• секвестранты желчных кислот;
• ингибиторы ГМГ-Ко А редуктазы (статины, ингибиторы синтеза
ХС);
• производные фиброевой кислоты (фибраты, активаторы липопротеин липазы);
• препараты никотиновой кислоты (ингибиторы триглицерид липазы).
Средства, угнетающие всасывание холестерина в кишечнике
Относительно новая группа гиполипидемических средств, представителем которой стал эзетимиб.
Эзетимиб избирательно угнетает всасывание ХС в кишечнике, при этом не влияет на всасывание других стероидов. Избирательность связана с особенностями транспорта ХС через кишечную стенку (рис. 24-4). Транспорт ХС в эпителиоциты осуществляется при участии специфического транспортера NPC1L1 Кроме того, в клетках эпителия кишечника существуют АТФ-связывающие кассетные переносчики АВСG5 и АВСG8, которые выводят стеролы (в том числе ХС) из эпителиоцитов в просвет кишечника. Эзетимиб угнетает NPC1L1 и активирует кассетные транспортеры. В результате всасывание ХС в кишечнике с последующим его включением в хиломикроны снижается.
При применении эзетимиба гиперхолестеринемия уменьшается на 18%. Наиболее эффективен эзетимиб в комбинации с симвастатином. Комбинированный препарат виторин* содержит эзетимиба 10 мг и симвастатина 10, 20, 40 или 80 мг.
Кроме гиполипидемического действия, эзетимиб вызывает плейотропный эффект в виде противовоспалительного действия (при при- менении препарата более чем вдвое снижается уровень С-реактивного белка в плазме крови).
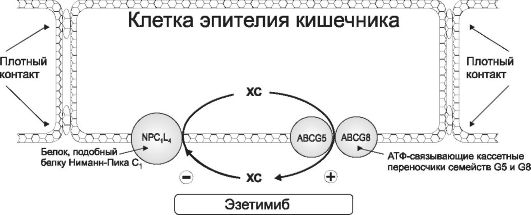
Рис. 24-4. Механизм действия эзетимиба
Секвестранты желчных кислот
Колестирамин (квестран*)и колестипол (холестид*)- анионообменные смолы, примерно одинаковой эффективности.
Секвестранты желчных кислот образуют в кишечнике невсасывающиеся комплексы с желчными кислотами, что приводит к усилению выведения желчных кислот из организма (см. рис. 24-2). Нарушение энтерогепатической циркуляции желчных кислот вызывает увеличение их синтеза de novo в печени из эндогенного ХС. Запасы ХС в печени при этом истощаются, что приводит к экспрессии ЛПНП-рецепторов на мембране гепатоцитов и увеличению рецепторозависимого эндоцитоза атерогенных липопротеинов. Их содержание в плазме крови снижается. Концентрация ЛПВП в плазме крови либо не изменяется, либо несколько повышается.
Колестирамин и колестипол применяют при гиперлипопротеинемии IIа типа внутрь в 2-3 приема в течение 14 дней. Действие препаратов начинается через 24-48 ч, продолжительность
действия 12-24 ч. Пик действия достигается в течение месяца. Эффект сохраняется в течение 2-4 нед после отмены препарата. Побочные эффекты: запоры, тошнота, изжога, метеоризм, головная боль.
Ингибиторы 3-гидрокси-3-метилглутарил-коэнзим А редуктазы (статины)
В настоящее время это одна из наиболее эффективных групп гиполипидемических средств. В нее входят: л о в а с т а т и н (мевакор*), симвастатин (зокор*), правастатин (липостат*), ф л у - вастатин (лескол*), аторвастатин (липримар*, аторис*).
Механизм гиполипидемического действия статинов заключается в блокаде синтеза ХС (см. рис. 24-2). Статины конкурентно обратимо ингибируют ГМГ-Ко А редуктазу. Это вызывает угнетение синтеза ХС на этапе образования мевалоновой кислоты. В результате запасы ХС в печени уменьшаются, что приводит к экспрессии ЛПНП-рецепторов на гепатоцитах и увеличению рецепторозависимого эндоцитоза атерогенных липопротеинов. Кроме того, уменьшается образование в печени и выделение в кровь ЛПОНП. Увеличение захвата и уменьшение выделения печенью атерогенных липопротеинов приводит к снижению их концентрации в плазме крови (гиполипидемическому эффекту). Кроме того, при применении статинов повышается уровень ЛПВП в плазме крови.
Основным показанием к применению статинов служит гиперлипопротеинемия типов IIа и IIb. Препараты назначают внутрь 1 раз в сутки на ночь. При комбинированном применении с секвестрантами желчных кислот статины назначают либо за 1 ч, либо через 4 ч после приема секвестранта.
Статины применяют длительно (в течение нескольких месяцев), переносят их относительно хорошо. Побочные эффекты: диспептические расстройства, бессонница, головная боль, эритема кожи, сыпь. Зависимый от дозы побочный эффект - гепатотоксичность (с повышением уровня трансаминаз или без него). Нечасто возникают, но наиболее тяжело протекают миопатия и рабдомиолиз.
Ловастатин получают из грибка Aspergillus terreus, а симвастатин и правастатин - химические его производные (полусинтетические препараты). Все три статина содержат в структуре гидронафталеновое кольцо (взаимодействует с ГМГ-Ко А редуктазой), а также оксикислоту (придает сходство с мевалонатом) в боковой цепи. Ловастатин и с и м -
вастатин - пролекарства, неактивные лактоны, приобретающие фармакологическую активность в процессе гидролиза в β-оксикис- лоты.
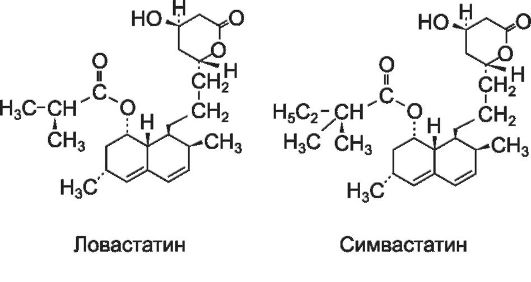
Флувастатин - синтетический препарат, производное мевалонолактона. Содержит в структуре фторфенилиндольную часть (придает сходство с коэнзимом А), а также боковую цепь (придает сходство с мевалонатом). Правастатин и флувастатин содержат в своей химической структуре оксикислоты и поэтому они фармакологически активны в исходном состоянии.
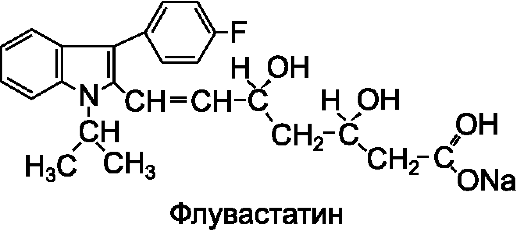
Биодоступность статинов при введении внутрь невелика, наиболее низкая у ловастатина и симвастатина - менее 5%, у аторвастатина - 14%, у правастатина - 18% и флувастатина - около 24%. Низкая биодоступность статинов связана с их активным захватом печенью при первом прохождении. Взаимодействие статинов с пищей различно. Так, биодоступность ловастатина возрастает, если препарат принимают после еды, биодоступность симвастатина не изменяется от приема пищи, а биодоступность правастатина и флувастатина уменьшается, если препараты приняты после еды. Максимальная концентрация в крови ловастатина и симвастатина достигается через 2-4 ч, а правастатина и флувастатина - через 0,75-1,5 ч и 0,5 ч соответственно. Через ГЭБ и плаценту хорошо проникают ловастатин и симвастатин (бла-
годаря липофильности), а флувастатин, правастатин и аторвастатин практически не проходят через эти барьеры.
В настоящее время считают, что антиатеросклеротическое действие статинов обусловлено не только их гиполипидемическим эффектом, но также рядом других, так называемых плейотропных эффектов. К ним относят следующие:
• восстановление функций эндотелия (препятствуют повреждающему действию окисленных ЛПНП на сосудистую стенку);
• сосудорасширяющий (экспрессия NO-синтетазы);
• антиишемический (увеличение толерантности к физической нагрузке);
• антитромбогенный (снижение количества и агрегации тромбоцитов, уменьшение количества тромбина, повышение фибринолиза);
• уменьшение пролиферации гладких мышц кровеносных сосудов (вероятно, за счет угнетения ГМГ-Ко А редуктазы и синтеза ХС в ангиомиоцитах);
• противовоспалительный.
Наиболее эффективен среди статинов а т о р в а с т а т и н . При приеме внутрь он абсорбируется на 80%, биодоступность - 14% (ввиду пресистемного метаболизма). Метаболизируетя в печени системой цитохрома Р450 3А4. При этом образуются активные метаболиты (орто- и парагидроксилированные производные, продукты β-окисления), которые оказывают ингибирующее действие на ГМГ-Ко А редуктазу и сохраняются 20-30 ч. Выводится аторвастатин преимущественно с желчью, t1/2 составляет 14 ч. В качестве плейотропных эффектов вызывает противоаритмическое действие и увеличение сердечного выброса (связаны с улучшением коронарного кровообра- щения), противовоспалительное действие (проявляется снижением уровня С-реактивного белка), стабилизацию и обратное развитие атеросклеротических бляшек, улучшение психического, физического самочувствия и качества жизни (связаны с улучшением мозгового кровообращения).
Производные фиброевой кислоты (фибраты)
Гемфиброзил (регулип*, иполипид*), фенофибрат (липантил*), безафибрат,ципрофибрат (липанор*).
Фибраты вызывают экспрессию эндотелиальной липопротеин липазы (см. рис. 24-2), что ускоряет катаболизм ЛПОНП и ЛППП.
Кроме того, фибраты угнетают синтез ХС в печени (возможно, ингибируя ГМГ-Ко А редуктазу) и синтез из него ЛПОНП. При применении фибратов увеличивается плотность липопротеиновых рецепторов в гепатоцитах, снижается уровень ЛПНП, а также повышается уровень ЛПВП.
Назначают фибраты при гиперлипопротеинемии II, IV и V типов. Из побочных эффектов отмечают диспептические расстройства, головную боль, затуманенное зрение, холелитиаз, миалгию, миопатии, реже - рабдомиолиз. Ввиду того, что фибраты и статины вызывают сходные побочные эффекты со стороны мышечной ткани (миопатии), эти группы препаратов нельзя комбинировать.
Гемфиброзил при приеме внутрь хорошо всасывается из ЖКТ в кровь, его биодоступность составляет 97%, пик плазменной концентрации достигается через 1-2 ч, метаболизируется в печени, t1/2 после приема однократной дозы составляет 1,5 ч. Выводится препарат из организма почками в количестве 70% (большая часть в неизмененном виде). Гиполипидемический эффект гемфиброзила начинается через 2-5 дней, пик действия наступает через 4 нед. Препарат обычно назначают в два приема за 30-40 мин до еды.
Ф е н о ф и б р а т - пролекарство, которое в тканях превращается в фенофиброевую кислоту. При длительном применении пре- парат значительно снижает уровень общего ХС (на 16-35%) и ТГ (на 30-60%). Кроме того, препарат обладает урикозурическим действием. Пролонгированная форма содержит фенофибрат в микронизированной форме, имеет улучшенные фармакокинетические показатели, позволяющие назначать препарат один раз в сутки.
Ципрофибрат отличается от других фибратов большим значением (48-120 ч), несколько лучше переносится, назначают препа- рат один раз день после еды вечером.
Препараты никотиновой кислоты
Никотиновая кислота (ниацин*) и ее пролонгированные формы (эндурацин*).
Гиполипидемическое действие никотиновой кислоты связано с тем, что она угнетает триглицерид липазу в адипоцитах (см. рис. 24-2). Как следствие, в жировой ткани снижается образование свободных жирных кислот, они не мобилизуются и не захватываются печенью. В результате в печени уменьшается биосинтез ТГ и образование из них ЛПОНП. Уровень ЛПОНП, ЛППП и ЛПНП в плазме крови снижается, а уровень антиатерогенных ЛПВП повышается.
При приеме внутрь препарат быстро и хорошо всасывается из ЖКТ. составляет 45 мин. В организме препарат подвергается метаболизму в печени и экскретируется почками в основном в неизмененном виде. Пик гиполипидемического действия наступает через 2 мес и эффект сохраняется в течение 2-6 нед после отмены препарата. Никотиновую кислоту можно применять при гиперлипопротеинемии IIа, IIb, III, IV и V типов (особенно эффективна при III и V типах).
Дозы, в которых никотиновая кислота оказывает гиполипидемическое действие (1,5-3 г/сут), значительно превосходят витаминные дозы (16 мг/сут). В высоких дозах никотиновая кислота увеличивает концентрацию простагландинов, что вызывает в качестве побочных эффектов покраснение кожи лица, шеи и верхней части груди, кожный зуд, расстройства со стороны ЖКТ и сердечно-сосудистой системы. Выраженность зуда и покраснения кожных покровов уменьшает предварительный (за 0,5 ч) прием ацетилсалициловой кислоты (инги- бирует синтез простагландинов).
В развитии атеросклероза имеют большое значение свободнорадикальные процессы и процессы перекисного окисления липидов.
Антиоксиданты подавляют перекисное окисление и снижают количество свободных радикалов. Последнее достигается восстановле- нием свободных радикалов в стабильную молекулярную форму. При этом антиоксиданты либо непосредственно связывают свободные радикалы (прямые антиоксиданты), либо стимулируют антиоксидантную систему организма (непрямые антиоксиданты).
Антиоксидантным действием обладают естественные вещества - токоферолы, кислота аскорбиновая, каротиноиды, витамины А, D, Е и др. Из лекарственных препаратов с антиоксидантным действием при атеросклерозе применяют пробукол, эйконол, тыквеол.
П р о б у к о л по химической структуре относят к бисфенолам, напоминает витамин Е. Пробукол обладает антиоксидантны- ми и гиполипидемическими свойствами. Антиоксидантное действие состоит в уменьшении перекисного окисления липопротеинов, что подавляет образование «пенистых» клеток в интиме сосудов. Гиполипидемическое действие проявляется снижением в плазме крови ЛПНП (вероятно, за счет активации их рецепторонезависимого эндоцитоза гепатоцитами). Одновременно наблюдают снижение в плазме крови антиатерогенных ЛПВП (что нежелательно).
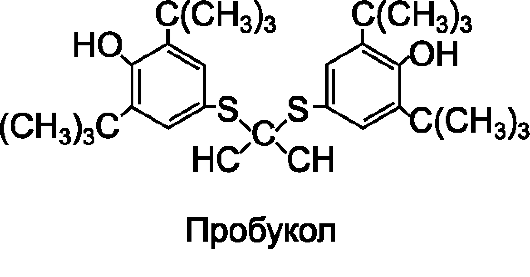
Всасывание пробукола из ЖКТ в кровь ограничено, биодоступность составляет 2-6%, прием препарата вместе с пищей повышает его биодоступность. Выводится из организма в основном через ЖКТ с желчью и только 2% с мочой; t1/2 более 1 мес. Поскольку препарат обладает высокой липофильностью, он сохраняется в жировой ткани до 6 мес. Гипохолестеринемическое действие пробукола начинает развиваться через 2-4 ч после приема, пик действия достигается через 1-3 мес, а после прекращения приема препарата его действие сохраняется в течение 20 дней и более. Препарат обычно хорошо переносят, применяют его в основном как гипохолестеринемическое средство при неэффективности других препаратов. Наиболее частые побочные эффекты - тошнота, диарея, боли в животе, нарушение функционального состояния печени.
Э й коно л * (МНН - омега-3 триглицериды [20 - комплексный препарат, получаемый из гидробионтов. Содержит полиненасыщенные жирные кислоты семейства ω3 (эйкозопентаеновая и докозагекса- еновая), мононенасыщенные жирные кислоты, насыщенные жирные кислоты, а также витамины А, D, Е. При атеросклерозе нормализует структуру ЛПНП и ЛПОНП, активирует взаимодействие липопротеинов с ферментами и оказывает гиполипидемическое действие. Кроме того, проявляет антиагрегантное, сосудорасширяющее и гипотензивное свойства.
Ты к в е о л * (МНН - тыквы обыкновенной семян масло) - комплексный препарат, содержащий биологически активные вещества, получаемые из тыквы: каротиноиды, токоферолы, витамины С, В1, В2, РР, полиненасыщенные, ненасыщенные и насыщенные жирные кислоты, ФЛ, флавоноиды и др. Оказывает антиатеросклеротическое, гепатопротективное, желчегонное и противовоспалительное действие. Уменьшает пролиферацию клеток предстательной железы.