Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
СРЕДСТВА, РЕГУЛИРУЮЩИЕ ПРОЦЕССЫ ОБМЕНА ВЕЩЕСТВ ГЛАВА 31 ПРЕПАРАТЫ ГОРМОНОВ, ИХ СИНТЕТИЧЕСКИХ ЗАМЕНИТЕЛЕЙ И АНТАГОНИСТОВ
Гормоны играют ключевую роль в процессах обмена веществ. Термин «гормон» предложен Bayliss и Starling для обозначения секрета эндокринных желез (желез внутренней секреции).
Железы внутренней секреции выделяют (инкретируют) гормоны непосредственно в системный кровоток. Достигая с током крови тканей-мишеней, гормоны связываются со специфическими рецепторами, в результате чего в тканях-мишенях происходят разнообразные метаболические изменения. Система эндокринных желез включает периферические железы (щитовидная, паращитовидная железы; яичники; яички; корковое вещество надпочечников; островковый аппарат поджелудочной железы), гипофиз и гипоталамус. Гипоталамус и передняя доля гипофиза регулируют деятельность (пролиферацию и инкрецию) большинства периферических эндокринных желез: гипоталамус продуцирует рилизинг-гормон (рилизинг-фактор, либерин), стимулирующий функцию соответствующих клеток передней доли гипофиза (аденогипофиза), которые продуцируют соответствующий тропный гормон. Тропный гормон передней доли гипофиза выделяется в кровь и достигает соответствующей периферической железы, стимулируя ее активность. Гормоны периферической железы выделяются в системный кровоток, достигают ткани-мишени и реализуют эффекты после взаимодействия со специфическими рецепторами. Кроме того, гормоны периферических желез, стимулируя рецепторы гипоталамуса и гипофиза, тормозят продукцию соответствующих рилизинг-гормонов гипоталамуса и тропных гормонов аденогипофиза («обратная отрицательная связь»).
Для коррекции эндокринных расстройств применяют препараты естественных гормонов, их синтетические аналоги, заменители (вещества с гормоноподобным действием), антагонисты гормонов (блокаторы специфических рецепторов гормонов, антигормоны).
Общие принципы применения указанных групп средств
• Заместительная терапия - введение извне препарата гормона или его аналога (инсулинотерапия при сахарном диабете, поддерживающие дозы глюкокортикоидов при индуцированной атрофии коры надпочечников). Заместительную терапию применяют при недостаточности эндогенной продукции гормона.
• Стимуляция функции периферических желез - применение препаратов тропных гормонов передней доли гипофиза (кортикотропин при атрофии коры надпочечников); применение блокаторов специфических рецепторов гипоталамо-гипофизарной системы (кломифен при ановуляторном бесплодии). Блокада рецепторов центральных эндокринных желез приводит к активации выде-
ления рилизинг-гормонов гипоталамусом и тропных гормонов передней долей гипофиза.
• Подавление функции периферических желез - угнетение синтеза гормона непосредственно в железе (тиамазол при гипертиреозе); стимуляция специфических рецепторов гипоталамо-гипофизарной системы (комбинированные оральные контрацептивы, даназол). Стимуляция рецепторов центральных эндокринных желез приводит к угнетению выделения рилизинг-гормонов гипоталамусом и тропных гормонов передней долей гипофиза.
В соответствии с химической структурой различают три группы гормонов, аналогично классифицируют синтетические препараты.
• Производные аминокислот (гормоны щитовидной железы).
• Гормоны белкового и пептидного строения (гормоны гипоталамуса, гипофиза, поджелудочной железы, паращитовидных желез).
• Гормоны стероидной структуры (гормоны коры надпочечников, половых желез).
«Мишени» гормонов - специфические рецепторы. Рецепторы гормонов пептидной структуры обычно находятся на наружной повер- хности клеточной мембраны; рецепторы стероидных гормонов - внутри клетки (гормон связывается с ними после проникновения в цитоплазму клетки). Системы вторичного сопряжения («возбуждение - эффект») изучены недостаточно. Некоторые гормоны способны активировать аденилатциклазу.
Механизм действия гормонов белкового и пептидного строения. Стимуляция специфических мембранных рецепторов приводит к активации G-белков, повышению активности аденилатциклазы. В результате в клетках желез-мишеней накапливается цАМФ. Накопление цАМФ активирует цАМФ-зависимые протеинкиназы, вследствие чего изменяется проницаемость мембран и течение различных внутриклеточных процессов: движение ионов, синтез веществ (в том числе гормонов), секреция, пролиферация и др. Использование трийодтиронина (в высоких дозах) также приводит к увеличению в клетках концентрации цАМФ, но не путем активации аденилатциклазы, а в результате угнетения фосфодиэстеразы.
Механизм действия стероидных гормонов. Молекулы гормонов легко преодолевают гистогематические барьеры, в том числе клеточные мембраны тканей-мишеней. Попадая в цитоплазму клетки, гормоны связываются с внутриклеточными рецепторами, после взаимо- действия с которыми возникают «активные центры», тропные к ДНК.
Затем комплекс «стероид-рецептор» проникает в ядро и, связываясь с ДНК, регулирует транскрипцию, вызывая супрессию или индукцию определенных генов.
Детали механизмов действия гормонов постоянно изучают и уточняют.
31.1. ГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ БЕЛКОВО-ПЕПТИДНОЙ
СТРУКТУРЫ
31.1.1. Препараты гормонов гипоталамуса и гипофиза
Гипоталамус и гипофиз - центральные звенья регуляции эндокринной системы. Гипофиз человека состоит из двух долей: передней и задней (у некоторых млекопитающих выделяют также среднюю долю гипофиза). Передняя доля - аденогипофиз, задняя - нейрогипофиз. Аденогипофиз содержит железистые («трофные») клетки, продуцирующие «тропные» гормоны, регулирующие функции периферических эндокринных желез или непосредственно тканей (рис. 31-1). Продукцию тропных гормонов контролирует гипоталамус, вырабатывая рилизинг-гормоны или угнетающие гормоны (факторы). Инкреторная активность гипоталамуса и аденогипофиза регулируется по принципу обратной связи: снижение в системном кровотоке концентрации гормонов периферических желез стимулирует секрецию рилизинг-гормонов и тропных факторов (et vice versa) (рис. 31-1).
Серморелин ** - синтетический аналог эндогенного рилизинг-фактора гормона роста; имеет пептидную структуру (40-44 аминокислотных остатка). Стимулирует продукцию и секрецию гормона роста соматотрофными клетками аденогипофиза. Препарат применяют в диагностических целях при подозрении на недостаточность соматотропного гормона (СТГ) у низкорослых детей. Вводят внутривенно с предварительным (за 15 мин и за 1 мин до введения) и последующим (через 15, 30, 45, 60 и 90 мин после введения) забором венозной крови для определения концентрации СТГ. Если в диагнос- тических пробах уровень СТГ составляет 7 нг/мл и менее, причиной низкорослости можно считать недостаточность СТГ. Возможно подкожное и интраназальное введение. Побочные эффекты редки; пациентов иногда беспокоит ощущение жара или чувство прилива крови к голове; болезненность в месте инъекции. Противопоказания:
повышенная чувствительность к препарату, беременность, грудное вскармливание.
Протирелин (рифатироин*) - синтетический аналог тиреотропного гормона (ТТГ). Имеет трипептидную структуру (5-оксо-L- пролил-L-гистидил-L-пролинамид). Стимулирует секрецию ТТГ и пролактина передней долей гипофиза. Концентрация ТТГ достигает пика (при внутривенном введении) через 20-30 мин и возвращается к исходному уровню через 2-3 ч. Препарат применяют для дифференциальной диагностики дисфункций щитовидной железы (первичный, вторичный, скрытый гипотиреоз; гипертиреоз). Характер поражения определяют на основании изменения уровней ТТГ и гормонов щитовидной железы в плазме крови до введения и через 30 мин после внутривенного введения протирелина. Побочные эффекты: головная боль, колебания АД, тревожность, потливость, чувство сжатия в груди, аллергические реакции, покраснение и болезненность в месте инъекции. Противопоказания: повышенная чувствительность к препарату, нестабильная стенокардия, сердечные аритмии, предрасположенность к бронхообструктивному синдрому.
С о м а т о с т а т и н (стиламин*) - синтетический циклический тетрадекапептидный аналог соматостатина. Эндогенный соматостатин синтезируется в гипоталамусе; угнетает продукцию СТГ передней долей гипофиза. Соматостатин также могут вырабатывать D-клетки периферических тканей (например, слизистой оболочки желудка, поджелудочной железы), где он выполняет функции паракринного ингибитора секреции. Труднообъяснимое, но ценное свойство соматостатина - способность значительно снижать скорость кровотока в чревных артериях и уменьшать объем кровенаполнения внутренних органов, не вызывая значительных колебаний системного АД; это свойство определяет показания к применению препарата в клинической практике. Соматостатин используют для остановки кровотечений из варикозно-расширенных вен пищевода, а также для профилактики осложнений после хирургических вмешательств на поджелудочной железе и при свищах поджелудочной железы, кишечника и желчных протоков. Применение соматостатина по другим показаниям лимитировано малой продолжительностью действия (t1/2 составляет от 2 до 6 мин). Такая продолжительность действия обусловлена быстрым разрушением эндопептидазами и аминопептидазами плазмы крови. Применяют внутривенно капельно. Может вызвать головокружение, ощущение приливов крови к лицу, брадикардию, тошноту и рвоту.
Октреотид (сандостатин*) - синтетический октапептидный аналог соматостатина. В отличие от соматостатина октреотид действует продолжительно, в среднем около 12 ч (t1/2 около 100 мин). Вводят парентерально (внутривенно и подкожно). Свойства октреотида аналогичны свойствам соматостатина, а значительно большая продолжительность действия позволяет расширить сферу применения этого препарата. Показания к применению:
• акромегалия (подавляет инкрецию СТГ); применяют при неэффективности стимуляторов дофаминовых рецепторов и при невозможности хирургического лечения;
• язвенная болезнь, гастринома, глюкагонома, карциноид и другие секретирующие опухоли (подавляет экскреторную активность железистой ткани);
• кровотечения из варикозно-расширенных вен пищевода у больных циррозом печени (снижает кровоток в чревных артериях); иногда применяют для профилактики кровотечений.
Побочные эффекты: колебания уровня глюкозы в плазме крови, тошнота, рвота, понос, нарушение функции печени; при длительном использовании препарат может вызвать образование и рост желчных камней. Противопоказания: гиперчувствительность, беременность, грудное вскармливание.
Аналогично, но еще более продолжительно действует л а н р е о - ти д (t1/2 2,7-7,7 сут). Вводят внутримышечно раз в 10-14 сут.
Выделение некоторых тропных гормонов передней долей гипофиза может регулировать дофамин. Дофамин - не гормон, однако он играет существенную роль в подавлении инкреции лактотропного гормона (про- лактина) и СТГ, стимулируя дофаминовые рецепторы гипоталамо-гипофизарной системы. Для коррекции эндокринных расстройств допамин не применяют, так как он действует непродолжительно и не проникает через ГЭБ. Используют другие стимуляторы дофаминовых рецепторов.
Бромокриптин - дофаминомиметик, прямо стимулирует постсинаптические дофаминовые рецепторы в ЦНС. Снижает инкрецию пролактина и СТГ; обладает противопаркинсонической активностью. Показания к применению: акромегалия (при невозможности хирургического лечения), галакторея, пролактинзависимая аменорея. Также препарат применяют для прекращения физиологической лактации. Побочные эффекты: тошнота и рвота (стимулирует дофаминовые рецепторы триггер-зоны рвотного центра); психотические реакции - бред, галлюцинации (стимулирует дофаминовые рецепторы
коры больших полушарий); дискинезии (стимулирует дофаминовые рецепторы экстрапирамидной системы). Препарат может вызвать нарушения периферического кровообращения - ортостатическую гипертензию, спазм периферических артерий, обусловливающий судороги икроножных мышц; сухость во рту, запоры. Противопоказания: тяжелые формы артериальной гипертензии, окклюзионные заболевания сосудов, хорея Гентингтона.
Аналогично бромокриптину действует каберголин (достинекс*). Этот препарат (в отличие от бромокриптина) - селективный агонист D2-рецепторов. В терапевтических дозах угнетает только инкреторную активность лактотрофных клеток передней доли гипофиза. При увеличении дозы могут проявиться другие эффекты стимуляции центральных D2-рецепторов. Продолжительность гипопролактинемического действия каберголина больше, чем у бромокриптина; составляет 7-28 дней. Показания к применению аналогичны бро- мокриптину.
Гонадорелин и другие препараты гонадотропного рилизинггормона - синтетические полипептидные аналоги естественного гонадотропного рилизинг-гормона. Они стимулируют специфические рецепторы мембран гонадотрофных клеток аденогипофиза, вызывая накопление диацилглицерола и инозитол-1,4,5-трифосфата. Это приводит к увеличению продукции и выделения этими клетками гонадотропных гормонов - ФСГ и лютеинизирующего гормона (ЛГ) и к увеличению инкреции половых гормонов (эстрогенов и гестагенов у женщин и тестостерона у мужчин). Однако такое действие препарат оказывает при однократном или прерывистом («пульсирующем») введении. Если в течение длительного времени концентрация препарата в плазме крови постоянна, то стимулирующий эффект сменяется угнетающим (происходит десенситизация гипофизарных рецепторов к гонадотропному рилизинг-гормону). Примерно к 14-му дню применения препарата уменьшается продукция ФСГ и ЛГ передней долей гипофиза. Это приводит к снижению концентрации половых гормо- нов в периферической крови до посткастрационного (постменопаузного) уровня; замедляется пролиферация гормонально-зависимых тканей. Обеспечить постоянную концентрацию препарата в плазме крови позволяют специальные системы доставки ЛВ:
• бусерелин (бусерелина ацетат*) выпускают в виде капель в нос (t1/2 3 ч) и в виде импланта (супрефакт-депо*), биотрансформация импланта длится более 2 мес;
• трипторелин (декапептил-депо*) выпускают в виде микрокапсул для приготовления суспензии для инъекций (t1/2 7,6 ч);
• гозерелин (золадекс*) в капсуле-депо для подкожного введения (t1/2 2-4 ч);
• имп л а нт (супрефакт-депо*) вводят под кожу живота один раз в 2 мес, капсулу-депо (золадекс*) вводят под кожу живота один раз в 28 сут, суспензию микрокапсул (декапептил-депо*) вводят подкожно или внутримышечно один раз в 28 сут;
• капли в нос применяют 3 раза в сутки с интервалом 6-8 ч. Показания к применению: эндометриоз, миома матки, бесплодие
(в рамках экстракорпорального оплодотворения), рак предстательной железы. Побочные эффекты: гиперчувствительность, психическая лабильность, нестабильность АД. Противопоказания: беременность, лактация, повышенная чувствительность к компонентам препарата.
Продукцию гонадотропин-рилизинг-гормона и гонадотропных гормонов гипофиза подавляют по механизму обратной отрицательной связи (рис. 31-1).
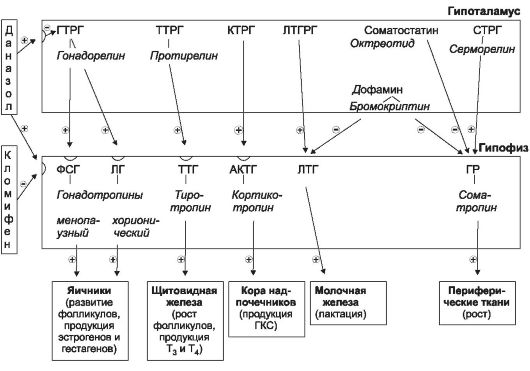
Рис. 31-1. Рилизинг-гормоны гипоталамуса и тропные гормоны аденогипофиза
Инкреция указанных гормонов снижается при стимуляции эстрогеновых и гестагеновых рецепторов гипоталамо-гипофизарной системы.
Да на з о л (дановал*, данол*) - синтетический препарат стероидной структуры, производное 17а-этинил-тестостерона. Частичный агонист гестагеновых (а также андрогеновых и глюкокортикоидных) рецепторов. Собственно гестагеновая активность низкая, поэтому препарат не вызывает периферических гестагеновых эффектов. Проникая через ГЭБ, он стимулирует гестагеновые рецепторы гипоталамуса и гипофиза. Это ведет к подавлению инкреции гонадотропного рилизинг-гормона и гонадотропных гормонов передней долей гипофиза (ФСГ и ЛГ), что, в свою очередь, приводит к подавлению выделения половых гормонов и снижению пролиферации гормонзависимых тканей. Применяют внутрь (t1/2 1,5 ч). Показания к применению: эндо- метриоз и обусловленное им бесплодие, первичная меноррагия, макромастия, гинекомастия, мастопатия, предупреждение обострений при наследственном ангионевротическом отеке. Побочные эффекты: диспептические расстройства, нарушение функций печени, нервозность, приливы, головокружения, головная боль. Противопоказания: порфирия, беременность, грудное вскармливание.
Продукцию гонадотропин-рилизинг-гормона и гонадотропных гормонов гипофиза активируют путем блокады эстрогеновых рецеп- торов гипоталамо-гипофизарной системы. Используют антиэстрогенные препараты, проникающие через ГЭБ.
Кломифен (клостильбегит*, кломид*) - синтетическое антиэстрогенное средство. Относится к частичным агонистам эстрогеновых рецепторов, поэтому в отношении полных агонистов блокирует эстрогеновые рецепторы в гипоталамо-гипофизарной системе и периферических тканях. В малых дозах препарат стимулирует инкрецию гонадотропинов, в высоких оказывает антиэстрогенное действие на яичники. Применяют внутрь (t1/2 5-7 дней). Показания к применению: ановуляторное бесплодие (для стимуляции овуляции), аменорея; олигоспермия и задержка полового развития у лиц мужского пола. Побочные эффекты: тошнота, рвота, приливы, головокружения, головные боли, расстройства зрения и менструально-овариального цикла. Противопоказания: киста яичника, опухоль гипофиза, беременность, тяжелая печеночная недостаточность, гиперчувствительность к препарату.
Гонадотропин хорионический (прегнил*, профази*, хорагон*). Естественный человеческий хорионический гонадотропин получают из мочи беременных. Он способствует овуляции, стимули-
рует образование и выделение прогестерона и эстрогенов. У мужчин стимулирует развитие интерстициальных клеток Лейдига и выделение тестостерона.
Показания к применению.
• У женщин:
- ановуляторное бесплодие;
- привычное невынашивание беременности;
- угроза самопроизвольного выкидыша.
• У мужчин:
- азооспермия;
- гипоталамо-гипофизарный гипогонадизм.
Побочные эффекты: головные боли, раздражительность, депрессия, кожные высыпания, у мужчин - задержка жидкости в организме. Противопоказания: опухоль гипофиза, гормонзависимые злока- чественные опухоли.
Ментропин (меногон*, хумегон*) получают из мочи женщин в постменопаузном периоде. Препарат содержит равные количества (по 75 МЕ) естественных человеческих гипофизарных ФСГ и ЛГ. У женщин препарат индуцирует созревание фолликула, у мужчин - сперматогенез. Показания к применению: ановулятроное бесплодие (у женщин), нарушения сперматогенеза (у мужчин). Побочные эффекты: синдром гиперстимуляции яичников (дискомфорт в низу живота), кисты яичников. Противопоказания: опухоли гипофиза, яичников, яичек.
Фоллитропин бета (пурегон*) - рекомбинантный ФСГ. Повышает уровень половых гормонов в крови. Стимулирует созревание фолликулов в яичниках (действуя активнее, чем менопаузный гонадотропин) и пролиферацию эндометрия. Показания к применению: ановуляторное бесплодие, индукция суперовуляции. Побочные эффекты: синдром гиперстимуляции яичников, кисты яичников, многоплодная беременность, внематочная беремен- ность. Противопоказания: опухоли яичников, матки, молочных желез, гипофиза, поликистоз яичников, доброкачественные опухоли матки.
Кортикотропин - препарат естественного адренокортикотропного гормона; получают из гипофиза крупного рогатого скота. Полипептид, состоит из 39 аминокислотных остатков. Стимулируя специфические рецепторы в коре надпочечников, усиливает продукцию глюкокортикоидов. Вводят парентерально (чаще внутримышечно),
продолжительность действия - 6-8 ч. Препарат используют при вторичной медикаментозной атрофии коры надпочечников (после длительного применения глюкокортикоидов). Побочные эффекты: гипертензия, задержка жидкости в организме, гипергликемия и усиление белкового катаболизма (связаны с усилением выделения глюкокортикоидов). Кроме того, введение кортикотропина может приводить к усилению выработки антител, поэтому предпочтительнее применение синтетического аналога кортикотропина.
Тетракозактид (синактен-депо*) - синтетический полипептидный аналог адренокортикотропного гормона (24 аминокислотных остатка). Аминокислотная последовательность повторяет N-концевую часть молекулы адренокортикотропного гормона и полностью сохраняет все его свойства. В отличие от кортикотропина тетракозактид действует более продолжительно (его можно применять 1 раз в сутки) и реже вызывает аллергические реакции. Показания к применению тетракозактида шире, чем у кортикотропина. Его можно использовать не только для профилактики осложнений длительного применения глюкокортикоидов, но и в комплексной терапии коллагенозов, бронхиальной астмы, дерматозов и неспецифического язвенного колита. Лечение препаратами адренокортикотропного гормона проводят курсами, поскольку при длительном непрерывном введении возможно «истощение» надпо- чечников. Противопоказания к применению обоих препаратов адре- нокортикотропного гормона: язвенная болезнь желудка и двенадцатиперстной кишки, сердечная недостаточность, тяжелые формы гипертонической болезни и сахарного диабета.
Соматропин (сайзен*, хуматроп*) - генно-инженерный аналог человеческого СТГ. Содержит ту же последовательность аминокислот, что и естественный СТГ. Действует на периферические ткани и стимулирует образование «соматомединов» - инсулиноподобных факторов роста. При этом инсулиноподобный фактор роста считают основополагающим фактором анаболического действия СТГ. В организме инсулиноподобный фактор роста синтезируется печенью и, взаимодействуя со специфическими рецепторами в тканях, стимулирует митоген-активируемую протеинкиназу, усиливает тканевый рост и активирует обмен веществ (синтез белка, рост костной и мышечной тканей). Уменьшается выделение с мочой азотистых продуктов, фосфора, кальция и натрия. Показания к применению: карликовый рост (синдром Тернера). Побочные эффекты: отеки, слабость, головная
боль, гипергликемия. Противопоказания: злокачественные новообразования.
Препараты ТТГ (тиротропин) и лактотропного гормона (лактин*) в медицинской практике широко не применяют.
Основные структурные элементы нейрогипофиза - окончания нейронов, тела которых залегают в супраоптическом и паравентри- кулярном ядрах гипоталамуса. Аксоны этих нейронов спускаются через ножку гипофиза в заднюю долю (образуют гипоталамо-гипофизарный тракт) и заканчиваются сильно утолщенными терминалями. Из терминалей в просвет капилляров выделяются два основных гормона: окситоцин и вазопрессин.
Окситоцин - синтетический октапептидный аналог эндогенного окситоцина. Состоит из пентапептидного цикла (цикл замкнут дисульфидным мостиком между двумя группами цистеина) и боковой цепи из трех аминокислотных остатков. Препарат стимулирует окситоциновые рецепторы матки, повышая тонус и сократительную активность миометрия. Плотность рецепторов в миометрии растет с увеличением срока беременности, при этом увеличивается утеротонический эффект препарата (способность стимулировать тоническую и ритмическую активность матки). Эта способность максимально выражена непосредственно перед родами, в период родов и сразу после родов. Действуя на миоэпителиальные клетки молочных желез, окситоцин усиливает сокращение гладкомышечных элементов альвеол и облегчает выделение молока. Кроме того, окситоцин обладает слабым вазопрессиноподобным антидиуретическим действием. Препарат вводят внутримышечно или внутривенно (t1/2 3-5 мин):
• для стимуляции родов (не расслабляет шейку матки, поэтому его применяют либо при полном раскрытии шейки, либо в комбинации с препаратами, снижающими тонус шейки матки);
• для остановки послеродовых кровотечений, связанных с атонией матки и ее недостаточной инволюцией;
• для облегчения отделения грудного молока в раннем послеродовом периоде.
Побочные эффекты: тахикардия, гипотензия, задержка воды в организме (при длительной инфузии). Противопоказания: преждев- ременные роды, несоответствие головки плода размерам таза роженицы, повышение АД.
Демокситоцин (сандопарт*) - синтетический аналог окситоцина с дезаминированным цистеином в положении 1.
Благодаря устойчивости к действию пептидаз его можно применять трансбуккально (закладывать за щеку для рассасывания) и внутрь (t1/2 3-5 мин). Отсутствие вазопрессиноподобного эффекта позволяет применять демокситоцин при артериальной гипертензии. Показания и противопоказания сходны с таковыми для окситоцина.
Десмопрессин (адиуретин СД*) - синтетический пептидный аналог вазопрессина. Действие препарата связано со стимуляцией спе- цифических V1- и V2-рецепторов вазопрессина (V1-рецепторы подразделяют на V1A- и V1B-подтипы). ^-рецепторы находятся в дистальной части нефрона. Они связаны с аденилатциклазой, при их стимуляции в клетках эпителия активируется синтез белков «водных пор» и увели- чивается их встраивание в люминальные мембраны эпителиоцитов. В результате усиливается реабсорбция воды (проявление антидиуретического действия вазопрессина). V1A-рецепторы находятся в артериальных сосудах; они связаны с фосфолипазой С. При их стимуляции в ангиомиоцитах накапливается инозитол-1,4,5-трифосфата и увеличивается содержание Ca2+. Это приводит к повышению тонуса сосудов и АД. Кроме того, препарат стимулирует агрегацию тромбоцитов и повышает активность VIII фактора свертываемости крови (активация V1- и V2-рецепторов соответственно). Антидиуретический эффект развивается при парентеральном применении (подкожном, внутривенном, внутримышечном, закапывании в нос) и длится 8-20 ч, несмотря на короткий период полувыведения (t1/2 составляет 75 мин). Показания к применению: несахарный диабет, острая полиурия (закапывание в нос), гемофилия А и болезнь Виллебранда (внутривенно). Побочные эффекты: гипертензия, головная боль, тошнота; боли в животе (спазм кишечника). Противопоказания: задержка жидкости в организме, анурия; недостаточность кровообращения, требующая назначения диуретиков.
Препараты, получаемые из естественного сырья
Адиурекрин* - препарат лиофилизированного порошка задней доли гипофиза, содержащий вазопрессин (капли в нос). Применяют при несахарном мочеизнурении и ночном недержании мочи. Эффект наступает через 15-20 мин после закапывания и сохраняется до 6 ч. Разовая доза - 2-3 капли (4-6 ЕД), суточная доза не превышает 10 капель (20 ЕД).
Гифотоцин**, питуитрин** - препараты, получаемые из задней доли гипофиза крупного рогатого скота и свиней. Содержат окситоцин и вазопрессин. Гифотоцин отличается от питуитрина степенью очистки и меньшим содержанием вазопрессина. Препараты применяют для стимуляции родов, ускорения инволюции матки и остановки кровотечений послеродового периода.
31.1.2. Препараты гормонов эпифиза
Эпифиз (шишковидная железа) играет ключевую роль в механизмах циркадных ритмов. Гормон эпифиза - мелатонин; образуется из серотонина путем ацетилирования и О-метилирования. Инкреция мелатонина зависит от времени суток, выделение гормона регулирует импульсация от сетчатки глаз. Афферентные импульсы поступают по адренергическим волокнам в супрахиазматическое ядро гипоталамуса, которое, возбуждаясь, подавляет инкрецию мелатонина при помощи нисходящих адренергических влияний. Продукция и выделение мелатонина в светлое время суток снижается, а в темное - увеличивается. Максимальная концентрация сопряженных с G-белками рецепторов мелатонина - в ЦНС. Вероятно, они участвуют в регуляции циркадной адаптации.
Мелатонин (мелаксен*) - синтетический аналог естественного мелатонина (N-ацетил-5-метокситриптамин). Нормализует циркадные ритмы, психоэмоциональный статус при десинхронозах, ускоряет адаптацию при быстрой смене часовых поясов, препятствует развитию депрессии в ответ на сезонное укорочение светового дня (улучшает настроение, влияет на эмоциональную и интеллектуально-мнестическую сферы), регулирует нейроэндокринные функции, проявляет иммуностимулирующие и антиоксидантные свойства. Наиболее выражено снотворное действие при бессонницах, связанных со сменой часовых поясов. После приема препарата человек засыпает быстрее, уменьшается количество ночных пробуждений, возрастает эффективность сна при одновременном увеличении количества и эмоциональной насыщенности сновидений. Препарат нормализует самочувствие после утреннего пробуждения и не оказывает «последействия». Применяют внутрь, за 30-40 мин до сна в качестве снотворного средства и для нормализации биологического ритма при смене часовых поясов. Побочные эффекты: в первую неделю приема возможны сонливость по утрам и появление отеков. Противопоказания: аутоиммунные заболевания, заболевания крови (лимфома, лейкемия), почечная недостаточность.
31.1.3. Препараты гормонов, регулирующих обмен кальция
Паращитовидные железы синтезируют паратгормон. Паратгормон и кальцитонин (гормон С-клеток щитовидной железы) регулируют обмен кальция: паратгормон повышает концентрацию ионов кальция в плазме крови, а кальцитонин снижает.
П а р а т г о р м о н - полипептид, состоящий из 84 аминокислотных остатков. На мембранах клеток паращитовидных желез находится так называемый кальциевый сенсор. Если концентрация ионов кальция в плазме крови снижается, усиливатся инкреция паратгормона. Эффекты паратгормона:
• стимуляция активности остеокластов (приводит к мобилизации кальция из «костных депо»);
• уменьшение выведения кальция почками;
• увеличение всасывания кальция в кишечнике.
Паратгормон также увеличивает коцентрацию кальцитриола, оказывающего аналогичное действие. Кроме того, паратгормон усиливает выведение фосфатов, уменьшая их концентрацию в плазме крови.
Паратиреоидин ** - препарат естественного паратгормона, получаемый из паращитовидных желез крупного рогатого скота. Вводят внутримышечно или подкожно при синдромах спазмофилии и тетании, связанных с недостаточностью паращитовидных желез. Действие препарата начинается через 4 ч и продолжается около суток. Так как препарат обладает длительным латентным периодом, при тетании введению паратиреоидина* должно предшествовать применение препаратов кальция. При длительном применении может сформироваться толерантность. Именно поэтому препарат следует отменить сразу после устранения гипокальциемии. После отмены паратиреоидина* назначают препараты витамина D и питание с повышенным содержанием кальция и с низким - фосфора.
Кальцитонин - полипептид, состоящий из 32 аминокислот- ных остатков; продуцируется С-клетками фолликулов щитовидной железы. При повышении концентрации ионов кальция в плазме крови инкреция гормона усиливается. Кальцитонин уменьшает резорбцию костной ткани и снижает реабсорбцию фосфатов и кальция в проксимальных извитых канальцах нефрона. В результате концентрация ионов кальция в плазме крови снижается. В клинической практике используют способность гормона подавлять декальцификацию кости.
Кальцитонин препятствует развитию и прогрессированию остеопороза и других заболеваний, связанных с деструкцией костной ткани, снижая активность остеокластов. Отмечают выраженное болеуто- ляющее действие, вероятно, связанное с влиянием кальцитонина на ЦНС. В медицинской практике применяют препараты естественного кальцитонина, а также синтетические аналоги.
Кальцитонин (кальцитрин*) - препарат кальцитонина щитовидных желез свиней. Вводят внутримышечно и подкожно. Показания к применению: остеопороз, болезнь Педжета (деформирующий остит), замедленное срастание костей после переломов; боли в костях, связанные с остеолизом. Побочные эффекты: приливы, головокружение, повышение АД. Противопоказания: гипокальциемия. Препарат не следует назначать детям до 6 лет ввиду отсутствия опыта применения.
Миакальцик* - препарат синтетического кальцитонина лосося. По сравнению с кальцитонином млекопитающих обладает большим сродством к рецепторам и оказывает продолжительное и более выраженное действие. Препарат выпускают в дозированном назальном аэрозоле, содержащем 14 доз (по 200 МЕ каждая). Эффект развивается в течение часа после ингаляции (t1/2 16-43 мин). Суточную дозу (200-400 МЕ) можно ввести одномоментно. Показания к применению, противопоказания и побочные эффекты те же.
31.1.4. Тиреоидные гормоны и антитиреоидные средства
Щитовидная железа принимает активное участие в обмене веществ и росте организма. Гормоны щитовидной железы - тироксин, трийодтиронин и кальцитонин. Термином «тиреоидные гормоны» обозначают тироксин и трийодтиронин. Оба гормона - йодированные формы тирозина.
Фолликул (функциональный элемент щитовидной железы) - полость, образованная одним слоем эпителиальных клеток. Она запол- нена коллоидом, содержащим тироглобулин (крупный гликопротеин; каждая молекула содержит около 115 остатков тирозина). Молекула йода захватывается эпителиальными клетками фолликулов из кровотока, путем активного транспорта проникает через базальную мембрану с последующим трансцитозом к люминальной мембране. В области апикальной мембраны молекула йода окисляется тиропероксидазой и выходит в просвет фолликула. Здесь происходит йодирование тиро-
зиновых остатков тироглобулина. Вначале тирозин йодируется в положении 3, образуя монойодтирозин. Затем некоторые молекулы монойодтирозина вторично йодируются в положении 5 с образованием дийодтирозина. Йодированные молекулы тирозина соединяются в димеры, причем соединение дийодтирозина с монойодтирозином приводит к образованию трийодтиронина, а соединение двух молекул дийодтирозина - к образованию тироксина. В соединении с молекулами тироглобулина они проникают через люминальные мембраны клеток эпителия фолликулов посредством эндоцитоза. В цитоплазме молекулы тироглобулина подвергаются лизосомальной деградации, а трийодтиронин и тироксин выделяются через базальные мембраны эпителиальных клеток в капиллярную сеть, окружающую фолликул. Образование и выделение тиреоидных гормонов регулируется гипоталамо-гипофизарной системой по цепочке рилизинг-гормон гипоталамуса → ТТГ передней доли гипофиза. Инкреция же рилизинг гормона и ТТГ регулируется по принципу обратной отрицательной связи, причем трийодтиронин подавляет их образование активнее, чем тироксин.
Тиреоидные гормоны активируют все виды основного обмена (углеводного, жирового и белкового). Действие трийодтиронина и тироксина может осуществляться как путем прямой стимуляции некоторых ферментов углеводного обмена, так и с помощью других гормонов: инсулина, глюкагона, глюкокортикоидов, катехоламинов. Ткани и органы-мишени тиреоидных гормонов: сердце, почки, печень и скелетная мускулатура. Эффекты тиреоидных гормонов:
• усиление основного обмена;
• повышение потребности тканей в кислороде;
• повышение температуры тела (особенно в ответ на охлаждение);
• усиление работы сердца (повышение силы, частоты сердечных сокращений, увеличение сердечного выброса).
Тиреоидные гормоны регулируют рост и развитие детей. Частично это связано с прямым влиянием трийодтиронина и тироксина на ткани, частично - с их способностью усиливать выделение и эффекты СТГ. Кроме того, тиреоидные гормоны увеличивают чувствительность тканей к паратгормону и кальцитонину, способствуя нормальному формированию скелета, развитию и нормализации функций мышечной и нервной тканей.
Механизм действия тиреоидных гормонов. В цитоплазме тироксин превращается в трийодтиронин. В результате стимуляции внутрикле-
точных рецепторов активируется транскрипция матричной РНК и усиливается синтез белка. Трийодтиронин в 3-5 раз активнее тироксина.
Гипофункция щитовидной железы (гипотиреоз) у взрослых проявляется микседемой, у детей - кретинизмом. Гиперфункция (гипертиреоз) - болезнь Грейвса-Базедова.
Увеличение размеров щитовидной железы обозначают термином «зоб» (струма). При избыточной продукции тиреоидных гормонов (диффузный токсический зоб, узловой токсический зоб) заболевание сопровождается клиническими признаками гипертиреоза. Простой (неток- сический) зоб клинически может не проявляться. Наиболее частая причина развития такого зоба - дефицит йода в продуктах питания. Данная патология развивается по механизму обратной отрицательной связи (недостаток йода в периферической крови приводит к усилению продукции рилизинг-гормона гипоталамусом и ТТГ гипофизом). В результате стимулирующего действия ТТГ железа гипертрофируется, но продукция тиреоидных гормонов не усиливается (следствие дефицита йода и снижения интенсивности йодирования предшественников).
Медикаментозную коррекцию расстройств функций щитовидной железы проводят следующими группами препаратов:
• средства, используемые при гипотиреозе (заместительная терапия препаратами гормонов щитовидной железы);
• средства, используемые при гипертиреозе (антитиреоидные препараты).
При гипотиреозе применяют препараты гормонов щитовидной железы, препараты нерадиоактивного неорганического йода, а также комбинированные препараты гормонов щитовидной железы и неорганического нерадиоактивного йода.
Лиотиронин - синтетический аналог трийодтиронина. Восполняет дефицит гормонов щитовидной железы при ее гипофун- кции. После приема внутрь всасывается 95% в течение 4 ч. Латентный период 4-8 ч (t1/2 2,5 сут). Максимальный терапевтический эффект наступает через 2-3 сут. Показания к применению:
• первичный гипотиреоз;
• микседема, кретинизм;
• эндемический и спорадический зобы;
• цереброгипофизарные заболевания с гипотиреоидизмом;
• гипотиреоидное ожирение;
• рак щитовидной железы;
• диагностика гипотиреоза.
Побочные эффекты: тахикардия, аритмии, стенокардия, сердечная недостаточность, раздражительность, головная боль, аллергические реакции, подавление выделения ТТГ (по принципу обратной отрица- тельной связи). Противопоказания: тиреотоксикоз, сахарный диабет, кахексия, надпочечниковая недостаточность (болезнь Аддисона), стенокардия.
Левотироксин натрия - синтетический аналог тироксина. Действует несколько слабее и медленнее, чем лиотиронин. Эффект наступает через 3-4 сут и достигает максимума через 10-15 сут.
Тиреотом* - комбинированный препарат, содержащий 40 мкг левотироксина натрия и 10 мкг лиотиронина.
Тиреоидин* - препарат, получаемый из высушенных и обезжиренных щитовидных желез скота. Препарат содержит левовращающие изомеры обоих тиреоидных гормонов. Действует аналогично лио- тиронину, но несколько (в 3-5 раз) слабее влияет на обмен веществ. Показания, противопоказания и побочные эффекты сходны с таковыми лиотиронина.
Калия йодид - препарат неорганического нерадиоактивного йода; фармакологические эффекты зависят от применяемых доз и содержания йода в организме. При недостатке йода препарат возмещает его дефицит и восстанавливает нарушенный синтез тиреоидных гормонов. Это свойство может быть использовано при гипотиреозе. При исходно нормальном содержании йода в организме препарат по принципу обратной отрицательной связи угнетает инкрецию ТТГ аденогипофизом. Это свойство может быть использовано для профилактики эндемического зоба. Накапливаясь в щитовидной железе, калия йодид защищает ее от действия радиации, препятствуя накоплению радиоактивного йода. В качестве индивидуального препарата калия йодид используют для профилактики развития зоба при недостаточности йода (в дозе 100-200 мкг в сутки). Побочные эффекты: аллергические реакции, тахикардия и бессонница.
Для лечения гипотиреоза калия йодид обычно используют в комбинации с препаратами тиреоидных гормонов:
• йодтирокс* - комбинированный препарат, содержащий
• 100 мкг левотироксина натрия и 130,8 мкг калия йодида; тиреокомб* - комбинированный препарат, содержащий
70 мкг левотироксина натрия, 10 мкг лиотиронина и 150 мкг
калия йодида (115 мкг йода).
Гипертиреоз лечат хирургическим, фармакотерапевтическим методами и их комбинацией.
Для фармакотерапевтической коррекции применяют так называемые антитиреоидные средства:
• разрушающие клетки фолликулов щитовидной железы;
• нарушающие захват йода;
• угнетающие синтез тиреоидных гормонов;
• угнетающие продукцию ТТГ аденогипофизом.
Препараты радиоактивного йода (131I) широко используют за рубежом, считая их антитиреоидными средствами «первого ряда». Радиоактивный йод захватывается щитовидной железой и включается в тироглобулин. Изотоп излучает γ-лучи и β-частицы; при этом β-частицы оказывают цитотоксическое действие на клетки эпителия фолликулов. Период полураспада радиоактивного изотопа йода - 8 сут, при этом излучение регистрируют около 2 мес. После однократного применения антитиреоидное действие радиоактивного йода сохраняется в течение 1-2 мес.
Калия перхлорат тормозит способность щитовидной железы захватывать и накапливать йод. Применяют внутрь, при легких и средних формах токсического зоба. Курс лечения - 12 мес. Препарат вызывает серьезные побочные эффекты: угнетение кроветворения (лейкопения, агранулоцитоз, тромбоцитопения, апластическая анемия), струмогенный эффект (развитие зоба по принципу обратной отрицательной связи); обладает гепатотоксическим действием.
Тиамазол (мерказолил*, тирозол*), блокирует пероксидазу и угнетает йодирование тирозина. В результате уменьшается синтез трийодтиронина и тироксина. Применяют внутрь при диффузном токсическом зобе. В терапевтических дозах хорошо переносим. Побочные эффекты: тошнота, рвота, угнетение кроветворения, увеличение размеров щитовидной железы.
Препараты неорганического нерадиоактивного йода (см. выше) угнетают продукцию ТТГ аденогипофизом. Это свойство позволяет использовать их для профилактики струмогенного действия калия перхлората и тиамазола.
31.1.5. Препараты гормонов поджелудочной железы
Поджелудочная железа - железа наружной и внутренней секреции. Инкреторную функцию выполняет островковый аппарат. Островки Лангерганса состоят из четырех типов клеток:
• А-клетки (α-клетки), вырабатывающие глюкагон;
• В-клетки (β-клетки), вырабатывающие инсулин и амилин;
• D-клетки (δ-клетки), вырабатывающие соматостатин;
• F-клетки, вырабатывающие панкреатический полипептид. Глюкагон и инсулин - гормоны, регулирующие уровень глюкозы
в плазме крови. Соматостатин выполняет функции паракринного ингибитора секреции. Функции панкреатического полипептида неясны. Инкреторная недостаточность поджелудочной железы проявляется симптомами дефицита инсулина, в связи с чем его принято считать основным гормоном поджелудочной железы.
И н с у л и н - полипептид, состоящий из двух цепей (А и В), соединенных двумя дисульфидными мостиками. Цепь А состоит из 21, а цепь В - из 30 аминокислотных остатков. Инсулин синтезируется в аппарате Гольджи β-клеток в виде препроинсулина и превращается в проинсулин. Проинсулин состоит из двух цепей инсулина, соединенных цепью С-белка (из 35 аминокислотных остатков). После отщепления С-белка и присоединения четырех аминокислотных остатков образуются молекулы инсулина, которые упаковываются в гранулы и подвергаются экзоцитозу. Инкреция инсулина имеет «пульсирующий» характер с периодом 15-30 мин. В течение суток в системный кровоток выделяется 5 мг инсулина, а всего в поджелудочной железе содержится (с учетом препроинсулина и проинсулина) 8 мг гормона. Секреция инсулина регулируется ней- рогуморальными факторами: парасимпатическая нервная система (через М3-холинорецепторы) усиливает, а симпатическая нервная система (через α2-адренорецепторы) угнетает выделение инсулина β-клетками. Соматостатин, продуцируемый D-клетками, препятствует выделению инсулина, а некоторые аминокислоты (фенилаланин), жирные кислоты, глюкагон, амилин, инкретины (глюка- гоноподобный полипептид-1, гастроингибирующий полипептид) и глюкоза - усиливают. Определяющий фактор регуляции выделения инсулина - уровень глюкозы в плазме крови (рис. 31-2). Глюкоза проникает в β-клетку с помощью специфического транспортера GLUT-2 и запускает каскад метаболических реакций. В результате в β -клетках возрастает концентрация АТФ. Это приводит к инак- тивации АТФ-зависимых калиевых каналов, и мембрана β-клетки деполяризуется, при этом увеличивается частота открытия потенциалозависимых кальциевых каналов. Концентрация ионов кальция в β-клетках увеличивается, приводя к усилению экзоцитоза инсулина.
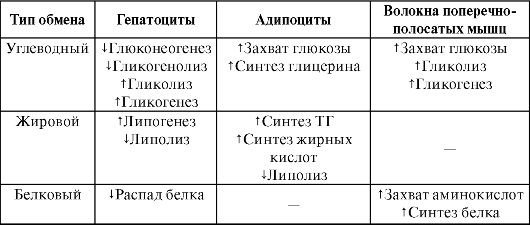
Инсулин регулирует основной обмен, а также рост тканей (табл. 31-1). Механизм влияния инсулина на рост тканей аналогичен механизму действия инсулиноподобных факторов роста. Влияние инсулина на обмен веществ в целом можно охарактеризовать как анаболическое (гормон усиливает синтез белка, жиров, гликогена). Первостепенное значение имеет влияние инсулина на углеводный обмен. Указанные изменения в обмене веществ сопровождаются снижением уровня глюкозы в плазме крови (гипогликемией). Одна из причин гипогликемии - увеличение захвата глюкозы тканями.
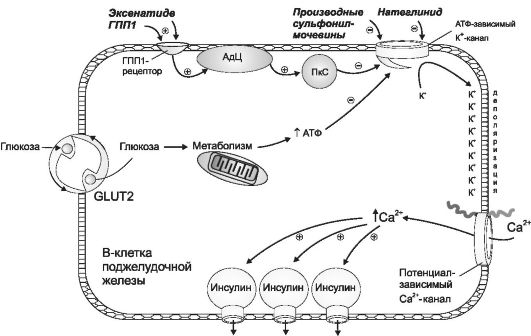
Рис. 31-2. Регуляция выделения инсулина
Через гистогематические барьеры глюкоза проникает путем облегченной диффузии (энергонезависимого транспорта по элек- трохимическому градиенту) при помощи специальных транспортных систем GLUT β-клетки поджелудочной железы содержат GLUT-2. «Инсулинозависимые» ткани (жировая и поперечно-полосатая мышечная ткани) содержат GLUT-4. Количество белков - переносчиков глюкозы увеличивается при стимуляции инсулиновых рецепторов. Эндотелиоциты капилляров головного мозга содержат GLUT-1; этот транспортер обеспечивает инсулинонезависимый (базальный) транспорт глюкозы в нейроны.
Таблица 31-1
Влияние инсулина на обмен веществ в разных тканях
Инсулин влияет на обмен веществ при помощи специфических мембранных инсулиновых рецепторов, состоящих из двух α- и двух β-субъединиц. α-Субъединицы расположены с наружной стороны мембран клеток и имеют центры связывания молекул инсулина. β-субъединицы - трансмембранные домены с тирозинкиназной активностью и тенденцией к взаимному фосфорилированию. Связывание молекулы инсулина с α-субъединицами рецептора стимулирует эндоцитоз, и комплекс «инсулин-рецептор» погружается в цитоплазму клетки. Пока молекула инсулина связана с рецептором, он пребывает в активированном состоянии и стимулирует процессы фосфорилирования. После разъединения комплекса рецептор «возвращается» в мембрану, а молекула инсулина разрушается лизосомами. Активированные инсулиновые рецепторы запускают процессы фосфорилирования, активируют некоторые ферменты углеводного обмена и усиливают синтез GLUT-4 (рис. 31-3).
При недостаточной продукции эндогенного инсулина развивается сахарный диабет. Его основные симптомы: гипергликемия, глюкозурия, полиурия, полидипсия, кетоацидоз, ангиопатии и др.
Инсулиновая недостаточность может быть абсолютной (аутоиммунный процесс, приводящий к гибели островкового аппарата) и относительной (у пожилых и тучных людей). В связи с этим принято различать сахарный диабет 1-го типа (абсолютная инсулиновая недостаточность) и сахарный диабет 2-го типа (относительная инсулиновая недостаточность). При обеих формах сахарного диабета показана диета.
Противодиабетические лекарственные препараты:
• препараты инсулина (средства заместительной терапии);
• синтетические противодиабетические средства для приема внутрь.
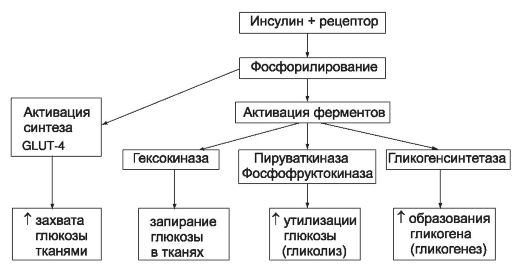
Рис. 31-3. Механизм гипогликемизирующего действия инсулина
Препараты инсулина - универсальные противодиабетические средства, эффективные при любой форме диабета. Сахарный диабет 1-го типа ранее называли «инсулинозависимым» или «инсулинопотребным». Лица, страдающие этой формой диабета, пожизненно используют препараты инсулина. При сахарном диабете 2-го типа («инсулинонезависимом») лечение начинают с назначения синтетических противодиабетических средств, а препараты инсулина применяют при неэффективности высоких доз синтетических гипогликемических средств.
Препараты инсулина можно производить из поджелудочных желез млекопитающих - бычий (говяжий) и свиной инсулины. Они могут содержать примеси проинсулина, С-белка, глюкагона, соматостатина. Разработаны методики получения генно-инженерного инсулина. Современные технологии позволяют получать высокоочищенные (монокомпонентные), кристаллизованные и монопиковые (при хроматографии регистрируется один «пик» инсулина) препараты.
Активность препаратов инсулина определяют биологическим путем и выражают в ЕД (1 ЕД инсулина утилизирует 4 г глюкозы). Применяют инсулин только парентерально (подкожно, внутримышечно и внутри- венно), поскольку он разрушается в ЖКТ. Инсулин имеет невысокую
продолжительность действия (подвергается протеолизу в системном кровотоке). В настоящее время широко применяют препараты инсулина пролонгированного действия. Их получают методом преципитации инсулина с протамином (иногда в присутствии ионов цинка для стабилизации пространственной структуры молекул инсулина). В результате получают либо аморфный, либо кристаллический препарат. При введении под кожу такие формы образуют эффект депо, медленно высвобождая инсулин в системный кровоток. Все пролонгированные формы инсулина - суспензии (противопоказано внутривенное введение). Один из недостатков пролонгированных форм - длительный латентный период, поэтому иногда их комбинируют с препаратами инсулина короткого действия. Такая комбинация обеспечивает быстрое развитие эффекта и его достаточную продолжительность.
Препараты инсулина классифицируют по продолжительности действия:
• инсулин быстрого действия (начало действия обычно через 30 мин; максимум действия через 1,5-2 ч; общая продолжительность действия - 4-6 ч);
• инсулин длительного действия (начало действия через 4-8 ч, пик - спустя 8-18 ч; общая продолжительность - 20-30 ч);
• инсулин средней продолжительности действия (начало действия через 1,5-2 ч, пик - спустя 3-12 ч, общая продолжительность - 8-12 ч);
• инсулин средней продолжительности действия в комбинациях.
Препараты инсулина быстрого действия используют как для систематического лечения, так и для купирования диабетической комы (внутривенно). Пролонгированные формы инсулина внутривенно вводить нельзя, поэтому основная сфера их применения - систематическое лечение.
Побочные эффекты: аллергические реакции, липодистрофии в местах инъекций. При введении слишком высоких доз инсулина или при недостаточном поступлении алиментарных углеводов может развиться чрезмерная гипогликемия вплоть до гипогликемической комы с потерей сознания, судорогами и явлениями сердечно-сосудистой недостаточности. При коме больному следует внутривенно ввести 20-40 мл (но не более 100 мл) 40% раствора глюкозы.
Поскольку препараты инсулина применяют пожизненно, следует иметь в виду, что их гипогликемический эффект может изменяться под действием других препаратов.
• Усиливают гипогликемическое действие инсулина:
- β-адреноблокаторы;
- сульфаниламиды;
- анаболические стероиды;
- ингибиторы МАО.
• Ослабляют гипогликемическое действие инсулина:
- тиазидные диуретики;
- глюкокортикоиды;
- тиреоидные гормоны;
- гепарин.
Противопоказания: гипогликемия, острые заболевания печени и поджелудочной железы, декомпенсированные пороки сердца.
Актрапид НМ* - раствор биосинтетического человеческого инсулина короткого и быстрого действия во флаконах по 10 мл (1 мл раствора содержит 40 или 100 МЕ инсулина) или в картриджах для использования в инсулиновой шприц-ручке Ново-Пен. В каждом картридже по 1,5 или 3 мл раствора. Гипогликемическое действие развивается через 30 мин, достигает максимума через 1-3 ч и длится 8 ч.
Изофан-инсулин ГМ* - нейтральная суспензия генноинженерного инсулина средней продолжительности действия. Флаконы по 10 мл суспензии (40 МЕ в 1 мл). Гипогликемическое действие начинается через 1-2 ч, достигает максимума через 6-12 ч и длится 18-24 ч.
Монотард НМ* - составная суспензия цинк-инсулина человека (содержит 30% аморфного и 70% кристаллического цинк- инсулина). Флаконы по 10 мл суспензии (40 или 100 МЕ в 1 мл). Гипогликемическое действие начинается через 2,5 ч, достигает максимума через 7-15 ч и длится 24 ч.
Ультратард НМ* - суспензия цинк-инсулина кристаллического. Флаконы по 10 мл суспензии (40 или 100 МЕ инсулина в 1 мл). Гипогликемическое действие начинается через 4 ч, достигает максимума через 8-24 ч и длится 28 ч.
Инсулин нейтральный для инъекций (Инсулин С*, Актрапид МС*) - нейтральный раствор монопикового или монокомпонентного свиного инсулина короткого и быстрого действия. Флаконы по 5 и 10 мл (40 или 100 МЕ инсулина в 1 мл). Гипогликемическое действие начинается через 20-30 мин после подкожного введения, достигает максимума через 1-3 ч и длится 6-8 ч. Для систематического лечения вводят под кожу за 15 мин
до еды, начальная доза - от 8 до 24 МЕ, высшая разовая доза - 40 МЕ. Для купирования диабетической комы вводят внутривенно.
Инсулин изофан* - монопиковый монокомпонентный свиной изофан протамин инсулин. Гипогликемическое действие начинается через 1-3 ч, достигает максимума через 3-18 ч и длится около 24 ч. Наиболее часто используют в комбинации с короткодействующим инсулином.
Инсулин Ленте СПП* - нейтральная составная суспензия монопикового или монокомпонентного свиного инсулина (содержит 30% аморфного и 70% кристаллического цинк-инсулина). Флаконы по 10 мл суспензии (40 МЕ инсулина в 1 мл). Гипогликемическое действие начинается через 1-3 ч после подкожного введения, достигает максимума через 7-15 ч и длится 24 ч.
Монотард МС* - нейтральная составная суспензия монопикового или монокомпонентного свиного инсулина (содержит 30% аморфного и 70% кристаллического цинк-инсулина). Флаконы по 10 мл суспензии (40 или 100 МЕ инсулина в 1 мл). Гипогликемическое действие начинается через 2,5 ч, достигает максимума через 7-15 ч и длится 24 ч.
31.1.6. Синтетические противодиабетические средства для приема внутрь
Один из недостатков препаратов инсулина - невозможность энтерального применения. Это обусловило необходимость поиска гипог- ликемических средств, эффективных при приеме внутрь. В настоящее время известны следующие группы препаратов: производные сульфонилмочевины, бигуаниды, производные тетрасахаридов, тиазолидиндионы, «глиниды». Препараты этих групп имеют отличные от инсулина механизмы действия. Их применяют при неосложненном сахарном диабете 2-го типа.
В фармакотерапии сахарного диабета 2-го типа применяют не только синтетические гипогликемические средства, но также парен- теральные аналоги естественных инкретинов (инкретиномиметики). Все средства, применяемые при сахарном диабете 2-го типа, классифицируют по механизму действия.
• Средства, увеличивающие инкрецию эндогенного инсулина.
- Производные сульфонилмочевины.
- «Глиниды».
- Инкретиномиметики.
• Средства, уменьшающие инсулинорезистентность тканей.
- Бигуаниды.
- Тиазолидиндионы (сенситайзеры инсулина).
• Средства, препятствующие всасыванию глюкозы в кишечнике (ингибиторы а-глюкозидазы).
• Средства заместительной терапии - препараты инсулина (назначают при неэффективности препаратов указанных выше групп).
Производные сульфонилмочевины - наиболее изученная группа синтетических противодиабетических средств. Выделяют два поколения (генерации) производных сульфонилмочевины:
- I поколение: карбутамид, толазамид, толбутамид;
- II поколение: хлорпропамид, глибенкламид, гликлазид, глипизид, гликвидон.
У всех производных сульфонилмочевины механизм гипогликемического действия состоит из нескольких компонентов. Главный ком- понент - стимуляция выделения эндогенного инсулина β-клетками островкового аппарата. Эти вещества взаимодействуют со специфическим местом связывания (белок 140 кДа) в стенках АТФ-зависимых калиевых каналов β-клеток поджелудочной железы (см. рис 31.2). В результате калиевые каналы блокируются, и мембраны β-клеток приходят в состояние деполяризации. Это приводит к открытию потенциалозависимых кальциевых каналов, ионы кальция входят в цитоплазму β-клеток и усиливают экзоцитоз эндогенного инсулина. Кроме того, производные сульфонилмочевины восстанавливают чувствительность β-клеток к глюкозе; увеличивают плотность инсулиновых рецепторов в инсулинозависимых тканях; повышают чувствительность рецепторов к инсулину и улучшают передачу пострецепторного сигнала.
Производные сульфонилмочевины хорошо переносятся больными, однако обладают рядом фармакокинетических и фармакодинамических особенностей. Препараты могут повышать аппетит. Это свойство расценивают как побочное действие, поскольку антидиабетическую терапию проводят на фоне диетической коррекции. Производные сульфонилмочевины связываются с белками плазмы крови, поэтому могут вступать в фармакокинетическое взаимодействие с НПВС, антикоагулянтами непрямого действия и др. Эти препараты проникают через плацентарный барьер, поэтому их следует с осторожностью назначать в период беременности. Также они недостаточно селектив- но взаимодействуют с калиевыми каналами β-клеток и могут бло-
кировать калиевые каналы кардиомиоцитов и ангиомиоцитов (при длительном применении увеличивают смертность от заболеваний сердечно-сосудистой системы). В течение трех лет регулярного применения у некоторых больных развивается вторичная резистентность к препаратам этой группы. В настоящее время широко применяют производные сульфонилмочевины II поколения.
Толбутамид (бутамид*) - производное сульфонилмочевины
I поколения. Гипогликемическое действие развивается в течение 1 ч (уровень глюкозы снижается на 30%), достигает максимума через 5-7 ч и длится около 12 ч. Назначают в дозе 1 г (2 таблетки по 0,5 г)
2 раза в сутки. Побочные эффекты: повышение аппетита, гипогликемия, при длительном применении - повышение смертности от заболеваний сердечно-сосудистой системы, парестезии, бессонница, головокружение, тошнота, рвота. Противопоказания: гиперчувствительность, кетоацидоз, беременность, лактация.
Хлорпропамид (диабенезе*) отличается от толбутамида большей продолжительностью действия (24-36 ч после однократного применения), более высокой активностью (назначают по 0,25-0,5 г 1 раз в сутки) и наличием «тетурамоподобного» эффекта (угнетает альдегиддегидрогеназу; останавливает окисление этилового спирта на стадии образования уксусного альдегида). Об этой особенности действия препарата следует оповещать больных и рекомендовать воз- держиваться от приема спиртных напитков на время лечения.
Глибенкламид (манинил*, глиданил*) - препарат II поколения; отличается от толбутамида и хлорпропамида более высокой (на два порядка) активностью (назначают по 0,005-0,001 г 1-2 раза в сутки). Гипогликемическое действие наступает через 2 ч, достигает максимума через 7-8 ч и длится до 24 ч. Кроме гипогликемического действия препарат обладает гиполипидемическим (снижает в плазме крови уровень атерогенных липопротеинов) и антитромбогенным эффектами.
Глипизид (минидиаб*) отличается от глибенкламида (и прочих производных сульфонилмочевины II поколения) относительно коротким периодом полувыведения (t1/2 3-4 ч), поэтому обладает менее выраженной способностью к кумуляции.
Гликвидон (глюренорм*) - наиболее эффективное и хорошо переносимое производное сульфонилмочевины. Препарат можно назначать лицам с заболеваниями печени и почек.
Гликлазид (глизид*, диабетон*, реклид*) в ходе метаболических изменений образует 8 метаболитов, один из которых оказывает
выраженное влияние на микроциркуляцию. Это проявляется снижением агрегации тромбоцитов, коагуляции (гепариноподобное действие); активацией фибринолиза, а также антиоксидантным действием. При применении гликлазида улучшается микроциркуляция, снижается выраженность ангиопатий, ретинопатий, нефропатий, улучшается васкуляризация и питание конъюнктивы, уменьшаются признаки сосудистого стаза. Препарат показан при сахарном диабете 2-го типа, осложненном ангиопатиями, ретинопатиями, нефропатиями.
Глимепирид (амарил*) - новый препарат из группы производных сульфонилмочевины. Место связывания глимепирида с АТФ- зависимыми калиевыми каналами β-клеток - белок массой 65 кДа. Скорость ассоциации/диссоциации глимепирида со специфическим местом связывания выше, чем у других производных сульфонилмочевины. Это обусловливает более быстрое наступление эффекта, менее выраженный риск гипергликемии, более высокую избирательность глимепирида к калиевым каналам β-клеток по сравнению с калиевыми каналами сердца и сосудов (меньше осложнений со стороны сердеч- но-сосудистой системы). Кроме того, глимепирид превосходит прочие производные сульфонилмочевины по продолжительности действия (назначают 1 раз в сутки). При приеме внутрь биодоступность 100%; Сmax в плазме крови достигается через 2,5 ч; 99% связывается с белками плазмы; объем распределения (Vd) около 8,8 л. Метаболизируется в печени, образуя карбоксилированный и гидроксилированный активные метаболиты. Выводится почками и кишечником (t1/2 5-8 ч).
К «внепанкреатическим» эффектам глимепирида относят:
• антиагрегантное действие (ингибируя ЦОГ, препятствует синтезу тромбоксана в тромбоцитах);
• антиоксидантное действие (стимулирует синтез эндогенного α- токоферола, повышает активность каталазы, глутатионпероксидзы и супероксиддисмутазы);
• уменьшение липогенеза и гликогенеза в тканях (стимулирует гликозил-фосфатидилинозитол-специфическую фосфолипазу С).
Побочные эффекты: гипогликемия, транзиторные нарушения зрения в начале лечения (связаны с изменением уровня глюкозы в плазме крови); возможны (крайне редко) изменения картины периферической крови и аллергические реакции.
Механизм действия «глинидов» сходен с таковым производных сульфонилмочевины. «Глиниды» стимулируют инкрецию эндогенного инсулина, блокируя АТФ-зависимые калиевые каналы
β-клеток островков поджелудочной железы. Действие их довольно избирательно, поскольку калиевые каналы β-клеток примерно в 300 раз чувствительнее к «глинидам», чем калиевые каналы сердца и сосудов. Ценное свойство препаратов этой группы - способность восстанавливать раннюю (стимулированную глюкозой) фазу секреции инсулина. Вызванная «глинидами» секреция инсулина зависит от уровня глюкозы в плазме крови. По мере снижения концентрации глюкозы в крови уменьшается и стимулированная препаратами инкреция инсулина. Это снижает до минимума риск гипогликемии, связанной с пропуском приема пищи. Наиболее выраженное стимулирующее действие «глинидов» на секрецию инсулина наблюдают в первые 15 мин после приема пищи. Это обусловливает применение «глинидов» для профилактики постпрандиальной (после приема пищи) гипергликемии.
Натеглинид (старликс*) - производное аминокислоты фенилаланина. При приеме внутрь быстро всасывается; биодоступность около 72%. Максимальная концентрация в плазме достигается менее чем через час. Метаболизируется в печени с участием микросомальных изоферментров цитохрома Р450. В ходе гидроксилирования образуются три активных метаболита. Выводится преимущественно с мочой (83% принятой дозы) в течение 6 ч после приема (t1/2 около 1,5 ч). Натеглинид применяют внутрь непосредственно перед приемом пищи (промежуток времени между приемом препарата и приемом пищи не должен превы- шать 30 мин). Побочные эффекты: гипогликемия (тремор, потливость, тахикардия, головокружение, слабость, повышение аппетита), повышение активности печеночных ферментов в крови, диспепсия, боли в животе, аллергические реакции (зуд, сыпь, крапивница).
Репаглинид (производное бензоевой кислоты) - аналог натеглинида. Выводится преимущественно с желчью и разрешен к применению у больных с патологией почек.
Инкретины - стимуляторы инкреции эндогенного инсулина; выделяются тонким кишечником в ответ на прием пищи и потенцируют стимулированную глюкозой секрецию инсулина. Один из инкретинов - глюкагоноподобный полипептид-1 (ГПП-1). Он состоит из 30 аминокислотных остатков и инактивируется дипептидилпептидазой 4, путем отщепления аминокислоты аланина. Рецепторы к глюкагоноподобному полипептиду-1 расположены в мембранах β-клеток поджелудочной железы (а также α- и δ-клеток) (рис. 31-2). Стимуляция рецепторов β-клеток активирует аденилатциклазу
(с последующей активацией протеинкиназы А) и фосфолипазу С (с последующей активацией протеинкиназы С). Активированные протеинкиназы блокируют АТФ-зависимые калиевые каналы. Это приводит к деполяризации мембран и повышению числа свободных ионов кальция в β-клетках, стимуляции синтеза и инкреции эндогенного инсулина. ЛВ, действующие по инкретиновому механизму, получили собирательное название «инкретиномиметики».
Эксенатиде (баета*) - агонист рецепторов к глюкагоноподобному полипептиду-1. Его получают из слюнной железы североамериканской ящерицы Gila Lizard. Препарат на 52% гомологичен глюкагоноподобному полипептиду-1. Эксенатиде вводят подкожно в дозе 5-10 мг (t1/2 2-4 ч), суточную дозу делят на два приема. Обычно препарат назначают в комбинации с метформином или производными сульфонилмочевины. Побочные эффекты: тошнота (20-30% пациентов) и рвота. Их возникновение, возможно, обусловлено стимуляцией рецепторов к глюкагоноподобному полипептиду-1 в мозге (area postrema) и замедлением эвакуации желудочного содержимого.
Инкретины, вырабатываемые в организме, быстро разрушаются дипептидилпептидазой-4 (сериновая пептидаза). В настоящее время разработаны и проходят III фазу клинических испытаний ингибиторы дипептидилпептидазы-4 в и л д а г л и п т и н **, ситаглиптин**, саксаглиптин** (относятся к пирролидинам). Эти препараты приводят к необратимому энзиматическому разрушению дипептидил- пептидазы-4, продлевая период полужизни естественных инкретинов и повышая их концентрацию в плазме крови в среднем в 2-3 раза. Существенных побочных эффектов при применении ингибиторов дипептидилпептидазы-4 не отмечают.
Сахарный диабет 2-го типа - неоднородная патология. Так, у пожилых лиц, не имеющих избыточной массы тела, гипергликемия обусловлена недостаточной продукцией эндогенного инсулина (гипоинсулинемией). В то же время у лиц с избыточной массой тела гипергликемия может протекать на фоне повышенного уровня инсулина (гиперинсулинемии). Такой феномен обозначают как «метаболический синдром», «синдром Х». В его основе лежит резистентность (нечувствительность) инсулинозависимых тканей к эндогенному инсулину. Инсулинорезистентность тканей ведет к компенсаторному увеличению инкреции инсулина. Гиперинсулинемия впоследствии приводит к гиперлипидемии, ожирению, гипертензии и другим нарушениям функции сердечно-сосудистой системы. При подобном течении сахар-
ного диабета 2-го типа целесообразно применение средств, уменьшающих инсулинорезистентность тканей. Такими свойствами обладают бигуаниды и тиазолидиндионы.
Метформин (глюкофаг*, глиформин*, сиофор 100, 500, 850*) - единственный представитель бигуанидов (буформин и фенформин выведены из употребления). Гипогликемическое действие метформина (и прочих бигуанидов) - не следствие увеличения секреции инсулина β-клетками поджелудочной железы. Детальный механизм действия не вполне ясен, но существуют и установленные его компоненты:
• повышение чувствительности инсулинозависимых тканей к инсулину;
• стимуляция захвата глюкозы скелетными мышцами;
• стимуляция анаэробного гликолиза (утилизация глюкозы);
• снижение всасывания глюкозы в кишечнике;
• снижение продукции глюкозы гепатоцитами;
• понижение уровня глюкагона в крови.
Метформин влияет на углеводный обмен, снижает уровень атерогенных липопротеинов (ЛПНП), ХС, ТГ в плазме крови, снижает аппетит и массу тела. Применяют при сахарном диабете 2-го типа (в особенности при сахарном диабете «тучных»). Побочные эффекты: тошнота, рвота, понос, метеоризм, боли в животе. Указанные побочные эффекты (возникают довольно часто) не опасны для жизни, но ограничивают применение метформина. Из других побочных эффектов следует отметить лактатный ацидоз (слабость, сонливость, мышечные боли, одышка, гипотермия, гипотония брадиаритмия). Его возникновение обусловлено стимуляцией анаэробного гликолиза, конечный продукт которого - молочная кислота. Противопоказания: гиперчувствительность, нарушения функции печени и почек, метаболический ацидоз, беременность, лактация.
Тиазолидиндионы (сенситайзеры инсулина) - относительно новая группа антидиабетических средств. К ней относят пиоглитазон (актос*, пиоглар*), розиглитазон** (авандиа**), т р о г л и т а з о н **. Тизолидиндионы не только уменьшают инсулинорезистентность тканей, но и замедляют прогрессирование атеросклероза. Механизм действия - антагонисты PPAR (рецепторов, активируемых пролифератором пероксисом.
Рецепторы, активируемые пролифератором пероксисом (PPAR) локализуются в ядрах клеток инсулинозависимых тканей (например,
в адипоцитах) и регулируют транскрипцию ряда генов, участвующих в жировом и углеводном обмене. Рецепторы, активируемые пролифератором пероксисом-γ (PPAR-γ) регулируют дифференцировку адипоцитов, накопление в них жирных кислот, инициацию адипогенеза, а также синтез и встраивание в мембраны GLUT-4. Рецепторы, активируемые пролифератором пероксисом-α (PPAR-α), регулируют жировой обмен (окисление жирных кислот), а также метаболизм медиаторов воспаления - простагландинов (за счет стимуляции синтеза ЦОГ-2).
Тиазолидиндионы уменьшают инсулинорезистентность тканей (антагонисты рецепторов PPAR-γ2); увеличиают количество мелких адипоцитов, более чувствительных к инсулину. Также тиазолидиндионы увеличивают количество инсулинозависимых переносчиков глю- козы GLUT-4 и уменьшают концентрацию свободных жирных кислот и глицерина, препятствующих захвату глюкозы инсулинозависимыми тканями. Замедление прогрессирования атеросклероза - результат агонистической активности тиазолидиндионов по отношению к рецепторам, активируемым пролифератором пероксисом-α (PPAR-α). В результате ускоряется катаболизм медиаторов воспаления, уменьшается концентрация атерогенных липопротеинов и увеличивается концентрация антиатерогенных ЛПВП в плазме крови.
Пиоглитазон (актос*, пиоглар*) при применении внутрь быстро всасывается, попадает в плазму крови через 30 мин, максимальную концентрацию в плазме регистрируют через 2 ч. Метаболизируется в печени (при участии цитохрома Р450) с образованием двух активных метаболитов. В неизмененном виде выводится желчью, метаболиты выводятся через почки (15-30%) и кишечник; t1/2 (пиоглитазона) составляет 3-7 ч, t1/2 (метаболитов) 16-24 ч. Применяют внутрь 1 раз в сутки как в монотерапии, так и в комбинации с производными суль- фонилмочевины, бигуанидами, препаратами инсулина. Побочные эффекты: гипогликемия, отеки, анемия, снижение концентраций билирубина и печеночных ферментов.
Акарбоза (глюкобай*) - олигосахарид (тетрасахарид), получаемый из микроорганизмов Actinoplanes utahensis путем ферментации. Акарбоза - обратимый ингибитор панкреатической α-амилазы и кишечной мембранно-связанной α-глюкозидазы. В результате алиментарные полисахариды не расщепляются до дисахаридов (угнетение α-амилазы), а дисахариды не расщепляются до моносахаридов (угнетение α-глюкозидазы). Таким образом, нарушается образование и всасывание моносахаридов в кишечнике. Выраженной гипогликемии пре-
парат не вызывает, но при назначении перед приемом пищи снижает постпрандиальную (после приема пищи) гипергликемию. Применяют чаще всего в комбинации с другими противодиабетическими средствами. Побочные эффекты: метеоризм (у 20-30% пациентов), понос (у 3% пациентов), боли в животе. Указанные эффекты связаны с тем, что оставшиеся в тонкой кишке углеводы ферментируются микрофлорой с выделением газа. Противопоказания: хронические воспалительные заболевания кишечника с нарушением функции всасывания.
В комплексном лечении сахарного диабета 2-го типа (чаще всего при легком течении) можно использовать фитотерапевтические средства - топинамбур и др.
Сбор «Арфазетин»:
• побегов черники - 20%;
• створок плодов фасоли обыкновенной - 20%;
• корня аралии маньчжурской (или корневища с корнями заманихи) - 15%;
• плодов шиповника - 15%;
• травы хвоща полевого - 10%;
• травы зверобоя - 10%;
• цветков ромашки аптечной - 10%.
Заваривают в домашних условиях, принимают внутрь за 30 мин до еды по 1/3 или 1/2 стакана 2-3 раза в день, в течение 20-30 дней. Через 10-15 дней курс повторяют. В течение года проводят 3-4 курса. Применение сбора позволяет снизить суточную дозу синтетических антидиабетических средств.
31.2. ГОРМОНАЛЬНЫЕ СРЕДСТВА СТЕРОИДНОЙ СТРУКТУРЫ
К стероидным гормонам относят гормоны коры надпочечников (глюкокортикоиды и минералокортикоиды), а также женские и мужские половые гормоны. Все эти гормоны - физиологически активные вещества, производные циклопентанпергидрофенантрена. Предшественник всех стероидных гормонов в организме человека - прегненолон, синтезируемый из холестерина.
Стероидные гормоны влияют на внутриклеточные рецепторы, расположенные в цитоплазме клеток-мишеней. Взаимодействие стероидных гормонов с рецепторами (общая модель процесса) происходит поэтапно.
Комплекс стероидного гормона с рецептором транспортируется в ядро клетки. В ядре этот комплекс взаимодействует с эффекторными элементами, локализованными на акцепторных участках хроматина (гены).
Как показали исследования, в результате взаимодействия происходит стимуляция или ингибирование экспрессии генов; это приводит к изменению синтеза матричной РНК и белков.
31.2.1. Препараты гормонов коры надпочечников, их синтетические заменители и антагонисты
Надпочечники - парный орган, расположенный на верхнем полюсе каждой почки, состоящий из наружного вещества (коры) и внут- реннего мозгового вещества (выделяет адреналин и норадреналин). В коре надпочечников различают три зоны - клубочковую (внешнюю), пучковую и сетчатую (внутреннюю). Все три зоны синтезируют непосредственно в кровь большое количество (более 50) стероидов, называемых кортикостероидами.
Некоторые кортикостероиды имеют небольшую биологическую активность и функционируют в основном как предшественники.
Другие кортикостероиды - истинные гормоны (их всего 8), составляют 80% всех образующихся жизненно необходимых человеку кортикостероидов и обеспечивают гуморальную регуляцию адаптации к изменяющимся условиям внешней среды (важные неспецифические факторы защиты организма от стресса).
Острая недостаточность коры надпочечников приводит к снижению АД и температуры тела, нарушению всех видов обмена веществ. При развитии недостаточности коры надпочечников очень быстро может насту- пить смерть (через несколько часов). При хронической недостаточности коры надпочечников (аддисонова болезнь) отмечают снижение массы тела, потемнение кожи и слизистых оболочек, боли в животе.
Наиболее активные естественные глюкокортикоиды - гидрокортизон (кортизол) и кортизон.
В 1948 году швейцарский химик Тадеуш Рейхштейн и американский биохимик Эдвард Кендэлл впервые выделили кортикостероиды из коркового вещества надпочечников. В сентябре 1948 года американский врач Филип Хенч ввел кортизон больному ревматоидным артритом. В результате пациент (после шести лет, проведенных неподвижно вследствие сильных болей в суставах) начал самостоятельно вставать и ходить.
По преимущественному влиянию на обмен веществ основные кортикостероиды делят на две группы. Глюкокортикоиды (глюкокор- тикостероиды) синтезируются сетчатой и пучковой зонами и минералокортикоиды (минералокортикостероиды), выделяемые клубочковой зоной коры надпочечников, в большей степени (по сравнению с глюкокортикоидами) влияют на минеральный обмен (табл. 31-2).
Таблица 31-2
Метаболические эффекты кортикостероидов
Группа стероидных гормонов | Эффекты | Следствие эффекта при длительном приеме больших доз |
Глюкокорти коиды | Уменьшение активности адре- нокортикотропного гормона | Угнетение функции коры надпочечников и ее атрофия |
Снижение захвата глюкозы тканями | Развитие стероидного сахарного диабета | |
Повышение глюконеогенеза | Мышечное истощение, истончение кожи | |
Повышение уровня глюкозы в крови | ||
Повышение катаболизма белков | ||
Снижение синтеза белков (антител) | Повышение восприимчивости к инфекциям | |
Повышение катаболизма костной ткани | Задержка роста костей (у детей) и остеопороз | |
Повышение секреции соляной кислоты и пепсина | Изъязвление слизистой оболочки желудка и пищевода | |
Перераспределение жировой ткани с верхних и нижних конечностей на туловище и лицо | Округление и покраснение лица (лунообразное лицо). Появление багровых полос растяжения кожи (стрии) | |
Возбуждение ЦНС | Стероидные психозы (от эйфории до депрессии) | |
Минерало- корти- коиды | Повышение экскреции К+ и Н+ | Задержка в организме натрия и воды. Гипокалиемия. Артериальная гипертензия. Мышечная слабость |
Повышение реабсорбции Na+ |
Аналоги естественных гормонов
• Гидрокортизон (акортин*, гидрокортизона ацетат*, кортеф*). Синтетические производные гидрокортизона
• Преднизолон (преднизолона ацетат*, преднизолона гемисукцинат*).
• Преднизон.
• Метилпреднизолон (депо-медрол*, медрол*, метипред*, солу-медрол*, урбазон*).
Фторированные синтетические производные глюкокортикоидов
• Дексаметазон (дексазон*, сондекс*).
• Триамцинолон (полькортолон*, кеналог*, фторокорт*). Глюкокортикоиды для местного применения
• Бетаметазон (целестодерм В*, целестон*).
• Клобетазол (дермовейт*).
• Метилпреднизолона ацепонат (адвантан*).
• Мометазон (элоком*).
• Флуоцинолона ацетонид (синафлан*, флуцинар*).
• Флуокортолон (ультралан*).
• Флуметазон (локакортен*, лоринден*). Препараты глюкокортикоидов
Глюкокортикоиды для ингаляционного применения
• Беклометазон (бекломет*, бекодиск*, бекотид*).
• Будесонид (апулеин*, пульмикорт*).
• Флунизолид (ингакорт*).
• Флутиказон (кутивейт*, фликсоназе*, фликсотид*).
В медицинской практике, в зависимости от требуемого эффекта, применяют три вида глюкокортикоидной терапии.
• Заместительная терапия - восполнение недостатка глюкокортикоидов в организме.
• Супрессивная терапия - подавление стероидогенеза в коре надпочечников путем торможения выработки кортиколиберина и адренокортикотропного гормона.
• Патогенетическая терапия - использование внеметаболических фармакотерапевтических эффектов глюкокортикоидов (применяют наиболее часто).
Механизмы действия и эффекты глюкокортикоидов
Главные внеметаболические эффекты глюкокортикоидов (основа их медицинского применения).
• Противовоспалительный.
• Иммуносупрессивный.
• Противоаллергический.
• Противошоковый.
Также глюкокортикоиды используют в комплексной терапии лейкозов (см. главу «Противоопухолевые средства»).
Механизм противовоспалительного действия глюкокортикоидов обусловлен несколькими факторами. Глюкокортикоиды индуцируют синтез липокортина, угнетающего активность фосфолипазы А2. Подавление фосфолипазой А2 гидролиза мембранных фосфолипидов поврежденных тканей препятствует образованию арахидоновой кислоты. При нарушении образования арахидоновой кислоты прекращается ее дальнейший метаболизм как по циклооксигеназному пути - с выключением синтеза простагландинов (см. раздел «Нестероидные противовоспалительные средства»), так и по липоксигеназному пути - с последующим ингибированием синтеза лейкотриенов. Этот эффект развивается наиболее быстро, при этом преимущественно происходит уменьшение выраженности внешних признаков (симптомов) воспалительной реакции (боль, повышение температуры, отек и покраснение тканей в области воспаления). Противовоспалительное действие глюкокортикоидов потенцируется их способностью тормозить экспрессию генов ЦОГ-2, что также приводит к снижению синтеза простагландинов в очаге воспаления, в том числе провоспалительных простагландинов Е2 и I2.
Глюкокортикоиды тормозят экспрессию молекул межклеточной адгезии в эндотелии кровеносных сосудов, нарушая проникновение нейтрофилов и моноцитов в очаг воспаления. После введения глюкокортикоидов отмечают повышение концентрации нейтрофилов в крови (за счет поступления их из костного мозга и вследствие ограничения миграции из кровеносных сосудов). Это вызывает снижение числа нейтрофилов в месте воспаления. Определяют снижение количества циркулирующих в крови лимфоцитов (Т-клеток и В-клеток), моноцитов, эозинофилов и базофилов за счет их перемещения из сосудистого русла в лимфоидную ткань. При этом происходит угнетение функции лейкоцитов, и особенно тканевых макрофагов, что ограничивает их способность реагировать на антигены, митогены, патогенные микроорганизмы, а также вырабатывать кинины и пирогенные факторы. Все эти изменения (в максимальной степени) диагностируют через 6 ч, а их исчезновение отмечают только через 24-36 ч.
Глюкокортикоиды тормозят транскрипцию генов таких провоспалительных цитокинов, как ИЛ-1, ИЛ-6, ИЛ-8 и факторы некроза опухоли (и некоторых других). Также отмечают снижение скорости транскрипции и усиление деградации генов рецепторов к ИЛ-1 и
ИЛ-2, ингибирование транскрипции генов металлопротеиназ (коллагеназы, эластазы и др.), участвующих в повышении проницаемости сосудистой стенки, в процессах рубцевания и деструкции хрящевой ткани при заболеваниях суставов.
В основе механизмов иммуносупрессивного и противоаллергического действия глюкокортикоидов [см. разделы «Иммуносупрессорные средства (иммуносупрессоры)» и «Противоаллергические средства»] лежат не только вышеописанные процессы, но и метаболические эффекты (например, торможение синтеза белков, в том числе антител).
Глюкокортикоиды оказывают противошоковое действие. Механизм противошокового эффекта глюкокортикоидов связан с уменьшением синтеза фактора активации тромбоцитов (медиатора шока), а также со снижением экстранейронального захвата и повышением прессорного действия катехоламинов.
Фармакокинетика
Пути введения и особенности химического строения глюкокортикоидов определяют их фармакокинетику. Сукцинаты, гемисукцинаты и фосфаты хорошо растворяются в воде, однако при парентеральном введении производят быстрый и кратковременный эффект. Ацетаты и ацетониды оказывают пролонгированное действие, но в воде не растворяются; поэтому их назначают в форме суспензии (внутривенно). Галогенизированные (фторированные) глюкокортикоиды обладают высокой противовоспалительной и низкой минералокортикоидной активностью. Увеличение числа атомов фтора в молекуле глюкокортикоидов приводит к снижению всасывания препарата через непов- режденную кожу.
Способ введения
Как показали исследования, наилучший эффект глюкокортикоиды производят при введении всей суточной дозы в 8 ч утра. Именно в это время наблюдают максимальную активность пучковой зоны коры надпочечников. Поэтому вероятность угнетения коры надпочечников при приеме всей суточной дозы глюкокортикоидов очень мала. Если такой метод не обеспечивает противовоспалительного эффекта, то % дозы назначают в 8 ч утра, а И дозы - в 10-12 ч;
таким образом, пациент принимает всю суточную дозу препарата в первой половине дня. При тяжелых состояниях возникает необхо- димость трехкратного или даже четырехкратного приема препарата в течение суток (утром, 2 раза днем и на ночь; при этом большую часть дозы лекарственного средства принимают утром). При необходимости длительного введения большого количества глюкокортикоидов назначают удвоенную поддерживающую дозу препарата, принимаемую через день. Это позволяет уменьшить вероятность подавления функции коры надпочечников и ее атрофии, так как в свободный от приема препарата день происходит повышенный выброс кортикотропина гипофизом, что стимулирует пучковую зону коры надпочечников. Побочные эффекты.
Глюкокортикоиды используют, как правило, при неэффективности других методов лечения, при этом нередко отмечают различные побочные эффекты.
Локальные осложнения длительного применения глюкокортикоидов.
• Местная атрофия и снижение защитных свойств кожи и слизистых оболочек.
• Нарушения пигментации и роста волос.
Для профилактики развития вторичной кожной инфекции глюкокортикоиды обычно комбинируют с антимикробными средствами.
Глюкокортикоиды по принципу обратной связи угнетают гипоталамо-гипофизарно-надпочечниковую систему, уменьшают выра- ботку адренокортикотропного гормона. При резкой отмене глюкокортикоидов иногда развивается острая недостаточность коры надпочечников.
При длительном применении глюкокортикоидов возникает синдром Иценко-Кушинга. Клинические признаки, характерные для этого синдрома: изъязвление слизистой оболочки ЖКТ, тромбозы, остеопороз, обменные нарушения - стероидный сахарный диабет, угнетение синтеза и повышение распада белков, гипокалиемия, задержка натрия, сопровождающаяся отеками и артериальной гипертензией.
Внешние симптомы развившихся в результате длительной глюкокортикоидной терапии осложнений: багрово-красное лунообразное лицо, перераспределение жировой ткани (избыточное накопление на груди, животе, спине; в конечностях происходит обратный процесс - уменьшение отложения жировой ткани).
Препараты
Препараты глюкокортикоидов
• Гидрокортизон.
• Преднизолон.
• Метилпреднизолон.
• Дексаметазон.
• Бетаметазон.
• Беклометазон.
Гидрокортизон (гидрокортизона ацетат*) - аналог кортизола. Выпускают крем, мазь, раствор или суспензию для инъекций (25 или 100 мг в ампулах). Применяют при острой надпочечниковой недостаточности (внутривенно по 100 мг каждые 6-8 ч), анафилактическом шоке, воспалительных заболеваниях суставов.
Противопоказания.
• Системные инфекции.
• Склонность к тромбозам.
• Острая почечная недостаточность.
Синтетические производные кортизола (преднизолон, преднизон, метилпреднизолон) используют преимущественно в качестве системных противовоспалительных, иммуносупрессивных и противошоко- вых препаратов.
П р е д н и з о л о н - глюкокортикоид, обладающий средней продолжительностью действия. Преднизолон хорошо проникает через кожу и слизистые оболочки. Преднизолон обладает большей, чем гидрокортизон глюкокортикоидной активностью. Оказывает выраженное системное, преимущественно катаболическое, дозозависимое влияние на все виды обмена веществ в лимфоидной, жировой, соединительной ткани, мышцах и коже; по сравнению с гидрокортизоном обладает меньшим минералокортикоидным эффектом.
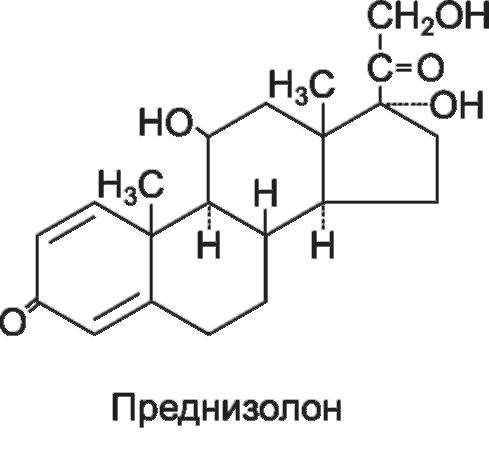
Метилпреднизолон обладает большей, по сравнению с преднизолоном, способностью накапливается преимущественно в воспаленных тканях (а не в здоровых). В отличие от преднизолона, метил- преднизолон в меньшей степени вызывает атрофию кожи, мышц, остеопороз костей. Поэтому этот препарат больше подходит для длительного применения.
При тяжелых, быстро прогрессирующих воспалительных заболеваниях проводят пульс-терапию глюкокортикоидами с использованием метилпреднизолона. Пульс-терапия - однократное внутривенное введение очень больших доз (не менее 1 г) метилпреднизолона в течение короткого времени (30-60 мин). Длительность пульс-терапии не должна превышать трех суток.
Побочные эффекты пульс-терапии метилпреднизолоном.
• Гиперемия лица.
• Изменение вкусовых ощущений.
• Боли в мышцах и суставах.
• Артериальная гипертензия.
• Гипергликемия.
Фторированные производные кортизола
Наиболее мощным (за счет большего сродства к глюкокортикоидным рецепторам) противовоспалительным действием, а также минимальным влиянием на минеральный обмен обладают фторированные производные кортизола (дексаметазон, триамцинолон, флудрокортизон).
Дексаметазон - фторированное производное преднизолона, оказывающее длительное системное действие. Благодаря наличию в молекуле дексаметазона атома фтора, это вещество в 10 раз превосходит преднизолон по противовоспалительной активности и, что немаловажно, практически не влияет на минеральный обмен. Дексаметазон (и триамцинолон) в большей степени, по сравнению с преднизолоном, активирует катаболические процессы, поэтому препарат рекомендуют применять кратковременно, только при обостре- нии заболевания и непереносимости преднизолона.
Противопоказания к назначению дексаметазона в случае его применения для контроля острых состояний (по жизненным показани- ям) отсутствуют.
Относительные противопоказания (после врачебной оценки соотношения пользы и риска).
• Туберкулез.
• Вирусные инфекции кожи и глаз.

• Системные грибковые инфекции.
• Сахарный диабет.
• Гипертоническая болезнь.
• Остеопороз.
• Психозы.
• Глаукома в анамнезе.
• Вакцинация животными вакцинами.
Побочные эффекты дексаметазона (при длительном применении препарата).
• Повышение восприимчивости к инфекциям.
• Развитие синдрома Иценко-Кушинга.
• Задержка воды и натрия (обострение гипертонической болезни).
• Потеря калия.
• Повышение хрупкости костей.
• Снижение способности поврежденной кожи к ранозаживлению.
• Повышение аппетита и, следовательно, увеличение массы тела.
• Задержка роста у детей.
Эти побочные реакции наблюдают у взрослых с возрастающей частотой при приеме больших доз (суточная доза 0,5-1 мг и более) дексаметазона в течение длительного периода времени (более одного года).
Бетаметазон - синтетический фторсодержащий глюкокортикоид длительного действия. Применяют местно. Выпускают мази и кремы (например, акридерм*, белодерм*, целестодерм В* и некоторые другие). Фторированные производные кортизола плохо всасываются через кожу и слизистые оболочки (при использовании мазей), оказывают, в основном, местный эффект, однако при их назначении отмечают снижение риска развития побочных эффектов.
Возникновение побочных системных эффектов синтетических фторсодержащих глюкокортикоидов наблюдают при использовании
мази (или крема) в течение более четырех недель и при нанесении лекарственного средства на участок кожи, по площади превышающий 10% поверхности тела.
Основные показания к применению.
• Заболевания кожи и слизистых оболочек (дерматозы, дерматиты).
• Кожные поражения при системных заболеваниях.
• Аллергические и зудящие сыпи.
Б е к л о м е т а з о н - глюкокортикоид, практически не оказывающий системного действия. При стероидзависимой (наиболее тяжелой) форме бронхиальной астмы и вазомоторных ринитах (инт- раназально) проводят аэрозольные ингаляции с беклометазоном.
Противопоказания.
• I триместр беременности.
• Наличие активного туберкулеза легких. Побочные эффекты.
• Охриплость голоса.
• Ощущение раздражения в горле, кашель, чихание.
• Парадоксальный бронхоспазм (купируют внутривенным введением теофиллина).
• Кандидоз полости рта и верхних дыхательных путей. Подробная информация о глюкокортикоидных препаратах для
ингаляционного применения изложена в разделе «Средства, применяемые при бронхиальной астме».
Препараты минералокортикоидов
• Дезоксикортикостерона ацетат*.
• Флудрокортизон (кортинефф*).
Основные минералокортикоиды - альдостерон и его предшественник дезоксикортикостерон. Секрецию этих гормонов регулирует адренокортикотропный гормон. В норме у людей, употребляющих в пищу среднее количество соли, секретируется 100-200 мкг альдостерона (t1/2 составляет 15-20 мин) и 200 мкг дезоксикортикостерона (t1/2 составляет 70 мин) в сутки.
В крови альдостерон связывается с белками плазмы крови. Примерно 70% альдостерона выводится с мочой в виде конъюгата тетрагидроальдостерона, а 30% экскретируется в свободном виде или в виде 3-оксоглюкуронида.
Механизм действия минералокортикоидов обусловлен связыванием со специфическими минералокортикоидными рецепторами в
цитоплазме клеток-мишеней, в первую очередь в клетках конечной части дистальных почечных канальцев и собирательных трубочек.
Минералокортикоиды усиливают реабсорбцию натрия в конечной части дистальных почечных канальцев и корковом отделе собирательных трубочек, в потовых и слюнных железах, слизистой оболочке ЖКТ.
Заместительную терапию минералокортикостероидами проводят при острой и хронической недостаточности коры надпочечников.
В качестве натрийзадерживающих средств в медицинской практике наиболее часто используют такие синтетические кортикостероиды, как дезоксикортикостерона ацетат* и флудрокортизон.
Дезоксикортикостерона ацетат* усиливает синтез белка - переносчика натрия в печени, усиливает реабсорбцию натрия в дистальных отделах нефрона (дистальной части дистальных почечных канальцев, в собирательных трубочках), в потовых и слюнных железах и слизистой оболочке кишечника, а также усиливает секрецию и выделение ионов калия.

Дезоксикортикостерона ацетат практически не влияет на углеводный обмен, пигментацию, эстрогенную и андрогенную активность. Показания к применению.
• Острая недостаточность коры надпочечников.
• Хроническая недостаточность коры надпочечников.
• Общая мышечная слабость. Противопоказания.
• Застойная сердечная недостаточность.
• Артериальная гипертензия.
• Атеросклероз.
• Заболевания печени и почек.
Ф л у д р о к о р т и з о н - сильнодействующий стероид, обладающий минералокортикоидными и глюкокортикоидными свойствами. Минералокортикоидную активность наблюдают при
назначении флудрокортизона в дозе 0,1 мг 2-7 раз в неделю, а глюкокортикоидную активность - при использовании более высоких доз. Флудрокортизон - наиболее широко применяемый минералокортикоид. Препарат используют (совместно с гидрокортизоном) как натрийзадерживающее средство при хронической надпочечниковой недостаточности.
Препараты антагонистов кортикостероидов
• Митотан (хлодитан*).
• Аминоглутетимид (мамомит*, ориметен*).
• Метирапон*.
• Спиронолактон (альдактон*, верошпирон*).
Антагонисты кортикостероидов оказывают ингибирующее действие на синтез гормонов коры надпочечников.
Митотан и аминоглутетимид - неселективные ингибиторы синтеза кортикостероидов, блокирующие превращение холестерина в прегненолон и вызывающие уменьшение образования всех гормонально активных стероидов. Их применяют для лечения гормонально активных опухолей надпочечников и синдрома Иценко-Кушинга. Аминоглутетимид назначают в комбинации с дексаметазоном для снижения или полной блокады продукции эстрогенов и андрогенов у больных, страдающих карциномой молочной железы. Дневная доза аминоглутетимида (хорошо переносимая пациентами) составляет 1 г; при назначении более высоких доз препарата нередко отмечают сонливость.
Метирапон * (при назначении малыхдоз) обладает селективным действием, угнетает синтез кортизола и кортикостерона. Метирапон используют для диагностики и лечения синдрома Иценко-Кушинга.
С п и р о н о л а к т о н - селективный антагонист альдостерона, применяемый в качестве диуретического средства (см. раздел «Антагонисты альдостерона»).
31.2.2. Препараты половых гормонов, их синтетических заменителей и антагонистов
В группу препаратов половых гормонов входят препараты эстрогенов, селективные модуляторы эстрогеновых рецепторов и антагонисты эстрогенов; препараты гестагенов и их антагонистов, а также препараты андрогенов и их антагонистов.
По химическому строению половые гормоны - стероидные соединения. Их общий предшественник - ХС. В организме между поло- выми гормонами существует тесная взаимосвязь. Так, метаболит прогестерона 17-гидроксипрогестерон - предшественник в синтезе тестостерона и эстрогенов (эстрадиола и эстрона), а эстрогены - ароматизированные производные андрогенов (андростендиона и тестостерона).
В зависимости от вызываемых физиологических эффектов выделяют женские и мужские половые гормоны.
31.2.2.1. Препараты женских половых гормонов
Синтез половых гормонов происходит в яичниках. Их фолликулы вырабатывают эстрогенные гормоны, с активностью которых связано развитие первичных и вторичных половых признаков и фолликулярная (пролиферативная) фаза менструального цикла. В начале фолликулярной фазы под влиянием импульсной секреции гонадотропин-рилизинг гормона гипоталамуса (гонадолиберина) происходит выделение ФСГ из передней доли гипофиза, который стимулирует рост и созревание фолликулов яичника и секрецию ими эстрогенов. Они, в свою очередь, по принципу обратной отрицательной связи угнетают продукцию гонадотропин-рилизинг гормона гипоталамуса и ФСГ гипофиза. В фолликулярную фазу цикла эстрогены подготавливают эндометрий к имплантации эмбриона. Они стимулируют пролиферацию желез, рост стромы и сосудов эндометрия, а также индуцируют синтез прогестероновых рецепторов.
В середине цикла повышение уровня эстрогенов по принципу положительной обратной связи стимулирует выброс ЛГ гипофиза, под влиянием которого наступает овуляция - из созревшего фолликула выходит яйцеклетка и через маточные трубы попадает в полость матки. На месте разрушенного фолликула образуется желтое тело, которое под влиянием ЛГ начинает вырабатывать прогестерон; начинается лютеиновая фаза цикла. Прогестерон стимулирует секреторную трансформацию эндометрия, обеспечивая оптимальные условия для имплантации.
Если происходит оплодотворение яйцеклетки и возникает беременность, желтое тело продолжает выделять в кровь прогестерон, способствующий сохранению беременности. Гормон по принципу отрицательной обратной связи угнетает образование ЛГ гипофиза и гонадотропин-рилизинг гормона гипоталамуса.
Если оплодотворения яйцеклетки не произошло, возникает атрофия желтого тела и снижение концентрации эстрогенов и прогестерона. В этот период в отсутствие гормональной стимуляции эндометрий отторгается, и происходит менструация.
Соответственно эстрогенным и гестагенным гормонам различают эстрогенные и гестагенные препараты.
Эстрогенные препараты
Основной эстрогенный гормон у женщин детородного возраста - эстрадиол, синтез которого происходит в гранулезных клетках яичников из андрогенов путем реакции ароматизации. В свою очередь, текоциты яичников синтезируют андрогены, которые через кровь поступают в гранулезные клетки. В печени происходит превращение эстрадиола в менее активные эстрогенные гормоны (эстриол и эстрон).
Синтез эстрогенов в периферических тканях происходит при участии нескольких ферментных систем. Ароматаза катализирует реакцию превращения андростендиона в эстрон. При участии эстрон сульфотрансферазы происходит превращение эстрона в эстрона сульфат (неактивная форма эстрогенов, которая выполняет роль депо эстрогенов). При снижении концентрации эстрона в крови, эстрон сульфатаза десульфирует неактивный эстрона сульфат в активный эстрон. Из эстрона эстрадиол-17β дегидрогеназа синтезирует эстрадиол. Таким образом, ароматаза, сульфатаза и эстрадиол-17β дегидрогеназа - группа ферментов, способствующих синтезу активных эстрогенов.
При попадании в кровь эстрогены образуют связь с α-глобулином и в меньшей степени с альбуминами. Несвязанные с белками плазмы эстрогены за счет высокой липофильности по механизму простой диффузии проникают через плазматическую мембрану клеток и взаимодействуют со специфическими внутриклеточными рецепторами. При связывании эстрогенов с рецептором происходит устранение ингибирующего действия белка теплового шока (шаперона) и образование из двух рецепторов димера. Димеризация приводит к перемещению рецепторного комплекса в ядро, где он взаимодействует с эстроген-чувствительными элементами ДНК. В результате этого взаимодействия происходит активация процессов транскрипции и, соответственно, ускорение синтеза специфических белков, которые обусловливают биологические эффекты эстрогенов.
Эстрогеновые рецепторы. Выделяют два типа эстрогеновых рецепторов: рецепторы-α (ERα) и рецепторы-β (ERβ). В их синтезе участвуют различные гены. Они отличаются по распределению в тканях и лигандам, которые их активируют. Эти рецепторы имеют сходное строение и состоят из 4 функциональных доменов: лигандсвязывающего, ДНК-связывающего и двух доменов, активирующих транскрипцию. Эстрогеновые рецепторы-α расположены в матке, влагалище, яичниках, а также в молочных железах, костной ткани, гипоталамусе, эндотелии и гладкомышечных клетках сосудов. Эстрогеновые рецепторы-β обнаружены в предстательной железе и яичниках, в меньшей степени - в легких, головном мозге и сосудах.
В печени происходит биотрансформация эстрогенных гормонов с образованием конъюгатов с серной и глюкуроновой кислотами, которые вместе с желчью попадают в кишечник, где осуществляется их гидролиз и всасывание. Конъюгаты эстрогенов выводятся из организма с мочой и частично с желчью.
Эффекты эстрогенов
В женском организме эстрогены обеспечивают половое созревание и развитие женских вторичных половых признаков. Они стимулируют развитие влагалища, матки, маточных труб, а также активируют рост протоков молочных желез, стромы. У женщин эстрогены участвуют в контроле овуляции и подготавливают половые органы к оплодотворению и имплантации.
Влияние на костную ткань. Эстрогены увеличивают массу костной ткани, способствуют закрытию эпифизарных зон роста как у женщин, так и у мужчин. Остеокласты и остеобласты содержат эстрогеновые рецепторы. Эстрогены активируют остеобласты и подавляют активность остеокластов. Кроме того, они тормозят действие паратгормона, способствующего мобилизации кальция из костей.
Антиатеросклеротическое действие. Эстрогены препятствуют развитию атеросклероза за счет повышения содержания ЛПВП и снижения содержания ЛПНП. Влияние эстрогенов на обмен липопротеинов связывают с их действием на эстрогеновые рецепторы гепатоцитов.
Влияние на свертывающую систему крови. В печени эстрогены активируют синтез фибриногена и витамин К-зависимых факторов свертывания крови (II, IX, X), что приводит к повышению ее свертывающей способности.
Влияние на обмен жидкости в организме. Эстрогены стимулируют переход внутрисосудистой жидкости в ткани. Возникающее при этом уменьшение объема циркулирующей крови способствует компенсаторному усилению секреции альдостерона и антидиуретического гормона, что приводит к задержке ионов натрия и воды в организме. По этой причине введение экзогенных эстрогенов может способствовать развитию отеков.
Эстрогены активируют синтез и повышают чувствительность рецепторов к прогестерону.
Влияние на тонус сосудов. Эстрогены обладают кратковременным сосудорасширяющим действием за счет активации продукции окиси азота и простациклина в эндотелии сосудов. Кроме того, они стимулируют синтез эндотелиальных клеток и ингибируют пролиферацию гладкомышечных клеток сосудов.
У женщин в период постменопаузы происходит значительное снижение содержания эстрогенных гормонов, при этом основным источником эстрогенов становится жировая ткань, где под влиянием ароматазы происходит ароматизация синтезируемого в надпочечниках андростендиона с образованием эстрона и эстрадиола. Снижение концентрации эстрогенов сопровождается у многих женщин «приливами», потливостью, сердцебиением, расстройствами сна, явлениями атрофии органов мочеполовой системы (атрофический вагинит и сухость влагалища) и развитием остеопороза.
Показания к назначению эстрогенных препаратов
Заместительная терапия при первичной недостаточности эстрогенных гормонов и связанных с этим нарушений (недоразвитие половых органов, задержка менструаций и др.).
Гормональная контрацепция и заместительная гормональная терапия в период постменопаузы с целью предупреждения и устранения климактерических нарушений (препараты эстрогенов в сочетании с гестагенами).
В зависимости от показания используют различные дозы эстрогенов.
Классификация эстрогенных препаратов
Препараты эстрогенных гормонов классифицируют по происхождению. Выделяют природные (натуральные) и синтетические эстрогены.
Природные эстрогены. К ним относят собственно эстрадиол, эфиры эстрадиола и эстриол.
Эстрадиол. После приема внутрь происходит быстрое и полное всасывание эстрадиола, однако, прежде чем попасть в систем- ный кровоток, он подвергается метаболизму с участием микрофлоры в просвете и стенке кишечника, а также в печени. При этом происходит связывание большей части эстрадиола с сульфатами и его инактивация, часть переходит в малоактивный эстрон, и только незначительная часть поступает в кровь в свободной форме и оказывает биологический эффект. По этой причине препарат внутрь назначают редко.
Высокая липофильность эстрадиола обусловливает хорошее всасывание препарата с поверхности кожи, что позволяет его использовать в виде пластыря (климара*) или геля (эстрожель*, дивигель*). При трансдермальном введении происходит постепенное повышение уровня эстрадиола в плазме крови, который и на 3-5-е сутки дости- гает плато. Выбор места аппликации не влияет на биодоступность. Чрескожное введение по эффективности не уступает пероральному приему (50 мкг в сутки эстрадиола трансдермально соответствует 1,5-2 мг в сутки перорально).
Э ф и р ы э с т р а д и о л а (эстрадиола дипропионат*) - масляные растворы, которые вводят внутримышечно. С места введения всасывание препаратов происходит медленно, и они оказывают про- лонгированное действие. Фармакологической активностью обладает эстрадиол за счет гидролиза эфиров в плазме крови.
Э с т р и о л - натуральный эстроген, обладающий избирательной активностью в отношении урогенитального тракта. Сродство эстрогеновых рецепторов к эстриолу приблизительно в 10 раз ниже, чем к эстрадиолу. Время связывания с рецептором слишком коротко, чтобы вызвать пролиферативную реакцию эндометрия, но достаточно для стимуляции слизистой оболочки влагалища, шейки матки и мочевых путей. Однако при частом введении эстриола его эстрогенное действие
становится сопоставимым с действием эстрадиола, поэтому во избежание пролиферативного эффекта лекарственные формы эстриола можно назначать не чаще одного раза в сутки в дозе, не превышающей 4 мг для перорального приема и 0,5 мг для вагинального введения.
Синтетические эстрогены. К ним относят этинилэстрадиол и местранол.
Синтетические эстрогены получили в процессе изменения структуры природных путем введения этинильной (для получения этинилэстрадиола) и метильной (для получения местранола) групп в 17-м и 3-м положении молекулы эстрадиола. Их основное отличие от природных эстрогенов - высокая эффективность при энтеральном применении.
- Э т и н и л э с т р а д и о л . При приеме внутрь метаболизм препарата происходит медленно; за счет высокой липофильности он накапливается в жировой ткани, откуда постепенно поступает в кровоток, оказывая пролонгированное действие. Он входит в состав большинства комбинированных оральных контрацептивов в связи с высокой биодоступностью по сравнению с природными эстрогенами.
- Местранол - метиловый эфир этинилэстрадиола. За счет отщепления метильной группы в печени он быстро переходит в этинилэстрадиол, который выступает его активной формой.
Побочные эффекты эстрогенных препаратов:
• тошнота, рвота, анорексия;
• усиление приступов мигрени, изменение настроения;
• нагрубание и болезненность молочных желез;
• за счет задержки ионов натрия и воды экзогенные эстрогены могут вызывать отеки и повышение массы тела;
• развитие желчно-каменной болезни в связи с повышением содержания ХС в желчи;
• увеличение риска развития тромбозов и тромбоэмболий;
• увеличение риска возникновения рака эндометрия, молочных желез и других эстрогензависимых органов половой системы, что в определенной степени связано с ускорением пролиферативных процессов.
Селективные модуляторы эстрогеновых рецепторов
К селективным модуляторам эстрогеновых рецепторов относят ЛС, которые в одних тканях взаимодействуют с эстрогеновыми рецепторами как агонисты, а в других - как антагонисты. В идеале такие
препараты должны стимулировать эстрогеновые рецепторы в тех тканях, где эстрогены оказывают положительные эффекты (кости, печень), и блокировать - в молочной железе и эндометрии, где митогенное действие эстрогенов нежелательно.
Механизм действия. Селективные модуляторы эстрогеновых рецепторов конкурируют с эстрадиолом, занимая участки его связывания на эстрогеновых α- и β-рецепторах. Однако эти рецепторы приобретают различную конформацию в зависимости от того, какой лиганд с ними связан. С активированными рецепторами могут взаимодействовать разные коактиваторы и корепрессоры, которые затем воздействуют на промотор гена-мишени. Таким образом, тканевую специфичность селективных модуляторов эстрогеновых рецепторов объясняют, во-первых, различиями в конформации рецепторов при связывании разных лигандов и, во-вторых, особым для каждого типа клеток набором коактиваторов и корепрессоров.
Классификация селективных модуляторов эстрогеновых рецепторов
По химической структуре селективные модуляторы эстрогеновых рецепторов относят к группам: трифенилэтилена (кломифен, тамоксифен и торемифен) и бензтиофена (ралоксифен).
Группа трифенилэтилена
- Кломифен блокирует эстрогеновые рецепторы в гипоталамо-гипофизарной системе, что приводит к нарушению отрицательной обратной связи и устранению ингибирующего действия эстрогенов на выделение гонадотропных гормонов гипофиза. В результате возрастает секреция ФСГ и ЛГ, что способствует созреванию фолликулов в яичниках и наступлению овуляции. Кроме того, кломифен взаимодействует с эстрогеновыми рецепторами в периферических тканях (табл. 31-3).
Применяют кломифен в качестве индуктора овуляции для лечения бесплодия, связанного с нарушением овуляции (ановуляторное бесплодие).
К побочным эффектам препарата относят приливы, нечеткость зрения, расстройства менструального цикла.
- Т а м о к с и ф е н блокирует эстрогеновые рецепторы в молочных железах, в связи с чем его назначают в постменопаузном периоде при раке молочной железы. В качестве агониста эстро- геновых рецепторов в костной ткани тамоксифен препятствует
возникновению остеопороза. Взаимодействуя с рецепторами в эндометрии по типу частичного агониста, препарат при длительном применении может способствовать развитию гиперплазии и рака эндометрия.
Таблица 31-3
Взаимодействие эстрадиола и селективных модуляторов эстрогеновых рецепторов с рецепторами в различных тканях
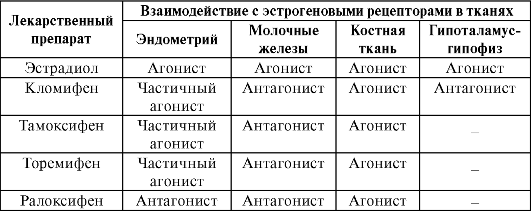
При его использовании могут возникать приливы, потливость, сердцебиение - проявления, характерные для гипоэстрогенных состояний.
- Торемифен по свойствам и применению аналогичен тамоксифену.
Группа бензтиофена
- Ралоксифен оказывает на костную ткань эстрогенное действие, а на эндометрий и молочные железы - антиэстрогенное. Препарат показан для профилактики и лечения остеопороза у женщин в постменопаузном периоде. В отличие от тамоксифена и торемифена, он не повышает риск гиперплазии и рака эндометрия.
Ингибиторы синтеза эстрогенных гормонов
Существуют ЛС, которые нарушают действие эстрогенов, блокируя их синтез. Синтез эстрогенных гормонов в яичниках нарушает гонадолиберин (при постоянном введении) и его аналоги длительного действия при сохранении синтеза эстрогенов из надпочечниковых андрогенов в периферических тканях. Поскольку образование эстрогенов из андрогенов происходит при участии ароматазы, препараты, ингибирующие этот фермент, вызывают дальнейшее угнетение образования эстрогенов.
Первым представителем этой группы был аминоглутетимид. Он блокирует ароматазу, что приводит к нарушению синтеза эстрогенов из предшественников. Однако он оказывает неизбирательное действие (помимо ароматазы препарат ингибирует ключевые стадии в синтезе гормонов коры надпочечников), что приводит к нарушению синтеза глюкокортикоидов и минералокортикодов.
В процессе поиска препаратов, нарушающих синтез эстрогенов в периферических тканях, были получены избирательные ингибиторы ароматазы. За счет подавления активности фермента эти препараты препятствуют образованию эстрона из андростендиона и эстрадиола из тестостерона в периферических тканях. Дефицит эстрогенов приводит к подавлению пролиферации эстрогензависимых тканей.
Классификация ингибиторов синтеза эстрогенных гормонов. По химическому строению выделяют стероидные и нестероидные ингибиторы синтеза эстрогенных гормонов.
Стероидные препараты. К ним относят форместан** и экземестан**. Они ковалентно образуют связь с активным центром фермента, необратимо подавляя его активность.
Нестероидные препараты. К ним относят анастрозол и летрозол - конкурентные ингибиторы ароматазы.
Ингибиторы ароматазы назначают в постменопаузном периоде при эстрогензависимом раке молочной железы.
Гестагенные препараты
Основной гестагенный гормон человека - прогестерон. Его синтез происходит из в яичниках, яичках и частично в коре надпочечников из прегненолона. Прогестерон секретирует желтое тело во время лютеиновой фазы менструального цикла и плаценту во время беременности. ЛГ стимулирует его синтез и выделение, а прогестерон, в свою очередь, по принципу отрицательной обратной связи угнетает выделение гипофизом ЛГ.
Механизм действия прогестерона
Биологические эффекты прогестерона обусловлены взаимодействием с гестагенными рецепторами, которые расположены в яичниках, молочных железах, гипоталамусе и гипофизе. Он проникает через плазматические мембраны и в цитозоле образует связь со специфическими рецепторами. В отсутствие прогестерона рецепторы связаны с белками теплового шока (шаперонами). Под действием
гормона происходит отсоединение этих белков, фосфорилирование рецепторов, что приводит к образованию гомо- и гетеродимеров, избирательно реагирующих с прогестерон-чувствительными регуляторными элементами генов-мишеней. В результате происходит активация транскрипции специфических генов, что обусловливает физиологические и морфологические изменения в органахмишенях.
Эффекты прогестерона
Влияние на матку. Прогестерон вызывает секреторную трансформацию эндометрия и способствует образованию густой и вязкой шеечной слизи, что препятствует проникновению в матку сперматозоидов. Снижая сократимость гладкой мускулатуры миометрия, он способствует сохранению беременности.
Влияние на молочные железы. Прогестерон стимулирует их рост, подготавливая к секреторной активности.
Влияние на обмен веществ:
- увеличение содержания гликогена в печени;
- активация выделения инсулина в ответ на прием углеводов;
- накопление жиров за счет повышения активности липопротеин липазы;
- уменьшение реабсорбции ионов натрия за счет конкуренции с альдостероном за связь с рецепторами.
В печени происходит инактивация прогестерона с образованием сульфатов и глюкуронидов, которые выводятся с мочой.
Классификация гестагенных препаратов
Выделяют природные и синтетические гестагенные препараты. Природные гестагенные препараты. К ним относят прогестерон.
Синтетические гестагенные препараты представлены тремя группами: производные прогестерона , производные 19-нортестостерона, или 19-норпрогестагены, производные спиронолактона.
- Производные прогестерона: медроксипрогестерон, мегестрол, дидрогестерон, ципротерон (андрокур*).
Введение метильной группы в 6-м положение молекулы прогестерона позволило получить препараты, активные при назначении внутрь (медроксипрогестерон и мегестрол).
Производные 19-нортестостерона, или 19-норпрогестагены, - соединения, в которых метильная группа в молекуле прогестерона в положении С19 заменена на водород. Выделяют производные 19-нортестосте- рона с этинильным радикалом в положении С17 (производные эстрана и производные гонана) и без этинильного остатка в положении С17.
- Производные эстрана: норэтистерон и тиболон (ливиал*).
- Производные гонана: левоноргестрел, дезогестрел, гестоден, норгестимат.
- Производные 19-нортестостерона без этинильного остатка в положении С17: диеногест.
- Производные спиронолактона (дроспейренон).
Препараты гестагенов обладают аффинитетом преимущественно в отношении гестагенных рецепторов, однако в той или иной степени они могут образовывать связь с другими типами стероидных рецепторов (андрогенными, эстрогенными, минералокортикоидными), что определяет особенности их действия.
В табл. 31-2 представлены фармакологические эффекты препаратов гестагенных гормонов.
Фармакологические эффекты гестагенных синтетических препаратов. Препараты могут оказывать гестагенный, эстрогенный и антиэстрогенный, андрогенный и минералокортикоидный эффект.
Гестагенный эффект обусловлен стимуляцией прогестероновых рецепторов и проявляется в способности подавлять выделение гонадотропных гормонов гипофиза по принципу отрицательной обратной связи, вызывать секреторную трансформацию эндометрия и способствовать сохранению беременности. Гестагенная активность наиболее выражена у производных 19-нортестостерона.
Эстрогенный эффект отмечают у норэтистерона, поскольку при его первом прохождении через печень образуются метаболиты с эстрогенной активностью.
Таблица 31-2
Фармакологические эффекты препаратов гестагенных гормонов
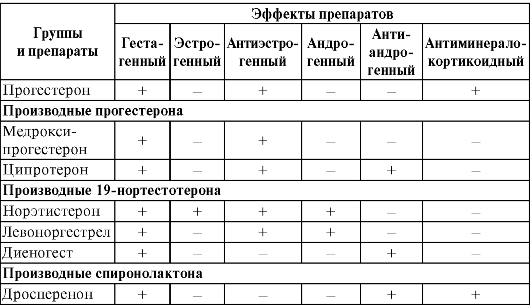
Примечания: «+» - наличие эффекта, «-» - отсутствие эффекта.
Антиэстрогенный эффект отмечают у большинства синтетических гестагенов (кроме диеногеста и дросперенона). Наличие антиэстрогенного эффекта нежелательно при проведении заместительной гормонотерапии в комбинации с эстрогенами из-за уменьшения положительных эффектов эстрогенов (повышение содержания ЛПВП и снижение ЛПНП, торможение резорбции костной ткани и др.).
Андрогенный эффект оказывают производные 19-нортестостерона (кроме диеногеста) . Наличие андрогенной активности у гестагенов имеет свои положительные и отрицательные стороны. Положительный момент - эффективность при слабости, астенизации, снижении либидо; отрицательный - увеличение массы тела, повышение уровня ЛПНП и снижения ЛПВП.
Андрогенный эффект установлен у ципротерона, диеногеста, дросперенона. Эти препараты снижают андрогензависимую секрецию сальных желез и устраняют действие андрогенов на волосяные фолликулы.
Антиминералокортикоидныйэффектоказываеттолькоодинсинтети-
ческий гестаген (дросперенон), входящий в состав комбинированного орального контрацептива ярина* (содержит 30 мкг этинилэстрадиола и 3 мг дросперенона) . Дросперенон конкурентно блокирует альдостероновые рецепторы в почечных канальцах, препятствуя задержке ионов натрия и воды, вызываемой этинилэстрадиолом. В отличие от спиронолактона дросперенон не оказывает диуретический эффект, а только препятствует задержке жидкости, вызываемой эстрогенными препаратами.
Показания к применению. Существуют многочисленные показания к использованию препаратов этой группы.
Контрацепция. Наиболее часто препараты гестагенов используют в составе комбинированных эстроген-гестагенных контрацептивов, в которых синтетические гестагены (обычно производные 19-нортестостерона и дросперенон) используют с этинилэстрадиолом .
- Контрацепция у женщин, страдающих андрогензависимыми заболеваниями (акне, гирсутизм, себорея, андрогенная алопеция). С этой целью назначают гестагены с выраженными антиандрогенными свойствами, как правило, в составе комбинированных контрацептивов (вместе с этинилэстрадиолом). Заместительная гормональная терапия в климактерическом периоде. В этом случае гестагены добавляют к эстрогенам с целью защитить эндометрий от пролиферативного действия эстрогенов и профилактики развития гиперплазии и рака эндометрия.
Все формы эндокринного невынашивания беременности с целью профилактики синдрома потери плода (назначают производные прогестерона [дидрогестерон]).
Дисфункциональные маточные кровотечения (норэтистерон, микронизированный прогестерон, дидрогестерон).
Гиперплазии эндометрия, эндометриоз, миома матки, дисфункциональные маточные кровотечения (левоноргестрел [в виде внутриматочной гормональной системы мирена*]).
Доброкачественные заболевания молочных желез у женщин позднего репродуктивного возраста (используют трансдермальные формы гестагенов).
Эндометриоз.
Гормонально зависимый рак предстательной железы, рак эндометрия. Гестагенные препараты назначают в качестве вспомогательных препаратов.
Побочные эффекты:
• бессонница;
• депрессия;
• нарушение менструального цикла;
• увеличение массы тела.
Антигестагенные препараты
К антигестагенным препаратам относят мифепристон (производное 19-норэтистерона). Препарат уменьшает действие прогестерона, конкурируя за связь с прогестероновыми рецепторами.
Показания к применению
Прерывание беременности в I триместре. С этой целью мифепристон назначают однократно внутрь, а через 48 ч применяют один из препаратов простагландина Е: мизопростол (перорально) или динопрост (интравагинально). Препараты простагландинов применяют для усиления сокращения миометрия.
Для расширения шейки матки у пациенток с доношенной беременностью при подготовке к родам.
Посткоитальная контрацепция. Мифепристон подавляет овуляцию.
Использовать мифепристон разрешено только врачам, которые могут определить срок беременности, исключить внематочную бере- менность и в случае тяжелого кровотечения оказать хирургическую помощь.
Гормональные контрацептивные средства
Гормональные контрацептивные средства используют для предупреждения нежелательной беременности. Их подразделяют на несколько групп: комбинированные эстроген-гестагенные препараты; препараты, содержащие только гестагены; экстренные (посткоитальные) контрацептивы.
Комбинированные эстроген-гестагенные препараты (комбинированные пероральные контрацептивы)
Эти препараты содержат эстроген (чаще всего этинилэстрадиол) и синтетический гестаген. Экзогенные эстрогены в пролиферативную фазу менструального цикла по принципу отрицательной обратной связи угнетают выработку ФСГ гипофиза, что замедляет рост и созре-
вание фолликулов в яичниках. Экзогенные гестагены угнетают выделение ЛГ гипофиза, что приводит к подавлению овуляции. Кроме того, под влиянием гестагенов железы шейки матки выделяют плотную вязкую слизь, затрудняющую проникновение сперматозоидов в полость матки. Снижение перистальтики маточных труб, обусловленное гестагенами, приводит к несвоевременному попаданию оплодотворенной яйцеклетки в полость матки. Под влиянием комбинированных эстроген-гестагенных препаратов возникают изменения в структуре эндометрия, что затрудняет нормальную имплантацию оплодотворенной яйцеклетки. Указанные эффекты эстрогенов и гестагенов используют для прерывания беременности.
В составе комбинированных пероральных контрацептивов гестагенные влияния значительно превышают эстрогенные, поэтому контрацептивное действие препаратов обусловлено, в основном, гестагенным компонентом. Роль эстрогенов заключается в потенцировании ингибирующего действия гестагенов на секрецию гонадотропных гормонов гипофиза.
В связи с тем, что систематический прием эстрогенов может способствовать развитию тромбозов (эстрогены стимулируют синтез прокоагулянтов в печени), содержание эстрогенов в таблетках обычно не превышает 35 мкг.
Классификация комбинированных пероральных контрацептивов по схеме комбинации эстрогена и гестагена
Выделяют 3 основных типа препаратов: монофазные, двухфазные и трехфазные.
Монофазные контрацептивы. К ним относят препараты, содержащие постоянную на протяжении всего цикла приема дозу эстрогена и гестагена. К монофазным препаратам, содержащим низкие дозы эстрогенов относят:
- диане-35* (этинилэстрадиол 35 мкг и ципротерон 2 мг);
- жанин* (этинилэстрадиол 30 мкг и диеногест 2 мг);
- ярина* (этинилэстрадиол 30 мкг и дросперенон 3 мг);
- логест* (этинилэстрадиол 20 мкг и гестоден 75 мкг);
- фемоден* (этинилэстрадиол 30 мкг и гестоден 75 мкг);
- минизистон* (этинилэстрадиол 30 мкг и левоноргестрел 125 мкг). В связи с цикличностью продукции женских половых гормонов
применяют двух- и трехфазные препараты.
Двухфазные препараты (в настоящее время их практически не используют). Содержание эстрогена во всех таблетках одинаково; доза гестагена увеличена во второй фазе приема. К ним относят:
- антеовин (этинилэстрадиол 50 мкг и левоноргестрел 0,05 и 0,125 мг).
Трехфазные препараты. В этих препаратах увеличение дозы гестагена происходит двухступенчато. К ним относят:
- триквилар* (этинилэстрадиол 30, 40 и 30 мкг и левоноргестрел 0,05, 0,075 и 0,125 мг);
- три-мерси* (этинилэстрадиол 35, 30 и 30 мкг и дезогестрел 0,05, 0,1 и 0,15 мг).
Комбинированные эстроген-гестагенные препараты содержат 21 таблетку (драже) в упаковке. Препараты начинают принимать с первого дня менструального цикла и принимают последовательно в одно и то же время в течение 21 дня; затем следует 7-дневный перерыв. При пропуске приема таблетки или увеличении интервала между приемами происходит снижение контрацептивной эффективности препаратов.
Дополнительные свойства комбинированных пероральных контрацептивов
Наряду с контрацептивным действием некоторые препараты оказывают дополнительные благоприятные эффекты, обусловленные входящим в их состав гестагеном. Выделяют комбинированные пероральные контрацептивы, обладающие антиандрогенными свойствами (диане-35*, жанин*), и препараты, сочетающие антиандрогенные и антиминералокортикоидные свойства (ярина*).
Антиандрогенное действие комбинированных пероральных контрацептивов, содержащих ципротерон (диане-35*) и диеногест (жанин*), проявляется в уменьшении роста волос при гирсутизме, торможении выпадения волос при алопеции, улучшении состояния кожи при угревой сыпи и жирной себорее. В связи с этим у женщин с признаками гиперандрогении (гирсутизм, акне, жирная себорея) предпочтительнее использовать комбинированные пероральные контрацептивы в состав которых входят гестагены с антиандрогенными свойствами. Жанин* за счет содержащегося в его составе диеногеста эффективен при эндометриозе.
Антиминералокортикоидное действие препарата ярина* обусловлено гестагеном дроспереноном, препятствующим эстрогензависимой
задержке жидкости. Благодаря этому эффекту дросперенон устраняет симптомы, связанные с задержкой ионов натрия и воды (нагрубание молочных желез, увеличение массы тела, повышение АД). За счет наличия антиандрогенной активности уменьшает проявления угревой сыпи, себореи и гирсутизма. Кроме того, ярина* подавляет симптомы предменструального синдрома.
Коррекция нарушений менструального цикла. Помимо предупреждения беременности комбинированные пероральные контрацептивы эффективны при нарушениях менструального цикла. У многих женщин он становится более регулярным, происходит уменьшение объема кровопотери, реже возникают железодефицитная анемия, боль внизу живота перед менструацией.
Снижение риска развития рака тела матки и яичников. Такое действие обусловлено гестагенами, которые блокируют митогенный эффект эстрогенов на протяжении всего цикла их приема.
Побочные эффекты комбинированных пероральных контрацептивов
Побочные эффекты со стороны ЖКТ: тошнота, крайне редко рвота.
Побочные эффекты со стороны репродуктивной системы: межменструальные кровянистые выделения, аменорея, нагрубание и болезненность молочных желез.
Побочные эффекты со стороны сердечно-сосудистой системы.
На фоне приема препаратов могут возникать отеки и повышаться АД. У некоторых женщин прием комбинированных контрацептивов вызывает головную боль.
Этинилэстрадиол, входящий в состав пероральных контрацептивов, вызывает повышение концентрации факторов свертывания, что может способствовать образованию тромбов как венозных, так и артериальных. Однако у здоровых некурящих женщин одновременно активируется система фибринолиза, поэтому в целом свертываемость крови практически не изменяется. У курящих женщин этот компенсаторный эффект уменьшен, из-за чего возрастает риск тромбоэмболии. По этой причине применение комбинированных оральных контрацептивов у курящих женщин противопоказано.
Гестагенные контрацептивы
Эти препараты содержат только гестагены (левоноргестрел, дезогестрел, норэтистерон и др.). Различают гестагенные пероральные
контрацептивы («мини-пили») и внутриматочные гестаген-содержащие контрацептивы.
Гестагенные пероральные контрацептивы
Они содержат микродозы (30-500 мкг) гестагенов. По механизму действия они отличаются от комбинированных эстроген-гестагенных препаратов. Овуляция при их использовании у большинства женщин сохраняется; противозачаточное действие связано с повышением вязкости шеечной слизи, нарушением координированных сокращений маточных труб и процесса имплантации. Отсутствие эстрогенного компонента снижает контрацептивную эффективность «мини-пили». К основным преимуществам контрацепции с использованием пероральных гестагенных препаратов относят отсутствие эстрогензависимых осложнений.
К «мини-пили» относят: экслютон* (500 мкг линэстренол) и чарозетта* (75 мкг дезогестрела).
Показания к назначению:
- послеродовая контрацепция у кормящих женщин, поскольку чистые гестагены не влияют на количество и качество материн- ского молока, а также на продолжительность лактации;
- контрацепция у женщин в позднем репродуктивном возрасте и у курящих женщин, но при строгом соблюдении режима приема препаратов.
Их принимают в постоянном режиме (ежедневно), без перерывов, по одной таблетке с первого дня менструального цикла в одно и то же время.
Побочные эффекты гестагенных контрацептивов:
- нарушение менструального цикла;
- метроррагии (нерегулярные маточные кровотечения).
Внутриматочные гестагенсодержащие контрацептивы
К ним относят внутриматочную систему с левоноргестрелом (мирена*) - полиэтиленовую Т-образную систему с мягкими гибкими горизонтальными ветвями. На ее вертикальном стержне раз- мещен резервуар, содержащий 52 мг левоноргестрела. Покрывающая резервуар мембрана обеспечивает непрерывное выделение гормона со скоростью 20 мкг/сут. Мирену* вводят в полость матки, и эффект ее сохраняется на протяжении 5 лет.
Внутриматочное введение левоноргестрела подавляет пролиферацию эндометрия и способствует образованию вязкой (густой) слизи,
которая предупреждает проникновение спермы в матку, угнетает подвижность и функции сперматозоидов в матке и маточных трубах. У некоторых женщин происходит угнетение овуляции. Совокупность перечисленных механизмов обеспечивает контрацептивный эффект препарата, который используют для длительной контрацепции (до 5 лет), особенно у рожавших женщин, а также с целью защиты эндометрия от гиперплазии во время заместительной терапии эстрогенами.
В связи с тем, что мирена* действует преимущественно локально, системные побочные эффекты (головная боль, изменение настроения, акне, гирсутизм) возникают редко.
Экстренные (посткоитальные) контрацептивы
К этой группе относят препараты, которые женщина может использовать для предупреждения беременности после полового акта без предохранения. Экстренную контрацепцию нельзя рекомендовать в качестве способа постоянного предохранения от беременности даже при редких половых актах.
Механизм действия посткоитальных контрацептивов - подавление или задержка овуляции, нарушение процессов оплодотворения, транспорта и имплантации яйцеклетки. Известно, что жизнеспособ- ность сперматозоидов в половом тракте женщины сохраняется от 3 до 7 сут, а неоплодотворенной яйцеклетки - 12-24 ч. В связи с этим назначать посткоитальные контрацептивы целесообразно в первые 24-72 ч после полового контакта.
Для экстренной гормональной контрацепции применяют: эстрогены, комбинированные эстроген-гестагенные препараты, гестагены, даназол и мифепристон.
Эстрогены. Экстренная контрацепция эстрогенами (этинилэстрадиол 0,5 мг в течение 5 дней) - высокоэффективна, однако побочные эффекты в виде тошноты и рвоты возникают часто. Кроме того, возможны осложнения, связанные с гиперкоагуляцией и риском тромбообразования.
Комбинированные эстроген-гестагенные препараты (этинилэстрадиол 0,1 мг и левоноргестрел 0,5 мг) принимают в первые 72 ч после незащищенного полового акта. Через 12 ч прием тех же доз препаратов повторяют. Могут возникать побочные эффекты в виде тошноты, рвоты, головокружения, болезненности молочных желез.
Гестагены. С целью экстренной контрацепции используют гес- тагенный препарат постинор*, содержащий 0,75 мг левоноргес-
трела. Его назначают двухкратно с перерывом в12 чв течение 48-72 ч после незащищенного полового акта. Контрацептивная эффективность препарата высокая. Основной недостаток - побочные эффекты в виде меноррагий (длительные и обильные маточные кровотечения), нарушение менструального цикла, тошнота, головные боли, головокружение. Его можно назначать только в экстренных, исключительных случаях, не чаще, чем раз в полгода, и только под контролем врача. Самостоятельное и регулярное использование препарата без наблюдения у врача может привести к тяжелым осложнениям.
Даназол - синтетический препарат стероидной структуры, производное 17а-этинилтестостерона. По фармакологическим свойствам препарат относят к частичным агонистам гестагеновых рецепторов. Стимулируя гестагеновые рецепторы в гипоталамусе и гипофизе, препарат угнетает выделение гонадолиберина и гонадотропных гормонов гипофиза. Это, в свою очередь, приводит к торможению овуляции и атрофии эндометрия. В качестве средства экстренной контрацепции его рекомендуют принимать дважды по 400 мг с интервалом в 12 ч в течение 72 ч после незащищенного полового акта.
Мифепристон - синтетический антагонист прогестерона. В качестве средства экстренной контрацепции препарат применяют в дозе 600 мг однократно в течение 72 ч после незащищенного полового акта или по 200 мг с 23-го по 27-й день менструального цикла. При назначении мифепристона возникает задержка менструации.
Средства заместительной гормональной терапии в климактерическом периоде
Заместительную гормональную терапию в климактерическом периоде назначают для устранения и предупреждения климактери- ческих нарушений у женщин.
В течение репродуктивного периода, длящегося 30-35 лет, организм женщины функционирует в условиях циклического воздействия женских половых гормонов, которые оказывают воздействие на различные органы и ткани, участвуют в обменных процессах. К 50 годам у большинства женщин происходит снижение функции яичников, и наступает климактерический период, характеризующийся недостаточностью эстрогенов. Незначительный синтез эстрогенов у женщин происходит в жировой ткани и надпочечниках за счет ароматизации андростендиона с образованием эстрона и эстрадиола.
Изменения в организме женщины, возникающие
в климактерическом периоде в связи с недостаточностью
эстрогенов:
• вазомоторные расстройства (приливы жара, ознобы, повышенная потливость, головные боли, артериальная гипоили гипертензия, учащенное сердцебиение);
• эмоционально-вегетативные расстройства (раздражительность, беспокойство, депрессия, слабость, снижении либидо);
• урогенитальные расстройства;
• поражение кожи и ее придатков (сухость, морщины, ломкость ногтей);
• развитие атеросклероза и ишемической болезни сердца;
• нарушение минерального обмена, приводящее к развитию остеопороза.
Цели заместительной гормональной терапии в климактерическом периоде:
лечебная - коррекция нейровегетативных, косметических, психо- логических и урогенитальных расстройств;
профилактическая - профилактика остеопороза и сердечно-сосудистых заболеваний.
Проблема лечения женщин в климактерическом периоде была актуальна во все времена. Первые упоминания о климактерических расстройствах обнаружили еще в египетских папирусах (1500 год до н. э.). Первый научный труд, посвященный климактерическим расстройствам, был издан в 1710 году в Университете Магдебурга, Германия. В 1857 году английский гинеколог Titl предположил, что менопаузальные расстройства вызваны «инволюцией яичников», а в 1893 году для устранения эмоциональных нарушений в климактерическом периоде впервые выполнили подкожную инъекцию экстракта яичников. В 20-30-х годов XX в. были разработаны методы промышленного получения эстрогенов, а в 1928 году в Европе появился первый эстроген-содержащий препарат для терапии климактерических расстройств прогинон* (производитель Shering, Германия) - высокоочищенный экстракт из мочи беременных женщин. В 1942 году в США был зарегистрирован препарат премарин*, содержащий конъюгированные лошадиные эстрогены, и с того времени эстрогены начали широко использовать для терапии климактерических расстройств.
Для заместительной гормонотерапии применяют различные препараты половых гормонов. При этом используют как пероральное, так и парентеральное введение препаратов.
Классификация препаратов, применяемых для заместительной гормонотерапии в климактерическом периоде
Для заместительной гормонотерапии применяют различные препараты половых гормонов. При этом используют как пероральное, так и парентеральное введение препаратов.
Препараты эстрогенных гормонов:
- 17β-эстрадиол (климара*, эстрожель*, дивигель*);
- эстрогены конъюгированные (премарин*). Комбинированные эстроген-гестагенные препараты:
- климодиен* (эстрадиол 2 мг и диеногест 2 мг);
- климонорм* (эстрадиол 2 мг и левоноргестрел 0,15 мг);
- климен* (эстрадиол 2 мг и ципротерон 2 мг);
- анжелик* (17β-эстрадиол 1 мг и дросперенон 2 мг). Препараты гестагенов:
- тиболон (ливиал*).
Препараты эстрогенных гормонов применяют для заместительной гормонотерапии у женщин с удаленной маткой. Назначают их непре- рывно или с 7-дневными перерывами. Эстрадиол и эстрогены конъюгированные принимают перорально, а 17β-эстрадиол используют в виде пластыря (климара*) или геля (эстрожель*, дивигель*) накожно.
Монотерапия эстрогенами повышает риск гиперплазии и рака эндометрия, поэтому у женщин с интактной маткой используют комбинированные эстроген-гестагенные препараты. Входящие в их состав гестагены, с одной стороны, защищают эндометрий от пролиферативного действия эстрогенов, а с другой - вызывают секреторную трансформацию эндометрия. Среди гестагенов, которые назначают с целью заместительной гормонотерапии, наиболее выраженную секреторную трансформацию эндометрия вызывают диеногест и левоноргестрел.
Тиболон после приема внутрь превращается в два метаболита, один из которых обладает эстрогенной активностью, а второй оказы- вает гестагенное и андрогенное действие. Благодаря такому спектру действия препарат применяют для заместительной гормонотерапии самостоятельно, без дополнительного введения эстрогенов. Наличие андрогенной активности способствует улучшению самочувствия, ослаблению приливов, усилению полового влечения. Он также ока-
зывает антипролиферативное действие на ткань молочной железы в результате избирательного угнетения в ней сульфатазы, что приводит к нарушению процесса десульфирования эстрона и прекращению образования метаболически активного эстрона.
Для профилактики остеопороза в постменопаузном периоде назначают ралоксифен.
31.2.2.2. Препараты мужских половых гормонов (андрогенные препараты)
Основной андроген в мужском организме - тестостерон. По химическому строению его относят к С19-стероидам. У мужчин синтез тестостерона из андростендиона происходит, главным образом, в яичках в клетках Лейдига. Кроме того, его в небольшом количестве вырабатывают яичники у женщин и надпочечники у обоих полов. Предшественники тестостерона (андростендион и дегидроэпиандростерон) обладают слабой андрогенной активностью.
Секрецию тестостерона стимулирует ЛГ гипофиза, выделение которого, в свою очередь, усиливает гонадотропин-рилизинг гормон гипоталамуса. По принципу отрицательной обратной связи циркулирующий в крови тестостерон угнетает продукцию ЛГ и гонадотропинрилизинг гормона гипоталамуса.
Тестостерон оказывает разнообразное действие на многие ткани. Причина такого разнообразия заключается в превращении тестос- терона в два других стероидных гормона: дигидротестостерон и эстрадиол. Одни эффекты тестостерон вызывает сам, другие оказывает дигидротестостерон, третьи - эстрадиол.
Действие тестостерона обусловлено взаимодействием с андрогеновыми рецепторами. Рецепторы к андрогенам, как и рецепторы к другим стероидным гормонам, расположены главным образом внут- риклеточно. При связывании специфических рецепторов с андрогенами происходит активация экспрессии определенных генов, что и определяет действие андрогенов на организм.
Тестостерон играет важную роль в формировании внутренних половых органов у мальчиков во внутриутробном периоде. Во время пубертатного периода гормон за счет анаболического действия стимулирует увеличение мышечной массы; принимает участие в формировании либидо и потенции, а также в эритропоэзе.
Под влиянием фермента 5а-редуктазы часть тестостерона необратимо переходит в дигидротестостерон. Этот процесс происходит
в предстательной железе, печени, в наружных половых органах. Образующийся дигидротестостерон, также как и тестостерон, активирует андрогеновые рецепторы, но по сравнению с тестостероном обладает более высоким аффинитетом к ним. Дигидротестостерон отвечает за дифференцировку наружных половых органов по мужскому типу во внутриутробном периоде, их созревание в ходе пубертатного периода, за рост волос по мужскому типу. Кроме того, дигидротестостерон, образующийся в предстательной железе, вызывает гиперплазию ее клеток, что может приводить к развитию аденомы и рака предстательной железы.
Под влиянием фермента ароматазы (в печени, жировой ткани, яичниках, ЦНС) некоторое количество тестостерона превращается в эстрадиол, который способствует поддержанию минеральной плотности костной ткани и способствует закрытию эпифизарных зон роста в конце пубертатного периода.
Инактивация тестостерона и дигидротестостерона происходит в печени с образованием андростерона и других неактивных метаболитов.
В качестве лекарственных препаратов андрогенных гормонов применяют тестостерон, эфиры тестостерона и 17-алкиландрогены.
Тестостерон
При приеме внутрь тестостерон быстро подвергается метаболизму в печени, поэтому его можно применять только в тех лекарственных формах, которые позволяют ему попасть в системный кровоток, минуя печень. Например, используют трансдермальный путь введения с помощью пластырей или гелей, содержащих тестостерон. Ежедневное применение этих лекарственных форм позволяет поддерживать концентрацию ЛС в крови на физиологическом уровне.
Эфиры тестостерона
Путем этерификации гидроксильной группы в 17-м положении молекулы тестостерона были получены различные эфиры тесто- стерона, обладающие высокой липофильностью. Повышение липофильности способствует депонированию эфиров в жировых депо и, соответственно, пролонгации их действия. В организме происходит гидролиз эфиров тестостерона с образованием тестостерона.
Тестостерона пропионат* в виде масляного раствора вводят внутримышечно 1 раз в день, тестостерона изокапронат* вводят внутримышечно 1 раз в 3-4 нед. Существуют комбинированные препараты
для внутримышечного введения, содержащие смесь эфиров тестостерона (омнадрен*). Для приема внутрь используют капсулы, содержащие тестостерона (андриол ТК*), а также местеролон - производное дигидротестостерона.
17-алкиландрогены
В процессе поиска андрогенов, устойчивых к разрушению в печени, были получены 17-алкиландрогены. В связи с тем, что у 17-алки- ландрогенов преимущественно выражено анаболическое действие, тогда как собственно андрогенная активность невелика, эта группа носит название «анаболические стероиды». К группе 17-алкилан- дрогенов относят метилтестостерон, нандролон (ретаболил*) и др. Метилтестостерон назначают в таблетках под язык, нандролон вводят внутримышечно 1 раз в 3-4 нед.
Показания к назначению андрогенов
Заместительная терапии при дефиците тестостерона (гипогонадизме) у мужчин. Препараты назначают строго по показаниям, так как их применение ведет к уменьшению продукции эндогенного тестостерона. При длительном применении андрогенов наступает атрофия клеток, продуцирующих тестостерон.
Рак молочной железы у женщин.
Побочные эффекты андрогенов:
• задержка ионов натрия и воды, приводящая к образованию отеков;
• повышенное половое возбуждение, гипертрофия предстательной железы (у мужчин);
• ускорение закрытия эпифизов длинных костей и замедление роста (при назначении препаратов мальчикам с недостаточным половым развитием);
• маскулинизация у женщин (рост волос на лице, огрубление голоса). Андрогенные препараты противопоказаны при раке предстательной железы.
31.2.2.3. Анаболические стероиды
К анаболическим стероидам относят 17-алкиландрогены (нандролон и др.). Так же, как и андрогены, они стимулируют синтез белков и кальцификацию костей. В то же время, специфическое андрогенное действие у этих препаратов выражено в меньшей степени.
Показания к назначению:
• мышечная дистрофия;
• остеопороз.
Для достижения лучших результатов некоторые спортсмены прибегают к допингу, том числе используют андрогены. В спортивной медицине анаболические стероиды относят к запрещенным веществам, и обнаружение их в моче спортсмена ведет к дисквалификации.
Побочные эффекты. При применении анаболических стероидов возникают побочные эффекты, связанные с их андрогенным действием:
• ускорение заращивания эпифизов длинных костей, задержка роста, вирилизация, раннее половое созревание (у детей);
• маскулинизация, понижение голоса, нарушения менструального цикла, гирсутизм, алопеция, акне (у женщин);
• повышение агрессивности, раздражительность, колебание настроения, депрессия, угнетение сперматогенеза, атрофия яичек (у мужчин).
• повышение АД;
• нарушение функций печени;
• гиперлипидемия.
31.2.2.4. Антиандрогенные препараты
Антиандрогенные препараты нарушают образование андрогенных гормонов или блокируют связывание андрогенов с андрогеновыми рецепторами.
Препараты, нарушающие образование андрогенов
Финастерид (проскар*) ингибирует 5α-редуктазу в предстательной железе, что препятствует восстановлению тестостерона в дигидротестостерон. Снижение образования дигидротестостерона приводит к уменьшению его стимулирующего влияния на пролиферацию клеток предстательной железы; это приводит к уменьшению размеров железы. Финастерид используют при доброкачественной гиперплазии предстательной железы; назначают внутрь.
Он оказывает тканеспецифичное антиандрогенное действие, поскольку его эффекты распространяются только на те ткани, где гормональной активностью обладает преимущественно дигидротестостерон (предстательная железа и наружные половые органы).
Препараты, блокирующие андрогеновые рецепторы
Флутамид и бикалутамид- нестероидные конкурентные антагонисты андрогеновых рецепторов. Применяют эти препараты в сочетании с аналогами гонадолиберина при раке предстательной железы. Флутамид назначают 3 раза в сутки, бикалутамид - 1 раз.
Ципротерон - производное прогестерона, частичный агонист андрогеновых рецепторов. Препарат подавляет секрецию гона- дотропных гормонов гипофиза и уменьшает эффекты андрогенов в периферических тканях.
Показания к назначению:
• у мужчин препарат применяют для снижения гиперсексуальности и при раке предстательной железы в сочетании с аналогами гонадолиберина;
• у женщин - при акне и явлениях маскулинизации.
Дозы ципротерона в зависимости от показаний к применению значительно различаются. Так, при лечении акне ципротерон назначают в дозе 2 мг в сутки, при гиперсексуальности - 100 мг в сутки, а при раке простаты - 300 мг в сутки.