Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
ГЛАВА 27 СРЕДСТВА, ВЛИЯЮЩИЕ НА ГЕМОСТАЗ И ТРОМБООБРАЗОВАНИЕ
Система гемостаза выполняет в организме следующие основные функции:
• поддерживает кровь в сосудах в жидком состоянии, что необходимо для нормального кровоснабжения органов и тканей;
• обеспечивает остановку кровотечения при повреждении сосудистой стенки.
Остановка кровотечения (гемостаз - от греческого hemo - кровь, stasis - остановка) достигается при участии нескольких механизмов. После повреждения сосудистой стенки возникает спазм сосудов. Эта немедленная реакция на травму может остановить кровотечение только при незначительных повреждениях мелких сосудов. В основном остановка кровотечения достигается благодаря образованию тромбов, которые препятствуют кровопотере, закрывая место повреждения. Такое локальное образование тромбов (гемостатических пробок) при повреждениях сосудов является защитной реакцией.
Однако при определенных условиях тромбы образуются внутри сосудов, закрывая их просвет и препятствуя нормальному кровотоку. Внутрисосудистое образование тромбов может происходить при пато- логических изменениях эндотелия сосудов, включая его повреждения, связанные с атеросклерозом, повышением артериального давления или другими факторами. Причиной образования тромбов могут быть также аномальные изменения кровотока (например, снижение его скорости) или недостаточность некоторых белков, препятствующих тромбообразованию.
Тромбообразование происходит при участии двух основных процессов: агрегации тромбоцитов и свертывания крови (гемокоагуляции).
Агрегация тромбоцитов - это объединение тромбоцитов в конгломераты (агрегаты) различной величины и плотности. Этот процесс инициируется при повреждении сосудистой стенки. В месте повреждения тромбоциты вначале связываются с фактором Виллебранда и коллагеном субэндотелиального слоя (происходит адгезия тромбоцитов). Взаимодействие с коллагеном вызывает активацию тромбоцитов (рис. 27-1). При этом сами тромбоциты становятся источниками веществ, стимулирующих агрегацию, таких как тромбоксан A2, АДФ,
серотонин. Тромбин, который образуется локально в процессе свертывания крови, также индуцирует агрегацию тромбоцитов. Кроме того, индукторами агрегации являются катехоламины, фактор активации тромбоцитов и некоторые другие эндогенные вещества.
Агрегации тромбоцитов препятствуют простациклин и эндотелиальный релаксирующий фактор, которые образуются клетками эндотелия сосудов и высвобождаются в кровоток. При повреждении эндотелиальных клеток синтез этих веществ снижается и на таком фоне действие веществ, стимулирующих агрегацию, доминирует. В результате тромбоциты объединяются в агрегаты, из которых формируется тромбоцитарный тромб.
Тромбоцитарный тромб становится более прочным благодаря нитям фибрина, который образуется в процессе свертывания крови. Основные участники этого процесса - белки плазмы крови, называемые факторами свертывания крови.
Плазменные факторы свертывания синтезируются в печени и циркулируют в крови в неактивной форме. При повреждении сосудистой стенки происходит быстрая активация фактора VII при участии тканевого фактора - трансмембранного белка, который синтезируется различными клетками (в том числе активированными эндотелиальными клетками) и в норме с кровью не контактирует. Экспрессия тканевого фактора на поверхности клеток при повреждении эндотелия значительно ускоряет активацию фактора VII (превращение его в фактор VIIa) в присутствии ионов Са2+. Под действием фактора VIIa (в комплексе с тканевым фактором) происходит последовательная активация других факторов свертывания крови (IX и X) в сложной аутокаталитической системе, называемой каскадом свертывания крови. В результате под действием фактора Xa образуется тромбин (фактор На), который превращает циркулирующий в крови растворимый белок фибриноген (фактор I) в нерастворимый фибрин (рис. 27-5). Фибрин полимеризуется и, заполняя пространство между тромбоцитами, укрепляет тромбоцитарный тромб. Фибриновые нити пронизывают тромб, образуя сеть, которая задерживает циркулирующие в крови эритроциты. Происходит фор- мирование красного тромба.
Свертыванию крови противодействуют вещества, которые являются естественными ингибиторами активных факторов свертывания крови.
Активации фактора Х под действием фактора VIIa препятствует ингибитор пути тканевого фактора, синтезируемый эндотелиальными
клетками. Ингибитором тромбина и некоторых других активных факторов свертывания (Xa, IXa XIa, XIIa) является антитромбин III - циркулирующий в плазме крови белок, который действует в комплексе с гепарином или гепариноподобными веществами (присутствующими на поверхности неповрежденных эндотелиальных клеток). Эти вещества во много раз ускоряют инактивацию факторов свертывания крови под действием антитромбина III.
Ингибитор необходимых для образования тромбина факторов VIIIa и Va - активированный протеин C. Этот белок синтезируется в печени при участии витамина K, циркулирует в крови в неактивной форме и активируется под действием тромбина на поверхности неповрежденных эндотелиальных клеток. Активация протеина C увеличивается при чрезмерном образовании тромбина. При локальном образовании тромбов в месте повреждения сосудистой стенки вышеназванные ингибиторы способствуют поддержанию крови в жидком состоянии, препятствуя росту тромба внутри сосуда.
Агрегация тромбоцитов и свертывание крови взаимосвязаны. Преобладание того или иного процесса в механизме тромбообразования зависит от калибра сосуда и скорости кровотока. Агрегация тромбоцитов имеет большее значение для формирования тромбов при высокой скоро- сти кровотока, т.е. в артериях. В венозных сосудах, где скорость кровотока невелика, преобладает процесс свертывания крови.
Последующая судьба тромба зависит от активности фибринолитической системы. Если эта система функционирует нормально, происходит постепенное растворение фибрина (фибринолиз) при участии фермента плазмина, который образуется из неактивного предшественника (плазминогена) под влиянием активаторов. Действию плазмина препятствуют циркулирующие в крови антиплазмины. Активаторы плазминогена нейтрализуются специфическими ингибиторами.
Нарушение процессов агрегации тромбоцитов и свертывания крови и/или повышение активности фибринолитической системы могут привести к кровоточивости, а чрезмерная активация этих процессов или угнетение фибринолиза - к возникновению внутрисосудистых тромбов (тромбозу). В результате тромбоза артериальных сосудов уменьшается приток крови к тканям и развивается их ишемия. Следствием ишемии является гибель клеток (некроз). Тромбозы могут быть причиной таких тяжелых осложнений, как инфаркт миокарда (тромбоз коронарных артерий), ишемический инсульт (тромбоз сосудов мозга) и т.д. Венозные тромбозы могут быть причиной эмболии легочной артерии.
Для предупреждения тромбозов используют вещества, которые ингибируют агрегацию тромбоцитов и свертывание крови, таким образом препятствуя образованию тромбов. При тромбозах используют также вещества, вызывающие лизис тромбов, - тромболитические (фибринолитические) средства.
Для остановки кровотечений применяют средства, повышающие свертываемость крови, и средства, угнетающие фибринолиз. Выбор тех или иных средств зависит от причины возникновения кровотечения.
Практическое значение имеют следующие группы средств, влияющих на тромбообразование.
• Средства, снижающие агрегацию тромбоцитов (антиагреганты).
• Средства, влияющие на свертывание крови.
- Средства, понижающие свертывание крови (антикоагулянты).
- Средства, повышающие свертывание крови (гемостатики).
• Средства, влияющие на фибринолиз.
- Фибринолитические (тромболитические) средства.
- Антифибринолитические средства (ингибиторы фибринолиза).
27.1. СРЕДСТВА, СНИЖАЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ (АНТИАГРЕГАНТЫ)
Тромбоциты - небольшие по размеру форменные элементы крови дисковидной формы образуются как фрагменты мегакариоцитов кос- тного мозга. Тромбоциты циркулируют в крови в течение 6-12 дней, а затем захватываются тканевыми макрофагами.
Эндотелий сосудов оказывает влияние на функциональную активность тромбоцитов. Эндотелиальные клетки выделяют в кровоток простациклин (простагландин I2) и эндотелиальный релаксирующий фактор, который идентифицируют с оксидом азота - NO. Эти вещес- тва препятствуют агрегации тромбоцитов. Кроме того, эндотелиальные клетки секретируют вещества, уменьшающие свертывание крови и способствующие лизису тромба. Все это обеспечивает антитромбогенные свойства неповрежденного эндотелия сосудов.
При повреждении эндотелия сосудов, которое может быть вызвано различными факторами (механическая травма, инфекции, атеро- склеротические изменения сосудистой стенки, повышение АД и др.), антитромбогенные свойства эндотелия снижаются, что создает условия для формирования тромба. Нарушается синтез простациклина и эндотелиального релаксирующего фактора и это облегчает контакт
тромбоцитов с поврежденной поверхностью эндотелия. Тромбоциты скапливаются в месте повреждения и взаимодействуют с субэндотелием сосудов: непосредственно или через фактор Виллебранда (его секретируют активированные тромбоциты и эндотелиальные клетки) они связываются с коллагеном и другими белками субэндотелия при участии специфических гликопротеинов, локализованных в мембране тромбоцитов. Фактор Виллебранда связывается с гликопротеином Ib, а коллаген - с гликопротеином Ia тромбоцитарной мембраны (см. рис. 27-1). Воздействие коллагена (а также тромбина, который в небольших количествах образуется локально уже на начальном этапе тромбообразования) на тромбоциты вызывает изменение их состояния - активацию. Тромбоциты меняют свою форму (из дисковидных они становятся распластанными с множеством отростков - псевдоподий) и покрывают поврежденную поверхность сосуда.
При активации тромбоциты высвобождают различные биологически активные вещества, которые в неактивированных тромбоцитах находятся в гранулах (α-гранулы, плотные гранулы). Плотные гранулы являются хранилищем веществ, стимулирующих агрегацию тромбоцитов: АДФ и серотонина. Высвобождение этих веществ из тромбоцитарных гранул происходит в результате повышения внутриклеточной концентрации Са2+ при действии на тромбоциты коллагена, тромбина и других индукторов агрегации, в том числе и самого АДФ. Высвобождаемый в кровоток АДФ стимулирует специфические (пуринергические) рецепторы, локализованные в мембране тромбоцитов. Через рецепторы, связанные с G-белками (Р2Y12-пуринергические рецепторы), АДФ вызывает угнетение аденилатциклазы и снижение уровня цАМФ, что приводит к повышению уровня Са2 в цитоплазме тромбоцитов (рис. 27-2).
Кроме того, при активации тромбоцитов повышается активность фосфолипазы А2 тромбоцитарных мембран - фермента, участвующего в образовании арахидоновой кислоты из мембранных фос- фолипидов. В тромбоцитах из арахидоновой кислоты под влиянием циклооксигеназы сначала синтезируются циклические эндопероксиды (простагландины G2/H2), а из них при участии тромбоксансин-
тетазы образуется тромбоксан А2 - активный стимулятор агрегации тромбоцитов и вазоконстриктор. После высвобождения в кровоток тромбоксан А2 стимулирует тромбоксановые рецепторы тромбоцитарных мембран. В результате через связанные с этими рецепторами Сq-белки активируется фосфолипаза C и увеличивается образование
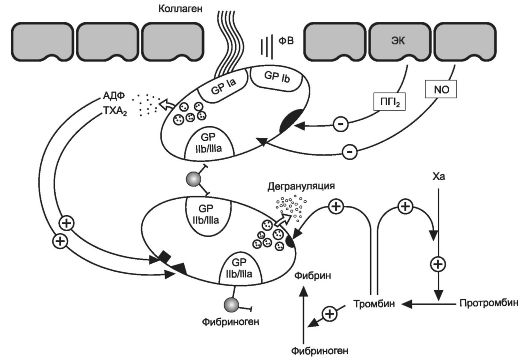
Рис. 27-1. Адгезия и агрегация тромбоцитов при поверждении сосудистой стенки: ЭК - эндотелиальная клетка; ФВ - фактор фон Виллебранда; ТхА2 - тромбоксан А2; ПГI2 - простациклин; NO - эндотелиальный релаксирующий фактор; GP - гликопротеины; GP llb/llla - гликопротеины llb/llla (Из: Katzung B.G. Bazic and Clinical Pharmacology - NY, 2001, с изм.)
инозитол-1,4,5-трифосфата, способствующего высвобождению Са2+ из внутриклеточного депо тромбоцитов (роль кальциевого депо в тромбоцитах выполняет система плотных трубочек). Это приводит к увеличению цитоплазматической концентрации Са2+ (рис. 27-2). Тромбоксан А2 вызывает повышение концентрации Са2+ и в гладкомышечных клетках сосудов, что приводит к вазоконстрикции.
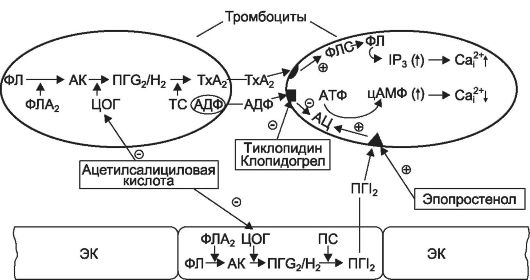
Рис. 27-2. Мехинизмы действия антиагрегантов (ацетилсалициловой кислоты, тиклопидина и эпопростенола): ЭК - эндотелиальная клетка; ФЛ - фосфолипиды клеточных мемебран; АК - архидоновая кислота; ФЛА2 - фосфолипаза А2; ЦОГ - циклооксигеназа; ТС - тромбоксансинтетаза; ПС - простациклинсинтетаза; ПГG2/H2 - циклические эндопероксиды; ТхА2 - тромбоксан А2; ПГI2 - простациклин; АЦ - аденилатциклаза; ФЛС - фосфолипаза С; IP3 - инозитол-1, 4, 5-трифосфат
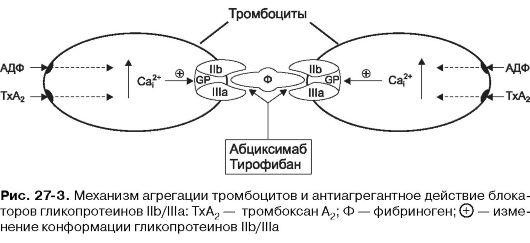
Таким образом, АДФ и тромбоксан А2 повышают уровень Са2+ в цитоплазме тромбоцитов. Цитоплазматический Са2+ вызывает изменение конформации гликопротеинов IIb/IIIa в мембране тромбоцитов, в результате чего они приобретают способность связывать фибриноген. Одна молекула фибриногена имеет два участка связывания для гликопротеинов IIb/IIIa и таким образом может объединить между собой два тромбоцита (рис. 27-3). Объединение многих тромбоцитов фибриногеновыми мостиками приводит к образованию тромбоцитарных агрегатов.
Противоположным образом на агрегацию тромбоцитов влияет простациклин (простагландин I2). Как и тромбоксан, простациклин
образуется из циклических эндопероксидов, но под действием другого фермента - простациклинсинтетазы. Простациклин синтезируется эндотелиальными клетками и высвобождается в кровоток, где сти- мулирует простациклиновые рецепторы в мембране тромбоцитов и связанную с ними через Gs-белок аденилатциклазу. В результате в тромбоцитах повышается уровень цАМФ и снижается концентрация цитоплазматического Са2+ (см. рис. 27-2). Это препятствует изменению конформации гликопротеинов IIb/IIIa и они утрачивают способность связывать фибриноген. Таким образом простациклин предупреждает агрегацию тромбоцитов. Под действием простациклина снижается концентрация Са2+ в гладкомышечных клетках сосудов, что приводит к расширению сосудов.
Можно выделить следующую последовательность основных событий, приводящих к агрегации тромбоцитов (см. схему 27-1).
Основная направленность действия антиагрегантов, которые в настоящее время применяются в клинической практике, связана с устранением действия тромбоксана А2 и АДФ, а также с блокадой гликопротеинов IIb/IIIa мембран тромбоцитов. Используют также вещества иного механизма действия, которые повышают концентрацию цАМФ в тромбоцитах и, следовательно, снижают в них концентрацию Са2+.
Выделяют следующие группы средств, уменьшающих агрегацию тромбоцитов.
Средства, ингибирующие синтез тромбоксана A2. - Ингибиторы циклооксигеназы:
ацетилсалициловая кислота.
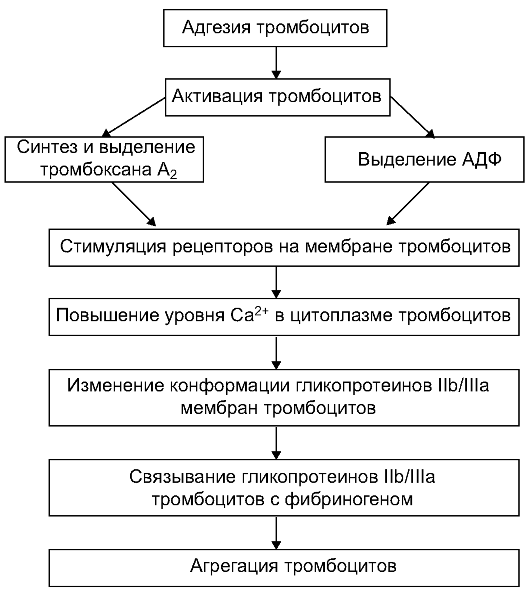
Схема 27.1. Механизм агрегации тробоцитов
- Ингибиторы циклооксигеназы и тромбоксансинтетазы: индобуфен.
Средства, стимулирующие простациклиновые рецепторы:
эпопростенол**.
Средства, препятствующие действию АДФ на тромбоциты:
тиклопидин; клопидогрел.
Средства, ингибирующие фосфодиэстеразу тромбоцитов:
дипиридамол
Средства, блокирующие гликопротеины IIb/IIIa мембран тромбоцитов.
- Моноклональные антитела: абциксимаб.
- Синтетические блокаторы гликопротеинов IIb/IIIa: эптифибатид; тирофибан.
Средства, ингибирующие синтез тромбоксана A2
Ацетилсалициловая кислота (аспирин*) - известное противовоспалительное, анальгетическое и жаропонижающее средство. В настоящее время широко применяется в качестве антиагреганта. Антиагрегантное действие ацетилсалициловой кислоты связывают с ее ингибирующим влиянием на синтез тромбоксана A2 в тромбоцитах.
Ацетилсалициловая кислота необратимо ингибирует циклооксигеназу (вызывает необратимое ацетилирование фермента) и таким образом нарушает образование из арахидоновой кислоты циклических эндопероксидов, предшественников тромбоксана A2 и простагландинов. Поэтому под действием ацетилсалициловой кислоты уменьшается не только синтез тромбоксана A2 в тромбоцитах, но и синтез простациклина в эндотелиальных клетках сосудов (см. рис. 27-2). Однако путем подбора соответствующих доз и режима применения можно добиться преимущественного действия ацетилсалициловой кислоты на синтез тромбоксана A2. Это связано с существенными различиями между тромбоцитами и эндотелиальными клетками.
Тромбоциты - безъядерные клетки - не имеют системы ресинтеза белка и, следовательно, не способны синтезировать циклооксигеназу. Поэтому при необратимом ингибировании этого фермента наруше- ние синтеза тромбоксана A2 сохраняется на протяжении всей жизни тромбоцита, т.е. в течение 7-10 дней. Вследствие образования новых тромбоцитов антиагрегантное действие ацетилсалициловой кислоты продолжается меньший период времени, и поэтому для достижения стабильного эффекта препарата (т.е. стабильного снижения уровня тромбоксана) его рекомендуют назначать 1 раз в сутки.
В клетках эндотелия сосудов происходит ресинтез циклоксигеназы, и активность этого фермента восстанавливается уже через несколько часов после приема ацетилсалициловой кислоты. Поэтому при назначении препарата 1 раз в сутки существенного снижения синтеза простациклина не происходит.
Кроме того, ацетилсалициловая кислота приблизительно на 30% подвергается пресистемному метаболизму в печени, поэтому ее концентрация в системном кровотоке ниже, чем в портальной крови. В результате на тромбоциты, циркулирующие в портальном кровотоке, ацетилсалициловая кислота действует в более высоких концентрациях, чем на эндотелиальные клетки системных сосудов. Поэтому для подавления синтеза тромбоксана A2 в тромбоцитах необходимы меньшие дозы ацетилсалициловой кислоты, чем для подавления синтеза простациклина в клетках эндотелия.
По этим причинам при увеличении дозы и кратности назначения ацетилсалициловой кислоты ее угнетающее действие на синтез простациклина становится более выраженным, что может привести к уменьшению антиагрегантного эффекта. В связи с указанными особенностями ацетилсалициловую кислоту в качестве антиагреганта рекомендуют назначать в небольших дозах (в среднем 100 мг) 1 раз в сутки.
Как антиагрегант ацетилсалициловую кислоту используют при нестабильной стенокардии, для профилактики инфаркта миокарда, ишемического инсульта и тромбозов периферических сосудов, для предупреждения образования тромбов при аортокоронарном шунтировании и коронарной ангиопластике. Ацетилсалициловую кислоту назначают внутрь в дозах 75-160 мг (по отдельным показаниям - в интервале доз от 50 до 325 мг) 1 раз в сутки на протяжении длительного времени. В настоящее время в распоряжении врачей есть препараты ацетилсалициловой кислоты, предназначенные для профилактики тромбо- зов, которые содержат 50-325 мг действующего вещества, в том числе таблетки, покрытые кишечнорастворимой оболочкой - Ацекардол*, Аспикор*, Кардиопирин*, Аспирин кардио*, Новандол*, Тромбо АСС* и др. Антиагрегантное действие ацетилсалициловой кислоты наступает быстро (в течение 20-30 мин). Лекарственные формы с кишечно- растворимой оболочкой начинают действовать медленнее, однако при длительном применении их эффективность практически не отличается от эффективности обычных таблеток. Для достижения более быстрого эффекта таблетки ацетилсалициловой кислоты следует разжевать.
Основные побочные эффекты ацетилсалициловой кислоты связаны с угнетением циклооксигеназы. При этом нарушается образование простагландинов Е2 и I2, которые оказывают антисекреторное и гастропротекторное действие (снижают секрецию хлористоводородной кислоты париетальными клетками желудка, повышают секрецию слизи и бикарбонатов). В результате даже при непродолжительном применении ацетилсалициловая кислота может вызвать повреждение эпителия желудка и двенадцатиперстной кишки (ульцерогенный эффект). Воздействие на слизистую желудка менее выражено при использовании лекарственных форм с кишечнорастворимой оболочкой. При применении ацетилсалициловой кислоты возможны желудочно-кишечные кровотечения и другие геморрагические осложнения. Риск таких осложнений ниже при назначении ацетилсалициловой кислоты в дозе 100 мг/сут и менее. Избирательное ингибирование ЦОГ приводит к активации липоксигеназного пути превращения арахидоновой кислоты и образованию лейкотриенов, обладающих бронхоконстрикторными свойствами. У больных бронхиальной астмой ацетилсалициловая кислота может провоцировать начало приступа («аспириновая астма»). Возможны аллергические реакции.
Для уменьшения ульцерогенного действия ацетилсалициловой кислоты предложен комбинированный препарат Кардиомагнил*, содержащий гидроксид магния. Гидроксид магния нейтрализует хлористоводородную кислоту желудка (антацидное действие), снижая ее повреждающее воздействие на слизистую оболочку. Препарат применяют по тем же показаниям, что и ацетилсалициловую кислоту, в том числе для вторичной профилактики ишемического инсульта.
Индобуфен (ибустрин*) уменьшает синтез тромбоксана A2, одновременно ингибируя циклооксигеназу и тромбоксансинтетазу. В отличие от ацетилсалициловой кислоты, индобуфен вызывает обратимое ингибирование циклооксигеназы. При приеме этого препарата происходит относительное увеличение количества простациклина (увеличивается соотношение простациклин/тромбоксан A2). Индобуфен подавляет адгезию и агрегацию тромбоцитов. Показания к применению и побочные эффекты такие же, как у ацетилсалициловой кислоты.
Средства, стимулирующие простациклиновые рецепторы
Еще один путь уменьшения агрегации тромбоцитов - стимуляция простациклиновых рецепторов. С этой целью используют
препарат простациклина э п о п р о с т е н о л *. Действие простациклина противоположно действию тромбоксана A2 не только на тромбоциты, но и на тонус сосудов. Он вызывает вазодилатацию и снижение АД. Этот эффект простациклина используют при легочной гипертензии. Так как простациклин быстро разрушается в крови (t1/2 около 2 мин) и поэтому действует непродолжительно, вводят препарат инфузионно. Из-за короткого действия эпопростенол* не нашел широкого применения в качестве антиагреганта. Возможная область использования антиагрегантного действия эпопростенола - профилактика агрегации тромбоцитов при экстракорпоральном кровообращении.
Средства, препятствующие действию АДФ на тромбоциты
Тиклопидин (тиклид*) - производное тиенопиридина, ингибирует агрегацию тромбоцитов, вызываемую АДФ. Тиклопидин является пролекарством, его антиагрегантный эффект связан с образованием активного метаболита при участии микросомальных ферментов печени. Метаболит тиклопидина содержит тиоловые группы, посредством которых он необратимо связывается с Р2Y12-пуринергическими рецепторами в мембране тромбоцитов. Это приводит к устранению стимулирующего действия АДФ на тромбоциты и снижению в них концентрации цитоплазматического Са2+. В результате уменьшается экспрессия гликопротеинов IIb/IIIa в мембране тромбоцитов и их связывание с фибриногеном (см. рис. 27-2). Из-за необратимого характера действия тиклопидин оказывает продолжительный антиагрегантный эффект.
Максимальный эффект при постоянном приеме тиклопидина достигается через 7-11 дней (время, необходимое для образования и развития действия активного метаболита) и после отмены препарата сохраняется в течение всего периода жизни тромбоцитов (7-10 дней).
Тиклопидин назначают для вторичной профилактики ишемического инсульта, для предупреждения тромбоза при облитерирующих заболеваниях нижних конечностей, при аортокоронарном шунтировании и стентировании коронарных артерий. Препарат эффективен при приеме внутрь, назначают 2 раза в сутки во время еды.
Применение тиклопидина ограничено в связи с его побочными эффектами. Возможны снижение аппетита, тошнота, рвота, диарея (20%), боли в животе, кожные высыпания (11-14%). Отмечено
повышение в плазме крови уровня атерогенных липопротеинов. Кровоточивость - общее осложнение при использовании антиаг- регантов. Опасным осложнением является нейтропения, которая встречается в течение первых трех месяцев лечения у 1-2,4% больных. Возможны тромбоцитопения, агранулоцитоз, очень редко - апластическая анемия. В связи с этим в течение первых месяцев лечения необходим систематический контроль картины крови.
Клопидогрел (плавикс*, зилт*) сходен с тиклопидином по химической структуре, основным эффектам и механизму действия. Как и тиклопидин, является пролекарством и подвергается превращению в печени с образованием активного метаболита. Значимое ингибирование агрегации тромбоцитов отмечено со второго дня лечения, максимальный эффект достигается через 4-7 дней. После отмены препарата действие его сохраняется в течение 7-10 дней. Клопидогрел превосходит тиклопидин по активности - в суточной дозе 75 мг он вызывает такое же снижение агрегации тромбоцитов и удлинение времени кровотечения, как и тиклопидин в суточной дозе 500 мг.
Применяют клопидогрел по тем же показаниям, что и ацетилсалициловую кислоту, при ее непереносимости. Принимают внутрь 1 раз в день независимо от приема пищи. Клопидогрел можно сочетать с ацетилсалициловой кислотой, так как препараты ингибируют разные механизмы агрегации тромбоцитов и поэтому усиливают действие друг друга (однако при таком сочетании выше опасность геморрагических осложнений).
По сравнению с тиклопидином побочные эффекты клопидогрела менее выражены (диарея - 4,5%, сыпь - 6%). Применение клопидогрела сопряжено с меньшим риском возникновения такого серьезного осложнения, как нейтропения (0,1%), реже возникает тромбоцитопения. В качестве редкого осложнения, как и при приеме тиклопидина, возможно развитие тромботической тромбоцитопенической пурпуры.
Средства, ингибирующие фосфодиэстеразу тромбоцитов
Дипиридамол (курантил*, персантин*) вначале был предложен как коронарорасширяющее средство. Позже была выявлена его способность угнетать агрегацию тромбоцитов. В настоящее время дипиридамол применяют в основном в качестве антиагреганта для профилактики тромбозов. Антиагрегантное действие дипиридамола связывают с повышением уровня цАМФ в тромбоцитах, в результате чего в них снижается концентрация цитоплазматического Ca2+. Происходит это по нескольким причинам. Во-первых, дипиридамол ингибирует фосфодиэстеразу, которая инактивирует цАМФ. Кроме того, дипири- дамол угнетает захват аденозина эндотелиальными клетками и эритроцитами и его метаболизм (ингибирует аденозиндезаминазу), тем самым повышая уровень аденозина в крови (рис. 27-4). Аденозин стимулирует А2-рецепторы тромбоцитов и повышает активность связанной с этими рецепторами аденилатциклазы, в результате в тромбоцитах увеличивается образование цАМФ и снижается уровень цитоплазматического Ca2+. Дипиридамол также повышает уровень цАМФ в гладкомышечных клетках сосудов, вызывая вазорелаксацию.
Применяют дипиридамол для профилактики ишемического инсульта, а также при заболеваниях периферических артерий (в основном в сочетании с ацетилсалициловой кислотой, так как сам дипиридамол обладает слабым антиагрегантным действием). Назначают внутрь 3-4 раза в день за 1 ч до приема пищи. В сочетании с пероральными антикоагулянтами дипиридамол назначают для предупреждения образования тромбов при митральном пороке сердца.
При применении дипиридамола возможны головная боль, головокружение, артериальная гипотензия, диспептические явления,
кожные сыпи. Опасность кровотечений меньше, чем при применении ацетилсалициловой кислоты. Дипиридамол противопоказан при стенокардии напряжения (возможен «синдром обкрадывания»).
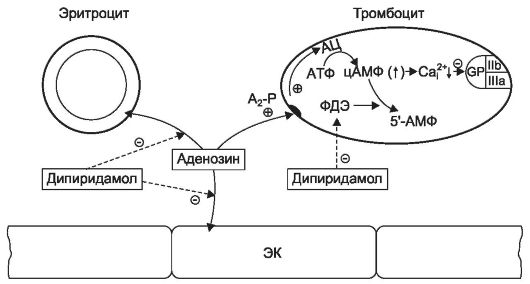
Рис. 27-4. Механизм антиагрегатного действия дипиридамола: ЭК - эндотелиальная клетка; А2-Р - аденозиновый А2-рецептор; ФДЭ -фосфодиэстераза цАМФ; АЦ - аденилатциклаза; GP IIb/IIIa - гликопротеины IIb/IIIa
Пентоксифиллин (агапурин*, трентал*), как и дипиридамол, ингибирует фосфодиэстеразу и повышает уровень цАМФ. В результате в тромбоцитах снижается уровень цитоплазматического Ca2+, что приводит к уменьшению их агрегации. Пентоксифиллин обладает и другими свойствами: повышает деформируемость эритроцитов, снижает вязкость крови, оказывает сосудорасширяющее действие, улучшая микроциркуляцию.
Пентоксифиллин применяют при нарушениях мозгового кровообращения, расстройствах периферического кровообращения раз- личного генеза, сосудистой патологии глаз (см. главу «Средства, применяемые при нарушении мозгового кровообращения»). Возможны побочные эффекты: диспептические явления, головокружение, покраснение лица, а также понижение АД, тахикардия, аллергические реакции, кровотечения. Как и дипиридамол, может провоцировать приступы при стенокардии напряжения.
Средства, блокирующие гликопротеины IIb/IIIa мембран тромбоцитов
Эта группа антиагрегантов, которые непосредственно взаимодействуют с гликопротеинами IIb/IIIa мембран тромбоцитов и нарушают их связывание с фибриногеном, появилась относительно недавно.
Абциксимаб (реопро*) - первый препарат из этой группы представляет собой «химерные» мышиные/человеческие моноклональные антитела (Fab-фрагмент мышиных антител к гликопротеинам IIb/IIIa, соединенный с Fc-фрагментом Ig человека). Абциксимаб неконкурентно ингибирует связывание фибриногена с гликопротеинами IIb/ IIIa на мембране тромбоцитов, нарушая их агрегацию (см. рис. 27-3). Агрегация тромбоцитов нормализуется через 48 ч после однократного введения. Препарат вводят внутривенно (в виде инфузии) для профи- лактики тромбоза при ангиопластике коронарных артерий. При применении абциксимаба возможны кровотечения, в том числе внутренние (желудочно-кишечные, внутричерепные, кровотечения из мочеполовых путей), тошнота, рвота, гипотензия, брадикардия, аллергические реакции вплоть до анафилактического шока, тромбоцитопения.
Поиски менее аллергогенных препаратов с таким же механизмом действия привели к созданию синтетических блокаторов гликопро- теинов IIb/IIIa. На основе барборина (пептид, выделенный из яда карликовой гремучей змеи) был получен препарат э п т и ф и б а т и д (интегрилин*) - циклический гектапептид, имитирующий аминокислотную последовательность цепи фибриногена, которая непосредственно связывается с гликопротеинами IIb/IIIa. Эптифибатид конкурентно вытесняет фибриноген из связи с рецепторами, вызывая обратимое нарушение агрегации тромбоцитов. Препарат вводят внутривенно в виде инфузии; антиагрегантный эффект наступает в течение 5 мин и исчезает через 6-12 ч после прекращения введения. Препарат рекомендован для предупреждения тромбообразования при чрескожной коронарной ангиопластике, при нестабильной стенокардии, для профилактики инфаркта миокарда. Опасное осложнение при применении эптифибатида - кровотечение; возможна тромбоцитопения.
Тирофибан (аграстат*) - непептидный блокатор гликопротеинов IIb/IIIa, аналог тирозина. Как и эптифибатид, тирофибан блокирует гликопротеиновые IIb/IIIa рецепторы конкурентно. Вводят препарат внутривенно (инфузионно). Скорость наступления эффекта, продолжительность действия и показания к применению такие же, как у эптифибатида. Побочные эффекты - кровотечения, тромбоцитопения.
Чтобы расширить возможности применения препаратов этой группы, были созданы блокаторы гликопротеинов IIb/IIIa, эффективные при введении внутрь - ксемилофибан*, сибрафибан* и др. Однако испытания этих препаратов выявили их недостаточную эффективность и побочный эффект в виде выраженной тромбоцитопении.
27.2. СРЕДСТВА, ВЛИЯЮЩИЕ НА СВЕРТЫВАНИЕ КРОВИ
Повреждение сосудистой стенки инициирует не только агрегацию тромбоцитов, но и свертывание крови. Известно множество факторов (плазменных, тканевых, тромбоцитарных), участвующих в этом процессе. Большинство из них - это белки плазмы крови, которые циркулируют в неактивном состоянии, но последовательно активируются в процессе свертывания крови. Для объяснения действия лекарственных препаратов необходимо упомянуть фактор VII (проконвертин), фактор IX (Кристмаса), фактор Х (Стюарта - Прауэр), фактор II (протромбин). Эти факторы свертывания являются проферментами и при активации превращаются в протеолитические ферменты (факторы ГХа, Ха и На). Факторы VIII и V после активации выполняют роль белков-кофакторов ферментов (факторов IXа и Ха соответственно), повышая их протеолитическую активность.
Фактор VII изначально обладает невысокой протеолитической активностью, но в результате взаимодействия с тканевым фактором (см. стр. 481) она быстро возрастает. Активированный фактор VII (фактор VIIa) вместе с тканевым фактором и Са2+ образует комплекс, вызывающий частичный протеолиз факторов IX и Х. Фактор IХа, в свою очередь, дополнительно активирует фактор Х (образуется фактор Ха). Фактор Ха действует на протромбин (фактор II) и превращает его в тромбин (фактор На). Тромбин вызывает частичный протеолиз фибриногена с образованием фибрина (рис. 27-5).
Протеолитическая активация факторов свертывания крови в значительной степени ускоряется, если они через ионы Са2+ связываются с отрицательно заряженными фосфолипидами клеточных мембран. Эти фосфолипиды выполняют роль своеобразной матрицы, на которой факторы свертывания собираются в комплексы при участии ионов Са2+. При этом скорость активации факторов в этих комплексах возрастает в 10 тысяч раз и более. Необходимым условием формирования таких комплексов является способность факторов II, VII, IX и Х связываться с Са2+. Эти факторы содержат отрицательно заряженные
остатки γ-карбоксиглутаминовых кислот, которые и обеспечивают их связывание с Са2+. Образование γ-карбоксиглутаминовых кислот происходит в печени при участии витамина K. При дефиците витамина K в крови появляются неполноценные II, VII, IX и Х факторы свертывания крови, что нарушает образование фибрина.
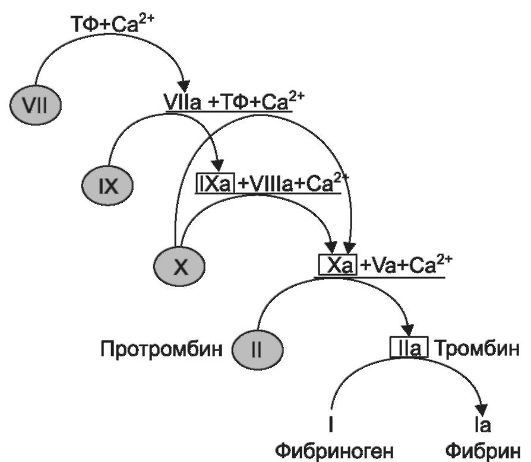
Рис. 27-5. Схема активации свертывания крови при повреждении сосудистой стенки (Из: Katzung B. G.Basic and clinical pharmacology. - NY, 2001, с изм.): жирной чертой подчеркнуты комплексы факторов свертывания крови, связанные с отрицательно заряженными фосфолипидами клеточных мембран. Комплекс VIIa + ТФ + Са2+ активирует факторы Х и IX (ТФ - тканевой фактор). Комплекс IXa + VIIIa + Ca2+ дополнительно активирует фактор Х. Комплекс Ха + Va + Са2+ (протромбиназа) способствует превращению протромбина в тромбин. Факторы, заключенные в прямоугольники, ингибируются гепарином
К белкам плазмы крови, которые содержат остатки γ-карбоксиглутаминовых кислот и образуются в печени при участии витамина K, относятся также протеины C и S. После активации протеин C (Са) вызывает протеолитическое расщепление факторов VIIIа и Уа. Это приводит к нарушению образования тромбина. Протеин S выполняет роль кофактора в реакциях протеолиза. Активация протеина C происходит под действием тромбина на поверхности интактных (неповрежденных) эндотелиальных клеток, которые экспрессируют белок тромбомодулин, связывающий одновременно протеин C и тромбин.
27.2.1. Средства, понижающие свертываемость крови (антикоагулянты)
Антикоагулянты, используемые в клинической практике, или ингибируют активные факторы свертывания непосредственно в крови, или нарушают их образование в печени. Поэтому их разделяют на 2 группы:
• Антикоагулянты прямого действия (действуют непосредственно в крови).
- Гепарин стандартный (нефракционированный).
- Низкомолекулярные гепарины:
• эноксапарин натрия;
• надропарин кальция;
• далтепарин натрия;
• ревипарин натрия.
- Гепариноиды:
• сулодексид;
• данапароид**.
- Препарат антитромбина III.
- Препараты гирудина:
• лепирудин*.
- Активированный протеин C:
• дротрекогин альфа.
• Антикоагулянты непрямого действия (угнетают синтез факторов свертывания в печени).
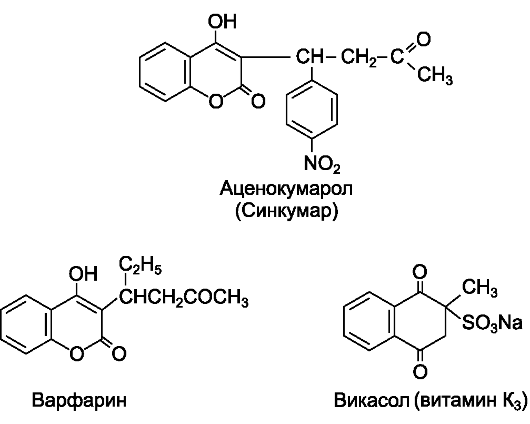
- Производные кумарина:
• аценокумарол (синкумар*) ;
• варфарин (варфарекс*) .
- Производные индандиона:
• фениндион (фенилин*) .
Антикоагулянты прямого действия
Гепарин - сульфатированный гликозаминогликан (мукополисахарид), состоящий из остатков D-глюкозамина и D-глюкуроновой кислоты. Гепарин образуется тучными клетками во многих тканях; в больших количествах его содержат печень, легкие, слизистая оболочка кишечника. Для медицинских целей гепарин выделяют из слизистой оболочки кишечника свиньи и из легких крупного рогатого скота. В процессе
выделения получают смесь фракций с различной длиной полисахаридной цепи и различной молекулярной массой (от 3000 до 40 000 Д). Фракции с различной молекулярной массой несколько отличаются по биологической активности и фармакокинетическим свойствам. Поэтому препараты гепарина, получаемые разными способами и из разных источников, могут обладать неодинаковой антикоагулянтной активностью, вследствие чего необходимо проводить их биологическую стандартизацию. Активность гепарина определяют по способности удлинять время свертывания крови (1 мг стандартного гепарина содержит 130 ЕД).
Гепарин оказывает действие на факторы свертывания крови только после образования комплекса с эндогенным антикоагулянтом антитромбином III. Антитромбин III, - гликопротеин плазмы крови, ингибирует сериновые протеазы, к которым относятся факторы свертывания крови IIа (тромбин), ЕХа и Ха (а также ХIа и ХIIа). Процесс инактивации факторов под действием одного антитромбина III протекает очень медленно. Гепарин вызывает конформационные изменения в молекуле антитромбина III, что приводит к ускорению этого процесса примерно в 1000 раз.
Основное действие комплекса гепарин-антитромбин III направлено против тромбина и фактора Ха, но механизмы ингибирования этих факторов имеют некоторые отличия. Для инактивации тромбина необходимо, чтобы гепарин связался как с молекулой антитромбина III, так и с молекулой тромбина. В то же время быстрая инактивация фактора Ха комплексом гепарин - антитромбин III не требует связывания этого фактора с гепарином. Фракции гепарина с относительно короткой полимерной цепью (менее 18 сахаридных единиц) не могут одновременно присоединять антитромбин III и тромбин, поэтому не обладают антитромбиновой активностью. Их действие в основном связано с инактивацией фактора Ха и, следовательно, с нарушением превращения протромбина в тромбин.
Кроме влияния на свертывание крови гепарин обладает и некоторыми другими эффектами: снижает уровень липидов в крови вследствие активации липопротеинлипазы (этот фермент гидролизует триглицериды), подавляет пролиферацию гладкомышечных клеток.
Гепарин плохо всасывается при введении внутрь, поэтому его вводят внутривенно, иногда подкожно. При внутривенном введении действие наступает сразу и продолжается 2-6 ч. При подкожном вве- дении гепарин начинает действовать через 1-2 ч, продолжительность действия составляет 8-12 ч (назначают 2-3 раза в сутки). Гепарин в крови связывается со многими белками, в том числе с теми, которые его нейтрализуют (тромбоцитарный фактор 4 и некоторые другие). Высокий уровень этих белков в крови может вызвать относительную резистентность к препарату. Кроме того, гепарин связывается с макрофагами и эндотелиальными клетками, при этом происходит его деградация (деполимеризация). Гепарин также метаболизируется в печени и выводится почками.
Применяют гепарин для профилактики и лечения тромбоза глубоких вен и тромбоэмболии легочной артерии, при нестабильной стенокардии и инфаркте миокарда, для предупреждения тромбоза периферических артерий, при протезировании клапанов сердца и экстракорпоральном кровообращении. Дозируют гепарин в единицах действия (ЕД).
Наиболее частые осложнения гепаринотерапии - кровотечения, причиной которых может быть угнетение функции тромбоцитов или уменьшение их количества (тромбоцитопения). Связывание гепарина с фактором Виллебранда, по-видимому, объясняет его ингибирующее воздействие на адгезию и агрегацию тромбоцитов. В таких случаях гепарин отменяют, а при серьезных кровотечениях, кроме того, вводят внутривенно протамина сульфат, который нейтрализует гепарин путем образования нерастворимого комплекса.
Тромбоцитопения возникает на 7-14-й день лечения примерно у 1-5% больных, получающих гепарин. Причиной ее является появление антител (IgG), направленных против комплекса гепарин-фак- тор 4 тромбоцитов. Этот комплекс связывается с мембраной тромбоцитов при нейтрализации гепарина фактором 4, гликопротеином тромбоцитарного происхождения, который высвобождается при агрегации тромбоцитов. Менее чем у 1% больных с тромбоцитопенией наблюдают тромбоз вследствие повреждения эндотелиальных
клеток и активации тромбоцитов антителами к комплексу гепарин- фактор 4. Это состояние требует отмены гепарина и назначения антикоагулянтов, не вызывающих тромбоцитопению: данапароид** и лепирудин**.
При длительном введении гепарина (более 3 мес) возможно развитие остеопороза. Это особенно важно учитывать при назначении гепарина во время беременности. Гиперкалиемия, связанная с инги- бированием синтеза альдостерона в надпочечниках, - довольно редкое осложнение гепаринотерапии.
Низкомолекулярные (фракционированные) гепарины состоят из фрагментов гепарина с молекулярной массой от 1000 до 10 000 Д (в среднем, 4000-5000 Д). Получают их путем фракционирования, гидролиза или деполимеризации обычного (нефракционированного) гепарина. Эти препараты, так же как и гепарин, действуют на факторы свертывания через антитромбин III, но отличаются от гепарина сле- дующими свойствами:
• в большей степени угнетают активность фактора Ха, чем фактора IIа (в 3-4 раза);
• обладают большей биодоступностью при подкожном введении (низкомолекулярные гепарины - около 90%, стандартный гепарин - 20%);
• действуют более продолжительно, что позволяет вводить их 1-2 раза в сутки;
• имеют меньшее сродство к фактору 4 тромбоцитов, поэтому реже, чем стандартный гепарин, вызывают тромбоцитопению;
• реже вызывают остеопороз.
В отечественной практике используют следующие препараты низкомолекулярных гепаринов: э н о к с а п а р и н н а т р и я (клексан*), надропарин кальция (фраксипарин*), д а л т е п а - рин натрия (фрагмин*), ревипарин натрия (кливарин*). Эти препараты неоднородны по своему составу (содержат разные фракции гепарина), поэтому несколько отличаются друг от друга по физико-химическим, фармакокинетическим свойствам и активности.
Низкомолекулярные гепарины применяют для профилактики и лечения тромбоза глубоких вен (особенно после хирургического вмешательства), для предупреждения тромбоэмболии легочной артерии, а также при нестабильной стенокардии и инфаркте миокарда. Препараты низкомолекулярных гепаринов показаны для профилак-
тики и терапии тромбозов в акушерской практике. Вводят только подкожно. Дозируют в ME (международных единицах).
Низкомолекулярные гепарины, как и препараты нефракционированного гепарина, могут вызвать кровотечения. В первые дни лечения возможна умеренная тромбоцитопения. Низкомолекулярные гепарины в ряде случаев повышают активность печеночных ферментов, могут вызвать аллергические реакции. Протамина сульфат устраняет эффекты низкомолекулярных гепаринов не полностью.
Недавно в клинической практике появился препарат ф о н д а п а - ринукс натрия- синтетический пентасахарид, который, связываясь с антитромбином III, ускоряет инактивацию фактора Ха. Препарат выпускают в виде натриевой соли, применяют для профилактики венозных тромбозов и тромбоэмболии легочной артерии в ортопедической хирургии.
Гепариноиды - сульфатированные гликозаминогликаны, родственные по структуре гепаринам. Как и гепарин, усиливают ингибирующее действие антитромбина III на факторы свертывания крови. По многим важным характеристикам отличны от гепарина и низкомолекулярных гепаринов, поэтому их выделяют в особую группу. К данной группе принадлежат данапароид* и сулодексид. Получают эти препараты из слизистой оболочки кишечника свиньи.
Данапароид** (органон**) содержит смесь гепарансульфата, дерматансульфата и хондроитинсульфата. Данапароидp более выраженно ингибирует фактор Ха, чем протромбин. Препарат вводят под кожу при профилактике и лечении венозных тромбозов. Данапароидp не связывается с фактором 4 тромбоцитов и не вызывает тромбоцитопению. Поэтому он показан в тех случаях, когда терапия гепарином осложняется тромбоцитопенией.
Сулодексид (вессел Дуэ Ф*) состоит из смеси гепарансульфата и дерматансульфата. Сулодексид в большей степени снижает активность фактора Ха, мало влияя на протромбин. Препарат повышает фибринолитическую активность, оказывает защитное действие на эндотелий сосудов, обладает гиполипидемическими свойствами. Сулодексид показан при заболеваниях периферических сосудов с повышенным риском тромбообразования. Существуют лекарственные формы препарата для парентерального (внутривенного и внутри- мышечного) введения и для приема внутрь.
Антитромбин III необходим для проявления антикоагулянтного действия гепарина, низкомолекулярных гепаринов, а также гепариноидов.
При наследственной недостаточности антитромбина III используют его препарат, вводят внутривенно. При длительном применении гепарина увеличивается потребление антитромбина III, поэтому концентрация его в крови заметно снижается. Это уменьшает эффективность проводимой гепаринотерапии. В таких случаях также вводят антитромбин III.
Гирудин - белок с молекулярной массой 7 кД, впервые обнаружен в слюнных железах медицинских пиявок Hirudo medicinalis. Гирудин, как и гепарин, относится к антикоагулянтам, действующим непосредственно в крови, но в отличие от гепарина, гирудин прямо ингибирует тромбин: селективно связывается с ним и инактивирует его без участия антитромбина III. Ингибирование носит необратимый характер. В отличие от гепарина, гирудин обладает способностью ингибировать тромбин, связанный с тромбом, и таким образом задерживает рост тромба. Гирудин не взаимодействует с фактором 4 тромбоцитов, поэтому не вызывает тромбоцитопению.
Для клинического применения получен рекомбинантный препарат гирудина - л е п и р у д и н * (рефлюдан*). Его рекомендуют использовать для профилактики возможных тромбоэмболических осложнений при тромбоцитопении, вызванной гепарином. Вводят лепирудин* внутривенно. При использовании возможны кровотечения. Специфического антидота у препаратов гирудина нет.
Дротрекогин альфа (зигрис*) - рекомбинантный препарат активированного протеина С. Ингибирует образование тромбина, вызывая протеолитическую инактивацию факторов свертывания крови VIIIа и Vа. Кроме того, дротрекогин повышает фибринолитическую активность плазмы крови, снижая количество циркулирующего в крови ингибитора активатора плазминогена типа 1. Наличие у препарата противовоспалительной активности связывают с его ингибирующим влиянием на высвобождение из моноцитов фактора некроза опухоли альфа. Все эти свойства дротрекогина определяют его эффективность при лечении септического шока (воспаление и повышение свертываемости крови - основные симптомы этого состояния). Как и другие антикоагулянты, препарат может вызвать геморрагические осложнения.
Антикоагулянты непрямого действия
Эти препараты, в отличие от гепарина, не оказывают влияния на факторы свертывания непосредственно в крови. Они ингибируют син-
тез в печени белков плазмы крови, зависимых от витамина K - фактора II (протромбин), факторов VII, IX и Х (см. рис. 27-5). Витамин K необходим для образования функционально полноценных факторов, так как выполняет роль кофермента в реакции γ-карбоксилирования остатков глутаминовых кислот. Коферментную активность проявляет восстановленная форма витамина K - гидрохинон. В процессе карбоксилировании витамин K-гидрохинон окисляется с образованием неактивного витамин K-эпоксида. Антикоагулянты непрямого действия препятствуют превращению (восстановлению) неактивного витамин K-эпоксида в активный витамин K-гидрохинон под действием эпоксидредуктазы и DT-диафоразы, ингибируя эти ферменты. Поэтому их относят к антагонистам витамина K (рис. 27-6).
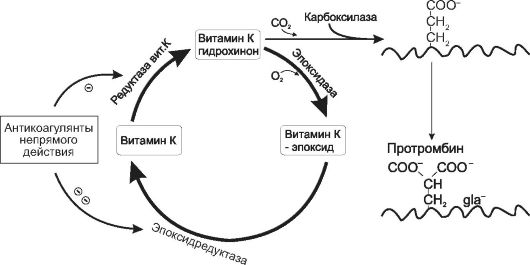
Рис. 27-6. Механизм действия витамина К и антикоагулянтов непрямого действия
Антикоагулянты непрямого действия снижают концентрацию факторов свертывания в крови не сразу. Их действие характеризуется латентным периодом. Так, антикоагулянтный эффект аценокумарола достигает максимальной величины через 48 ч и более. Такое медленное развитие эффекта объясняют тем, что при введении этих препаратов в крови еще какое-то время циркулируют полноценные факторы свертывания (скорость наступления эффекта определяется временем, в течение которого происходит деградация факторов свертывания протромбинового комплекса). Эффект антикоагулянтов непрямого действия сохраняется около 2-4 дней, препараты способны к кумуляции.
Антикоагулянты непрямого действия применяют для длительной профилактики и лечения тромбозов и тромбоэмболий (тромбозов глубоких вен, тромбоэмболии легочной артерии, тромбоэмболических осложнений при мерцательной аритмии предсердий, инфаркте миокарда, протезировании клапанов сердца), в хирургической практике для предупреждения тромбообразования в послеоперационном периоде. Вводят внутрь. Лечение проводят под обязательным контролем уровня протромбина в плазме крови путем определения протромбинового времени - показателя, величина которого зависит от содержания в крови протромбина и факторов IX и X.
Наиболее частыми осложнениями при применении антикоагулянтов непрямого действия являются кровотечения. Риск возникновения кровотечений усиливается при одновременном применении аспирина* и других антиагрегантов. Для остановки кровотечений, вызванных антикоагулянтами непрямого действия, следует вводить препараты витамина K1, концентрат протромбинового комплекса (содержит факторы II, VII, IX и X). Возможны и другие побочные эффекты: аллергические реакции, диарея, дисфункция печени, некроз кожи. Препараты антикоагулянтов непрямого действия противопоказаны при беременности: они проникают через плаценту и могут оказывать тератогенное действие (нарушают формирование скелета, так как
угнетают образование остеокальцина - витамин K-зависимого белка костной ткани). Фениндион (фенилин*) может вызвать угнетение кроветворения.
27.2.2. Средства, повышающие свертываемость крови
Средства, повышающие свертываемость крови, применяют для остановки кровотечений, поэтому их относят к гемостатическим средствам (гемостатикам), или антигеморрагическим средствам. Эта группа включает вещества, необходимые для образования факторов свертывания крови (препараты витамина K), и препараты самих факторов свертывания.
Препараты витамина K
Витамин K существует в виде двух форм - витамина K1 (филлохинон), обнаруженного в растениях, и витамина K2 - группы соединений (менахиноны) , синтезируемых микроорганизмами (в частности, микрофлорой кишечника человека). Витамины K1 и K2 - жирорастворимые соединения, производные 2-метил-1,4-нафтохинона, различа- ющиеся по длине и характеру боковой углеродной цепи. Витамин Kj получен синтетическим способом, его препарат известен под названием ф и т о м е н а д и о н . Синтезирован водорастворимый предшественник витамина K - 2-метил-1,4-нафтохинон (менадион), обладающий провитаминной активностью. Это соединение было названо витамином K3. Производное витамина K3 - менадиона натрия бисульфит - используют в медицинской практике под названием в и к а - сол*.
Витамин K необходим для синтеза в печени протромбина (фактора II) и факторов свертывания крови VII, IX и Х, а также белков С и S. Известно участие витамина K в синтезе белка костной ткани остеокальцина.
Структура всех витамин-K-зависимых белков имеет общую особенность: эти белки содержат остатки γ-карбоксиглутаминовых кислот, связывающих ионы Са2+. Витамин K-гидрохинон выполняет функцию кофермента в реакции γ-карбоксилирования остатков глутаминовых кислот (см. рис. 27-6). При недостаточности витамина K появляются неактивные предшественники факторов свертывания крови, неспособные связывать Са2+. Дефицит витамина K в организме наиболее быстро приводит к нарушению гемокоагуляции. Поэтому основными
и наиболее ранними проявлениями K-витаминной недостаточности являются кровотечения и кровоизлияния.
Препараты витамина K используют для предупреждения и остановки кровотечений и других геморрагических осложнений, вызванных недостаточностью витамина K в организме, например при геморра- гическом синдроме новорожденных. К-авитаминоз у новорожденных может быть вызван как недостаточным поступлением витамина K1, так и отсутствием микрофлоры кишечника, синтезирующей витамин K2. Для предупреждения таких осложнений рекомендуют профилактическое введение витамина K1 новорожденным в первые часы жизни.
Препараты витамина К показаны при снижении всасывания витамина K в кишечнике в связи с нарушением выделения желчи при обтурационной желтухе (желчь необходима для всасывания жирорастворимого витамина K) или с синдромом мальабсорбции (при спру, энтероколитах, болезни Крона и др.)
Препараты витамина K1 эффективны при кровотечениях, вызванных антикоагулянтами непрямого действия. Вводят их внутрь и внутривенно медленно.
Препараты витамина K могут вызывать аллергические реакции (сыпь, зуд, эритема, бронхоспазм). При внутривенном введении возникает риск анафилактоидных реакций. При применении препаратов витамина K3 (викасол*) у новорожденных существует опасность раз- вития гемолитической анемии и гипербилирубинемии.
Препараты факторов свертывания крови
Необходимость в таких препаратах возникает при недостаточности одного или нескольких факторов свертывания крови.
Антигемофильный фактор свертывания крови VIII (гемофил М*, иммунат* и др.) представляет собой сухой концентрат фактора VIII. Препараты получают из плазмы крови доноров, подвергшейся двойной вирусинактивации, стандартизируют по содержанию фактора VIII. Они более активны и безопасны, чем криопреципитат*.
Криопреципитат* - концентрат белков плазмы крови, в состав которого входят фактор VIII, фактор Виллебранда, фибронектин, а также в меньшей степени другие факторы свертывания крови и небольшие количества фибриногена.
Препараты вводят внутривенно при наследственной (гемофилия A) и приобретенной недостаточности фактора VIII. Криопреципитат*,
кроме того, используют для заместительной терапии при болезни Виллебранда (наследственная недостаточность фактора фон Виллебранда) и афибриногенемии. При введении возможны побочные реакции в виде тахикардии, артериальной гипотензии, одышки, аллергические реакции (крапивница, повышение температуры тела, анафилактический шок), а также гемолиз эритроцитов.
Все препараты факторов свертывания, получаемые из плазмы крови, имеют существенный недостаток - возможность передачи вирусных инфекций (ВИЧ, гепатита). В настоящее время получены рекомбинантные препараты фактора VIII и фактора Виллебранда, применение которых снижает риск инфицирования.
Кроме препаратов факторов свертывания, при легкой форме гемофилии A и болезни Виллебранда применяют аналог аргининвазопрессина д е с м о п р е с с и н . Десмопрессин повышает содержание фактора Виллебранда в плазме крови, способствуя его выделению из эндотелиальных клеток, и увеличивает активность фактора
VIII. Препарат вводят парентерально.
Фактор свертывания крови IX (агемфил B*, иммунин*, октанайн*) - очищенная фракция человеческой плазмы, обогащенная фактором IX. Применяют при врожденном (гемофилия B) и приобретенном дефиците фактора IX, а также при передозировке антикоагулянтов непрямого действия. Побочные эффекты такие же, как и у препаратов фактора VIII.
Эптаког альфа активированный (новосэвен*) - рекомбинантный фактор свертывания крови VIIa. Применяют при недостаточности фактора VII и других факторов свертывания (V, II,
IX, X).
Местно для остановки кровотечений из мелких капилляров и паренхиматозных органов используют препарат т р о м б и н а (полу- чают из плазмы крови доноров), а также гемостатические г у б к и (коллагеновую, желатиновую).
Для остановки маточных, легочных, почечных, кишечных и других кровотечений используют препараты лекарственных растений: листья крапивы, траву тысячелистника, траву горца перечного, траву горца почечуйного, кору калины, цветки арники, лагохилус опьяняющий. Применяют лекарственные растения в виде настоев, настоек и экстрактов внутрь и местно.
27.3. СРЕДСТВА, ВЛИЯЮЩИЕ НА ФИБРИНОЛИЗ
При образовании тромбов происходит активация фибринолитической системы, которая обеспечивает растворение (лизис) фибрина и разрушение тромба. Это приводит к восстановлению нормального кровотока.
В процессе фибринолиза неактивный плазминоген превращается в плазмин (фибринолизин) при участии активаторов плазминогена. Плазмин гидролизует фибрин с образованием растворимых пептидов. Плазмин не обладает специфичностью и вызывает также разрушение фибриногена и некоторых других факторов свертывания крови, что повышает риск развития кровотечений. Плазмин, циркулирующий в крови, быстро инактивируется α2-антиплазмином и другими ингибиторами, поэтому в норме не оказывает системного фибриногено- литического действия. Однако при определенных патологических состояниях или применении фибринолитических средств возможна чрезмерная активация плазминогена плазмы крови, что может стать причиной кровотечений.
27.3.1. Фибринолитические (тромболитические) средства
Фибринолитические средства применяют для растворения образовавшихся тромбов при коронарном тромбозе (остром инфаркте миокарда), тромбозе глубоких вен, остром тромбозе периферических артерий, тромбоэмболии легочной артерии.
В качестве фибринолитических средств применяют препараты, которые активируют плазминоген: препараты стрептокиназы, препарат тканевого активатора плазминогена, препараты урокиназы.
Препараты стрептокиназы
С т р е п т о к и н а з а (кабикиназа*) - высокоочищенный белковый препарат, получаемый из культуры β-гемолитического стрептококка. Стрептокиназа приобретает протеолитическую активность только в комплексе с плазминогеном. При введении стрептокиназы образуется эквимолярный комплекс стрептокиназа-плазминоген, превращающий плазминоген в плазмин. Стрептокиназа действует на плазминоген как в тромбе, так и в плазме крови (рис. 27-7).
Стрептокиназу вводят внутривенно капельно при остром инфаркте миокарда, вызванном тромбозом коронарных сосудов (наиболее
эффективна первые 3-6 ч), при тромбозе глубоких вен, тромбоэмболии легочной артерии, тромбозах сосудов сетчатки. Дозируют стрептокиназу в ME (международных единицах).
Частые осложнения при применении стрептокиназы - кровотечения, которые могут быть связаны как с активацией плазминогена, циркулирующего в крови (образующийся плазмин разрушает фибриноген, в результате чего снижается агрегация тромбоцитов), так и с растворением физиологических тромбов. Возможны тошнота, рвота, артериальная гипотензия. Вследствие наличия антигенных свойств стрептокиназа может вызвать аллергические реакции, включая анафилактический шок. Опасность их возрастает при повторном введении препарата. Циркулирующие в крови антитела могут инактивировать стрептокиназу и снижать эффективность терапии.
Анистреплаза ** (эминаза**) - комплекс стрептокиназы с ацилированным лизин-плазминогеном. Ацильная группа в молекуле плазминогена закрывает каталитический центр, что препятствует активации плазминогена. Препарат является пролекарством и способность превращать плазминоген в плазмин приобретает только после отщепления ацильной группы. Скорость деацилирования и, следовательно, время образования активного препарата зависит от характера ацильной группы и может составлять от 40 мин до нескольких часов. Анистреплазу** вводят внутривенно. После однократного введения фибринолитический эффект сохраняется 4-6 ч. Показания к применению и побочные эффекты такие же, как у стрептокиназы.
Препараты тканевого активатора плазминогена и урокиназы
Тканевой активатор плазминогена и урокиназа - основные физиологические активаторы плазминогена.
Тканевой активатор плазминогена продуци- руется эндотелиальными клетками. Он вызывает частичный протеолиз плазминогена, в результате чего тот превращается в плазмин. Отличительная особенность тканевого активатора - высокое сродство к фибрину, который в сотни раз ускоряет его действие на плазминоген. В результате тканевой активатор с большей скоростью активирует те молекулы плазминогена, которые адсорбированы на нитях фибрина. Таким образом, действие тканевого активатора плазминогена ограничивается фибрином тромба. Попадая в кровоток,
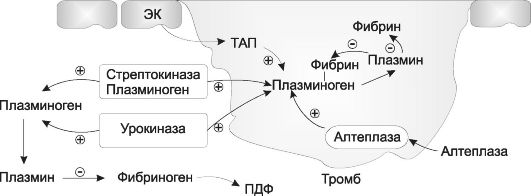
Рис. 27-7. Механизм действия фибринолитических средств: ТАП - тканевой активатор плазминогена; ПДФ - продукты деградации фибриногена; ЭК - эндотелиальная клетка; ? - активация; Θ - лизис
тканевой активатор связывается со специфическим ингибитором, поэтому мало действует на циркулирующий в крови плазминоген и в меньшей степени снижает уровень фибриногена.
Для клинического использования получены рекомбинантные препараты тканевого активатора плазминогена: а л т е п л а з а (актилизе*) и т е н е к т е п л а з а (метализе*). Препараты вводят внутривенно при остром инфаркте миокарда, вызванном тромбозом коронарных сосудов (эффективны в первые 6-12 ч), при тромбоэмболии легочной артерии. Несмотря на то, что алтеплаза мало действует на циркулирующий в крови плазминоген, при ее применении часто возникают геморрагические осложнения. Антигенных свойств не имеет. Тенектеплаза обладает повышенной специфичностью по отношению к фибрину тромба.
Урокиназа образуется клетками почек, обнаружена в моче. В почках образуется одноцепочечная урокиназа (проурокиназа), которая под действием плазмина превращается в активную форму - двухцепочечную урокиназу. Двухцепочечная урокиназа оказывает прямое активирующее действие на плазминоген (образования комплекса с плазминогеном не требуется). Препарат двухцепочечной урокиназы получают из культуры эмбриональных клеток почек человека. Применяют при остром инфаркте миокарда, венозном и артериальном тромбозе, тромбоэмболии легочной артерии. Вводят внутривенно. Дозируют в ME. В сравнении с тканевым активатором плазминогена урокиназа в большей степени действует на циркулирующий в крови плазминоген, в результате образующийся в крови плазмин вызывает распад фибриногена (см. рис. 27-7). При этом снижается агрегация тромбоцитов и образуются продукты деградации фибриногена, которые обладают антикоагулянтной активностью. Основные побочные эффекты - кровотечения. Антигенными свойствами не обладает.
Получен рекомбинантный препарат одноцепочечной урокиназы (проурокиназы) - с а р у п л а з а *, проявляющий большую, чем урокиназа, специфичность по отношению к фибрину тромба.
27.3.2. Антифибринолитические средства
Антифибринолитические средства применяют для остановки кровотечений, вызванных повышенной активностью фибринолитической системы, при травмах, хирургических вмешательствах, родах,
заболеваниях печени, простатитах, меноррагиях, а также при передозировке фибринолитических средств. Для этих целей используют препараты, которые ингибируют активацию плазминогена, или являются ингибиторами плазмина.
Аминокапроновая кислота связывается с плазми- ногеном и препятствует его превращению в плазмин. Кроме того, она препятствует действию плазмина на фибрин. Препарат вводят внутрь и внутривенно. Возможны побочные эффекты: артериальная гипотензия, брадикардия, аритмии, головокружение, тошнота, диарея. Сходным действием обладает аминометилбензойная кислота (амбен*, памба*).
Транексамовая кислота (транексам*, циклокапрон*) ингибирует активацию плазминогена. Препарат вводят внутрь и внут- ривенно. По эффективности превосходит аминокапроновую кислоту, действует более продолжительно. Из побочных эффектов вызывает диспептические явления (анорексию, тошноту, рвоту, диарею), головокружение, сонливость; возможны кожные аллергические реакции.
Апротинин (гордокс*, контрикал*, трасилол*, ингитрил*) ингибирует плазмин и другие протеолитические ферменты. Препарат вводят внутривенно. Побочные эффекты: артериальная гипотензия, тахикардия, тошнота, рвота, аллергические реакции.