Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
ГЛАВА 18 АНТИАРИТМИЧЕСКИЕ СРЕДСТВА
Противоаритмические (антиаритмические) средства - клинико-фармакологическая группа препаратов, применяемых при нарушениях сердечного ритма и воздействующих непосредственно на сердце или на его иннервацию.
Кардиомиоциты как основной структурный элемент сердца подразделяют на типичные (рабочие, сократительные) и атипичные. Первые содержат сократительные белки (актин и миозин), благодаря которым осуществляется насосная функция органа.
Проводимостью и автоматизмом (способностью к самопроизвольной генерации импульса) обладают и рабочие клетки, однако это основные функции атипичных кардиомиоцитов, не содержащих сократительных белков и образующих проводящую систему сердца (рис. 18-1).
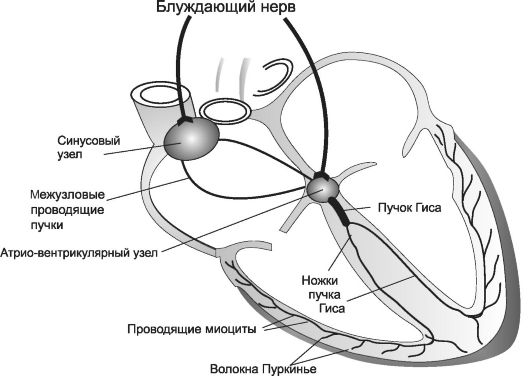
Рис. 18-1. Проводящая система сердца
Проводящая система состоит из:
• синусового (синоатриального) узла;
• межузловых (интернодальных) проводящих пучков;
• атриовентрикулярного соединения (атриовентрикулярного узла);
• атриовентрикулярного пучка (пучка Гиса);
• волокон Пуркинье.
Ее основная функция заключается в поддержании нормального ритма сердечных сокращений.
С инусовый (синоатриальный) узел расположен в верхнелатеральной стенке правого предсердия, сбоку от устья верхней полой вены. Он состоит из пучка волокон длиной 15 мм, шириной 3 мм и толщиной 1 мм. Потенциал покоя кардиомиоцитов синусового узла составляет - 55 МВ.
Синусовый узел генерирует импульсы с частотой 70-80 в минуту. Это наиболее высокие значения во всей проводящей системе. Меньшая частота генерации импульсов нижерасположенных элементов проводящей системы подавляется («обнуляется») более высоким уровнем автоматизма синусового узла. Поэтому именно он определяет частоту сердечных сокращений и выполняет функцию водителя ритма (pacemaker), а генерируемые им импульсы проводятся по проводящей системе к рабочим кардиомиоцитам желудочков.
Значения проводимости также неодинаковы в разных отделах. Так, межузловые пучки проводят импульс со скоростью 0,3 м/сек, а в кардиомиоцитах атриовентрикулярного соединения отмечают наиболее низкие значения проводимости - 0,02-0,05 м/сек.
Атриовентрикулярное соединение состоит из атриовентрикулярного узла, тонких прободающих и толстых дистальных волокон предсердно-желудочкового пучка. Атриовентрикулярный узел находится в задней части стенки правого предсердия, непосредственно позади трехстворчатого клапана. Его уровень автоматизма достигает 40-60 импульсов в минуту и в норме подавляется синусовым узлом.
Необходимо подчеркнуть, что оба узла проводящей системы находятся в стенках предсердий, отделенных от желудочков непроводящей фиброзной тканью, препятствующей ретроградному проведению возбуждения во время систолы. Через эту фиброзную преграду из предсердий в желудочки проходят тонкие прободающие волокна атриовентрикулярного пучка. Таким образом, все соединение функционирует как фильтр, передающий возбуждение только в одну
сторону и ограничивающий проведение лишних импульсов с высокоавтоматичных тканей предсердий на желудочки.
Атриовентрикулярный пучок (пучок Гиса) расположен в межжелудочковой перегородке. Он обладает наиболее высокой проводимостью (1,5-5 м/сек). Пучок Гиса делится на две ножки (правую и левую), проходящие субэндокардиально. От них отходят волокна Пуркинье, располагающиеся в толще стенок желудочков и контактирующие там с рабочими кардиомиоцитами. Волокна содержат некоторое количество филаментов миозина, что позволяет им сокращаться вместе в типичными кардиомиоцитами желудочков.
Проводимость рабочих клеток желудочков составляет 0,6-1,0 м/сек. Ее высокие значения в системе Гис-Пуркинье и сократительных кардиомиоцитах желудочков позволяют импульсам от водителей ритма с большой скоростью распространяться по миокарду. Это делает систо- лическое сокращение быстрым и скоординированным.
Автоматизм и проводимость находятся под контролем эфферентной иннервации сердца. Парасимпатическая нервная система оказывает подавляющее влияние за счет стимуляции М2-холинорецепторов. Необходимо отметить, что холинергическая иннервация сердца не распространяется на желудочки: правая ветвь блуждающего нерва воздействует на синусовый узел, левая - на атриовентрикулярный. Симпатическая нервная система повышает автоматизм и проводимость за счет стимуляции β1-адренорецепторов. Адренергические волокна иннервируют как саму проводящую систему, так и сокра- тительные кардиомиоциты, а следовательно, регулируют и проводимость, и автоматизм, и сократимость.
Нарушения автоматизма и проводимости приводят к сердечным аритмиям. В качестве их причин выделяют:
• гипоксические явления (в результате ухудшения коронарного кровотока);
• нарушения метаболических процессов в сердце;
• изменения нейроэндокринной регуляции вследствие различных заболеваний (тиреотоксикоз, пороки сердца, тромбоэмболия легочной артерии и др.).
Кроме того, некоторые группы ЛВ способны повышать автоматизм и изменять проводимость, способствуя тем самым развитию аритмий (оказывать проаритмическое, или аритмогенное действие). К таким препаратам относят адренергические, кардиотонические и даже антиаритмические средства.
Аритмии классифицируют по:
• локализации:
- наджелудочковые (суправентрикулярные);
- желудочковые (вентрикулярные);
• влиянию на частоту сердечных сокращений:
- брадисистолические (снижающие частоту сердечных сокращений);
- тахисистолические (повышающие частоту сердечных сокращений);
• механизму развития:
- блокады (развиваются в результате снижения проводимости);
- экстрасистолии (развиваются в результате повышения автоматизма);
- аритмии повторного входа («reentry-аритмии») (развиваются в результате нарушения проводимости).
Блокады проводящей системы обычно протекают в брадиаритмической форме; экстрасистолии и аритмии повторного входа - в тахи- аритмической форме (их часто объединяют в группу «экстрасистолии и тахиаритмии»).
Для выяснения причин возникновения аритмий и понимания механизмов действия антиаритмических средств необходимо рассмотреть некоторые вопросы электрофизиологии миокарда. Моделью для изучения служит модель потенциала действия волокна Пуркинье. Механизм представлен на рис. 18-2.
Потенциал покоя на мембране волокна Пуркинье составляет -90 мВ (рис. 18-2, а). Однако он самопроизвольно увеличивается во время спонтанной медленной диастолической деполяризации (фаза 4). При достижении порогового уровня возникает потенциал действия, вызывающий сокращение сердца. Спонтанная деполяризация обусловлена медленным входом ионов Na+ и выходом ионов К+. Продолжительность этой фазы прямо влияет на время генерации очередного импульса, а также отражает автоматизм волокна Пуркинье (чем она длительнее, тем ниже уровень автоматизма).
В результате спонтанной диастолической деполяризации заряд на мембране достигает -60 мВ. В этот момент открываются потенциалзависимые натриевые каналы (рис. 18-2, б) и возникает лавинообраз- ный вход ионов Na+ в клетку. Заряд на мембране при этом мгновенно увеличивается до +35 мВ, возникает быстрая деполяризация мембра-
ны (фаза 0). Продолжительность этой фазы отражает проводимость волокна (чем она короче, тем выше проводимость).
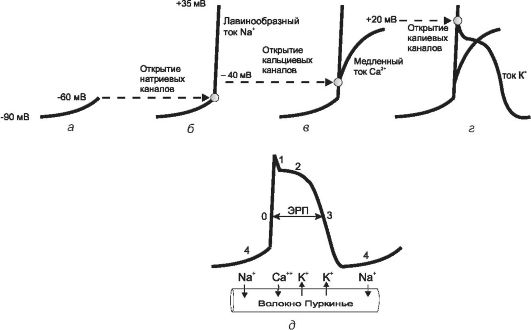
Рис. 18-2. Механизм возникновения потенциала действия волокна Пуркинье. Пояснения в тексте
Во время фазы 0 (при уровне заряда на мембране -40 мВ) открываются потенциалзависимые кальциевые каналы (рис. 18-2, в) обеспечивающие ток ионов Са2+. Эти каналы функционируют примерно в 3 раза медленнее натриевых. Благодаря этому ток ионов Са2+ образует фазу «плато» (фаза 2) потенциала действия.
Потенциалзависимые калиевые каналы открываются при достижении электроположительных значений заряда на мембране (рис. 18-2, г). Через них ионы K+ выходят из кардиомиоцитов во время инициальной (фаза 1) и окончательной реполяризации (фаза 3). Фаза 1 непродолжительна, так как повышение заряда, вызываемое выходом ионов K+ нивелируется противотоком ионов Са2+. Во время окончательной реполяризации кальциевые и натриевые каналы уже закрыты, поэтому она достигается только за счет тока ионов К+.
В ходе фазы 3 заряд на мембране возвращается к исходному уровню потенциала покоя (-90 мВ). Смена фаз потенциала действия волокна Пуркинье представлена на рис. 18-2, д.
• Фаза 0 - быстрая деполяризация (вход ионов Na+), отражает функцию проводимости.
• Фаза 1 - ранняя реполяризация (выход ионов K+ из клетки).
• Фаза 2 - «плато» (вход ионов Са2+).
• Фаза 3 - окончательная реполяризация (выход ионов K+).
• Фаза 4 - спонтанная медленная диастолическая деполяризация (вход ионов Na+ и К+), отражает функцию автоматизма.
Общая продолжительность потенциала действия около 1 сек. При этом половина времени приходится на фазу 4. В фазы 0, 1 и 2 волокно Пуркинье пребывает в состоянии возбуждения и абсолютной рефрактерности (невозбудимости). В третью фазу абсолютная рефрактерность сменяется относительной (способностью генерировать внеочередной импульс в ответ на пришедшее извне раздражение). Этот период времени обозначают как ЭРП. Обычно ЭРП занимает % окончательной реполяризации, поэтому чем она продолжительнее, тем длительнее ЭРП, и соответственно меньше риск возникновения потенциала действия в ответ на внеочередную стимуляцию.
Электрофизиологические механизмы генерации потенциала действия в узлах проводящей системы существенно отличаются от таковых в волокнах Пуркинье (рис. 18-3).
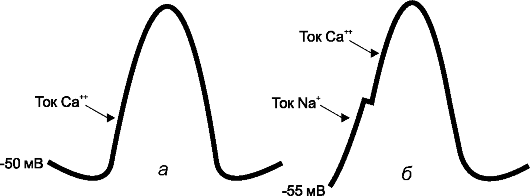
Рис. 18-3. Потенциалы действия водителей ритма (пояснения в тексте): а) синусового угла; б) атривентрикулярного угла
Синусовый и атриовентрикулярный узлы генерируют кальциевые потенциалы действия. Потенциал покоя пейсмейкерных кле- ток первого составляет -55 мВ. При этом большинство натриевых каналов находятся в инактивированном состоянии, а фаза 4 и фаза 0 обусловлены током ионов Са2+. Однако их проникновение в клет-
ки инициируется входящим током ионов Na+ через специфические If-каналы. Это дает основание считать, что If-каналы имеют основополагающее значение для нормального автоматизма синусового узла.
Основными способами терапии при экстрасистолиях и тахиаритмиях считают:
• угнетение автоматизма;
• угнетение проводимости;
• пролонгирование ЭРП.
Первый способ целесообразен при экстрасистолиях (внеочередных сокращениях желудочков). Они возникают в результате несвоевременной и эктопической генерации импульса. Повышенное содержание калия в тканях, гипоксия и другие факторы приводят к увеличению уровня автоматизма волокон Пуркинье и сократительных кардиомиоцитов. Формируется эктопический очаг, генерирующий внеочередные импульсы, которые могут распространяться на миокард желудочков и вызывать экстрасистолию. Применение ЛС, пролонгирующих фазу 4, приводит к уменьшению автоматизма и подавлению активности таких очагов.
Угнетение проводимости целесообразно при аритмиях повторного входа (reentry-аритмиях). Они возникают в результате неполных блокад в системе Гис-Пуркинье (рис. 18-4).
В норме импульс проходит по волокнам с одинаковой скоростью (рис. 18-4, а). Однако если из-за вышеперечисленных патологических факторов одно из них находится в рефрактерном состоянии, то оно неспособно к проведению ортодромного импульса, направленного от узла на периферию. В то же время потенциал действия, прошедший по неповрежденному волокну может возвратиться антидромно в поврежденное, которое к этому моменту теряет рефрактерность и способно к проведению. Возникает так называемый односторонний блок. В этом случае антидромный импульс повторно входит в неповрежденное волокно, становясь внеочередным (рис. 18-4, б).
При применении средств, угнетающих проводимость ЛС блок в пораженном волокне становится полным (двухсторонне направленным) и волокно теряет способность проводить не только ортодромные, но и ретроградные импульсы. В результате повторный вход внеочередных потенциалов действия прекращается (рис. 18-4, в).
По механизму reentry возникают не только желудочковые аритмии
(рис. 18-5).
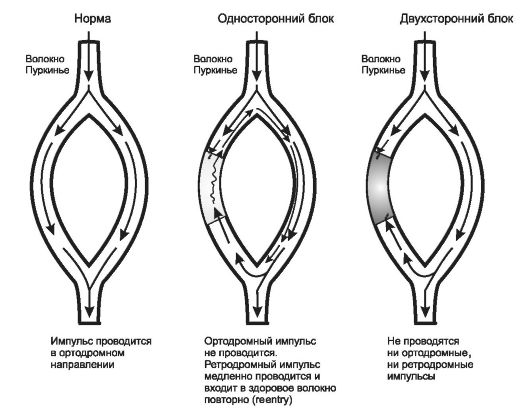
Рис. 18-4. Механизм возникновения reentry-аритмий. Пояснения в тексте
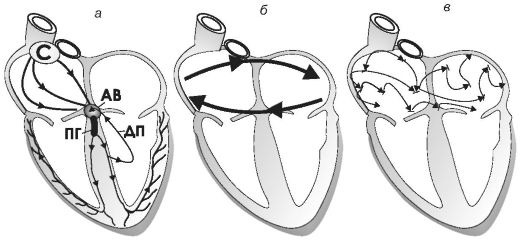
Рис. 18-5. Разные варианты reentry-аритмий (а, б, в): С - синусовый узел; АВ - атриовентрикулярный узел; ПГ - пучок Гиса; ДП - дополнительный проводящий пучок
Так синдром преждевременного возбуждения желудочков, представляет собой упорядоченную циркуляцию возбуждения между камерами сердца (рис. 18-5, а). Если атриальные и вентрикулярные отделы соединены дополнительным проводящим пучком, то ортодромный импульс, пройдя вниз по звеньям проводящей системы, затем ретроградно возвращается и становится внеочередным.
Кроме того, по принципу упорядоченной циркуляции возбуждения возникает трепетание предсердий (рис. 18-5, б). В этом случае они сокращаются по очереди. Фибрилляция предсердий возникает по принципу беспорядочной циркуляции возбуждения (рис. 18-5, в).
Пролонгирование ЭРП целесообразно при экстрасистолиях и тахиаритмиях любой локализации. Применение средств, увеличивающих фазу 3, снижает риск генерации желудочками внеочередного импуль- са в ответ на несвоевременную стимуляцию.
В соответствии с вышеописанным электрофизиологическим механизмом возникновения потенциала действия волокна Пуркинье, можно заключить, что:
• пролонгирование фазы 0 достигают путем блокады натриевых каналов;
• пролонгирование фазы 3 достигают путем блокады калиевых каналов;
• пролонгирование фазы 4 достигают путем блокады как натриевых, так и калиевых каналов.
Кроме того, снижение уровня автоматизма, проводимости и увеличение ЭРП возникает при блокаде β1-адренорецепторов.
Необходимо также особо подчеркнуть, что угнетение сократимости не приводит к противоаритмическому эффекту, и считается побочным действием антиаритмических средств.
Противоаритмические средства классифицируют по применению и механизмам действия
• Средства, применяемые при тахиаритмиях и экстрасистолии.
- I класс: блокаторы натриевых каналов.
- II класс: β-адреноблокаторы.
- III класс: блокаторы калиевых каналов.
- IV класс: блокаторы кальциевых каналов.
- Аденозин.
- Сердечные гликозиды.
- Препараты калия и магния.
• Средства, применяемые при брадиаритмиях и блокадах.
- М-холиноблокаторы.
- β-адреномиметики.
Классификацию антиаритмических средств на 4 класса по механизму действия впервые предложил Vaughan Williams в 1970 году. В несколько модифицированном виде ей пользуются до сих пор. Кроме этих четырех групп, при некоторых видах наджелудочковых тахиаритмий эффективны сердечные гликозиды и аденозин, а при экстрасистолиях, связанных с гипокалиемией, - препараты калия и магния.
18.1. КЛАСС I - БЛОКАТОРЫ НАТРИЕВЫХ КАНАЛОВ
Прежнее название этой группы препаратов - мембраностабилизирующие средства. В настоящее время блокаторы натриевых каналов принято разделять на 3 подкласса: IA, IB и IC Между ними существует ряд различий в механизме действия, применении и влиянии на параметры сердца.
Класс1А
К этому классу противоаритмических препаратов относят хинидин и хинидиноподобные средства (прокаинамид и дизопирамид).
Эти ЛВ блокируют натриевые и калиевые каналы и тем самым пролонгируют фазы 0, 3 и 4 потенциала действия (рис. 18-6). Это приводит к снижению автоматизма, проводимости и увеличению ЭРП. Хинидиноподобные средства действуют на все отделы сердца, поэтому они эффективны как при желудочковых, так и при суправентрикулярных экстрасистолиях и тахиаритмиях.
Общие побочные эффекты этой группы препаратов:
• снижение сократимости миокарда;
• снижение атриовентрикулярной проводимости;
• снижение АД;
• ваголитическое и проаритмическое (аритмогенное) действие. Последнее обусловлено несколькими причинами.
• Пролонгирование потенциала действия повышает риск появления ранней последеполяризации, которая в свою очередь приводит к возникновению аритмии torsades de pointes (русские названия: «пируэт» «скручивание пиков», «пробежка», «танец на пуантах», «веретено»).
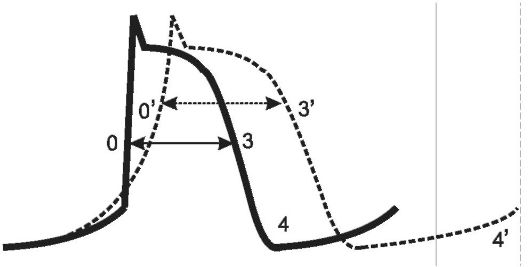
Рис. 18-6. Влияние хинидина на потенциал действия волокна Пуркинье
• Ваголитическое действие хинидиноподобных средств повышает уровень автоматизма синусового узла, тем самым облегчая проведение импульсов через атриовентрикулярное соединение и усиливая аритмию желудочков.
• Угнетение проводимости при reentry-аритмиях может привести к циркуляции возбуждения по более коротким траекториям, что в свою очередь способствует учащению повторного входа и усилению аритмии.
Хинидин (Хинипэк*, Кинидин Дурулес*) - алкалоид коры хинного дерева (правовращающий изомер хинина). В медицинской практике препарат используют в виде хинидина сульфата. Он хорошо всасывается из ЖКТ, что обусловливает его применение внутрь. Биодоступность в среднем составляет 70-80%. Максимальная концентрация препарата в крови достигается через 2-3 ч, а связывание с белками плазмы происходит на 60-80%. Метаболизируется хинидин в печени, выводится почками (около 20% в неизмененном виде); период полуэлиминации составляет 6-7 ч. Почечная экскреция препарата увеличивается при изменении реакции мочи в кислую сторону.
Хинидин:
• снижает автоматизм, проводимость и увеличивает ЭРП кардиомиоцитов желудочков;
• подавляет автоматизм водителей ритма (в большей степени атриовентрикулярного и в меньшей - синусового узла);
• умеренно снижает скорость проведения возбуждения по атриовентрикулярному узлу и сократимость миокарда (в терапевтических дозах);
• оказывает ваголитическое (антихолинергическое) действие, угнетая передачу возбуждения с блуждающего нерва на сердце, и таким образом вызывая повышение уровня автоматизма синоатриального узла и умеренную тахикардию;
• расширяет периферические сосуды (блокирует α-адренорецепторы), тем самым вызывая умеренное снижение АД.
Хинидин эффективен при желудочковых и наджелудочковых нарушениях сердечного ритма. Его назначают при постоянной и пароксизмальной формах мерцательной аритмии предсердий, пароксизмальной тахикардии, экстрасистолии.
Побочные эффекты хинидина:
• снижение сократимости миокарда, артериальная гипотензия, атриовентрикулярный блок;
• тошнота, рвота, диарея;
• головокружение, звон в ушах, нарушения слуха, зрения;
• тромбоцитопения.
В 5% случаев хинидин оказывает аритмогенное действие, приводя к возникновению желудочковых нарушений ритма типа «пируэт».
Прокаинамид (новокаинамид*) воздействует на электрофизиологические механизмы работы сердца аналогично хинидину. В отличие от последнего он меньше снижает сократимость миокарда, обладает менее выраженными антихолинергическими свойствами и не блокирует α-адренорецепторы, однако обладает умеренным ганглиоблокирующим действием. Так же, как хинидин, прокаинамид применяют при желудочковых и наджелудочковых тахиаритмиях и экстрасистолии.
Препарат назначают не только внутрь, но и внутривенно (при необходимости быстрого достижения эффекта). При применении внутрь прокаинамид всасывается быстрее, чем хинидин. Биодоступность составляет 75-95%. Препарат незначительно связывается с белками плазмы крови (15-20%). Метаболизируется в печени с образованием активного метаболита - N-ацетилпрокаинамида. По скорости метаболизма среди пациентов выделяют медленных и быстрых «ацетиляторов», существенно различающихся по продолжительности действия препарата. Прокаинамид выводится почками в неизмененном виде и в виде метаболитов. Активный метаболит экскретируется медленнее, чем сам препарат, и при нарушении функции почек может кумулировать в организме.
Побочные эффекты:
• снижение АД (вследствие ганглиоблокирующего действия), нарушение проводимости;
• тошнота, рвота, диарея;
• судороги;
• аллергические реакции в виде лихорадки, болей в суставах и мышцах, кожной сыпи, реже в виде агранулоцитоза или синдрома, подобного системной красной волчанке;
• нервно-психические расстройства (редко).
Дизопирамид (ритмодан*, ритмилен*) - аналог хинидина, обладает выраженными антиаритмическими свойствами. Показания к применению те же. Препарат снижает сократимость миокарда, а так же обладает сильным М-холиноблокирующим действием. Хорошая всасываемость из кишечника (биодоступность 80%) позволяет применять препарат внутрь. Вещество связывается с белками плазмы крови, метаболизируется в печени. Выводится в основном почками (период полуэлиминации 6-8 ч).
Побочные эффекты:
• значительное снижение сократимости миокарда, атриовентрикулярный блок, аритмогенное действие;
• сухость во рту, паралич аккомодации, обстипация (запор), задержка мочеиспускания (в связи с выраженной М-холиноблокирующей активностью).
Класс IB
Препараты этого класса имеют ряд существенных отличий.
• Это селективные блокаторы натриевых каналов, пролонгирующие только фазы 0 и 4. Они угнетают проводимость и автоматизм волокон Пуркинье и сократительных кардиомиоцитов. Препараты класса IB блокируют натриевые каналы в инактивированном
состоянии и имеют скорость ассоциации/диссоциации менее 1 сек, что не превышает продолжительности нормального потенциала действия. Таким образом, не урежая сердечного ритма, они препятствуют генерации и проведению внеочередных импульсов.
• Препараты класса IB не блокируют калиевые каналы и не пролонгируют реполяризацию. Напротив, при их применении отмечено некоторое укорочение фазы 3 и ЭРП.
• Препараты класса IB не изменяют ток кальция (ни прямо, ни опосредованно). Поэтому они воздействуют только на желудочки, не влияя на водители ритма, и не снижают сократимость миокарда. Это обусловливает применение данных препаратов только при желудочковых экстрасистолиях.
Лидокаин (ксикаин*, ксилокаин*), блокируя натриевые каналы клеточных мембран, обладает местноанестезирующим и противо- аритмическим действием. Он уменьшает проводимость и автоматизм волокон Пуркинье и рабочих кардиомиоцитов, подавляя эктопические очаги в желудочках. Его считают препаратом выбора при желудочковых аритмиях, возникающих после инфаркта миокарда. Это обусловлено тем, что, оказывая противоаритмическое действие, лидокаин не влияет на сократимость, которая в этом случае обычно снижена.
Препарат вводят внутривенно капельно, так как при пероральном применении он обладает низкой биодоступностью. На 50-80% лидо- каин связывается с белками плазмы крови, метаболизируется в основном в печени. Период полураспада мал - около 2 ч. При патологии печени скорость метаболизма лидокаина снижается.
Препарат легко переносится, но возможны побочные эффекты:
• нарушения со стороны ЦНС (сонливость, спутанность сознания, судорожные реакции);
• артериальная гипотензия, снижение атриовентрикулярной проводимости.
Мексилетин - структурный аналог лидокаина, эффективный при приеме внутрь (биодоступность 90-100%). Действует длительно (период полуэлиминации 12-16 ч). Возможно и внутривенное введение препарата. Применяют при желудочковых аритмиях.
Побочные эффекты:
• брадикардия, артериальная гипотензия, нарушение атриовентрикулярной проводимости, аритмии;
• тошнота, рвота;
• неврологические нарушения.
Фенитоин (дифенин *) первоначально применяли в качестве противоэпилептического средства. Позже у него было обнаружено антиаритмическое действие. Фенитоин считают препаратом выбора при желудочковых аритмиях, вызванных сердечными гликозидами. Это связано с тем, что оказывая антиаритмическое действие, он не уменьшает положительный инотропный эффект данных кардиотонических средств.
Фенитоин медленно всасывается из ЖКТ, в крови связывается с белками плазмы на 80-96%. Метаболизируется в печени, метаболиты выводятся в основном почками. В связи с замедленной экскрецией из организма (период полуэлиминации составляет 24-30 ч) возможна кумуляция препарата.
Из побочных эффектов отмечают атаксию, нистагм, диплопию, гиперпластический гингивит (гиперплазию десен).
Класс IС
Как и препараты класса IA, эти вещества действуют и на желудочки и на водители ритма. Однако применяют их только при вентрикулярных аритмиях, угрожающих жизни и резистентных (устойчивых) к другим противоаритмическим средствам. Такая специфическая ниша препаратов класса IC обусловлена их выраженной проаритмической активностью. Кроме того отдельные представители этой группы могут сильно угнетать сократимость и атриовентрикулярную проводимость.
П р о п а ф е н о н - типичный представитель этого класса веществ. Блокирует натриевые и в некоторой степени кальциевые каналы, а также обладает небольшой β-адреноблокирующей активностью. Препарат применяют при желудочковых аритмиях в случае неэффективности других антиаритмических средств. Вводят внутрь и внутривенно. При пероральном применении хорошо всасывается из кишечника, однако интенсивно метаболизируется при первом прохождении через печень (биодоступность варьирует от 4 до 40%).
По метаболизму пропафенона в зависимомти от генетических особенностей выделяют 2 группы пациентов:
• быстро метаболизирующих препарат (более 90%);
• медленно метаболизирующих препарат (около 10%).
В результате образуются 2 фармакологически активных вещества. Побочные эффекты:
• тошнота, рвота, запор, сухость во рту;
• нарушение сна;
• брадикардия;
• бронхоспазм;
• выраженное аритмогенное действие.
Флекаинид* выраженно угнетает проводимость в атриовентрикулярном узле, пучке Гиса и волокнах Пуркинье, незначительно снижает уровень автоматизма синусного узла, практически не увеличивает ЭРП в желудочках и мало влияет на сократимость миокарда. Препарат применяют в виде флекаинида ацетата при вентрикулярных аритмиях в случае неэффективности других антиаритмических средств. Вводят внутрь, иногда внутривенно. При применении внутрь максимальную концентрацию в плазме отмечают через 3-4 ч после приема. Флекаинид практически не изменяется при первом прохождении через печень. 75-85% препарата связываются с белками плазмы.
Побочные эффекты:
• проаритмическое действе (отмечают в 5-15% случаев);
• тошнота, головная боль, головокружение;
• нарушение зрения.
Морацизин (этмозин*) - производное фенотиазина, препарат смешанного типа действия, обладает свойствами блокаторов натриевых каналов всех трех классов: IC, IB, IA. Он угнетает проводимость в атри- овентрикулярном узле, пучке Гиса и волокнах Пуркинье, мало влияет на автоматизм синусового узла и сократимость миокарда. Морацизин эффективен при желудочковых и наджелудочковых нарушениях ритма. Однако из-за выраженного аритмогенного действия его применяют только при вентрикулярных аритмиях, рефрактерных к другим ЛС. Вводят внутрь (биодоступность составляет около 40%) и внутривенно. На 95% связывается с белками плазмы, период полуэлиминации - 2 ч.
Побочные эффекты:
• проаритмическое действие;
• головная боль;
• повышенная утомляемость и слабость;
• диарея и др.
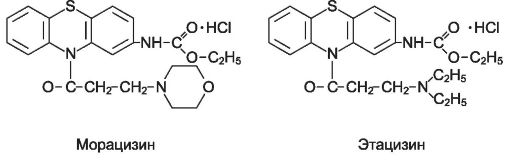
Этацизин * близок по химическому строению к морацизину. Он блокирует не только натриевые, но и кальциевые каналы. Применяют аналогично морацизину, назначают внутрь и внутривенно. Побочные эффекты более выражены и проявляются чаще (в особенности при внутривенном введении).
18.2. КЛАСС II - β-АДРЕНОБЛОКАТОРЫ
β1-Адренорецепторы локализованы как в водителях ритма, так и в рабочих кардиомиоцитах желудочков. При их блокаде снижаются проводимость, автоматизм, возбудимость и увеличивается ЭРП во всех отделах сердца. В связи с этим β-адреноблокаторы эффективны как при желудочковых, так и при суправентрикулярных тахиаритмиях. В качестве противоаритмических средств применяют кардиоселективные (атенолол, талинолол, метопролол) и неселективные β-адреноблокаторы (пропранолол).
К побочным эффектам этих средств относят:
• атриовентрикулярный блок;
• снижение сократимости миокарда;
• брадикардию.
Для пропранолола характерны также спазм бронхов и периферических сосудов.
18.3. КЛАСС III - БЛОКАТОРЫ КАЛИЕВЫХ КАНАЛОВ
Включает средства, пролонгирующие реполяризацию и, следовательно, увеличивающие продолжительность потенциала действия. Эта группа веществ очень неоднородна. Традиционно к ней относят:
• амиодарон - препарат с многокомпонентным механизмом антиаритмического действия, включающим в том числе блокаду калиевых каналов;
• соталол - блокатор β-адренорецепторов и калиевых каналов.
Кроме того, в настоящее время существуют средства, избирательно блокирующие калиевые каналы, - ибутилид и нибентан*.
Амиодарон (кардиодарон *, кордарон *) обладает смешанным механизмом противоаритмического действия (сочетает свойства I, II, III и IV классов антиаритмических средств). Препарат:
• блокирует калиевые каналы волокон Пуркинье, тем самым увеличивая ЭРП и пролонгируя фазу 3 потенциала действия;
• блокирует натриевые каналы волокон Пуркинье, уменьшая таким образом проводимость и автоматизм желудочков (из-за увеличения фаз 0 и 4);
• блокирует кальциевые каналы, снижая уровень автоматизма, проводимости и увеличивая ЭРП в узлах проводящей системы;
• обладает неконкурентным β-адреноблокирующим действием;
• угнетает аденилатциклазу;
• выполняет функции антагониста глюкагоновых рецепторов миокарда.
Амиодарон воздействует на все отделы сердца, поэтому он эффективен как при желудочковых, так и при суправентрикулярных тахиаритмиях и экстрасистолии. При приеме внутрь препарат всасывается медленно и не полностью (степень всасывания варьирует от 20 до 50%). Связывается с белками плазмы на 96%. Терапевтический эффект при пероральном применении развивается медленно: для достижения максимальной эффективности требуется несколько недель. Метаболизируется в печени с образованием активного метаболита N-дезэтиламиодарона. Выводится главным образом через кишечник очень медленно. Элиминация носит двухфазный характер:
• начальная фаза - около 10 дней;
• терминальная фаза - до 100 дней.
Период полуэлиминации составляет 10-50 сут. Из-за продолжительной циркуляции амиодарона в системном кровотоке, он кумули- рует (накапливается в тканях) и может откладываться в виде кристаллов в роговице.
Применяют в качестве противоаритмического и антиангинального средства, поскольку он:
• уменьшает потребность миокарда в кислороде за счет блокады β1-адренорецепторов сердца;
• повышает доставку кислорода к миокарду за счет расширения коронарных сосудов в результате блокады α-адренорецепторов и кальциевых каналов.
К побочным эффектам относят:
• снижение силы сердечных сокращений (в результате блокады кальциевых каналов сократительных кардиомиоцитов), уменьшение атриовентрикулярной проводимости, брадикардию, гипотензию;
• проаритмическое действие препарата (однако он реже чем хинидиноподобные средства вызывает аритмию типа «пируэт»);
• нарушения функции щитовидной железы (гипоили гипертиреоз), а также струмогенное (зобогенное) действие препарата. Это обусловлено тем, что амиодарон содержит в структуре йод и воздействует на рецепторы тиреоидных гормонов в ядре клеток;
• фиброзный пневмонит, часто приводящий к летальному исходу. При длительном применении возможно:
• возникновение обменных нарушений (отложение липофусцина в роговице и коже, что придает последней серо-голубой оттенок);
• появление фотосенсибилизации;
• угнетение микросомальных ферментов печени;
• появление неврологических нарушений (тремор, атаксия, парестезии).
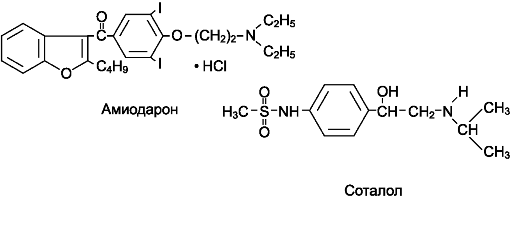
Соталол (Соталекс*, Лоритмик*, Дароб*) сочетает в себе свойтва II и III классов противоаритмических средств:
• блокирует калиевые каналы, что ведет к пролонгированию реполяризации и увеличению ЭРП;
• блокирует β-адренорецепторы, тем самым угнетает автоматизм синоатриального узла, снижает автоматизм и проводимость в атриовентрикулярном соединении и в других отделах проводящей системы.
Поскольку соталол оказывает влияние на все отделы сердца, он эффективен как при желудочковых так и при наджелудочковых тахиаритмиях и экстрасистолии. Вводят внутрь и внутривенно. При пероральном применении хорошо всасывается из ЖКТ - биодоступность составляет 90-100%; однако она снижается при приеме препарата вместе с молочными продуктами. Соталол не связывается белками плазмы крови, экскретируется почками в неизмененном виде. Период полуэлиминации составляет 7-12 ч. Действие препарата начинается через 1 ч после приема внутрь и продолжается в течение 24 ч. Побочные эффекты соталола связаны с неселективной β-адреноблокирующей активностью (см. раздел «Адреноблокаторы»).
Бретилия тозилат (Орнид*) - четвертичное аммониевое соединение, обладающее симпатолитическими свойствами. Увеличивает продолжительность потенциала действия и удлиняет ЭРП. Применяют при желудочковых аритмиях, рефрактерных к другим антиаритмическим средствам. Поскольку препарат плохо всасывается из ЖКТ, его вводят внутривенно или внутримышечно. Экскретируется преимущественно почками в неизмененном виде. Период полуэлиминации составляет 6-10 ч. Из побочных эффектов отмечают связанную с симпатолитическим действием препарата артериальную гипотензию (возможна ортостатическая гипотензия).
В последние годы в медицинской практике появились блокаторы калиевых каналов более избирательного действия и б у т и л и д (корверт*) и н и б е н т а н *. Однако оба препарата оказались эффективными только при наджелудочковых тахиаритмиях. Это объясняют морфо-функциональной особенностью волокон атриовентрикулярного пучка. Их мембраны содержат большое количество калиевых каналов, поэтому фаза 3 потенциала действия значительно короче, чем в других отделах. Короткий период рефрактерности кардиомиоцитов пучка Гиса определяет высокий уровень проводимости. Избирательная блокада калиевых каналов ибутилидом или нибентаном в первую очередь увеличивает ЭРП атриовентрикулярного пучка и внеочередные импульсы с предсердий перестают проходить на желудочки.
Необходимо отметить, что, по некоторым данным, ибутилид обладает также способностью блокировать натриевые каналы, что ведет к увеличению фазы 0 и снижению проводимости.
Оба препарата вводят внутривенно с целью купирования пароксизмов суправентрикулярных тахиаритмий (мерцание и трепетание
предсердий). Дозы подбирают индивидуально с учетом массы тела пациента. Существенным недостатком обоих средств считают их высокую проаритмическую активность. Поэтому данные препараты применяют только в условиях стационара при обязательном постоянном контроле ЭКГ.
18.4. КЛАСС IV - БЛОКАТОРЫ КАЛЬЦИЕВЫХ КАНАЛОВ
Эта группа препаратов очень неоднородна, поскольку существует несколько типов кальциевых каналов (L, T, и др.). В сердце и кровеносных сосудах локализованы преимущественно кальциевые каналы L-типа. Их чувствительность к веществам разного химического строения неодинакова. Поэтому блокаторы кальциевых каналов классифицируют на следующие группы:
• селективные блокаторы кальциевых каналов I класса (фенилалкиламины: верапамил). Эти препараты в большей степени блокируют кальциевые каналы L-типа кардиомиоцитов;
• селективные блокаторы кальциевых каналов II класса (дигидропиридины: нифедипин, амлодипин, лацидипин). Эти препараты в основном блокируют кальциевые каналы L-типа гладкомышечных клеток сосудов;
• селективные блокаторы кальциевых каналов III класса (бензотиазепин: дилтиазем). Они в равной степени блокируют кальциевые каналы L-типа в сердце и сосудах;
• блокаторы кальциевых каналов IV класса с преимущественным влиянием на сосуды головного мозга (циннаризин);
• блокаторы кальциевых каналов V класса (фенилалкиламин: прениламин);
• блокаторы кальциевых каналов VI класса (мибефрадил). Эти препараты блокируют преимущественно кальциевые каналы Т-типа.
В качестве противоаритмических средств применяют верапамил, реже дилтиазем.
Препараты этой группы эффективны только при наджелудочковых аритмиях. Это связано с тем, что водители ритма генерируют кальциевые потенциалы действия. Поэтому блокада этих каналов приводит к сниже- нию уровня автоматизма и проводимости ЭРП преимущественно в узлах проводящей системы. Блокада же кальциевых каналов кардиомиоцитов желудочков вызывает уменьшение сократимости, что считают побочным эффектом данных препаратов. Кроме того, представители этой группы
воздействуют на ангиомиоциты, в результате чего расширяются кровеносные сосуды и возникает гипотензия.
Верапамил (изоптин*, финоптин*) относят к группе фенилалкиламинов. При приеме внутрь хорошо всасывается (степень абсорбции 90-92%). Максимальный эффект отмечают через 1,5-2 ч. До 90% препарата связываются с белками плазмы крови. Экскретируется с мочой и желчью в неизмененном виде и в виде конъюгатов. Период полуэлиминации составляет 3-7 ч.
Побочные эффекты верапамила, связанные с блокадой кальциевых каналов:
• ослабление и урежение сокращений сердца;
• снижение атриовентрикулярной проводимости (вплоть до полного атриовентрикулярного блока);
• артериальная гипотензия.
Кроме того, возможны констипация, тошнота, рвота, аллергические реакции.
Дилтиазем (кардил*, алтиазем PP*) относят к группе бензотиазепинов. При приеме внутрь, хорошо всасывается (степень абсорбции до 90%); биодоступность препарата составляет 40%. Пик концен- трации в плазме наступает через 3 ч. Действие препарата развивается быстро - через 30 мин после приема. Дилтиазем ацетилируется и в неизмененном виде и в виде метаболитов выводится через кишечник. Период полуэлиминации составляет 3-4 ч.
Побочные эффекты дилтиазема, как правило, обусловлены его вазодилатирующим действием:
• головная боль;
• головокружение;
• тахикардия;
• отеки;
• мышечная слабость.
18.5. ДРУГИЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ТАХИАРИТМИЯХ И ЭКСТРАСИСТОЛИИ
Аденозин
Естественный нуклеозид, агонист аденозиновых рецепторов. Быстро захватывается кардиомиоцитами, поэтому обладает чрезвы- чайно коротким периодом полуэлиминации (t1/2 - 10 сек) и невысокой
продолжительностью действия (около 1 мин). Вводят внутривенно болюсно. В качестве противоаритмического средства применяется только при наджелудочковых тахиаритмиях (например, при синдроме преждевременного возбуждения желудочков). Антиаритмическое действие обусловлено способностью аденозина вызывать короткую атриовентрикулярную блокаду, приводящую к прекращению циркуляции возбуждения между желудочками и предсердиями по механизму reentry. Кроме того, стимуляция А1-рецепторов приводит к угнетению автоматизма синусного узла, увеличению ЭРП атрио- вентрикулярного соединения и снижению сократимости миокарда. Последнее в виде кратковременной асистолии относят к побочным эффектам препарата. Кроме того, аденозин может вызывать нарушения дыхания (диспноэ).
Сердечные гликозиды
Противоаритмическим действием обладает препарат наперстянки дигоксин. Его назначают в основном при тахисистолической форме мерцательной аритмии.
Мерцание предсердий обусловлено повышением их автоматизма и беспорядочной циркуляцией возбуждения (см. рис. 18-5, в). Частота их сокращений достигает 300 в минуту. При этом естественная проводимость атриовентрикулярного соединения позволяет пропустить только каждый 2-й или каждый 4-й импульс. Частота сокращения желудочков в такой ситуации составляет 150 (тахисистолическая форма мерцательной аритмии) или 75 (нормосистолическая форма) ударов в минуту соответственно.
Дигоксин снижает атриовентрикулярную проводимость - обладает отрицательным дромотропным эффектом. При этом даже неполная блокада (переход от тахисистолической формы мерцательной аритмии к нормосистолической) способна нормализовать частоту сокращения желудочков. В случае, если дигоксин вызывает полную поперечную блокаду, мерцание предсердий переходит в трепетание, а желудочки начинают сокращаться в автономном (идиовентрикулярном) ритме. Роль водителя такого ритма берет на себя группа кардиомиоцитов пучка Гиса. Она генерирует импульсы с частотой 40-60 в мин. Сокращения желудочков урежаются, но при этом становятся более скоординированными, что положительно сказывается на гемодинамике.
Препараты калия и магния
Калия хлорид, наиболее эффективный в виде поляризующих смесей, а также калия и магния аспарагинат (панангин* и аспаркам*) используют только при тахиаритмиях и экстрасистолии, обусловленных сниженной концентрацией этих ионов в крови. Вводят внутрь или внутривенно.
Побочные эффекты:
• парестезии;
• диспепсия;
• атриовентрикулярный блок.
Магния сульфат применяют для купирования аритмий типа «пируэт». Вводят внутривенно.