Неврология и нейрохирургия / под ред. А.Н. Коновало- ва, А.В. Коз лова ; Е.И. Гусев, А.Н. Коновалов, В.И. Скворцова : учебник : в 2 т. - т. 2. 2009. - 420 с.
|
|
|
|
ГЛАВА 14. ФУНКЦИОНАЛЬНАЯ НЕЙРОХИРУРГИЯ
К функциональным относят нейрохирургические вмешательства, основная цель которых - нормализовать нарушенную функцию ЦНС, либо прервав пути патологической импульсации, либо стимулируя структуры, тормозящие патологические импульсы. Подробнее вопросы клиники, диагностики и консервативного лечения данной патологии освещены в гл. 23 тома 1.
Предметом функциональной нейрохирургии в основном является хирургическое лечение:
• насильственных движений (гиперкинезов) и нарушений тонуса мышц - болезни Паркинсона, торсионной дистонии и
др.;
• хронической боли;
• эпилепсии.
Методы функциональной нейрохирургии делят на разрушающие и стимулирующие.
Исторически первыми были деструктивные методы, применявшиеся для лечения болевых синдромов, экстрапирамидных расстройств и тяжелых форм эпилепсии.
Деструктивные стереотаксические методики широко применялись в 1940-1960-е годы у больных с экстрапирамидными формами тремора и торсионной дистонией. Сутью метода было введение в заданную точку мозга - мишень - специальной канюли, кончик которой термически (замораживанием или нагреванием с помощью электрического тока) обеспечивал разрушение ткани мозга в радиусе нескольких миллиметров. Обычно мишенью при экстрапирамидных нарушениях были ядра зрительного бугра и бледный шар.
Для точного попадания в мишень использовалась стереотаксическая технология. На голове больного в стандартных точках
 Рис. 14.1. Стереотаксический
аппарат Рихерта-Мундингера; а - рабочая часть, фиксировавшаяся к голове
больного; б - фантом, на котором моделировалось оперативное
вмешательство
Рис. 14.1. Стереотаксический
аппарат Рихерта-Мундингера; а - рабочая часть, фиксировавшаяся к голове
больного; б - фантом, на котором моделировалось оперативное
вмешательство
фиксировалась специальная рама (стереотаксический аппарат) - рис. 14.1, а; для определения внутренних ориентиров проводилась вентрикулография, и на модели - «фантоме» (рис. 14.1, б) с использованием специального анатомического атласа осуществлялся расчет траектории доступа к мишени. Потом через фрезевое отверстие на заданную глубину по заданной траектории вводилась канюля, осуществлялась электрофизиологическая верификация правильности ее положения (по торможению тремора при динамической поляризации слабым анодным током) и затем - необратимая деструкция.
С появлением КТ и МРТ точность метода повысилась, а число осложнений снизилось. Стереотаксические аппараты стали более точными и удобными (рис. 14.2). Однако функциональные результаты деструктивных стереотаксических операций были недостаточно удовлетворительными, в связи с чем появились методы электронейростимуляции.
Электронейростимуляция предусматривает введение в структуры-мишени электродов, подсоединенных к расположенному обычно под кожей генератору импульсов с источником питания. Внешние программирующие устройства позволяют изменять ха-
рактеристику импульсов с целью обеспечения максимального эффекта (рис. 14.3). Установка стимулирующих электродов в структуры головного мозга осуществляется с помощью стереотаксического метода.
К методам функциональной нейрохи-
 Рис. 14.2. Современные стереотаксические аппараты (а, б)
Рис. 14.2. Современные стереотаксические аппараты (а, б)
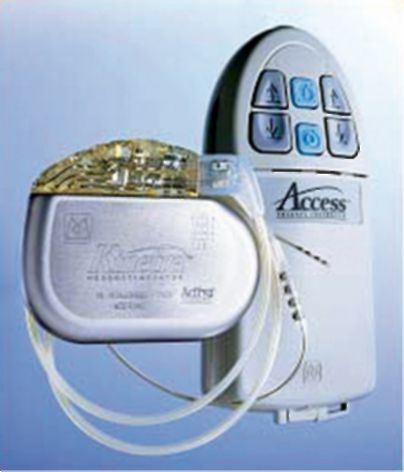 Рис. 14.3. Система
для хронической нейростимуляции структур головного мозга; слева -
имплантируемый генератор Kinetra, соединенный с внутримозговым
электродом; справа - наружный пульт управления генератором
Рис. 14.3. Система
для хронической нейростимуляции структур головного мозга; слева -
имплантируемый генератор Kinetra, соединенный с внутримозговым
электродом; справа - наружный пульт управления генератором
рургии относят также установку специальных программируемых помп, доставляющих необходимый лекарственный препарат к заданной области ЦНС.
Паркинсонизм
Болезнь Паркинсона, или идиопатический дрожательньй паралич, поражает около 1% жителей развитых стран в возрасте старше 50 лет. Встречается чаще у мужчин (соотношение - 3/2). Классическая триада симптомов включает в себя тремор, ригидность и брадикинезию. Тремор с частотой 4-7 в секунду наблюдается в покое. Под ригидностью понимают повышение тонуса мышц экстрапирамидного характера с феноменом «зубчатого колеса». Брадикинезия (акинезия), или замедленность движений, состоит в характерных изменениях походки (которая становится «шаркающей», мелкими шажками, с пропульсиями и латеропульсиями, т.е. больной не может остановиться при движении вперед или при поворотах) и скудности мимических реакций - «маскообразное лицо».
В зависимости от преобладания в клинической картине тех или иных симптомов выделяют дрожательную, дрожательно-ригидную, брадикинетическую (акинетическую) и акинетико-ригидную формы болезни Паркинсона.
Болезнь Паркинсона развивается постепенно-прогредиентно, в течение ряда лет; первыми симптомами обычно бывают брадикинезия и асимметричный тремор.
Этиология болезни Паркинсона пока окончательно не установлена. В основе некоторых ее форм лежит генетический дефект (например, в хромосомах 6 или 4), но для четко генетически детерминированных форм болезни Паркинсона характерно раннее начало - в возрасте 40-45 лет или даже в юношеском. В отношении классической болезни Паркинсона выявлена только наследственная предрасположенность - повреждение хромосомы 2 в локусе 2p13. Для развития болезни у носителей данного патологического гена имеют значение особенности питания и образа жизни. Так, болезнь Паркинсона реже развивается у курильщиков (предположительно за счет ингибирования моноаминооксидазы компонентами табачного дыма).
Паркинсонизм - синдромологический диагноз, означающий появление симптомов болезни Паркинсона вследствие травматического, ишемического, лекарственного, токсического, инфекционного, опухолевого и других поражений ЦНС.
В основе как болезни Паркинсона, так и любой формы паркинсонизма лежит гибель не менее 80% дофаминергических нейронов головного мозга (расположенных преимущественно в области черной субстанции). Снижение содержания дофамина в подкорковых структурах до уровня ниже некоего критического приводит к патологической активации одних и торможению других подкорковых ядер, что проявляется указанными симптомами дисфункции экстрапирамидной системы. Поэтому лечение экстрапирамидных нарушений не зависит от их этиологии, т.е. все формы болезни Паркинсона и паркинсонизма лечатся одинаково. Соответственно в нейрохирургической литературе обычно употребляется 1 термин - паркинсонизм - для всех форм болезни (но у каждого больного при возможности устанавливается этиологический диагноз).
Основными в консервативном лечении паркинсонизма являются препараты леводопы - предшественника дофамина, который
сам по себе не проникает через гематоэнцефалический барьер. Леводопа в наибольшей степени влияет на брадикинезию, поэтому может сочетаться с М-холиноблокаторами и другими препаратами, а также с агонистами дофаминовых рецепторов - бромокриптином и др. Подробно принципы консервативного лечения паркинсонизма изложены в курсе неврологии.
К сожалению, через несколько лет лечения препаратами леводопы их эффективность снижается, дозу и частоту приема препарата приходится увеличивать, при этом могут развиваться достаточно тяжелые медикаментозные дискинезии (неконтролируемые размашистые движения в конечностях, гримасничанье), болезненные мышечные спазмы, галлюцинации, кошмарные сновидения, повышение артериального давления; примерно у 50% больных развивается тяжело переносимый «on-off» феномен (феномен «включениявыключения», когда эффект препарата резко начинается и также резко и не всегда предсказуемо заканчивается).
В таких ситуациях необходима консультация нейрохирурга для решения вопроса о возможности оперативного лечения.
Показаниями к операции являются:
• неэффективность медикаментозного лечения;
• выраженные медикаментозные дискинезии;
• on-off феномен.
Сегодня методом выбора в нейрохирургическом лечении паркинсонизма являются стимуляционные имплантационные методики. Их преимущества перед классическими деструктивными методами заключаются в возможности осуществления двусторонних вмешательств, обратимом характере изменений и меньшей частоте осложнений. Кроме того, со временем клинический эффект как деструктивных, так и стимуляционных методов снижается; современные имплантируемые устройства позволяют путем изменения параметров стимуляции продлить этот период. Недостатком имплантируемых электронейростимуляторов является их высокая стоимость.
Механизм действия электростимуляции до конца неясен. Предполагается, что она в определенной степени подавляет патологическую активность нейронов, возникающую при устранении тормозного влияния дофаминергических структур. Наряду с этим под влиянием электростимуляции происходят изменения нейромедиаторного обмена в подкорковых структурах, о чем свидетель-
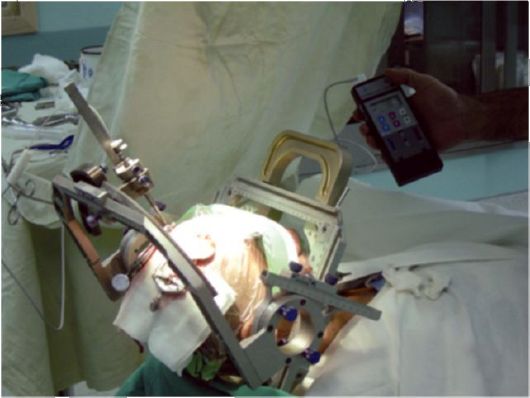 Рис. 14.4. Интраоперационная диагностическая электростимуляция через имплантированный в субталамическое ядро хронический электрод
Рис. 14.4. Интраоперационная диагностическая электростимуляция через имплантированный в субталамическое ядро хронический электрод
ствует сохранение клинического эффекта в течение иногда значительного периода после прекращения подачи импульсов.
Операция заключается во введении посредством стереотаксического метода в соответствующие подкорковые структуры (субталамическое ядро, бледный шар, вентролатеральное ядро зрительного бугра) специального изолированного (с 1-4 точками контакта) электрода для хронической стимуляции. Электрод фиксируется к черепу, затем соединяется с временным коннектором, который проводится в туннеле под кожей и выводится наружу в стороне от места операции (рис. 14.4). Затем в течение нескольких дней (в среднем - 4-7) проводят электронейростимуляцию с помощью наружного генератора, при этом определяют оптимальные параметры импульсов. В случае достижения стабильного клинического эффекта и соответственно убежденности в корректной установке электрода проводят 2-й этап операции - удаление коннектора, имплантацию стимулятора (обычно - под кожу передней поверхности грудной клетки) и соединение стимулятора с мозговым электродом с помощью постоянного коннектора. Иногда, при использовании комплекса современных методов электрофизиологического контроля, операция проводится в 1 этап.
Обычно операцию выполняют на стороне, противоположной стороне максимальных клинических проявлений паркинсонизма. При необходимости следующим этапом может быть произведено аналогичное вмешательство на другой стороне; при двусторонних операциях наиболее безопасной мишенью считается бледный шар.
Современные имплантируемые устройства позволяют больному самостоятельно, с помощью внешнего программирующего устройства, изменять параметры стимуляции для обеспечения максимального эффекта. Однако пользование такими устройствами требует сохранности интеллекта; у больных с выраженной деменцией имплантация нейростимулятора не оправдана.
Электронейростимуляция приводит к прекращению или значительному уменьшению медикаментозных дискинезий у 90-95% больных и к полному или частичному регрессу других симптомов паркинсонизма в 75-90% случаев. Становится возможным уменьшение дозы леводопы и других препаратов, хотя полная отмена противопаркинсонических средств обычно невозможна.
Операция, как правило, позволяет продлить на несколько лет срок относительно удовлетворительного качества жизни больного.
Деструкция соответствующих подкорковых структур в настоящее время применяется редко. Мишенями вмешательства являются те же структуры, что и при электронейростимуляции, но чаще всего выполняют вентролатеральную таламотомию.
Деструктивные вмешательства обеспечивают практически тот же клинический эффект, что и стимуляционные методы. Производятся они, как правило, на стороне, противоположной наиболее выраженным клиническим проявлениям болезни. Двусторонние вмешательства из-за высокого риска осложнений - нарушений речи, зрения, спутанности сознания и др. - выполняются редко. Следует отметить, что при деструктивных операциях риск осложнений и даже летального исхода существенно выше, чем при использовании метода электронейростимуляции.
Нейротрансплантация. Теоретически трансплантация в область черной субстанции вырабатывающих дофамин клеток могла бы стать способом патогенетического лечения паркинсонизма. Изучалась возможность трансплантации фетальных дофаминергических нейронов (экспериментальные работы в Европе и США практически прекращены по этическим соображениям) и собственных клеток мозгового слоя надпочечника больного. Никаких преимуществ перед деструктивными методами при использовании этих технологий при независимом анализе результатов получено не было, специфический эффект нейротрансплантации не зарегистрирован. В клинической практике нейротрансплантация в настоящее время не используется.
Ведутся экспериментальные исследования по стимуляции выработки дофамина в подкорковых структурах с помощью генноинженерных технологий.
Торсионная дистония
Торсионная дистония (называвшаяся ранее по одной из распространенных форм спастической кривошеей, или тортиколисом) - заболевание неясной этиологии и патогенеза, при котором возникают практически постоянный спазм и укорочение мышц шеи и туловища, чаще - одной или обеих грудиноключичнососцевидных. Голова при этом принимает неестественную позу, которая при сгибании называется антероколисом, наклоне в сторону - латероколисом, разгибании - ретроколисом. Следует отличать от симптоматической кривошеи, которая может наблюдаться при посттравматическом фиброзе грудиноключично-сосцевидной мышцы, подвывихе I шейного позвонка, поражении ствола мозга, микрососудистой компрессии добавочного нерва, опухоли задней черепной ямки у детей и т.д.; определенную трудность представляет дифференциальная диагностика со спастической кривошеей и истерией.
В более тяжелых случаях наблюдается вовлечение в процесс мышц плечевого пояса и конечностей, возможно сочетание с атетозом (непроизвольными неритмичными крупноразмашистыми движениями в конечностях и туловище).
Считается, что в основе торсионной дистонии лежит нарушение обмена нейромедиаторов в подкорковых структурах, о чем свидетельствует эффективность стереотаксических вмешательств на структурах зрительного бугра. Однако конкретный биохимический механизм торсионной дистонии пока неясен.
При установленном диагнозе идиопатической торсионной дистонии, т.е. при исключении всех других возможных причин, приводящих к ее появлению, назначают консервативное лечение - лечебную физкультуру (упражнения, направленные на снижение тонуса), массаж, небольшие дозы бензодиазепинов и при показаниях - серотонинергических антидепрессантов.
Временный эффект в случаях ретроколиса или латероколиса может дать введение ботулинического токсина в спазмированные мышцы.
При неэффективности консервативных мер показана консультация нейрохирурга. Практиковавшееся ранее пересечение одной или обеих грудиноключично-сосцевидных мышц сейчас не производится по причине неэффективности.
Основными при торсионной дистонии являются стереотаксические вмешательства (стимуляционные, редко - деструктивные) на подкорковых ядрах, преимущественно - на медиальном членике бледного шара с 2-х сторон.
Спастичность
В основе повышения тонуса мышц «пирамидного» характера лежит снижение ингибирующего воздействия на функцию альфамотонейронов, приводящее к гиперактивности последних.
При клиническом исследовании выявляются повышенное сопротивление пассивным движениям в конечности с симптомом «складного ножа», одновременное сокращение мышц агонистов и антагонистов, повышение глубоких рефлексов вплоть до клонусов. Длительное повышение тонуса мышц ведет к формированию патологической позы, контрактур и деформации конечностей; довольно часто наблюдаются боли в спазмированных мышцах, возможно недержание мочи и кала. В тяжелых случаях больной становится обездвиженным, могут развиваться пролежни.
Причинами развития спастичности чаще являются повреждения головного или спинного мозга (травма, инсульт, гипоксия), рассеянный склероз и врожденные уродства развития головного и спинного мозга. Частнъгй случай спастичности - детский церебральный паралич, развивающийся вследствие перинатального (травматического или гипоксического) повреждения головного мозга.
Лечение спастичности обязательно включает в себя надлежащий уход за больным, лечебную физкультуру с использованием упражнений, направленных на растяжение мышц, механическое растяжение мышц лонгетами и специальными устройствами, массаж и т.д.
Из лекарственных средств назначают диазепам (с постепенным увеличением дозы не выше 60 мг в сутки), баклофен (с 5 мг 2 раза в день с постепенным увеличением дозы, но не выше 60-75 мг в сутки) или дантролен (с 25 мг в сутки с постепенным увеличением дозы не выше 300 мг в сутки, учитывают опасность развития токсического гепатита). Все лекарственные препараты, помимо снижения мышечного тонуса, вызывают вялость, сонливость и снижение силы мышц. Задача врача - определить (методом под-
бора) эффективную дозу препарата, при которой обеспечивается максимальное снижение тонуса мышц при минимальном снижении силы в них.
При неэффективности консервативного лечения либо при развитии выраженных побочных эффектов решается вопрос о хирургической коррекции спастичности.
Ортопедические операции - удлинение сухожилий (тенотомия, тенопластика) и мышц (миотомия) бывают необходимы при выраженных контрактурах, но, практически не воздействуя на патогенетический механизм спастичности, обычно дают лишь временный эффект.
Более эффективны нейрохирургические вмешательства, основными из которых являются:
• Интратекальное введение баклофена. Осуществляется с помощью имплантируемой помпы, устройство которой аналогично противоболевой. Катетер устанавливается в субарахноидальном пространстве на уровне нижнегрудных позвонков, помпа - в подкожной жировой клетчатке. Скорость и периодичность введения препарата могут быть изменены самим пациентом с помощью внешнего программирующего устройства. При уменьшении количества препарата в резервуаре до определенного уровня производится заправка помпы новой дозой препарата путем чрескожной пункции резервуара. Эффективность методики - около 95%, но с годами эффект может снижаться.
• Хроническая электростимуляция спинного мозга. Электроды устанавливаются в заднее эпидуральное пространство на уровне позвонков ThIX-LI (рис. 14.5) либо в ходе открытого вмешательства, либо чрескожно. Обычно проводится пробная стимуляция, после чего электроды соединяют с имплантируемым электронейростимулятором. Подбор параметров стимуляции осуществляется с помощью внешнего программирующего устройства (рис. 14.6); появление болезненных парестезий указывает на необходимость изменения режима стимуляции.
• При детском церебральном параличе иногда применяется хроническая электростимуляция мозжечка. Зонами стимуляции могут быть кора верхней дольки мозжечка, передняя ножка и зубчатое ядро мозжечка.
При неэффективности данных способов лечения спастичности могут применяться деструктивные операции, из которых наиболее распространена задняя селективная ризотомия. При этой операции выполняют ламинэктомию позвонков LI-LII, вскрывают ТМО и обнажают корешки конского хвоста. Под электрофизиологическим контролем производят селективное пересечение от 25 до 75% волокон чувствительных корешков, иннервирующих наиболее спастичные мышцы. Длительный эффект в виде снижения спастичности наблюдается у 80-90% больных. У больных детским церебральным параличом, помимо улучшения движений в ногах и походки, часто наблюдается улучшение артикуляции и движений в руках.
С этой же целью может производиться разрушение зоны входа задних корешков в спинной мозг (DREZ-операция, рис. 14.7). В функциональном плане DREZ-операция аналогична задней селективной ризотомии. Сопровождается несколько большим риском осложнений. Техника описана в разделе «Хроническая боль».
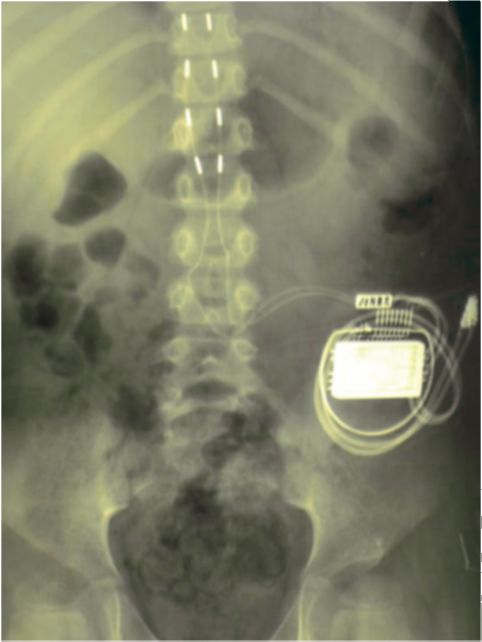 Рис. 14.5. Послеоперационная спондилограмма с эпидуральными электродами на уровне позвонков ThIX-ThXII
(поясничное утолщение); видны 2 эпидуральных электрода на уровне
поясничного утолщения спинного мозга, соединенные с подкожным приемником
импульсов
Рис. 14.5. Послеоперационная спондилограмма с эпидуральными электродами на уровне позвонков ThIX-ThXII
(поясничное утолщение); видны 2 эпидуральных электрода на уровне
поясничного утолщения спинного мозга, соединенные с подкожным приемником
импульсов
 Рис. 14.6. Наружный генератор с антенной для хронической нейростимуляции спинного мозга
Рис. 14.6. Наружный генератор с антенной для хронической нейростимуляции спинного мозга
 Рис. 14.7. DREZ-операция: точечное разрушение зоны входа чувствительных корешков в спинной мозг
Рис. 14.7. DREZ-операция: точечное разрушение зоны входа чувствительных корешков в спинной мозг
Существует еще ряд деструктивных вмешательств, обычно приводящих к появлению или нарастанию пареза конечностей. Эти вмешательства выполняются редко, по особым показаниям.
Гемифациальный спазм
Гемифациальный спазм - внезапно возникающие насильственные сокращения мимической мускулатуры с одной стороны, обычно безболезненные; могут сопровождаться слезотечением, учащаться при ситуациях, связанных с повышением артериального давления (волнение и пр.), повторяться от нескольких раз в год до нескольких в минуту.
Их причина аналогична причине невралгии тройничного нерва - сдавление лицевого нерва в мостомозжечковой цистерне атипично расположенным сосудом, чаще - артериальным. В отличие от невралгии тройничного нерва при этом виде патологии карбамазепин и баклофен практически неэффективны.
Лечение - только хирургическое. После костно-пластической трепанации задней черепной ямки со стороны поражения полу-
шарие мозжечка слегка смещается медиально и становятся видны структуры мостомозжечкового угла. Обычно лицевой нерв бывает сдавлен вблизи ствола мозга петлей передней нижней мозжечковой артерии. Компримирующий сосуд смещают в сторону от нерва, и между ним и нервом устанавливают тефлоновую или латексную прокладку - протектор. Гемифациальный спазм в подавляющем большинстве случаев проходит сразу после операции.
Хроническая боль
Восприятие боли является естественной защитной реакцией, однако в патологических ситуациях боль утрачивает защитную роль и может стать причиной мучительных страданий, в первую очередь - когда речь идет о хронической боли.
Восприятие боли связано с раздражением рецепторов - нервных окончаний в коже, слизистых оболочках, надкостнице и других тканях. Передача боли осуществляется по нервным волокнам двух типов: немиелинизированным С-волокнам и тонким миелинизированным А-сигма-волокнам. По А-сигма-волокнам с большой быстротой передаются импульсы острой, четко локализованной боли. Импульсы, распространяющиеся по С-волокнам, отличаются меньшей скоростью и передают жгучие, тупые, плохо локализованные болевые ощущения.
Из чувствительных клеток, расположенных в межпозвоночных узлах, болевые импульсы попадают в клетки задних рогов спинного мозга.
Далее больпроводящие пути идут на 1-2 сегмента выше, переходят на противоположную сторону и формируют спиноталамический тракт, располагающийся в переднелатеральных отделах спинного мозга.
Важно отметить, что часть вторичных больпроводящих путей (прямой спиноталамический и непрямой спиноретикулярно-таламический) достигают ретикулярной формации ствола. Оба пути заканчиваются в вентробазальных ядрах зрительного бугра, откуда ноцицептивные (болевые) импульсы поступают в соматосенсорную область коры.
Существуют также пути, по которым распространяются импульсы, модифицирующие или блокирующие восприятие боли.
Знать эти особенности строения больпроводящих и больвоспринимающих путей важно, чтобы попытаться разобраться в сложных
механизмах формирования болевых ощущений и обосновать методы воздействия, направленные на устранение боли. Выделяют следующие основные типы боли:
• Соматическая боль. Хорошо локализованная, описывается больным как острая, режущая, колющая, схваткообразная. Возникает как реакция на альтерацию - повреждение тканей в результате травмы, воспаления, сдавления (в том числе - чувствительных нервов и нервных сплетений). Анальгетики дают хороший эффект.
• Висцеральная боль. Имеет те же причины, что и соматическая, отличается нечеткой локализацией и худшей реакцией на анальгетики.
• Деафферентационная боль - плохо локализованная. Описывается больными как жгучая, разрывающая, пронизывающая, ломящая, сопровождается дизэстезией, гиперпатией или отсутствием чувствительности в зоне боли (anesthesia dolorosa), может возникать в отсутствующих конечностях (фантомная боль). Анальгетики малоэффективны.
Патогенез деафферентационной боли связан, вероятно, с поражением путей, по которым реализуются влияния, блокирующие или модифицирующие болевые ощущения. Имеет значение возникающее при этом нарушение медиаторного обмена. В лишенных периферических влияний центрально расположенных структурах возникают очаги стойкого патологического возбуждения.
• Каузалгия (от греч. kausis - жжение и algos - боль). Сейчас ее называют «комплексным региональным болевым синдромом», но старый термин продолжает использоваться. Возникает после неполного повреждения (преимущественно огнестрельного) периферических нервов, чаще - срединного, лучевого и седалищного.
В первое время после ранения отмечается гиперпатия в зоне иннервации пораженного нерва, затем боль распространяется на всю конечность, и любое прикосновение к ней начинает вызывать мучительные жгучие боли. Иногда больные испытывают облегчение от смачивания конечности, прикладывания влажной ткани («синдром мокрой тряпки»). Наблюдаются, как правило, выраженные вегетативно-трофические нарушения: расширение сосудов (кожа конечности горячая, красная) или
их сужение (конечность холодная, кожа мраморно-синюшная), нарушается потоотделение, возникают трофические изменения в суставах. Анальгетики малоэффективны.
Лечение
В большинстве случаев соматическая и висцеральная боль успешно лечится устранением причинного фактора (иммобилизация перелома, снятие воспаления, удаление опухоли и пр.). Показаниями к нейрохирургическому вмешательству являются хронические соматические и висцеральные болевые синдромы с неустранимой причиной, а также деафферентационные боли и каузалгия.
Операции, выполняемые при хронической боли, можно подразделить на деструктивные и имплантационные (нейромодулирующие). В свою очередь, деструктивные операции делятся: 1) на операции на периферических нервах, корешках и симпатической нервной системе; 2) операции на спинном мозге; 3) операции на головном мозге.
Деструктивные операции на периферических нервах, корешках и вегетативной нервной системе
При болях, обусловленных формированием краевых невром в поврежденных нервах, положительный эффект может быть достигнут путем микрохирургического иссечения невром.
В других случаях пересечение периферических нервов с целью прерывания потока болевых импульсов от пораженного участка тела, как правило, малоэффективно из-за перекрытия зон иннервации и травматично, поскольку большинство периферических нервов содержат как чувствительные, так и двигательные волокна.
Более эффективно пересечение корешков - ризотомия, которая может быть произведена как экстра-, так и интрадурально.
Интрадурально чувствительные корешки перед вхождением в спинной мозг распадаются на отдельные пучки, что позволяет производить избирательную, селективную ризотомию. Эта операция оправдана при поражении плечевого или пояснично-крестцового сплетения злокачественной опухолью. Аналогичный обезболивающий эффект может быть достигнут и путем разрушения или удаления межпозвонковых ганглиев.
При каузалгии изредка может применяться симпатэктомия, которая приводит к уменьшению или ликвидации вегетативного
компонента болевого синдрома. Однако полного прекращения боли не происходит, и через несколько месяцев боль обычно возвращается к исходному уровню.
Деструктивные операции на спинном мозге
Пересечение спиноталамического тракта (хордотомия). Название вмешательства произошло от английского cordotomy (рассечение спинного мозга - spinal cord). Хордотомия показана больным в терминальной стадии онкологического процесса при односторонней локализации боли. Выполняется обычно под местной анестезией. Суть операции - введение на шейном уровне (Сш-Су) через пункционную иглу под рентгенотелевизионным или кТ-контролем специального радиочастотного электрода в боковой спиноталамический тракт с противоположной от зоны боли стороны и создание в этой зоне (после электрофизиологического контроля) очага деструкции. Эффект оценивается на операционном столе; частота осложнений (появление атаксии, дизэстезии, ипсилатерального пареза, нарушения функции тазовых органов) не превышает 20%. Обычно развивается ипсилатеральный синдром Горнера (птоз, миоз, энофтальм). Противоболевой эффект достигается более чем в 90% случаев, но в случае большой продолжительности жизни больного к году после вмешательства болевой синдром рецидивирует в 30-40% наблюдений. Частота осложнений существенно возрастает при двусторонних вмешательствах, поэтому они не производятся.
Комиссуротомия может быть показана больным в терминальной стадии онкологического процесса с двусторонними болями, локализующимися ниже грудной клетки. Операция производится под наркозом. Суть ее - в пересечении перекрещивающихся волокон болевой чувствительности в области передней спайки спинного мозга. Ламинэктомия производится на 3 сегмента выше вовлеченных в процесс дерматомов (поскольку именно там происходит перекрест болевых путей от пораженных дерматомов). Спинной мозг рассекается строго по средней линии соответственно срединной борозде на глубину 6-7 мм) на протяжении 3-4 см. Операция приводит к временному (на месяцы) уменьшению или прекращению болевого синдрома. Выполняется редко.
Разрушение зоны входа задних корешков (Dorsal Root Entry Zone) - DREZ-операция - одна из наиболее эффективных опе-
раций на спинном мозге при деафферентационных болях, обусловленных отрывом спинальных корешков плечевого сплетения или перерывом спинного мозга. Операция проводится под наркозом. Выполняется ламинэктомия, идентифицируются пораженные корешки, после чего производится точечное разрушение зоны их входа в спинной мозг на глубину нескольких миллиметров (см. рис. 14.7). Стойкий противоболевой эффект в указанных случаях достигается в 80-90%, но при других деафферентационных болях и каузалгии стойкий эффект DREZ-операции наблюдается не более чем у 30% больных.
Деструктивные операции на головном мозге
При тяжелых деафферентационных болях, обусловленных неоперабельными онкологическими процессами в области лица и шеи, в отдельных случаях применяют разрушение медиальных структур зрительного бугра - таламотомию. Операция выполняется с использованием стереотаксической технологии; эффективность не превышает 50%, через несколько месяцев боль обычно возобновляется.
При односторонней боли в области лица и шеи возможно выполнение стереотаксической мезэнцефалотомии - создание очага деструкции в среднем мозгу на уровне верхних коленчатых тел, захватывающего окружающее сильвиев водопровод серое вещество.
Имплантационные методики (нейромодуляция)
Это - наиболее эффективный способ лечения подавляющего большинства хронических болевых синдромов. Имплантационные методики подразделяют на электростимуляционные и фармакологические.
Электростимуляция ответственных за восприятие и проведение боли структур (называемая также нейростимуляцией, или электронейростимуляцией) осуществляется с помощью имплантируемых компьютерных устройств, вырабатывающих импульсы определенной частоты, амплитуды и формы. Устройства различаются по техническим характеристикам; некоторые из них позволяют изменять 1 или 2 параметра стимуляции; более современные приборы обеспечивают значительный диапазон возможностей внешней бесконтактной регулировки и соответственно - достижение максимального противоболевого эффекта. Большое значение имеет и длительность работы источника питания; ряд систем обеспечи-
вают возможность подзарядки аккумулятора через бесконтактное внешнее устройство.
Электронейростимуляция приводит к определенным биохимическим изменениям (повышению уровней гамма-аминомасляной кислоты и серотонина, которые модифицируют интенсивность болевых импульсов) в подвергающихся воздействию структурах, но до конца механизм противоболевого эффекта неясен. Эффективность стимуляции со временем иногда снижается, что в определенной степени может зависеть от возможностей регулировки параметров работы нейростимулятора.
Чаще используется электростимуляция спинного мозга. Основные показания к ее применению - синдром неудачных операций на позвоночнике (постламинэктомический болевой синдром, см. главу 13 «Дегенеративные поражения позвоночника»), деафферентационная боль и каузалгия. Существует 2 вида электродов: пластинчатые, устанавливаемые открытым способом на заднюю поверхность ТМО спинного мозга (эпидурально), и мягкие проволочные электроды, которые могут быть установлены в эпиили субдуральное пространство чрескожно через специальную иглу (Туохи). Электроды соединяются с расположенным подкожно компьютерным генератором импульсов. Параметры и длительность стимуляции регулирует сам больной с помощью внешнего пульта управления генератором.
Электростимуляция структур головного мозга в лечении болевых синдромов используется реже. Ранее при неэффективности других методов применяли стимуляцию глубинных структур мозга - вентрокаудальных ядер зрительного бугра, серого вещества в окружности сильвиева водопровода или боковых желудочков; эффективность этих методик была невысокой.
Сегодня интенсивно развивается метод хронической электростимуляции моторной зоны коры головного мозга, предложенный T. Tsubokawa в 1991 г. Выполняют костно-пластическую трепанацию в теменной области, после чего под электрофизиологическим контролем на поверхность ТМО в проекции центральных извилин устанавливают специальные электроды. Подкожный генератор размещают обычно в подключичной области.
Хроническая электростимуляция моторной коры особенно показана при послеинсультных «таламических» болях (редкий синдром мучительных болей в противоположной очагу половине тела), при атипичной невралгии тройничного нерва (например, при рас-
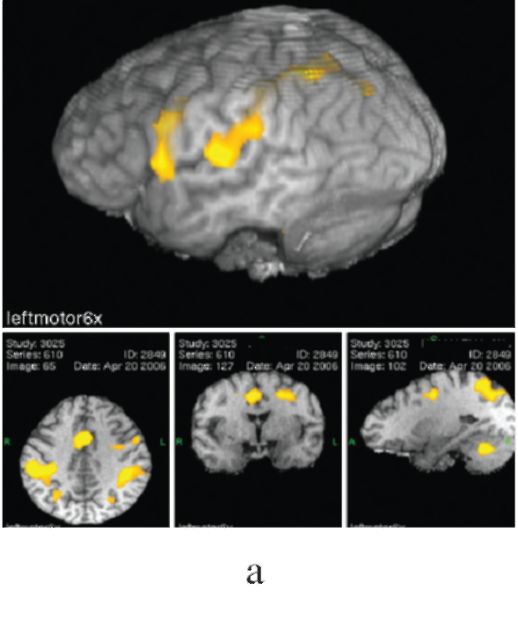
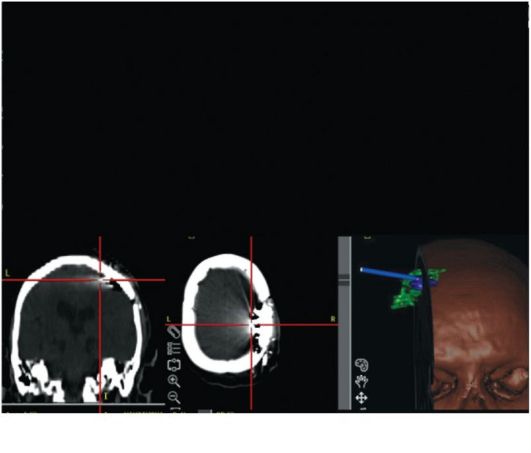
Рис. 14.8. Хроническая электростимуляция сенсомоторной коры при фантомном болевом синдроме (после ампутации плеча); а - функциональная МРТ выявляет сенсомоторную зону руки (желтый цвет); б - установка корковых электродов с использованием интраоперационной безрамной нейронавигации и КТ-контроль правильности их положения
сеянном склерозе), но эффективна она и при комплексном регионарном болевом синдроме и фантомных болях (рис. 14.8).
Имплантация устройств для доставки обезболивающих препаратов в центральную нервную систему
Устройство - «противоболевая помпа» - представляет собой имплантируемый под кожу резервуар с препаратом, помпу и катетер (рис. 14.9), через который лекарство в заданном количестве и в заданное время (или постоянно с заданной скоростью) поступает в необходимое место (эпидуральное спинальное пространство, ликворное пространство спинного или головного мозга).
В отличие от острых болей, когда применяются вводимые перидурально (или редко в спинно-мозговую жидкость) местные анестетики, при хронических болевых синдромах используются нарко-
 Рис. 14.9. Имплантируемое устройство для доставки лекарственных препаратов в ЦНС («противоболевая помпа»)
Рис. 14.9. Имплантируемое устройство для доставки лекарственных препаратов в ЦНС («противоболевая помпа»)
тические анальгетики (обычно - морфина сульфат). Эти препараты в отличие от анестетиков не вызывают нарушений чувствительности, движений и вегетативных реакций.
Преимущество такого способа введения - значительное снижение суточной дозы наркотика и соответственно уменьшение выраженности сонливости, запоров, увеличение сроков возникновения наркотической зависимости.
При локализации боли ниже шеи препарат вводится через катетер в эпидуральное пространство (при этом он диффундирует по корешкам в спинной мозг) или непосредственно в ликворное пространство спинного мозга. При болевых синдромах, обусловленных онкологическими процессами в области головы и шеи, препарат вводят в боковой желудочек мозга.
Невралгия черепных нервов
Невралгия черепных нервов занимает особое место среди хронических болевых синдромов в связи с особенностями патогенеза. Для возникновения невралгии черепного нерва необходимо формирование очага демиелинизации в зоне входа нервного корешка в ствол головного мозга. В результате раздражение чувствительных рецепторов (тактильное, температурное, болевое) приводит к распространению возбуждения в очаге демиелинизации на соседние волокна и появлению очень сильной, стреляющей боли в зоне иннервации нерва. Этот процесс патологического возбуждения имеет большое сходство с таковым при эпилепсии, и противосудорожные средства составляют основу консервативного лечения.
Невралгия тройничного нерва (tic douloureux, neuralgia quinti major)
Заболеваемость составляет 4 на 100 тыс. населения в год. В подавляющем большинстве случаев (примерно в 98%) невралгия тройничного нерва обусловлена сдавлением корешка нерва вблизи его входа в ствол мозга атипично расположенным сосудом (обычно - петлей верхней мозжечковой артерии) и развивающейся в месте пульсирующей компрессии демиелинизацией нервных волокон. Однако для развития демиелинизации существенное значение имеют генетическая предрасположенность, наследственные особенности обмена миелина, ибо контакт корешка тройничного нерва с артерией выявляется у большинства людей.
В 2% случаев невралгия тройничного нерва является следствием локальной демиелинизации у больных с рассеянным склерозом, но для возникновения боли также необходим нейроваскулярный конфликт. Рассеянный склероз выявляется у 20% больных с двусторонней невралгией тройничного нерва.
Боль сохраняется в течение нескольких секунд, но приступы могут повторяться много раз в сутки. Диагностическое значение имеет возникновение боли при компрессии «точек выхода ветвей тройничного нерва» - точнее, надглазничного, подглазничного и подбородочного нервов.
Изредка, по аналогии с эпилептическим статусом, встречается «тригеминальный статус» - практически постоянные интенсивные боли, провоцируемые любым минимальным стимулом (вплоть до движения пальцами руки).
Основным препаратом, применяющимся в консервативном лечении невралгии тройничного нерва, является карбамазепин в суточной дозе 600-800-1200 мг, разделенной на 3-4 приема (вначале препарат назначают по 100 мг на ночь с постепенным - в течение 2-3 нед - увеличением дозы до клинически эффективной). Карбамазепин вызывает значительное ослабление или прекращение болей примерно в 70% случаев. Механизм действия карбамазепина, как и при эпилепсии, связан с повышением порога «судорожной готовности» нейронов в очаге раздражения. При неэффективности карбамазепина иногда может оказаться эффективным габапентин (начинают с 300 мг в день в 3 приема в течение 3 дней, затем постепенно увеличивают дозу до минимальной клинически эффективной, обычно - 800-1200 мг в день). Может также применяться баклофен (начинают с 5 мг в сутки с постепенным повышением на 5 мг каждые 3 дня; суточная доза делится на 3-4 приема, обычно бывает достаточно 20-30 мг в сутки).
Однако наиболее эффективный и патогномонически оправданный метод лечения невралгии тройничного нерва - операция: микроваскулярная декомпрессия корешка тройничного нерва (рис. 14.10). Операция производится под наркозом. Выполняется небольшая костно-пластическая трепанация чешуи затылочной кости, мозжечок незначительно смещается вниз и медиально, и визуализируется тройничный нерв и сдавливающий его сосуд. Сосуд путем микропрепаровки отводится от нерва, и между ним и нервом устанавливается «нейропротектор» - кусочек тефлоновой
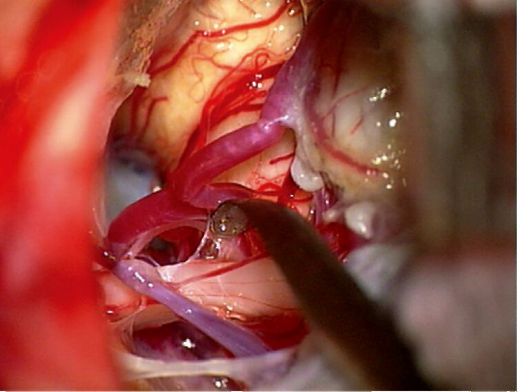 Рис. 14.10. Микроваскулярная
декомпрессия корешка V нерва. Хирургическим инструментом
(микродиссектором) компримирующий сосуд отведен от V нерва
Рис. 14.10. Микроваскулярная
декомпрессия корешка V нерва. Хирургическим инструментом
(микродиссектором) компримирующий сосуд отведен от V нерва
ваты или вспененного латекса. Прекращение боли сразу или в течение нескольких дней после операции наблюдается у абсолютного большинства больных.
При наличии соматических противопоказаний к операции эффективна радиохирургия - точечное облучение корешка тройничного нерва в однократной очаговой дозе около 90 Гр.
Другие методики - «блокада» или алкоголизация ветвей тройничного
нерва, разрушение гассерова узла и т.д. - носят преимущественно исторический характер. Эффект деструктивных вмешательств обусловлен дерецепцией, устранением триггерных стимулов, но чреват развитием anesthesia dolorosa (еще более тяжелой формы болевого синдрома). Сегодня деструктивные вмешательства иногда применяют при неэффективности микроваскулярной декомпрессии, но более эффективным методом является хроническая стимуляция двигательной зоны коры головного мозга.
Крайне редко встречается невралгия тройничного нерва при опухолях основания черепа. После удаления опухоли боль обычно проходит.
Невралгия других черепных нервов
Чаще языкоглоточного. Встречается намного реже, чем невралгия тройничного нерва. Обусловлена теми же факторами - демиелинизацией в сочетании с сосудистой компрессией. Лечение - хирургическое: микроваскулярная декомпрессия.
Эпилепсия
Полиэтиологическое заболевание, характеризующееся повторяющимися эпилептическими припадками. Эпилептическим при-
падком называют нарушения движений, чувствительности, сознания или поведения вследствие патологического пароксизмального биоэлектрического разряда мозговых нейронов.
Эпилептические припадки подразделяют на первично генерализованные и частичные (парциальные).
Первично генерализованные припадки наблюдаются в примерно 40% случаев эпилепсии. Характеризуются отсутствием фокального начала приступа, потерей сознания в самом начале приступа и симметричными, синхронными формами патологической биоэлектрической активности на ЭЭГ на протяжении всего припадка.
Первично-генерализованные припадки
Генерализованные тонико-клонические припадки (большие припадки - grand mal), при которых тоническое сокращение мышц в начале припадка сменяется клоническими судорогами.
Припадку может предшествовать различной продолжительности (чаще - несколько секунд) аура - ощущение приближения приступа. Видов ауры много, от простых - тех или иных изменений чувствительности, зрения - до сложных психоэмоциональных состояний. Важно знать, что аура сама по себе является частью припадка, и сохранение у больного на фоне лечения приступов ауры без последующего тонико-клонического компонента свидетельствует о недостаточной эффективности противосудорожной терапии.
После ауры больной теряет сознание, что сопровождается своеобразным «утробным» криком, обусловленным спазмом голосовой щели и тоническим сокращением мышц грудной клетки. Туловище и конечности вытягиваются, голова запрокидывается, вены на шее набухают, развивается нарастающий цианоз лица. Внешнее дыхание во время тонической фазы припадка отсутствует. Продолжается тоническая фаза обычно 10-20 с, редко - до 40-50 с. Затем появляются клонические судороги в виде толчкообразных сокращений мышц конечностей, шеи, туловища; начало клонической фазы припадка сопровождается громким вдохом и восстановлением самостоятельного дыхания, которое бывает глубоким и шумным. Цианоз исчезает, изо рта выделяется пена (появление которой обусловлено клоническими судорогами языка), часто окрашенная кровью вследствие прикусывания языка или щеки.
Частота судорог постепенно уменьшается, и по окончании их наступает общее мышечное расслабление. В этот период больной не реагирует даже на сильные раздражители, зрачки могут быть расширены, нередко отмечается непроизвольное мочеиспускание. Продолжительность клонической фазы припадка обычно не превышает 1, редко 2 мин.
Восстановление сознания до уровня глубокого или поверхностного оглушения происходит в течение нескольких минут, при этом больной закрывает глаза (во время всего припадка глаза открыты, в клоническую фазу веки подергиваются в отличие от истерических припадков) и погружается в глубокий сон. После припадка больные отмечают общую слабость, усталость, сонливость, мышечные боли, но о самом припадке не помнят.
Во время одиночного общего судорожного припадка не нужно пытаться оказать больному какую-то квалифицированную медицинскую помощь. Необходимо лишь обеспечить предупреждение травм - поддержать при падении, подложить под голову подушку и т.д. Не следует пытаться поднять больного, открывать ему рот (это приводит лишь к травмам языка и зубов), вводить какие-либо лекарственные препараты (возможное исключение - бензодиазепины внутривенно в самом начале припадка, для чего необходимо наличие венозного доступа и набранного в шприц препарата; понятно, что такие ситуации маловероятны даже в практике стационара).
Клонические припадки - возникающие при потере сознания симметричные двусторонние подергивания рук и ног (чаще наблюдаются сгибание в локтевых и разгибание - в коленных суставах).
Тонические припадки - представляют тоническую фазу большого припадка.
Абсансы (малые припадки - petit mal: пти маль) - нарушение сознания без судорожного компонента.
Выделяют простые абсансы - «отключение» сознания на несколько секунд с моментальным полным его восстановлением, без ауры, и сложные абсансы - длительные, иногда продолжающиеся минуты (редко - часы) приступы амбулаторного автоматизма, во время которых больной в бессознательном состоянии, не отдавая себе отчета, совершает внешне целенаправленные действия. Сложные абсансы встречаются очень редко.
Миоклонические припадки - внезапные подергивания всего туловища - от 1 до нескольких за время припадка.
Атонические (астатические) припадки, или «приступы падения» - внезапная кратковременная потеря тонуса всех мышц тела и конечностей, часто приводящая к падению.
Парциальные (частичные) припадки
Встречают чаще первично генерализованных (почти 60% случаев эпилепсии). На ЭЭГ выявляется асимметрия биоэлектрической активности, может определяться «патологический очаг» - преобладание патологических биопотенциалов в том или ином отделе мозга.
Парциальные эпилептические припадки подразделяют на следующие виды.
• Простые (без нарушения сознания). Могут быть двигательными (джексоновскими), чувствительными, речевыми, зрительными, слуховыми, вегетативными. После простых двигательных припадков, особенно обусловленных локальным поражением мозга, например опухолью, характерно развитие временной слабости в вовлеченных в приступ группах мышц - паралич Тодда.
• Сложные (психомоторные). Протекают с вегетативной аурой (неприятными ощущениями в эпигастрии, тошнотой, чувством жара или похолодания конечностей, потливостью) и с нарушениями сознания (от автоматических насильственных движений, насильственного плача и т.д. до полной потери сознания). Чаще встречаются при поражении височной доли.
• Парциальные припадки с вторичной генерализацией (простые и сложные).
Наконец, примерно 2-3% эпилептических припадков являются настолько своеобразными, что не могут быть отнесены к той или иной категории, их называют неклассифицируемыми.
По этиологии и соответственно возможностям лечения эпилепсию подразделяют на:
• симптоматическую, или вторичную, обусловленную определенным морфологическим субстратом;
• идиопатическую (устаревшее название - генуинная), когда не удается выявить тот или иной морфологический или биохимический субстрат.
Некоторые выделяют криптогенную эпилепсию, к которой относят весьма своеобразные формы припадков (детские спазмы, синдром Леннокса-Гасто), причина которых должна существовать, но пока не открыта.
Следует иметь в виду, что с развитием диагностических методов в большинстве случаев эпилепсии удается выявить тот или иной морфологический субстрат, и удельный вес «генуинной» эпилепсии в структуре синдрома неуклонно уменьшается.
Выделяют также состояния, протекающие с судорожными припадками, но сами по себе не дающие основания диагностировать их как эпилепсию. К ним относят детские припадки на фоне высокой температуры тела (фебрильные судороги) и припадки, возникающие при острой интоксикации (например, алкоголем) и не повторяющиеся в остальное время. При фебрильных припадках не следует назначать антиконвульсанты; ребенку с одним или несколькими фебрильными припадками в анамнезе при температуре тела свыше 38 °С можно назначить диазепам внутрь по 3 мг на 1 кг массы тела в сутки в 3 приема на весь период лихорадки и в течение суток после нормализации температуры тела.
Заболеваемость эпилепсией составляет 4-5 на 100 тыс. населения в год; в развитых странах эпилепсией страдает 0,3-0,5% населения (по некоторым данным, до 1%). Высокая распространенность эпилепсии в развитых странах обусловлена большей продолжительностью жизни и меньшими показателями перинатальной смертности, в том числе среди детей с ЧМТ и асфиксией, последствия которых могут стать причиной эпилепсии.
В основе любой формы эпилепсии лежат патологические биоэлектрические импульсы, генерируемые группой измененных, дистрофичных нейронов, структурные изменения в оболочках которых обеспечивают облегченную деполяризацию. При одновременной, синхронной деполяризации группы расположенных рядом нейронов возникает интенсивный электрический импульс, приводящий к деполяризации соседних нормальных клеток, что, в свою очередь, в зависимости от локализации первичного очага и интенсивности разряда ведет к развитию парциального (фокального) или генерализованного эпилептического припадка.
Механизм действия противосудорожных препаратов связан со стабилизацией мембран как патологических, так и нормальных
нейронов, что снижает амплитуду генерируемых патологических импульсов и предотвращает их распространение.
Поскольку побочными эффектами большинства противосудорожных препаратов являются сонливость, вялость, снижение работоспособности, вначале их назначают в небольших дозах на ночь с постепенным - в течение 1-3 нед - увеличением дозы до терапевтической.
Основные противосудорожные препараты
• Вальпроаты (вальпроевая кислота и ее соли). Это - наиболее универсальное (эффективное при всех видах припадков), но достаточно токсичное средство. Доза - 15-60 мг на 1 кг массы тела в сутки.
• Карбамазепин. Эффективен при парциальных и первично генерализованных припадках. Рекомендуется при лечении детей (в наименьшей степени сказывается на интеллектуальном развитии). Доза - 10-30 мг на 1 кг массы тела в сутки.
• Этосуксимид. Назначается при абсансах. Доза - 10-30 мг на 1 кг массы тела в сутки.
• Барбитураты - фенобарбитал и бензобарбитал (бензонал) - эффективны при парциальных, включая вторично генерализованные, и первично генерализованных припадках. Обычная доза фенобарбитала - 2-5 мг на 1 кг массы тела в сутки, доза бензобарбитала - 4-10 на 1 кг массы тела в сутки.
Обычно проводится монотерапия - лечение 1 препаратом. Поскольку существуют индивидуальные особенности метаболизма препаратов, большую помощь в подборе адекватной дозы оказывает определение содержания препарата в сыворотке крови. Иногда, особенно у детей, дополнительно назначают ацетазоламид, дающий слабый противосудорожный эффект.
При резистентности эпилепсии к указанным средствам применяют 1 из «новых» препаратов: габапентин (эффективен при первично генерализованных, кроме абсансов, и любых парциальных припадках); это - дорогостоящий, но наименее токсичный препарат из существующих на сегодня; топирамат (обладает наименьшей тератогенностью); тиагабин, ламотриджин, фелбамат и др.; консервативное лечение сложных случаев эпилепсии входит в компетенцию врача-эпилептолога.
Эпилептический статус - особое состояние больного эпилепсией, при котором либо припадок продолжается свыше 20 мин,
либо припадки повторяются один за другим, и в период между припадками не происходит релаксации мышц и восстановления сознания. Эпилептический статус может наблюдаться при любой форме припадков, но наиболее часто встречающимся и наиболее опасным является тонико-клонический эпилептический статус - как при первично генерализованных, так и при парциальных припадках с вторичной генерализацией.
В 15-20% случаев эпилептический статус может быть первым припадком, т.е. развиться у больного без анамнеза эпилептических припадков.
Помощь больному при эпилептическом статусе
• Обязательная госпитализация в отделение реанимации или интенсивной терапии. Обеспечение проходимости верхних дыхательных путей, установка ротового воздуховода, подача кислорода через маску или канюлю. При неэффективности медикаментозной терапии или при признаках дыхательной недостаточности - интубация трахеи. Мониторинг ЭКГ, артериального давления, насыщения капиллярной крови кислородом, исследование глюкозы и электролитов крови в том числе (желательно) - магния и кальция; коррекция выявленных биохимических нарушений.
• Бензодиазепины внутривенно. Действуют быстро (в течение минут). При отсутствии венозного доступа детям можно вводить ректально. Побочный эффект - угнетение дыхания у 10-15% больных; необходимо быть готовым к интубации трахеи и ИВЛ.
❖ Диазепам: детям - 0,2 мг на 1 кг массы тела; взрослым обычно достаточно разовой дозы 10 мг; вводить со скоростью 5 мг/мин, можно повторить через 5 мин, всего - до 3 введений; ректально - 0,5 мг на 1 кг массы тела, не более 20 мг, эффект - в течение 10 мин; диазепам купирует эпилептический статус примерно в 70% случаев.
❖ Лоразепам: детям - 0,1 мг на 1 кг массы тела; взрослым обычно достаточно разовой дозы 4 мг; вводить со скоростью до 2 мг/мин, можно повторить через 5 мин, максимальная суммарная доза взрослым - 9 мг; ректально - 0,1 мг на 1 кг массы тела, не более 6 мг; более эффективен, чем диазепам (примерно в 95% случаев). При отсутствии указанных
препаратов возможно введение других бензодиазепинов, в частности клоназепама, мидазолама.
• Противосудорожные препараты. Выбор инъекционных форм ограничен. Назначают вместе с бензодиазепинами внутривенно. При отсутствии альтернативой является постоянная внутривенная перфузия бензодиазепина.
❖ Фенитоин - 20 мг на 1 кг массы тела со скоростью 1 мг/ мин.
❖ Фенобарбитал - до 20 мг на 1 кг массы тела со скоростью 100 мг/мин; при купировании судорог введение препарата прекратить. Может быть заменен более короткодействующими тиопенталом натрия или гексеналом.
❖ Детям может быть назначена вальпроевая кислота по 20 мг на 1 кг массы тела ректально.
• При неэффективности указанного лечения - интубация трахеи, ИВЛ, наркоз (изофлуран или пропофол). Цель наркоза - подавление биоэлектрической активности мозга, поэтому назначения миорелаксантов недостаточно.
После купирования эпилептического статуса больной переводится на поддерживающую противосудорожную терапию.
Как уже говорилось, с развитием диагностики в большинстве случаев так называемой генуинной эпилепсии появилась возможность идентифицировать патологический субстрат, пул дефектных нейронов, генерирующих эпилептический разряд, и уточнить локализацию и границы области первичного патологического возбуждения нейронов - эпилептогенной зоны (или эпилептогенного очага).
В частности, стало ясно, что многие случаи «височной» эпилепсии обусловлены склерозом гиппокампа, где и генерируются первичные эпилептогенные импульсы (рис. 14.11). В ряде случаев патогенез склероза гиппокампа, или «медиального склероза височной доли», обусловлен перинатальной травмой, когда при сдавлении головы ребенка в родовых путях, при вакуум-экстракции, наложении акушерских щипцов и т.д. происходит смещение медиальных отделов височной доли в вырезку намета мозжечка, где гиппокамп ущемляется, в нем развиваются нарушения венозного оттока, отек и гибель части клеток. После разрешения острой ситуации нормальные анатомические отношения восстанавливают-
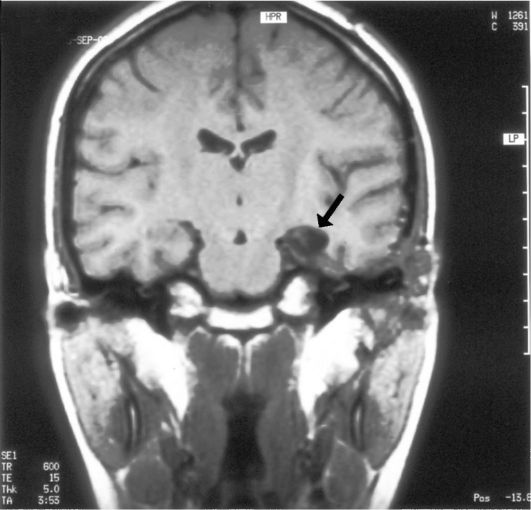 Рис. 14.11. Медиальный склероз левой височной доли (стрелка): МРТ, Т1- взвешенное изображение
Рис. 14.11. Медиальный склероз левой височной доли (стрелка): МРТ, Т1- взвешенное изображение
ся, но в ишемизированном гиппокампе развиваются фибрознодегенеративные изменения.
Современные методы: нейровизуализации облегчили диагностику внутричерепных объемных процессов и очагов повреждения мозга (при травме, инсульте, демиелинизирующих процессах и т.д.), что обеспечило возможность анатомической идентификации эпилептогенного очага и соответственно вмешательства на нем.
Показанием к консультации нейрохирурга является фармакорезистентность эпилепсии - невозможность купирования приступов при применении не менее 3 противосудорожных препаратов в адекватных дозах.
Естественно, это не относится к случаям выявления внутричерепного объемного процесса или другого локального поражения мозга, когда больного следует сразу направлять в нейрохирургическое лечебное учреждение.
Наилучшие результаты нейрохирургического лечения фармакорезистентной эпилепсии получены у больных с локализацией эпилептогенного очага в височной доле. Однако следует иметь в виду, что даже нейрохирургическое вмешательство не может гарантировать прекращения припадков. Хорошим результатом операции считается сокращение частоты приступов на 80-90%, удовлетворительным - прекращение наиболее тяжелых приступов (с потерей сознания, падением и т.д.) при сохранении других форм припадков.
В нейрохирургическом стационаре, помимо широкого спектра неинвазивных исследований (обязательно включающих в себя ЭЭГ с провокационными пробами, иногда - ЭЭГ-мониторинг с депривацией сна), для уточнения локализации очага могут устанавливаться диагностические электроды в ту или иную область мозга, например в область гиппокампа.
В ходе операции окончательно уточняются размеры и границы эпилептогенного очага с помощью интраоперационной электрокортикографии. Особенностью анестезиологического обеспечения является исключение препаратов, оказывающих значительное влияние на биопотенциалы мозга; оптимально сочетание пропофола с фентанилом.
В случае локализации эпилептогенного очага вблизи речевых и двигательных зон коры мозга для исключения их повреждения в ходе противоэпилептической операции может применяться «краниотомия в сознании», когда начальные и конечные этапы операции проводятся под наркозом в сочетании с местной анестезией длительно действующими анестетиками при самостоятельном дыхании больного, а после вскрытия ТМО больной пробуждается до уровня словесного контакта. После этого проводят электростимуляцию коры в области функционально значимых зон и предполагаемой резекции.
Операции при эпилепсии
• Деструктивные:
❖ удаление эпилептогенного очага;
❖ операции на проводящих путях.
• Стимулирующие - имплантация устройств, снижающих судорожную активность.
Иногда к противоэпилептическим относят операции по поводу объемного процесса (опухоли, сосудистой мальформации, гематомы и т.д.), вызвавшего симптоматическую эпилепсию. При
таких операциях в большинстве случаев бывает достаточно удалить только объемное образование без дополнительных вмешательств на коре мозга или проводящих путях, поэтому техника их выполнения не отличается от описанной в соответствующих разделах. Единственным исключением являются длительно существующие доброкачественные опухоли височной доли, когда лучший эффект достигается при одновременном удалении опухоли, миндалевидного ядра и гиппокампа.
Удаление эпилептогенной зоны чаще всего возможно при локализации ее в височной доле. Размеры эпилептогенной зоны могут превосходить размеры морфологического очага, поэтому для достижения максимального эффекта резекция производится до исчезновения патологической активности по данным интраоперационной электрокортикографии. В зависимости от локализации очага производят резекцию гиппокампа или более обширную височную лобэктомию.
Операция выполняется под общей анестезией. После костнопластической трепанации определяют анатомические ориентиры и, как правило, резецируют необходимый объем мозга единым блоком (такая техника повышает радикальность иссечения эпилептогенной зоны и снижает риск осложнений). При резекции гиппокампа необходимо удалить всю зону склероза (при больших ее размерах может быть удален весь гиппокамп). Объем безопасной (т.е. не приводящей к появлению новых клинических симптомов) резекции височной доли представлен на рис. 14.12.
Частота осложнений (нарушений речи, движений) не превышает нескольких процентов. Может возникать верхнеквадрантная гнемианопсия (частичное нарушение полей зрения), которую больные обычно не ощущают. Нарушения психики и личности после односторонних вмешательств на височной доли либо отсутствуют, либо могут быть выявлены только в ходе специального нейропсихологического исследования. Двусторонние вмешательства в связи с высоким риском нарушений психики не производят.
Примерно у 50% больных приступы прекращаются и не возобновляются в течение не менее 2 лет (при условии продолжения противосудорожной терапии), значительное улучшение наблюдается не менее чем у 80% больных.
При локализации эпилептогенного очага в других зонах коры (что встречается редко и бывает обусловлено обычно травматиче-
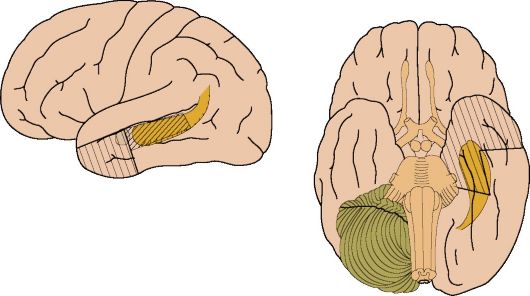
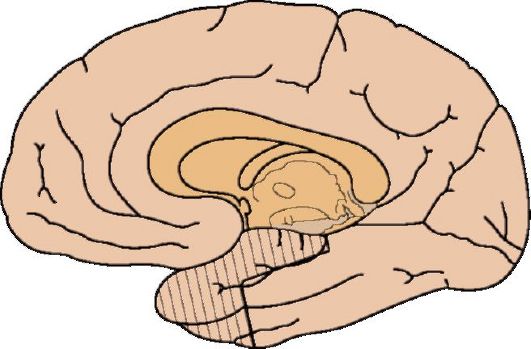 Рис. 14.12. Допустимая область резекции (заштрихована) при височной лобэктомии
Рис. 14.12. Допустимая область резекции (заштрихована) при височной лобэктомии
ским повреждением мозга) также возможна либо резекция очага, либо (при его локализации в функционально значимой, например двигательной зоне) достаточно безопасные «множественные субпиальные транссекции» - насечки на толщину серого вещества, наносимые под операционным микроскопом скальпелем или иглой поперек извилины в 5 мм друг от друга.
В самых тяжелых, к счастью редких, случаях грубого поражения одного полушария мозга (при инфантильной гемиплегии, энцефалите Расмунсена и др. и контралатеральной гемиплегии или грубом гемипарезе) возможна операция функциональной гемисферэктомии - пересечение связей с корой пораженного полушария. Операция состоит в пересечении со стороны полости бокового желудочка проводящих путей, связывающих кору мозга и подкорковые структуры, и рассечении мозолистого тела.
Операции на проводящих путях производят при многоочаговых и двусторонних формах эпилепсии, когда невозможна резекция всех очагов. В настоящее время применяется только рассечение мозолистого тела - каллозотомия, обычно - частичная. Чаще осуществляют открытое рассечение мозолистого тела, реже создают очаги деструкции в мозолистом теле с помощью стереотаксического или радиохирургического метода.
Цель операции - не прекращение припадков, а изменение их формы путем затруднения генерализации эпилептического разряда через мозолистое тело. В результате каллозотомии генерализованные припадки у большинства больных прекращаются или частота их заметно снижается, парциальные припадки остаются и иногда даже учащаются.
Операция (особенно тотальная каллозотомия) приводит к частично обратимым изменениям личности больного («синдром расщепленного мозга»), психики, но не вызывает снижения интеллекта. Производится редко, только в случаях тяжелых генерализованных припадков у больных с грубыми изменениями психики.
Методы электростимуляции различных структур мозга пока в основном находятся в стадии изучения. Достоверно доказана клиническая эффективность только одного метода - хронической электростимуляции блуждающего нерва.
Механизм противосудорожного эффекта электростимуляции объясняется раздражением солитарного ядра блуждающего нерва, что благодаря определенной десинхронизации активности коры головного мозга препятствует распространению синхронных пароксизмальных импульсов.
Суть операции состоит в имплантации кольцевого электрода, охватывающего левый блуждающий нерв на шее. Электрод соединяется с имплантируемым генератором, параметры стимуляции регулируются дистанционно.
На фоне стимуляции у больных со сложными парциальными или вторично генерализованными припадками частота приступов снижается примерно на 50%.