Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
ГЛАВА 37 АНТИБАКТЕРИАЛЬНЫЕ ХИМИОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА
К антибактериальным химиотерапевтическим средствам относят следующие группы ЛС:
• антибиотики;
• синтетические антибактериальные средства;
• противосифилитические средства;
• противотуберкулезные средства.
37.1. АНТИБИОТИКИ
Антибиотики - это химиотерапевтические вещества биологического происхождения, избирательно угнетающие жизнедеятельность микроорганизмов.
Для классификации антибиотиков используют различные принципы.
В зависимости от источников получения антибиотики подразделяют на две группы:
• природные (биосинтетические), продуцируемые микроорганизмами и низшими грибами;
• полусинтетические, получаемые в результате модификации структуры природных антибиотиков.
По химическому строению выделяют следующие группы антибиотиков:
• β-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы);
• макролиды и близкие к ним антибиотики;
• аминогликозиды;
• тетрациклины;
• полимиксины;
• полиены (противогрибковые антибиотики);
• препараты хлорамфеникола (левомицетина*);
• гликопептидные антибиотики;
• антибиотики разных химических групп.
Характер (тип) действия антибиотиков может быть бактерицидным (фунгиили протозоацидным, в зависимости от возбудителя), под которым понимают полное разрушение клетки инфекционного агента, и бактериостатическим (фунги-, протозоастатическим), которое проявляется прекращением роста и деления его клеток.
Бактерицидный или бактериостатический характер влияния антибиотиков на микрофлору во многом определяется особеннос- тями механизма их действия. Установлено, что противомикробное действие антибиотиков развивается, в основном, как следствие нарушения:
• синтеза клеточной стенки микроорганизмов;
• проницаемости цитоплазматической мембраны микробной клетки;
• внутриклеточного синтеза белка в микробной клетке;
• синтеза РНК в микроорганизмах.
При сопоставлении характера и механизма действия антибиотиков (табл. 37-1) видно, что бактерицидный эффект дают преимущественно те антибиотики, которые нарушают синтез клеточной стенки, изменяют проницаемость цитоплазматической мембраны или нарушают синтез РНК в микроорганизмах. Бактериостатическое действие характерно для антибиотиков, нарушающих внутриклеточный синтез белка.
Таблица 37-1
Механизм и характер антимикробного действия антибиотиков
Механизм действия | Антибиотики | Преимущественный характер антимикроб- ного действия |
Нарушение синтеза клеточной стенки | β-Лактамные антибиотики | Бактерицидный |
Гликопептидные антибиотики | Бактерицидный | |
Циклосерин | Бактерицидный | |
Бацитрацин | Бактерицидный | |
Нарушение проницаемости цитоплазматической мембраны | Полимиксины | Бактерицидный |
Полиеновые антибиотики | Бактерицидный | |
Нарушение внутриклеточного синтеза белка | Макролиды | Бактериостатический |
Тетрациклины | Бактериостатический | |
Линкозамиды | Бактериостатический | |
Хлорамфеникол | Бактериостатический | |
Аминогликозиды | Бактерицидный | |
Нарушение синтеза РНК | Рифампицин | Бактерицидный |
По спектру антимикробного действия антибиотики можно условно разделить на препараты широкого спектра (действующие на грамположительную и грамотрицательную микрофлору: тетрациклины, хлорамфеникол, аминогликозиды, цефалоспорины, полусинтетические пенициллины) и препараты сравнительно узкого спектра действия. ЛВ второй группы в свою очередь подразделяют на антибиотики, действующие преимущественно на грамположительную микрофлору (биосинтетические пенициллины, макролиды), и анти-
биотики, влияющие преимущественно на грамотрицательную микрофлору (полимиксины). Кроме того, различают противогрибковые и противоопухолевые антибиотики.
По клиническому применению выделяют основные антибиотики, с которых начинают лечение до определения чувствительности к ним микроорганизмов, вызвавших заболевание, и резервные, которые применяют при устойчивости микроорганизмов к основным антибиотикам или при непереносимости последних.
В процессе применения антибиотиков к ним может развиться устойчивость (резистентность) микроорганизмов, т.е. способность микроорганизмов размножаться в присутствии терапевтической дозы антибиотика. Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной.
Природная устойчивость связана с отсутствием у микроорганизмов «мишени» для действия антибиотика или недоступностью «мишени» вследствие низкой проницаемости клеточной стенки, а также ферментативной инактивацией антибиотика. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны.
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Приобретенная устойчивость связана либо со спонтанными мутациями в генотипе бактериальной клетки, либо с передачей плазмид от естественно-устойчивых бактерий к чувствительным видам.
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
• ферментативная инактивация препаратов;
• модификация «мишени» действия антибиотиков;
• активное выведение антибактериальных препаратов из микробной клетки;
• снижение проницаемости клеточной стенки бактерий;
• формирование метаболического «шунта».
Устойчивость микроорганизмов к антибиотикам может иметь групповую специфичность, т.е. резистентность не только к приме- няемому препарату, но и к другим препаратам из той же химической группы. Такая устойчивость называется перекрестной.
Соблюдение принципов применения химиотерапевтических средств позволяет уменьшить вероятность возникновения устойчивости.
Несмотря на то, что антибиотики характеризуются высокой избирательностью действия, они дают некоторые побочные эффекты аллергической и неаллергической природы.
β-Лактамные антибиотики
β - Лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы и монобактамы) - это ЛС, имеющие в составе молекулы β-лактамное кольцо, которое необходимо для реализации противомикробной активности этих соединений. При расщеплении β-лактамного кольца бактериальными ферментами (β-лактамазами) антибиотики утрачивают антибиотическую способность.
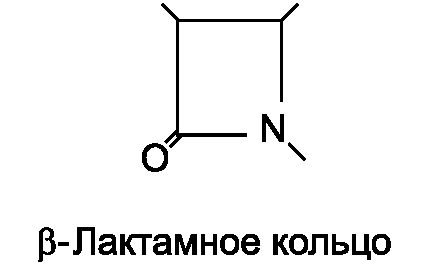
Все β-лактамные антибиотики оказывают бактерицидное действие, в основе которого лежит угнетение ими синтеза клеточной стенки бактерий. Антибиотики этой группы нарушают синтез пептидогликана - биополимера, основного компонента клеточной стенки бактерий. Пептидогликан состоит из полисахаридов и полипептидов.
В состав полисахаридов входят аминосахара - N-ацетилглюкоза- мин и N-ацетилмурамовая кислота. С аминосахарами связаны короткие пептидные цепи. Окончательную жесткость клеточной стенке придают поперечные пептидные цепочки, состоящие из пяти остатков глицина (пентаглициновые мостики). Синтез пептидогликана протекает в три стадии:
• синтез в цитоплазме предшественников пептидогликана (N-ацетилмурамилпентапептида и N-ацетилглюкозамина), перенос их через цитоплазматическую мембрану с участием липидного транспортера, ингибируемого бацитрацином;
• включение этих предшественников в растущую полимерную цепь;
• образование поперечных связей между двумя соседними цепями в результате реакции транспептидирования, катализируемой ферментом (транспептидазой пептидогликана).
Процесс расщепления пептидогликана катализирует фермент (муреингидролаза), активность которого в нормальных условиях сдерживается эндогенным ингибитором.
β-Лактамные антибиотики ингибируют:
• транспептидазу пептидогликана, что приводит к нарушению его образования;
• эндогенный ингибитор, что приводит к активации муреингидролазы, расщепляющей пептидогликан.
β -Лактамные антибиотики малотоксичны для макроорганизма, так как мембраны клеток человека не содержат пептидогликан. Антибиотики этой группы эффективны преимущественно в отношении делящихся, а не покоящихся клеток, поскольку в клетках, находящихся в стадии активного роста, синтез пептидогликана происходит наиболее интенсивно.
Пенициллины
В основе строения пенициллинов лежит 6-аминопенициллановая кислота - гетероциклическая система, состоящая из двух конденсированных колец: четырехчленного β-лактамного и пятичленного тиазолидинового.
Пенициллины отличаются друг от друга строением ацильного остатка у аминогруппы 6-аминопенициллановой кислоты.
По способу получения выделяют природные (биосинтетические) и полусинтетические пенициллины.
Природные пенициллины
Природные пенициллины - продукт синтеза различных видов плесневого гриба рода Penicillium.
Спектр действия природных пенициллинов включает преимущественно грамположительные микроорганизмы:
• грамположительные кокки (стрептококки, пневмококки; стафилококки, не продуцирующие пенициллиназу);
• грамположительные палочки (возбудители дифтерии, сибирской язвы; листерии);
• анаэробы (клостридии);
• актиномицеты; а также:
• грамотрицательные кокки (менингококки и гонококки);
• спирохеты (бледная трепонема, лептоспиры, боррелии).
Природные пенициллины применяют при:
• тонзиллофарингите (ангине);
• скарлатине;
• роже;
• бактериальном эндокардите;
• пневмонии;
• дифтерии;
• менингите;
• гнойных инфекциях;
• газовой гангрене;
• актиномикозе.
Препараты этой группы - средства выбора при лечении сифилиса и профилактики обострений ревматических заболеваний.
Все природные пенициллины разрушаются β-лактамазами (пенициллиназами), поэтому их нельзя использовать для лечения стафилококковых инфекций, так как в большинстве случаев возбудитель - продуцирующий пенициллиназу стафилококк.
Различают следующие препараты природных пенициллинов.
• Препараты для парентерального введения (кислотонеустойчивые).
- Короткого действия. Бензилпенициллина натриевая и калиевая соли*.
- Длительного действия.
Бензилпенициллин прокаина (бензилпенициллина новокаиновая соль*), бензатина бензилпенициллин (бициллин-1*), бензатина бензил- пенициллин+бензилпенициллин прокаина (бициллин-5*).
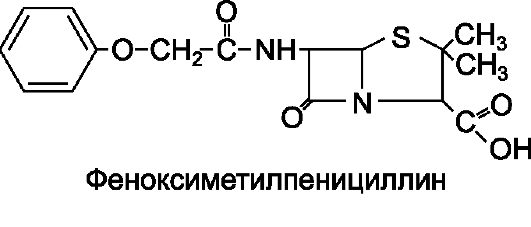
• Препараты для энтерального введения (кислотоустойчивые). Феноксиметилпенициллин.
Бензилпенициллина натриевая и калиевая соли* - хорошо растворимые препараты бензилпенициллина. Быстро всасываются в системный кровоток и создают высокие концентрации в плазме крови, что позволяет их применять при острых, тяжелопротекающих инфекционных процессах. При внутримышечном введении препараты накапливаются в крови в максимальных количествах через 30-60 мин и практически полностью выводятся из организма через 3-4 ч, поэтому внутримышечные инъекции препаратов необходимо проводить через каждые 3-4 ч. При тяжелых септических состояниях растворы препаратов вводят внутривенно. Бензилпенициллина натриевую соль* вводят также под оболочки мозга (эндолюмбально) при менингитах и в полости тела - плевральную, брюшную, суставную (при плев-
ритах, перитонитах и артритах). Подкожно применяют препараты для обкалывания инфильтратов. Бензилпенициллина калиевую соль* нельзя вводить эндолюмбально и внутривенно, так как освобождающиеся из препарата ионы калия могут вызывать судороги и угнетение сердечной деятельности.
Необходимость частых инъекций натриевой и калиевой солей бензилпенициллина послужила поводом для создания длительно действующих препаратов бензилпенициллина (депо-пенициллинов). Вследствие плохой растворимости в воде эти препараты образуют с водой суспензии, их вводят только внутримышечно. Депо-пенициллины медленно всасываются с места введения и не создают высокие концентрации в плазме крови, поэтому их применяют при хроничес- ких инфекциях легкой и средней тяжести.
К пролонгированным пенициллинам относят б е н з и л п е н и - циллин прокаина , или бензилпенициллина новокаиновую соль*, которая действует 12-18 ч, бензатина бензилпенициллин (бициллин-1*), действующий 7-10 дней, и би- циллин-5*, оказывающий противомикробное действие в течение одного месяца.
Феноксиметилпенициллин по химическому строению отличается от бензилпенициллина наличием в молекуле феноксиметильной группы вместо бензильной, что придает ему устойчивость в кислой среде желудка и делает его пригодным для применения внутрь.
Природные пенициллины имеют некоторые недостатки. Главные из них - разрушение пенициллиназой, неустойчивость в кислой среде желудка (кроме феноксиметилпенициллина) и относительно узкий спектр действия.
Полусинтетические пенициллины
В процессе поиска более совершенных антибиотиков группы пенициллина на основе 6-аминопенициллановой кислоты были получены полусинтетические препараты. Химические модификации 6-амино-
пенициллановой кислоты проводили путем присоединения различных радикалов к аминогруппе. Полусинтетические пенициллины отличаются от природных кислотоустойчивостью, устойчивостью к пенициллиназе и спектром действия.
Различают следующие препараты полусинтетических пенициллинов.
• Препараты узкого спектра действия, устойчивые к действию пенициллиназы.
- Изоксазолиловые пенициллины. Оксациллин, диклоксациллин.
• Препараты широкого спектра действия, не устойчивые к действию пенициллиназы.
- Аминопенициллины. Ампициллин, амоксициллин.
- Карбоксипенициллины. Карбенициллин, карфециллин, тикарциллин.
- Уреидопенициллины.
Азлоциллин, пиперациллин, мезлоциллин.
Полусинтетические пенициллины, устойчивые к действию пенициллиназы, отличаются от препаратов бензилпенициллина тем, что они эффективны при инфекциях, вызываемых пенициллиназообразующими стафилококками, поэтому препараты этой группы получили название «антистафилококковые пенициллины». В остальном спектр действия соответствует спектру природных пенициллинов, но активность значительно ниже.
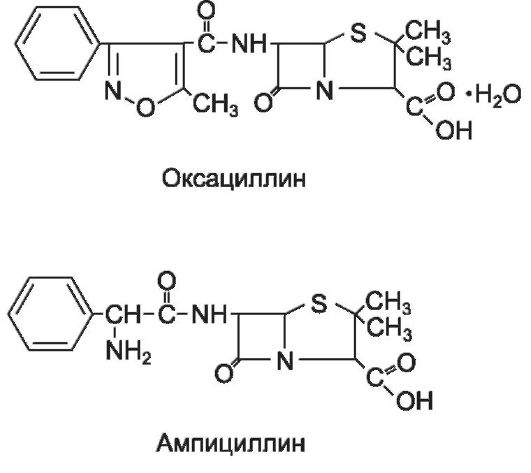
Оксациллин устойчив в кислой среде желудка, но всасывается из ЖКТ всего 20-30% препарата. Значительная часть связывается с белками крови. Через ГЭБ не проникает. Препарат применяют внутрь, внутримышечно и внутривенно.
Диклоксациллин отличается от оксациллина высокой степенью абсорбции из ЖКТ (40-45%).
Аминопенициллины отличаются от препаратов бензилпенициллина более широким спектром действия, а также кислотоустойчивостью.
Спектр действия аминопенициллинов включает как грамположительные микроорганизмы, так и грамотрицательные (сальмонеллы, шигеллы, кишечную палочку, некоторые штаммы протея, гемофильную палочку). Препараты этой группы не действуют на синегнойную палочку и пенициллиназообразующие стафилококки.
Аминопенициллины применяют при острых бактериальных инфекциях верхних дыхательных путей, бактериальном менингите, кишечных инфекциях, инфекциях желче- и мочевыводящих путей, а также для эрадикации Helicobacter pylori при язвенной болезни желудка.
Ампициллин из ЖКТ всасывается неполно (30-40%). В плазме крови незначительно (до 15-20%) связывается с белками. Плохо проникает через ГЭБ. Из организма выводится с мочой и желчью, где создаются высокие концентрации препарата. Препарат вводят внутрь и внутривенно.
Амоксициллин - производное ампициллина со значительно улучшенной фармакокинетикой при приеме внутрь. Хорошо вса- сывается из ЖКТ (биодоступность 90-95%) и создает более высокие концентрации в плазме крови. Применяют только внутрь.
В медицинской практике используют комбинированные препараты, содержащие разные соли ампициллина и оксациллина. К числу таких препаратов относят ампиокс* (смесь ампициллина тригидрата и натриевой соли оксациллина в соотношении 1:1) и ампиокс-натрий* (смесь натриевых солей ампициллина и оксациллина в соотношении 2:1). Эти препараты сочетают широкий спектр действия и устойчивость к пенициллиназе. В связи с этим ампиокс* и ампиокс-натрий* применяют при тяжело протекающих инфекционных процессах (сепсис, эндокардит, послеродовая инфекция и др.); при неустановленной антибиотикограмме и невыделенном возбудителе; при смешанной инфекции, вызванной грамположительными и грамотрицательными микроорганизмами. Ампиокс* применяют внутрь, а ампиокс-натрий* вводят внутримышечно и внутривенно.
Главное достоинство карбокси- и уреидопенициллинов - активность в отношении синегнойной палочки (Pseudomonas aeruginosa), в связи с чем эти пенициллины называют «антисинегнойными». Основные показания для препаратов этой группы - инфекции, вызванные синегнойной палочкой, протеем, кишечной палочкой (сепсис, раневые инфекции, пневмонии и др.).
Карбенициллин разрушается в ЖКТ, поэтому его вводят внутримышечно и внутривенно. Через ГЭБ не проникает. Около 50% препарата связывается с белками плазмы крови. Выводится преимущественно почками.
Карфециллин, в отличие от карбенициллина, кислотоустойчив, его принимают внутрь. Тикарциллин активнее карбенициллина, особенно по воздействию на синегнойную палочку.
Уреидопенициллины в 4-8 раз превосходят карбоксипеницил- лины по активности в отношении синегнойной палочки. Вводят их парентерально.
Все полусинтетические пенициллины широкого спектра действия разрушаются бактериальными β-лактамазами (пенициллиназами), что значительно снижает их клиническую эффективность. Исходя из этого были получены соединения, инактивирующие β-лактамазы бактерий. К ним относят клавулановую кислоту, сульбактам и тазобактам. Они входят в состав комбинированных препаратов, содержащих полусинтетический пенициллин и один из ингибиторов β-лактамаз. Такие препараты получили название ингибиторзащищенных пенициллинов. В отличие от монопрепаратов, ингибиторза- щищенные пенициллины действуют на пенициллиназообразующие штаммы стафилококков, обладают высокой активностью в отношении грамотрицательных бактерий, продуцирующих β-лактамазы, а также эффективны в отношении бактероидов.
Фармацевтическая промышленность выпускает следующие комбинированные препараты: амоксициллин+клавулановая кислота (амоксиклав*, аугментин*), ампициллин+сульбактам (уназин*), пиперациллин+тазобактам (тазоцин*).
Препараты группы пенициллина малотоксичны и обладают большой широтой терапевтического действия. Однако они относительно часто вызывают аллергические реакции, которые могут проявляться в виде крапивницы, кожной сыпи, отека Квинке, бронхоспазма и анафилактического шока. Аллергические реакции могут возникать при любом пути введения препарата, но наиболее часто развиваются при
парентеральном введении. Лечение аллергических реакций заключается в отмене препаратов пенициллина, а также во введении антигистаминных средств и глюкокортикоидов. При анафилактическом шоке внутривенно вводят эпинефрин и глюкокортикоиды.
Кроме того, пенициллины вызывают некоторые побочные эффекты неаллергической природы. К ним относят раздражающее дейс- твие. При приеме внутрь они могут вызывать тошноту, воспаление слизистой оболочки языка и ротовой полости. При внутримышечном введении могут появиться болезненность и инфильтраты, а при внутривенном - флебиты и тромбофлебиты.
Цефалоспорины
Цефалоспорины - группа природных и полусинтетических антибиотиков, имеющих в своей основе 7-аминоцефалоспорановую кислоту.
По химическому строению основа этих антибиотиков (7-аминоце- фалоспорановая кислота) имеет сходство с 6-аминопенициллановой кислотой. Однако есть и существенные различия: структура пенициллинов включает тиазолидиновое кольцо, а цефалоспоринов - дигидротиазиновое.
Черты структурного сходства цефалоспоринов с пенициллинами предопределяют одинаковый механизм и тип антибактериального действия, высокую активность и эффективность, низкую токсичность для макроорганизма, а также перекрестные аллергические реакции с пенициллинами. Важные отличительные особенности цефалоспоринов - их устойчивость к пенициллиназе и широкий спектр антимикробного действия.
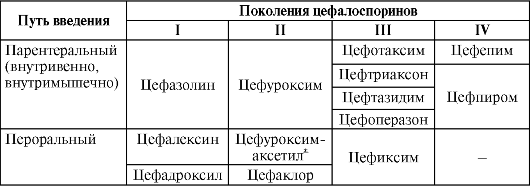
Цефалоспорины принято классифицировать по поколениям, внутри которых выделяют препараты для парентерального и энтерального введения (табл. 37-2).
Цефалоспорины I поколения
Цефалоспорины I поколения обладают широким спектром действия с преимущественным влиянием на грамположительную флору и сопоставимы по спектру и силе действия с аминопенициллинами. Основная особенность препаратов этого поколения - их высокая антистафилококковая активность, в том числе против β-лактамазообразующих штаммов. Цефалоспорины I поколения действуют на некоторые грамотрицательные бактерии (кишечную палочку и клеб-
сиеллы), но разрушаются β-лактамазами грамотрицательных микроорганизмов. К препаратам I поколения первично резистентны синегнойная палочка, протей, энтерококки и бактероиды.
Таблица 37-2
Классификация цефалоспоринов
Цефалоспорины I поколения применяют при тонзиллофарингите, инфекциях кожи и мягких тканей, а также для профилактики послеоперационных осложнений.
Цефазолин (кефзол*) при парентеральном введении хорошо проникает в различные органы и ткани, но плохо - через ГЭБ. Создает высокие концентрации в плазме крови. Выделяется почками в неизмененном виде.
Цефалексин (кефлекс*) по спектру активности близок к цефазолину, но хуже действует на грамотрицательные бактерии. Хорошо всасывается из ЖКТ, но высоких концентраций в крови и большинстве органов и тканей не создает. Терапевтическая концентрация в крови после однократного введения сохраняется в течение 4-6 ч.
Цефалоспорины II поколения
Цефалоспорины II поколения отличаются от препаратов I поколения более высокой активностью в отношении грамотрицательных микроорганизмов (кишечной палочки, протея, сальмонелл, шигелл). Препараты этого поколения более устойчивы к действию β-лактамаз грамотрицательных бактерий. Как и цефалоспорины I поколения, не действуют на синегнойную палочку.
Цефалоспорины II поколения применяют при бактериальных инфекциях верхних и нижних дыхательных путей, инфекциях мочевы-
водящих путей, инфекциях кожи, мягких тканей, костей и суставов, а также для периоперационной антибиотикопрофилактики в хирургии.
Цефуроксим (кетоцеф*) при парентеральном введении хорошо проникает во многие органы и ткани, в том числе через ГЭБ (при воспалении). Выводится преимущественно почками.
Цефуроксим-аксетил (зиннат*) - производное цефуроксима для приема внутрь, пролекарство.
Ц е ф а к л о р хорошо всасывается из ЖКТ, проникает во многие органы и ткани, через ГЭБ не проходит. Выводится с мочой.
Цефалоспорины III поколения
Цефалоспорины III поколения отличаются высокой активностью в отношении большинства грамотрицательных бактерий, в том числе резистентных к другим антибиотикам. Некоторые из цефалоспоринов III поколения (цефтазидим, цефоперазон) действуют на синегнойную палочку. Вместе с тем по действию на стафилококки, стрептококки и другие грамположительные бактерии цефалоспорины III поколения уступают препаратам I-II поколений. Все цефалоспорины этого поколения устойчивы к действию β-лактамаз грамотрицательных микроорганизмов.
Показания к назначению цефалоспоринов III поколения включают инфекции разной локализации: верхних и нижних дыхатель- ных путей, мочевыводящих путей, кожи, мягких тканей, кишечные инфекции, сепсис, гонорею, менингит.
Ц е ф о т а к с и м (клафоран*) - основной представитель цефалоспоринов III поколения для парентерального введения. Препарат хорошо проникает в различные ткани и проходит через ГЭБ. Метаболизируется в печени. Выделяется через почки. t1/2 - около одного часа.
Ц е ф т р и а к с о н (лонгацеф*) по спектру активности сходен с цефотаксимом, но имеет более длительный t1/2 (5-7 ч). Средство выбора при лечении гонореи.
Цефтазидим (фортум*) и цефоперазон (цефобид*) отличаются высокой активностью в отношении синегнойной палочки, поэтому их применяют преимущественно при инфекциях, вызванных этим возбудителем.
Цефалоспорины IV поколения
У цефалоспоринов IV поколения еще более широкий спектр антимикробного действия, чем у препаратов III поколения. Они более
эффективны в отношении грамположительных кокков. Для них характерна более высокая устойчивость к действию β-лактамаз.
Применяют цефалоспорины IV поколения при тяжелых инфекциях, вызванных полирезистентной микрофлорой, а также для лечения инфекций у пациентов с иммунодефицитом.
Ц е ф е пим (максипим*) и цефпером (кейтен*) при парентеральном введении хорошо проникают во многие органы и ткани, проникают через ГЭБ. Выводятся преимущественно в неизмененном виде через почки.
При применении цефалоспоринов возможно развитие аллергических реакций (крапивница, лихорадка, сывороточная болезнь, анафилактический шок). Больным, имеющим в анамнезе аллергические реакции на пенициллины, нельзя назначать цефалоспорины. Из неаллергических осложнений возможно нарушение функции почек, что наиболее характерно для цефалоспоринов I поколения. В редких случаях цефалоспорины вызывают лейкопению. Для некоторых цефалоспоринов, имеющих в структуре 4-метилтиотетразольное кольцо (цефоперазон и др.), характерно тетурамоподобное действие. При приеме пероральных цефалоспоринов могут возникать диспепсические явления. При внутримышечном введении цефалоспоринов возможно появление инфильтратов, а при внутривенном - флебитов. При приеме цефалоспоринов следует учитывать возможность развития суперинфекции.
Карбапенемы
Карбапенемы относят к группе β-лактамных антибиотиков. Они характеризуются более высокой устойчивостью к действию β-лактамаз и обладают широким спектром антибактериального действия, включая штаммы, устойчивые к цефалоспоринам III и IV поколений.
Карбапенемы - резервные антибиотики, их применяют при тяжелых инфекциях, вызванных полирезистентными штаммами микро- организмов.
К группе карбапенемов относят имипенем и меропенем.
И м и п е н е м - производное тиенамицина, продуцируемого Streptomyces cattleya. Для медицинского применения выпускают комбинированный препарат, содержащий имипенем в сочетании со специфическим ингибитором дегидропептидазы I почечных канальцев - циластатином. Такое сочетание тормозит метаболизм имипенема в почках и значительно повышает концентрацию неизмененного
антибиотика в почках и мочевыводящих путях. Этот комбинированный препарат носит название тиенам*.
Тиен а м * вводят внутривенно. Он хорошо проникает во многие органы и ткани, проходит через ГЭБ при воспалении оболочек мозга.
составляет 1 ч. При применении препарата возможны аллергические реакции, тошнота, рвота, судороги.
Меропенем (Меронем*) в отличие от имипенема не разрушается дегидропептидазой почечных канальцев, поэтому его применяют без ее ингибиторов. По остальным характеристикам близок к имипе- нему.
Монобактамы
Антибиотики этой группы имеют в своей структуре моноциклическое β-лактамное кольцо. Из монобактамов в медицинской практике применяют один антибиотик - азтреонам. Препарат высоко активен по отношению к грамотрицательным бактериям (кишечной и синегнойной палочке, протею, клебсиеллам и др.) и не действует на грамположительные бактерии, бактероиды и другие анаэробы.
Своеобразие антимикробного спектра действия азтреонама обусловлено тем, что он устойчив ко многим β-лактамазам, продуцируемым грамотрицательной флорой, и в то же время разрушается β-лактамазами грамположительных микроорганизмов и бактероидов.
Азтреонам - препарат резерва, его применяют при тяжелых инфекциях мочевыводящих путей, брюшной полости и малого таза, менингите, сепсисе, при неэффективности других антибактериальных средств. Вводят препарат внутримышечно или внутривенно. Из побочных эффектов отмечают диспепсические нарушения, кожные аллергические реакции, головную боль.
Макролиды и близкие к ним антибиотики
Макролиды - класс антибиотиков, основу химической структуры которых составляет макроциклическое лактонное кольцо, связанное с различными сахарами.
Макролиды классифицируют в зависимости от способов получения и количества атомов углерода в макроциклическом лактонном кольце (табл. 37-3).
Таблица 37-3
Классификация макролидов

Для макролидов характерны следующие общие свойства.
• Способность нарушать синтез микробных белков на уровне рибосом. Они связываются с 50S-субъединицей бактериальных рибосом и нарушают процесс образования пептидных связей (ингибируют процесс транслокации). Резистентность микроорганизмов к макролидам связана с изменениями структуры рецепторов на 50S-субъединицах бактериальных рибосом, что нарушает связывание антибиотика с рибосомами.
• Преимущественно бактериостатический тип действия. В высоких концентрациях оказывают бактерицидное действие на пневмококки, возбудители коклюша и дифтерии.
• Высокая активность в отношении грамположительных кокков (стрептококков, стафилококков) и внутриклеточных возбудителей (хламидий и микоплазм).
• Способность проникать внутрь клеток и создавать высокие внутриклеточные концентрации.
• Низкая токсичность для макроорганизма.
• Отсутствие перекрестных аллергических реакций с β-лактамными антибиотиками.
Спектр действия макролидов включает:
• грамположительные кокки (стрептококки, стафилококки);
• грамположительные палочки (возбудители дифтерии, листерии);
• грамотрицательные кокки (гонококки, менингококки);
• грамотрицательные палочки (легионеллы, геликобактерии);
• хламидии, микоплазмы, спирохеты.
Таким образом, по спектру антимикробного действия макролиды напоминают препараты бензилпенициллина.
Макролиды применяют для лечения стрептококкового тонзиллофарингита, пневмонии (в том числе «атипичной», вызванной микоплазмами, хламидиями и легионеллами), коклюша, дифтерии, скарлатины, инфекций кожи и мягких тканей, хламидиоза, микоплазменной инфекции, инфекций полости рта, а также с целью круглогодичной профилактики ревматизма (при аллергии на пенициллины).
Эритромицин - природный макролид, продуцируемый Streptomyces erythreus. Препарат при назначении внутрь медленно всасывается из ЖКТ, частично разрушается в кислой среде желудка.
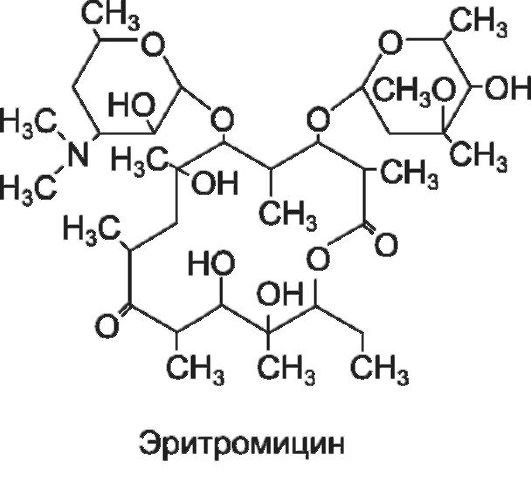
В присутствии пищи биодоступность резко снижается. Хорошо проникает в бронхиальный секрет, желчь. Плохо проходит через ГЭБ. Выводится преимущественно через ЖКТ. Длительность действия 4-6 ч.
Олеандомицин продукт синтеза Streptomyces antibioticus. По спектру активности близок к эритромицину, но менее активен.
Рокситромицин (рулид*) и кларитромицин (клацид*) - полусинтетические 14-членные макролиды. В отличие от эритромицина хорошо всасываются из ЖКТ, при этом пища не влияет на абсорбцию препаратов. Создают высокие концентрации в тканях. Действуют более продолжительно. t1/2 рокситромицина составляет 13 ч, кларитромицина - 3-4 ч. Применяют внутрь.
Кроме вышеперечисленных показаний, кларитромицин применяют для эрадикации Helicobacter pylori при язвенной болезни желудка и двенадцатиперстной кишки, а также для профилактики и лечения атипичных микобактериозов при СПИДе.
Азитромицин (сумамед*) - полусинтетический 15-членный макролид, относится к подклассу азалидов, так как в макроцикличес-
ком кольце содержит атом азота. В отличие от эритромицина более активен в отношении грамотрицательных микроорганизмов. Создает самые высокие среди макролидов концентрации в тканях. Препарат имеет длительный t1/2 - до 35-55 ч, что дает возможность назначать препарат один раз в сутки.
Спирамицин, джозамицин и мидекамицин - природные 16-членные макролиды. Препараты эффективны в отношении некоторых штаммов стрептококков и стафилококков, резистентных к эритромицину. Хорошо всасываются из ЖКТ, при этом пища практически не влияет на биодоступность. Мидекамицина ацетат - полусинтетический антибиотик с улучшенной фармакокинетикой.
Побочное действие препаратов данной группы - в основном, аллергические реакции и диспепсические расстройства.
Линкосамиды
В группу линкосамидов входят природный антибиотик линкомицин и его полусинтетический аналог - клиндамицин.
Для линкосамидов характерны следующие общие свойства:
• способность ингибировать синтез белка в микробной клетке (действуют подобно макролидам);
• преимущественно бактериостатический тип действия. В высоких концентрациях могут действовать бактерицидно на грамположительные кокки;
• узкий спектр действия (преимущественно грамположительные кокки, включая пенициллиназообразующие штаммы стафилококков). Высокоактивны в отношении бактероидов - облигатных неспорообразующих анаэробов;
• способность накапливаться в костной ткани и суставах;
• быстрое развитие устойчивости микрофлоры;
• отсутствие перекрестных аллергических реакций с β-лактамными антибиотиками.
Линкосамиды применяют как резервные антистафилококковые препараты при тонзиллофарингите, пневмонии, инфекциях кожи, мягких тканей, костей и суставов, а также при инфекциях, вызванных бактероидами.
Линкомицин всасывается из ЖКТ, при этом пища нарушает абсорбцию препарата. Метаболизируется в печени, выводится пре- имущественно с желчью.
Клиндамицин (далацин Ц*) более активен, чем линкомицин. В высоких дозах действует на токсоплазмы и плазмодии, поэтому дополнительные показания к применению - тропическая малярия (в сочетании с хинином) и токсоплазмоз (в сочетании с пириметамином). У клиндамицина более высокая биодоступность, не зависящая от приема пищи.
При применении линкосамидов могут возникать диспепсические расстройства, аллергические реакции.
Наиболее тяжелый побочный эффект - псевдомембранозный колит, который развивается в результате подавления неспорообразующей анаэробной флоры кишечника и размножения Clostridium difficile, продуцирующего энтеротоксины, вызывающие деструктивные изменения в стенке кишечника. Колит имеет тяжелое течение, характерны язвы, вплоть до прободения кишечника и развития перитонита. Для лечения колита назначают внутрь ванкомицин или метронидазол, а также проводят дезинтоксикационную терапию.
Аминогликозиды
В основе молекулы аминогликозидов лежит циклический спирт - аминоциклитол, к которому присоединены аминосахара. Группа аминогликозидов представлена природными и полусинтетическими препаратами, которые принято классифицировать по поколениям.
• Аминогликозиды I поколения.
- Стрептомицин, неомицин, канамицин.
• Аминогликозиды II поколения.
- Гентамицин, тобрамицин, сизомицин.
• Аминогликозиды III поколения.
- Амикацин.
Все аминогликозиды близки по своим свойствам и различаются, главным образом, по активности, спектру действия, выраженности побочных эффектов и устойчивости микроорганизмов.
К общим свойствам аминогликозидов относят следующие:
• способность нарушать синтез белка в микробной клетке. Аминогликозиды связываются с 30S-субъединицей рибосом бактериальной клетки, что нарушает движение рибосомы по нити матричной РНК. Аминогликозиды также нарушают процессы считывания кода мРНК, что приводит к синтезу функционально неактивных белков;
• способность нарушать проницаемость цитоплазматической мембраны микроорганизмов;
• бактерицидный тип действия;
• потенцирование антибактериального действия пенициллинов и цефалоспоринов;
• широкий спектр антибактериального действия с преимущественным влиянием на грамотрицательную флору;
• высокая токсичность для человека, которая выражается в специфическом повреждении почек (нефротоксический эффект), слухового и вестибулярного аппарата (ототоксический эффект), угнетении нервно-мышечной передачи, проявляющемся ослаблением дыхания, снижением мышечного тонуса и двигательной функции;
• сходные фармакокинетические свойства - аминогликозиды практически не всасываются из ЖКТ (высокогидрофильны), плохо проходят через гистогематические барьеры, практически не метаболизируются и выводятся почками в неизмененном виде, создавая в моче высокие концентрации.
Спектр действия аминогликозидов включает многие грамположительные и грамотрицательные микроорганизмы (стафилококки, стрептококки, пневмококки, кишечную палочку, сальмонеллы, шигеллы, клебсиеллы, протей, энтеробактерии, синегнойную палочку). Аминогликозиды I поколения оказывают угнетающее воздействие на микобактерии туберкулеза, возбудители туляремии и чумы. К аминогликозидам не чувствительны анаэробы, спирохеты и простейшие.
Применяют аминогликозиды при инфекциях различной локализации, вызванных грамотрицательными микроорганизмами, при синегнойной инфекции, а также при туберкулезе, чуме, туляремии, бруцеллезе.
Аминогликозиды I поколения в настоящее время применяют ограниченно в связи с быстрым развитием устойчивости микрофлоры и высокой токсичностью.
Стрептомицин применяют для лечения туберкулеза и терапии некоторых особо опасных инфекций (чума, туляремия) в комбинации с тетрациклином. Вводят препарат чаще всего внутримышечно. Стрептомицин оказывает выраженное ототоксическое действие.
Неомицин - самый ототоксичный аминогликозид. Применяют внутрь для санации кишечника при подготовке к операциям на
ЖКТ (неомицин не всасывается в кишечнике) и местно для лечения гнойных поражений кожи (пиодермии, инфицированные экземы и др.). Наружно неомицин иногда используют с глюкокортикоидами (входит в состав комбинированных мазей локакортен-Н*, синалар Н* и др.). Для парентерального введения препарат не используют в связи с высокой токсичностью.
Канамицин применяют внутрь по тем же показаниям, что и неомицин, и парентерально для лечения туберкулеза.
Аминогликозиды II поколения высокоактивны в отношении синегнойной палочки и некоторых других микроорганизмов, устойчивых к препаратам I поколения и антибиотикам других групп. К препаратам этого поколения медленнее развивается устойчивость.
Основной представитель аминогликозидов II поколения - г е н - т а мицин . Препарат применяют, главным образом, при тяжелых инфекциях (сепсисе, пневмонии, эндокардите, инфекциях мочевыводящих путей и др.), вызванных грамотрицательными бактериями, устойчивыми к другим антибиотикам. Вводят препарат внутримышечно и внутривенно. Гентамицин используют также местно при лечении инфицированных ран и ожогов. При применении гентамицина возникают побочные эффекты, типичные для аминогликозидов.
Тобрамицин и сизомицин аналогичны по своим свойствам гентамицину.
К аминогликозидам III поколения относят амикацин. В отличие от гентамицина амикацин действует на многие штаммы грамотри- цательных бактерий, резистентных к аминогликозидам II поколения, поскольку он не инактивируется бактериальными ферментами. Применяют препарат для лечения наиболее тяжелых инфекций, вызванных множественно устойчивой микрофлорой. Вводят внутримышечно и внутривенно.
При парентеральном применении аминогликозидов необходим систематический контроль функций почек, состояния слуха и вести- булярной системы. Аминогликозиды противопоказаны при заболеваниях почек и слухового нерва, беременности, миастении.
Тетрациклины
К группе тетрациклинов относят природные и полусинтетические антибиотики, структурную основу которых составляют четыре конденсированных шестичленных кольца.
Классифицируют тетрациклины в зависимости от способа получения.
• Природные (биосинтетические) антибиотики.
- Тетрациклин, окситетрациклин.
• Полусинтетические антибиотики.
- Метациклин (рондамицин*), доксициклин (вибрамицин*). Общие свойства тетрациклинов следующие:
• способность ингибировать синтез микробных белков на уровне рибосом. Тетрациклины связываются с 30S-субъединицей бактериальных рибосом, в результате чего приостанавливается процесс удлинения полипептидной цепи;
• бактериостатический тип действия. Тетрациклины наиболее активны в отношении размножающихся микроорганизмов;
• широкий спектр антимикробного действия;
• высокая активность в отношении внутриклеточных микроорганизмов;
• большая липофильность, обеспечивающая препаратам высокую степень всасывания из ЖКТ, способность преодолевать биологические барьеры и накапливаться в тканях;
• способность связывать в хелатные комплексы двухвалентные ионы - железа, кальция, магния, цинка.
Как антибиотики широкого спектра действия тетрациклины применяют при многих инфекционных заболеваниях. В первую очередь тетрациклины показаны при бруцеллезе, риккетсиозах (сыпной тиф, ку-лихорадка и др.), чуме, холере, туляремии. Тетрациклины назначают при заболеваниях, вызываемых кишечной палочкой (перитониты, холециститы и др.), шигеллой (бациллярная дизентерия), спирохетами (сифилис), хламидиями (трахома, орнитоз, мочеполовой хламидиоз и др.), микоплазмами (возбудителями атипичной пневмонии). Тетрациклины также используют для эрадикации Helicobacter pylori при язвенной болезни желудка и двенадцатиперстной кишки.
Широкое применение тетрациклинов в медицинской практике привело к появлению большого количества резистентных к этим антибиотикам штаммов стафилококков, энтерококков, стафилококков и пневмококков. При этом вырабатывается перекрестная устойчивость по отношению ко всем препаратам тетрациклинового ряда.
Длительность антибактериального действия препаратов данной группы неодинакова. По этому признаку среди них следует различать:
• тетрациклины короткого действия (6-8 ч) - тетрациклин и окситетрациклин;
• тетрациклины длительного действия (12-24 ч) - метациклин и доксициклин.
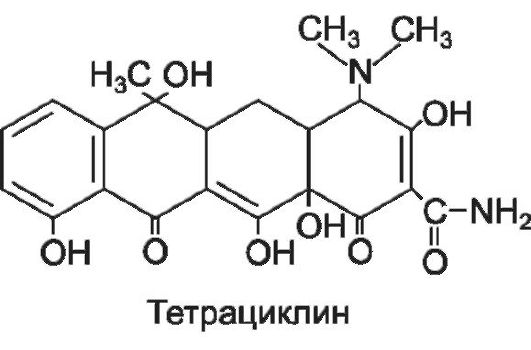
Тетрациклины обычно назначают внутрь (в капсулах или таблетках, покрытых оболочкой). Препараты короткого действия назначают четыре раза в сутки, длительного - 1-2 раза в сутки. Кроме того, при тяжелых формах гнойно-септических заболеваний растворимые соли тетрациклинов вводят парентерально (внутримышечно, внутривенно, в полости тела).
При применении тетрациклинов нередко возникают побочные эффекты аллергической и неаллергической природы. Наиболее частое проявление аллергических реакций - кожная сыпь и крапивница, в редких случаях могут возникнуть отек Квинке и анафилактический шок.
Из побочных эффектов неаллергической природы следует отметить раздражающее действие на слизистые пищеварительного тракта (тошнота, рвота, боли в животе, метеоризм, поносы) при пероральном применении, а при внутривенном введении в случае попадания на стенку вены - развитие тромбофлебитов.
Тетрациклины оказывают гепатотоксическое действие, особенно выраженное при нарушении функций печени.
Антибиотики данной группы оказывают общее катаболическое действие: угнетают синтез белка, способствуют выведению из орга- низма аминокислот, витаминов и других соединений.
Тетрациклины депонируются в костной ткани, в том числе в тканях зубов, и образуют труднорастворимые комплексы с кальцием, в связи с чем нарушается образование скелета, происходит окрашивание и повреждение зубов. По этой причине тетрациклины не следует назначать детям до 12 лет и беременным.
Характерный побочный эффект тетрациклинов - дисбактериоз и суперинфекция с возникновением орального и других видов кан-
дидоза. В редких случаях может возникнуть псевдомембранозный энтероколит.
Противопоказаны тетрациклины при беременности, кормлении грудью, тяжелой патологии печени и почек.
37.2. СИНТЕТИЧЕСКИЕ АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА
Антибактериальной активностью обладают многие синтетические вещества из разных классов химических соединений. Наибольшую практическую ценность среди них представляют следующие группы препаратов.
• Сульфаниламиды.
• Производные хинолона.
• Производные нитрофурана.
• Производные 8-оксихинолина.
• Производные хиноксалина.
• Оксазолидиноны.
Сульфаниламидные препараты
К сульфаниламидным препаратам относят группу соединений с общей структурной формулой.
Сульфаниламиды можно рассматривать как производные амида сульфаниловой кислоты.
Химиотерапевтическая активность сульфаниламидных препаратов впервые была обнаружена в 1935 году немецким врачом и исследователем Г. Домагком, который опубликовал данные об успешном применении в клинике пронтозила (красного стрептоцида), синтезированного в качестве красителя. Вскоре было установлено, что действующее начало красного стрептоцида - это образующийся при метаболизме сульфаниламид (стрептоцид*).
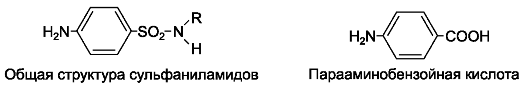
Впоследствии на основе молекулы сульфаниламида было синтезировано большое количество его производных, часть из которых
получила широкое применение в медицине. Синтез различных модификаций сульфаниламидов осуществлялся в направлении создания более эффективных, продолжительно действующих и менее токсичных препаратов.
За последние годы использование сульфаниламидов в клинической практике снизилось, поскольку по активности они значительно уступают современным антибиотикам и обладают сравнительно высокой токсичностью. Кроме того, в связи с многолетним, часто бесконтрольным и неоправданным применением сульфаниламидов большинство микроорганизмов выработало к ним резистентность.
На микроорганизмы сульфаниламиды оказывают бактериостатическое действие. Механизм бактериостатического действия сульфа- ниламидов заключается в том, что эти вещества, имея структурное сходство с парааминобензойной кислотой, конкурируют с ней в процессе синтеза фолиевой кислоты - фактора роста микроорганизмов.
Сульфаниламиды конкурентно ингибируют дигидроптероатсинтетазу, а также препятствуют включению парааминобензойной кислоты в дигидрофолиевую. Нарушение синтеза дигидрофолиевой кислоты уменьшает образование из нее тетрагидрофолиевой кислоты, которая необходима для синтеза пуриновых и пиримидиновых оснований (рис. 37-1). В результате этого подавляется синтез нуклеиновых кислот, что приводит к торможению роста и размножения микроорганизмов.
Сульфаниламиды не нарушают синтез дигидрофолиевой кислоты в клетках макроорганизма, поскольку последние не синтезируют, а утилизируют готовую дигидрофолиевую кислоту.
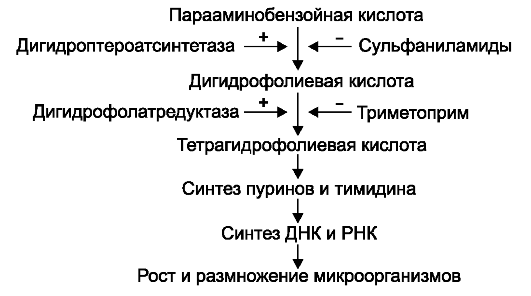
Рис. 37-1. Механизм действия Ко-тримоксазола
В средах, где имеется много парааминобензойной кислоты (гной, тканевой детрит), сульфаниламиды малоэффективны. По этой же причине они слабо действуют в присутствии прокаина (новокаина*) и бензокаина (анестезина*), гидролизующихся с образованием пара- аминобензойной кислоты.
Длительное применение сульфаниламидов приводит к возникновению устойчивости микроорганизмов.
Изначально сульфаниламиды были активны в отношении широкого спектра грамположительных и грамотрицательных бактерий, однако в настоящее время многие штаммы стафилококков, стрептококков, пневмококков, гонококков, менингококков приобрели устойчивость. Сульфаниламиды сохранили свою активность в отношении нокардий, токсоплазм, хламидий, малярийных плазмодиев и актиномицетов.
Основные показания для назначения сульфаниламидов: нокардиоз, токсоплазмоз, тропическая малярия, устойчивая к хлорохину. В некоторых случаях сульфаниламиды применяют при кокковых инфекциях, бациллярной дизентерии, инфекциях, вызываемых кишечной палочкой.
Сульфаниламиды практически не отличаются друг от друга по спектру активности. Основное различие между сульфаниламидами заключается в их фармакокинетических свойствах.
• Сульфаниламиды для резорбтивного действия (хорошо всасывающиеся из ЖКТ).
- Короткого действия (t1/2 < 10 ч).
Сульфаниламид (стрептоцид*), сульфатиазол (норсульфазол*), сульфаэтидол (этазол*), сульфакарбамид (уросульфан*), сульфадимидин (сульфадимезин*).
- Средней продолжительности действия (t1/210-24 ч). Сульфадиазин (сульфазин), сульфаметоксазол.
- Длительного действия (t1/2 24-48 ч). Сульфадиметоксин , сульфамонометоксин .
- Сверхдлительного действия (t1/2 > 48 ч). Сульфален.
• Сульфаниламиды, действующие в просвете кишечника (плохо всасывающиеся из ЖКТ).
Фталилсульфатиазол (фталазол*), сульфагуанидин (сульгин*).
• Сульфаниламиды для местного применения.
Сульфацетамид (сульфацил-натрий*), сульфадиазин серебра, сульфатиазол серебра (аргосульфан*).
• Комбинированные препараты сульфаниламидов и салициловой кислоты.
Сульфасалазин, месалазин (салазопиридазин*), салазодиметок- син*.
• Комбинированные препараты сульфаниламидов с триметопримом.
Ко-тримоксазол (бактрим*, бисептол*), лидаприм*, сульфатон*, потесептил*.
Препараты для резорбтивного действия хорошо всасываются из ЖКТ. Наибольшую концентрацию в крови создают препараты короткой и средней продолжительности действия. С белками плазмы крови в большей степени связываются препараты длительного и сверхдлительного действия. Сульфаниламиды распределяются по всем тканям, проходят через ГЭБ, плаценту, накапливаются в серозных полостях тела. Основной путь превращения сульфаниламидов в организме - ацетилирование, происходящее в печени. Степень ацетилирования для разных препаратов неодинакова. Ацетилированные метаболиты фармакологически неактивны. Растворимость ацетилированных метаболитов значительно хуже, чем исходных сульфаниламидов, особенно при кислых значениях pH мочи, что может приводить к образованию в моче кристаллов (кристаллурии). Выделяются сульфаниламиды и их метаболиты преимущественно почками.
С у л ь ф а н и л а м и д - один из первых антимикробных препаратов сульфаниламидной структуры. В настоящее время препарат практически не используют ввиду его низкой эффективности и высокой токсичности.
Сульфатиазол,сульфаэтидол,сульфадимидин и сульфакарбамид применяют 4-6 раз в сутки. Уросульфан* используют для лечения инфекций мочевыводящих путей, поскольку препарат выводится почками в неизмененном виде и создает в моче высокие концентрации. С у л ь ф а м е т о к с а з о л входит в состав комбинированного препарата ко-тримоксазол*. Сульфамонометоксин и сульфадиметоксин назначают 1-2 раза в сутки.
С у л ь ф а л е н применяют ежедневно при острых или быстро протекающих инфекционных процессах, один раз в 7-10 дней - при хронических, длительно текущих инфекциях.
Сульфаниламиды для резорбтивного действия вызывают много побочных эффектов. При их применении возможны нарушения в сис- теме крови (анемия, лейкопения, тромбоцитопения), гепатотоксичность, аллергические реакции (кожные сыпи, лихорадка, агрануло-
цитоз), диспепсические расстройства. При кислых значениях pH мочи возможна кристаллурия. Для профилактики возникновения кристаллурии сульфаниламиды необходимо запивать щелочной минеральной водой или раствором соды.
Сульфаниламиды, действующие в просвете кишечника, практически не всасываются в ЖКТ и создают высокие концентрации в просвете кишки, поэтому их применяют при лечении кишечных инфекций (шигеллеза, энтероколитов), а также для профилактики кишечной инфекции в послеоперационном периоде. Однако в настоящее время многие штаммы возбудителей кишечных инфекций приобрели устойчивость к сульфаниламидам. Для повышения эффектив- ности лечения одновременно с сульфаниламидами, действующими в просвете кишечника, целесообразно назначать хорошо всасывающиеся препараты (этазол*, сульфадимезин* и др.), поскольку возбудители кишечных инфекций локализуются не только в просвете, но и в стенке кишки. При приеме препаратов этой группы следует назначать витамины группы В, так как сульфаниламиды подавляют рост кишечной палочки, участвующей в синтезе витаминов этой группы.
Ф т а л и л с у л ь ф а т и а з о л оказывает антимикробное действие после отщепления фталевой кислоты и освобождения аминогруппы. Действующее начало фталилсульфатиазола - норсульфазол*.
Фталилсульфатиазол назначают 4-6 раз в сутки. Препарат малотоксичен. Побочных эффектов практически не вызывает.
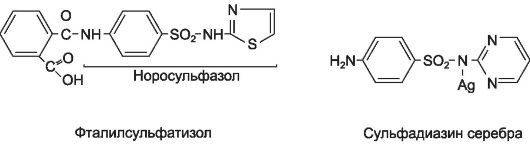
Сульфагуанидин по действию сходен с фталилсульфатиазолом.
С у л ь ф а ц е т а м и д - сульфаниламид для местного применения, который применяют в глазной практике в виде растворов (10-20-30%) и мази (10-20-30%) при конъюнктивитах, блефаритах, гнойных язвах роговицы и гонорейных заболеваниях глаз. Пациенты обычно хорошо переносят препарат. Иногда, особенно при использовании более концентрированных растворов, возможно раздражающее
действие; в этих случаях назначают растворы меньшей концентрации.
Сульфадиазин серебра и сульфатиазол серебра отличаются наличием в молекуле атома серебра, что усиливает их антибактериальное действие. Препараты применяют местно в виде мазей при ожоговых и раневых инфекциях, трофических язвах, пролежнях. При использовании препаратов могут развиться кожные аллергические реакции.
К комбинированным препаратам, сочетающим в своей структуре фрагменты сульфаниламида и салициловой кислоты, относят суль- фасалазин, салазопиридазин*, салазодиметоксин*. В толстой кишке под влиянием микрофлоры происходит гидролиз этих соединений до 5-аминосалициловой кислоты и сульфаниламидного компонента. Все эти препараты обладают антибактериальным и противовоспалительным действием. Применяют их при неспецифическом язвенном колите и болезни Крона, а также в качестве базисных средств при лечении ревматоидного артрита.
Сульфасалазин - азосоединение сульфапиридина с салициловой кислотой. Препарат назначают внутрь. При приеме препарата могут возникнуть аллергические реакции, диспепсические явления, жжение в прямой кишке, лейкопения.
Аналогичными свойствами обладают салазопиридазин* и салазодиметоксин*.
Триметоприм - производное пиримидина, оказывающее бактериостатическое действие. Препарат блокирует восстановление дигидрофолиевой кислоты в тетрагидрофолиевую вследствие ингибирования дигидрофолатредуктазы.
Сродство триметоприма к бактериальной дигидрофолатредуктазе в 50 000 раз выше, чем к дигидрофолатредуктазе клеток млекопитающих.
Комбинация триметоприма с сульфаниламидами характеризуется бактерицидным эффектом и широким спектром антибактериального
действия, включая микрофлору, устойчивую ко многим антибиотикам и обычным сульфаниламидам.
Наиболее известный препарат из данной группы, ко-тримоксазол - это сочетание пяти частей сульфаметоксазола (сульфаниламид средней продолжительности действия) и одной части триметоприма. Выбор сульфаметоксазола в качестве компонента ко-тримоксазола вызван тем, что он имеет одинаковую скорость элиминации с триметопримом.
Ко-тримоксазол хорошо всасывается из ЖКТ, проникает во многие органы и ткани, создает высокие концентрации в брон- хиальном секрете, желчи, моче, предстательной железе. Проникает через ГЭБ, особенно при воспалении мозговых оболочек. Выводится преимущественно с мочой.
Препарат применяют при инфекциях дыхательных и мочевыводящих путей, хирургических и раневых инфекциях, бруцеллезе.
При применении препарата возникают побочные эффекты, характерные для сульфаниламидов резорбтивного действия. Ко-тримокса- зол противопоказан при выраженных нарушениях функций печени, почек и кроветворения. Препарат не следует назначать при беременности.
Аналогичные препараты: лидаприм* (сульфаметрол+три метоприм), сульфатон* (сульфамонометоксин+триметоприм), потесептил* (сульфадимидин+триметоприм).
Производные хинолона
Производные хинолона представлены нефторированными и фторированными соединениями. Наибольшей антибактериальной активностью обладают соединения, содержащие в положении 7 хинолонового ядра незамещенный или замещенный пиперазиновый цикл, а в положении 6 - атом фтора. Эти соединения названы фторхинолонами.
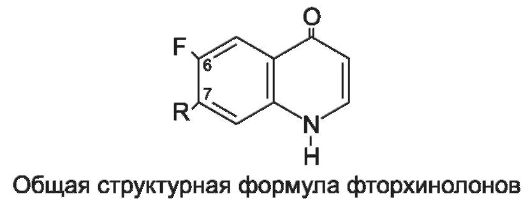
Классификация производных хинолона.
• Нефторированные хинолоны.
- Налидиксовая кислота (невиграмон*, неграм*), оксолиновая кислота (грамурин*), пипемидовая кислота (палин*).
• Фторхинолоны (препараты I поколения).
- Ципрофлоксацин (цифран*, ципробай*), ломефлоксацин (максаквин*), норфлоксацин (нолицин*), офлоксацин (таривид*), эноксацин (эноксор*), пефлоксацин (абактал*).
• Фторхинолоны (новые препараты II поколения).
- Левофлоксацин (таваник*), спарфлоксацин, моксифлоксацин. Родоначальник группы нефторированных хинолонов - н а л и -
диксовая кислота. Препарат активен только в отношении некоторых грамотрицательных микроорганизмов - кишечной палочки, шигелл, клебсиелл, сальмонелл. Синегнойная палочка устойчива к налидиксовой кислоте. Резистентность микроорганизмов к препарату возникает быстро.
Препарат хорошо всасывается в ЖКТ, особенно натощак. Высокие концентрации препарата создаются только в моче (около 80% препарата выделяется с мочой в неизмененном виде). t1/2 составляет 1-1,5 ч.
Применяют налидиксовую кислоту при инфекциях мочевыводящих путей (цистит, пиелит, пиелонефрит). Назначают препарат также для профилактики инфекций при операциях на почках и мочевом пузыре.
При применении препарата возможны диспепсические расстройства, возбуждение ЦНС, нарушения функций печени, аллергические реакции.
Налидиксовая кислота противопоказана при почечной недостаточности.
Оксолиновая кислота и пипемидовая кислота аналогичны по фармакологическому действию налидиксовой кислоте.
Для фторхинолонов характерны следующие общие свойства.
• Препараты этой группы ингибируют жизненно важный фермент микробной клетки - ДНК-гиразу (топоизомеразу II типа), обеспечивающую суперспирализацию и ковалентное замыкание молекул ДНК. Блокада ДНК-гиразы приводит к разобщению нитей ДНК и, соответственно, к гибели клетки (бактерицидное действие). Избирательность антимикробного действия фторхинолонов связана с тем, что в клетках макроорганизма отсутствует топоизомераза II типа.
• Для фторхинолонов характерен широкий спектр антибактериального действия. Они активны в отношении грамположительных и грамотрицательных кокков, кишечной палочки, сальмонелл, шигелл, протея, клебсиелл, хеликобактерий, синегнойной палочки. Отдельные препараты (ципрофлоксацин, офлоксацин, ломефлоксацин) действуют на микобактерии туберкулеза. К фторхинолонам не чувствительны спирохеты, листерии и большинство анаэробов.
• Фторхинолоны действуют на внеклеточно и внутриклеточно локализованные микроорганизмы.
• Для препаратов этой группы характерен выраженный постантибиотический эффект.
• Резистентность микрофлоры к фторхинолонам развивается относительно медленно.
• Фторхинолоны создают высокие концентрации в крови и тканях при приеме внутрь, причем биодоступность не зависит от приема пищи.
• Фторхинолоны хорошо проникают в различные органы и ткани: легкие, почки, кости, простату и др.
Применяют фторхинолоны при инфекциях мочевыводящих, дыхательных путей, ЖКТ, вызванных чувствительными к ним микроорганизмами. Назначают фторхинолоны внутрь и внутривенно.
При применении фторхинолонов возможны аллергические реакции, диспепсические явления, бессонница. Препараты этой группы тормозят развитие хрящевой ткани, поэтому они противопоказаны беременным и кормящим матерям; у детей их можно применять только по жизненным показаниям. В редких случаях фторхинолоны могут вызывать развитие тендинитов - воспаления сухожилий, что при физической нагрузке может привести к их разрывам.
Новые фторхинолоны (II поколение) обладают более высокой активностью в отношении грамположительных бактерий, прежде всего - пневмококков. Активность левофлоксацина и спарфлоксацина превышает активность ципрофлоксацина и офлоксацина в 2-4 раза, а моксифлоксацина - в четыре раза и более. Важно, что действие новых фторхинолонов не различается в отношении пенициллинчувствительных и пенициллинрезистентных штаммов пневмококка.
Новые фторхинолоны обладают более выраженной активностью в отношении стафилококков, причем некоторые препараты оказывают умеренное воздействие в отношении метициллинрезистентных стафилококков.
Если препараты I поколения обладают умеренной активностью в отношении хламидий и микоплазм, то препараты II поколения - высокой, сравнимой с активностью макролидов и доксициклина.
Некоторые новые фторхинолоны (моксифлоксацин и др.) обладают хорошей активностью в отношении анаэробов, включая Clostridium spp. и Bacteroides spp., что позволяет применять их при смешанных инфекциях в режиме монотерапии.
Основное применение новых фторхинолонов - внебольничные инфекции дыхательных путей. Показана также эффективность этих препаратов при инфекции кожи и мягких тканей, урогенитальных инфекциях.
Наиболее хорошо изучен из новых фторхинолонов левофлоксацин - левовращающий изомер офлоксацина. Поскольку левофлоксацин существует в двух лекарственных формах - парентеральной и пероральной, то возможно его применение при тяжелых инфекциях в стационаре. Биодоступность препарата близка к 100%. Клиническая эффективность левофлоксацина при однократном назначении 250-500 мг/сут - существенное достоинство препарата, однако при генерализованных инфекционных процессах, протекающих в тяжелой форме, левофлоксацин назначают дважды в сутки.
Формирование резистентности к левофлоксацину возможно, однако устойчивость к нему развивается медленно и не становится перекрестной с другими антибиотиками.
Левофлоксацин - наиболее безопасный фторхинолон с низким уровнем гепатотоксичности. Он наиболее безопасен, наряду с офлоксацином и моксифлоксацином, в отношении влияния на ЦНС. Побочные эффекты на сердечно-сосудистую систему бывают значительно реже, чем при применении других фторхинолонов. Увеличение дозы левофлоксацина до 1000 мг/сут не приводит к повышению выраженности побочных эффектов, а вероятность их возникновения не зависит от возраста больного.
В целом уровень побочных эффектов, связанных с применением левофлоксацина, наиболее низкий среди фторхинолонов, а переноси- мость его расценивают как очень хорошую.
Производные нитрофурана
Производные нитрофурана, обладающие антимикробной активностью, характеризуются наличием нитрогруппы в положении С5 и различных заместителей в положении С2 фуранового ядра.
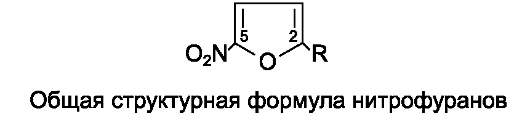
К нитрофуранам относят следующие препараты.
Нитрофурал (фурацилин*), нитрофурантоин (фурадонин*), фуразолидон, фуразидин (фурагин*).
Для производных нитрофурана характерны следующие общие свойства.
• Способность нарушать структуру ДНК. В зависимости от концентрации нитрофураны оказывают бактерицидное или бактериостатическое действие.
• Широкий спектр антимикробного действия, который включает бактерии (грамположительные кокки и грамотрицательные палочки), вирусы, простейшие (лямблии, трихомонады). Производные нитрофурана способны действовать на штаммы микроорганизмов, устойчивые к некоторым антибиотикам. На анаэробы и синегнойную палочку нитрофураны не действуют. Устойчивость к нитрофуранам возникает редко.
• Высокая частота побочных реакций, возникающих при приеме препаратов.
Нитрофурал используют преимущественно в качестве антисептика (для наружного применения) для лечения и предупреждения гнойно-воспалительных процессов.
Нитрофурантоин создает высокие концентрации в моче, поэтому его применяют при инфекциях мочевыводящих путей.
Фуразолидон плохо всасывается в ЖКТ и создает высокие концентрации в просвете кишки. Применяют фуразолидон при кишечных инфекциях бактериальной и протозойной этиологии.
Ф у р а з и д и н применяют внутрь при инфекциях мочевыводящих путей и местно для промывания и спринцевания в хирургической практике.
Производные нитрофурана могут вызвать диспепсические расстройства, поэтому нитрофураны следует принимать во время или после еды. Для препаратов этой группы характерно гепатотоксическое, гематотоксическое и нейротоксическое действие. При длительном применении производные нитрофурана могут вызвать легочные реакции (отек легких, бронхоспазм, пневмониты).
Производные нитрофурана противопоказаны при тяжелой почечной и печеночной недостаточности, беременности.
Производные 8-оксихинолина
К противомикробным средствам данной группы относят 5-нитро- 8-оксихинолин - нитроксолин (5-НОК*). Нитроксолин оказывает бактериостатическое действие путем селективного ингибирования синтеза бактериальной ДНК. Препарат обладает широким спектром антибактериального действия. Хорошо всасывается из ЖКТ и выделяется в неизмененном виде почками, в связи с чем в моче препарат накапливается в высокой концентрации.
Применяют нитроксолин для лечения инфекций мочевыводящих путей и для профилактики инфекций после операции на почках и мочевыводящих путях. Пациенты обычно хорошо переносят препарат. Иногда возникают диспепсические явления. Моча при лечении препаратом окрашивается в шафраново-желтый цвет.
Производные хиноксалина
Выраженной антибактериальной активностью обладают некоторые производные хиноксалина. К препаратам этой группы относят хиноксидин* и диоксидин*. Производные хиноксалина оказывают бактерицидное действие, которое связано со способностью активировать процессы перекисного окисления, приводящие к нарушению биосинтеза ДНК и глубоким структурным изменениям в цитоплазме микробной клетки. В связи с высокой токсичностью производные хиноксалина используют только по жизненным показаниям для лечения тяжелых форм анаэробной или смешанной аэробно-анаэробной инфекции, вызванной полирезистентными штаммами при неэффективности других антимикробных средств. Назначают хиноксидин* и диоксидин* только взрослым в условиях стационара. Препараты высокотоксичны; вызывают головокружение, озноб, судорожные сокращения мышц и т.п.
Оксазолидиноны
Оксазолидиноны - новый класс синтетических антибактериальных средств, высокоактивных против грамположительных микроор- ганизмов.
Линезолид - первый препарат этого класса, зарегистрированный в РФ под патентованным (торговым) названием зивокс*. Для него характерны следующие свойства:
• способность ингибировать синтез белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, действующих на белковый синтез, линезолид воздействует на ранних этапах трансляции путем необратимого связывания 30S- и 50S-субъединицей рибосом, в результате чего нарушается процесс образования 70S- комплекса и формирование пептидной цепи. Этот уникальный механизм действия препятствует развитию перекрестной резистентности с такими антибиотиками, как макролиды, аминогликозиды, линкозамиды, тетрациклины, хлорамфеникол;
• тип действия - бактериостатический. Бактерицидная активность отмечена для Bacteroides fragilis, Clostridium perfringens и некоторых штаммов стрептококков, включая Streptococcus pneumoniae и Streptococcus pyogenes;
• спектр действия включает основные грамположительные патогены, такие проблемные возбудители, как метициллин- и гликопептидрезистентные стафилококки; пенициллин- и макролидрезистентные пневмококки и гликопептидрезистентные энтерококки. Линезолид менее активен в отношении грамотрицательных бактерий;
• в высокой концентрации накапливается в бронхолегочном эпителии. Хорошо проникает в кожу, мягкие ткани, легкие, сердце, кишечник, печень, почки, ЦНС, синовиальную жидкость, кости, желчный пузырь. Имеет 100% биодоступность;
• резистентность развивается очень медленно. Риск развития резистентности к линезолиду связывают с длительным парентеральным применением (4-6 нед).
Активность in vitro и in vivo, а также клинические исследования доказали эффективность линезолида при госпитальной и внебольничной пневмонии (в комбинации с антибиотиками, активными в отношении грамотрицательных микроорганизмов); инфекциях, вызванных ванкомицинрезистентными энтерококками; при инфекциях кожи и мягких тканей.
Рекомендован следующий режим дозирования: 600 мг (перорально или внутривенно) каждые 12 ч. Линезолид можно применять в режиме ступенчатой терапии с начальным назначением парентерально, затем перорально (на 3-5-й день), что обусловливает его фармакоэкономичес-
кие преимущества в качестве альтернативы ванкомицину. При лечении инфекций кожи и мягких тканей доза составляет 400 мг каждые 12 ч.
Линезолид показал хорошую переносимость как при пероральном, так и при внутривенном применении. Наиболее часто отмечали побочные эффекты со стороны ЖКТ (диарея, тошнота, окрашивание языка), головную боль и кожную сыпь. Обычно эти явления нетяжелые по интенсивности и недлительные. Отмечена обратимая тромбоцитопения при применении линезолида более двух недель.
Линезолид - обратимый неселективный ингибитор моноамиоксидазы, поэтому может взаимодействовать с адренергическими средс- твами, такими как допамин, эпинефрин, и серотонинергическими препаратами. При совместном приеме возможно повышение прессорного ответа на допаминергические, вазопрессорные или симпатомиметические препараты, что требует снижения дозы. Пероральная суспензия линезолида содержит фенилалин, поэтому следует избегать ее назначения больным с фенилкетонурией.
37.3. ПРОТИВОСИФИЛИТИЧЕСКИЕ СРЕДСТВА
Сифилис - хроническое венерическое заболевание, характеризующееся поражением кожи, слизистых оболочек, внутренних органов, костей и нервной системы. Это общее инфекционное заболевание, которое длится у нелеченых больных многие годы и отличается волнообразным течением со сменой периодов обострения скрытыми периодами.
Возбудитель сифилиса - бледная трепонема (Treponema pallidum). Основной путь заражения - половой, при различных формах половых контактов.
Лечение сифилиса проводят по специальным схемам.Лекарственная терапия сифилиса, как правило, комплексная, включает антибактериальные препараты, а также средства, влияющие на иммунологическую резистентность организма.
Для лечения сифилиса используют антибиотики и синтетические средства.
• Противосифилитические средства Антибиотики.
• - Препараты бензилпенициллина. Бензилпенициллина натриевая и калиевая соли*, бензилпенициллин прокаина, бензатин бензилпенициллин (бицил- лин-1*, бициллин-5*).
- Цефалоспорины.
• Цефалоридин (цепорин*), цефтриаксон (лонгацеф*).
- Макролиды и азалиды.
• Эритромицин, азитромицин (сумамед*). • Синтетические средства.
- Препараты висмута.
• Бийохинол*, бисмоверол*.
- Препараты мышьяка.
• Миарсенол*, ацетарсол (осарсол*).
Основное место в лечении сифилиса занимают препараты бензилпенициллина. Препараты бензилпенициллина эффективны при сифилисе на всех его стадиях. Назначают их курсами.
При непереносимости бензилпенициллина для лечения сифилиса можно использовать антибиотики из других групп (см. макролиды, цефалоспорины).
Препараты висмута и мышьяка применяют для лечения различных форм сифилиса преимущественно в комбинации с антибио- тиками группы пенициллина. Механизм действия этих препаратов обусловлен способностью блокировать сульфгидрильные группы ферментов в клетках микроорганизмов и нарушать тем самым течение нормальных обменных процессов. Вводят их внутримышечно. При применении препаратов висмута возможно развитие гингивитов и стоматитов. Препараты мышьяка вызывают желтуху, гепатит, полиневриты.
37.4. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА
Противотуберкулезные средства - химиотера- певтические вещества, подавляющие рост и жизнедеятельность микобактерий туберкулеза.
Туберкулез - хроническая рецидивирующая инфекция, при которой микобактерии туберкулеза, выделяемые ими токсины и продукты тканевого распада обусловливают многообразные нарушения нормальной жизнедеятельности и патологические изменения в разных органах. В зависимости от локализации возбудителя выделяют туберкулез органов дыхания и туберкулез внелегочный: кожи, костей и суставов, мочеполовой системы, ЦНС, органов брюшной полости и др.
Основные принципы лечения туберкулеза состоят в следующем:
• для получения стойкого лечебного эффекта и предупреждения возможных рецидивов противотуберкулезные препараты необходимо применять длительно (от 6 мес до 1 года и более);
• для преодоления резистентности микобактерий следует проводить комбинированную химиотерапию;
• комплексное использование специфических противотуберкулезных препаратов и ЛС из разных фармакологических групп (иммуностимуляторов, гормональных препаратов, муколитических средств и др.).
До 40-х годов прошлого столетия человечество не знало эффективно действующих противотуберкулезных средств. В 1944 году из культуральной жидкости лучистого грибка Ваксманом был выделен стрептомицин. Два года спустя установили противотуберкулезную активность аминосалициловой кислоты (ПАСК*), а в 1952 году была доказана эффективность производных гидразида изоникотиновой кислоты.
Активностью в отношении микобактерий туберкулеза обладает значительное число препаратов, отличающихся по происхождению, химической структуре, механизму действия и клинической эффективности.
По происхождению все противотуберкулезные средства делят на антибиотики и синтетические антибактериальные средства.
• Противотуберкулезные средства - антибиотики.
- Аминогликозиды.
• Стрептомицина сульфат*, канамицин, амикацин.
- Антибиотики разных химических групп.
• Рифампицин, виомицин (флоримицина сульфат*), циклосерин, капреомицин.
• Синтетические противотуберкулезные средства.
- Производные гидразида изоникотиновой кислоты.
• Изониазид , фтивазид.
- Производные парааминосалициловой кислоты.
• ПАСК* (натрия парааминосалицилат*), бепаск*.
- Производные тиоамида изоникотиновой кислоты.
• Этионамид, протионамид.
- Производные разных химических групп.
• Этамбутол, пиразинамид, тиоацетазон.
Основное отличие синтетических противотуберкулезных средств от антибиотиков заключается в спектре действия: синтетические средства активны только в отношении микобактерий, а антибиотики обладают широким спектром антимикробного действия.
В зависимости от эффективности и токсичности противотуберкулезные средства делят на две группы.
• Препараты I ряда (основные антибактериальные).
- Изониазид и его производные, рифампицин, стрептомицин, ПАСК*, этамбутол.
• Препараты II ряда: (резервные).
- Циклосерин, флоримицина сульфат*, канамицин, этионамид, протионамид, пиразинамид, тиоацетазон.
Противотуберкулезные средства I ряда более активны, однако при их применении довольно быстро развивается устойчивость микобактерий туберкулеза. Препараты II ряда менее активны по действию на микобактерии туберкулеза; их основная особенность заключается в том, что они действуют на микобактерии, ставшие устойчивыми к препаратам I ряда. Кроме того, многие препараты II ряда более токсичны и чаще вызывают побочные эффекты.
По клинической эффективности все противотуберкулезные средства принято делить на три группы.
• Группа I (наиболее эффективные средства).
- Изониазид и его производные, рифампицин.
• Группа II (препараты средней эффективности).
- Стрептомицин, канамицин, виомицин, циклосерин, этамбутол, этионамид, протионамид, пиразинамид, офлоксацин, ломефлоксацин.
• Группа III (препараты низкой эффективности).
- ПАСК*, тиоацетазон.
Изониазид (гидразид изоникотиновой кислоты) - основной представитель производных изоникотиновой кислоты, нашедших применение в качестве противотуберкулезных средств. Механизм действия изониазида заключается в ингибировании ферментов, необходимых для синтеза миколевых кислот (основного структурного компонента клеточной стенки микобактерий туберкулеза).
Так как синтез миколевых кислот наиболее интенсивно происходит в растущих клетках, изониазид в отношении последних оказывает бактерицидное действие; на клетки, находящиеся в состоянии покоя - бактериостатическое. Для изониазида характерна высокая избирательность химиотерапевтического действия, так как в тканях макроорганизма, а также у других микроорганизмов миколевые кислоты отсутствуют.
Изониазид хорошо всасывается из ЖКТ. Максимальную концентрацию препарата в крови регистрируют через 1-4 ч после приема внутрь.
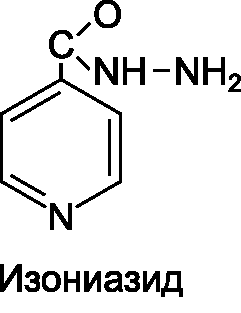
Изониазид легко проникает через ГЭБ, его обнаруживают в различных тканях и жидкостях организма. Препарат метаболизируется в печени путем ацетилирования. Ацетилированная форма изониазида не обладает химиотерапевтической активностью. Установлено, что скорость ацетилирования обусловлена генетически. У «быстрых ацетиляторов» средний период полувыведения изониазида меньше 1 ч, в то время как у «медленных ацетиляторов» - 3 ч. «Быстрым ацетиляторам» препарат назначают в более высоких дозах. Изониазид выводится преимущественно почками.
Изониазид используют при всех формах туберкулеза. Препарат вводят обычно внутрь, иногда ректально. При необходимости препарат применяют внутривенно и внутримышечно.
При применении изониазида могут возникать разнообразные побочные эффекты. Наиболее часто они затрагивают центральную и периферическую нервную систему (невриты, мышечные подергивания, бессонница, психические нарушения, расстройства памяти). Возникновение периферических нейропатий связывают с угнетением процесса образования пиридоксальфосфата, а нарушения со стороны ЦНС - с возникающим недостатком ГАМК (предполагают, что изониазид нарушает переход глутамата в ГАМК).
Изониазид обладает гепатотоксическим действием, в некоторых случаях может вызвать лекарственный гепатит. При применении препарата возможны кожные аллергические реакции.
Для предупреждения и уменьшения побочных эффектов изониазида рекомендуют прием витаминов В1 и В6, а также глутаминовой кислоты.
Препарат противопоказан при эпилепсии, склонности к судорожным припадкам, нарушении функции печени и почек.
К производным гидразида изоникотиновой кислоты относят также фтивазид, опиниазид (салюзид растворимый*), метазид.
Рифампицин (рифампин*, бенемицин*) - полусинтетический антибиотик макроциклической структуры, обладающий широким спектром антибактериальной активности. Препарат активен в отноше-
нии микобактерий туберкулеза и лепры, некоторых грамотрицательных и грамположительных микроорганизмов. Рифампицин ингибирует бактериальную ДНК-зависимую РНК-полимеразу, что приводит к торможению синтеза РНК у бактерий. На человеческую РНК-полимеразу рифампицин не действует. В малых дозах препарат оказывает бактериостатическое действие, в больших - бактерицидное.
Рифампицин хорошо всасывается из ЖКТ, биодоступность при приеме натощак составляет 95%, но снижается в присутствии пищи. Препарат проникает в различные органы и ткани, проходит через ГЭБ. В печени рифампицин метаболизируется с образованием активного диацетилированного метаболита. Из организма выводится с мочой и желчью.
Рифампицин используют при легочной и внелегочной формах туберкулеза в сочетании с изониазидом и другими противотуберкулезными средствами. Назначают рифампицин внутрь и внутри- венно.
При применении рифампицина возможны нарушения функции печени; тромбоцитопения, анемия; гриппоподобный синдром (лихорадка, артралгия, миалгия).
Кроме того, препарат вызывает диспепсические расстройства, а также окрашивание мочи, слюны и слезной жидкости в оранжевый цвет.
Стрептомицин и канамицин - антибиотики, отно- сящиеся к группе аминогликозидов (см. главу 37). Применяют эти препараты, главным образом, для лечения впервые зарегистрированного туберкулеза легких и туберкулезных поражений других органов. Устойчвость микобактерий туберкулеза к аминогликозидам развивается довольно быстро.
Стрептомицина сульфат* вводят внутримышечно, интратрахеально и внутрикавернозно, а канамицина сульфат* - внутримышечно. Эти препараты характеризуются высокой токсичностью.
Виомицин (флоримицина сульфат*) - антибиотик, продукт жизнедеятельности лучистых грибов Streptomyces floridae. Препарат оказывает бактериостатическое действие на микобактерии туберкулеза, активен также в отношении некоторых грамположительных и грамотрицательных бактерий. «Резервный» препарат при лечении различных форм и локализаций туберкулеза. Вводят виомицин внутримышечно. При применении препарата может возникать ототоксическое действие, поэтому его нельзя комбинировать с антибиотиками из группы аминогликозидов.
Циклосерин - антибиотик, образующийся в процессе жизнедеятельности Streptomyces orchidaceus. В настоящее время циклосерин получают синтетически.
По химической структуре представляет собой D-4-амино-З-изок- сазолидинон. Циклосерин действует бактерицидно, нарушая синтез клеточной стенки микроорганизмов (см. главу 37). Препарат обладает широким спектром антибактериального действия: угнетает грамположительные и грамотрицательные бактерии. Наиболее ценное его свойство - активность в отношении микобактерий туберкулеза. Устойчивость к циклосерину развивается медленно.
Циклосерин хорошо всасывается при приеме внутрь, создавая высокие концентрации в плазме крови. Проникает в различные ткани и жидкости организма, проходит через ГЭБ. Выводится почками. Препарат применяют внутрь.
При использовании циклосерина часто возникают побочные эффекты. Наиболее частые из них - нейротоксические реакции (головная боль, головокружение, дезориентация; в тяжелых случаях - нарушения зрения, депрессия, психоз). Для профилактики этих нарушений назначают пиридоксин и глутаминовую кислоту.
Э т а м б у т о л - синтетическое противотуберкулезное средство. По химическому строению - производное этилендиимина.
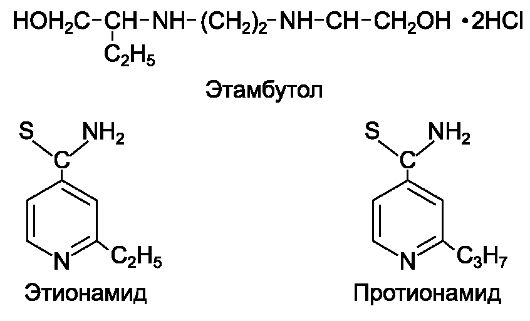
Этамбутол оказывает выраженное туберкулостатическое действие, на другие микроорганизмы не действует. Препарат подавляет размножение микобактерий, устойчивых к стрептомицину и изониазиду.
Препарат хорошо всасывается из ЖКТ, проникает в большинство тканей и жидкостей организма, проходит через ГЭБ. Выводится пре- имущественно почками. Назначают его внутрь.
При применении этамбутола могут усилиться кашель, увеличиться количество мокроты, появиться диспепсические явления, головная боль, ухудшиться острота зрения. В процессе лечения необходим систематический контроль остроты зрения, цветоощущения и других показателей состояния глаза.
Этионамид и протионамид (тревентикс*) - близкие по структуре синтетические препараты, производные изоникотиновой кислоты.
Препараты оказывают бактериостатическое действие. Тормозят развитие устойчивости к другим противотуберкулезным препаратам и обладают синергизмом по отношению к ним.
Этионамид и протионамид хорошо всасываются из ЖКТ, проникают во многие органы и ткани, способны также проникать в инкап- сулированные образования и полости. Метаболизируются в печени, выводятся из организма почками.
Применение препаратов может сопровождаться желудочно-кишечными расстройствами, нарушениями функций печени, сонливостью, галлюцинациями.
П и р а з и н а м и д - синтетическое средство, оказывающее туберкулостатическое действие. На другие микроорганизмы препарат не влияет. Устойчивость к пиразинамиду возникает быстро.
Препарат хорошо всасывается из ЖКТ, быстро проникает во все ткани и биологические жидкости, метаболизируется преимущественно в печени, выводится почками.
При применении препарата часто возникают диспепсические явления. Пиразинамид способен вызывать гиперурикемию, прояв- ляющуюся артралгией и миалгией. Кроме того, препарат оказывает гепатотоксическое действие.
Офлоксацин и ломефлоксацин - синтетические антибактериальные средства из группы фторхинолонов, активные в отношении микобактерий туберкулеза (см. главу 37). Препараты применяют в комплексной терапии туберкулеза.
Аминосалициловую кислоту (ПАСК*) применяют в виде натриевой или кальциевой соли.
Препарат оказывает туберкулостатическое действие. В основе туберкулостатического действия ПАСК* лежит антагонизм с парааминобензойной кислотой - фактором роста микобактерий. ПАСК* действует только на микобактерии, находящиеся в состоянии активного размножения.
Препарат хорошо всасывается при приеме внутрь, но оказывает выраженное раздражающее действие на слизистую ЖКТ. Метаболизируется в печени и частично в ЖКТ. Экскретируется с мочой.
Применяют ПАСК при всех формах туберкулеза в составе комбинированной химиотерапии.
Наиболее часто побочные эффекты ПАСК проявляются диспепсическими расстройствами (тошнота, рвота, понос). Кроме того, возможны осложнения аллергического характера.
Тиоацетазон (тибон*) - синтетическое средство, оказывающее бактериостатическое действие в отношении микобактерий туберкулеза и возбудителя лепры. В связи с высокой токсичностью препарат применяют ограниченно: назначают обычно в сочетании с изониазидом, стрептомицином и другими противотуберкулезными средствами для повышения терапевтического эффекта и уменьшения возможности появления резистентных форм микобактерий туберкулеза. Препарат принимают внутрь.
При лечении тиоацетазоном возможны головная боль, тошнота, дерматиты, ухудшение аппетита. В редких случаях могут быть гема- тологические нарушения.
В настоящее время при лечении туберкулеза часто используют комбинированные препараты, которые представляют различные сочетания препаратов I и II группы.
Фармацевтическая промышленность выпускает следующие комбинированные препараты:
• рифампицин+изониазид+пиразинамид (таблетки по 120, 150, 300 мг);
• этамбутол+изониазид+рифампицин (таблетки по 300, 75, 150 мг);
• рифампицин+изониазид (таблетки по 150, 100 мг);
• рифампицин+изониазид + пиридоксин (таблетки по 150, 100,