Фармакология / Под ред. проф. Р.Н. Аляутдина. - 4-е изд., перераб. и доп. - 2008. - 832 с. : ил.
|
|
|
|
ГЛАВА 14 АНАЛЬГЕЗИРУЮЩИЕ СРЕДСТВА (АНАЛЬГЕТИКИ)
Анальгетики - средства, основной эффект которых представлен избирательным уменьшением или устранением болевой чувствительности (анальгезия) в результате резорбтивного действия лекарственного вещества. В терапевтических дозах не вызывают потерю сознания, не угнетают другие виды чувствительности (температурную, тактильную и др.) и не нарушают двигательных функций. Этим они отличаются от средств для наркоза, которые устраняют ощущение боли, но при этом выключают сознание и другие виды чувствительности, а также от местных анестетиков, которые неизбирательно угнетают все виды чувствительности.
Боль - сложная защитная реакция. Болевые ощущения воспринимаются специальными рецепторами (ноцицепторами), которые рас-
положены в коже, мышцах, капсулах суставов и внутренних органов, надкостнице и могут стимулироваться механическими, термическими и химическими раздражителями. В развитии болевой перцепции важ- ное значение имеют ванилоидные рецепторы, возбуждают которые брадикинин, протоны, АТФ, ванилоиды (капсаицин острого перца). Эндогенные соединения (брадикинин, гистамин, серотонин, простагландины) могут сенсибилизировать эти рецепторы к внешним раздражителям, а также непосредственно вызывать боль (например, при воспалении). Ноцицептивные импульсы распространяются по С- и Аδ-волокнам афферентных нервов и поступают в ЦНС к нейронам задних рогов спинного мозга. Здесь через систему вставочных нейронов возбуждение направляется по трем путям.
• В передние рога спинного мозга на двигательные мотонейроны. Их возбуждение проявляется быстрым защитным двигательным рефлексом со стороны скелетных мышц.
• В боковые рога спинного мозга на вегетативные нейроны симпатического отдела нервной системы, стимуляция которой приводит к функциональной адаптации внутренних органов (например, повышение АД).
• В головной мозг по восходящим афферентным трактам к высшим структурам восприятия и оценки боли - стволу головного мозга, ретикулярной формации, таламусу, лимбической системе, коре головного мозга.
Очевидно, что нейроны задних рогов спинного мозга имеют ключевое значение в восприятии и оценке болевой информации. Активность этих нейронов находится под контролем супраспинальной антиноцицептивной системы (так называемый контроль афферентного входа). В подкорковых структурах головного мозга (околоводопроводное серое вещество, большое ядро шва, голубое пятно) расположены нейроны, аксоны которых образуют нисходящие тормозные пути, заканчивающиеся на нейронах задних рогов спинного мозга. Активация нисходящей тормозной системы приводит к уменьшению выделения «ноцицептивных» медиаторов (субстанция Р, глутамат) и снижению активации вставочных нейронов, передающих информацию о боли. Таким образом, активация супраспинальной антиноцицептивной системы вызывает торможение проведения болевых импульсов по афферентным путям спинного мозга, что приводит к повышению порога болевой чувствительности.
Иммунохимический анализ показал, что на нейронах околоводопроводного серого вещества, большого ядра шва и задних рогов спинного мозга находятся так называемые опиоидные рецепторы, специфические места связывания, с которыми взаимодействуют эндогенные анальгетические пептиды: энкефалины (содержат 5 аминокислот), динорфины (содержат 17 аминокислот) и эндорфины (содержат 31 аминокислоту). Выделяют несколько подтипов опиоидных рецепторов, которые различаются по чувствительности к вышеперечисленным эндогенным лигандам и эффектам, вызываемым активацией этих рецепторов.
• μ-Рецепторы активируются β-эндорфином; при возбуждении этих рецепторов развивается анальгезия, седативный (успокаивающий) эффект, угнетение дыхательного центра, эйфория (положительные эмоции, повышенное настроение, ощущение душевного комфорта, не связанные с реальной действительностью) и лекарственная зависимость, брадикардия, миоз, снижение моторики ЖКТ. Выделено три подтипа μ-рецепторов: μ1, μ2 и μ3.
• δ-Рецепторы активируются мет-энкефалином и лей-энкефалином, при стимуляции этих рецепторов развивается анальгезия, угнетение дыхания, снижение моторики ЖКТ.
• κ-Рецепторы, эндогенными лигандами которых являются динорфины, стимуляция этих рецепторов сопровождается угнетением проведения болевых импульсов на уровне спинного мозга (спинальная анальгезия), развивается седативный эффект, миоз. Для агонистов κ-рецепторов характерна дисфория (отрицательные эмоции, ощущение дискомфорта), возможно развитие физической зависимости, возникает небольшое снижение моторики ЖКТ.
Опиоидные рецепторы связаны с G-белками, их стимуляция вызывает угнетение активности аденилатциклазы и снижение концентра- ции цАМФ в клетке. Кроме того, опиоиды открывают связанные с G-белками калиевые каналы, при этом повышается выход ионов калия из клетки, что приводит к гиперполяризации мембраны. Вследствие этого в пресинаптических мембранах нейронов блокируется вход ионов кальция в клетку и уменьшается выделение медиаторов из пресинаптических окончаний. Из окончаний первичных афферентов в задних рогах спинного мозга уменьшается выделение «ноцицептивных» медиаторов (медиаторов боли) - глутамата, нейрокининов, вещества Р и таким образом снижается активирующее воздействие на вставочные нейроны, участвующие в передаче болевых импульсов в
высшие центры. Кроме того, гиперполяризация мембран вставочных нейронов приводит к угнетению их активности. Нисходящие тормозные пути антиноцицептивной системы образованы аксонами норад- ренергических и серотонинергических и пуринергических нейронов. В развитии анальгетического действия определенную роль играют каннабиноидные рецепторы.
Анальгезирующие средства по механизму и локализации действия подразделяются на несколько групп.
1. Анальгезирующие средства преимущественно центрального действия.
- Опиоидные (наркотические) анальгетики:
• агонисты;
• частичные агонисты;
• агонисты-антагонисты.
- Неопиоидные препараты с анальгетической активностью.
- Анальгетики смешанного действия (опиоидный и неопиоидный компоненты).
2. Анальгезирующие средства преимущественно периферического действия.
14.1. СРЕДСТВА ПРЕИМУЩЕСТВЕННО ЦЕНТРАЛЬНОГО ДЕЙСТВИЯ
14.1.1. Опиоидные (наркотические) анальгетики
Агонисты опиоидных рецепторов антиноцицептивной системы, оказывают обезболивающее действие без утраты сознания или погружения в сон и угнетения других видов чувствительности.
Основные механизмы анальгетического действия опиоидных анальгетиков:
• угнетение проведения болевых импульсов в афферентных путях ЦНС (нарушение передачи импульсов с окончаний первичных афферентов на вставочные нейроны спинного мозга);
• усиление тормозного влияния нисходящей антиноцицептивной системы на проведение болевых импульсов в афферентных путях
ЦНС;
• изменение эмоциональной оценки боли.
Действие наркотических анальгетиков опосредуется через опиоидные рецепторы.
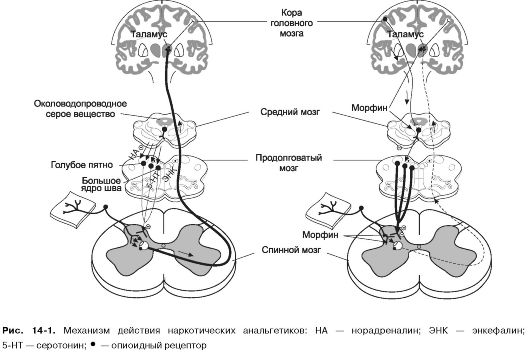
В результате возбуждения пресинаптических опиоидных рецепторов, находящихся на окончаниях первичных афферентов, умень- шается выделение субстанции P, при этом нарушается передача болевых импульсов на вставочные нейроны задних рогов спинного мозга. Вследствие стимуляции постсинаптических опиоидных рецепторов нарушается процесс деполяризации постсинаптической мембраны и угнетается активация вставочных нейронов под действием медиатора. Все это приводит к нарушению передачи болевых импульсов на уровне спинного мозга (спинальное действие) (рис. 14-1).
При стимуляции опиоидных рецепторов в сером околоводопроводном веществе и некоторых других отделах ствола мозга за счет угнетения ингибирующих ГАМК-ергических нейронов происходит активация нисходящей антиноцицептивной системы, оказывающей тормозное влияние на передачу болевых импульсов по афферентным путям спинного мозга (супраспинальное действие). Нисходящие тормозные влияния на уровне спинного мозга осуществляются при участии серотонина и норадреналина (см. рис. 14-1).
В результате действия наркотических анальгетиков на высшие отделы ЦНС изменяется эмоциональная оценка боли, снижается ее восприятие (даже если чувство боли сохраняется, оно меньше беспо- коит больного).
Среди веществ, стимулирующих опиоидные рецепторы, выделяют полные агонисты опиоидных рецепторов (вещества, которые способны вызвать максимальный для данной системы эффект), частичные агонисты опиоидных рецепторов (вещества, которые всегда вызывают эффект, меньший максимального) и агонисты-антагонисты опиоидных рецепторов (стимулируют рецепторы одного подтипа и блокируют рецепторы другого подтипа).
Полные агонисты опиоидных рецепторов
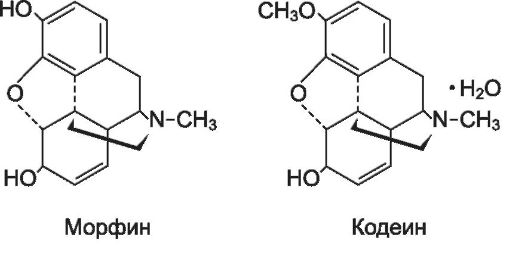
- Природные наркотические анальгетики (опиаты): морфина гидрохлорид (долтард*, морфилонг*), ом нопон (пан- топон*), кодеин.
- Синтетические наркотические анальгетики: тримепе- р и д и н (промедол*), фентанил, ремифентанил, метадон .
Частичные агонисты и агонисты-антагонисты опиоидных рецепторов:
- пентазоцин (фортрал*), буторфанол (бефорал*, ста- дол*), налбуфин (нубаин*), бупренорфин.
Полные агонисты опиоидных рецепторов
Природные наркотические анальгетики (опиаты)
Источник получения морфина гидрохлорида и других природных наркотических анальгетиков - опий (от греч. opos - млечный сок растения). Опий - высохший на воздухе млечный сок, который полу- чают из надрезов на незрелых коробочках мака снотворного (Papaver somniferum). Опий использовали в качестве болеутоляющего средства более 6000 лет назад в Древнем Египте, Греции и Риме. Его способность вызывать физическую и психическую зависимость (пристрастие) стала являться предметом озабоченности начиная с XVIII в.
Опий содержит более 20 алкалоидов. Алкалоиды фенантренового ряда (морфина гидрохлорид, кодеин) обладают анальгезирующей и противокашлевой активностью; алкалоиды изохинолинового ряда не анальгетики, они обладают спазмолитическим эффектом (папаверин).
Морфина гидрохлорид - производное фенантрена, основной алкалоид опия (10% от общей массы). Морфина гидрохлорид был выделен из опия в 1806 году немецким ученым Сертюрнером, который назвал его по имени бога сна Морфея (Morpheus). Химическая структура морфина гидрохлорида была установлена в 1925 году, а в 1952 году был осуществлен его синтез, однако в промышленных масштабах более целесообразным оказалось его получение из растительного сырья.
Действие морфина на организм связано с возбуждением опиоидных рецепторов, расположенных как в ЦНС, так и в периферических тканях.
Эффекты, вызванные возбуждением центральных опиоидных рецепторов
• Анальгезия.
• Эйфория - возникновение приятных ощущений и немотивированного состояния свободы от тревог и проблем. При этом воз-
никает чувство комфорта и устраняются чувства голода, жажды и др. Это становится причиной развития лекарственной зависи- мости - непреодолимого желания повторного приема морфина (морфинизм). У некоторых больных и здоровых людей, не испытывающих боли, может развиться ощущение беспокойства и разбитости, плохое самочувствие (дисфория).
• Седативный эффект - состояние покоя, сонливость, нарушение способности к рассуждению (без утраты памяти) и поверхностный сон.
• Противокашлевое действие вследствие угнетения кашлевого центра (к эффекту быстро развивается привыкание).
• Угнетение дыхания связано в основном со снижением чувствительности дыхательного центра к двуокиси углерода и зависит от дозы. Дыхание становится редким и глубоким при введении даже терапевтических доз морфина. При приеме в токсических дозах развивается очень редкое поверхностное дыхание, вплоть до полной его остановки (при отравлении морфином смерть наступает от паралича дыхательного центра). Для восстановления дыхания используют антагонисты опиоидных рецепторов.
• Миоз - сужение зрачков, являющееся характерным диагностическим признаком приема морфина. Возникает в результате возбуждения центра глазодвигательного нерва. Привыкание в отношении миоза развивается медленно.
• Брадикардия вследствие повышения тонуса центра блуждающих нервов.
• Тошнота и рвота (усиливающиеся при движении) развиваются за счет стимуляции рецепторов пусковой (триггерной) зоны рвотного центра, расположенной на дне IV желудочка мозга. Непосредственно рвотный центр морфин угнетает.
• Влияние на продукцию гормонов. Повышение продукции пролактина, антидиуретического гормона (вазопрессина), гормона роста, что связано со стимуляцией центров в гипоталамусе. Усиление выделения вазопрессина приводит к уменьшению диуреза. Снижение секреции гонадотропных гормонов, адренокортикотропный гормон. Снижается также секреция тестостерона и гидрокортизона.
• Снижение температуры тела ниже нормы (вне зависимости от исходного уровня). Эффект связан с угнетением центра теплорегуляции в гипоталамусе и снижением теплопродукции. Гипотермия отчетливо проявляется при применении больших доз морфина.
• Повышение тонуса скелетных мышц (преимущественно мышцсгибателей и дыхательных мышц). Эффект реализуется на уровне спинного мозга.
• Лекарственная зависимость (психическая и физическая) развивается при повторных приемах морфина. Желание повторного приема морфина сначала связано с вызываемой морфином эйфорией. Затем развивается физическая зависимость, которая проявляется абстинентным синдромом. Явления абстиненции возникают при отмене морфина: сначала слезотечение, насморк, потливость, «гусиная кожа», затем беспокойство, тахикардия, тремор, тошнота, рвота, диарея, сильные боли в животе, спине и др. Эти явления исчезают при приеме морфина.
Эффекты, вызванные возбуждением периферических опиоидных рецепторов
• Стимуляция выделения гистамина приводит к расширению сосудов кожи и конъюнктивы глаз, крапивнице. У больных бронхиальной астмой морфин может вызвать бронхоспазм (повышение тонуса бронхов связано с действием на опиоидные рецепторы бронхиальных мышц).
• Снижение пропульсивной моторики желудка и кишечника, повышение тонуса сфинктеров кишечника, уменьшение секреции поджелудочной железы и выделения желчи (вследствие повышения тонуса сфинктера Одди и желчных протоков) нарушают продвижение содержимого по кишечнику и приводят к развитию обстипации (запора). Вследствие повышения тонуса гладких мышц желчевыводящих путей могут возникнуть спастические боли (колики).
• Повышение под действием морфина тонуса мочеточников может вызвать приступ почечной колики, а повышение тонуса сфинктеров уретры может вызвать задержку мочеиспускания.
При повторном применении морфина к его действию развивается привыкание. Снижается его анальгетическое действие и для получения прежнего эффекта необходимо увеличивать дозу. Привыкание развивается и к некоторым другим эффектам морфина (к возникновению эйфории, угнетению дыхания). Практически не развивается привыкание к действию на величину зрачка и ЖКТ. При постоянном приеме морфина развивается привыкание (толерантность) к его
токсическому действию (угнетение дыхательного центра), поэтому у лиц с зависимостью к морфину высокие и даже смертельные дозы не вызывают токсических эффектов. При прекращении приема морфина (например, во время лечения в стационаре) толерантность быстро исчезает и введение высокой, но прежде переносимой дозы может вызвать смертельный исход.
Применяют морфин как болеутоляющее средство при выраженных болях, связанных с тяжелыми травмами, ожогами, такими заболеваниями, как злокачественные опухоли, инфаркт миокарда. В анестезиологии используют для подготовки больных к операции (премедикации), а также при послеоперационных болях. Снимая сильные боли, морфин препятствует развитию болевого шока. Можно применять при почечной, кишечной коликах, связанных со спазмом гладких мышц, но поскольку морфин повышает тонус гладких мышц, в этих случаях его назначают вместе со спазмолитическими средствами (атропином, папаверином). Морфин также применяют при остром отеке легких.
Вводят парентерально (внутривенно, подкожно) и внутрь в виде таблеток. Поскольку морфин всасывается из ЖКТ недостаточно хорошо, а также в значительной степени метаболизируется при первом прохождении через печень, для достижения быстрого и выраженного действия его вводят парентерально.
Действие морфина развивается через 10-15 мин после введения под кожу и через 20-30 мин после приема внутрь (максимальная концентрация в плазме крови достигается через 10-30 мин после подкожного введения морфина и через 1-2 ч после приема внутрь). Действие однократной дозы продолжается 3-6 ч.
Морфин накапливается в наибольших концентрациях в хорошо кровоснабжаемых органах (печень, легкие, селезенка). В скелетных мышцах морфин накапливается в меньшей степени, но вследствие большой общей массы они служат основным его резервуаром.
Морфин плохо преодолевает тканевые барьеры, однако при ацетилировании двух гидроксильных групп он превращается в активный метаболит - диацетилморфин (героин), который значительно быстрее проникает через ГЭБ в ткани мозга, где оказывает анальгетический эффект. В мозге диацетилморфин гидролизуется до моноацетилморфина и далее до морфина. У новорожденных, вследствие слабого развития ГЭБ, морфин в высоких концентрациях способен проникать в мозг и вызывать интоксикацию с угнетением дыхания.
Наличие в молекуле морфина двух свободных гидроксильных групп позволяет ему легко конъюгировать с глюкуроновой кислотой. Морфин- 6-глюкуронид обладает большей анальгетической активностью и действует несколько продолжительнее, чем морфин. У больных с почечной недостаточностью может происходить накопление активных метаболитов, что ведет к более продолжительной и выраженной анальгезии.
Значительная часть морфина превращается в полярные метаболиты, которые быстро экскретируются почками (85%), 9-12% морфина выводится с мочой в неизмененном виде. Небольшая часть глюкуронидов морфина (7-10%) экскретируется с желчью и поступает в просвет ЖКТ, откуда морфин может снова всасываться в кровь, или (при лечении отравления морфином) может быть удален при промывании желудка слабым раствором калия перманганата.
Побочные эффекты морфина: тошнота, рвота, спазм гладких мышц, обстипация, брадикардия, артериальная гипотония, урежение дыхания; при повторном применении - привыкание, лекарственная зависимость.
Морфин противопоказан при артериальной гипотензии, дыхательной недостаточности, паралитических, спастических и обструктивных заболеваниях ЖКТ, гипертрофии простаты, повышенном внутричерепном давлении, беременности. Морфин не рекомендуют применять для обезболивания родов (возможно угнетение дыхательного центра у плода), у детей до 2 лет и лиц старше 60 лет, не назначают кормящим матерям.
При остром отравлении морфином развивается коматозное состояние, редкое поверхностное дыхание, брадикардия, резко суживаются зрачки (диагностический признак интоксикации опиоидами), однако при асфиксии зрачки расширяются. Тяжелое отравление приводит к смертельному исходу вследствие остановки дыхания.
При отравлении морфином основные мероприятия направлены на удаление его из организма (промывают желудок 0,05% раствором калия перманганата, который вызывает окисление морфина, и теплой водой со взвесью активированного угля, адсорбирующего морфин, затем назначают солевое слабительное) и на восстановление дыхания (вводят внутримышечно или внутривенно антагонист опиоидных рецепторов налоксона гидрохлорид). При глубоком угнетении дыхания проводят искусственную вентиляцию легких.
Омнопон - препарат, содержащий смесь алкалоидов опия: морфин, кодеин, тебаин (алкалоиды фенантренового ряда), наркотин,
папаверин (алкалоиды изохинолинового ряда). Омнопон близок по фармакологическим свойствам к морфину (содержит 48-50% мор- фина). Применяют по тем же показаниям, что и морфин. Вводят парентерально (подкожно, внутривенно). За счет папаверина обладает спазмолитическими свойствами, поэтому имеет преимущества перед морфином при болях, связанных со спазмом гладкомышечных органов (почечная, печеночная, кишечная колики).
Кодеин - производное фенантрена, алкалоид опия (0,5% концентрации). Для использования в качестве лекарственного средства кодеин синтезируют из морфина (метилированное производное). Обладает всеми свойствами наркотических анальгетиков. По анальгетическому действию примерно в 10 раз слабее морфина. По сравнению с морфином, кодеин в большей степени угнетает кашлевой центр, поэтому его применяют чаще как противокашлевое средство (см. раздел «Противокашлевые cредства»).
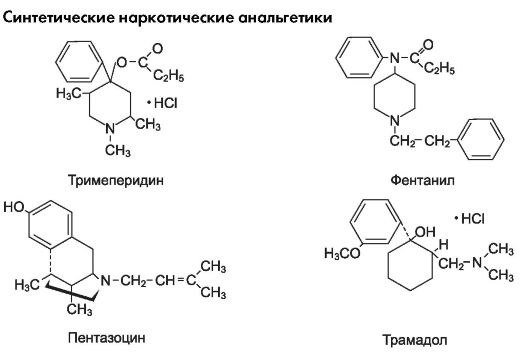
Тримеперидин - синтетический наркотический анальгетик, производное N-метилпиперидина-(гидрохлорид-1,2,4-триме- тил-4-пропионилокси-4-фенилпиперидин), оригинальный отечественный препарат (Машковский М.Д., Ищенко В. И.).
Тримеперидин по анальгетической активности в 2-4 раза уступает морфину, но в меньшей степени угнетает дыхательный центр (может быть использован при беременности, для обезболивания родов и у детей), несколько повышает тонус и сократительную активность миометрия. В отличие от морфина тримеперидин оказывает спазмолитический эффект (на мочеточники, бронхи) и менее выраженное спазмогенное действие (на кишечник, желчевыводящие пути), в связи с чем может использоваться при почечных и печеночных коликах. Фармакокинетические параметры тримеперидина аналогичны морфину.
Показания: выраженный болевой синдром (травмы, злокачественные новообразования, послеоперационный период и др.), подготовка к операции, обезболивание родов, почечная, кишечная и печеночная колики.
Побочные действия: тошнота, рвота, слабость, головокружение. Возможно развитие лекарственной зависимости.
Противопоказания: дыхательная недостаточность.
Ф е н т а н и л - производное фенилпиперидина, полный агонист опиоидных рецепторов (в большей степени стимулирует μ-рецепторы). В 100-400 раз активнее морфина (для получения такого же анальгетического эффекта необходимо в 100-400 раз меньшие дозы фентанила), также эффективнее морфина (устраняет боли при которых морфин неэффективен). Вследствие высокой липофильности быстро проникает в ткани мозга, но затем перераспределяется и накапливается в жировой ткани, где подвергается медленному метаболизму. Фентанил оказывает очень быстрое (эффект наступает через 1-3 мин после внутривенного введения) и кратковременное (20-30 мин) обезболивающее действие. Препарат применяют парентерально (внутривенно, внутримышечно) главным образом для быстрого обезболивания перед и во время хирургических операций, при инфаркте миокарда, отдельно и в комбинации с нейролептиком дроперидолом (комбинированный препарат таламонал). Таламонал применяют для нейролептанальгезии (метод обезболивания с сохранением сознания при хирургических операциях), а также для снятия болей при инфаркте миокарда, при травмах. Дроперидол потенцирует обезболивающее действие фентанила, а также устраняет у пациента чувство страха, тревоги, напряжения перед оперативным вмешательством.
Противопоказания и побочные эффекты фентанила такие же, как и у морфина. Фентанил сильнее, чем морфин, угнетает дыхательный
центр, кроме того, после его применения возможна кратковременная ригидность (повышение тонуса) мышц грудной клетки.
Метадон - производное фенилгептиламина. Сходен по эффектам с морфином, оказывает более слабое, но продолжительное действие. Назначают внутрь.
Привыкание и физическая зависимость развиваются значительно медленнее, чем при применении морфина. Абстиненция после прекращения приема метадона менее выражена (мягкая абстиненция), но продолжительнее, чем при отмене морфина. Эти свойства метадона позволяют использовать его в ряде стран для детоксикации и поддерживающего лечения лекарственной зависимости к опиоидам, в частности к героину. Родственное метадону соединение левометадил ацетат (1-α-ацетилметадон), оказывает еще более продолжительное действие, применяют его внутрь 1 раз в 2-3 дня, наиболее оптимальный препарат для проведения детоксикации.
Частичные агонисты и агонисты-антагонисты опиоидных рецепторов
Бупренорфин - частичный агонист μ-опиоидных рецепторов. По анальгетической активности в 20-30 раз превышает морфин и действует длительнее (6-8 ч). По эффективности сравним с морфином. Вводят парентерально и сублингвально. При сублингвальном применении бупренорфина действие наступает через 25-35 мин и продолжается 8-12 ч (применяют для неотложной помощи при массовых травматических поражениях - оказывает противошоковое действие, облегчает транспортировку пострадавших).
Пентазоцин - производное бензоморфана, синтетический наркотический анальгетик из группы агонистов-антагонистов опио- идных рецепторов (агонист κ- и δ-рецепторов, антагонист μ-рецепторов). Анальгетические свойства обусловлены в основном стимуляцией κ-рецепторов. По анальгетической активности уступает морфину, но в меньшей степени угнетает дыхание. Так как пентазоцин не вызывает эйфорию (связана со стимуляцией μ-рецепторов), а может вызывать дисфорию, при его применении меньше риск возникновения лекарственной зависимости. Пентазоцин проявляет свойства антагониста, он вытесняет морфин из связи с опиоидными рецепторами, обусловливая развитие абстинентного синдрома у лиц с физической зависимостью к наркотическим анальгетикам.
Препарат вводят парентерально (внутривенно, внутримышечно, подкожно) и внутрь. Хорошо всасывается при всех путях введения. Начало эффекта и его максимальная выраженность отмечаются соответственно через 2-3 мин и 15-30 мин после внутривенного введения; через 15-30 мин и 30-60 мин после внутримышечного и энтерального введения. Продолжительность действия до 3 ч.
Пентазоцин вызывает повышение давления в легочной артерии, при этом увеличивается преднагрузка на сердце, усиливается работа сердца. Поэтому препарат не рекомендуют применять при инфаркте миокарда. Для пентазоцина характерны дисфория, галлюцинации, тахикардия, повышение АД.
Препарат противопоказан при бронхиальной астме, черепно-мозговой травме, эпилепсии, желчно- и мочекаменной болезни, недостаточности печени и почек. Ограничения к применению: беременность, грудное вскармливание, возраст до 1 года.
Б у т о р ф а н о л - агонист-антагонист опиоидных рецепторов (стимулирует κ-рецепторы и выступает в роли антагониста μ-рецепторов). Применяют для премедикации перед хирургическими операциями, во время операций и для послеоперационного обезболивания. В меньшей степени, чем морфин, угнетает дыхание, меньше риск лекарственной зависимости. Так же как пентазоцин, буторфанол повышает давление в легочной артерии и увеличивает работу сердца, в связи с чем его не рекомендуют применять при инфаркте миокарда. Вызывает такие же побочные эффекты, что и пентазоцин.
Налбуфин также агонист κ-рецепторов и антагонист μ-рецепторов. По анальгетической активности близок к морфину, но меньше угнетает дыхание. В отличие от пентазоцина и буторфанола не влияет на гемодинамику, применяют для обезболивания при болевых синдромах, в том числе при инфаркте миокарда. Продолжительность действия до 6 ч.
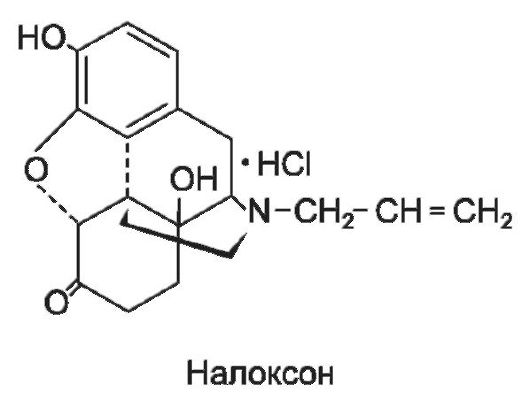
В качестве антагонистов наркотических анальгетиков используют налоксона гидрохлорид (наркан*) и налтрексон. Эти препараты блокируют μ-, δ- и κ-рецепторы, поэтому устраняют как анальгезирующее действие наркотических анальгетиков, так и вызываемые ими эйфорию, угнетение дыхания и другие эффекты.
Налоксона гидрохлорид - производное фенантрена, полный конкурентный антагонист μ-, δ- и κ-рецепторов.
Вводят внутривенно при интоксикации наркотическими анальгетиками для конкурентного вытеснения их из связи с дыхательным
центром. Действует 2-4 ч. Устраняет не только угнетение дыхания, но и многие другие эффекты опиоидных анальгетиков, в том числе агонистов-антагонистов. Менее эффективен при передозировке буп- ренорфина. Налоксона гидрохлорид вызывает синдром абстиненции у лиц с лекарственной зависимостью к опиоидам.
Н а л т р е к с о н эффективен при приеме внутрь, действует до 24 ч. Уменьшает или предотвращает эффекты, вызываемые опиоидами. Снижает потребление алкоголя. Используется при алкогольной зависимости, а также для предотвращения эйфории, вызываемой опиоидами, при лечении наркоманов.
14.1.2. Неопиоидные препараты с анальгетической активностью
Препараты различных фармакологических групп с анальгетическим компонентом действия
Ацетаминофен (парацетамол*, панадол*, тайленол*, эффералган*) - ненаркотический анальгетик, производное пара-аминофенола, активный метаболит фенацетина. Обладает болеутоляющим и жаропонижающим действием. Противовоспалительная активность отсутствует. Анальгетическое действие связано с ингибированием циклооксигеназы в ЦНС.
Используют при головной боли, для снижения температуры при лихорадке, миалгии, невралгии, суставных болях. По эффективности ацетаминофен сопоставим с ацетилсалициловой кислотой . В терапев- тических дозах редко вызывает побочные эффекты. Однако токсическая
доза ацетаминофена лишь в 3 раза превышает терапевтическую. При передозировке препарат оказывает гепатотоксическое действие, вызывая некроз клеток печени, что связано с образованием токсичного метаболита ацетаминофена - N-ацетил-п-бензохинонимина. С целью пре- дупреждения развития токсических эффектов ацетаминофена в течение первых 12 ч после отравления вводят ацетилцистеин или метионин.
Клонидин (клофелин*) - α2-адреномиметик, используют как антигипертензивное средство. Обладает выраженным анальгетическим действием, которое объясняют усилением нисходящих тормозных влияний (опосредуемых α2-адренорецепторами) на проведение болевых импульсов в афферентных путях спинного мозга. Препятствует развитию вегетативных нарушений, вызванных болью. Используют для уменьшения боли при оперативных вмешательствах, в послеоперационном периоде, при инфаркте миокарда, злокачественных опухолях.
Амитриптилин и имипрамин (имизин*) - трицик- лические антидепрессанты. За счет угнетения обратного нейронального захвата норадреналина и серотонина активируют нисходящую антиноцицептивную систему, угнетающую передачу болевых импульсов на уровне спинного мозга. Эффективны при хронических болях. Используют при невралгии различной этиологии, фантомных болях.
Карбамазепин (тегретол*) и фенитоин (дифенин*) - блокаторы натриевых каналов, применяют как противоэпилептические средства. Как анальгетики эффективны при невралгии тройничного нерва, сопровождающейся приступами сильных болей.
Габапентин применяют как противоэпилептическое средство. Анальгетическое действие связано со стимуляцией ГАМК-ергической передачи в головном мозге. Как анальгетик применяют при мигрени, нейропатических болях.
Баклофен - агонист ГАМК-рецепторов, применяют при болезненных мышечных спазмах, спастичности.
Кетамин - производное фенциклидина, неконкурентный антагонист NMDA-рецепторов, обладает выраженным анальгетичес- ким действием, применяют для общего обезболивания (диссоциативной анестезии).
Азота закись применяют ингаляционно (см. раздел «Средства для ингаляционного наркоза»), обладает выраженными анальгетическими свойствами, используют для уменьшения болей при инфаркте миокарда, для обезболивания родов, в послеоперационном периоде.
Кроме того, некоторое анальгетическое действие оказывают антагонисты Н1-рецепторов, например, дифенгидрамин, а также соматостатин, кальцитонин.
14.1.3. Анальгетики со смешанным механизмом действия (опиоидный и неопиоидный компоненты)
Трамадол (трамал*) - центральный неселективный агонист μ-, δ- и κ-рецепторов. Анальгетический эффект дополнительно опосредуется за счет влияния на адренергическую и серотонинергическую передачу (нарушается нейрональный захват норадреналина и серотонина) в нисходящих антиноцицептивных путях, в результате чего усиливаются нисходящие тормозные влияния на проведение болевых импульсов на уровне спинного мозга. Трамадол по активности уступает морфину. Анальгетическое действие практически не сопровождается угнетением дыхания, снижением моторики ЖКТ, повышением тонуса мочевыводящих путей. В сравнении с морфином препарат обладает незначительным наркогенным потенциалом (меньше риск лекарственной зависимости), не входит в перечень наркотиков. Применяют препарат при послеоперационных болях и других болевых синдромах (при инфаркте миокарда, злокачественных опухолях, травмах). Назначают парентерально, внутрь и ректально.
14.2. АНАЛЬГЕЗИРУЮЩИЕ СРЕДСТВА ПРЕИМУЩЕСТВЕННО ПЕРИФЕРИЧЕСКОГО ДЕЙСТВИЯ (НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА)
Нестероидные противовоспалительные средства (НПВС) - большая группа соединений, обладающих противовоспалительным, анальгезирующим и жаропонижающим свойствами. Эти свойства НПВС связаны с их способностью нарушать образование простагландинов E2 и I2, которые являясь медиаторами воспаления, вызывают следующие эффекты:
• расширяют артериолы, а также усиливают действие других медиаторов воспаления гистамина и брадикинина на проницаемость сосудов, это приводит к экстравазации плазмы, инфильтрации и отеку тканей;
• повышают чувствительность болевых рецепторов к брадикинину, гистамину и некоторым другим веществам, которые являются медиаторами боли;
• простагландин E2 оказывает стимулирующее действие на центр теплорегуляции в гипоталамусе и повышает температуру тела.
Простагландины E2 и I2 образуются из арахидоновой кислоты. Происходит это следующим образом: сначала из арахидоновой кислоты под действием ЦОГ синтезируются циклические эндопероксиды, а из нестабильных циклических эндопероксидов далее образуются простагландины E2, I2, другие простагландины и тромбоксан (рис. 14-2). НПВС ингибируют ЦОГ и таким образом нарушают образование простагландинов E2 и I2, что и определяет их основные фармакологические эффекты: противовоспалительный, анальгезирующий и жаропонижающий.
В качестве противовоспалительных и болеутоляющих средств при артритах, миозитах, невритах применяют различные НПВС, в том числе ацетилсалициловую кислоту (аспирин*), ибупрофен (бруфен*), диклофенак (вольтарен*), при этом используют противовоспалительное и анальгетическое свойство этих препаратов. Как болеутоляющие средства НПВС (ацетилсалициловую кислоту) применяют при головных болях, эффективны НПВС также при болях, связанных с менструацией (возникновение болей обусловлено простагландинами). Подробнее об этих препаратах см. раздел «Нестероидные противовоспалительные средства».
Только как болеутоляющие средства используют метамизол-натрий и кеторолак.
Метамизол-натрий (анальгин*) применяют при болях, связанных с воспалительными процессами: миалгиях, невралгиях, артралгиях, а также при головной боли, болях, вызванных менструациями. Вводят внутрь и парентерально. Входит в состав комбинированного препарата баралгин (спазмалгин*), который кроме метамизола содержит вещества спазмолитического действия питофен и фенпивериния бромид. Препарат применяют при болях, связанных со спазмом гладких мышц (почечная, печеночная, кишечная колика), вводят внутривенно или внутримышечно. При систематическом применении метамизол может вызвать лейкопению, возможен агранулоцитоз, в связи с чем его применение ограничено, препарат не рекомендуется принимать длительно.
Кеторолак (кетанов*) обладает выраженной анальгетической активностью, но оказывает меньшее по сравнению с другими НПВС противовоспалительное действие. Кеторолак хорошо всасывается из ЖКТ, при введении внутрь биодоступность составляет 80-100%.
Применяют внутрь и парентерально для купирования послеоперационных болей (в качестве альтернативы опиоидным анальгетикам), а также при болях, вызванных травмами, при опухолевых заболеваниях и др. Показан при невралгии тройничного нерва.
Кеторолак при длительном применении вызывает побочные эффекты, характерные для других НПВС: изъязвление слизистой оболочки желудка и двенадцатиперстной кишки (в связи с угнетением синтеза простагландинов E2 и I2, обладающих гастропротекторным действием), нарушение функции почек (изменение фильтрации в почечных клубочках) и др. (Подробнее о побочных эффектах НПВС см. раздел «Нестероидные противовоспалительные средства»).