Патофизиология Новицкого, Е.Д. Гольдберга Тома 1 и 2 - 2009 г.
|
|
|
|
ГЛАВА 16 ПАТОФИЗИОЛОГИЯ ДЫХАНИЯ
Дыхание - это совокупность процессов, обеспечивающих аэробное окисление в организме, в результате которого освобождается энергия, необходимая для жизни. Оно поддерживается функционированием нескольких систем: 1) аппарата внешнего дыхания; 2) системы транспорта газов; 3) тканевого дыхания. Система транспорта газов, в свою очередь, подразделяется на две подсистемы: сердечнососудистую и систему крови. Деятельность всех этих систем тесно связана сложными регуляторными механизмами.
16.1. ПАТОФИЗИОЛОГИЯ ВНЕШНЕГО ДЫХАНИЯ
Внешнее дыхание - это совокупность процессов, совершающихся в легких и обеспечивающих нормальный газовый состав артериальной крови. Следует подчеркнуть, что в данном случае речь идет только об артериальной крови, так как газовый состав венозной крови зависит от состояния тканевого дыхания и транспорта газов в организме. Внешнее дыхание обеспечивается аппаратом внешнего дыхания, т.е. системой легкие - грудная клетка с дыхательной мускулатурой и системой регуляции дыхания. Нормальный газовый состав артериальной крови поддерживается следующими взаимно связанными процессами: 1) вентиляцией легких; 2) диффузией газов через альвеолярно-капиллярные мембраны; 3) кровотоком в легких; 4) регуляторными механизмами. При нарушении любого из этих процессов развивается недостаточность внешнего дыхания.
Таким образом, можно выделить следующие патогенетические факторы недостаточности внешнего дыхания: 1. Нарушение вентиляции легких.
2. Нарушение диффузии газов через альвеолярно-капиллярную мембрану.
3. Нарушение легочного кровотока.
4. Нарушение вентиляционно-перфузионных соотношений.
5. Нарушение регуляции дыхания.
16.1.1. Нарушение вентиляции легких
Минутный объем дыхания (МОД), в нормальных условиях составляющий 6-8 л/мин, при патологии может увеличиваться и уменьшаться, способствуя развитию альвеолярной гиповентиляции либо гипервентиляции, которые определяются соответствующими клиническими синдромами.
Показатели, характеризующие состояние вентиляции легких, можно разделить:
1) на статические легочные объемы и емкости - жизненная емкость легких (ЖЕЛ), дьгхательньгй объем (ДО), остаточный объем легких (ООЛ), общая емкость легких (ОЕЛ), функциональная остаточная емкость (ФОЕ), резервный объем вдоха (РО), резервный объем выдоха (РОвыд) (рис. 16-1);
2) динамические объемы, отражающие изменение объема легких в единицу времени - форсированная жизненная емкость лег-
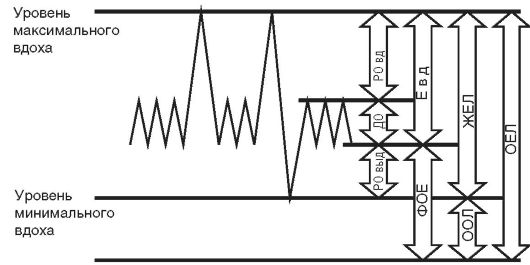 Рис. 16-1. Схематическое
изображение легочных объемов и емкостей: ОЕЛ - общая емкость легких;
ЖЕЛ - жизненная емкость легких; ООЛ - остаточный объем легких; РО выд -
резервный объем выдоха; РО вд - резервный объем вдоха; ДО - дыхательный
объем; Е вд - емкость вдоха; ФОЕ - функциональная остаточная емкость
легких
Рис. 16-1. Схематическое
изображение легочных объемов и емкостей: ОЕЛ - общая емкость легких;
ЖЕЛ - жизненная емкость легких; ООЛ - остаточный объем легких; РО выд -
резервный объем выдоха; РО вд - резервный объем вдоха; ДО - дыхательный
объем; Е вд - емкость вдоха; ФОЕ - функциональная остаточная емкость
легких
ких (ФЖЕЛ), индекс Тиффно, максимальная вентиляция легких
(МВЛ) и др.
Наиболее распространенными методами исследования функции внешнего дыхания являются спирометрия и пневмотахография. Классическая спирография позволяет определить величину статических показателей легочных объемов и емкостей. Пневмотахограмма регистрирует динамические величины, характеризующие изменения объемной скорости потока воздуха во время вдоха и выдоха.
Фактические величины соответствующих показателей необходимо сравнивать с должными величинами. В настоящее время разработаны нормативы для этих показателей, они унифицированы и заложены в программы современных приборов, снабженных компьютерной обработкой результатов измерений. Снижение показателей на 15% по сравнению с их должными величинами считается допустимым.
Альвеолярная гиповентиляция - это уменьшение альвеолярной вентиляции за единицу времени ниже необходимой организму в данных условиях.
Выделяют следующие типы альвеолярной гиповентиляции:
1) обструктивный;
2) рестриктивный, который включает два варианта причин своего развития - внутрилегочные и внелегочные;
3) гиповентиляция вследствие нарушения регуляции дыхания.
Обструктивный (от лат. obstructio - преграда, помеха) тип альвеолярной гиповентиляции. Этот вид альвеолярной гиповентиляции связан со снижением проходимости (обструкцией) дыхательных путей. При этом препятствие движению воздуха может быть как в верхних, так и в нижних дыхательных путях.
Причинами обструкции дыхательных путей являются:
1. Обтурация просвета дыхательных путей инородными твердыми предметами (пища, горошинки, пуговки, бусинки и т.д. - особенно у детей), жидкостями (слюна, вода при утоплении, рвотные массы, гной, кровь, транссудат, экссудат, пена при отеке легкого) и запавшим языком при бессознательном состоянии больного (например, при коме).
2. Нарушение дренажной функции бронхов и легких (при гиперкринии - гиперсекреции слизи бронхиальными железами, дискринии - повышении вязкости секрета).
3. Утолщение стенок верхних и нижних дыхательных путей при развитии гиперемии, инфильтрации, отека слизистых оболо-
чек (при аллергии, воспалении), при росте опухолей в дыхательных путях.
4. Спазм мускулатуры бронхов и бронхиол при действии аллергенов, лекарств (холиномиметиков, -адреноблокаторов), раздражающих веществ (фосфорорганических соединений, сернистого газа).
5. Ларингоспазм (спазм мышц гортани) - например, при гипокальциемии, при вдыхании раздражающих веществ, при невротических состояниях.
6. Сдавление (компрессия) верхних дыхательных путей извне (заглоточный абсцесс, аномалии развития аорты и ее ветвей, опухоли средостения, увеличение размеров соседних органов - например, лимфоузлов, щитовидной железы).
7. Динамическое сдавление мелких бронхов во время выдоха при повышении внутрилегочного давления у больных с эмфиземой легких, бронхиальной астмой, при сильном кашле (например, при бронхитах). Это явление называют «экспираторная компрессия бронхов», «экспираторный коллапс бронхов», «клапанная обструкция бронхов». В норме в процессе дыхания бронхи расширяются на вдохе и сжимаются на выдохе. Сужению бронхов на выдохе способствует компрессия окружающими структурами легочной паренхимы, где давление выше. Препятствует избыточному сужению бронхов их эластическое напряжение. При ряде патологических процессов отмечаются скопление в бронхах мокроты, отек слизистой оболочки, бронхоспазм, утрата стенками бронхов эластичности. При этом диаметр бронхов уменьшается, что приводит к раннему спадению мелких бронхов в начале выдоха повышенным внутрилегочным давлением, возникающим при затруднении движения воздуха по мелким бронхам.
Обструктивная гиповентиляция легких характеризуется следующими показателями:
1. При уменьшении просвета дыхательных путей увеличивается сопротивление движению воздуха по ним (при этом по закону Пуазейля бронхиальное сопротивление потоку воздушной струи возрастает пропорционально четвертой степени уменьшения радиуса бронха).
2. Увеличивается работа дыхательных мышц по преодолению возросшего сопротивления движению воздуха, особенно во время выдоха. Увеличиваются энергозатраты аппарата внешнего дыхания. Дыхательный акт при выраженной бронхиальной обструкции
проявляется экспираторной одышкой с затрудненным и усиленным выдохом. Иногда больные жалуются на затрудненный вдох, что в некоторых случаях объясняется психологическими причинами (так как вдох, «приносящий кислород», кажется больному важнее выдоха).
3. Увеличивается ООЛ, так как опорожнение легких затрудняется (эластичности легких не хватает для преодоления возросшего сопротивления), и поступление воздуха в альвеолы начинает превышать изгнание его из альвеол. Отмечается увеличение отношения ООЛ/ОЕЛ.
4. ЖЕЛ долгое время остается нормальной. Снижаются МОД, МВЛ, ОФВ1 (объем форсированного выдоха за 1 с), индекс Тиффно.
5. В крови развиваются гипоксемия (так как при гиповентиляции уменьшается оксигенация крови в легких), гиперкапния (при гиповентиляции уменьшается выведение СО2 из организма), газовый ацидоз.
6. Кривая диссоциации оксигемоглобина смещается вправо (снижаются сродство гемоглобина к кислороду и оксигенация крови), и поэтому явления гипоксии в организме становятся еще более выраженными.
Рестриктивный (от лат. restrictio - ограничение) тип альвеолярной гиповентиляции.
В основе рестриктивных нарушений вентиляции легких лежит ограничение их расправления в результате действия внутрилегочных и внелегочных причин.
а) Внутрилегочные причины рестриктивного типа альвеолярной гиповентиляции обеспечивают снижение дыхательной поверхности или (и) снижение растяжимости легких. Такими причинами являются: пневмонии, доброкачественные и злокачественные опухоли легкого, туберкулез легкого, резекция легкого, ателектазы, альвеолиты, пневмосклерозы, отек легкого (альвеолярный или интерстициальный), нарушение образования сурфактанта в легких (при гипоксии, ацидозе и др. - см. раздел 16.1.10), повреждение эластина легочного интерстиция (например, при действии табачного дыма). Снижение сурфактанта уменьшает способность легких растягиваться во время вдоха. Это сопровождается увеличением эластического сопротивления легких. В результате глубина вдохов уменьшается, а частота дыхания увеличивается. Возникает поверхностное частое дыхание.
б) Внелегочные причины рестриктивного типа альвеолярной гиповентиляции приводят к ограничению величины экскурсий грудной клетки и к снижению дыхательного объема (ДО). Такими причинами являются: патология плевры, нарушение подвижности грудной клетки, диафрагмальные нарушения, патология и нарушение иннервации дыхательной мускулатуры.
Патология плевры. Патология плевры включает: плевриты, опухоли плевры, гидроторакс, гемоторакс, пневмоторакс, плевральные шварты.
Гидроторакс - жидкость в плевральной полости, вызывающая компрессию легкого, ограничение его расправления (компрессионный ателектаз). При экссудативном плеврите в плевральной полости определяется экссудат, при легочных нагноениях, пневмониях экссудат может быть гнойным; при недостаточности правых отделов сердца в плевральной полости накапливается транссудат. Транссудат в плевральной полости может обнаруживаться также при отечном синдроме различной природы.
Гемоторакс - кровь в плевральной полости. Это может быть при ранениях грудной клетки, опухолях плевры (первичных и метастатических). При поражениях грудного протока в плевральной полости определяется хилезная жидкость (содержит липоидные вещества и по внешнему виду напоминает молоко).
Пневмоторакс - газ в плевральной области. Различают спонтанный, травматический и лечебный пневмоторакс. Спонтанный пневмоторакс возникает внезапно. Первичный спонтанный пневмоторакс может развиваться у практически здорового человека при физическом напряжении или в покое. Причины этого вида пневмоторакса не всегда ясны. Чаще всего он обусловлен разрывом мелких субплевральных кист. Вторичный спонтанный пневмоторакс развивается также внезапно у больных на фоне обструктивных и необструктивных заболеваний легких и связан с распадом легочной ткани (туберкулез, рак легких, саркоидоз, инфаркт легких, кистозная гипоплазия легких и др.). Травматический пневмоторакс связан с нарушением целостности грудной стенки и плевры, ранением легкого. Лечебный пневмоторакс в последние годы используется редко. При попадании воздуха в плевральную полость развивается ателектаз легких, выраженный тем больше, чем больше газа находится в плевральной полости.
Пневмоторакс может быть ограниченным, если в плевральной полости имеются сращения висцерального и париетального лист-
ков плевры в результате перенесенного воспалительного процесса. Если воздух в плевральную полость поступает без ограничения, происходит полный коллапс легкого. Двусторонний пневмоторакс имеет очень неблагоприятный прогноз. Однако и частичный пневмоторакс имеет серьезный прогноз, так как при этом нарушается не только дыхательная функция легких, но также функция сердца и сосудов. Пневмоторакс может быть клапанным, когда на вдохе воздух попадает в плевральную полость, а во время выдоха патологическое отверстие закрывается. Давление в плевральной полости становится положительным, и оно нарастает, сдавливая функционирующее легкое. В таких случаях нарушения вентиляции легких и кровообращения быстро нарастают и могут привести к гибели пациента, если ему не будет оказана квалифицированная помощь.
Плевральные шварты являются следствием воспалительного поражения плевры. Выраженность нашвартований может быть различной: от умеренной до так называемого панцирного легкого.
Нарушение подвижности грудной клетки. Причинами этого являются: травмы грудной клетки, множественные переломы ребер, артриты реберных суставов, деформация позвоночного столба (сколиоз, кифоз), туберкулезный спондилит, перенесенный рахит, крайняя степень ожирения, врожденные дефекты костнохрящевого аппарата, ограничение подвижности грудной клетки при болевых ощущениях (например, при межреберной невралгии и др.).
В исключительных случаях альвеолярная гиповентиляция может быть следствием ограничения экскурсий грудной клетки механическими воздействиями (сдавление тяжелыми предметами, землей, песком, снегом и т.д. при различных катастрофах).
Диафрагмальные нарушения. К ним могут привести травматическое, воспалительное и врожденное поражения диафрагмы, ограничение подвижности диафрагмы (при асците, ожирении, парезе кишечника, перитоните, беременности, болевом синдроме и др.), нарушение иннервации диафрагмы (например, при повреждении диафрагмального нерва могут возникнуть парадоксальные движения диафрагмы).
Патология и нарушение иннервации дыхательной мускулатуры. Причинами данной группы гиповентиляции являются: миозиты, травмы, дистрофия и усталость мышц (вследствие чрезмерной нагрузки - при коллагенозах с поражением реберных суставов, ожирении), а также невриты, полиневриты, судорожные сокращения
мышц (при эпилепсии, столбняке), поражение соответствующих мотонейронов спинного мозга, нарушение передачи в нервномышечном синапсе (при миастении, ботулизме, интоксикации фосфорорганическими соединениями).
Рестриктивная гиповентиляция характеризуется следующими показателями:
1. Снижаются ОЕЛ и ЖЕЛ. Индекс Тиффно остается в пределах нормы или превышает нормальные значения.
2. Рестрикция уменьшает ДО и РОвд.
3. Отмечается затруднение вдоха, возникает инспираторная одышка.
4. Ограничение способности легких расправляться и увеличение эластического сопротивления легких приводят к увеличению работы дыхательных мышц, повышаются энергозатраты на работу дыхательной мускулатуры и возникает ее усталость.
5. Снижается МОД, в крови развиваются гипоксемия и гиперкапния.
6. Кривая диссоциации оксигемоглобина смещается вправо.
Гиповентиляция вследствие нарушения регуляции дыхания. Данный вид гиповентиляции обусловлен снижением активности дыхательного центра. Выделяют несколько механизмов расстройств регуляции дыхательного центра, приводящих к его угнетению:
1. Дефицит возбуждающих афферентных влияний на дыхательный центр (при незрелости хеморецепторов у недоношенных новорожденных; при отравлениях наркотическими средствами или этанолом).
2. Избыток тормозных афферентных влияний на дыхательный центр (например, при сильных болевых ощущениях, сопровождающих акт дыхания, что отмечается при плевритах, травмах грудной клетки).
3. Непосредственное повреждение дыхательного центра при поражении мозга - травматическом, метаболическом, циркуляторном (атеросклероз сосудов мозга, васкулиты), токсическом, нейроинфекционном, воспалительном; при опухолях и отеке мозга; передозировке наркотических веществ, седативных препаратов и др.
Клинические последствия гиповентиляции:
1. Изменения нервной системы при гиповентиляции. Гипоксемия и гиперкапния обусловливают развитие ацидоза в ткани мозга из-за накопления недоокисленных продуктов обмена. Ацидоз вызыва-
ет расширение сосудов мозга, увеличение кровотока, возрастание внутричерепного давления (что становится причиной появления головной боли), повышение проницаемости сосудов мозга и развитие отека интерстиция. В результате этого снижается диффузия кислорода из крови в ткань мозга, что усугубляет гипоксию мозга. Активируется гликолиз, возрастает образование лактата, что еще больше усугубляет ацидоз и увеличивает интенсивность пропотевания плазмы в интерстиций - замыкается порочный круг. Таким образом, при гиповентиляции имеется серьезная опасность поражения церебральных сосудов и развития отека мозга. Гипоксия нервной системы проявляется нарушением мышления и координации движений (проявления сходны с алкогольным опьянением), повышенной утомляемостью, сонливостью, апатией, нарушением внимания, замедленной реакцией и снижением трудоспособности. Если ра02 <55 мм рт.ст., то возможно развитие нарушения памяти на текущие события.
2. Изменения системы кровообращения. При гиповентиляции возможно формирование легочной артериальной гипертензии, так как срабатывает рефлекс Эйлера-Лильестранда (см. раздел 16.1.3), и развитие отека легкого (см. раздел 16.1.9). Кроме этого легочная гипертензия увеличивает нагрузку на правый желудочек сердца, а это, в свою очередь, может привести к правожелудочковой недостаточности кровообращения, особенно у пациентов, уже имеющих или склонных к формированию легочного сердца. При гипоксии компенсаторно развивается эритроцитоз, возрастает вязкость крови, что увеличивает нагрузку на сердце и может привести к еще более выраженной сердечной недостаточности.
3. Изменения со стороны системы дыхания. Возможно развитие отека легкого, легочной гипертензии. Кроме этого ацидоз и повышенное образование медиаторов вызывают бронхоспазм, снижение выработки сурфактанта, увеличение секреции слизи (гиперкриния), снижение мукоцилиарного очищения (см. раздел 16.1.10), усталости дыхательной мускулатуры - все это приводит к еще более выраженной гиповентиляции, и замыкается порочный круг в патогенезе дыхательной недостаточности. О декомпенсации свидетельствуют брадипноэ, патологические типы дыхания и появление терминального дыхания (в частности, дыхания Куссмауля).
Альвеолярная гипервентиляция - это увеличение объема альвеолярной вентиляции за единицу времени в сравнении с необходимой организму в данных условиях.
Выделяют несколько механизмов расстройств регуляции дыхания, сопровождающихся повышением активности дыхательного центра, которое в конкретных условиях неадекватно потребностям организма:
1. Непосредственное повреждение дыхательного центра - при психических заболеваниях, истерии, при органических поражениях головного мозга (травмах, опухолях, кровоизлияниях и т.д.).
2. Избыток возбуждающих афферентных влияний на дыхательный центр (при накоплении в организме больших количеств кислых метаболитов - при уремии, сахарном диабете; при передозировке некоторых лекарств, при лихорадке (см. главу 11), экзогенной гипоксии (см. раздел 16.2), перегревании).
3. Неадекватный режим искусственной вентиляции легких, что в редких случаях возможно при отсутствии должного контроля за газовым составом крови у больных со стороны медицинского персонала во время операции или в послеоперационном периоде. Данная гипервентиляция достаточно часто называется пассивной.
Альвеолярная гипервентиляция характеризуется следующими показателями:
1. Увеличивается МОД, в результате отмечается избыточное выделение из организма углекислого газа, это не соответствует продукции СО2 в организме и поэтому происходит изменение газового состава крови: развивается гипокапния (снижение раСО2) и газовый (респираторный) алкалоз. Может отмечаться некоторое увеличение напряжения О2 в крови, оттекающей от легких.
2. Газовый алкалоз смещает кривую диссоциации оксигемоглобина влево; это означает увеличение сродства гемоглобина к кислороду, снижение диссоциации оксигемоглобина в тканях, что может привести к снижению потребления кислорода тканями.
3. Выявляется гипокальциемия (снижение содержания в крови ионизированного кальция), связанная с компенсацией развивающегося газового алкалоза (см. раздел 12.9).
Клинические последствия гипервентиляции (они обусловлены в основном гипокальциемией и гипокапнией):
1. Гипокапния снижает возбудимость дыхательного центра и в тяжелых случаях может привести к параличу дыхания.
2. В результате гипокапнии происходит спазм мозговых сосудов, снижается поступление кислорода в ткани мозга (в связи с этим у больных отмечаются головокружение, обмороки, снижение
внимания, ухудшение памяти, раздражительность, расстройство сна, кошмарные сновидения, ощущение угрозы, тревоги и др.).
3. Вследствие гипокальциемии имеются парестезии, покалывание, онемение, похолодание лица, пальцев рук, ног. В связи с гипокальциемией отмечается повышенная нервно-мышечная возбудимость (наклонность к судорогам вплоть до тетании, может быть тетанус дыхательных мышц, ларингоспазм, судорожные подергивания мышц лица, рук, ног, тоническая судорога кисти - «рука акушера» (положительные симптомы Труссо и Хвостека - см. раздел 12.9).
4. У больных отмечаются сердечно-сосудистые расстройства (тахикардия и другие аритмии из-за гипокальциемии и спазма коронарных сосудов вследствие гипокапнии; а также гипотонии). Развитие гипотоний обусловлено, во-первых, угнетением сосудодвигательного центра вследствие спазма мозговых сосудов и, вовторых, наличием у больных аритмий.
16.1.2. Нарушение диффузии газов через альвеолярно-капиллярную мембрану
Альвеолярно-капиллярная мембрана (АКМ) с анатомической точки зрения идеально подходит для диффузии газов между альвеолярными пространствами и легочными капиллярами. Огромная площадь альвеолярной и капиллярной поверхности в легких создает оптимальные условия для поглощения кислорода и выделения углекислого газа. Переход кислорода из альвеолярного воздуха в кровь легочных капилляров, а углекислого газа - в обратном направлении осуществляется путем диффузии по градиенту концентрации газов в указанных средах.
Диффузия газов через АКМ происходит согласно закону Фика. По этому закону скорость переноса газа (V) через мембрану (например, АКМ) прямо пропорциональна разнице парциальных давлений газа по обе стороны мембраны (р1-р2) и диффузионной способности легких (ДL), которая, в свою очередь, зависит от растворимости газа и его молекулярной массы, площади диффузионной мембраны и ее толщины:
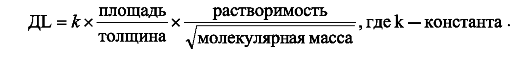 Диффузионная
способность легких (ДL) отражает объем газа в мл, диффундирующего через
АКМ при градиенте давления в 1 мм рт.ст. за 1 мин. В норме ДL для
кислорода равна 15 мл/мин/мм рт.ст., а для углекислого газа - около 300
мл/мин/мм рт. ст. (таким образом, диффузия СО2 через АКМ происходит в 20 раз легче, чем кислорода).
Диффузионная
способность легких (ДL) отражает объем газа в мл, диффундирующего через
АКМ при градиенте давления в 1 мм рт.ст. за 1 мин. В норме ДL для
кислорода равна 15 мл/мин/мм рт.ст., а для углекислого газа - около 300
мл/мин/мм рт. ст. (таким образом, диффузия СО2 через АКМ происходит в 20 раз легче, чем кислорода).
Исходя из выше сказанного, скорость переноса газа через АКМ (V) определяется площадью поверхности мембраны и ее толщиной, молекулярной массой газа и его растворимостью в мембране, а также разницей парциальных давлений газа по обе стороны мембраны (р1-р2):
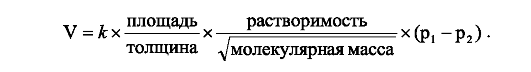 Из
указанной формулы следует, что скорость диффузии газа через АКМ
возрастает: 1) с увеличением площади поверхности мембраны, растворимости
газа и градиента давления газа по обе стороны мембраны; 2) с
уменьшением толщины мембраны и молекулярной массы газа. Напротив,
снижение скорости диффузии газа через АКМ отмечается: 1) при уменьшении
площади поверхности мембраны, при снижении растворимости газа и
градиента давления газа по обе стороны мембраны; 2) при возрастании
толщины мембраны и молекулярной массы газа.
Из
указанной формулы следует, что скорость диффузии газа через АКМ
возрастает: 1) с увеличением площади поверхности мембраны, растворимости
газа и градиента давления газа по обе стороны мембраны; 2) с
уменьшением толщины мембраны и молекулярной массы газа. Напротив,
снижение скорости диффузии газа через АКМ отмечается: 1) при уменьшении
площади поверхности мембраны, при снижении растворимости газа и
градиента давления газа по обе стороны мембраны; 2) при возрастании
толщины мембраны и молекулярной массы газа.
Площадь диффузионной мембраны в норме у человека достигает 180-200 м2, а толщина мембраны колеблется от 0,2 до 2 мкм. При многих заболеваниях системы дыхания отмечается уменьшение площади АКМ (при рестрикции альвеолярной ткани, при редукции сосудистого русла), их утолщение (рис. 16-2). Таким образом, диффузионная способность легких снижается при острых и хронических пневмониях, пневмокониозах (силикозах, асбестозах, бериллиозах), фиброзирующих и аллергических альвеолитах, отеках легкого (альвеолярных и интерстициальных), эмфиземе, недостатке сурфактанта, при формировании гиалиновых мембран и др. При отеке легких увеличивается расстояние диффузии, что объясняет снижение диффузионной способности легких. Снижение диффузии газов закономерно возникает в старческом возрасте в связи со склеротическими изменениями паренхимы легких и стенок сосудов. Диффузия кислорода снижается также в результате уменьшения парциального давления кислорода в альвеолярном воздухе (например, при уменьшении кислорода в атмосферном воздухе или при гиповентиляции легких).
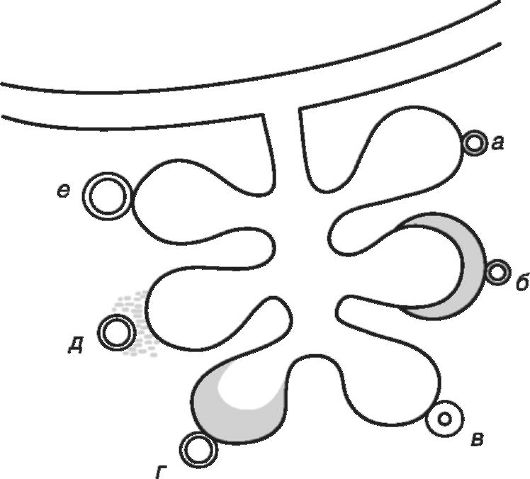 Рис. 16-2. Причины,
уменьшающие диффузию: а - нормальные соотношения; б - утолщение стенок
альвеолы; в - утолщение стенок капилляра; г - внутриальвеолярный отек; д
- интерстициальный отек; е - расширение капилляров
Рис. 16-2. Причины,
уменьшающие диффузию: а - нормальные соотношения; б - утолщение стенок
альвеолы; в - утолщение стенок капилляра; г - внутриальвеолярный отек; д
- интерстициальный отек; е - расширение капилляров
Процессы, затрудняющие диффузию газов, в первую очередь приводят к нарушению диффузии кислорода, поскольку углекислый газ диффундирует в 20 раз легче. Поэтому при нарушениях диффузии газов через АКМ развивается гипоксемия обычно на фоне нормокапнии.
Особое место в рассматриваемой группе болезней занимает острая пневмония. Проникая в респираторную зону, бактерии взаимодействуют с сурфактантом и нарушают его структуру. Это ведет к снижению его способности уменьшать поверхностное натяжение в альвеолах, а также способствует развитию отека (см. раздел 16.1.10). Кроме этого нормальная структура монослоя сурфактанта обеспечивает высокую растворимость кислорода и способствует его диффузии в кровь. При нарушении структуры сурфактанта растворимость кислорода уменьшается, снижается диффузионная способность легких. Важно отметить, что патологическое изменение сурфактанта характерно не только для зоны воспаления, но и для всей или по крайней мере большей части диффузионной поверхности легких. Восстановление свойств сурфактанта после перенесенной пневмонии происходит в течение 3-12 месяцев.
Фиброзные и грануломатозные изменения в легких затрудняют диффузию кислорода, обусловливая обычно умеренную степень гипоксемии. Гиперкапния для данного вида недостаточности внешнего дыхания не типична, так как для снижения диффузии СО2 требуется очень высокая степень поражения мембран. При
тяжелой пневмонии возможна выраженная гипоксемия, а избыточная вентиляция в связи с лихорадкой может привести даже к гипокапнии. С гиперкапнией, тяжелой гипоксемией, дыхательным и метаболическим ацидозом протекает респираторный дистресссиндром новорожденных (РДСН), который относят к диффузионному виду нарушения внешнего дыхания.
Для определения диффузионной способности легких используют несколько методов, которые основаны на определении концентрации угарного газа - СО (ДЬСО). ДЬСО повышается с увеличением размеров тела (масса, рост, площадь поверхности), увеличивается по мере взросления человека и достигает максимума к 20 годам, затем уменьшается с возрастом в среднем на 2% ежегодно. У женщин ДЬСО в среднем на 10% меньше, чем у мужчин. При физической нагрузке ДЬСО увеличивается, что связано с раскрытием резервных капилляров. В положении лежа ДЬСО больше, чем в положении сидя, и еще больше по сравнению с таковым в положении стоя. Это объясняется разницей объема капиллярной крови в легких при разных положениях тела. Уменьшение ДЬСО происходит при рестриктивных нарушениях вентиляции легких, что обусловливается снижением объема функционирующей паренхимы легких. При эмфиземе легких ДЬСО также снижается (главным образом это связано с редукцией сосудистого русла).
16.1.3. Нарушение легочного кровотока
В легких имеются два сосудистых русла: малый круг кровообращения и система бронхиальных сосудов большого круга кровообращения. Кровоснабжение легких осуществляется, таким образом, из двух систем.
Малый круг как часть системы внешнего дыхания участвует в поддержании необходимого организму легочного газообмена. Малый круг кровообращения имеет ряд особенностей, связанных с физиологией аппарата внешнего дыхания, которые определяют характер патологических отклонений функции кровообращения в легких, приводящих к развитию гипоксемии. Давление в легочных сосудах низкое по сравнению с большим кругом кровообращения. В легочной артерии оно в среднем составляет 15 мм рт.ст. (систолическое - 25, диастолическое - 8 мм рт.ст.). Давление в левом предсердии достигает 5 мм рт.ст. Таким образом, перфузия легких обеспечивается давлением, в среднем равным 10 мм рт.ст.
Этого достаточно для достижения перфузии против сил гравитации в верхних отделах легких. Тем не менее силы гравитации считаются важнейшей причиной неравномерности перфузии легких. В вертикальном положении тела легочный кровоток почти линейно убывает в направлении снизу вверх и является минимальным в верхних отделах легких. В горизонтальном положении тела (лежа на спине) кровоток в верхних отделах легких увеличивается, но остается все-таки меньше, чем в нижних отделах. При этом возникает дополнительный вертикальный градиент кровотока - он убывает от дорзальных отделов по направлению к вентральным.
В нормальных условиях минутный объем правого желудочка сердца несколько меньше, чем левого, за счет сброса крови из системы большого круга кровообращения через анастомозы бронхиальных артерий, капилляров и вен с сосудами малого круга, так как давление в сосудах большого круга выше, чем в сосудах малого круга. При значительном увеличении давления в малом круге, например при митральном стенозе, сброс крови может быть в противоположном направлении, и тогда минутный объем правого желудочка сердца превышает таковой левого желудочка. Гиперволемия малого круга кровообращения характерна для врожденных пороков сердца (открытый артериальный проток, дефект межжелудочковой и межпредсердной перегородок), когда в легочную артерию постоянно поступает повышенный объем крови в результате патологического сброса ее слева направо. В таких случаях оксигенация крови остается нормальной. При высокой легочной артериальной гипертензии сброс крови может быть в противоположном направлении. В таких случаях развивается гипоксемия.
В нормальных условиях в легких находится в среднем 500 мл крови: по 25% ее объема в артериальном русле и в легочных калиллярах, 50% - в венозном русле. Время прохождения крови через малый круг кровообращения составляет в среднем 4-5 с.
Бронхиальное сосудистое русло представляет собой разветвление бронхиальных артерий большого круга кровообращения, через которые осуществляется кровоснабжение легких, т.е. выполняется трофическая функция. Через эту систему сосудов проходит от 1 до 2% крови минутного объема сердца. Около 30% крови, проходящей по бронхиальным артериям, поступает в бронхиальные вены и затем в правое предсердие. Большая часть крови попадает в левое предсердие через прекапиллярные, капиллярные и венозные шунты. Кровоток по бронхиальным артериям усиливается при пато-
логии легких (острые и хронические воспалительные заболевания, пневмофиброз, тромбоэмболия в системе легочной артерии и др.). Значительное повышение кровотока по бронхиальным артериям способствует повышению нагрузки на левый желудочек сердца и объясняет развитие гипертрофии левого желудочка. Разрывы расширенных бронхиальных артерий являются основной причиной легочных кровотечений при различных формах патологии легких.
Движущей силой легочного кровотока (перфузии легких) является градиент давления между правым желудочком и левым предсердием, а регулирующим механизмом - легочное сосудистое сопротивление. Поэтому уменьшению перфузии легких способствуют: 1) снижение сократительной функции правого желудочка; 2) недостаточность левых отделов сердца, когда снижение перфузии легких происходит на фоне застойных изменений в легочной ткани; 3) некоторые врожденные и приобретенные пороки сердца (стеноз устья легочной артерии, стеноз правого атриовентрикулярного отверстия); 4) сосудистая недостаточность (шок, коллапс); 5) тромбоз или эмболия в системе легочной артерии. Выраженные нарушения перфузии легких отмечаются при легочной гипертензии.
Легочная гипертензия - это повышение давления в сосудах малого круга кровообращения. Ее могут вызывать следующие факторы:
1. Рефлекс Эйлера-Лильестранда. Уменьшение напряжения кислорода в альвеолярном воздухе сопровождается повышением тонуса артерий малого круга. Этот рефлекс имеет физиологическое назначение - коррекция кровотока в связи с изменяющейся вентиляцией легких. Если в определенном участке легкого вентиляция альвеол уменьшается, соответственно должен уменьшиться кровоток, так как в противном случае отсутствие должной оксигенации крови приводит к снижению насыщения ее кислородом. Повышение тонуса артерий в данном участке легкого уменьшает кровоток, и отношение вентиляция/кровоток выравнивается. При хронической обструктивной эмфиземе легких альвеолярная гиповентиляция охватывает основную массу альвеол. Следовательно, тонус артерий малого круга, ограничивающих кровоток, повышается в основной массе структур респираторной зоны, что приводит к увеличению сопротивления и повышению давления в легочной артерии.
2. Редукция сосудистого русла. В нормальных условиях при физической нагрузке в легочный кровоток включаются резервные сосудистые русла и повышенный кровоток не встречает повышен-
ного сопротивления. При редуцировании сосудистого русла увеличение кровотока при физической нагрузке приводит к увеличению сопротивления и повышению давления в легочной артерии. При значительном сокращении сосудистого русла сопротивление может быть повышенным и в покое.
3. Повышение альвеолярного давления. Повышение давления на выдохе при обструктивной патологии способствует ограничению кровотока. Экспираторное повышение альвеолярного давления более продолжительное, чем падение его на вдохе, ибо выдох при обструкции, как правило, затянут. Поэтому повышение альвеолярного давления способствует увеличению сопротивления в малом круге и повышению давления в легочной артерии.
4. Повышение вязкости крови. Оно обусловлено симптоматическим эритроцитозом, который характерен для хронической экзогенной и эндогенной дыхательной гипоксии.
5. Увеличение минутного объема сердца.
6. Биологически активные вещества. Они вырабатываются под влиянием гипоксии в тканях легких и способствуют развитию легочной артериальной гипертензии. Серотонин, например, способствует нарушению микроциркуляции. При гипоксии снижается разрушение в легких норадреналина, который способствует сужению артериол.
7. При пороках левых отделов сердца, гипертонической болезни, ишемической болезни сердца развитие легочной артериальной гипертензии обусловлено недостаточностью левых отделов сердца. Недостаточность систолической и диастолической функции левого желудочка приводит к повышению в нем конечного диастолического давления (более 5 мм рт.ст.), что затрудняет переход крови из левого предсердия в левый желудочек. Антеградный кровоток в этих условиях поддерживается в результате повышения давления в левом предсердии. Чтобы поддержать кровоток по системе малого круга, включается рефлекс Китаева. Барорецепторы находятся в устье легочных вен, а результатом раздражения этих рецепторов являются спазм артерий малого круга и повышение давления в них. Таким образом, увеличивается нагрузка на правый желудочек, повышается давление в легочной артерии и восстанавливается каскад давлений от легочной артерии к левому предсердию.
Описанные механизмы легочной артериальной гипертензии способствуют развитию «легочного сердца». Длительная перегрузка правого желудочка повышенным давлением приводит к снижению
его сократимости, развивается правожелудочковая недостаточность и повышается давление в правом предсердии. Развиваются гипертрофия и недостаточность правых отделов сердца - так называемое легочное сердце.
Легочная гипертензия приводит к рестриктивным нарушениям вентиляции легких: альвеолярному или интестициальному отеку легких, снижению растяжимости легких, инспираторной одышке, снижению ЖЕЛ, ОЕЛ. Легочная гипертензия способствует также усилению шунтирования крови в легочные вены, минуя капилляры, и возникновению артериальной гипоксемии.
Выделяют три формы легочной гипертензии: прекапиллярная, посткапиллярная и смешанная.
Прекапиллярная легочная гипертензия характеризуется увеличением давления в прекапиллярах и капиллярах и возникает: 1) при спазме артериол под влиянием различных вазоконстрикторов - тромбоксана А2, катехоламинов (например, при значительном эмоциональном напряжении); 2) эмболии и тромбозе легочных сосудов; 3) сдавлении артериол опухолями средостения, увеличенными лимфоузлами; при повышении внутриальвеолярного давления (например, при тяжелом приступе кашля).
Посткапиллярная легочная гипертензия развивается при нарушении оттока крови из венул и вен в левое предсердие. В этом случае возникают застойные явления в легких, к которым могут привести: 1) сдавление вен опухолями, увеличенными лимфоузлами, спайками; 2) левожелудочковая недостаточность (при митральном стенозе, гипертонической болезни, инфаркте миокарда и др.).
Смешанная легочная гипертензия является результатом прогрессирования и осложнения прекапиллярной формы легочной гипертензии посткапиллярной формой и наоборот. Например, при митральном стенозе (посткапиллярная гипертензия) затрудняется отток крови в левое предсердие и происходит рефлекторный спазм легочных артериол (вариант прекапиллярной гипертензии).
16.1.4. Нарушение вентиляционно-перфузионных соотношений
В норме вентиляционно-перфузионныгй показатель равен 0,8-1,0 (т.е. кровоток осуществляется в тех участках легких, в которых имеется вентиляция, за счет этого происходит газообмен между альвеолярным воздухом и кровью). Если в физиологических условиях в относительно небольшом участке легкого происходит снижение пар-
циального давления кислорода в альвеолярном воздухе, то в этом же участке рефлекторно возникает местная вазоконстрикция, которая приводит к адекватному ограничению кровотока (по рефлексу Эйлера-Лильестранда). В результате местный легочный кровоток приспосабливается к интенсивности легочной вентиляции и нарушений вентиляционно-перфузионных соотношений не происходит.
При патологии возможны 2 варианта нарушений вентиляционноперфузионных соотношений (рис. 16-3):
1. Адекватная вентиляция слабо снабжаемых кровью участков легких приводит к увеличению вентиляционно-перфузионного показателя: это происходит при локальной гипоперфузии легких (например, при пороках сердца, коллапсе, обтурации легочных артерий - тромбом, эмболом и др.). Поскольку имеются вентилируемые, но не кровоснабжаемые участки легких, то в результате увеличиваются функциональное мертвое пространство и внутрилегочное шунтирование крови, развивается гипоксемия.
2. Неадекватная вентиляция нормально снабжаемых кровью участков легких приводит к снижению вентиляционно-перфузионного показателя: это наблюдается при локальной гиповентиляции легких (при обструкции бронхиол, рестриктивных нарушениях в легких - например, при ателектазе). Так как имеются кровоснабжаемые, но не вентилируемые участки легких, то в результате этого снижается оксигенация крови, оттекающей от гиповентилируемых участков легких, и в крови развивается гипоксемия.
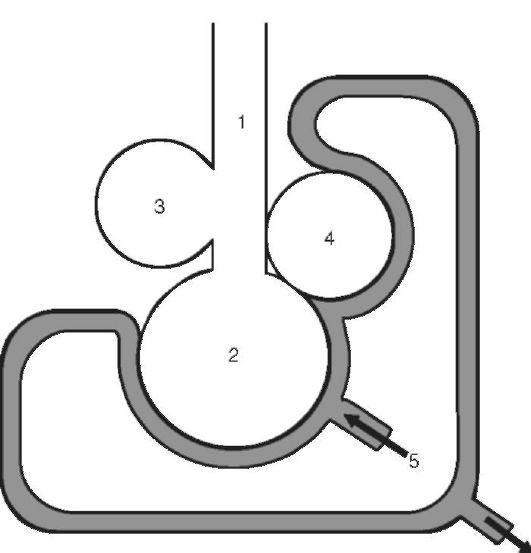 Рис. 16-3. Модель
взаимоотношений вентиляции альвеол и кровотока по капиллярам: 1 -
анатомически мертвое пространство (воздухоносные пути); 2 -
вентилируемые альвеолы с нормальным кровотоком; 3 - вентилируемые
альвеолы, лишенные кровотока; 4 - невентилируемые альвеолы с кровотоком;
5 - приток венозной крови из системы легочной артерии; 6 - отток крови в
легочные вены
Рис. 16-3. Модель
взаимоотношений вентиляции альвеол и кровотока по капиллярам: 1 -
анатомически мертвое пространство (воздухоносные пути); 2 -
вентилируемые альвеолы с нормальным кровотоком; 3 - вентилируемые
альвеолы, лишенные кровотока; 4 - невентилируемые альвеолы с кровотоком;
5 - приток венозной крови из системы легочной артерии; 6 - отток крови в
легочные вены
16.1.5. Нарушение регуляции дыхания
Регуляция дыхания осуществляется дыхательным центром, расположенным в ретикулярной формации продолговатого мозга. Различают центр вдоха и центр выдоха. Деятельность дыхательного центра регулируется вышележащими отделами мозга. Большое влияние на деятельность дыхательного центра оказывает кора головного мозга, что проявляется в произвольной регуляции дыхательных движений, возможности которой ограничены. Человек в покое дышит без каких-либо видимых усилий, чаще всего не замечая этого процесса. Такое состояние называется дыхательным комфортом, а дыхание - эупноэ, с частотой дыхательных движений от 12 до 20 в минуту. При патологии под влиянием рефлекторных, гуморальных или других воздействий на дыхательный центр может изменяться ритм дыхания, его глубина и частота. Эти изменения могут быть проявлением как компенсаторных реакций организма, направленных на поддержание постоянства газового состава крови, так и проявлением нарушений нормальной регуляции дыхания, ведущих к развитию недостаточности дыхания.
Выделяют несколько механизмов расстройств регуляции дыхательного центра:
1. Дефицит возбуждающих афферентных влияний на дыхательный центр (при незрелости хеморецепторов у недоношенных новорожденных; при отравлениях наркотическими средствами или этанолом).
2. Избыток возбуждающих афферентных влияний на дыхательный центр (при раздражении брюшины, ожогах кожи и слизистых, стрессе).
3. Избыток тормозных афферентных влияний на дыхательный центр (например, при сильных болевых ощущениях, сопровождающих акт дыхания, что может иметь место при плевритах, травмах грудной клетки).
4. Непосредственное повреждение дыхательного центра; может быть обусловлено различными причинами и отмечается при многих видах патологии: сосудистых заболеваниях (атеросклероз сосудов, васкулиты) и опухолях мозга (первичных, метастатических), нейроинфекциях, отравлениях алкоголем, морфином и другими наркотическими препаратами, снотворными, транквилизаторами. Кроме этого, нарушения регуляции дыхания могут быть при психических и многих соматических заболеваниях.
Проявлениями нарушения регуляции дыхания являются:
брадипноэ - редкое, менее 12 дыхательных движений в минуту, дыхание. Рефлекторное уменьшение частоты дыхания наблюдается при повышении артериального давления (рефлекс с барорецепторов дуги аорты), при гипероксии в результате выключения хеморецепторов, чувствительных к понижению раО2. При стенозировании крупных дыхательных путей возникает редкое и глубокое дыхание, называемое стенотическим. В этом случае рефлексы поступают только от межреберных мышц, и запаздывает действие рефлекса Геринга-Брейера (он обеспечивает переключение дыхательных фаз при возбуждении рецепторов растяжения в трахее, бронхах, бронхиолах, альвеолах, межреберных мышцах). Брадипноэ возникает при гипокапнии, развивающейся при подъеме на большую высоту (горная болезнь). Угнетение дыхательного центра и развитие брадипноэ может иметь место при длительной гипоксии (пребывание в условиях разреженной атмосферы, недостаточность кровообращения и др.), действии наркотических веществ, органических поражениях головного мозга;
полипноэ (тахипноэ) - частое, более 24 дыхательных движений в минуту, поверхностное дыхание. Этот вид дыхания наблюдается при лихорадке, функциональных нарушениях деятельности центральной нервной системы (например, истерии), поражениях легких (пневмония, застой в легких, ателектаз), болях в грудной клетке, брюшной стенке (боль приводит к ограничению глубины дыхания и увеличению его частоты, развивается щадящее дыхание). В происхождении тахипноэ имеет значение большая, чем в норме, стимуляция дыхательного центра. При снижении растяжимости легких усиливаются импульсы от проприорецепторов дыхательных мышц. При ателектазе усиливаются импульсы с легочных альвеол, находящихся в спавшемся состоянии, и возбуждается центр вдоха. Но во время вдоха непораженные альвеолы растягиваются в большей, чем обычно, степени, что вызывает сильный поток импульсов со стороны тормозящих вдох рецепторов, которые и обрывают вдох раньше времени. Тахипноэ способствует развитию альвеолярной гиповентиляции в результате преимущественной вентиляции анатомически мертвого пространства;
гиперпноэ - глубокое и частое дыхание. Отмечается при повышении основного обмена: при физической и эмоциональной нагрузке, тиреотоксикозе, лихорадке. Если гиперпноэ вызвано рефлекторно и не связано с повышением потребления кислорода
и выведения СО2, то гипервентиляция приводит к гипокапнии, газовому алкалозу. Это возникает вследствие интенсивной рефлекторной или гуморальной стимуляции дыхательного центра при анемиях, ацидозе, снижении содержания кислорода во вдыхаемом воздухе. Крайняя степень возбуждения дыхательного центра проявляется в виде дыхания Куссмауля;
апноэ - отсутствие дыхания, но обычно подразумевается временная остановка дыхания. Может возникнуть рефлекторно при быстром подъеме артериального давления (рефлекс с барорецепторов), после пассивной гипервентиляции пациента под наркозом (снижение раСО2). Апноэ может быть связано с понижением возбудимости дыхательного центра (при гипоксии, интоксикациях и др.). Торможение дыхательного центра вплоть до его остановки может возникать при действии наркотических препаратов (эфир, хлороформ, барбитураты и др.), при понижении содержания кислорода во вдыхаемом воздухе.
Одним из вариантов апноэ является синдром нарушения ночного сна (или синдром ночного апноэ), проявляющийся в кратковременных остановках дыхания во сне (5 приступов и более за 1 час представляют угрозу для жизни больного). Синдром проявляется беспорядочным громким храпом, чередующимся с длительными паузами от 10 с до 2 мин. При этом развивается гипоксемия. Часто у пациентов отмечается ожирение, иногда гипотиреоз.
Нарушения ритма дыхательных движений
Типы периодического дыхания. Периодическим дыханием называется такое нарушение ритма дыхания, при котором периоды дыхания чередуются с периодами апноэ. К нему относятся дыхание Чейна-Стокса и дыхание Биота
(рис. 16-4). При дыхании Чейна- Стокса паузы (апноэ - до 5-10 с) чередуются с дыхательными движениями, которые сначала нарастают по глубине, затем убывают. При дыхании Биота паузы чередуются с дыхательными движениями нормальной частоты и глубины. В основе патогенеза периодического дыхания лежит понижение возбудимости дыхатель-
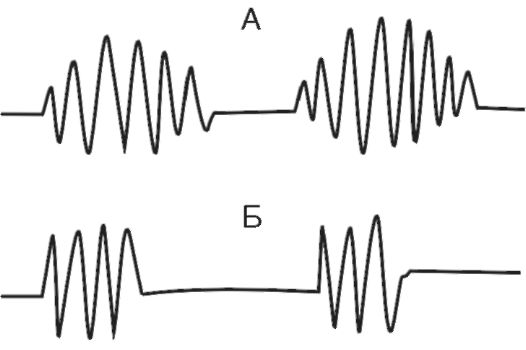 Рис. 16-4. А - дыхание Чейна-Стокса; Б - дыхание Биота
Рис. 16-4. А - дыхание Чейна-Стокса; Б - дыхание Биота
ного центра. Оно может возникать при органических поражениях головного мозга - травмах, инсультах, опухолях, воспалительных процессах, при ацидозе, диабетической и уремической комах, при эндогенных и экзогенных интоксикациях. Возможен переход в терминальные типы дыхания. Иногда периодическое дыхание наблюдается у детей и людей старческого возраста во время сна. В этих случаях нормальное дыхание легко восстанавливается при пробуждении.
В основе патогенеза периодического дыхания лежит снижение возбудимости дыхательного центра (или другими словами - повышение порога возбудимости дыхательного центра). Предполагают, что на фоне пониженной возбудимости дыхательный центр не реагирует на нормальную концентрацию углекислого газа в крови. Для возбуждения дыхательного центра требуется большая его концентрация. Время накопления этого раздражителя до пороговой дозы определяет длительность паузы (апноэ). Дыхательные движения создают вентиляцию легких, СО2 вымывается из крови, и дыхательные движения вновь замирают.
Терминальные типы дыхания. К ним относятся дыхание Куссмауля (большое дыхание), апнейстическое дыхание и гаспингдыхание. Есть основания предполагать существование определенной последовательности фатального нарушения дыхания до его полной остановки: сначала возбуждение (дыхание Куссмауля), апнейзис, гаспинг-дыхание, паралич дыхательного центра. При успешных реанимационных мероприятиях возможно обратное развитие нарушений дыхания до его полного восстановления.
Дыхание Куссмауля - большое, шумное, глубокое дыхание («дыхание загнанного зверя»), характерное для пациентов с нарушением сознания при диабетической, уремической комах, при отравлении метиловым спиртом. Дыхание Куссмауля возникает в результате нарушения возбудимости дыхательного центра на фоне гипоксии мозга, ацидоза, токсических явлений. Глубокие шумные вдохи с участием основной и вспомогательной дыхательной мускулатуры сменяются активным форсированным выдохом.
Апнейстическое дыхание (рис. 16-5) характеризуется продолжительным вдохом и изредка прерывающимся, форсированным коротким выдохом. Длительность вдохов многократно превышает продолжительность выдохов. Развивается при поражении пневмотаксического комплекса (передозировка барбитуратов, травмы головного мозга, инфаркт моста мозга). Такой вид дыхательных
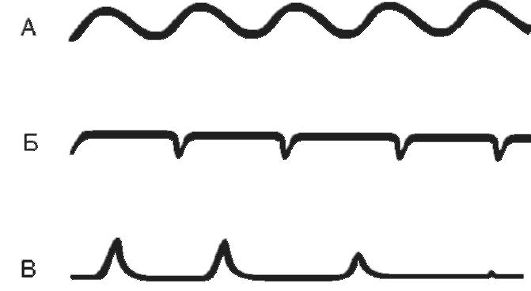 Рис. 16-5. А - эупноэ; Б - апнейстическое дыхание; В - гаспингдыхание
Рис. 16-5. А - эупноэ; Б - апнейстическое дыхание; В - гаспингдыхание
движений возникает в эксперименте после перерезки у животного обоих блуждащих нервов и ствола на границе между верхней и средней третью моста. После подобной перерезки устраняются тормозные влияния верхних отделов моста на нейроны, отвечающие за вдох.
Гаспинг-дыхание (от англ. gasp - ловить воздух ртом, задыхаться) возникает в самой терминальной фазе асфиксии (т.е. при глубокой гипоксии или гиперкапнии). Оно встречается у недоношенных детей и при многих патологических состояниях (отравлениях, травмах, кровоизлияниях и тромбозах ствола головного мозга). Это единичные, редкие, убывающие по силе вдохи с длительными (по 10-20 с) задержками дыхания на выдохе. В акте дыхания при гаспинге участвуют не только диафрагма и дыхательные мышцы грудной клетки, но и мускулатура шеи и рта. Источником импульсов при данном виде дыхательных движений являются клетки каудальной части продолговатого мозга при прекращении функции вышележащих отделов мозга.
Различают еще диссоциированное дыхание - нарушение дыхания, при котором наблюдаются парадоксальные движения диафрагмы, асимметрии движения левой и правой половины грудной клетки. «Атаксическое» уродливое дыхание Грокко-Фругони характеризуется диссоциацией дыхательных движений диафрагмы и межреберных мышц. Это наблюдается при нарушениях мозгового кровообращения, опухолях мозга и других тяжелых расстройствах нервной регуляции дыхания.
16.1.6. Недостаточность внешнего дыхания
Недостаточность внешнего дыхания - такое состояние внешнего дыхания, при котором не обеспечивается нормальный газовый состав артериальной крови или это достигается напряжением аппарата
внешнего дыхания, что сопровождается ограничением резервных возможностей организма. Другими словами, это энергетическое голодание организма в результате повреждений в аппарате внешнего дыхания. Недостаточность внешнего дыхания достаточно часто обозначают термином «дыхательная недостаточность».
Основным критерием недостаточности внешнего дыхания является изменение газового состава артериальной крови: гипоксемия, гиперкапния, реже гипокапния. Однако при наличии компенсаторно возникшей одышки может быть нормальный газовый состав артериальной крови. Выделяют также клинические критерии дыхательной недостаточности: одышка (при нагрузке или даже в покое), цианоз и др. (см. раздел 16.1.7). Имеются функциональные критерии дыхательной недостаточности, например, при рестриктивных нарушениях - снижение ДО и ЖЕЛ, при обструктивных нарушениях - снижены динамические (скоростные) показатели - МВЛ, индекс Тиффно из-за повышенного сопротивления дыхательных путей и др.
Классификации недостаточности внешнего дыхания
1. По локализации патологического процесса выделяют дыхательную недостаточность с преобладанием легочных нарушений и дыхательную недостаточность с преобладанием внелегочных нарушений.
К дыхательной недостаточности с преобладанием легочных нарушений могут привести:
• обструкция дыхательных путей;
• нарушение растяжимости легочной ткани;
• уменьшение объема легочной ткани;
• утолщение альвеолярно-капиллярной мембраны;
• нарушение легочной перфузии.
К дыхательной недостаточности с преобладанием внелегочных нарушений приводят:
• нарушение нервно-мышечной передачи импульса;
• торакодиафрагмальные нарушения;
• нарушения системы кровообращения;
• анемии и др.
2. По этиологии дыхательныж расстройств выделяют следующие виды дыхательной недостаточности:
• центрогенная (при нарушении функции дыхательного центра);
• нервно-мышечная (при нарушении функции нервномышечного аппарата дыхания);
• торакодиафрагмальная (при нарушении подвижности костномышечного каркаса грудной клетки);
• бронхолегочная (при поражении бронхов и респираторных структур легких).
3. По типу нарушения механики дыхания выделяют:
• обструктивную дыхательную недостаточность;
• рестриктивную дыхательную недостаточность;
• смешанную дыхательную недостаточность.
4. По патогенезу выделяют следующие формы дыхательной недостаточности:
• гипоксемическая (паренхиматозная) - возникает на фоне паренхиматозных заболеваний легких, ведущая роль в развитии этой формы дыхательной недостаточности принадлежит нарушению перфузии легких и диффузии газов, поэтому в крови определяется гипоксемия;
• гиперкапническая (вентиляционная) - развивается при первичном уменьшении вентиляции (гиповентиляции), нарушаются оксигенация крови (гипоксемия) и выделение углекислого газа (гиперкапния), при этом выраженность гиперкапнии пропорциональна степени альвеолярной гиповентиляции;
• смешанная форма - развивается чаще всего при обострении хронических неспецифических заболеваний легких с обструктивным синдромом, в крови регистрируются выраженные гиперкапния и гипоксемия.
5. Недостаточность внешнего дыхания по темпам развития подразделяется на острую, подострую и хроническую.
Острая недостаточность внешнего дыхания развивается в течение минут, часов. Она требует срочной диагностики и неотложной помощи. Основными ее симптомами являются прогрессирующая одышка и цианоз. При этом цианоз наиболее выражен у тучных людей. Напротив, у больных с анемией (содержание гемоглобина менее 50 г/л) острая дыхательная недостаточность характеризуется выраженной бледностью, отсутствием цианоза. На определенном этапе развития острой дыхательной недостаточности возможна гиперемия кожных покровов, обусловленная вазодилататорным действием углекислоты. Примером острой недостаточности внешнего дыхания может быть быстро развивающийся приступ удушья при бронхиальной астме, сердечной астме, при острой пневмонии.
Острую дыхательную недостаточность подразделяют на три степени тяжести по выраженности гипоксемии (по уровню раО2), так
как гипоксемия является более ранним признаком острой дыхательной недостаточности, чем гиперкапния (это связано с особенностями диффузии газов - см. раздел 16.1.2). В норме раО2 равно 96-98 мм рт.ст.
При острой дыхательной недостаточности первой степени (умеренная) - раО2 превышает 70 мм рт.ст.; второй степени (средняя) - раО2 варьирует в пределах 70-50 мм рт.ст.; третьей степени (тяжелая) - раО2 оказывается ниже 50 мм рт.ст. В то же время необходимо учитывать, что хотя степень выраженности недостаточности внешнего дыхания определяется гипоксемией, наличие гипервентиляции или гиповентиляции альвеол у больного может вносить существенные коррективы в лечебную тактику. Например, при тяжелой пневмонии возможна гипоксемия третьей степени. Если при этом раСО2 в пределах нормы, показано лечение вдыханием чистого кислорода. При понижении раСО2 назначается газовая смесь кислорода и углекислого газа.
Подострая недостаточность внешнего дыхания развивается в течение суток, недели и может быть рассмотрена на примере гидроторакса - накопления в плевральной полости жидкости различной природы.
Хроническая недостаточность внешнего дыхания развивается месяцы и годы. Она является следствием длительно протекающих патологических процессов в легких, приводящих к нарушениям функции аппарата внешнего дыхания и кровообращения в малом круге (например, при хронической обструктивной эмфиземе легких, диссеминированных легочных фиброзах). Длительное развитие хронической дыхательной недостаточности позволяет включиться долговременным компенсаторным механизмам - эритроцитозу, повышению сердечного выброса вследствие гипертрофии миокарда. Проявлением хронической дыхательной недостаточности является гипервентиляция, необходимая для обеспечения оксигенации крови и выведения углекислого газа. Нарастает работа дыхательной мускулатуры, развивается усталость мускулатуры. В дальнейшем гипервентиляция становится недостаточной для обеспечения адекватной оксигенации, развивается артериальная гипоксемия. В крови повышается уровень недоокисленных продуктов обмена, развивается метаболический ацидоз. При этом аппарат внешнего дыхания не в состоянии обеспечить требуемую элиминацию углекислого газа, в результате повышается раСО2. Для хронической дыхательной недостаточности также характерны цианоз, легочная гипертензия.
Клинически выделяют три степени хронической дыхательной недостаточности:
1-я степень - включение компенсаторных механизмов и возникновение одышки только в условиях повышенной нагрузки. Больной выполняет полный объем только повседневных нагрузок.
2-я степень - возникновение одышки при незначительном физическом напряжении. Повседневные нагрузки больной выполняет с трудом. Гипоксемии может и не быть (за счет компенсаторной гипервентиляции). Легочные объемы имеют отклонения от должных величин.
3-я степень - одышка выражена даже в покое. Резко снижена способность выполнять даже незначительные нагрузки. У больного выраженная гипоксемия и тканевая гипоксия.
Для выявления скрытой формы хронической дыхательной недостаточности, уточнения патогенеза, определения резервов системы дыхания проводят функциональные исследования при дозированной физической нагрузке. Для этого используются велоэргометры, беговые дорожки, лестницы. Нагрузку выполняют кратковременно, но с большой мощностью; продолжительно, но с малой мощностью; и с возрастающей мощностью.
Следует отметить, что патологические изменения при хронической недостаточности внешнего дыхания, как правило, необратимы. Однако практически всегда под влиянием лечения происходит существенное улучшение функциональных параметров. При острой и подострой недостаточности внешнего дыхания возможно полное восстановление нарушенных функций.
16.1.7. Клинические проявления недостаточности внешнего дыхания
К ним относятся одышка, цианоз кожных покровов, кашель, чихание, повышенное отделение мокроты, хрипы, в крайних случаях - асфиксия, болевой синдром в области груди, а также нарушения функции ЦНС (эмоциональная лабильность, быстрая утомляемость, нарушение сна, памяти, мышления, чувство страха и др.). Последние проявления объясняется в основном недостатком кислорода в ткани мозга, что обусловлено развитием гипоксемии при дыхательной недостаточности.
Одышка (dyspnoe) - тягостное, мучительное ощущение недостаточности дыхания, отражающее восприятие повышенной рабо-
ты дыхательной мускулатуры. Одышка сопровождается комплексом неприятных ощущений в виде стеснения в груди и нехватки воздуха, доводящих иногда до мучительных приступов удушья. Эти ощущения формируются в лимбической области, структурах мозга, где также возникают реакции тревоги, страха и беспокойства, что придает одышке соответствующие оттенки.
К одышке не следует относить учащение и углубление дыхания, хотя в момент ощущения недостаточности дыхания человек непроизвольно и, что особенно важно, сознательно увеличивает активность дыхательных движений, направленных на преодоление дыхательного дискомфорта. При тяжелых нарушениях вентиляционной функции легких резко повышается работа дыхательной мускулатуры, что определяется визуально по ундуляции межреберных промежутков, усилению сокращения лестничных мышц, отчетливо бывают выражены и физиогномические признаки («игра» крыльев носа, страдание и утомление). Напротив, у здоровых людей при значительном повышении минутного объема вентиляции легких под влиянием физической нагрузки возникает ощущение усиленных дыхательных движений, одышка при этом не развивается. Дыхательный дискомфорт у здоровых людей может возникнуть при тяжелой физической работе на пределе их физиологических возможностей.
При патологии самые различные нарушения дыхания в целом (внешнего дыхания, транспорта газов и тканевого дыхания) могут сопровождаться чувством одышки. При этом обычно включаются различные регуляторные процессы, направленные на коррекцию патологических нарушений. При нарушении включения того или иного регуляторного механизма происходит непрекращающаяся стимуляция центра вдоха, следствием чего является возникновение одышки.
Источниками патологической стимуляции дыхательного центра могут быть:
• ирритантные рецепторы (рецепторы спадения легких) - их стимулирует снижение растяжимости легких;
• юкстакапиллярные (J-рецепторы) - реагируют на повышение содержания жидкости в интерстициальном периальвеолярном пространстве, на повышение гидростатического давления в капиллярах;
• рефлексы, поступающие с барорецепторов аорты и сонной артерии; раздражение этих барорецепторов оказывает тормо-
зящее действие на инспираторные нейроны в продолговатом мозгу; при падении артериального давления уменьшается поток импульсов, в норме тормозящих центр вдоха;
• рефлексы, поступающие от механорецепторов дыхательных мышц при их чрезмерном растяжении;
• изменения газового состава артериальной крови (падение раО2, повышение раСО2, снижение рН крови) оказывают влияние на дыхание (активируют центр вдоха) через периферические хеморецепторы аорты и сонных артерий и центральные хеморецепторы продолговатого мозга.
В зависимости от того, затруднение какой фазы дыхательного цикла испытывает человек, выделяют: инспираторную, экспираторную и смешанную одышку. По продолжительности одышки отмечают постоянную и приступообразную. Постоянную одышку обычно разделяют по степени выраженности: 1) при привычной физической нагрузке: 2) при незначительной физической нагрузке (ходьба по ровному месту); 3) в покое.
Экспираторная одышка (затруднен выдох) наблюдается при обструктивных нарушениях вентиляции легких. При хронической обструктивной эмфиземе легких одышка постоянная, при бронхообструктивном синдроме - приступообразная. При рестриктивных нарушениях вентиляции легких возникает инспираторная одышка (затруднен вдох). Сердечная астма, отек легких различной природы характеризуются приступом инспираторного удушья. При хроническом застое и диффузных грануломатозных процессах в легких, пневмофиброзе инспираторная одышка становится постоянной. Важно отметить, что не всегда при обструктивных нарушениях вентиляции легких возникает экспираторная одышка, а при рестриктивных нарушениях - инспираторная. Такое несоответствие, вероятно, связано с особенностями восприятия больным соответствующих нарушений дыхания.
В клинике весьма часто степень выраженности нарушения вентиляции легких и степень выраженности одышки неравнозначны. Более того, в ряде случаев, даже при значительно выраженных нарушениях функции внешнего дыхания, одышка вообще может отсутствовать.
Кашель - это произвольный или непроизвольный (рефлекторный) взрывной выброс воздуха из глубоко расположенных дыхательных путей, иногда с мокротой (слизь, посторонние частицы); может носить защитный и патологический характер. Кашель от-
носят к нарушениям дыхания, хотя это справедливо лишь отчасти, когда соответствующие изменения дыхательных движений носят не защитный, а патологический характер. Вызывается кашель следующими группами причин: механическими (посторонними частицами, слизью); физическими (холодный или горячий воздух); химическими (раздражающими газами). Наиболее типичными рефлексогенными зонами кашлевого рефлекса являются гортань, трахея, бронхи, легкие и плевра (рис. 16-6). Однако кашель может быть вызван и раздражением наружного слухового прохода, слизистой оболочки глотки, а также далеко расположенных рефлексогенных зон (печень и желчные пути, матка, кишечник, яичники). Раздражение с указанных рецепторов передается в продолговатый мозг по чувствительным волокнам блуждающего нерва к дыхательному центру, где и формируется определенная последовательность фаз кашля.
Чихание - рефлекторный акт, аналогичный кашлю. Вызывается раздражением нервных окончаний тройничного нерва, расположенных в слизистой оболочке носа. Форсированный поток воздуха при чихании направлен через носовые ходы и рот.
И кашель, и чихание являются физиологическими защитными механизмами, направленными на очищение в первом случае бронхов, а во втором - носовых ходов. При патологии длительные приступы кашля приводят к продолжительному повышению
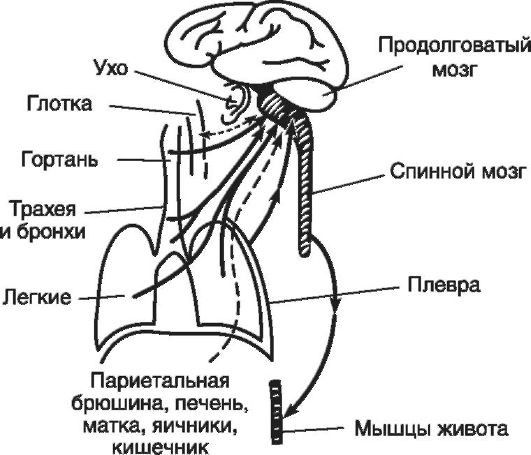 Рис. 16-6. Афферентные пути кашлевого рефлекса
Рис. 16-6. Афферентные пути кашлевого рефлекса
внутригрудного давления, что ухудшает вентиляцию альвеол и нарушает кровообращение в сосудах малого круга кровообращения. Длительный, изнуряющий пациента кашель требует определенного терапевтического вмешательства, направленного на облегчение кашля и улучшение дренажной функции бронхов.
Зевота представляет собой непроизвольное дыхательное движение, состоящее из затяжного глубокого вдоха и энергичного выдоха. Это рефлекторная реакция организма, цель которой - улучшение снабжения органов кислородом при накоплении в крови углекислого газа. Полагают, что зевота направлена на расправление физиологических ателектазов, объем которых нарастает при утомлении, сонливости. Не исключено, что зевота является своеобразной дыхательной гимнастикой, однако она развивается и незадолго до полной остановки дыхания у умирающих больных, у пациентов с нарушениями корковой регуляции дыхательных движений и встречается при некоторых формах невроза.
Икота - спазматические сокращения (судороги) диафрагмы, сочетающиеся с закрытием голосовой щели и связанными с этим звуковыми явлениями. Проявляется субъективно неприятными короткими и интенсивными дыхательными движениями. Нередко икота развивается после чрезмерного наполнения желудка (переполненный желудок оказывает давление на диафрагму, раздражая ее рецепторы), она может возникнуть при общем охлаждении (особенно у детей раннего возраста). Икота может иметь центрогенное происхождение и развивается при гипоксии мозга.
Асфиксия (от греч. а - отрицание, sphyxis - пульс) - угрожающее жизни патологическое состояние, вызванное остро или подостро возникающей недостаточностью кислорода в крови и накоплением углекислоты в организме. Асфиксия развивается вследствие: 1) механического затруднения прохождения воздуха по крупным дыхательным путям (гортань, трахея); 2) нарушения регуляции дыхания и нарушения дыхательной мускулатуры. Асфиксия возможна также при резком снижении содержания кислорода во вдыхаемом воздухе, при остром нарушении транспорта газов кровью и тканевого дыхания, что находится за пределами функции аппарата внешнего дыхания.
Механическое затруднение прохождения воздуха по крупным дыхательным путям возникает из-за действий насильственного характера со стороны окружающих или из-за обтурации крупных дыхательных путей при чрезвычайных ситуациях - при повеше-
нии, удушении, утоплении, при сходе снежных лавин, песчаных оползней, а также при отеке гортани, спазме голосовой щели, при преждевременном появлении дыхательных движений у плода и поступлении околоплодной жидкости в дыхательные пути, при многих других ситуациях. Отек гортани может быть воспалительным (дифтерия, скарлатина, корь, грипп и др.), аллергическим (сывороточная болезнь, отек Квинке). Спазм голосовой щели может возникнуть при гипопаратиреозе, рахите, спазмофилии, хорее и др. Он может быть и рефлекторным при раздражении слизистой трахеи и бронхов хлором, пылью, различными химическими соединениями.
Нарушение регуляции дыхания, дыхательной мускулатуры (например, паралич дыхательной мускулатуры) возможны при полиомиелите, отравлениях снотворными, наркотическими, отравляющими веществами и др.
Различают четыре фазы механической асфиксии:
1-я фаза характеризуется активированием деятельности дыхательного центра: усиливается и удлиняется вдох (фаза инспираторной одышки), развивается общее возбуждение, повышается симпатический тонус (расширяются зрачки, возникает тахикардия, повышается артериальное давление), появляются судороги. Усиление дыхательных движений вызывается рефлекторно. При напряжении дыхательных мышц возбуждаются расположенные в них проприорецепторы. Импульсы от рецепторов поступают в дыхательный центр и активируют его. Понижение раО2 и повышение раСО2 дополнительно раздражают как инспираторный, так и экспираторный дыхательные центры.
2-я фаза характеризуется урежением дыхания и усиленными движениями на выдохе (фаза экспираторной одышки), начинает преобладать парасимпатический тонус (суживаются зрачки, снижается артериальное давление, возникает брадикардия). При большем изменении газового состава артериальной крови наступает торможение дыхательного центра и центра регуляции кровообращения. Торможение экспираторного центра происходит позднее, так как при гипоксемии и гиперкапнии его возбуждение длится дольше.
3-я фаза (предтерминальная) характеризуется прекращением дыхательных движений, потерей сознания, падением артериального давления. Остановка дыхательных движений объясняется торможением дыхательного центра.
4-я фаза (терминальная) характеризуется глубокими вздохами типа гаспинг-дыхания. Смерть наступает от паралича бульбарного дыхательного центра. Сердце продолжает сокращаться после остановки дыхания 5-15 мин. В это время еще возможно оживление задохнувшегося.
16.1.8. Механизмы развития гипоксемии при дыхательной недостаточности
1. Альвеолярная гиповентиляция. Давление кислорода в альвеолярном воздухе меньше атмосферного в среднем на 1/3, что обусловлено поглощением О2 кровью и восстановлением его напряжения в результате вентиляции легких. Это равновесие динамическое. При уменьшении вентиляции легких преобладает процесс поглощения кислорода, а вымывание углекислого газа снижается. В результате развиваются гипоксемия и гиперкапния, что может иметь место при различных формах патологии - при обструктивных и рестриктивных нарушениях вентиляции легких, нарушениях регуляции дыхания, поражении дыхательной мускулатуры.
2. Неполная диффузия кислорода из альвеол. Причины нарушения диффузионной способности легких рассмотрены выше (см. раздел 16.1.2).
3. Увеличение скорости потока крови по легочным капиллярам.
Оно приводит к уменьшению времени контакта крови с альвеолярным воздухом, что отмечается при рестриктивных нарушениях вентиляции легких, когда уменьшается емкость сосудистого русла. Это характерно и для хронической обструктивной эмфиземы легких, при которой тоже имеет место уменьшение сосудистого русла.
4. Шунты. В нормальных условиях около 5% потока крови идет мимо альвеолярных капилляров, и неоксигенированная кровь снижает среднее напряжение кислорода в венозном русле малого круга кровообращения. Насыщение артериальной крови кислородом составляет 96-98%. Шунтирование крови может увеличиваться при повышении давления в системе легочной артерии, возникающем при недостаточности левых отделов сердца, хронической обструктивной патологии легких, патологии печени. Шунтирование венозной крови в легочные вены может осуществляться из системы вен пищевода при портальной гипертензии через так называемые портопульмональные анастомозы. Особенностью ги-
поксемии, связанной с шунтированием крови, является отсутствие лечебного эффекта от вдыхания чистого кислорода.
5. Вентиляционно-перфузионные расстройства. Неравномерность вентиляционно-перфузионных отношений свойственна нормальным легким и обусловлена, как уже было отмечено, силами гравитации. В верхних отделах легких кровоток минимальный. Вентиляция в этих отделах тоже снижена, но в меньшей степени. Поэтому от верхушек легких кровь оттекает с нормальным или даже повышенным напряжением О2, однако в связи с небольшим общим количеством такой крови это мало влияет на степень оксигенации артериальной крови. В нижних отделах легких, напротив, кровоток значительно повышен (в большей степени, чем вентиляция легких). Небольшое снижение напряжения кислорода в оттекающей крови при этом способствует развитию гипоксемии, так как увеличивается общий объем крови с недостаточным насыщением кислородом. Такой механизм гипоксемии характерен для застоя в легких, отека легких различной природы (кардиогенного, воспалительного, токсического).
16.1.9. Отек легких
Отек легких - это избыток воды во внесосудистых пространствах легких, возникающий при нарушении механизмов, поддерживающих баланс между количеством жидкости, поступающей в легкие и покидающей их. Отек легких возникает, когда жидкость фильтруется через легочное микроциркуляторное русло быстрее, чем удаляется лимфатическими сосудами. Особенностью патогенеза отека легких по сравнению с отеком других органов является то, что транссудат преодолевает в развитии этого процесса два барьера: 1) гистогематический (из сосуда в межтканевое пространство) и 2) гистоальвеолярный (через стенку альвеол в их полость). Переход жидкости через первый барьер приводит к тому, что жидкость накапливается в интерстициальных пространствах и формируется интерстициальный отек. Когда в интерстиций поступает большое количество жидкости и поврежден альвеолярный эпителий, то жидкость проходит через второй барьер, заполняет альвеолы и формируется альвеолярный отек. Когда альвеолы наполняются, пенистая жидкость поступает в бронхи. Клинически отек легких проявляется инспираторной одышкой при напряжении и даже в покое. Одышка часто усиливается в положении лежа на спине (ортопноэ)
и несколько ослабевает в положении сидя. Больные с легочным отеком могут просыпаться ночью с тяжелой одышкой (пароксизмальное ночное диспноэ). При альвеолярном отеке определяются влажные хрипы и пенистая, жидкая, с кровью мокрота. При интерстициальном отеке хрипов нет. Степень гипоксемии зависит от тяжести клинического синдрома. При интерстициальном отеке более характерна гипокапния в связи с гипервентиляцией легких. В тяжелых случаях развивается гиперкапния.
В зависимости от причин, вызвавших развитие отека легких, различают следующие его виды: 1) кардиогенный (при болезнях сердца и сосудов); 2) обусловленный парентеральным введением большого количества кровезаменителей; 3) воспалительный (при бактериальных, вирусных поражениях легких); 4) вызванный эндогенными токсическими воздействиями (при уремии, печеночной недостаточности) и экзогенными поражениями легких (вдыхание паров кислот, отравляющих веществ); 5) аллергический (например, при сывороточной болезни и других аллергических заболеваниях).
В патогенезе отека легкого можно выделить следующие основные патогенетические факторы:
1. Повышение гидростатического давления в сосудах малого круга кровообращения (при сердечной недостаточности - изза застоя крови, при увеличении объема циркулирующей крови (ОЦК), тромбоэмболии легочной артерии).
2. Уменьшение онкотического давления крови (гипоальбуминемия при быстрой инфузии различных жидкостей, при нефротическом синдроме - из-за протеинурии).
3. Повышение проницаемости АКМ при действии на нее токсических веществ (ингаляционные токсины - фосген и др.; эндотоксемия при сепсисе и др.), медиаторов воспаления (при тяжелых пневмониях, при РДСВ - респираторном дистресс-синдроме взрослых - см. раздел 16.1.11).
В некоторых случаях в патогенезе отека легкого играет роль лимфатическая недостаточность.
Кардиогенный отек легких развивается при острой недостаточности левых отделов сердца (см. главу 15). Ослабление сократительной и диастолической функций левого желудочка возникает при миокардитах, кардиосклерозе, инфаркте миокарда, гипертонической болезни, недостаточности митрального клапана, аортальных клапанов и стенозе устья аорты. Недостаточность левого
предсердия развивается при митральном стенозе. Исходным моментом недостаточности левого желудочка является повышение в нем конечного диастолического давления, что затрудняет переход крови из левого предсердия. Повышение давления в левом предсердии препятствует переходу в него крови из легочных вен. Повышение давления в устье легочных вен приводит к рефлекторному повышению тонуса артерий мышечного типа малого круга кровообращения (рефлекс Китаева), что вызывает легочную артериальную гипертензию. Давление в легочной артерии возрастает до 35-50 мм рт.ст. Особенно высокой легочная артериальная гипертензия бывает при митральном стенозе. Фильтрация жидкой части плазмы из легочных капилляров в ткани легких начинается, если гидростатическое давление в капиллярах превышает 25- 30 мм рт.ст., т.е. величину коллоидно-осмотического давления. При повышенной проницаемости капилляров фильтрация может происходить при меньших величинах давления. Попадая в альвеолы, транссудат затрудняет газообмен между альвеолами и кровью. Возникает так называемая альвеолярно-капиллярная блокада. На этом фоне развивается гипоксемия, резко ухудшается оксигенация тканей сердца, может возникнуть его остановка, развиться асфиксия.
Отек легких может возникнуть при быстром внутривенном вливании большого количества жидкости (физиологический раствор, кровезаменители). Отек развивается в результате снижения онкотического давления крови (из-за разведения альбуминов крови) и повышения гидростатического давления крови (из-за увеличения
ОЦК).
При микробном поражении легких развитие отека связано с поражением системы сурфактанта микробными агентами. При этом повышается проницаемость АКМ, что способствует развитию внутриальвеолярного отека и снижению диффузии кислорода. Это происходит не только в очаге воспалительного отека, а диффузно в легких в целом.
Токсические вещества различной природы также повышают проницаемость АКМ.
Аллергический отек легких обусловлен резко возникающим повышением проницаемости капилляров в результате действия медиаторов, высвобождающихся из тучных и других клеток при аллергии.
16.1.10. Нарушение недыхательных функций легких
Задача легких - не только газообмен, есть и дополнительные недыхательные функции. К ним относятся организация и функционирование обонятельного анализатора, голосообразование, метаболическая, защитная функции. Нарушение некоторых из этих недыхательных функций может привести к развитию дыхательной недостаточности.
Метаболическая функция легких заключается в том, что в них образуются и инактивируются многие биологически активные вещества. Например, в легких из ангиотензина-I под влиянием ангиотензинпревращающего фермента в эндотелиальных клетках легочных капилляров образуется ангиотензин-II - мощный вазоконстриктор. Особо важную роль играет метаболизм арахидоновой кислоты, в результате которого образуются и выделяются в кровоток лейкотриены, вызывающие бронхоспазм, а также простагландины, обладающие как вазоконстрикторным, так и вазодилататорным действием. В легких инактивируются брадикинин (на 80%), норадреналин, серотонин.
Образование сурфактанта является частным случаем метаболической функции легких.
Недостаточность образования сурфактанта является одной из причин гиповентиляции легких (см. раздел 16.1.1). Сурфактант - комплекс веществ, меняющих силу поверхностного натяжения и обеспечивающих нормальную вентиляцию легких. Он постоянно разрушается и образуется в легких, его продукция относится к числу самых высокоэнергетических процессов в легких. Роль сурфактанта: 1) предупреждение спадения альвеол после выдоха (снижает поверхностное натяжение); 2) повышение эластической тяги легких перед выдохом; 3) снижение транспульмонального давления и, следовательно, уменьшение мышечных усилий при вдохе; 4) противоотечный фактор; 5) улучшение диффузии газов через
АКМ.
Причинами снижения образования сурфактанта являются: снижение легочного кровотока, гипоксия, ацидоз, гипотермия, транссудация в альвеолы жидкости; чистый кислород также разрушает сурфактант. В результате развиваются рестриктивные нарушения в легких (ателектазы, отек легкого).
Важным компонентом метаболической функции легких считается участие их в гемостазе. Легочная ткань является богатым
источником факторов свертывающей и противосвертывающей систем крови. В легких синтезируются тромбопластин, гепарин, тканевой активатор плазминогена, простациклины, тромбоксан А2 и др. В легких осуществляется фибринолиз (с образованием продуктов деградации фибрина - ПДФ). Последствиями перегрузки или недостаточности этой функции могут явиться: 1) тромбоэмболические осложнения (например, тромбоэмболия легочной артерии); 2) избыточное образование ПДФ приводит к повреждению АКМ и развитию отечно-воспалительных нарушений в легких, нарушению диффузии газов.
Таким образом, легкие, выполняя метаболическую функцию, регулируют вентиляционно-перфузионные соотношения, влияют на проницаемость АКМ, тонус легочных сосудов и бронхов. Нарушение этой функции приводит к дыхательной недостаточности, так как способствует формированию легочной гипертензии, тромбоэмболии легочной артерии, бронхиальной астмы, отека легкого.
Дыхательные пути кондиционируют воздух (согревают, увлажняют и очищают дыхательную смесь), так как к респираторной поверхности альвеол должен поступать увлажненный воздух, имеющий температуру внутренней среды и не содержащий посторонних частиц. При этом особо важное значение имеют площадь поверхности воздухоносных путей и мощная сеть кровеносных сосудов слизистой оболочки, слизистая пленка на поверхности эпителия и координированная активность мерцательных ресничек, альвеолярные макрофаги и компоненты иммунной системы органов дыхания (антигенпредставляющие клетки - например, дендритные клетки; Т- и В-лимфоциты; плазматические клетки; тучные клетки).
Защитная функция легких включает очистку воздуха и крови. Слизистая оболочка воздухоносных путей участвует также в защитных иммунных реакциях.
Очистка воздуха от механических примесей, инфекционных агентов, аллергенов осуществляется с помощью альвеолярных макрофагов и дренажной системы бронхов и легких. Альвеолярные макрофаги продуцируют ферменты (коллагеназа, эластаза, каталаза, фосфолипаза и др.), которые и разрушают присутствующие в воздухе примеси. Дренажная система включает мукоцилиарное очищение и кашлевой механизм. Мукоцилиарное очищение (клиренс) - перемещение мокроты (трахеобронхиальной слизи) ресничками специфического эпителия, выстилающего дыхательные пути от респираторной бронхиолы до носоглотки. Извест-
ны следующие причины нарушений мукоцилиарного очищения: воспаление слизистых, их высыхание (при общей дегидратации, ингаляциях неувлажненной смесью), гиповитаминоз А, ацидоз, ингаляции чистым кислородом, действие табачного дыма и алкоголя и др. Кашлевой механизм поднимает мокроту из альвеол в верхние дыхательные пути. Это вспомогательный механизм очистки дыхательных путей, включающийся при несостоятельности мукоцилиарного очищения из-за его повреждения или избыточной продукции и ухудшения реологических свойств мокроты (это так называемые гиперкриния и дискриния). В свою очередь, для эффективности кашлевого механизма необходимы следующие условия: нормальная деятельность нервных центров блуждающего нерва, языкоглоточного нерва и соответствующих сегментов спинного мозга, наличие хорошего мышечного тонуса дыхательной мускулатуры, мышц живота. При нарушении указанных факторов происходит нарушение кашлевого механизма, а значит, дренажа бронхов.
Несостоятельность или перегрузка функции очистки воздуха ведет к возникновению обструктивных или отечно-воспалительных рестриктивных (из-за избытка ферментов) изменений в легких, а значит, к развитию дыхательной недостаточности.
Очистка крови от сгустков фибрина, жировых эмболов, конгломератов клеток - лейкоцитов, тромбоцитов, опухолевых и др. осуществляется с помощью ферментов, выделяемых альвеолярными макрофагами, тучными клетками. Последствиями нарушения этой функции могут быть: тромбоэмболия легочной артерии или отечно-воспалительные рестриктивные изменения в легких (из-за избыточного образования различных конечных агрессивных веществ - например, при деструкции фибрина образуются ПДФ).
16.1.11. Респираторный дистресс-синдром взрослых (РДСВ)
РДСВ (пример острой дыхательной недостаточности) - полиэтилогическое состояние, характеризующееся острым началом, выраженной гипоксемией (не устраняемой оксигенотерапией), интерстициальным отеком и диффузной инфильтрацией легких. РДСВ может осложнять любое критическое состояние, вызывая тяжелейшую острую дыхательную недостаточность. Несмотря на прогресс в диагностике и лечении данного синдрома, летальность составляет 50%, по некоторым данным - 90%.
Этиологическими факторами РДСВ являются: шоковые состояния, множественные травмы (включая ожоговые), ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания крови), сепсис, аспирация желудочным содержимым при утоплении и вдыхании токсических газов (включая чистый кислород), острые заболевания и повреждения легких (тотальная пневмония, контузии), атипичная пневмония, острый панкреатит, перитонит, инфаркт миокарда и др. Многообразие этиологических факторов РДСВ отражается во множестве синонимов: синдром шокового легкого, синдром влажных легких, травматическое легкое, синдром легочных нарушений у взрослых, синдром перфузионного легкого и др.
Картина РДСВ имеет две основные черты:
1) клинические и лабораторные (раО2 <55 мм рт.ст.) признаки гипоксии, некупируемой ингаляцией кислородом;
2) диссеминированная двусторонняя инфильтрация легких, выявляемая рентгенологически, дающая внешние проявления затрудненного вдоха, «надрывного» дыхания. Кроме того, при РДСВ отмечаются интерстициальный отек, ателектазы, в сосудах легких - множество мелких тромбов (гиалиновых и фибриновых), жировые эмболы, гиалиновые мембраны в альвеолах и бронхиолах, стаз крови в капиллярах, внутрилегочные и субплевральные кровоизлияния. На клинике РДСВ сказываются также проявления основного заболевания, вызвавшего РДСВ.
Основным звеном патогенеза РДСВ является повреждение АКМ этиологическими факторами (например, токсическими газами) и большим количеством биологически активных веществ (БАВ). К последним относятся агрессивные вещества, выделяющиеся в легких в ходе выполнения ими недыхательных функций при деструкции задержанных легкими жировых микроэмболов, тромбов из фибрина, агрегатов тромбоцитов и др. клеток, поступивших в легкие в большом количестве из различных органов при их повреждении (например, при панкреатите). Таким образом, можно считать, что возникновение и развитие РДСВ является прямым следствием перегрузки недыхательных функций легких - защитной (очистка крови и воздуха) и метаболической (участие в гемостазе). К БАВ, секретируемым различными клеточными элементами легких и нейтрофилами при РДСВ, относятся: ферменты (эластаза, коллагеназа и др.), свободные радикалы, эйкозаноиды, хемотаксические факторы, компоненты системы комплемента,
кинины, ПДФ и др. В результате действия этих веществ отмечаются: бронхоспазм, спазм легочных сосудов, повышение проницаемости АКМ и увеличение внесосудистого объема воды в легких, т.е. возникновение отека легкого, усиление тромбообразования.
В патогенезе РДСВ выделяют 3 патогенетических фактора:
1. Нарушение диффузии газов через АКМ, так как из-за действия БАВ отмечаются утолщение и повышение проницаемости АКМ. Развивается отек легкого. Формирование отека усиливается снижением образования сурфактанта, обладающего противоотечным действием. АКМ начинает пропускать внутрь альвеол белки, которые образуют гиалиновые мембраны, выстилающие изнутри альвеолярную поверхность. В результате снижается диффузия кислорода и развивается гипоксемия.
2. Нарушение альвеолярной вентиляции. Развивается гиповентиляция, так как имеют место обструктивные расстройства (бронхоспазм) и увеличивается сопротивление движению воздуха по дыхательным путям; возникают рестриктивные расстройства (растяжимость легких снижается, они становятся жесткими в связи с образованием гиалиновых мембран и снижением образования сурфактанта вследствие ишемии легочной ткани, образуются микроателектазы). Развитие гиповентиляции обеспечивает гипоксемию альвеолярной крови.
3. Нарушение перфузии легких, так как под влиянием медиаторов развивается спазм легочных сосудов, легочная артериальная гипертензия, увеличивается тромбообразование, отмечается внутрилегочное шунтирование крови. На конечных этапах развития РДСВ формируется правожелудочковая, а затем и левожелудочковая недостаточность, а в конечном итоге еще более выраженная гипоксемия.
Оксигенотерапия при РДСВ неэффективна из-за шунтирования крови, гиалиновых мембран, недостатка продукции сурфактанта, отека легкого.
С гиперкапнией, тяжелой гипоксемией, дыхательным и метаболическим ацидозом протекает дистресс-синдром новорожденных, который относят к диффузионному виду нарушения внешнего дыхания. В его патогенезе имеет большое значение анатомическая и функциональная незрелость легких, заключающаяся в том, что к моменту рождения в легких в недостаточной мере вырабатывается сурфактант. В связи с этим при первом вдохе раскрываются не
все отделы легких, возникают участки ателектаза. В них повышена проницаемость сосудов, которая способствует развитию кровоизлияний. Гиалиноподобное вещество на внутренней поверхности альвеол и альвеолярных ходов способствует нарушению диффузии газов. Прогноз тяжелый, зависит от степени и протяженности патологических изменений в легких.
16.2. ПАТОФИЗИОЛОГИЯ ВНУТРЕННЕГО ДЫХАНИЯ
Под внутренним дыханием подразумевается транспорт кислорода от легких к тканям, транспорт углекислоты от тканей к легким и использование кислорода тканями.
16.2.1. Транспорт кислорода и его нарушения
Для транспорта кислорода решающее значение имеют: 1) кислородная емкость крови; 2) сродство гемоглобина (Hb) к кислороду; 3) состояние центральной гемодинамики, которое зависит от сократительной способности миокарда, величины сердечного выброса, объема циркулирующей крови и величины кровяного давления в сосудах большого и малого круга; 4) состояние кровообращения в микроциркуляторном русле.
Кислородная емкость крови - это максимальное количество кислорода, которое могут связать 100 мл крови. Только очень небольшая часть находящегося в крови кислорода транспортируется в виде физического раствора. Согласно закону Генри количество растворенного в жидкости газа пропорционально его напряжению. При парциальном давлении кислорода (раО2), равном 12,7 кПа (95 мм рт.ст.), в 100 мл крови растворено лишь 0,3 мл кислорода, но именно эта его фракция обусловливает раО2. Основная часть кислорода транспортируется в составе оксигемоглобина (НbО2), каждый грамм которого связывают 1,34 мл этого газа (число Гюфнера). Нормальное количество Hb в крови колеблется в пределах 135-155 г/л. Таким образом, 100 мл крови может переносить в составе НbО2 17,4-20,5 мл кислорода. К этому количеству следует добавить 0,3 мл кислорода, растворенного в плазме крови. Поскольку степень насыщения гемоглобина кислородом в норме составляет 96-98%, принято считать кислородную емкость крови равной 16,5-20,5 об. % (табл. 16-1).
Таблица 16-1. Нормальные значения параметров кислородно-транспортной функции крови (по В.Ф. Альяс и соавт.)
Параметр | Значения |
Напряжение кислорода в артериальной крови | 80-100 мм рт.ст. |
Напряжение кислорода в смешанной венозной крови | 35-45 мм рт.ст. |
Содержание гемоглобина | 13,5-15,5 г/дл |
Сатурация гемоглобина артериальной крови кислородом | 97-98% |
Сатурация смешанной венозной крови кислородом | 70-77% |
Объемное содержание кислорода в артериальной крови | 16,5-20,5 об. % |
Объемное содержание кислорода в смешанной венозной крови | 12,0-16,0 об. % |
Артериовенозная разница по кислороду | 4,0-5,5 об. % |
Доставка кислорода | 520-760 мл/мин/м2 |
Потребление кислорода | 110-180 мл/мин/м2 |
Экстракция кислорода тканями | 22-32% |
Насыщение гемоглобина кислородом зависит от его напряжения в альвеолах и крови. Графически эту зависимость отражает кривая диссоциации оксигемоглобина (рис. 16-7, 16-8). Кривая показывает, что процент оксигенации гемоглобина сохраняется на довольно высоком уровне при существенном снижении парциального давления кислорода. Так, при напряжении кислорода, равном 95-100 мм рт.ст., процент оксигенации гемоглобина соответствует 96-98, при напряжении 60 мм рт.ст. - равняется 90, а при снижении напряжения кислорода до 40 мм рт.ст., что имеет место в венозном конце капилляра, процент оксигенации гемоглобина равен 73.
Кроме парциального давления кислорода, на процесс оксигенации гемоглобина оказывают влияние температура тела, концентрация Н+-ионов, напряжение в крови СО2, содержание в эритроцитах 2,3-дифосфоглицерата (2,3-ДФГ) и АТФ и некоторые другие факторы.
Под действием перечисленных факторов изменяется степень сродства гемоглобина к кислороду, что оказывает влияние на скорость взаимодействия между ними, прочность связи и быстроту диссоциации НbО2 в капиллярах тканей, а это очень важно, так как в клетки тканей проникает только физически растворенный
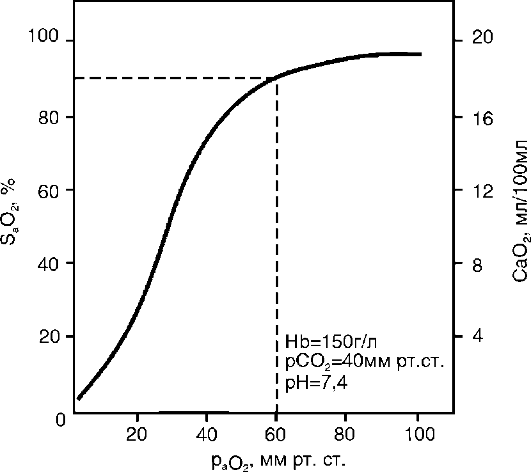 Рис. 16-7. Кривая диссоциации оксигемоглобина: раО2 - рО2 в артериальной крови; SаО2 - насыщение гемоглобина артериальной крови кислородом; СаО2 - содержание кислорода в артериальной крови
Рис. 16-7. Кривая диссоциации оксигемоглобина: раО2 - рО2 в артериальной крови; SаО2 - насыщение гемоглобина артериальной крови кислородом; СаО2 - содержание кислорода в артериальной крови
 Рис. 16-8. Влияние различных факторов на кривую диссоциации оксигемоглобина: А - температуры, Б - рН, В - раСО2
Рис. 16-8. Влияние различных факторов на кривую диссоциации оксигемоглобина: А - температуры, Б - рН, В - раСО2
в плазме крови кислород. В зависимости от изменения степени сродства гемоглобина к кислороду происходят сдвиги кривой диссоциации оксигемоглобина. Если в норме превращение 50% гемоглобина в НbО2 происходит при раО2, равном 26,6 мм рт.ст., то при снижении сродства между гемоглобином и кислородом это имеет место при 30-32 мм рт.ст. В результате кривая смещается вправо. Сдвиг кривой диссоциации НbО2 вправо происходит при метаболическом и газовом (гиперкапния) ацидозе, при повышении температуры тела (лихорадка, перегревание, лихорадоподобные состояния), при увеличении содержания АТФ и 2,3-ДФГ в эритроцитах;
накопление последнего имеет место при гипоксемии, различных видах анемий (особенно при серповидно-клеточной). При всех указанных состояниях увеличивается быстрота отщепления кислорода от НbО2 в капиллярах тканей, и вместе с тем замедляется скорость оксигенации гемоглобина в капиллярах легких, что ведет к снижению содержания кислорода в артериальной крови.
Сдвиг кривой диссоциации НbО2 влево происходит при увеличении сродства гемоглобина к кислороду и наблюдается при метаболическом и газовом (гипокапния) алкалозе, при общей гипотермии и в участках местного охлаждения тканей, при понижении содержания в эритроцитах 2,3-ДФГ (например, при сахарном диабете), при отравлении окисью углерода и при метгемоглобинемии, при наличии в эритроцитах больших количеств фетального гемоглобина, что имеет место у недоношенных детей. При сдвиге влево (вследствие повышения сродства гемоглобина к кислороду) ускоряется процесс оксигенации гемоглобина в легких, и вместе с тем замедляется процесс дезоксигенации НbО2 в капиллярах тканей, что ухудшает снабжение клеток кислородом, в том числе клеток ЦНС. Это может вызвать ощущение тяжести в голове, головную боль и тремор.
Снижение транспорта кислорода к тканям будет наблюдаться при уменьшении кислородной емкости крови вследствие анемии, гемодилюции, образования карбокси- и метгемоглобина, не участвующих в транспорте кислорода, а также при понижении сродства гемоглобина к кислороду. Снижение содержания НbО2 в артериальной крови происходит при усиленном ее шунтировании в легких, при пневмонии, отеке, эмболии a. pulmonalis. Доставка кислорода тканям уменьшается при снижении объемной скорости кровотока в связи с сердечной недостаточностью, гипотонией, снижением объема циркулирующей крови, расстройством микроциркуляции вследствие уменьшения количества функционирующих микрососудов из-за нарушения их проходимости или централизации кровообращения. Доставка кислорода становится недостаточной при увеличении расстояния между находящейся в капиллярах кровью и клетками тканей в связи с развитием интерстициального отека и гипертрофией клеток. При всех указанных нарушениях может развиться гипоксия.
Важным показателем, позволяющим определить количество кислорода, поглощенное тканями, является индекс утилизации кислорода, который представляет собой умноженное на 100 отноше-
ние артериовенозной разницы по содержанию кислорода к объему его в артериальной крови. В норме при прохождении крови через тканевые капилляры используется клетками в среднем 25% поступающего кислорода. У здорового человека индекс утилизации кислорода существенно возрастает при физической работе. Повышение этого индекса происходит также при пониженном содержании кислорода в артериальной крови и при уменьшении объемной скорости кровотока; индекс будет снижаться при уменьшении способности тканей утилизировать кислород.
16.2.2. Транспорт углекислого газа и его нарушения
Парциальное давление СО2 (рСО2) в артериальной крови такое же, как в альвеолах, и соответствует 4,7-6,0 кПа (35-45 мм рт.ст., в среднем 40 мм рт.ст.). В венозной крови рСО2 равно 6,3 кПа (47 мм рт.ст.). Количество транспортируемого СО2 в артериальной крови равняется 50 об.%, а в венозной - 55 об.%. Примерно 10% этого объема физически растворено в плазме крови, и именно эта часть углекислоты определяет напряжение газа в плазме; еще 10-11% объема СО2 транспортируется в виде карбгемоглобина, при этом восстановленный гемоглобин более активно, чем оксигемоглобин, связывает углекислоту. Остальной объем СО2 переносится в составе молекул бикарбоната натрия и калия, которые образуются при участии фермента карбоангидразы эритроцитов. В капиллярах легких по причине превращения гемоглобина в оксигемоглобин связь СО2 с гемоглобином становится менее прочной и происходит его превращение в физически растворимую форму. Вместе с тем образующийся оксигемоглобин, являясь сильной кислотой, отнимает калий от бикарбонатов. Образовавшаяся при этом Н2СО3 расщепляется под действием карбоангидразы на Н2О и СО2, и последний диффундирует в альвеолы.
Транспорт СО2 нарушается: 1) при замедлении кровотока; 2) при анемиях, когда уменьшается связывание его с гемоглобином и включение в бикарбонаты из-за недостатка карбоангидразы (которая содержится только в эритроцитах).
На парциальное давление СО2 в крови существенное влияние оказывает понижение или повышение вентиляции альвеол. Уже незначительное изменение парциального давления СО2 в крови влияет на мозговое кровообращение. При гиперкапнии (вследствие гиповентиляции) сосуды мозга расширяются, повышается
внутричерепное давление, что сопровождается головной болью и головокружением.
Уменьшение парциального давления СО2 при гипервентиляции альвеол снижает мозговой кровоток, при этом возникает состояние сонливости, возможны обмороки.
16.2.3. Гипоксия
Гипоксия (от греч. hypo - мало и лат. oxigenium - кислород) - состояние, возникающее при недостаточном поступлении кислорода в ткани или при нарушении его использования клетками в процессе биологического окисления.
Гипоксия является важнейшим патогенетическим фактором, играющим ведущую роль в развитии многих заболеваний. Этиология гипоксии отличается большим разнообразием, вместе с тем ее проявления при различных формах патологии и компенсаторные реакции, возникающие при этом, имеют много общего. На этом основании гипоксию можно считать типическим патологическим процессом.
Виды гипоксии. В.В. Пашутин предложил различать два вида гипоксии - физиологическую, связанную с повышенной нагрузкой, и патологическую. Д. Баркрофт (1925) выделил три вида гипоксии: 1) аноксическую, 2) анемическую и 3) застойную.
В настоящее время используется классификация, предложенная И.Р. Петровым (1949), который разделил все виды гипоксии на: 1) экзогенную, возникающую при понижении рО2 во вдыхаемом воздухе; она была подразделена, в свою очередь, на гипо- и нормобарическую; 2) эндогенную, возникающую при различного рода заболеваниях и патологических состояниях. Эндогенная гипоксия представляет собой обширную группу, и в зависимости от этиологии и патогенеза в ней выделены следующие виды: а) дыхательная (легочная); б) циркуляторная (сердечно-сосудистая); в) гемическая (кровяная); г) тканевая (или гистотоксическая); д) смешанная. Дополнительно в настоящее время выделяют гипоксию субстратную и перегрузочную.
По течению различают гипоксию молниеносную, развивающуюся в течение нескольких секунд или десятков секунд; острую - в течение нескольких минут или десятков минут; подострую - в течение нескольких часов и хроническую, длящуюся недели, месяцы, годы.
По степени тяжести гипоксия подразделяется на легкую, умеренную, тяжелую и критическую, как правило, имеющую летальный исход.
По распространенности различают гипоксию общую (системную) и местную, распространяющуюся на какой-то один орган или определенную часть тела.
Экзогенная гипоксия
Экзогенная гипоксия возникает при понижении рО2 во вдыхаемом воздухе и имеет две формы: нормобарическую и гипобарическую.
Гипобарическая форма экзогенной гипоксии развивается при восхождении на высокие горы и при подъеме на большую высоту с помощью летательных аппаратов открытого типа без индивидуальных кислородных приборов.
Нормобарическая форма экзогенной гипоксии может развиться при пребывании в шахтах, глубоких колодцах, подводных лодках, водолазных костюмах, у оперируемых пациентов при неисправности наркозно-дыхательной аппаратуры, при смоге и загазованности воздуха в мегаполисах, когда имеется недостаточное количество О2 во вдыхаемом воздухе при нормальном общем атмосферном давлении.
Для гипобарической и нормобарической форм экзогенной гипоксии характерно падение парциального давления кислорода в альвеолах, в связи с чем замедляется процесс оксигенации гемоглобина в легких, снижаются процент оксигемоглобина и напряжение кислорода в крови, т.е. возникает состояние гипоксемии. Вместе с тем повышается содержание в крови восстановленного гемоглобина, что сопровождается развитием цианоза. Уменьшается разница между уровнями напряжения кислорода в крови и тканях, и скорость поступления его в ткани замедляется. Наиболее низкое напряжение кислорода, при котором еще может осуществляться тканевое дыхание, называется критическим. Для артериальной крови критическое напряжение кислорода соответствует 27-33 мм рт.ст., для венозной - 19 мм рт.ст. Наряду с гипоксемией развивается гипокапния из-за компенсаторной гипервентиляции альвеол. Это ведет к сдвигу кривой диссоциации оксигемоглобина влево вследствие повышения прочности связи между гемоглобином и кислородом, что еще в большей степени затрудняет поступление
кислорода в ткани. Развивается респираторный (газовый) алкалоз, который в дальнейшем может смениться декомпенсированным метаболическим ацидозом из-за накопления в тканях недоокисленных продуктов. Другим неблагоприятным следствием гипокапнии является ухудшение кровоснабжения сердца и мозга вследствие сужения артериол сердца и мозга (из-за этого возможны обмороки).
Существует особый случай нормобарической формы экзогенной гипоксии (нахождение в замкнутом пространстве с нарушенной вентиляцией), когда пониженное содержание кислорода в воздухе может сочетаться с повышением в воздухе парциального давления СО2. В таких случаях возможно одновременное развитие гипоксемии и гиперкапнии. Умеренная гиперкапния оказывает благоприятное влияние на кровоснабжение сердца и мозга, повышает возбудимость дыхательного центра, но значительное накопление СО2 в крови сопровождается газовым ацидозом, сдвигом кривой диссоциации оксигемоглобина вправо вследствие снижения сродства гемоглобина к кислороду, что дополнительно затрудняет процесс оксигенации крови в легких и усугубляет гипоксемию и гипоксию тканей.
Гипоксия при патологических процессах в организме (эндогенная)
Дыхательная (легочная) гипоксия развивается при различных видах дыхательной недостаточности, когда по тем или другим причинам затруднено проникновение кислорода из альвеол в кровь. Это может быть связано: 1) с гиповентиляцией альвеол, вследствие чего в них падает парциальное давление кислорода; 2) их спадением из-за недостатка сурфактанта; 3) уменьшением дыхательной поверхности легких вследствие понижения количества функционирующих альвеол; 4) затруднением диффузии кислорода через альвеолярно-капиллярную мембрану; 5) нарушением кровоснабжения ткани легких, развитием в них отека; 6) появлением большого количества перфузируемых, но не вентилируемых альвеол; 7) усилением шунтирования венозной крови в артериальную на уровне легких (пневмония, отек, эмболия a. pulmonalis) или сердца (при незаращении боталлова протока, овального отверстия и др.). Из-за этих нарушений снижается рО2 в артериальной крови, уменьшается содержание оксигемоглобина, т.е. возникает состояние гипоксемии. При гиповентиляции альвеол развивается гиперкапния, понижающая сродство гемоглобина к кислороду, сдвигающая кри-
вую диссоциации оксигемоглобина вправо и затрудняющая еще больше процесс оксигенации гемоглобина в легких. Вместе с тем в крови возрастает содержание восстановленного гемоглобина, что способствует появлению цианоза.
Скорость кровотока и кислородная емкость при дыхательном типе гипоксии нормальны или повышены (в качестве компенсации).
Циркуляторная (сердечно-сосудистая) гипоксия развивается при нарушениях кровообращения и может иметь генерализованный (системный) или местный характер.
Причиной развития генерализованной циркуляторной гипоксии могут являться: 1) недостаточность функции сердца; 2) снижение сосудистого тонуса (шок, коллапс); 3) уменьшение общей массы крови в организме (гиповолемия) после острой кровопотери и при обезвоживании; 4) усиленное депонирование крови (например, в органах брюшной полости при портальной гипертензии и др.); 5) нарушение текучести крови в случаях сладжа эритроцитов и при синдроме диссеминированного внутрисосудистого свертывания крови (ДВС-синдроме); 6) централизация кровообращения, что имеет место при различных видах шока. Циркуляторная гипоксия местного характера, захватывающая какой-либо орган или область тела, может развиться при таких местных нарушениях кровообращения, как венозная гиперемия и ишемия.
Для всех перечисленных состояний характерно уменьшение объемной скорости кровотока. Общее количество крови, притекающей к органам и участкам тела, снижается, соответственно уменьшается и объем доставляемого кислорода, хотя его напряжение (рО2) в артериальной крови, процент оксигемоглобина и кислородная емкость могут быть нормальными. При этом виде гипоксии обнаруживается нарастание коэффициента утилизации кислорода тканями вследствие увеличения времени контакта между ними и кровью при замедлении скорости кровотока, кроме того, замедление скорости кровотока способствует накоплению в тканях и капиллярах углекислоты, которая ускоряет процесс диссоциации оксигемоглобина. Содержание оксигемоглобина в венозной крови в этом случае понижается. Артериовенозная разница по кислороду возрастает. У больных отмечается акроцианоз.
Повышение утилизации кислорода тканями не происходит при усиленном шунтировании крови по артериоло-венулярным анастомозам вследствие спазма прекапиллярных сфинктеров или на-
рушения проходимости капилляров при сладже эритроцитов или развитии ДВС-синдрома. В этих условиях содержание оксигемоглобина в венозной крови может оказаться повышенным. То же происходит, когда транспорт кислорода замедлен на отрезке пути от капилляров до митохондрий, что имеет место при интерстициальном и внутриклеточном отеках, снижении проницаемости стенок капилляров и клеточных мембран. Из этого следует, что для правильной оценки количества кислорода, потребленного тканями, большое значение имеет определение содержания оксигемоглобина в венозной крови.
Гемическая (кровяная) гипоксия развивается при уменьшении кислородной емкости крови из-за снижения содержания гемоглобина и эритроцитов (так называемая анемическая гипоксия) или вследствие образования разновидностей гемоглобина, не способных транспортировать кислород, таких, как карбоксигемоглобин и метгемоглобин.
Снижение содержания гемоглобина и эритроцитов имеет место при различных видах анемий и при гидремии, возникающей в связи с избыточной задержкой воды в организме. При анемиях рО2 в артериальной крови и процент оксигенации гемоглобина не отклоняются от нормы, но снижается общее количество кислорода, связанного с гемоглобином, и поступление его в ткани является недостаточным. При этом виде гипоксии общее содержание оксигемоглобина в венозной крови по сравнению с нормой понижено, но артериовенозная разница по кислороду нормальная.
Образование карбоксигемоглобина происходит при отравлении окисью углерода (СО, угарный газ), которая присоединяется к молекуле гемоглобина в том же месте, что и кислород, при этом сродство гемоглобина к СО в 250-350 раз (по данным различных авторов) превышает сродство к кислороду. Поэтому в артериальной крови процент оксигенации гемоглобина снижен. При содержании в воздухе 0,1% угарного газа более половины гемоглобина быстро превращается в карбоксигемоглобин. Как известно, СО образуется при неполном сгорании топлива, работе двигателей внутреннего сгорания, может накапливаться в шахтах. Важным источником СО является курение. Содержание карбоксигемоглобина в крови курильщиков может достигать 10-15%, у некурящих оно составляет 1-3%. Отравление СО происходит также при вдыхании большого количества дыма при пожарах. Частым источником СО является метиленхлорид - распространенный компонент растворителей
красок. Он проникает в организм в виде паров через дыхательные пути и через кожу, поступает с кровью в печень, где расщепляется с образованием угарного газа.
Карбоксигемоглобин не может участвовать в транспорте кислорода. Образование карбоксигемоглобина уменьшает количество оксигемоглобина, способное переносить кислород, а также затрудняет диссоциацию оставшегося оксигемоглобина и отдачу кислорода тканям. В связи с этим уменьшается артериовенозная разница по содержанию кислорода. Кривая диссоциации оксигемоглобина в этом случае сдвигается влево. Поэтому инактивация 50% гемоглобина при превращении его в карбоксигемоглобин сопровождается более тяжелой гипоксией, чем недостаток 50% гемоглобина при анемии. Утяжеляющим является и то обстоятельство, что при отравлении СО не происходит рефлекторной стимуляции дыхания, так как парциальное давление кислорода в крови остается неизменным. Токсическое действие угарного газа на организм обеспечивается не только образованием карбоксигемоглобина. Малая фракция растворенной в плазме крови окиси углерода играет очень важную роль, так как она проникает в клетки и повышает образование в них активных радикалов кислорода и перекисное окисление ненасыщенных жирных кислот. Это ведет к нарушению структуры и функции клеток, в первую очередь в ЦНС, с развитием осложнений: угнетением дыхания, падением кровяного давления. В случаях тяжелых отравлений быстро возникает состояние комы и наступает смерть. Наиболее эффективными мерами помощи при отравлении СО являются нормо- и гипербарическая оксигенация. Сродство окиси углерода к гемоглобину снижается при повышении температуры тела и под действием света, а также при гиперкапнии, что послужило поводом для использования карбогена при лечении людей, отравленных угарным газом.
Карбоксигемоглобин, формирующийся при отравлении угарным газом, имеет яркий вишнево-красный цвет, и его присутствие нельзя визуально определить по цвету крови. Для определения содержания СО в крови используют спектрофотометрический анализ крови, цветовые химические пробы с веществами, придающими СО-содержащей крови малиновый цвет (формалин, дистиллированная вода) или коричневато-красный оттенок (КОН) (см. раздел 14.4.5).
Метгемоглобин отличается от оксигемоглобина наличием в составе гема трехвалентного железа и так же, как карбоксигемогло-
бин, имеет большее сродство к гемоглобину, чем кислород, и не способен к переносу кислорода. В артериальной крови при метгемоглобинообразовании процент оксигенации гемоглобина снижен.
Существует большое количество веществ - метгемоглобинообразователей. К их числу относятся: 1) нитросоединения (окислы азота, неорганические нитриты и нитраты, селитра, органические нитросоединения); 2) аминосоединения - анилин и его производные в составе чернил, гидроксиламин, фенилгидразин и др.; 3) различные красители, например метиленовая синь; 4) окислители - бертолетова соль, перманганат калия, нафталин, хиноны, красная кровяная соль и др.; 5) лекарственные препараты - новокаин, аспирин, фенацитин, сульфаниламиды, ПАСК, викасол, цитрамон, анестезин и др. Вещества, вызывающие превращение гемоглобина в метгемоглобин, образуются при ряде производственных процессов: при производстве силоса, работе с ацетиленовыми сварочно-режущими аппаратами, гербицидами, дефолиантами и др. Контакт с нитритами и нитратами происходит также при изготовлении взрывчатых веществ, консервировании пищевых продуктов, при сельскохозяйственных работах; нитраты часто присутствуют в питьевой воде. Существуют наследственные формы метгемоглобинемии, обусловленные дефицитом ферментных систем, участвующих в превращении (редукции) постоянно образующегося в малых количествах метгемоглобина в гемоглобин.
Образование метгемоглобина не только снижает кислородную емкость крови, но и резко уменьшает способность оставшегося оксигемоглобина отдавать кислород тканям вследствие сдвига кривой диссоциации оксигемоглобина влево. В связи с этим уменьшается артериовенозная разница по содержанию кислорода.
Метгемоглобинообразователи могут оказывать и непосредственное угнетающее действие на тканевое дыхание, разобщать окисление и фосфорилирование. Таким образом, имеется значительное сходство в механизме развития гипоксии при отравлении СО и метгемоглобинообразователями. Признаки гипоксии выявляются при превращении в метгемоглобин 20-50% гемоглобина. Превращение в метгемоглобин 75% гемоглобина является смертельным. Присутствие в крови метгемоглобина свыше 15% придает крови коричневый цвет («шоколадная кровь») (см. раздел 14.4.5).
При метгемоглобинемии происходит спонтанная деметгемоглобинизация благодаря активации редуктазной системы эритроцитов
и накоплению недоокисленных продуктов. Этот процесс ускоряется под действием аскорбиновой кислоты и глутатиона. При тяжелом отравлении метгемоглобинообразователями лечебный эффект могут оказать обменное переливание крови, гипербарическая оксигенация и вдыхание чистого кислорода.
Тканевая (гистотоксическая) гипоксия характеризуется нарушением способности тканей поглощать в нормальном объеме доставленный им кислород из-за нарушения системы клеточных ферментов в цепи транспорта электронов.
В этиологии данного вида гипоксии играют роль: 1) инактивация дыхательных ферментов: цитохромоксидазы под действием цианидов; клеточных дегидраз - под действием эфира, уретана, алкоголя, барбитуратов и других веществ; ингибирование дыхательных ферментов происходит также под действием ионов Cu, Hg и Ag; 2) нарушение синтеза дыхательных ферментов при дефиците витаминов B1, B2, PP, пантотеновой кислоты; 3) ослабление сопряженности процессов окисления и фосфорилирования при действии разобщающих факторов (отравление нитритами, микробными токсинами, тиреоидными гормонами и др.); 4) повреждение митохондрий ионизирующей радиацией, продуктами перекисного окисления липидов, токсически действующими метаболитами при уремии, кахексии, тяжелых инфекциях. Гистотоксическая гипоксия может развиться также при отравлении эндотоксинами.
При тканевой гипоксии, обусловленной разобщением процессов окисления и фосфорилирования, потребление кислорода тканями может возрастать, однако превалирующее количество образующейся энергии рассеивается в виде тепла и не может использоваться для нужд клетки. Синтез макроэргических соединений снижен и не покрывает потребностей тканей, они находятся в таком же состоянии, как при недостатке кислорода.
Подобное состояние возникает и при отсутствии в клетках субстратов для окисления, что имеет место при тяжелой форме голодания. На этом основании выделяют субстратную гипоксию.
При гистотоксической и субстратной формах гипоксии напряжение кислорода и процент оксигемоглобина в артериальной крови нормальны, а в венозной крови - повышены. Артериовенозная разница в содержании кислорода падает вследствие снижения утилизации кислорода тканями. Цианоз при данных видах гипоксии не развивается (табл. 16-2).
Таблица 16-2. Основные показатели, характеризующие различные виды гипоксии
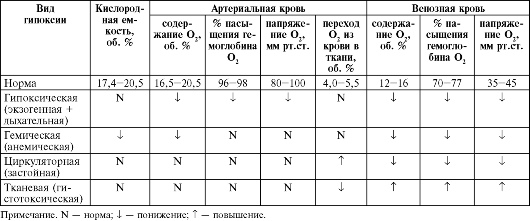 Смешанные формы гипоксии являются
наиболее частыми. Они характеризуются сочетанием двух основных типов
гипоксии или более: 1) при травматическом шоке наряду с циркуляторной
может развиться дыхательная форма гипоксии в связи с нарушением
микроциркуляции в легких («шоковое легкое»); 2) при тяжелой анемии или
массивном образовании карбоксиили метгемоглобина развивается гипоксия
миокарда, что ведет к снижению его функции, падению кровяного давления -
в результате на анемическую гипоксию наслаивается циркуляторная; 3)
отравление нитратами вызывает гемическую и тканевые формы гипоксии, так
как под действием этих ядов происходит не только образование
метгемоглобина, но и разобщение процессов окисления и фосфолирирования.
Разумеется, смешанные формы гипоксии могут оказать более выраженное
повреждающее действие, чем какой-либо один вид гипоксии, так как
приводят к срыву ряда компенсаторноприспособительных реакций.
Смешанные формы гипоксии являются
наиболее частыми. Они характеризуются сочетанием двух основных типов
гипоксии или более: 1) при травматическом шоке наряду с циркуляторной
может развиться дыхательная форма гипоксии в связи с нарушением
микроциркуляции в легких («шоковое легкое»); 2) при тяжелой анемии или
массивном образовании карбоксиили метгемоглобина развивается гипоксия
миокарда, что ведет к снижению его функции, падению кровяного давления -
в результате на анемическую гипоксию наслаивается циркуляторная; 3)
отравление нитратами вызывает гемическую и тканевые формы гипоксии, так
как под действием этих ядов происходит не только образование
метгемоглобина, но и разобщение процессов окисления и фосфолирирования.
Разумеется, смешанные формы гипоксии могут оказать более выраженное
повреждающее действие, чем какой-либо один вид гипоксии, так как
приводят к срыву ряда компенсаторноприспособительных реакций.
Развитию гипоксии способствуют состояния, при которых возрастает потребность в кислороде, - лихорадка, стресс, высокая физическая нагрузка и др.
Перегрузочная форма гипоксии (физиологическая) развивается у здоровых людей при тяжелой физической работе, когда поступление в ткани кислорода может стать недостаточным из-за высокой потребности в нем. При этом коэффициент потребления кислорода тканями становится очень высоким и может достигать 90% (вместо 25% в норме). Повышенной отдаче кислорода тканям способствует развивающийся при тяжелой физической работе метаболический ацидоз, который снижает прочность связи гемоглобина с кислородом. Парциальное давление кислорода в артериальной крови нормально, так же как и содержание оксигемоглобина, а в венозной крови эти показатели резко снижены. Артериовенозная разница по кислороду в этом случае повышается вследствие возрастания утилизации кислорода тканями.
Компенсаторно-приспособительные реакции при гипоксии
Развитие гипоксии является стимулом для включения комплекса компенсаторных и приспособительных реакций, направленных на восстановление нормального снабжения тканей кислородом. В противодействии развитию гипоксии принимают участие системы органов кровообращения, дыхания, система крови, проис-
ходит активация ряда биохимических процессов, способствующих ослаблению кислородного голодания клеток. Приспособительные реакции, как правило, предшествуют развитию выраженной гипоксии.
Имеются существенные различия в характере компенсаторноприспособительных реакций при острой и хронической формах гипоксии. Срочные реакции, возникающие при остро развивающейся гипоксии, выражаются в первую очередь в изменении функции органов кровообращения и дыхания. Происходит увеличение минутного объема сердца за счет как тахикардии, так и возрастания систолического объема. Повышаются артериальное давление, скорость кровотока и возврат венозной крови к сердцу, что способствует ускорению доставки кислорода тканям. В случае тяжелой гипоксии происходит централизация кровообращения - значительная часть крови устремляется к жизненно важным органам. Расширяются сосуды мозга. Гипоксия является мощным сосудорасширяющим фактором для коронарных сосудов. Объем коронарного кровотока значительно возрастает при снижении в крови содержания кислорода до 8-9 об.%. Вместе с тем суживаются сосуды мышц и органов брюшной полости. Кровоток через ткани регулируется наличием в них кислорода, и чем ниже его концентрация, тем больше крови притекает к этим тканям.
Сосудорасширяющим действием обладают продукты распада АТФ (АДФ, АМФ, неорганический фосфат), а также СО2, Н+- ионы, молочная кислота. При гипоксии их количество возрастает. В условиях ацидоза понижается возбудимость α-адренорецепторов по отношению к катехоламинам, что также способствует расширению сосудов.
Срочные приспособительные реакции со стороны органов дыхания проявляются его учащением и углублением, что способствует улучшению вентиляции альвеол. Происходит включение в акт дыхания резервных альвеол. Увеличивается кровоснабжение легких. Гипервентиляция альвеол обусловливает развитие гипокапнии, которая повышает сродство гемоглобина к кислороду и ускоряет оксигенацию притекающей к легким крови. В течение двух суток от начала развития острой гипоксии в эритроцитах возрастает содержание 2,3-ДФГ и АТФ, что способствует ускорению отдачи кислорода тканям. К числу реакций на острую гипоксию относится увеличение массы циркулирующей крови за счет опорожнения кровяных депо и ускоренного вымывания эритроцитов
из костного мозга; благодаря этому повышается кислородная емкость крови. Приспособительные реакции на уровне испытывающих кислородное голодание тканей выражаются в повышении сопряженности процессов окисления и фосфорилирования и в активации гликолиза, за счет которого могут удовлетворяться в течение короткого времени энергетические потребности клеток. При усилении гликолиза в тканях накапливается молочная кислота, развивается ацидоз, который ускоряет диссоциацию оксигемоглобина в капиллярах.
При экзогенном и дыхательном видах гипоксии огромное приспособительное значение имеет одна особенность взаимодействия гемоглобина с кислородом: снижение раО2 с 95-100 до 60 мм рт. ст. мало отражается на степени оксигенации гемоглобина. Так, при раО2, равном 60 мм рт.ст., 90% гемоглобина будет связано с кислородом, и если доставка оксигемоглобина тканям не будет нарушена, то и при таком существенно сниженном рО2 в артериальной крови они не будут испытывать состояние гипоксии. Наконец, еще одно проявление приспособления: в условиях острой гипоксии снижается функция, а значит, и потребность в кислороде многих органов и тканей, не принимающих непосредственного участия в обеспечении организма кислородом.
Долговременные компенсаторно-приспособительные реакции возникают при хронической гипоксии на почве различных заболеваний (например, врожденных пороков сердца), при длительном пребывании в горах, при специальных тренировках в барокамерах. В этих условиях отмечается увеличение количества эритроцитов и гемоглобина вследствие активации эритропоэза под действием эритропоэтина, усиленно выделяемого почками при их гипоксии. В результате увеличиваются кислородная емкость крови и ее объем. В эритроцитах повышается содержание 2,3-ДФГ, понижающего сродство гемоглобина к кислороду, что ускоряет его отдачу тканям. Увеличиваются дыхательная поверхность легких и их жизненная емкость вследствие образования новых альвеол. У людей, живущих в горной местности на большой высоте, увеличен объем грудной клетки, развивается гипертрофия дыхательной мускулатуры. Расширяется сосудистое русло легких, повышается его кровенаполнение, что может сопровождаться гипертрофией миокарда в основном за счет правого сердца. В миокарде и дыхательных мышцах возрастает содержание миоглобина. Вместе с тем в клетках различных тканей увеличивается количество митохондрий и
повышается сродство дыхательных ферментов к кислороду. Увеличивается емкость микроциркуляторного русла в мозгу и сердце за счет расширения капилляров. У людей, находящихся в состоянии хронической гипоксии (например, при сердечной или дыхательной недостаточности), увеличивается васкуляризация периферических тканей. Одним из признаков этого является увеличение размеров концевых фаланг с утратой нормального угла ногтевого ложа. Другое проявление компенсации при хронической гипоксии - это развитие коллатерального кровообращения там, где имеется затруднение для кровотока.
Существует некоторое своеобразие адаптационных процессов при каждом виде гипоксии. Приспособительные реакции в меньшей степени могут проявляться со стороны патологически измененных органов, ответственных за развитие гипоксии в каждом конкретном случае. Например, гемическая и гипоксическая (экзогенная + дыхательная) гипоксии могут вызвать увеличение минутного объема сердца, тогда как циркуляторная гипоксия, возникающая при сердечной недостаточности, не сопровождается такой приспособительной реакцией.
Механизмы развития компенсаторных и приспособительных реакций при гипоксии. Изменения функции органов дыхания и кровообращения, возникающие при острой гипоксии, являются в основном рефлекторными. Они обусловлены раздражением дыхательного центра и хеморецепторов дуги аорты и каротидной зоны низким напряжением кислорода в артериальной крови. Эти рецепторы чувствительны также к изменению содержания СО2 и Н+, но в меньшей степени, чем дыхательный центр. Тахикардия может быть результатом прямого действия гипоксии на проводящую систему сердца. Сосудорасширяющим действием обладают продукты распада АТФ и ряд других ранее упомянутых тканевых факторов, количество которых при гипоксии возрастает.
Гипоксия является сильным стрессорным фактором, под действием которого происходит активация гипоталамо-гипофизарнонадпочечниковой системы, увеличивается выделение в кровь глюкокортикоидов, которые активируют ферменты дыхательной цепи и повышают стабильность клеточных мембран, в том числе мембран лизосом. Это снижает опасность выделения из последних в цитоплазму гидролитических ферментов, способных вызвать аутолиз клеток.
При хронической гипоксии происходят не только функциональные сдвиги, но и структурные изменения, имеющие большое компенсаторно-приспособительное значение. Механизм этих явлений был подробно исследован в лаборатории Ф.З. Меерсона. Установлено, что дефицит макроэргических фосфорных соединений, обусловленный гипоксией, вызывает активацию синтеза нуклеиновых кислот и белков. Итогом этих биохимических сдвигов является усиление в тканях пластических процессов, лежащих в основе гипертрофии миокардиоцитов и дыхательной мускулатуры, новообразования альвеол и новых сосудов. В результате повышается работоспособность аппарата внешнего дыхания и кровообращения. Вместе с тем функционирование этих органов становится более экономичным вследствие повышения мощности системы энергообеспечения в клетках (увеличение числа митохондрий, повышение активности дыхательных ферментов).
Установлено, что при длительной адаптации к гипоксии уменьшается продукция тиреотропного и тиреоидных гормонов; это сопровождается снижением основного обмена и уменьшением потребления кислорода различными органами, в частности сердцем, при неизменной внешней работе.
Активация синтеза нуклеиновых кислот и белков при адаптации к хронической гипоксии обнаружена и в головном мозгу и способствует улучшению его функции.
Состояние устойчивой адаптации к гипоксии характеризуется уменьшением гипервентиляции легких, нормализацией функции сердца, снижением степени гипоксемии, устранением стресссиндрома. Происходит активация стресс-лимитирующих систем организма, в частности многократное повышение содержания опиоидных пептидов в надпочечниках, а также в мозгу животных, подвергнутых острой или подострой гипоксии. Наряду с антистрессорным действием опиоидные пептиды понижают интенсивность энергетического обмена и потребность тканей в кислороде. Усиливается активность ферментов, устраняющих повреждающее действие продуктов перекисного окисления липидов (супероксиддисмутазы, каталазы и т.д.).
Установлено, что при адаптации к гипоксии повышается резистентность организма к действию других повреждающих факторов, различного рода стрессоров. Состояние устойчивой адаптации может сохраняться в течение многих лет.
Повреждающее действие гипоксии
При резко выраженной гипоксии компенсаторые механизмы могут оказаться недостаточными, что сопровождается выраженными структурными, биохимическими и функциональными расстройствами.
Чувствительность различных тканей и органов к повреждающему действию гипоксии сильно варьирует. В условиях полного прекращения доставки кислорода сухожилия, хрящи и кости сохраняют свою жизнеспособность в течение многих часов; поперечно-полосатые мышцы - около двух часов; миокард, почки и печень - 20-40 мин, тогда как в коре головного мозга и в мозжечке в этих условиях уже через 2,5-3 мин появляются очаги некроза, а через 6-8 мин происходит гибель всех клеток коры головного мозга. Несколько большей устойчивостью обладают нейроны продолговатого мозга - их деятельность может восстанавливаться спустя 30 мин после прекращения доставки кислорода.
Нарушение процессов обмена веществ при гипоксии. В основе всех нарушений при гипоксии лежит пониженное образование или полное прекращение образования макроэргических фосфорных соединений, которое ограничивает способность клеток выполнять нормальные функции и поддерживать состояние внутриклеточного гомеостаза. При недостаточном поступлении в клетки кислорода усиливается процесс анаэробного гликолиза, но он может лишь в незначительной степени компенсировать ослабление окислительных процессов. Особенно это касается клеток центральной нервной системы, потребность которых в синтезе макроэргических соединений наиболее высока. В норме потребление кислорода мозгом составляет около 20% от общей потребности в нем организма. Под действием гипоксии повышается проницаемость капилляров мозга, что ведет к его отеку и некрозу.
Миокард также характеризуется слабой способностью к энергообеспечению за счет анаэробных процессов. Гликолиз может обеспечить потребность миокардиоцитов в энергии лишь в течение нескольких минут. Запасы гликогена в миокарде быстро истощаются. Содержание гликолитических ферментов в миокардиоцитах незначительно. Уже через 3-4 мин после прекращения доставки к миокарду кислорода сердце теряет способность создавать артериальное давление, необходимое для поддержания кровотока в мозгу, вследствие чего в нем возникают необратимые изменения.
Гликолиз не только является неадекватным способом образования энергии, но и оказывает отрицательное действие на другие метаболические процессы в клетках, так как в результате накопления молочной и пировиноградной кислот развивается метаболический ацидоз, который уменьшает активность тканевых ферментов. При резко выраженном дефиците макроэргов расстраивается функция энергозависимых мембранных насосов, вследствие этого нарушается регуляция перемещения ионов через клеточную мембрану. Происходят повышенный выход из клеток калия и избыточное поступление внутрь натрия. Это ведет к понижению мембранного потенциала и изменению нервно-мышечной возбудимости, которая первоначально повышается, а затем ослабляется и утрачивается. Вслед за ионами натрия в клетки устремляется вода, это вызывает их набухание.
Кроме избытка натрия, в клетках создается избыток кальция в связи с нарушением функции энергозависимого кальциевого насоса. Повышенное поступление кальция в нейроны обусловлено также открытием дополнительных кальциевых каналов под действием глутамата, образование которого при гипоксии возрастает. Ионы Са активируют фосфолипазу А2, которая разрушает липидные комплексы клеточных мембран, что в еще большей степени нарушает работу мембранных насосов и функцию митохондрий (подробнее см. главу 3).
Развивающийся при острой гипоксии стресс-синдром, наряду с ранее упомянутым положительным эффектом глюкокортикоидов, оказывает выраженное катаболическое действие на белковый обмен, вызывает отрицательный азотистый баланс, повышает расход жировых запасов организма.
Повреждающее действие на клетки оказывают продукты перекисного окисления липидов, которое в условиях гипоксии усиливается. Образующиеся при этом процессе активные формы кислорода и другие свободные радикалы повреждают наружную и внутренние клеточные мембраны, в том числе мембрану лизосом. Этому способствует и развитие ацидоза. В результате этих воздействий лизосомы освобождают находящиеся в них гидролитические ферменты, оказывающие повреждающее действие на клетки вплоть до развития аутолиза.
В результате указанных метаболических расстройств клетки утрачивают способность выполнять свои функции, что лежит в основе наблюдаемых при гипоксии клинических симптомов повреждения.
Нарушение функции и структуры органов при гипоксии. Основная симптоматология при острой гипоксии обусловлена нарушением функции центральной нервной системы. Частым первичным проявлением гипоксии являются головная боль, боли в области сердца. Предполагается, что возбуждение болевых рецепторов происходит в результате раздражения их накапливающейся в тканях молочной кислотой. Другими ранними симптомами, возникающими при снижении насыщения артериальной крови кислородом до 89-85% (вместо 96% в норме), являются состояние некоторого эмоционального возбуждения (эйфории), ослабление остроты восприятия изменений окружающей обстановки, нарушение их критической оценки, что ведет к неадекватному поведению. Считается, что эти симптомы обусловлены расстройством процесса внутреннего торможения в клетках коры головного мозга. В дальнейшем ослабляется тормозное влияние коры на подкорковые центры. Возникает состояние, подобное алкогольному опьянению: тошнота, рвота, нарушение координации движений, двигательное беспокойство, заторможенность сознания, судороги. Дыхание становится неритмичным. Появляется периодическое дыхание. Сердечная деятельность и сосудистый тонус падают. Может развиться цианоз. При снижении парциального давления кислорода в артериальной крови до 40-20 мм рт.ст. возникает состояние комы, угасают функции коры, подкорковых и стволовых центров головного мозга. При парциальном давлении кислорода в артериальной крови менее 20 мм рт.ст. наступает смерть. Ей может предшествовать агональное дыхание в виде глубоких редких судорожных вздохов.
Описанные функциональные изменения характерны для острой или подострой гипоксии. При молниеносной гипоксии может произойти быстрая (иногда в течение нескольких секунд) остановка сердца и паралич дыхания. Такой вид гипоксии может иметь место при отравлении большой дозой яда, блокирующего тканевое дыхание (например, цианидами).
Острая гипоксия, возникающая при отравлении СО в высокой дозе, может быстро привести к смерти, при этом потеря сознания и смерть могут наступить без каких-либо предшествующих симптомов. Описаны случаи гибели людей, находящихся в закрытом гараже при включенном двигателе машины, при этом необратимые изменения могут развиться в течение 10 мин. Если летальный исход не наступил, то у отравленных угарным газом людей позже может развиться нейропсихический синдром. К его проявлени-
ям относят паркинсонизм, деменцию, психозы, развитие которых связано с повреждением globus pallidus и глубоко расположенного белого вещества головного мозга. В 50-75% случаев в течение года может произойти исчезновение этих расстройств.
Хронические некомпенсированные формы гипоксии, развивающиеся при длительно существующих заболеваниях органов дыхания и сердца, а также при анемиях, характеризуются понижением работоспособности в связи с быстро возникающим утомлением. Уже при небольшой физической нагрузке у больных появляются сердцебиение, одышка, ощущение слабости. Нередко возникают боли в области сердца, головная боль, головокружение.
Кроме функциональных расстройств, при гипоксии могут развиться морфологические нарушения в различных органах. Их можно подразделить на обратимые и необратимые. Обратимые нарушения проявляются в виде жирового перерождения в волокнах поперечно-полосатой мускулатуры, миокарде, гепатоцитах. Необратимые нарушения при острой гипоксии характеризуются развитием очаговых кровоизлияний во внутренние органы, в том числе в оболочки и ткань мозга, дегенеративными изменениями в коре мозга, мозжечке и подкорковых ганглиях. Может возникнуть периваскулярный отек ткани мозга. При гипоксии почек может развиться некробиоз или некроз почечных канальцев, сопровождающийся острой почечной недостаточностью. Может произойти гибель клеток в центре печеночных долек с последующим фиброзом. Длительное кислородное голодание сопровождается повышенной гибелью паренхиматозных клеток и разрастанием соединительной ткани в различных органах.
Оксигенотерапия
Ингаляция кислорода под нормальным (нормобарическая оксигенация) или повышенным давлением (гипербарическая оксигенация) является одним из эффективных методов лечения при некоторых тяжелых формах гипоксии.
Нормобарическая оксигенотерапия показана в тех случаях, когда парциальное давление кислорода в артериальной крови ниже 60 мм рт.ст., а процент оксигенации гемоглобина - менее 90. Не рекомендуется проводить оксигенотерапию при более высоком раО2, так как это лишь в незначительной степени повысит образование оксигемоглобина, но может привести к нежелательным послед-
ствиям. При гиповентиляции альвеол и при нарушении диффузии кислорода через альвеолярную мембрану такая кислородная терапия существенно или полностью устраняет гипоксемию.
Гипербарическая оксигенация особенно показана при лечении больных с острой постгеморрагической анемией и при тяжелых формах отравления окисью углерода и метгемоглобинообразователями, при декомпрессионной болезни, артериальной газовой эмболии, острой травме с развитием ишемии тканей и ряде других тяжелых состояний. Гипербарическая оксигенация устраняет как острые, так и отдаленные эффекты отравления окисью углерода.
При введении кислорода под давлением 2,5-3 атм его фракция, растворенная в плазме крови, достигает 6 об. %, что вполне достаточно для удовлетворения потребностей тканей в кислороде без участия гемоглобина. Кислородная терапия мало эффективна при гистотоксической гипоксии и при гипоксии, обусловленной венозно-артериальным шунтированием крови при эмболии a. pulmonalis и некоторых врожденных пороках сердца и сосудов, когда значительная часть венозной крови поступает в артериальное русло, минуя легкие.
Длительно проводимая оксигенотерапия может оказать токсическое действие, которое выражается в потере сознания, развитии судорог и отеке мозга, в угнетении сердечной деятельности; в легких могут развиться нарушения, подобные таковым при респираторном дистресс-синдроме у взрослых. В механизме повреждающего действия кислорода играют роль: понижение активности многих ферментов, участвующих в клеточном метаболизме, образование большого количества свободных радикалов кислорода и усиление перекисного окисления липидов, что ведет к повреждению клеточных мембран.
Опасным до некоторой степени является применение кислородной терапии при снижении чувствительности дыхательного центра к повышению содержания СО2 в крови, что имеет место у лиц пожилого и старческого возраста с наличием церебрального атеросклероза, при органических поражениях центральной нервной системы. У таких больных регуляция дыхания происходит с участием каротидных хеморецепторов, чувствительных к гипоксемии. Устранение ее может привести к остановке дыхания.