Патофизиология Новицкого, Е.Д. Гольдберга Тома 1 и 2 - 2009 г.
|
|
|
|
ГЛАВА 13 ПАТОФИЗИОЛОГИЯ ТКАНЕВОГО РОСТА
13.1. НАРУШЕНИЯ ОСНОВНЫХ ПЕРИОДОВ РОСТА ЧЕЛОВЕКА
Рост всего организма человека или отдельных его клеток, тканей, или органов является патологическим, если он перестает способствовать существованию организма в окружающей его среде и становится вредным для него. Физиологический рост человека заканчивается в основном к 21-му году, если он завершается раньше этого срока или продолжается дольше, то становится патологическим. Например, при недостатке соматотропного гормона (СТГ) передней доли гипофиза рост у людей заканчивается значительно раньше. Такие люди остаются малорослыми (карликами), физически недоразвитыми. Они страдают ослаблением функции половых желез и надпочечников, менее устойчивы к инфекциям и отравлениям. Избыточный рост, например, при опухоли передней доли гипофиза и избытке СТГ, также вреден для организма. Такие гиганты обычно физически слабы, малоустойчивы к вредоносным влияниям среды (инфекция, интоксикация).
Нарушения могут возникать в каждом из основных периодов роста человека: эмбриональном и постнатальном (препубертатном и пубертатном).
Нарушение эмбрионального роста. Эмбриональный, или внутриутробный, рост и развитие (рост до рождения, пренатальный рост) начинается с первого деления оплодотворенной яйцеклетки и продолжается до рождения (270 суток со времени зачатия или 280 дней с первого дня последней менструации). Кривая этого роста представляет линейную зависимость между длиной, массой эмбриона и временем его развития.
Эмбриональньгй рост управляется генетическими факторами - генофондом оплодотворенного яйца. Реализация действия гена на развитие эмбриона и процессы формообразования органов и тканей (механика развития) осуществляются через влияние клеток эмбриона друг на друга. Разные части зародыша имеют неодинаковую организующую активность. Например, организационный центр области верхней губы - бластопора обладает особенно активным организующим свойством.
Уродства - нарушения внутриутробного развития, вызывающие стойкие изменения строения тела человека. В ранних стадиях эмбриогенеза (морула, бластула) возможны отделения от зародыша части, связанной с ним, но развивающейся, как другой зародыш или его часть. Этот другой зародыш может получить полное развитие, и к рождению образуются два сращенных плода. В зависимости от места сращения различают торакопаги (thoracopagus - сращение через грудную клетку, или общая грудная клетка), пигопаги (pigopagus - сращение в области крестца) и многие другие виды (рис. 13-1). Иногда один из зародышей полностью не развивается, остается прикрепленным к черепу плода и выходит у него наружу через рот (epignatus). Уроды могут родиться живыми и продолжать существование многие годы после рождения. Известен случай, когда cиамские близнецы, имевшие сращение сбоку, жили до 65 лет (рис. 13-2).
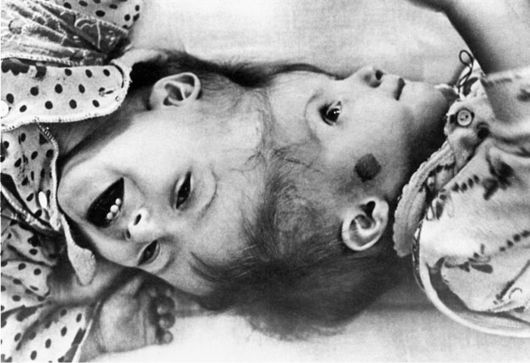 Рис. 13-1. Дефекты развития плода - уроды (по El. Gendler, 1989)
Рис. 13-1. Дефекты развития плода - уроды (по El. Gendler, 1989)
Под влиянием различных механических, токсических (например, талидамид, кордиган и др.), инфекционных воздействий возникают существенные нарушения развития и роста эмбриона, формирование уродств и прекращение эмбрионального развития с преждевременным удалением его из матки (аборты, выкидыши). Особое значение в этом отношении имеет действие ионизирующей радиации. Оно настолько велико, что через 55 лет после атомного взрыва в Японии (Хиросима, Нагасаки) еще наблюдались его последствия: рождение уродов, бесплодие и другие осложнения. Различают много видов уродств: недоразвитие конечностей, туловища, головы и т.д.
Нарушение постнатального развития. Ненормально быстрый рост (гигантизм). Рост свыше 185 см (у женщин) - 195 см (у мужчин) считается патологическим (рис. 13-3). Его причиной чаще всего является увеличение продукции СТГ при опухолях передней доли гипофиза. Если опухоль возникает у взрослого человека, то она вызывает не общий гигантизм, а рост отдельных костей скелета (нижняя челюсть, эпифизы костей, кости кистей рук и стоп) (подробнее см. главу 20).
Задержка роста, «карликовый рост». Карликом считается человек ниже 121 см для женщин и 130 см для мужчин (рис. 13-4). Задержка роста возникает: а) вследствие недостатка белка в питании; б) при повреждении промежуточного мозга; в) вследствие снижения продукции СТГ передней долей гипофиза; г) при гипофункции щитовидной железы; д) при некоторых наследственных заболеваниях (болезнь Дауна).
Особый вид малорослости представляет хондродистрофия. У людей с этой болезнью, которая начинается внутриутробно, имеется повреждение зародышевого эпифизарного хряща при

 Рис. 13-3. Знаменитая в свое время великанша Марианна Вэде в 16 лет имела рост 255 см (по B. Aschner, 1910)
Рис. 13-3. Знаменитая в свое время великанша Марианна Вэде в 16 лет имела рост 255 см (по B. Aschner, 1910)
 Рис.
13-4. Обрученные американские карлики «Мисс Милли» (12 лет, рост 72 см)
и «Генерал Майт» (16 лет, рост 82 см) с отцом последнего (по B.
Aschner, 1910)
Рис.
13-4. Обрученные американские карлики «Мисс Милли» (12 лет, рост 72 см)
и «Генерал Майт» (16 лет, рост 82 см) с отцом последнего (по B.
Aschner, 1910)
сохраняющемся без изменений периостальном развитии костей. В результате голова и туловище достигают нормальных размеров при маленьких коротких конечностях и слаборазвитой мускулатуре. Умственное развитие таких больных соответствует возрастной норме.
13.2. ГИПО- И ГИПЕРБИОТИЧЕСКИЕ ПРОЦЕССЫ
Патологическими (вредными для организма) являются различные формы недостатка или избытка роста и размножения отдельных видов клеток, тканей или органов.
Процессы недостатка роста и размножения клеток и тканей называют гипобиотическими. К ним относятся: 1) атрофии (от греч. а - отрицание, trophos - питаю); 2) дистрофии и дегенерации,
различные виды нарушения обмена веществ в клетках органов и тканей.
Процессы избытка роста и размножения клеток, тканей и органов называются гипербиотическими. К ним относятся: 1) гипертрофия и гиперплазия клеток, органов и тканей; 2) возрождение клеток, органов, тканей, или регенерация; 3) опухоли.
Наконец, возможны особые формы патологического роста тканей, при которых имеют место сочетания гипо- и гипербиотических процессов. Они возникают при пересадках органов и тканей.
13.2.1. Гипобиотические процессы
Атрофия - процесс уменьшения объема органа или ткани вследствие их недостаточного питания или нарушения обмена веществ. По механизму развития различают несколько видов атрофии.
Атрофия от бездействия. Например, если перерезать сухожилие скелетной мышцы и лишить ее одной из точек прикрепления, произойдет уменьшение объема мышцы вследствие невозможности ее полноценных сокращений. Показана возможность развития атрофии скелетной мускулатуры у животных от неподвижности (гипокинезий) при их искусственной иммобилизации.
Атрофия от денервации органа. Известно, что нервы оказывают на органы и ткани троякое влияние: а) регулируют кровоснабжение органов через вазомоторные нервы; б) оказывают трофическое влияние на ткани, активируют обмен веществ и в) вызывают возбуждение деятельности (сокращение, секреция и др.). Перерезка нерва лишает ткань нормального кровоснабжения и трофического влияния нервной системы. Вследствие этого в денервированном органе или ткани угнетается обмен веществ, уменьшается объем органа.
Атрофия вследствие длительного сдавления органа или ткани, которое нарушает их нормальное питание и обмен веществ (рис. 13-5).
Например, опухоль, оказывая давление на кость, может вызвать ее истончение и последующее разрушение. При закупорке мочеточника моча скапливается в нем и в почечной лоханке, вызывает атрофию ткани почки от давления на нее со стороны лоханки (гидронефроз).
Дистрофия клеток. Разнообразные патологические процессы сопровождаются существенными нарушениями обмена веществ в
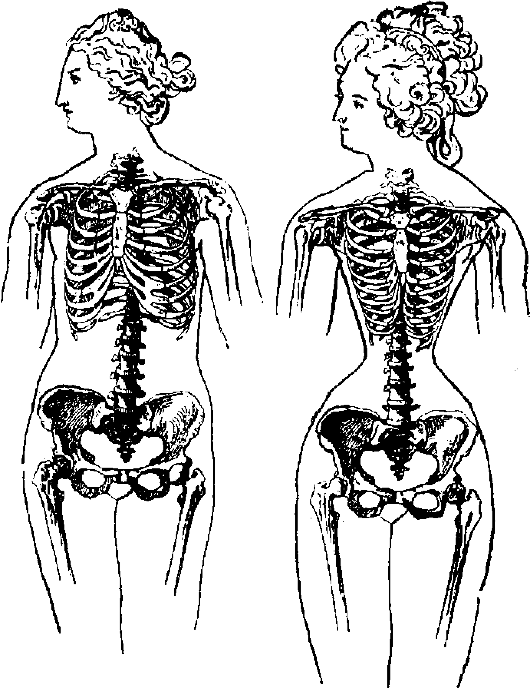 Рис.
13-5. Атрофия вследствие воздействия длительного сдавливания. Женщина,
имеющая нормальный остов груди (слева), и со скелетом, изуродованным от
ношения корсета (справа) (по Г. Плоссу, 1902)
Рис.
13-5. Атрофия вследствие воздействия длительного сдавливания. Женщина,
имеющая нормальный остов груди (слева), и со скелетом, изуродованным от
ношения корсета (справа) (по Г. Плоссу, 1902)
клетках, которые называются дистрофией (дегенерацией, перерождением). В зависимости от характера изменения обмена веществ в клетках различают белковые, жиролипоидные и углеводные дистрофии.
13.2.2. Гипербиотические процессы
Гипертрофия
Различают несколько видов гипертрофии.
Рабочая гипертрофия - к ней относятся гипертрофия скелетных мышц и сердца у спортсменов, гипертрофия молочных желез во время лактации, гипертрофия гладких мышц матки во время беременности. Рабочая гипертрофия часто сочетается с гиперплазией клеток - усилением их размножения (например, в матке при беременности).
Заместительная (компенсаторная), или викарная, гипертрофия увеличение объема оставшегося органа после удаления одного из парных органов (почки, легкие, надпочечники и др.). Процесс гипертрофии сопровождается также усиленным размножением клеток поврежденного органа (гиперплазией).
Регенерационная гипертрофия - увеличение оставшейся части органа после удаления некоторой его части (например, печени, поджелудочной железы, селезенки).
Корреляционная гипертрофия - увеличение органа после удаления одного из функционально связанных между собой органов (например, увеличение гипофиза после удаления щитовидной железы).
Нарушения функции органов при гипертрофии. Удаление парного органа вызывает характерные изменения функции в оставшемся органе при компенсаторной гипертрофии. Вначале (1-я фаза) наблюдается недостаточность функции по сравнению с функцией обоих парных органов. В дальнейшем (2-я фаза) функция гипертрофированного органа постепенно повышается, однако объем ее никогда не достигает объема деятельности двух парных органов. Обычно деятельность гипертрофированного органа составляет 60-70% объема работы двух парных органов до операции. Масса гипертрофированного органа также колеблется в пределах 60-80% массы обоих органов здорового организма.
Компенсаторная гипертрофия почки, надпочечника, легкого и других органов сопровождается увеличением скорости размножения и числа клеток в этих органах (гиперплазия). Процесс перехода гипертрофии клеток в гиперплазию выражает общебиологический закон, согласно которому делению каждой клетки предшествует увеличение ее в объеме. Активацию процесса размножения клеток можно наблюдать, считая число митозов в клетках гипертрофированного органа. Так, при компенсаторной гипертрофии почки у крыс уже через 2 суток после удаления другой почки число митозов в канальцах возрастает в 3 раза. После удаления одного легкого у крысы через 7 дней число митозов в оставшемся легком возрастает также в 3 раза. Срок достижения максимальной гипертрофии парного органа после удаления другого, как показано в эксперименте, колеблется от 20 до 180 дней в зависимости от вида органа и вида животного. Однако при компенсаторной гипертрофии парного органа полной компенсации не происходит, и организм животного или человека продолжает существовать в условиях большей или меньшей недостаточности функции оставшегося органа.
Процесс компенсаторной гипертрофии в легком после удаления другого легкого начинается с явления растяжения альвеол, напоминающего эмфизему, к которому вскоре присоединяются гипертрофия альвеол, утолщение межальвеолярных перегородок,
эластического каркаса и развитие капиллярной сети. Отмечается также размножение структурных компонентов межальвеолярных перегородок. Жизненная емкость и остаточный воздух в оставшемся легком после удаления другого оказываются несколько большими, чем в одном легком до операции, но значительно меньшими, чем в обоих легких.
На развитие процесса гипертрофии существенное влияние оказывают характер питания животного и деятельность регулирующих систем. Установлено, что увеличение в пище белка вызывает значительное усиление процесса компенсаторной гипертрофии почек.
Гипертрофия почки может возникнуть и без удаления парного органа. Так, повреждение одной из почек (пиелонефрит, гидронефроз) сопровождается компенсаторной гипертрофией здоровой почки. Вероятным механизмом этого процесса являются нервногормональные влияния. Недостаток соматотропного гормона передней доли гипофиза после гипофизэктомии сопровождается задержкой компенсаторной гипертрофии почки. К аналогичному эффекту приводит и тиреоидэктомия. Установлено, что гормоны надпочечных желез (кортизол и кортикостерон) в какой-то степени подавляют гипертрофию, но полностью не предотвращают ее развитие.
Регенерация
Регенерация (возрождение) - процесс восстановления разрушенных или утраченных тканей, органов и отдельных частей живых существ. Регенерация широко распространена в природе, бывает как у растений, так и у животных. Она имеет большое значение и у здоровых, и больных людей.
Различают физиологическую и патологическую регенерации. Физиологической регенерацией называется процесс постоянного восстановления клеток многоклеточного организма. Особенно интенсивно эти процессы протекают для клеток крови и эпидермальных структур (эпидермис, волосы, ногти). Патологической регенерацией называются процессы возрождения органов и тканей после их повреждения. Регенерировать могут клетки всех 4 видов тканей.
Регенерация соединительной ткани. Особенно сильно выражена способность регенерации у рыхлой соединительной ткани. Вы-
раженной регенераторной способностью обладает также костная ткань. Регенераторные процессы протекают в периосте, эндосте и костном мозгу. Размножающиеся малодифференцированные камбиальные клетки костной ткани - остеобласты - являются основными элементами, восстанавливающими поврежденную костную ткань. Этот процесс сопровождается резорбцией поврежденной костной ткани и рассасыванием избыточно образованной новой ткани остеокластами. Процесс регенерации костной ткани имеет большое значение при заживлении переломов костей. Хорошо регенерируют сухожилия, фасции, значительно слабее выражены регенераторные процессы в хрящевой ткани. Источником регенерации являются не сами хрящевые клетки, а перихондрии, содержащие малодифференцированные элементы - хондробласты. Жировая ткань обладает весьма слабой регенераторной способностью.
Регенерация эпителиальной ткани. Эпителиальные ткани (многослойный плоский эпителий кожи, роговая оболочка глаза) характеризуются весьма выраженной регенераторной способностью. Регенерация эпидермиса имеет очень большое значение в процессах заживления ран. Эпителий слизистых оболочек также обладает значительной генераторной способностью. Хорошо известно быстрое заживление ран в полости рта, губ, полости носа и др. Многослойный эпителий эпидермиса кожи возрождается из глубокого зародышевого слоя, однослойный цилиндрический эпителий - из элементов крипт. В случае наличия раздражающих факторов, препятствующих регенерации эпителия, слизистой оболочки (например, в желудке, мочевом пузыре), регенерация становится резко патологической, возникают атипичные разрастания эпителия, способные к злокачественному перерождению. Железистый эпителий регенерирует по-разному. Хорошо регенерирует печеночная ткань. В.В. Подвысоцкий удалял у собак 3/4 печени, и оставшаяся ткань восстанавливала целостность органа до первоначального объема. При этом имела место не столько гиперплазия - размножение клеток, сколько гипертрофия - увеличение их объема. Регенераторные процессы возможны также в эпителиальных тканях почки, слюнных желез, поджелудочной железы.
Регенерация мышечной ткани. Мышечная ткань регенерирует значительно слабее соединительной ткани и эпителия. Регенерация мышечных волокон скелетной мускулатуры совершается путем амитотического деления клеток, граничащих с поврежденным участком. На концах поврежденной мышцы при этом возникают
особые колбовидные выпячивания, называемые мышечными почками. Появляясь с двух концов поврежденной мышцы, эти почки сливаются, а в поврежденных мышечных волокнах восстанавливается поперечная исчерченность. Регенерация гладкой мускулатуры выражена относительно слабо, она может происходить за счет митотического деления гладкомышечных клеток.
Регенерация нервной ткани. Нервные клетки (периферической и вегетативной нервной системы, моторные и чувствительные нейроны спинного мозга, симпатических узлов и др.) регенерируют весьма слабо, хотя возможность их регенерации в настоящее время не отрицается. Аксоны нервных клеток обладают сильной регенераторной способностью. Регенерация аксонов нервных клеток головного мозга (кора, подкорковые узлы) происходит весьма слабо или отсутствует. Если перерезать периферический нерв, возникают дегенерация аксона к периферии от места перерезки и регенерация его конца, связанного с клеткой перерезанного нерва.
После перерезки мякотного нерва аксоны и мембраны в периферическом отрезке подвергаются аутолизу, и продукты их резорбируются. Остаются клетки Шванна, образующие как бы трубочки, в которые и врастают регенерирующие волокна центрального конца перерезанного нерва. На концах растущих аксонов формируются колбочки и разветвления. Регенерирующие аксоны перерезанного нерва «ползут» по шванновским трубочкам периферического конца этого нерва со скоростью 1-3 мм в сутки. Таким образом, возможна регенерация аксонов до 1 м и более. Роль клеток Шванна, по-видимому, очень существенна, так как в мозгу, где их опорная и трофическая функции заменены клетками глии, регенерация нервных волокон не происходит.
Если центральные и периферические концы перерезанного нерва отодвинуты далеко друг от друга, регенерирующие концы аксонов не достигают шванновских клеток периферического конца перерезанного нерва, и полная регенерация не наступает. Одним из важных процессов при регенерации аксонов нервных клеток в этом случае является образование на их концах колбовидных утолщений, пуговок. Если количество этих утолщений велико (после травмы толстого смешанного нерва), то на конце перерезанного нерва образуется опухолевидное разрастание - неврома. Окружающие ткани раздражают эти необычные окончания чувствительных нервов и вызывают резкие болевые ощущения, называемые каузалгиями.
В эксперименте предпринимались многочисленные попытки сшивать центральные концы двигательных нервов с периферическими концами чувствительных нервов, а также различные чувствительные нервы друг с другом. Эти опыты вызывали образование различных необычных рефлексов или неврогенных «химер». Если двигательный нерв, например подъязычный, сшить с периферическим концом чувствительного нерва, например язычного, то двигательные аксоны не образуют в языке чувствительных окончаний. Под эпителием возникают лишь сплетения, лишенные функционального значения. Если сшить чувствительную ветвь блуждающего нерва, например центральный конец возвратного нерва, с периферическим концом чувствительного кожного нерва, то блуждающий нерв регенерирует и образует чувствительные окончания в коже. Раздражение кожи в этих случаях может вызвать кашель наподобие того, который возникает при раздражении слизистой оболочки гортани - нормальной рефлексогенной зоны возвратного нерва.
Обмен веществ регенерирующей ткани. Установлено, что уже через 2 ч после повреждения в гистиоцитах рыхлой соединительной ткани, а затем в лейкоцитах и фибробластах активируются окислительно-восстановительные ферменты (сукцинатдегидрогеназа, глутатион) и гидролазы (фосфатаза, пептидаза, липаза и др.). В дальнейшем отмечается активация 5-нуклеотидазы, АТФазы и других ферментов. Активация этих ферментов вызывает увеличение процесса расщепления белка, освобождает липиды (лецитин, жирные кислоты), которые понижают поверхностное натяжение в регенерирующих клетках. Регенерирующая ткань характеризуется активацией анаэробного гликолиза. Распад лейкоцитов и освобождение из них стимулирующих рост продуктов (нуклеопротеиды и др.) вызывают усиленное митотическое деление регенерирующих клеток. Усиление гликолиза в растущих регенерирующих клетках сопровождается накоплением молочной и пировиноградной кислот и приводит к тканевому ацидозу. Активация протеолитических ферментов приводит также к освобождению из поврежденных регенерирующих клеток гистамина. Гистамин вызывает расширение сосудов, окружающих регенерирующую ткань или врастающих в нее. Расширение сосудов улучшает поступление новых количеств лейкоцитов, доставляющих новые порции стимуляторов роста в регенерирующую ткань. В клетках этой ткани увеличиваются осмотическое давление и гидратация (содержание воды) (рис. 13-6).
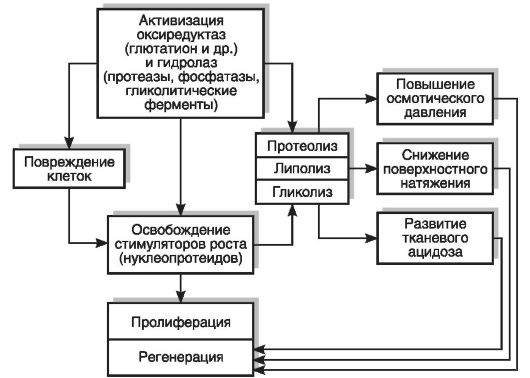 Рис. 13-6. Обмен веществ в регенерирующей ткани
Рис. 13-6. Обмен веществ в регенерирующей ткани
Механизмы регенерации. Регенерировать могут как взрослые дифференцированные клетки, так и менее дифференцированные (камбиальные) клетки различных тканей (например, герминативный слой эпителиальных клеток кожи, гистиоциты рыхлой соединительной ткани), возможны превращения клеток в менее дифференцированные формы (метаплазия, анаплазия).
Метаплазия у млекопитающих, однако, наблюдается в пределах только одного вида тканей, например из рыхлой соединительной ткани может образоваться хрящевая и костная ткани, из эпителия выводных протоков печени или слюнных желез - соответствующие секреторные клетки и т.д.
Процесс регенерации обусловливается рядом факторов:
1. Первым и важнейшим стимулом для регенерации является повреждение. Именно продукты поврежденной ткани (протеазы, полипептиды и низкомолекулярные белки) выполняют роль стимуляторов размножения клеток. Ранее они назывались «раневые гормоны».
2. Важным фактором заживления и регенерации являются лейкоциты и продукты их распада. Эти продукты имеют собирательное название - «трефоны» (от греч. trephos - питаю).
3. На основании опытов с тканевыми культурами было установлено стимулирующее влияние одной растущей клетки данной ткани на другую. Предполагали, что это влияние определяется особыми веществами - «десмонами» (от греч. desmos - ткань). Десмоны могут выделяться в рингеровский раствор при промывании им кусочка регенерирующей ткани. Десмоны специфичны и не влияют на рост тканей другого вида (например, десмоны соединительной ткани не влияют на мышечную).
4. Большое влияние на регенерацию оказывает состояние питания организма и его регулирующих систем. При голодании регенерация хотя и происходит, но значительно слабее. Хорошо известно, что заживление ран у лиц с алиментарной дистрофией резко замедлено. Особое значение имеют полноценное белковое питание и витамины, в частности витамины С и А. У больных цингой заживление ран и переломов резко задерживается. Это показано и в эксперименте над животными с авитаминозом С. Резко стимулирующее влияние на регенерацию оказывает витамин А как при внутреннем, так и при местном (на рану) применении, например в виде рыбьего жира.
5. С увеличением возраста регенерирующая способность всех тканей понижается. При этом особое значение имеет состояние реактивности целого организма. Например, пересадка относительно «старой» по возрасту конечности молодому головастику вызывает ее хорошее приживление и регенерацию. Пересадка «молодой» конечности более старшему по возрасту головастику вызывает менее выраженную регенерацию, что говорит о влиянии целого организма на регенераторный процесс.
6. Большое значение в регуляции регенерации имеют железы внутренней секреции. Так, тиреоидэктомия снижает регенерирующую способность тканей, а введение гормонов щитовидной железы стимулирует заживление ран. Удаление поджелудочной железы приводит к замедлению заживления ран, а кастрация затрудняет заживление переломов. Гипофизэктомия вызывает значительное замедление регенерации конечностей у аксолотля. Минералокортикоиды (альдостерон) стимулируют, а глюкокортикоиды (кортизол) угнетают регенерацию. Роль зобной железы в процессах регенерации пока выяснена недостаточно.
7. Большое значение в качестве стимулятора регенерации имеет нервная система. В личиночных стадиях амфибий перерезка спинного мозга или периферических нервов не оказывает существенного влияния на регенерацию хвоста и конечностей. Однако у выс-
ших млекопитающих и человека показано существенное влияние различных отделов нервной системы на регенерацию. Экспериментальные повреждения коры головного мозга у собак, кроликов и крыс задерживали процессы заживления ран.
Особенно сильное влияние на регенерацию и репаративные процессы оказывают повреждения вентромедиальных ядер гипоталамуса. Разрушение этих ядер вызывает угнетение процессов заживления ран и приживления трансплантатов. Экспериментальная перерезка или травмы (военные, бытовые) смешанных периферических нервов вызывают резкие нервно-дистрофические явления. Одним из ярких выражений этого влияния является образование незаживающих трофических язв. Они возникают часто на месте случайной царапины, а иногда и без видимого повреждения. Нарушение обмена веществ в тканях, в частности в коже, приводит к ослаблению процессов регенерации эпидермиса. На поверхности кожи образуется дефект - язва, она обычно окружена вялыми грануляциями, заживает очень долго, иногда несколько лет. После временного заживления она легко возобновляется. Замедление процессов регенерации в данном случае вызывается нарушением трофического влияния нервной системы и сосудодвигательными расстройствами в денервированной ткани.
Заживление ран
Заживление ран является типичным примером патологической регенерации тканей, наступающей после их повреждения. Заживление повреждений внутренних органов происходит за счет размножения элементов соединительной ткани с последующим превращением ее в рубец. Заживление кожи осуществляется также за счет соединительной ткани и сопровождается регенерацией эпителия. Легкие повреждения эпидермиса кожи восстанавливаются полностью за счет регенерации эпидермиса. Различают заживления первичным и вторичным натяжением.
Заживление первичным натяжением - края раны склеиваются фибрином, вышедшим в рану с кровью и лимфой. Начинается процесс свертывания крови в ране и выпадение фибрина. В случае больших количеств выпавшего фибрина последний образует корку - струп, под которым совершается заживление. После заживления струп отпадает. Особенностью химического состава струпа является большое (13-14%) содержание в нем гидроксипролина.
Сущность начала заживления как первичным, так и вторичным натяжением заключается в том, что под краями раны скапливаются лейкоциты, которые выделяют вещества, стимулирующие размножение прежде всего соединительнотканных клеток - гистиоцитов. Последние превращаются в фибробласты, образующие коллагеновые и эластические волокна. Постепенно дефект в ткани заполняется этими клетками. Одновременно к пленке фибрина начинают двигаться размножающиеся клетки эпидермиса. Стимулом для размножения этих клеток является факт соприкосновения их с необычной средой - выпавшим в рану фибрином. Размножаясь, клетки эпителия заполняют и затягивают дефект, вызванный ранением. Возникает полное заживление (рис. 13-7).
Заживление вторичным натяжением происходит обычно при инфицировании раны (нагноении) или при ее относительно больших размерах, когда рана не может первично быть склеенной выпавшим фибрином. В этих случаях, кроме процессов, характерных для первичного натяжения, рана постепенно заполняется новой, молодой соединительной тканью, очень богатой кровеносными сосудами. Она приобретает ярко-красный цвет и имеет вид зернышек, связанных друг с другом, отсюда и название «грануляционная» (от лат. granulum - зернышко).
Грануляционная ткань образуется за счет размножения гистиоцитов и фибробластов, со стороны здоровой ткани в нее врастают кровеносные сосуды. Грануляционная ткань весьма богата водой, ее коллоиды находятся в состоянии гидратации. Грануляционная ткань - это защитный барьер против инфекции. При попытке инфицирования кролика палочкой сибирской язвы через грануляционную ткань все микробы поглощались клетками соединительной ткани, и заражение не наступало. При заражении той же дозой палочки сибирской язвы под кожу здоровый кролик погибал через несколько часов.
После заполнения грануляционной тканью раны в ней начинают происходить изменения. Кровеносные сосуды затягиваются, клетки постепенно разрушаются и рассасываются. Остаются только волокна субстанции соединительной ткани, образующие рубец. Эпителизация раны после заживления вторичным натяжением не происходит, и рубец (например, на коже) остается видимым многие годы.
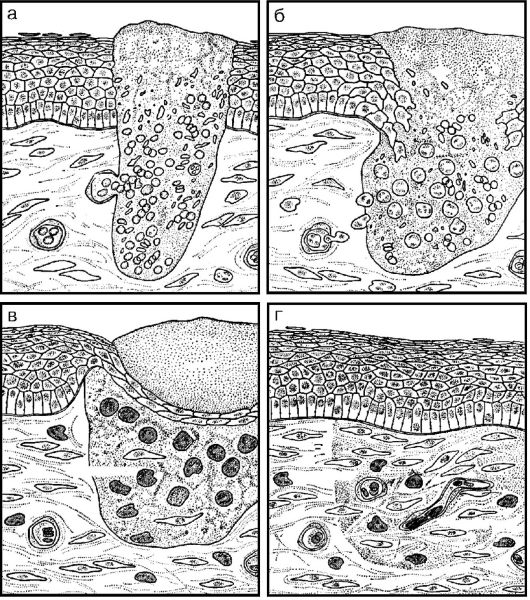 Рис. 13-7. Различные
стадии процесса заживления раны: а - в момент нанесения раны (она
заполняется кровью, выпавшие нити фибрина соединяют края раны); б -
через день (в рану поступают нейтрофилы, начинается фагоцитоз); в -
через 2 дня (края эпидермиса смыкаются, в рану проникают моноциты,
фибробласты); г - через 7 дней (струп отторгается, в ране остается
немного моноцитов, нейтрофилов, образуется грануляционная ткань) (по
Россу)
Рис. 13-7. Различные
стадии процесса заживления раны: а - в момент нанесения раны (она
заполняется кровью, выпавшие нити фибрина соединяют края раны); б -
через день (в рану поступают нейтрофилы, начинается фагоцитоз); в -
через 2 дня (края эпидермиса смыкаются, в рану проникают моноциты,
фибробласты); г - через 7 дней (струп отторгается, в ране остается
немного моноцитов, нейтрофилов, образуется грануляционная ткань) (по
Россу)
13.3. ОПУХОЛЕВЫЙ РОСТ
Опухоль - типовой патологический процесс, в основе которого лежит неограниченный, неконтролируемый рост клеток с преобладанием процессов пролиферации над явлениями нормальной клеточной дифференцировки. Опухолевый процесс возникает под влиянием многообразных экзогенных и эндогенных онкогенных (бластомогенных) факторов, которые реализуют свое действие через генетический аппарат клетки. В опухолетрансформированных клетках появляются стереотипические нарушения обмена, структуры и функции - атипизм (от греч. аtypos [typos - образец, форма] - необычность, ненормальность), приводящие в конечном итоге к изменениям в жизнедеятельности всего организма.
При размножении клеток риск развития соматических мутаций и появления опухолевых клеток резко повышается, поэтому опухолевый рост, вероятно, является своего рода «платой за многоклеточность». Опухолевый процесс широко распространен в различных органах и тканях у живых существ на всех уровнях эволюции, независимо от возраста, пола, конституции. Если опухоли (реактивные разрастания тканевых элементов), встречающиеся у растений, и не являются истинными, а существование опухолей у моллюсков и насекомых многими оспаривается, то наличие опухолевого процесса у всех других живых существ, начиная с рыб, общепризнано. Признаки опухоли (остеосаркомы) обнаружены у динозавров (50 млн лет назад) и у ископаемых предков человека (1 млн лет назад).
В отечественной литературе широко используют понятия русского, греческого и латинского происхождения: «опухоль», «новообразование», «tumor», «blastoma», «neoplasma», и производные от них: «опухолевый рост», «опухолевый процесс», «опухолевая болезнь», «бластомогенные факторы», «онкология», «онкогенные воздействия». Для обозначения злокачественных новообразований из эпителиальной ткани используют понятия: «рак», «cancer», «carcinoma», а из соединительной и других мезенхимальных тканей - «саркома». Для обозначения доброкачественных новообразований любой ткани к корню латинского названия прибавляют окончание «ома» - аденома, миома, остеома. Для обозначения злокачественных новообразований из эпителиальной ткани к ее названию прибавляют слово «карцинома» - аденокарцинома (толстой кишки, желудка, матки), а из мезенхимальных тканей - «саркома» (хондросаркома,
липосаркома, миосаркома). Термин «гемобластозы» объединяет опухоли кроветворной и лимфоидной ткани.
13.3.1. Эпидемиология опухолевых заболеваний у человека
Рак приобретает все более значимую роль в структуре болезней. Среди причин смерти человека злокачественные опухоли занимают второе место после сердечно-сосудистых заболеваний. Согласно данным Американского общества рака и Международного агентства по изучению рака (МАИР), на сегодняшний день в мире живет 24,6 млн человек, больных раком. При этом ежегодно диагностируется более 12 млн новых случаев рака и около 7 млн человек умирают от опухолевых образований, что составляет приблизительно 20 тыс. смертельных исходов ежедневно. По прогнозу ВОЗ, к 2020 г. число болеющих раком может возрасти на 50% (на 15 млн человек). Подсчитано, что в 2015 г. от рака умрет 9 млн человек, а в 2030 г. - 11,4 млн.
Актуальность опухолевых заболеваний определяется еще и тем, что они обнаруживаются во всех возрастных группах, как у мужчин, так и у женщин, и выявляются практически во всех тканях и органах человека. Исследователи отметили, что в экономически развитых странах три самые распространенные формы рака среди мужчин - это опухоль легкого, простаты и желудка, а среди женщин - рак груди, пищевода и легких. В развивающихся странах мужчины чаще всего болеют раком легкого, желудка и печени, а женщины - раком груди, шейки матки и желудка. Часто опухоли возникают у людей зрелого возраста на высоте их социальной и профессиональной активности. Опухолевая болезнь нередко завершается летальным исходом, иногда в относительно короткие сроки, и это формирует у пациентов сознание обреченности, во многом трансформирует свойства личности. Все это усугубляется физическими страданиями, связанными с болевым синдромом, кахексией, нарушением функции ряда органов, особенно при метастазировании опухолей.
13.3.2. Опухоли доброкачественные и злокачественные
Доброкачественная опухоль, как правило, не покидает пределы ткани того органа, в котором она развилась, и не внедряется в соседние органы. Главный признак злокачественной опухоли - это ин-
фильтрирующий рост, инвазия (выход за пределы исходной ткани, прорастание в окружающие ткани, разрушение их протеазами).
В период бурного роста злокачественной опухоли появляются незрелые клетки, характеризующиеся тканевым и клеточным атипизмом. Клетки злокачественной опухоли могут отрываться от основного очага и распространяться по организму лимфо- и гематогенным путем, оседая в отдаленных органах и образуя там вторичные очаги опухолевого роста (метастазы).
Одними из важнейших свойств злокачественных опухолей являются автономность в неограниченном их росте и опухолевая прогрессия - непрерывная эволюция опухоли в сторону все более агрессивной и неконтролируемой ткани. Злокачественные опухоли в запущенных стадиях опухолевого процесса имеют неблагоприятный прогноз. Рост злокачественной опухоли и ее метастазов вызывает деструктивные повреждения окружающих тканей, эрозивные кровотечения, воспаление, переломы костей, функциональную недостаточность пораженного органа (множественные метастазы в легкие, печень), кахексию, паранеопластические синдромы, иногда угрожающие жизни. Доброкачественные же опухоли протекают благоприятно, а их осложнения всегда связаны с локализацией. Так, доброкачественные опухоли мозга могут привести к нарушению оттока цереброспинальной жидкости и гидроцефалии, пищевода - к его непроходимости и как следствие к голоданию и кахексии. Доброкачественные опухоли могут осложниться кровотечением; такие доброкачественные новообразования, как полипы желудка, множественный полипоз толстой кишки, могут малигнизироваться. После хирургического удаления доброкачественной опухоли она прекращает свое существование. Для злокачественных опухолей часто характерно рецидивирование опухолевого процесса: 1) в виде локального появления опухоли (на месте оставшихся невидимых глазом хирурга микрометастазов) после хирургического ее удаления в различные сроки после операции; 2) в виде отдаленных метастазов (в легкие, головной мозг, печень, кости).
13.3.3. Этиология опухолей
Установлено, что причиной опухоли могут быть разнообразные этиологические факторы - главные, предрасполагающие и способствующие. Главные этиологические факторы - канцерогены - вызывают изменения генетического аппарата клетки (обладают
мутагенной активностью), способствуют ее опухолевой трансформации. Комитет экспертов ВОЗ еще в 1979 г. дал четкое определение понятия «канцероген»: «Канцероген - это агент, который в силу своих физических или химических свойств может вызвать необратимое изменение или повреждение в тех частях генетического аппарата, которые осуществляют гомеостатический контроль над соматическими клетками».
Канцерогенные факторы подразделяют на экзогенные и эндогенные. Среди экзогенных выделяют физические, биологические и химические канцерогены.
Физические канцерогенные факторы
Среди них наибольшее значение имеют различные виды ионизирующей радиации (рентгеновские, γ-лучи, элементарные частицы атома - протоны, нейтроны, α-, β-частицы и др.), ультрафиолетовое излучение, а также длительное термическое воздействие и механические травмы тканей.
1. Ионизирующее излучение. Еще в средние века среди рудокопов Саксонии и Чехии отмечались случаи загадочной болезни типа «горной чахотки», и только в 1897 г. было установлено, что у шахтеров развивался рак легких. Как выяснилось позднее, руда на этих шахтах была богата радиоактивными веществами, и именно в ней Мария и Пьер Кюри обнаружили радий и полоний. В настоящее время считают, что развитие опухолей легких у шахтеров было связано с действием радия и радона. Известны случаи развития опухолей легких у работников радиевых лабораторий.
Канцерогенный эффект ионизирующей радиации стал известен уже спустя 7 лет после открытия рентгеновских лучей. В 1902 г. был описан первый случай кожного «рентгеновского» рака у человека, а в 1911 г. появилось первое сообщение о лейкозах у рентгенологов. В 1922 г. опубликованы данные о возникновении остеосарком после рентгенотерапии больных туберкулезом костей. Трагедией обернулось широкое использование в 1930-1940-х гг. в качестве контрастирующего средства для рентгенодиагностики торотраста (диоксида тория), являющегося источником α-, β- и γ-излучения. Препарат вводили 50 000 пациентов, и у большинства из них впоследствии развились карциномы печени, почек, легких, саркомы верхнечелюстной полости. Не менее трагические отдаленные последствия действия ионизирующей радиации на-
блюдали после взрывов атомных бомб в Хиросиме и Нагасаки: среди облученного населения уже спустя 5-7 лет участились случаи заболевания лейкозом, раком легких, щитовидной и молочной желез. Этиологическая роль радиации подтверждается зависимостью частоты заболеваемости от дозы, которая изменялась по мере удаления от эпицентра поражения.
Повышенной чувствительностью к действию ионизирующей радиации обладает организм плода и ребенка в первые месяцы постнатального развития. В 1950 г. появились первые сообщения о развитии опухолей щитовидной железы и лейкозов у детей, подвергавшихся в раннем детском возрасте облучению органов шеи. Вместе с тем, несмотря на абсолютную доказанность бластомогенного действия ионизирующей радиации и применяемые меры защиты, опасность воздействия на человека этого вида энергии в настоящее время не только не уменьшается, но, напротив, возрастает - увеличивается доля населения, занятого в атомной индустрии, все больше людей подвергаются воздействию ионизирующего излучения с диагностическими и лечебными целями.
Канцерогенный эффект ионизирующей радиации доказан многими экспериментами на животных. Впервые группой русских исследователей во главе с Н.Н. Петровым удалось индуцировать радием опухоли костей у приматов и тем самым доказать онкогенную опасность этого радионуклида при действии его в высоких дозах.
Ионизирующие агенты, как и химические канцерогены, обладают исключительной политропностью действия. Они вызывают опухоли практически во всех органах и тканях, поглотивших достаточно высокую энергию облучения. При внешнем облучении опухоли возникают, как правило, в пределах облученных тканей (в этом случае чаще развиваются опухоли кожи, костей, легких, щитовидной и молочной желез). При действии радионуклидов опухоли развиваются в очагах депонирования, и их локализация зависит от тропности препарата: 90Sr, 89Sr, 140Ba, 45Ca вызывают опухоли костей; 144Ce, 140La, 147Pm, 232Th, 198Au - опухоли печени, костей, кроветворной ткани, желудка, толстой кишки. Кроме ионизирующего фактора, в генезе некоторых гормонзависимых опухолей (например, рак молочной железы) могут иметь значение эндокринные дисфункциональные нарушения. Действие некоторых радионуклидов может быть связано с местом их приложения. Так, 144Ce при пероральном введении вызывает опухоли желудочно-кишечного
тракта, при подкожном - саркомы и рак кожи, при введении в трахею - опухоли легких.
Механизм действия ионизирующей радиации до конца не изучен, однако, по мнению большинства исследователей, в основе возникновения опухолей лежат повреждение ДНК свободными радикалами и нарушения ее репарации. Полагают также, что свободные радикалы вызывают активацию вирусов на фоне развивающейся при облучении иммунодепрессии.
2. Ультрафиолетовое излучение. Максимальным биологическим эффектом обладают ультрафиолетовые лучи (УФЛ) с длиной волны 280-320 нм. Составляя значительную часть солнечной радиации, УФЛ при длительном интенсивном действии на кожу могут быть причиной развития ее опухолей. Впервые опухоли кожи были индуцированы в эксперименте облучением прямым солнечным светом в 1928 г. У лиц, подвергающихся длительной и интенсивной инсоляции (крестьян, моряков, рыбаков) или проживающих в южных странах, частота опухолей кожи значительно выше. Кожа, содержащая большое количество пигмента, более устойчива к онкогенному действию УФЛ.
3. Термическое воздействие и механические травмы органов и тканей. Типичным примером является бытовой рак кожи, связанный с постоянным термическим повреждением тканей. Возникновение опухолей нередко ассоциируется с предшествующими переломами, огнестрельными ранениями, ожогами, длительным нахождением конкрементов в полых органах (желчном пузыре, мочевом пузыре, лоханке почки). Подобные наблюдения легли в основу гипотезы Р. Вирхова о роли хронического раздражения в генезе опухолей. Противники этой концепции обычно ссылаются на то, что массовые травмы во время мировых войн не сопровождались последующими «эпидемиями» опухолевых заболеваний, а частота возникновения опухолей на месте повреждений невысока и может быть объяснена случайным совпадением. Однако истинную частоту возникновения «посттравматических» опухолей оценить трудно, поскольку злокачественная опухоль может возникнуть через десятки лет после повреждения. Ряд исследователей полагают, что само повреждение ткани и вызываемое им воспаление не являются обязательным звеном в цепи событий, ведущих к развитию рака. Роль травмы в большей степени сводится к ее воздействию на канцерогенез, вызываемый эндогенными и экзогенными бластомогенными веществами, причем это воздействие может быть и стимулирующим, и тормозящим.
Наиболее опасны вызванные повреждением хронические воспалительные процессы, при которых сочетаются факторы, стимулирующие канцерогенез: депонирование канцерогенных веществ; длительная пролиферация клеток с нарушением их дифференцировки; изменение взаимоотношений между эпителием и стромой.
Взаимосвязь травмы и канцерогенеза остается сложной и неоднозначной. Однако, несмотря на это, повреждение тканей в генезе рака следует учитывать при формировании групп риска среди лиц с различными бытовыми и промышленными повреждениями.
Биологические канцерогенные факторы
Наиболее изученными среди биологических канцерогенов являются вирусы. В 1910 г. молодому Пейтону Раусу первому удалось привить спонтанную саркому кур с помощью бесклеточного экстракта. Это положило начало изучению так называемых вирусных опухолей и опухолеродных вирусов. В 30-х гг. ХХ в. Р.Е. Шоуп описал вирусную папиллому у диких кроликов. Бесклеточный фильтрат этих папиллом, нанесенный на предварительно поврежденную кожу лабораторных кроликов, вызывал у них образование таких же папиллом. К началу 60-х гг. ХХ в. Л.А. Зильбер окончательно сформулировал вирусогенетическую концепцию развития опухолевого процесса, согласно которой онкогенный вирус, попадая в клетку, внедряет свой генетический материал в состав хромосомы клетки-хозяина, становясь ее интегральной частью («геном» или «батареей генов») и тем самым индуцируя трансформацию нормальной клетки в опухолевую. В зависимости от химической природы генетического материала онкогенные вирусы подразделяются на ДНК- и РНК-содержащие.
Среди ДНК-содержащих онкогенных вирусов выделяют следующие группы.
Паповавирусы. К ним относятся папилломатозные вирусы, которые вызывают доброкачественные новообразования (папилломы) кожи и слизистой оболочки у различных видов животных (мыши, кролики, свиньи, кошки, собаки) и человека.
Аденовирусы.
Герпес-вирусы вызывают злокачественные опухоли у животных и человека: вирус Эпштейна-Барр определяет возникновение лимфомы Беркитта (рис. 13-8) и рака носоглотки; вирус гепатита С вызывает рак печени.
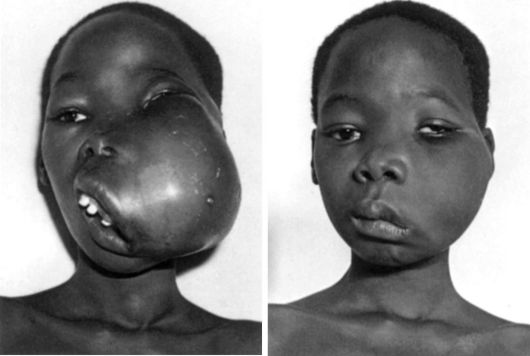 Рис. 13-8. Лимфома Беркитта до и после лечения циклофосфаном (по D. Burkitt, 1970)
Рис. 13-8. Лимфома Беркитта до и после лечения циклофосфаном (по D. Burkitt, 1970)
Вирусы группы оспы. Воздействие ДНК-содержащих опухолеродных вирусов на клетки естественных природных хозяев не приводит к возникновению злокачественных опухолей, их действие ограничено либо доброкачественными новообразованиями (паповавирусы, вирусы группы оспы), либо продуктивной инфекцией (с цитопатогенным эффектом) в виде тех или иных инфекционных заболеваний (аденовирусы, вирусы герпеса). Взаимодействие клеток неприродных хозяев с ДНК-содержащими вирусами иногда приводит к злокачественной трансформации клетокмишеней.
РНК-содержащие онкогенные вирусы (ретровирусы, онкорнавирусы). В отличие от ДНК-содержащих вирусов они являются естественными возбудителями большинства злокачественных опухолей у животных. Изучение этих опухолей позволило получить современные представления о молекулярных механизмах клеточной трансформации. В настоящее время из опухолей различных локализаций у животных выделено более 100 видов онкорнавирусов, которые могут быть разделены на три группы: 1) вирусы, вызывающие лейкозы; 2) вирусы, вызывающие саркомы; 3) вирусы, вызывающие рак молочных желез.
РНК-содержащие опухолевые вирусы имеют общие свойства: а) в качестве генетического материала содержат одноцепочечную РНК; б) в составе вириона содержат комплекс ферментов обратной транскрипции (необходимых для репродукции своего генома РНК- и ДНК-зависимых ДНК-полимераз), наличие которого делает возможным переход генетического материала ретровирусов (РНК) в форму, доступную для интеграции с клеточным геномом; в) вирусные частицы созревают в непосредственной связи с мембранными компонентами клетки; г) инфекция онкорнавирусами не приводит к гибели клетки.
Канцерогенез, индуцируемый ДНК- и РНК-содержащими вирусами, включает следующие основные этапы: 1) вирус проникает в клетку и закрепляет свой генетический материал в клетке-хозяине путем физической интеграции с клеточной ДНК; 2) начинается экспрессия специфических генов (онкогенов) в составе интегрированного вирусного генома с образованием специфических матричных РНК (мРНК) и онкобелков, которые ответственны за превращение нормальной клетки в опухолевую; 3) под влиянием онкобелков клетка утрачивает чувствительность к факторам, регулирующим деление, и по своим фенотипическим признакам (морфологическим, цитогенетическим, биохимическим) становится опухолевой. Необходимым условием для индукции опухолей онкогенными вирусами, наряду с физической интеграцией вирусного и клеточного геномов, является наличие и функционирование онкогена и его белкового продукта, что имеет решающее значение для превращения нормальной клетки в опухолевую. Кроме того, вирусиндуцированная мутация может определенное время не проявляться, а активация мутантного гена может произойти под влиянием физических и химических канцерогенов, гормонов, других экзогенных ретровирусов. Следовательно, присутствие онкогена является необходимым условием для инициации опухолевой трансформации клетки онкогенными вирусами. В настоящее время обнаружены онкогены у нескольких десятков ретровирусов, и выявлены соответствующие онкобелки, которые являются фосфопротеинами и относятся к классу протеинкиназ. Признание клеточного происхождения вирусных онкогенов позволяет говорить о единстве вирусного и невирусного канцерогенеза.
По данным ВОЗ, пятая часть раковых заболеваний во всем мире возникает в результате хронических инфекций, основными возбудителями которых являются вирусы гепатита B (рак пече-
ни), вирусы папилломы человека (рак шейки матки), Helicobacter pylori (рак желудка), шистосомы (рак мочевого пузыря), печеночные двуустки (рак желчных протоков) и вирус иммунодефицита человека (ВИЧ) (саркома Капоши и лимфомы).
Химические канцерогенные факторы
В 1915 г. японские ученые Ямагива и Ишикава индуцировали небольшие опухоли, нанося каменноугольную смолу на кожу ушей кролика, впервые доказав таким образом возможность новообразования при действии химического вещества.
Наиболее распространенной классификацией химических канцерогенных веществ в настоящее время является разделение их на классы в соответствии с химическим строением: 1) полициклические ароматические углеводороды (ПАУ) и гетероциклические соединения; 2) ароматические азосоединения; 3) ароматические аминосоединения; 4) нитрозосоединения и нитрамины; 5) металлы, металлоиды и неорганические соли. Канцерогенными свойствами могут обладать и другие химические вещества.
Принято по происхождению выделять антропогенные канцерогены, появление которых в окружающей среде связано с деятельностью человека, и природные, не связанные с производственной или иной деятельностью человека.
Химические канцерогены могут быть также подразделены на три группы в зависимости от характера действия на организм:
1) вещества, вызывающие опухоли преимущественно на месте аппликации (бенз(а)пирен и другие ПАУ);
2) вещества отдаленного, преимущественно селективного действия, индуцирующие опухоли не в месте введения, а избирательно в том или ином органе (2-нафтиламин, бензидин вызывают опухоли мочевого пузыря; п-диметиламиноазобензол индуцирует опухоли печени у животных; винилхлорид вызывает развитие ангиосарком печени у человека);
3) вещества множественного действия, вызывающие опухоли различного морфологического строения в разных органах и тканях (2-ацетиламинофлуорен, 3,3-дихлорбензидин или о-толидин индуцируют опухоли молочных, сальных желез, печени и других органов у животных).
Такое разделение канцерогенных агентов условно, поскольку в зависимости от метода введения вещества в организм или вида
экспериментального животного локализация опухолей и их морфология могут меняться в зависимости от особенностей метаболизма канцерогенных веществ.
По степени канцерогенной опасности для человека бластомогенные вещества подразделяются на 4 категории:
I. Химические вещества, канцерогенность которых доказана как в опытах на животных, так и данными популяционных эпидемиологических исследований.
II. Химические вещества с доказанной сильной канцерогенностью в опытах на нескольких видах животных при различных путях введения. Несмотря на отсутствие данных о канцерогенности для человека, их следует считать потенциально опасными для него и принимать такие же строгие меры профилактики, как и в отношении соединений первой категории.
III. Химические вещества со слабой канцерогенной активностью, вызывающие опухоли у животных в 20-30% случаев в поздние сроки опыта, преимущественно к концу жизни.
IV. Химические вещества с «сомнительной» канцерогенной активностью. В эту категорию включаются химические соединения, канцерогенная активность которых не всегда четко выявляется в эксперименте.
Более конкретная классификация канцерогенных веществ, основанная на анализе эпидемиологических и экспериментальных данных 585 химических веществ, групп соединений или технологических процессов, была разработана МАИР в 1982 г. Предложенное в этой классификации подразделение всех изученных на канцерогенность соединений имеет большое практическое значение, так как позволяет оценить действительную опасность химических веществ для человека и установить приоритетность в проведении профилактических мероприятий.
Наибольшей канцерогенной активностью обладают ПАУ (7,12- диметилбенз(а)антрацен, 20-метилхолантрен, бенз(а)пирен и др.), гетероциклические соединения (9-метил-3,4-бензакридин и 4-нитро- хинолин-N-оксид). ПАУ обнаруживаются как продукты неполного сгорания в выхлопных газах автотранспорта, в дыме доменных печей, в табачном дыме, в продуктах копчения, а также в выбросах вулканов.
Ароматические азосоединения (азокрасители) используются для окраски натуральных и синтетических тканей, для цветной печати в полиграфии, в косметике (моноазобензол, N,N`-диметил-4-
аминоазобензол). Опухоли обычно возникают не на месте введения азокрасителей, а в органах, удаленных от места аппликации (печень, мочевой пузырь).
Ароматические аминосоединения (2-нафтиламин, бензидин, 4-аминодифенил) вызывают у животных опухоли различной локализации: мочевого пузыря, подкожной клетчатки, печени, молочных и сальных желез, кишечника. Ароматические аминосоединения применяются в различных отраслях промышленности (при синтезе органических красителей, лекарственных препаратов, инсектицидов и др.).
Нитрозосоединения и нитрамины (N-метилнитрозоуретан, метилнитрозомочевина) вызывают у животных опухоли, разнообразные по морфологическому строению и локализации. В настоящее время установлена возможность эндогенного синтеза некоторых нитрозосоединений из предшественников - вторичных и третичных аминов, алкил- и ариламидов и нитрозирующих агентов - нитритов, нитратов, окислов азота. Этот процесс осуществляется в желудочно-кишечном тракте человека при поступлении с пищей аминов и нитритов (нитратов). В связи с этим важной задачей является уменьшение содержания нитритов и нитратов (используемых в качестве консервантов) в пищевых продуктах.
Металлы, металлоиды, асбест. Известно, что ряд металлов (никель, хром, мышьяк, кобальт, свинец, титан, цинк, железо) обладают канцерогенной активностью и многие из них на месте введения вызывают саркомы различного гистологического строения. Асбест и его разновидности (белый асбест - хризотил, амфибол и его разновидность - голубой асбест - крокидолит) играют значительную роль в возникновении профессионального рака у человека. Установлено, что при длительном контакте у рабочих, занятых добычей и переработкой асбеста, возникают опухоли легкого, желудочно-кишечного тракта, мезотелиомы плевры и брюшины. Бластомогенная активность асбеста зависит от размеров волокон: наиболее активны волокна длиной не менее 7-10 мкм и толщиной не более 2-3 мкм.
Природные канцерогены. В настоящее время известно более 20 канцерогенов природного происхождения - продуктов жизнедеятельности растений, в том числе низших растений - плесневых грибов. Aspergillus flavus продуцирует афлатоксины В1, В2 и G1, G2; A. nodulans и A. versicolor - стеригматоцистин. Penicillium islandicum образует лютеоскирин, циклохлоротин; P. griseofulvum -
гризеофульвин; Strepromyces hepaticus - элайомицин; Fusarium sporotrichum - фузариотоксин. Канцерогеном является также сафрол, который содержится в масле (ароматической добавке, получаемой из корицы и мускатного ореха). Из высших растений также выделены канцерогены: семейство сложноцветных Senecio содержит алкалоиды, в структуре которых выявлено пирролизидиновое ядро; основным токсическим метаболитом и конечным канцерогеном является пирроловый эфир. Папоротник-орляк (Pteridium aquilinum) при употреблении в пищу вызывает опухоли тонкой кишки и мочевого пузыря.
Эндогенные канцерогенные вещества. Могут быть причиной развития некоторых видов злокачественных новообразований в особых условиях внутренней среды, при наличии генетических, гормональных и обменных нарушений. Они могут рассматриваться как эндогенные факторы, реализующие бластомогенный потенциал непосредственно или косвенно. Подтверждением этому явились опыты по индукции опухолей у животных при подкожном введении бензольных экстрактов из ткани печени человека, погибшего от рака желудка. Было изучено действие экстрактов из желчи, легочной ткани, мочи, и во всех случаях, как правило, у животных возникали опухоли. Экстракты, выделенные из органов умерших от неопухолевых заболеваний, были малоактивны или неактивны. Установлено также, что при бластомогенезе в процессе биотрансформации триптофана в организме образуются и накапливаются некоторые промежуточные продукты ортоаминофенольной структуры: 3-оксикинуренин, 3-оксиантраниловая кислота, 2-амино- 3-оксиацетофенон. Все эти метаболиты в незначительных количествах выявляются также в моче здоровых людей, однако при некоторых новообразованиях их количество резко возрастает (например, 3-оксиантраниловая кислота при опухолях мочевого пузыря). Кроме того, у больных опухолью мочевого пузыря обнаружен извращенный обмен триптофана. В экспериментах, посвященных изучению канцерогенных свойств метаболитов триптофана, наиболее активной оказалась 3-оксиантраниловая кислота, введение которой индуцировало лейкозы и опухоли у животных. Также показано, что введение больших количеств триптофана вызывает развитие дисгормональных опухолей и что некоторые метаболиты циклической аминокислоты тирозина (параоксифенилмолочная и параоксифенилпировиноградная кислоты) обладают канцерогенными свойствами и вызывают опухоли легких, печени, мочевого
пузыря, матки, яичников, лейкозы. Клинические наблюдения свидетельствуют о повышении содержания параоксифенилмолочной кислоты у больных лейкозами и ретикулосаркомами. Все это указывает на то, что эндогенные канцерогенные метаболиты триптофана и тирозина, возможно, ответственны за развитие некоторых спонтанных опухолей у человека.
Общие закономерности действия химических канцерогенных веществ. Все химические канцерогенные соединения обладают рядом общих черт действия независимо от их структуры и физикохимических свойств. Прежде всего для канцерогенов характерен длительный латентный период действия: истинный, или биологический, и клинический латентные периоды. Опухолевая трансформация начинается не сразу после контакта канцерогена с клеткой: вначале канцерогенное вещество подвергается биотрансформации, в результате образуются канцерогенные метаболиты, которые внедряются в клетку, изменяют ее генетический аппарат, обусловливая малигнизацию. Биологический латентный период - это время от образования в организме канцерогенного метаболита до начала неконтролируемого роста. Клинический латентный период более длителен и исчисляется от начала контакта с канцерогенным агентом до клинического обнаружения опухоли, причем начало контакта с канцерогеном может быть четко определено, а время клинического обнаружения опухоли - широко варьировать.
Длительность латентного периода может значительно колебаться. Так, при контакте с мышьяком опухоли кожи могут развиться спустя 30-40 лет, профессиональные опухоли мочевого пузыря у рабочих, контактирующих с 2-нафтиламином или бензидином, - в сроки от 3 до 30 лет. Длительность латентного периода зависит от канцерогенной активности веществ, интенсивности и продолжительности контакта организма с канцерогенным агентом. Проявление онкогенной активности канцерогена зависит от вида животного, его генетических особенностей, пола, возраста, коканцерогенных модифицирующих влияний. Канцерогенная активность вещества определяется скоростью и интенсивностью метаболических превращений и соответственно количеством образующихся конечных канцерогенных метаболитов, а также дозой вводимого канцерогена. Кроме того, немаловажное значение могут иметь промоторы канцерогенеза.
Одной из важных особенностей действия канцерогенов считается зависимость доза-время-эффект. Выявлена корреляция
между дозой (суммарной и разовой), латентным периодом и частотой возникновения опухолей. При этом чем выше разовая доза, тем короче латентный период и тем выше частота возникновения опухолей. У сильных канцерогенов отмечается более короткий латентный период.
Для большинства химических канцерогенов показано, что конечный эффект зависит не столько от разовой, сколько от суммарной дозы. Разовая доза определяет время, необходимое для индукции опухоли. При дроблении дозы для получения того же самого конечного эффекта необходимо более длительное введение канцерогена, в этих случаях «время восполняет дозу».
Способствующие этиологические факторы опухолевых заболеваний
Развитию опухолевых заболеваний способствуют:
1. Вредные привычки человека (курение, особенности питания, гиподинамия, злоупотребление алкоголем и др.).
2. Профессиональные вредности (в результате нарушения техники безопасности).
3. Экологическое неблагополучие (в результате загрязнения окружающей среды).
4. Ятрогенный канцерогенез.
Вредные привычки человека. Повышенный риск развития рака достоверно коррелирует с определенными факторами быта. Наиболее типичным примером считается рак легких у курильщиков. Порядка 90% случаев рака легкого спровоцировано курением. Рак легкого устойчиво лидирует в структуре онкологической заболеваемости в России и в мире. В настоящий момент злокачественные опухоли легких стоят на первом месте в структуре смертности от онкологических заболеваний у мужчин и на втором - у женщин. Связь рака с курением доказана эпидемиологическими исследованиями, проводившимися во многих странах. Показано, что степень риска развития рака органов дыхания возрастает в зависимости от числа выкуренных сигарет, частоты курения, возраста, в котором было начато курение. Курение во время беременности отрицательно влияет на плод. При этом пассивное курение не менее вредно, чем активное.
Сигаретный дым представляет собой продукт сложного состава, в котором присутствуют биологически активные соединения и канцерогены (например, соединения мышьяка и никеля, радиону-
клид 210Ро). Полагают, что в табачном дыме содержатся вещества, усиливающие бластомогенный эффект канцерогенов, в частности фенолы.
По данным ВОЗ, около 40% раковых заболеваний можно предотвратить благодаря воздержанию от потребления табака. Особо подчеркивается, что отказ от табака предотвращает развитие рака не только бронхолегочной локализации, но и других органов и систем, в частности полости рта, гортани, пищевода, желчного пузыря, поджелудочной железы, мочевого пузыря, желудка, печени, почек и других форм рака (табл. 13-1).
Имеется достаточное количество данных, свидетельствующих о том, что диетические факторы также играют большую роль в развитии рака. Это относится к составу рациона питания - например, недостаточное употребление фруктов и овощей, чрезмерное употребление соли и т.д. Малоподвижный образ жизни также является определенным фактором риска развития рака. Имеются доказательства того, что потребление алкоголя приводит к развитию некоторых форм рака, таких, как рак пищевода, глотки, гортани, печени, молочной железы и других органов.
Таблица 13-1. Соотношение между смертностью от рака различной локализации у курильщиков и некурящих (по E. Hammond)
Локализация опухоли | Возраст, годы | |
45-64 | 65-79 | |
Некурящие | 1 | 1 |
Курильщики: | ||
Рак всех локализаций | 2,14 | 1,76 |
Рак легкого | 7,84 | 11,59 |
Рак полости рта и глотки | 9,90 | 2,93 |
Рак гортани | 6,09 | 8,99 |
Рак пищевода | 4,17 | 1,74 |
Рак мочевого пузыря | 2,00 | 2,96 |
Рак поджелудочной железы | 2,69 | 2,17 |
Рак печени и желчных путей | 2,84 | 1,34 |
Рак почки | 1,42 | 1,57 |
Рак желудка | 1,42 | 1,26 |
Лейкозы | 1,40 | 1,68 |
Профессиональные опухоли. Особый раздел в онкологии составляют профессиональные опухоли - бластомогенные реакции, возникшие в результате профессиональной деятельности человека, при регулярном и длительном контакте с некоторыми экзогенными химическими или физическими факторами. Эти опухоли по клиническому течению и прогнозу не отличаются от «спонтанных» раков. Особенностью этих опухолей считается выявленная связь с профессиональными вредностями и длительный латентный период до клинического их проявления. Примером таких опухолей могут быть ангиосаркомы печени, развивающиеся через 40 лет и более после работы с винилхлоридом; рак мочевого пузыря - спустя 12-15 лет после контакта с ароматическими аминосоединениями; опухоли легких - через 7-21 год после контакта с асбестом. МАИР выделило несколько десятков химических соединений, сложных продуктов и технологических процессов, представляющих реальную канцерогенную опасность для людей и относящихся к профессиональным вредностям. Риску развития профессионального рака подвержены занятые в производстве и очистке каменноугольных смол, минеральных масел, некоторых ароматических аминосоединений, асбеста, мышьяка, хрома, никеля, некоторых продуктов промежуточного органического синтеза, а также работники мебельных и обувных фабрик и др.
Ятрогенный канцерогенез связан с применением диагностических процедур и терапевтических воздействий, выполняемых медицинскими работниками. К лекарствам, канцерогенное действие которых было отмечено давно, относится мышьяк (начало XIX в.), вызывающий рак кожи после применения его препаратов с лечебной целью. Антибиотик хлорамфеникол вызывает острый лейкоз (миелоидного типа). Из алкилирующих препаратов следует упомянуть циклофосфамид, после применения которого зарегистрированы случаи развития лейкозов. Рак мочевого пузыря выявлен у больных, лечившихся хлорнафтизином - производным β-нафтиламина. Индукция фибросарком и опухолей других локализаций отмечена при лечении эпилепсии производными гидантоина (железодекстрановый комплекс). Опухоли мочеполовых органов отмечены после приема анальгетиков, созданных на основе фенацетина. Зафиксированы случаи опухолей у детей, родившихся от женщин, получавших синэстрол или диэтилстильбестрол. Кроме того, лечение последним повышает риск развития рака эндометрия и молочной железы. Имеются отдельные сообщения о
развитии опухолей после лечения туберкулеза гидразидом изоникотиновой кислоты, а также гризеофульвином, тиоурацилом, цикломатом. Как уже было отмечено выше, опухоли у людей могут быть обусловлены воздействием ионизирующего излучения, применяемого в диагностических и терапевтических целях.
Предрасполагающие этиологические факторы опухолевых заболеваний
К ним относятся пол, возраст, конституция, ожирение, в некоторых случаях наследственная предрасположенность, иммунодефицитные состояния (возникающие в том числе и при тяжелом эмоциональном стрессе), наличие некоторых заболеваний - сахарный диабет, атеросклероз и др.
Возрастные и половые различия в развитии опухолей. Имеются различия не только в структуре, но и в частоте выявления онкологических заболеваний у мужчин и женщин. Рак легкого, желудка почти в 2 раза чаще возникает у мужчин, у женщин преобладает рак молочной железы, кожи. Причины этих различий неизвестны, однако существует предположение, что вероятность развития вышеуказанных новообразований зависит от особенностей обмена гормонов и биологически активных веществ, влияющих на пролиферативную активность клеток. Так, пик остеосаркомы отмечен в пубертатный период, когда начинают активно функционировать половые железы; развитие остеосаркомы при этом сопровождается синдромом гиперандрогенемии. Для больных раком молочной железы, яичников, матки, ободочной кишки характерно раннее начало менструаций. Раннее менархе и позднее наступление менопаузы следует относить к факторам риска развития рака молочной железы и матки.
Ожирение и рак. По некоторым данным, ожирение может представлять собой самостоятельный фактор повышенного онкологического риска. При этом опасно не само ожирение, а ассоциированные с ним эндокринно-обменные нарушения. Избыток массы тела может представлять интерес как фактор прогноза. Так, у 50-59-летних женщин, которые страдали ожирением уже в возрасте 20-29 лет, выше риск развития рака молочной железы и эндометрия. Выявлена прямая корреляционная зависимость между риском развития рака молочной и предстательной желез, раком толстой кишки и потреблением насыщенных жирных кислот. По данным некоторых авторов, пища, которая содержит растительные
волокна (пектин, целлюлозу), может способствовать уменьшению частоты рака толстой кишки и предстательной железы. Ожирению может способствовать гипокинезия. У спортсменов, которые прекратили интенсивные физические нагрузки и набрали избыточную массу тела, отмечается тенденция к учащению и более раннему развитию злокачественных новообразований.
Наследственная предрасположенность к раку. Несмотря на генетическую природу всех злокачественных опухолей, далеко не все они являются наследственными заболеваниями, так как в большинстве случаев связаны с соматическими мутациями, не передающимися по наследству. Доля собственно наследственных форм рака среди всех злокачественных опухолей составляет 7%. Передаваться по наследству может ген, вызывающий определенную форму рака (ретинобластома, опухоль Вильмса) или повышающий риск заболевания раком (пигментная ксеродерма, анемия Фанкони, атаксия-телеангиэктазия); при полигенном наследовании опухоль возникает при сочетании нескольких наследственных признаков. Механизмы развития рака при наследственных заболеваниях неизвестны, однако полагают, что они связаны с повышением частоты мутаций, трансформирующих нормальный ген в онкоген (альбинизм, заболевания, сопровождающиеся увеличением пула пролиферирующих клеток, - множественный полипоз толстой кишки, синдром Гарднера, фиброматоз десен), угнетением процессов ликвидации мутаций на уровне клетки (болезни, связанные с нарушением репарации ДНК, например пигментная ксеродерма, синдром Блума - карликовость с нарушением пигментации кожи, для которого характерны лейкозы, карциномы кишечника и языка), снижением эффективности элиминации трансформированных клеток на уровне организма (прямые наследственные нарушения иммунитета и случаи метаболической иммунодепрессии - болезнь Дауна).
Сахарный диабет и рак. Развитию злокачественных новообразований благоприятствуют снижение толерантности к углеводам и гиперинсулинемия. Эти нарушения метаболизма могут быть следствием возрастных изменений, стресса, нарушения функции печени, а также развиться под влиянием самой опухоли. Вместе с тем снижение толерантности к углеводам определяется задолго до развития опухолевого процесса. Так, большинство женщин, страдающих онкологическими заболеваниями, имеют в анамнезе роды крупным плодом с массой более 4000 г. Влияние самой глюкозы на развитие опухолевого процесса зависит от стадии развития опу-
холи. Так, при наличии большой массы опухолевых клеток, когда усилен глюконеогенез, введение глюкозы с инсулином может оказать благоприятное влияние на организм вследствие блокирования глюконеогенеза, подавления липолиза и катаболического расходования белков организма.
Стресс и рак. Хронический стресс потенцирует опухолевый рост посредством изменения секреции ряда биологически активных веществ и гормонов: катехоламинов, простагландинов, нейромедиаторов, глюкокортикоидов, гормона роста, пролактина. Стрессовая реакция приводит к угнетению важных звеньев противоопухолевого иммунитета - подавлению функции макрофагов и натуральных киллеров (NK-клеток).
Беременность и рак. В некоторых случаях беременность ухудшает течение опухолевого процесса, что связано с эндокриннометаболическими изменениями, которые происходят в этот период в организме женщины.
13.3.4. Биологические особенности опухолей, механизм их развития
Клетки организма объединены в ткани, число клеток в каждой из которых более или менее постоянно. Естественная убыль клеток возмещается за счет молодой ткани, содержащей низкоспециализированные, делящиеся клетки, темп созревания которых определяется потерей зрелых, функционирующих клеток, что, в свою очередь, контролируется ростовыми факторами. Если баланс убыль-пополнение по каким-либо причинам нарушается в пользу пополнения, то возникает избыточная масса клеток, и в том месте, где этот баланс нарушен, образуется опухоль.
К биологическим особенностям опухолевых клеток и тканей (в первую очередь - злокачественных) относятся беспредельность роста, автономность роста, инфильтрирующий рост, способность к метастазированию, атипизм (анаплазия) опухолевых клеток и тканей, клоновый характер роста, опухолевая прогрессия.
Беспредельность роста - это избыточность пролиферации опухолевых клеток.
Известно, что у опухолевых клеток понижено свойство контактного торможения, отсутствует предел клеточного деления - «барьер Хейфлика». В норме в процессе межклеточного взаимодействия осуществляется контактное торможение роста клеток:
во время пролиферации дальнейшее деление клетки тормозится соседними, при этом обеспечивается сохранение генетически запрограммированного числа клеток в данной ткани. В опухоли контактное торможение заблокировано, а сама опухолевая клетка «навязывает» окружающим клеткам свои условия существования. Под влиянием паракринных команд, которые исходят из самой опухолевой клетки, окружающие клетки начинают вырабатывать стимуляторы пролиферации, и опухолевая клетка переходит на внутреннюю систему аутокринного и паракринного управления. Нормальные клетки имеют генетически ограниченное число делений («барьер Хейфлика»), после чего включается программа их естественной гибели - апоптоз. В нормальных клетках за программу апоптоза отвечают гены-супрессоры клеточного деления - антионкогены (например, р53). В опухолевых клетках антионкогены инактивированы, поэтому программа апоптоза не включается. В результате опухолевые клетки не гибнут, становятся иммортализованными («бессмертными»), что в условиях неограниченного числа клеточных делений обусловливает прогрессирующее увеличение количества клеток в ткани. Беспредельность роста обеспечивается также растормаживанием пролиферации за счет увеличения продукции факторов роста (эпидермальный фактор роста и др.), что опосредуется активацией в опухолевых клетках протоонкогенов - генов, кодирующих ростовые факторы. Растормаживание пролиферации обеспечивается переходом к ее паракринной и аутокринной регуляции. Опухолевая клетка осуществляет аутокринную регуляцию своей жизнедеятельности путем самостоятельной продукции и активной рецепции факторов роста. Таким образом, под влиянием генетического сигнала опухолевая клетка сама может стимулировать свое собственное размножение, продуцируя митогены и их рецепторы.
Автономность роста. Опухолевая клетка запрограммирована на размножение, и этому подчинены все внутриклеточные механизмы регуляции обмена веществ и воспроизводства структур. Для реализации этой программы формируется ее автономность - относительная независимость от командных нейрогуморальных влияний организма больного. Она обусловлена снижением на опухолевых клетках числа рецепторов к гормонам и нейромедиаторам организма и переходом к пара- и аутокринной регуляции пролиферации.
Инфильтрирующий (инвазивный) рост - это критерий злокачественности опухолевого роста. При инфильтрирующем росте
опухолевые клетки выходят за пределы исходной ткани, прорастают в окружающие ткани, разрушая их при этом. Механизмы инфильтрирующего роста и метастазирования во многом совпадают.
В основе инфильтрирующего роста лежат беспредельность роста, нарастание количества клеток, проникающих в окружающие ткани. Кроме этого, нормальные клетки гибнут и освобождают пространство для опухоли вследствие их конкуренции с опухолевыми клетками за метаболиты («опухоль - ловушка глюкозы, азота, витаминов и др.»). Гибель нормальных клеток происходит и из-за того, что опухолевые клетки выделяют протеазы в окружающую среду (в настоящее время известны четыре класса протеаз, участвующих в процессах инвазии). Успешность инвазивного роста зависит от ослабления адгезивных свойств опухолевых клеток между собой (например, из-за уменьшения содержания в них кальция, обеспечивающего сцепление клеток), от возрастания числа молекул адгезии к межклеточному фибронектину, коллагену. Все это обеспечивает перемещение, инвазию опухолевых клеток в окружающую среду.
Метастазирование - также один из критериев злокачественности опухоли. Это появление вторичных новых очагов опухолевого роста, удаленных от первичного опухолевого узла. Механизмы инфильтрирующего роста и метастазирования во многом совпадают. Поэтому можно сказать, что метастаз - это отдаленное в пространстве и во времени последствие инфильтрирующего роста.
Метастазирование является главной проблемой в лечении злокачественных опухолей. Раковые клетки отрываются от первичного опухолевого узла, мигрируют по лимфатической и кровеносной системе, а также по межтканевым щелям, имплантируются и дают начало новым опухолям в различных органах и тканях. Однако, как правило, когда удается обнаружить первичную опухоль, часть клеток уже покинула ее и осела в других органах. Около 30% пациентов со злокачественными опухолями имеют клинически выявляемые метастазы в период установления диагноза. У 30-40% пациентов метастазы являются скрытыми и проявляются в дальнейшем.
Формирование метастатических очагов является продолжительным процессом, который начинается на ранней стадии развития первичной опухоли и усиливается со временем. Опухолевые клетки из метастатических очагов сами обладают способностью метастазировать; часто существование крупного и клинически идентифи-
цируемого метастаза осложняется наличием большого количества микрометастазов, образованных из клеток первичной опухоли или из клеток другого метастаза. Различия возраста и размеров метастазов, их рассеянное расположение по всему организму и гетерогенная структура препятствуют полному хирургическому их удалению и ограничивают эффективность многих системных противоопухолевых препаратов.
Выделяют следующие стадии метастазирования:
1. Отрыв одной или нескольких опухолевых клеток от первичного узла и их интравазация - проникновение в кровеносные и лимфатические сосуды и последующая циркуляция по сосудам.
2. Имплантация опухолевых клеток в том или ином органе.
Механизмы отрыва опухолевых клеток от первичного опухолевого узла совпадают с механизмами инфильтрирующего роста (отрицательный заряд мембраны опухолевых клеток, снижение уровня ионов кальция в них, ослабление сил сцепления между опухолевыми клетками, наличие молекул адгезии к межклеточному веществу).
Механизм интравазации опухолевых клеток опосредован: 1) выделением протеаз; 2) наличием молекул адгезии к межклеточному веществу; 3) активацией неоангиогенеза (в опухолевой ткани повышен синтез позитивных факторов ангиогенеза). Все указанные механизмы позволяют опухолевым клеткам проникать в сосуды.
1. Опухолевые протеазы. Одним из наиболее важных свойств опухоли является способность выделять протеолитические ферменты и регулирующие их активность вещества. Опухолевым клеткам необходимо пройти через внеклеточный матрикс в ходе инвазии, а для этого они должны быть способны секретировать или активировать ферменты, разрушающие основные составляющие матрикса. Известно, что в состав межклеточного вещества и базальных мембран входят структурные белки - коллаген, эластин, ламинин и др. Выделяемые опухолевыми клетками протеазы разрушают эти белки, чем облегчают продвижение клеток вглубь окружающих тканей. В некоторых случаях раковые клетки сами не образуют протеаз, а каким-то образом привлекают к инвазивной зоне макрофаги, фибробласты и нейтрофилы, которые выполняют за них эту функцию.
В настоящее время известны четыре класса протеаз, участвующих в процессах опухолевой инвазии: металлопротеиназы - коллагеназы, желатиназы и стромелизины; цистеиновые протеазы - ка-
тепсины B и L; аспартиловая протеаза - катепсин D; сериновые протеазы - плазмин, активаторы плазминогена тканевого (t-PA) и урокиназного (u-PA) типа.
Некоторые из этих протеаз выделяются опухолевыми клетками во внеклеточное пространство (например, коллагеназа или эластаза), другие оказываются связанными с поверхностью клеток (протеазы, деградирующие фибронектин внеклеточного матрикса). Для некоторых протеаз обнаружен рецептор на поверхности клетки, и поэтому они могут находиться как в связанном с клеточной мембраной, так и свободном состоянии (u-PA).
Кроме веществ, активирующих протеолиз, в ткани опухоли и в плазме обнаруживаются вещества, специфически ингибирующие действие этих ферментов, такие, как тканевые ингибиторы металлопротеиназ или ингибиторы активаторов плазминогена. В настоящее время уже известны два ингибитора активатора плазминогена - PAI-1 и PAI-2. При этом с повышением уровня первого типа ингибитора связан риск возникновения метастазов и рецидива опухоли, а повышение содержания PAI-2 в ткани коррелирует с благоприятным прогнозом развития злокачественного новообразования. Это явление объясняется скорее всего тем, что PAI-1 защищает саму опухоль от разрушающего действия протеаз.
2. Взаимодействие метастазирующих клеток с внеклеточным веществом, адгезия (контактное взаимодействие) клеток. Организмы млекопитающих состоят из серии тканевых компартментов, разделенных внеклеточным матриксом. Базальная мембрана вместе с подлежащей интерстициальной стромой является главным звеном, соединяющим паренхиматозные компартменты органов. В ходе превращения из in situ в инвазивную карциному опухолевые клетки пенетрируют базальную мембрану эпителия и внедряются в подлежащую интерстициальную строму. Непрерывная базальная мембрана представляет собой сеть коллагена IV типа, протеогликанов, гликопротеинов, таких, как ламинин и фибронектин, и в норме не содержит пор, достаточных для прохождения злокачественных клеток. Таким образом, инвазия в базальную мембрану должна быть активным процессом. Только после инвазии в соединительнотканную строму опухолевые клетки получают доступ к кровеносным и лимфатическим сосудам. В ходе интравазации и экстравазации опухолевые клетки также должны пенетрировать субэндотелиальную мембрану. В отдаленном органе клетки, вышедшие за пределы сосудов, должны мигрировать через
периваскулярную интерстициальную строму, чтобы образовать новые колонии в паренхиме.
Взаимодействие злокачественных клеток с базальными мембранами можно разделить на три этапа:
1-й этап. В случае циркулирующих опухолевых клеток базальная мембрана обнажается локальным удалением эндотелия, индуцированным злокачественными клетками. В дальнейшем они присоединяются к поверхности базальной мембраны посредством связывания белков клеточной поверхности с гликопротеинами базальной мембраны. Примером основного белка, необходимого для присоединения злокачественных клеток к базальной мембране, является ламинин. На поверхности нормальных и неопластических клеток имеется рецептор к ламинину с молекулярной массой 64 кД. Второй тип матриксных рецепторов, необходимых для связывания с компонентами внеклеточной среды, представлен интегринами - семейством гликопротеинов клеточной поверхности. Кадхерины являются внеклеточными кальцийзависимыми молекулами клеточной адгезии. Кадхериновые молекулы адгезии обеспечивают разрыв межклеточных контактов, необходимый для выхода опухолевых клеток из первичного места расположения и метастазирования.
2-й этап. После присоединения опухолевые клетки нарушают целостность базальной мембраны. Для этого они или сами выделяют протеолитические ферменты, или индуцируют продукцию протеаз локальными нормальными клетками. Лизис внеклеточного вещества происходит в высоколокализованной области, близкой к поверхности опухолевых клеток, где количество активных ферментов превышает количество естественных ингибиторов, находящихся в плазме и матриксе или синтезируемых окружающими клетками.
3-й этап. Происходит переход опухолевых клеток через поры в базальной мембране, возникшие в результате местного протеолиза. Направление и конечная цель движения клеток могут определяться хемоаттрактантами, выделяемыми тканями хозяина, либо веществами, продуцируемыми самой опухолью. Процесс инвазии является динамичным вследствие циклического повторения вышеуказанных этапов.
3. Неоангиогенез в опухоли. Известно, что большинство злокачественных новообразований склонно к быстрому лимфогенному и/ или гематогенному метастазированию, чему способствует неоан-
гиогенез в первичной опухоли. К потенциальным регуляторам ангиогенеза, сопровождающего рост как первичной опухоли, так и метастазов, относят многие ростовые факторы, среди них особое место занимают ангиогенин и фактор роста эндотелия сосудов. Доказано, что они являются активными митогенами для клеток кровеносных и лимфатических сосудов, не действуют на другие типы клеток и реализуют свой эффект в синергизме с другими факторами роста, в частности с фактором роста фибробластов-2. Отмечено, что клетки наиболее агрессивных опухолей склонны к повышенной экспрессии ангиогенина и фактора роста эндотелия сосудов.
Механизм имплантации опухолевых клеток также реализуется поэтапно:
1-й этап. Адгезия циркулирующих по сосудам опухолевых клеток к элементам сосудистой стенки за счет молекул адгезии, чему способствуют воспалительное, атеросклеротическое, операционное повреждение сосудистой стенки, повышение вязкости крови (причины этого - активация коагуляционного, сосудистотромбоцитарного гемостаза, угнетение фибринолиза, сладжирование эритроцитов, увеличение содержания сывороточных глобулинов);
2-й этап. Экстравазация опухолевых клеток (с участием опухолевых протеаз).
Судьба клеток, прошедших экстравазацию и вышедших в ткань, различна: часть их вступает в митоз и образует метастаз; часть - гибнет (под влиянием NK-клеток, макрофагов); оставшиеся переходят в стадию G0 В фазе покоя (G0) опухолевые клетки могут находиться достаточно долго, переходу в фазу митоза из фазы G0 способствуют: гормональный дисбаланс, возраст, снижение резистентности организма (например, уменьшение количества NK- клеток, макрофагов, снижение противоопухолевого иммунитета), операционная травма и др.
Только наиболее приспособленные клетки могут выжить на каждом из этапов метастазирования. Лишь небольшая часть (<0,01%) циркулирующих опухолевых клеток способна в конечном итоге успешно образовать метастатическую колонию. Таким образом, метастазирование является высокоселективной конкуренцией, которая способствует выживанию небольшой субпопуляции метастатических опухолевых клеток, существовавших в первичной опухоли.
В настоящее время во многих лабораториях проводится широкий спектр работ, посвященных изучению молекулярных основ инвазии и метастазирования опухолевых клеток. Хорошо изучены некоторые процессы: адгезия, межклеточные взаимодействия, протеолитическая активность, а также неоангиогенез. Не следует забывать и об иммунной системе, так как благодаря ее толерантности к опухолевым клеткам у онкологических больных некоторые клоны раковых клеток способны выживать и давать начало новым, вторичным опухолям.
Локализация метастазов широко варьирует в зависимости от гистологического варианта и расположения первичной опухоли. Во многих случаях при злокачественных новообразованиях наиболее часто поражается метастазами орган, оказавшийся первым на пути циркулирующих клеток по капиллярному руслу. В качестве примера можно привести саркомы, метастазирующие в легкие, метастазирование рака легкого в мозг и диссеминацию рака толстой кишки в печень. С другой стороны, имеются разные типы локализации метастазов в органах и тканях, происхождение которых не может быть объяснено только на основании анатомического их расположения. Так, светлоклеточная карцинома почек часто метастазирует в щитовидную железу, рак молочной железы - в яичники, а меланома - в печень. Также широко известно сродство клеток рака молочной и предстательной желез к костной системе, куда они чаще всего метастазируют. Эти явления скорее всего отражают различную степень органного тропизма раковых клеток к тканям организма.
Атипизм (анаплазия) - это особенности структурно-функциональной организации опухолевых клеток, создающие сходство с эмбриональными клетками и отличающие их от нормальных исходных клеток.
Виды атипизма: морфологический, биохимический, функциональный, иммунологический.
Атипизм структуры опухолевой ткани отмечается на всех уровнях - тканевом, клеточном и ультраструктурном. Клеточный и ультраструктурный атипизм проявляется полиморфизмом клеток и субклеточных структур по величине и форме, возрастанием ядерноцитоплазматического соотношения, гиперхромией ядер, изменением числа хромосом, увеличением ядрышек, неодновременным делением ядра и протоплазмы. Появляются многоядерные клетки и клетки с почкованием протоплазмы, часто обнаруживаются ми-
тозы с аномальным расположением хромосом. Тканевый атипизм характеризуется изменением величины, формы и расположения тканевых элементов, а также соотношения стромы и паренхимы в органе, пораженном опухолью.
Биохимическая анаплазия - это особенности обмена веществ в опухолевых клетках.
Фенотипические особенности поведения злокачественных клеток (способность к неограниченному росту, инвазии и метастазированию) регистрируются сравнительно легко с помощью биохимических и молекулярно-биологических маркеров. Значительно сложнее решается проблема качественных биохимических отличий опухолевой клетки от нормальной.
Наиболее ранние открытия в этой области связаны с нарушениями (атипизмом) энергетического и углеводного обменов, которые проявляются изменением интенсивности анаэробного гликолиза (расщепление гликогена и глюкозы до пировиноградной кислоты без использования кислорода) и тканевого дыхания. В начале ХХ в. Отто Варбург показал, что опухолевые клетки получают необходимую им энергию в результате анаэробного гликолиза, превращая глюкозу в молочную кислоту. Другое важное открытие, сделанное им, состояло в том, что опухоли потребляют меньше кислорода, чем нормальные ткани. В опухоли постоянно обнаруживается 10-30-кратное усиление анаэробного гликолиза. Усиление анаэробного гликолиза в гиалоплазме опухолевых клеток сопровождается ослаблением тканевого дыхания, которое происходит в митохондриях. В норме усиление анаэробного гликолиза возникает как компенсаторная реакция в ответ на дефицит АТФ при недостатке кислорода. Поступление кислорода в нормальные клетки и активация тканевого дыхания приводят к ослаблению анаэробного гликолиза (положительный эффект Пастера). В опухолевой ткани в отличие от нормальной кислород и тканевое дыхание не ослабляют гликолиз (отрицательный эффект Пастера). Некоторые исследователи считают, что усиленное потребление опухолевой тканью глюкозы и активация гликолиза ослабляют тканевое дыхание (положительный эффект Кребтри). Усиление гликолиза и ослабление тканевого дыхания прогрессивно нарастают по мере увеличения степени злокачественности опухоли. Кроме того, в опухолевой ткани усилен пентозомонофосфатный шунт и использование в нем глюкозы, что приводит к повышенному образованию рибозы и НАДФ2Н, которые необходимы для син-
теза нуклеиновых кислот и размножения клеток. Вследствие атипизма энергетического и углеводного обмена потребность опухоли в глюкозе резко увеличивается, и опухоль становится «ловушкой» глюкозы. Опухолевые клетки приобретают повышенную устойчивость к гипоксии, возникающей при колебаниях в ней кровотока и оксигенации крови, благодаря чему сохраняют способность к инвазивному росту и метастазированию. В связи с накоплением молочной кислоты в опухоли возникает ацидоз, который может действовать отрицательно на окружающие ткани.
В опухолевых клетках существенно изменяются изоферментный спектр ряда ферментов энергетического обмена и их субклеточная локализация в результате нарушения регуляции на геномном уровне. Опухолевая клетка обладает таким изоферментным набором, который позволяет ей адаптироваться к среде и конкурировать с нормальными клетками за необходимые для размножения субстраты.
Следует подчеркнуть, что ни в злокачественных клетках, ни в сыворотке онкологических больных не обнаружены ферменты, специфичные для рака. Речь идет либо о количественных изменениях активности, либо о преобладании того или иного изофермента. Все найденные в злокачественных опухолях изоферменты обнаруживаются в органах взрослого организма либо в эмбриональном периоде. Следует также отметить чрезвычайно высокую вариабельность активности ферментов в опухолях одной и той же локализации независимо от их тканевого происхождения и гистологической структуры. Это обусловлено гетерогенностью клеточного состава опухолей человека и разной степенью их прогрессии. В злокачественных опухолях происходят изменения преимущественно тех ферментов, которые обеспечивают способность к росту и пролиферации клеток: увеличение активности ключевых ферментов гликолиза (гексокиназы, лактатдегидрогеназы - ЛДГ, альдолазы и др.), ферментов синтеза ДНК (ДНК-полимеразы), ферментов, связанных с плазматической мембраной клеток (щелочная фосфатаза, γ-глутамилтрансфераза). Увеличение активности ферментов при злокачественном росте сопровождается нарушением представительства изоформ с унификацией их спектра, выражающейся для ЛДГ в преобладании М-субъединиц при раке желудочно-кишечного тракта, легкого, яичников, предстательной железы и, наоборот, Н-субъединиц при раке яичек и гемобластозах.
Атипизм жирового обмена в опухоли проявляется преобладанием липогенеза над липолизом, при этом особенно интенсивно синтезируются липиды и липопротеины, которые в дальнейшем идут на построение мембран вновь образующихся клеток. При злокачественных опухолях у больных в сыворотке крови возрастает уровень отдельных липидов, в первую очередь нейтральных жиров, эфиров холестерина, триацилглицеролов.
Атипизм белкового обмена и обмена нуклеиновых кислот проявляется многообразными, подчас неоднозначными изменениями. Однако для опухоли характерно преобладание анаболизма над катаболизмом белков, что приводит к возрастанию уровня протеинов, необходимых для усиленного размножения клеток. Повышенный синтез белка требует постоянной утилизации аминокислот и высоких энергозатрат, опухоль активно поглощает аминокислоты из крови даже при низкой их концентрации. Из аминокислот и пептидов в раковых клетках обнаружено много серосодержащих соединений (в составе SH-групп), таких, как метионин, цистеин, глутатион, а также соединений основного характера - лизин, аргинин. Параллельно с ростом опухоли в ее клетках преобладают катаболизм углеводов и анаболизм нуклеиновых кислот по двум путям: рециклизации (синтеза из продуктов распада пуриновых и пиримидиновых оснований) и образования de novo из остатков глюкозы при переаминировании с генерацией оснований нуклеиновых кислот. Усиленный синтез нуклеиновых кислот связан с нарушением генетического контроля.
При опухолевом процессе выявлены нарушения водно-минерального обмена, которые характеризуются накоплением в клетках опухоли К+ и снижением уровня Са2+, что способствует ограничению межклеточных связей, инвазивному росту и метастазированию. Для опухолей также характерна гипергидратация как следствие гиперонкии ткани и гипоонкии крови.
Функциональная анаплазия - это особенности функционирования опухолевых клеток по сравнению с исходными нормальными клетками. Возможны следующие ее варианты:
1. Снижение либо полная утрата специализированной функции, свойственной нормальным клеткам и тканям. Например, при гемобластозах лейкозные клетки не способны осуществлять фагоцитоз, клетки карциномы печени утрачивают способность синтезировать альбумины.
2. Сохранение функции. Но она выполняется монотонно, некоординированно с организмом, не соответствует его потреб-
ностям (например, в глюкагономе или феохромоцитоме идет постоянный синтез гормонов независимо от уровня этих гормонов в крови; при базофильной аденоме гипофиза с гиперпродукцией аденокортикотропного гормона (АКТГ) развивается болезнь Иценко-Кушинга).
3. Появление новой несвойственной функции: белковый обмен в опухоли изменяется не только количественно, но и качественно. Так, например, в опухоли возобновляется синтез эмбриональных белков в связи с разблокировкой эмбриональных генов (синтез α-фетопротеина при первичном раке печени). В клетках опухоли могут синтезироваться белки, гормоны, не характерные для исходной ткани (синтез АКТГ, паратиреоидного гормона при мелкоклеточном раке легкого; синтез аномальных иммуноглобулинов при макроглобулинемии Вальденстрема, болезни тяжелых цепей, миеломной болезни). Определение этих белков в сыворотке крови используют в диагностике опухолей. Синтез аномальных белков и гормонов опухолью может стать причиной тяжелых нарушений регуляции жизнедеятельности. Например, так называемый белок Бенс-Джонса, синтезируемый клетками опухоли при миеломе, обладает низкой молекулярной массой, поэтому проходит через клубочковый фильтр почек и определяется в моче как маркер заболевания. Усиленный синтез этого белка приводит к развитию парапротеинемического нефроза. При мелкоклеточном раке легкого трансформированные клетки эпителия бронхов начинают продуцировать гормоны. В результате в организме развивается параэндокринный синдром - это ситуация клинической картины гиперфункции эндокринной железы на фоне ее атрофии из-за синтеза гормонов опухолевыми клетками. Параэндокринный синдром - один из вариантов паранеопластических синдромов.
Иммунологическая анаплазия - изменение антигенных свойств опухолевых клеток. Существует 3 варианта изменения набора антигенов опухолевых клеток:
1) антигенное упрощение - уменьшение количества антигенов;
2) антигенная дивергенция - появление у опухолевых клеток антигенов различных нормальных клеток и тканей;
3) антигенная реверсия - появление эмбриональных антигенов.
Все это становится одним из механизмов ускользания опухоли от иммунного надзора организма.
Клоповый характер опухолевого роста (клональное развитие опухолей).
В настоящее время является общепризнанным наличие двух вариантов развития опухолей - моноклонального и поликлонального. Большинство известных опухолей развиваются из одной опухолевой клетки (например, аденома и рак толстой кишки, миелолейкоз, Т- и В-клеточные лимфомы), возникшей вследствие ее соматической мутации, и характеризуются моноклональным происхождением, определенным маркером (например, «филадельфийская» хромосома), в начале своего развития растут из одного узла (уницентрический рост). Опухоли поликлонального происхождения характеризуются ростом из нескольких клеток (мультицентрический рост) и образованием нескольких зачатков опухолей (рак молочной и предстательной желез, рак печени).
Одна трансформированная клетка производит сначала один клон подобных себе клеток с одинаковым генотипом и фенотипом - это моноклоновая стадия. Затем вследствие нестабильности генетического материала опухолевых клеток возникают мутации, и в определенный момент из одного клона появляется несколько вторичных клонов, отличающихся по генотипу и фенотипу, - это поликлоновая стадия. Таким образом, в опухолевом узле появляются гетерогенные клоны клеток - потомков одной трансформированной клетки. При этом основа поликлоновости - генетическая нестабильность. Она вызвана многими факторами, в том числе и супрессией гена р53.
Опухолевая прогрессия - это качественные изменения свойств опухоли в сторону малигнизации, возникающие по мере ее роста. С момента появления поликлоновой популяции в действие вступает естественнный отбор между клонами - движущая сила опухолевой прогрессии. Естественный отбор отдает предпочтение наиболее агрессивным, приспособленным клонам, наиболее устойчивым к противоопухолевой терапии, к иммунной системе организма. Идет клональная селекция наиболее злокачественных для организма клонов опухолевых клеток.
Для каждой популяции неопластических клеток характерна определенная степень стабильности свойств, а именно: ростовые потребности, характер распространения и др., которые могут сохраняться неопластическими клетками во многих генерациях. Однако эта стабильность не абсолютна, и время от времени популяция может изменять свои свойства, причем многократно. Из-
менение свойств неопластической популяции называют прогрессией. По Л. Фулдсу, прогрессия - это необратимое качественное изменение одного или нескольких свойств неоплазии, направленное в сторону увеличения хотя бы некоторых различий между нормальной и неопластической тканью и характеризующееся рядом общих правил:
1. Независимая прогрессия множественных опухолей: независимая прогрессия разных опухолей, возникших у одного и того же организма.
2. Независимая прогрессия признаков: независимая прогрессия разных свойств одной и той же опухоли.
3. Прогрессия не зависит от роста: прогрессии могут подвергнуться не только растущие опухоли, но и опухоли, рост которых остановился. Важным следствием этого правила является то, что стадия прогрессии, на которой находится выявляемая у человека опухоль, не зависит от ее величины или длительности клинического течения.
4. Прогрессия может быть скачкообразной или постепенной.
5. Прогрессия может идти несколькими альтернативными путями.
6. Прогрессия не всегда доходит до конца раньше, чем наступает смерть организма, в котором развивается опухоль.
В целом правила Л. Фулдса констатируют лишь одно: отсутствие всяких правил в прогрессии, невозможность предсказать время или характер изменений, которые наступят в данной неоплазии. Поэтому эволюция каждого новообразования сугубо индивидуальна и предсказать судьбу отдельного новообразования нельзя. Так называемое независимое формирование и присоединение опухолевых признаков исследователи объясняют неодномоментным включением комплементарных онкогенов. В практической онкологии неблагоприятные условия, создаваемые лечебными воздействиями (химио-, лучевая терапия), могут приводить к селекции клеток и появлению более устойчивого злокачественного клона.
13.3.5. Патогенез опухолевого роста (онкогенез)
Современные концепции онкогенеза связаны с успехами молекулярной биологии и генной инженерии. В процессе опухолевого превращения клетка проходит несколько стадий, приобретая на каждой из них новые свойства. В основе онкогенеза лежат изменения особых генов: протоонкогенов и/или антионкогенов.
В нормальном состоянии эти гены играют ключевую роль в важнейших проявлениях жизнедеятельности клетки, осуществляя позитивный (протоонкогены) или негативный (антионкогены) контроль клеточного деления, регуляцию организации цитоскелета, а также участвуя в механизмах программируемого «самоубийства» клетки - апоптоза. Однако различные мутации могут привести к усилению или извращению функций протоонкогенов (с превращением их в онкогены) и/или к инактивации функции антионкогенов. Такие изменения в геноме приводят клетку к опухолевой трансформации.
Протоонкогены - специфические гены нормальных клеток, которые осуществляют позитивный контроль процессов пролиферации и мембранного транспорта. Под влиянием мутаций протоонкогены претерпевают так называемую активацию, что способствует их превращению в онкогены, экспрессия которых вызывает возникновение и прогрессию опухолей. Протоонкоген может превратиться в онкоген при замене в нем даже одного из 5000 нуклеотидов. В настоящее время известно около сотни протоонкогенов. Нарушение функций протоонкогенов вызывает их превращение в онкогены и способствует опухолевой трансформации клетки. Онкогены обозначают соответственно их нахождению: в вирусе (v - virus) или в клетке (c - cellula), а также по характеру опухоли (src, sis, myc, erb и т.д.); например, v-src - вирус саркомы Рауса; c-myc - клеточный онкоген миелоцитарного лейкоза; c-erb - клеточный онкоген эритробластоза; v-sis - вирус саркомы обезьян.
Продуктами протоонкогенов являются белки, которые имеют различную локализацию в клетке. Белки, кодируемые протоонкогенами src и ras, связаны с клеточной мембраной; erbB или fmc - с плазматической и внутриклеточной мембранами; erbA или mos расположены в цитоплазме; myc, fos, jun или myb - в клеточном ядре; sis секретируется во внешнюю среду. Белки, кодируемые протоонкогенами, непосредственно участвуют в проведении ростстимулирующих сигналов, побуждающих клетку к делению. В литературе достаточно подробно описана цепь последовательных сигналов для нормального роста и функционирования клеток. Все ключевые белки, участвующие в этой цепи, кодируются протоонкогенами. Например, рецептор эпидермального фактора роста кодируется протоонкогеном erbB, тирозиновая протеинкиназа на внутренней поверхности плазматической мембраны клетки - протоонкогеном src, G-белки - протоонкогеном семейства ras,
ядерные транскрипционные факторы являются продуктами протоонкогенов fos, jun, myc.
В результате мутационного превращения протоонкогенов в онкогены одно или несколько звеньев этой цепи спонтанно становятся сверхактивными. Так, например, аномальная форма рецептора эпидермального фактора роста (ЭФР) приводит к тому, что такой рецептор постоянно находится в состоянии активации, посылая ложные сигналы, стимулирующие размножение клеток. G-белки, утратившие способность гидролизовать гуанидинтрифосфат в гуанидиндифосфат, остаются постоянно связанными с гуанидинтрифосфатом и непрерывно передают ростстимулирующий сигнал. Связанные с плазматической мембраной и цитоплазматические протеинкиназы могут стать постоянно активированными без необходимости в стимуляции. Может резко возрасти количество или повыситься функциональная активность транскрипционных факторов, влияющих на экспрессию генов, побуждающих клетку к делению. Следствием этих нарушений является неконтролируемое деление клеток, что характеризует опухоли. Поэтому считается, что протоонкогены осуществляют позитивную регуляцию процесса пролиферации. Блокирование же любого из этапов передачи митогенного сигнала может в принципе привести к нарушению регуляции пролиферации опухолевых клеток и потенциально к торможению роста опухоли. В эксперименте уже исследовано достаточно большое количество препаратов, влияющих на вышеперечисленные процессы. Большинство из них находится на стадии предклинического изучения, хотя ряд препаратов уже прошли первую фазу клинических испытаний и показали себя достаточно эффективными при некоторых видах опухолей.
Выделяют несколько механизмов трансформации протоонкогена в онкоген: 1) инсерционная активация - активация протоонкогена клетки при включении в ее геном вирусного промотора; 2) амплификация - в результате умножения (копирования) числа одинаковых протоонкогенов, которые, как и в первом случае, приводят к усилению синтеза онкобелков (так называемый эффект дозы), при этом могут появляться добавочные участки хромосомы; 3) активация протоонкогена при транслокации участка хромосомы в другое место той же или другой хромосомы; 4) точечная мутация протоонкогена, приводящая к синтезу онкобелков, которые нарушают регуляцию клеточного деления.
Описанные нарушения генома могут быть вызваны различными канцерогенными факторами: химическими, физическими (уль-
трафиолетовое и ионизирующее излучение) и др. В дальнейшем при прогрессировании опухоли частота мутаций, транслокаций и других хромосомных нарушений, выявляемых в опухолевых клетках, значительно возрастает, и это является следствием утраты контроля над стабильностью генома, что свойственно опухолевым клеткам.
Мутация обычно возникает в одной из двух копий (аллелей) протоонкогена, располагающихся в парных хромосомах, и проявляется как доминантная. Таким образом, одной мутации достаточно для превращения протоонкогена в действующий онкоген. Для многих типов опухолей характерна гиперэкспрессия онкогенов семейства ras в результате точечных мутаций. Так, мутация гена k-ras отмечается в 60-80% случаев рака поджелудочной железы, и поэтому обнаружение этой мутации имеет диагностическое значение. В клетках плоскоклеточной карциномы обнаруживается гиперэкспрессия онкогена erbB-1 в результате амплификации. Для хронического миелоидного лейкоза характерна транслокация гена abl с 9-й на 22-ю хромосому с укорочением последней (так называемая филадельфийская хромосома). Лимфома Беркитта в значительной мере обусловлена перемещением протоонкогена myc на другую хромосому и попаданием под его контроль энхансера гена, кодирующего цепи иммуноглобулина. В результате клетка вместо «включения» генов для синтеза антител «включает» онкоген myc, что усиливает пролиферацию. Вызванное транслокацией (между 15-й и 17-й хромосомами) соединение части протоонкогена pml с геном, кодирующим клеточный рецептор ретиноевой кислоты, ведет к образованию гибридного гена, обусловливающего развитие острого промиелоцитарного лейкоза. Эта транслокация служит диагностическим признаком данного заболевания. В табл. 13-2 представлены данные исследований о некоторых изменениях протоонкогенов, характерных для новообразований человека.
Изменения в геноме клетки могут быть также вызваны онкогенными вирусами. РНК-содержащие вирусы содержат онкогены, образовавшиеся, по-видимому, из клеточных протоонкогенов, захваченных когда-то вирусами. В случае заражения ретровирусами в клетку вносится готовый онкоген. Одним из механизмов опухольтрансформирующего действия ДНК-содержащих вирусов является способность некоторых белков, кодируемых специфическими генами этих вирусов, инактивировать антионкогены в клетках.
Таблица 13-2. Некоторые изменения протоонкогенов, характерные для новообразований у человека (по Б.П. Копнину, 2000)
Протоонкогены | Функция белка | Изменения | Новообразования |
RET (GDNF-R) | Рецепторная тирозинкиназа | Точечные активирующие мутации. Рекомбинации, образующие химерные гены Ret/ ptc, кодирующие постоянно активированный рецептор | Синдромы множественных эндокринных неоплазий (MEN2a, MEN2b), медуллярный и папиллярный рак щитовидной железы* |
ERBB1 (EGF-R) | Рецепторная тирозинкиназа | Амплификация и гиперэкспрессия гена | Глиобластомы и другие нейрогенные опухоли |
ERBB2 (HER2) | Рецепторная тирозинкиназа | Амплификация и/ или гиперэкспрессия гена | Рак молочной железы |
PGDF-Rb | Рецепторная тирозинкиназа | Хромосомные транслокации, образующие химерные гены TEL/PDGF-Rb, CVE6/ PDGF- Rb, кодирующие постоянно активированные рецепторы | Хронический миеломоно- цитарный лейкоз, острый миелобластный лейкоз |
SRC | Нерецепторная тирозинкиназа | Мутации в кодоне 531, отменяющие негативную регуляцию киназной активности | Часть опухолей толстого кишечника на поздних стадиях |
K-RAS, N-RAS, H-RAS | Участвуют в передаче митогенных сигналов и регуляции морфогенетических реакций | Мутации в кодонах 12, 13, 61, вызывающие образование постоянно активированной GTP-связанной формы ras | 60-80% случаев рака поджелудочной железы; 25-30% различных солидных опухолей и лейкозов |
Продолжение табл. 13-2
PRADI/ циклин D1 | Регулирует клеточный цикл | Амплификация и/или гиперэкспрессия гена | Рак молочной и слюнных желез |
C-MYC | Фактор транскрипции, регулирует клеточный цикл и активность теломеразы | Хромосомные транслокации, перемещающие ген под контроль регуляторных элементов генов иммуноглобулинов. Амплификация и/ или гиперэкспрессия гена; мутации, стабилизирующие белок | 1. Лимфома Беркитта 2. Многие формы новообразований |
CTNNB1 (β-катенин) | Транскрипционный фактор, регулирует с-MYC и циклин D1. Связываясь с кадхерином, участвует в образовании адгезионных контактов | Мутации, увеличивающие количество несвязанного с Е-кадхерином β-катенина, который функционирует как транскрипционный фактор | Наследственный аденоматозный полипоз толстой кишки; различные формы спорадических опухолей |
BCL2 | Подавляет апоптоз, регулируя проницаемость митохон- дриальных и ядерных мембран | Хромосомные транслокации, перемещающие ген под контроль регуляторных элементов генов иммуноглобулинов | Фолликулярная лимфома |
ABL | Регулирует клеточный цикл и апоптоз | Хромосомные транслокации, ведущие к образованию химерных генов BCR/ABL, продукты которых стимулируют пролиферацию клеток и подавляют апоптоз | Все хронические миелоидные лейкозы, часть острых лимфобластных лейкозов |
Окончание табл. 13-2 | |||
MDM2 | Инактивирует опухолевые супрессоры р53 и pRb | Амплификация и/ или гиперэкспрессия гена | Часть остеосарком и сарком мягких тканей |
* Выделены наследственные формы заболеваний, возникающие при мутациях в половых клетках; в остальных случаях мутации происходят в соматических клетках, которые образуют опухоли.
Антионкогены - гены-супрессоры клеточного деления. Их известно около двух десятков, они действуют как ингибиторы проведения рострегулирующих сигналов в клетке и тем самым предупреждают возможность нерегулируемой пролиферации. Поэтому считается, что антионкогены осуществляют негативную регуляцию пролиферации. Инактивация антионкогенов, вызванная их мутациями (точковыми мутациями и делециями), приводит к неконтролируемому росту клеток. Для выключения антионкогена необходимы две мутации в обоих его аллелях (так как антионкогены - рецессивны), тогда как для превращения протоонкогена в действующий онкоген достаточно только одной (доминантной) мутации. Наличие первой мутации в одном из аллелей антионкогенов предрасполагает к возникновению опухоли, и если такой мутантный аллель унаследован, то достаточно второй мутации, чтобы произошла опухолевая трансформация.
Антионкогены осуществляют роль негативных регуляторов прохождения клетки по клеточному циклу, конечным результатом которого является митоз. Под клеточным циклом понимается упорядоченная последовательность событий от одного клеточного деления до другого. Как известно, клеточный цикл разделяется на 4 дискретных временных периода: G1, S, G2 и М. В фазе S (синтетическая фаза) происходит репликация ДНК; фаза М - митоз; G1 и G2 - промежутки соответственно между М и S и между S и М. Временной механизм прохождения клеткой этого цикла контролируется синтезом и распадом специальных белков - циклинов. Их экспрессия периодически возрастает в течение одной фазы клеточного цикла и затем снижается в другой фазе. Циклины группы В накапливаются в G2-фазе и распадаются в М, циклины Е и D действуют в G1-фазе, циклины А - в S-фазе. Циклины образуют комплексы с так называемыми циклинзависимыми протеинкиназами (ЦЗПК) разных типов. Образование комплексов циклина Е
с ЦЗПК-2 и циклина D с ЦЗПК-4 вызывает фосфорилирование нескольких белков, необходимых для вхождения клетки в S-фазу цикла. Одним из таких белков является продукт антионкогена Rb, с интактивацией которого связано развитие ретинобластомы в раннем детском возрасте и наследственной формы остеосаркомы. Когда этот белок не фосфорилирован, он связан с транскрипционными факторами, которые включают гены, регулирующие репликацию ДНК в S-фазе. Связь этих транскрипционных факторов с белком антионкогена Rb лишает их активности, что препятствует дальнейшему продвижению по циклу клеток, находящихся в G1-фазе. При фосфорилировании белка Rb транскрипционные факторы освобождаются и вызывают вступление клетки в S-фазу. Таким образом, в норме антионкоген Rb осуществляет негативный контроль пролиферации, разрешая или не разрешая клеткам вхождение в фазу репликации ДНК (S-фазу клеточного цикла). Утрата этой функции в результате инактивации антионкогена Rb (его мутации) приводит к тому, что транскрипционные факторы остаются несвязанными, и клетка безостановочно «пробегает» по циклу даже в тех случаях, когда действует запрет на пролиферацию.
Другим антионкогеном, выполняющим в клетке рострегулирующую функцию, является p53. Белок, кодируемый этим антионкогеном, локализован в ядре и является транскрипционным фактором, который включает ряд генов, в том числе и ген waf1. Продукт последнего инактивирует комплексы циклина Е с ЦЗПК-2 и циклина D - с ЦЗПК-4, необходимые для вхождения клетки в S-фазу цикла, в результате чего клетка задерживается в G1-фазе. Мутация антионкогена р53, как и Rb, приводит к нарушению этой регуляции и к безостановочному делению клетки. В норме антионкоген р53 препятствует вхождению в S-фазу клеток с поврежденной или измененной ДНК, поддерживая таким образом целостность клеточного генома. Эту функцию он реализует двумя способами: 1) временно задерживая клетку в G1-фазе цикла, давая ей возможность исправить повреждения ДНК прежде, чем клетка вступит в S-фазу; 2) запуская механизм апоптоза (программируемой гибели клетки) в тех случаях, когда повреждения ДНК столь серьезны, что не подлежат исправлению. Индукция апоптоза в аномальных клетках - чрезвычайно важная функция антионкогена р53. Благодаря апоптозу исключается возможность передачи серьезных поломок ДНК в поколениях клеток. В случае нарушения этой функции р53
происходит накопление клеток с различными хромосомными повреждениями, что является характерным для клеток опухолей.
Мутации антионкогена р53 выявляются примерно в 60% злокачественных опухолей у человека. У людей с врожденной мутацией одного из аллелей р53 опухоли (саркомы, лимфолейкозы, рак молочной железы) обнаруживаются в молодом возрасте с вероятностью 100% (семейный синдром Ли-Фраумени). Антионкоген р53 во многом определяет реакции опухоли на химио- и/или лучевую терапию. В тех опухолях, где р53 не изменен и нормально функционирует, повреждение ДНК под влиянием химиотерапии или облучения вызывает апоптоз опухолевых клеток. В опухолях с инактивированным р53 индуцированные повреждения ДНК не приводят к апоптозу, и такие опухоли резистентны к химио- и лучевой терапии.
Из других антионкогенов, с инактивацией которых связывают возникновение определенных опухолей, можно назвать АРС (семейный аденоматозный полипоз толстого кишечника), WT1 (опухоль Вильмса), NF1 (нейрофиброматоз Реклингаузена) и некоторые другие, которые представлены в табл. 13-3.
Таблица 13-3. Формы опухолей человека, возникающие при инактивации некоторых опухолевых супрессоров и мутаторных генов (по Б.П. Копни-
ну, 2000)
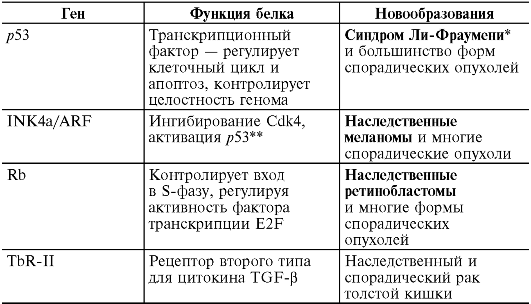 Продолжение табл. 13-3
Продолжение табл. 13-3
SMAD2, SMAD3 | Передают сигнал от активированных рецепторов TGF-β к Smad 4 | Рак толстой кишки, легкого, поджелудочной железы |
SMAD4/DPC4 | Транскрипционный фактор - опосредует действие цитокина TGF-β, приводящее к активации ингибиторов Cdk-p21wafl, p27kipl, pl5ink4b | Ювенильный гамартоматозный полипоз желудка и кишечника и различные формы спорадических опухолей |
Е-кадхерин | Участвует в межклеточных взаимодействиях, инициирует передачу сигналов, активирующих p53, p27kipl | Наследственный рак желудка и многие формы спорадических опухолей |
APC | Связывает и разрушает цитоплазматический β-катенин, препятствует образованию транскрипционных комплексов β-катенин/ Tcf | Наследственный аденоматозный полипоз и спорадические опухоли толстой кишки |
VHL | Подавляет экспрессию гена VEGF (фактора роста эндотелия сосудов) и других генов, активируемых при гипоксии | Синдром фон Хиппеля- Линдау (множественные гемангиомы), светлоклеточные карциномы почки |
WT1 | Транскрипционный фактор - связываясь с p53, модулирует экспрессию p53- респонсивных генов | Наследственные нефробластомы (опухоль Вилмса) |
PTEN/MMACI | Фосфатаза; стимулирует апоптоз, подавляя активность PI3K-PKB/ Akt сигнального пути | Болезнь Коудена (множественные гамартомы) и многие спорадические опухоли |
NF1 (нейрофибромин) | Белок семейства GAP - переводит онкоген ras из активной в неактивную форму | Нейрофиброматоз первого типа |
Окончание табл. 13-3
NF2 (мерлин) | Участвует во взаимодействиях мембраны с цитоскелетом | Нейрофиброматоз второго типа: спорадические менингиомы, мезотелиомы и др. опухоли |
BRCA1 | Повышает активность p53 и других факторов транскрипции, связываясь с RAD51, участвует в узнавании и/или репарации повреждений ДНК | Наследственные опухоли молочной железы и яичников и различные формы спорадических опухолей |
BRCA2 | Транскрипционный фактор с активностью гистоновой ацетилтрансферазы; связываясь с RAD51, участвует в репарации ДНК | Наследственные опухоли молочной железы и яичников и различные формы спорадических опухолей |
MSH2, MLH1, PMS1, PMS2 | Репарация неспаренных участков ДНК (mismatch repair) | Неполипозный рак толстой кишки и яичников и многие спорадические опухоли |
* Выделены наследственные формы заболеваний, возникающие при мутациях в половых клетках; ** - локус INK4a/ARF кодирует 2 белка: p16INK4a - ингибитор циклинзависимых киназ Cdk4,6 и p19ARF (Alternative Reading Frame) - продукт альтернативной рамки считывания, который, связывая p53 и Mdm2, блокирует их взаимодействие и препятствует деградации p53. Делеции и многие точечные мутации в локусе INK4a/ARF вызывают одновременно инактивацию супрессоров обоих этих белков.
Таким образом, для появления опухоли необходимо, чтобы в одной и той же клетке возникли мутации в нескольких разных протоонкогенах (с превращением их в онкогены) и антионкогенах. Опухоли одного и того же клеточного или тканевого типа могут развиться в результате различных комбинаций мутаций в протоонкогенах и антионкогенах. Следствием этих генетических изменений является утрата контроля над клеточной пролиферацией. В итоге клетка приобретает трансформированный фенотип, включающий в себя не только нерегулируемую пролиферацию, но и целый ряд характерных изменений структуры и обмена веществ.
Стадийность опухолевого процесса. Предполагается, что опухоль развивается из единичной клетки, которая в процессе роста опухоли проходит ряд стадий.
На I стадии (стадия инициации) под влиянием канцерогенных факторов из одной нормальной исходной клетки в результате стойкого необратимого нарушения генетического материала образуется одна трансформированная клетка. Этот процесс называется опухолевой трансформацией. Канцерогены взаимодействуют с локусами ДНК, содержащими гены, которые регулируют пролиферацию (протоонкогены и антионкогены). Происходит экспрессия протоонкогенов, преобразующихся в онкогены, и инактивация антионкогенов. Вследствие этого клетка становится иммортализованной и потенциально способной к неограниченному делению, но для этого требуется ряд дополнительных условий.
На II стадии (стадия промоции, или активации) происходит активация транформированной клетки под влиянием промотора и последующее превращение ее в активную, пролиферирующую опухолевую клетку. Промоторы - это вещества, которые не являются канцерогенами, не повреждают ДНК, но их воздействие стимулирует пролиферацию уже имеющихся трансформированных клеток. Главное в промоции - стимуляция клеточного деления, вследствие чего создается критическая масса инициированных клеток. К промоторам относятся фенол, скипидар, карболовый эфир и др.
Присутствие промотора, однако, необязательно для индукции опухоли. Он необходим только в случае действия так называемого неполного канцерогена или полного канцерогена, но используемого в таких низких дозах, которые обычно не вызывают опухоли. Полный канцероген, действующий на ткани в достаточно высокой дозе, обладает как инициирующим, так и промоцирующим действием. Неполными канцерогенами считаются те вещества, у которых бластомогенные свойства проявляются только после действия промоцирующего агента. В отличие от инициирующих агентов эффект промоторов может быть обратим, особенно на ранних стадиях формирования опухоли. В течение промоции инициированная клетка приобретает фенотипические свойства трансформированной клетки в результате изменений генной экспрессии (эпигенетический механизм). Однако для индукции опухоли необходимо длительное и непрерывное воздействие промотора. Следовательно, промоторы могут представлять такую же опасность для индукции опухолей, как и полные канцерогены. Так, например, промотор
н-додекан может усиливать канцерогенность бенз(а)пирена в 1000 раз. Фаза промоции в отличие от стадии инициации обратима, по крайней мере на раннем этапе неопластического процесса.
Основные положения канцерогенеза можно обобщить следующим образом:
1) для индукции опухоли недостаточно воздействия одного инициатора (канцерогена) или одного промотора;
2) действия инициатора и промотора не перекрываются во времени;
3) вероятность возникновения опухоли увеличивается в том случае, если промотор действует после инициатора, а не наоборот;
4) интервал между воздействием инициатора и промотора не влияет на возникновение опухоли;
5) индукция опухоли зависит лишь от дозы инициатора.
На III стадии (стадия прогрессии опухоли) идет естественный отбор сильнейших клонов - клональная селекция.
В возникновении опухолевого процесса важное значение имеет возрастная и половая реактивность. С возрастом скорость репарации ДНК снижается и одновременно увеличивается частота мутаций и хромосомных аберраций, особенно при наличии сопутствующих заболеваний и состояний, таких, как хронический стресс, атеросклероз, гипертоническая болезнь, сахарный диабет. Опухоли чаще развиваются в возрасте старше 50 лет, что объясняется увеличением продолжительности действия (суммирование во времени) внешних онкогенных факторов и снижением противоопухолевой резистентности организма. Кроме того, полагают, что в процессе старения возникают гормональные нарушения, способствующие канцерогенезу, причем это связано, по всей видимости, не с недостатком самих гормонов, а со снижением чувствительности центрального (гипоталамо-гипофизарного) звена к действию соответствующего периферического гормона по механизму отрицательной обратной связи. Поэтому не только введение гормонов с лечебной целью, но и нарушение гормонального гомеостаза, вызванное изменениями в функционировании нейроэндокринной системы, способствует развитию рака. Так, повышение концентрации фолликулостимулирующего гормона в крови с возрастом приводит к увеличению частоты возникновения опухолей яичников. Относительное преобладание эстрогенов над прогестероном в период предменопаузы способствует развитию рака молочной железы и эндометрия.
13.3.6. Взаимоотношение опухоли и организма
Проблема взаимоотношения опухоли и организма является одной из центральных в современной онкологии. Она включает два аспекта: 1) влияние опухоли на организм и 2) влияние организма на опухоль.
Влияние опухоли на организм. Паранеопластические синдромы
Паранеопластические синдромы - это совокупность признаков (симптомов), возникающих при выявлении опухоли, сопровождающих ее течение и исчезающих после удаления новообразования. Многие паранеопластические синдромы неспецифичны для определенных видов опухолей, могут возникать за месяцы и годы до развития клинических проявлений опухолевого процесса. Следовательно, многие стойкие отклонения в клинической картине должны вызывать онкологическую настороженность врача. Паранеопластические синдромы подразделяют на кожные, неврологические, психоневрологические, параэндокринные (см. раздел 13.3.4), метаболические (с развитием раковой кахексии), гематологические, сосудистые, почечные, костные, иммунодепрессию (с повышенной подверженностью к инфекционным заболеваниям) и др.
Среди кожных проявлений паранеопластического синдрома следует отметить эритему Гаммела, чернеющий акантоз, акро- и гиперкератоз, кожную порфирию, ихтиоз, гипертрихоз, псориаз, кожный зуд неясной этиологии, дерматомиозит. К группе неврологических проявлений паранеопластического синдрома относят мионейропатии (при миеломе, раке легкого и молочной железы), полиневриты, а также синдромы, напоминающие миастению. Часто при раке молочной железы, плоскоклеточном раке почки, яичка, щитовидной железы выявляется паранеопластический синдром гиперкальциемии, который сопровождается развитием неврологических проявлений при отсутствии видимых поражений метастазами костной системы. При аденоме паращитовидных желез и раке легкого отмечаются гиперкальциемия и остеопороз. Конкретным примером паранеопластического синдрома может служить карциноидный синдром, который проявляется усиленной продукцией серотонина, гистамина, ряда нейромедиаторов, гормонов, вызывающих клинические проявления в виде сосудистых изменений.
Среди признаков гематологического паранеопластического синдрома выделяют анемию, не связанную с кровопотерей, эритроцитоз, полиглобулию (почечно-клеточный рак почки, опухоль Вильмса, рак надпочечников). Нередко при опухолях наблюдаются эозинофилия, моноцитоз, тромбоцитоз, лейкоцитоз, повышение СОЭ, нарушения системы свертывания крови - у большинства онкологических больных свертываемость крови повышена. Необходимо подчеркнуть, что факторы свертывающей и противосвертывающей систем крови могут способствовать инвазии опухолевых клеток в окружающие ткани, возникновению и стимуляции роста метастазов.
Продукты распада опухоли вызывают системную неспецифическую реакцию, заключающуюся в общей интоксикации организма, лихорадке. Продуцируемые злокачественными новообразованиями эктопические гормоны, нейромедиаторы, факторы роста могут влиять на клиническое течение и прогноз опухолевого процесса, а также использоваться в дифференциальной диагностике заболеваний.
Опухолевые маркеры
Начало изучения опухолевых маркеров было весьма обнадеживающим. Уже в конце XIX в. в моче больных множественной миеломой были обнаружены специфические белки (иммуноглобулины), получившие название «белки Бенс-Джонса», однако следующего успеха пришлось ждать более 80 лет. Он связан с открытием Г.И. Абелевым и Ю.С. Татариновым α-фетопротеина в крови больных гепатомой. Эти исследования положили начало новому этапу в изучении факторов, ассоциированных с ростом злокачественных опухолей, и привели к открытию в ХХ столетии серии различных соединений, получивших название «опухолевые маркеры». Маркеры широко используются клиническими биохимиками для выявления первичной опухоли и ее метастазов. К маркерам злокачественного роста относят вещества различной природы. В их число входит более 200 соединений: антигены, гормоны, ферменты, гликопротеины, липиды, белки, метаболиты, концентрация которых коррелирует с массой опухоли, ее пролиферативной активностью, а в некоторых случаях - со степенью злокачественности новообразования. Аномальная экспрессия генома - один из основных механизмов продукции маркеров опухолевыми клетка-
ми, который обусловливает синтез эмбриональных, плацентарных и эктопических белков, ферментов, антигенов и гормонов.
В качестве «идеальных тестов» для ранней диагностики злокачественных опухолей предлагалось множество маркеров, однако эта проблема до настоящего времени остается нерешенной. Сложности обусловлены многообразием требований, предъявляемых к «идеальному маркеру». Идеальный опухолевый маркер должен продуцироваться опухолевой клеткой в достаточных количествах, чтобы его можно было определить с помощью современных методов. Он не должен присутствовать у здоровых людей и при доброкачественных опухолях, но должен выявляться на ранних стадиях опухолевого процесса еще до клинических проявлений опухоли. Количество опухолевого маркера должно быть прямо пропорционально объему опухоли, а его уровень должен коррелировать с результатами противоопухолевого лечения.
В клинических исследованиях используется ряд достаточно эффективных «опухолевых маркеров», которые, однако, не всегда соответствуют всем вышеуказанным критериям в полной мере. Современные биохимические и иммунологические методы позволяют выявить новообразования, когда число опухолевых клеток достигает 109-1010, а минимальный уровень секретируемого опухолью маркера - от одного до нескольких фемтомолей в 1,0 мл сыворотки крови. Большая эффективность использования опухолевых маркеров в клинике может быть достигнута путем комбинации разных тестов. Следует отметить, что количество предлагаемых маркеров для диагностики и мониторинга злокачественных новообразований постоянно увеличивается, и наступает этап критической их переоценки с целью формирования стратегии и адекватного использования. Большинство опухолевых маркеров в достаточной степени изучено (см. табл. 13-4, 13-5). Из числа недавних успехов клинической биохимии следует отметить разработку и внедрение в практическую онкологию маркеров костного ремоделирования (пиридинолина, дезоксипиридинолина), поскольку кости скелета относятся к одной из наиболее распространенных локализаций метастазирования злокачественных опухолей. Биохимические методы диагностики метастазов в кости необходимы для правильного планирования лечебных мероприятий, определения стадии основного заболевания и оценки прогноза.
Таблица 13-4. Маркеры злокачественного роста

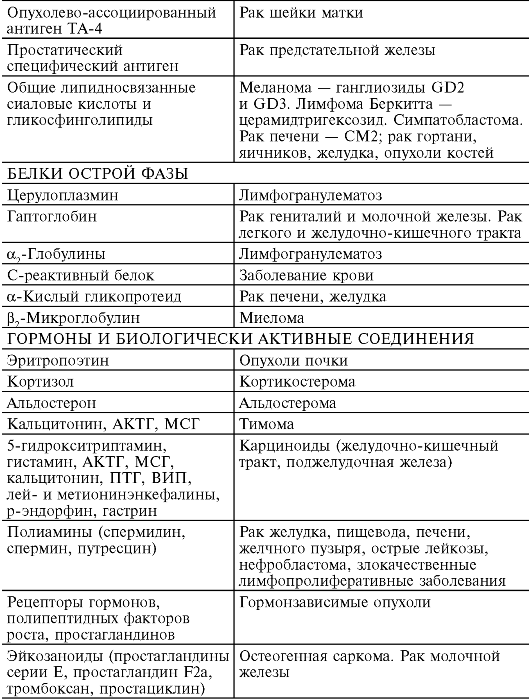
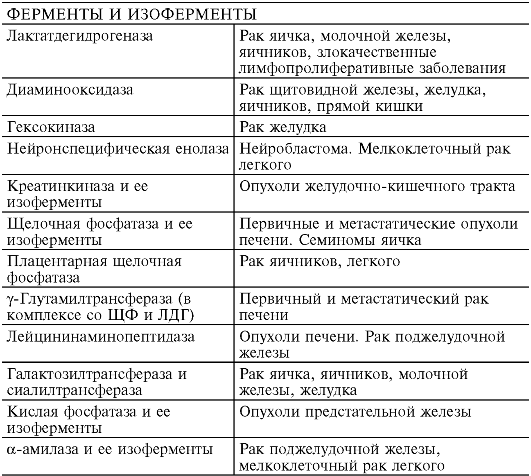 Примечание.
Здесь и в табл. 13-5: АКТГ - аденокортикотропный гормон; ВИП -
вазоактивный интестинальный пептид; ЛДГ - лактатдегидрогеназа; МСГ -
меланоцитстимулирующий гормон; ПТГ - паратиреоидный гормон; ЩФ -
щелочная фосфатаза.
Примечание.
Здесь и в табл. 13-5: АКТГ - аденокортикотропный гормон; ВИП -
вазоактивный интестинальный пептид; ЛДГ - лактатдегидрогеназа; МСГ -
меланоцитстимулирующий гормон; ПТГ - паратиреоидный гормон; ЩФ -
щелочная фосфатаза.
Таблица 13-5. Гормоны, секретируемые опухолями, и вызываемые ими синдромы
Секретируемый гормон | Клинический синдром | Локализация, вид опухоли |
Кортикотропин (АКТГ) | Синдром Иценко- Кушинга | Аденомы гипофиза, опухоли надпочечников |
β-Эндорфин | Аденомы гипофиза, феохромоцитомы надпочечников |
Продолжение табл. 13-5
Энкефалины | Аденомы гипофиза, феохромоцитомы надпочечников | |
Катехоламины и их метаболиты | Феохромоцитомы надпочечников. Хемодектома, ганглионейрома, нейробластома | |
Инсулин | Гипогликемия | Инсулиномы поджелудочной железы |
Глюкагон | Гипергликемия | Глюкагономы поджелудочной железы |
Панкреатический полипептид (ПП) | Опухоли поджелудочной железы | |
ВИП | Синдром «водной диареи» | ВИПы поджелудочной железы |
Соматостатин | Соматостатиномы поджелудочной железы | |
Кальцитонин | Медуллярные карциномы щитовидной железы | |
КТ, гастрин, ВИП, инсулин, ПП | Синдром Вермера | МЭН-I: опухоли гипофиза, поджелудочной и паращитовидных желез |
КТ, катехоламины, ПТГ | Синдром Сиппла | МЭН-II: медуллярный рак щитовидной и паращитовидной желез, феохромоцитомы надпочечников |
ОПУХОЛИ ЭНДОКРИННЫХ ЖЕЛЕЗ НЕ ИЗ КЛЕТОК APUD- СИСТЕМЫ | ||
Гормон роста | Гигантизмакромегалия | Аденомы гипофиза |
Пролактин | Аменорея-галакторея | Пролактиномы гипофиза |
Тиреотропин | Гипертиреоидизм | Аденомы гипофиза |
ЛГ | Аденомы гипофиза | |
ФСГ | Аденомы гипофиза | |
ПТГ | Опухоли паращитовидных желез | |
Хорионический гонадотропин | Трофобластические опухоли | |
Окончание табл. 13-5
АКТГ, β-эндорфин, энкефалины, β-ЛПТ, α-МСГ | Опухоли легкого, яичника, щитовидной, молочной, паращитовидных, поджелудочной желез, желудочно-кишечного тракта, пищевода, тимомы, параганглиомы надпочечников | |
Кортикотропинрилизинг-фактор | Опухоли легкого, яичника | |
Кальцитонин | Опухоли легкого, молочной и поджелудочной желез, почек, желудочнокишечного тракта | |
Инсулин | Гипогликемия | Опухоли легкого, почек, молочной железы, шейки матки |
Вазопрессин | Опухоли легкого, вилочковой железы, яичка, желчного пузыря | |
Глюкагон | Гипергликемия | Опухоли почек, яичников, легкого |
ВИП | Синдром «водной диареи» | ВИПы желудочнокишечного тракта, эпидермиса, феохромоцитомы надпочечников |
Примечание. ЛГ - лютеинизирующий гормон, ЛПТ - липотрофин, ФСГ - фолликулостимулирующий гормон.
Раковая кахексия
Термин «кахексия» (от греч. kakos - плохой и hexis - состояние) обозначает состояние общего истощения организма, потери массы тела за счет мышечной и жировой ткани и встречается при различных заболеваниях. У онкологических больных кахексия характеризуется анорексией, отвращением к пище, снижением массы тела, анемией, мышечной слабостью, при этом наблюдается интенсивный распад жиров и белков в организме, в результате чего наступает смерть.
Растущая в организме опухоль затрагивает многие стороны деятельности организма, оказывает существенное влияние на различ-
ные его функции. Для интенсивных синтетических процессов в ходе пролиферации опухолью потребляется огромное количество энергии, которую она получает за счет гликолиза, определяющего большой расход глюкозы. Общеизвестно, что опухоль - «ловушка глюкозы» (рис. 13-9). Поэтому в организме возникает угроза гипогликемии, что сопровождается активацией компенсаторно-
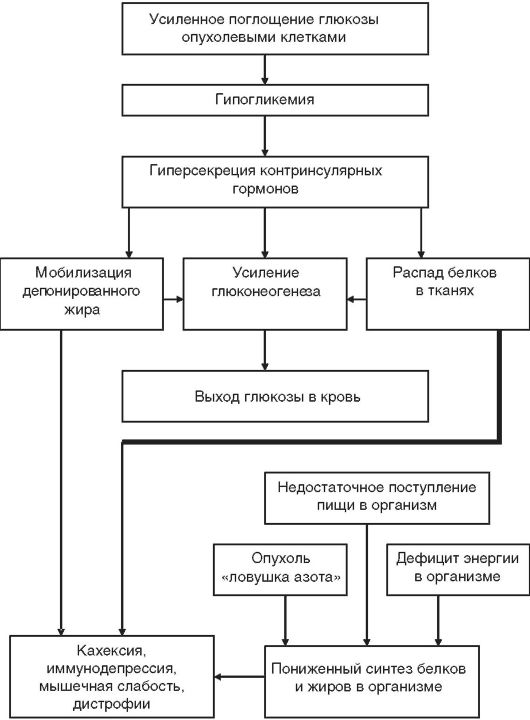 Рис. 13-9. Патогенез раковой кахексии
Рис. 13-9. Патогенез раковой кахексии
приспособительных механизмов. Усиливается продукция контринсулярных гормонов. Это приводит к усиленному распаду гликогена в печени и в мышцах, к распаду белков и жиров в тканях и органах организма для усиления процессов глюконеогенеза. Все это обеспечивает сохранение нормогликемии в течение достаточно длительного времени. Указанная компенсация так называемого «гипогликемического давления опухоли на организм» (по В.С. Шапоту) имеет нежелательные последствия для организма. Отмечается повышенный распад лимфоидной ткани, что сопровождается развитием иммунодефицитного состояния, тем более что процесс синтеза антител в организме при гипогликемии снижен. Кроме этого имеется повышенный распад мышечной ткани, в результате у больных развиваются дистрофические изменения в мышцах, мышечная слабость.
В организме-опухоленосителе ограничены возможности синтеза собственных белков и жиров, что усугубляет дистрофию тканей (мышечной, лимфоидной и др.) и кахексию. Это объясняется энергодефицитом (из-за гипогликемии), использованием метаболитов (аминокислот) для глюконеогенеза и снижением поступления питательных веществ в организм из-за анорексии, возникающей у онкологических больных.
Многие биологически активные вещества, выделяемые опухолями и нормальными клетками организма, способны влиять на развитие кахексии при онкологической патологии. К ним относятся цитокины, неконтролируемое выделение которых может быть одной из причин изменения обмена веществ в организмеопухоленосителе. Высказываются предположения о том, что TNF-α, IL-6 и γ-интерферон, повышенная экспрессия которых часто определяется при кахексии, могут выступать в качестве медиаторов этого процесса, способствуя развитию интоксикации, анорексии, снижению массы тела. При кахексии перечисленные цитокины определяются в повышенном количестве не только в опухоли, но и в циркулирующих жидкостях, а при снижении их содержания возможно обратное развитие кахексии.
В развитии кахексии, вызванной онкологической патологией, определенную роль может играть фактор мобилизации липидов, который осуществляет прямой гидролиз триглицеридов в жировой ткани до глицерина и неэстерифицированных жирных кислот. Введение сыворотки крови мышей с лимфомой здоровым особям вызывало массивную мобилизацию жиров. Фактор мобилизации
липидов присутствовал и в опухолевой ткани, и в культуре клеток лимфомы. Дальнейшие исследования показали, что это стабильный протеин с молекулярной массой около 5 кД, состоящий из двух субъединиц с высокой и низкой молекулярной массой. Он термостабилен, не реагирует на воздействие липазы, разрушается трипсином c образованием низкомолекулярной субъединицы, резистентной к воздействию протеолитических ферментов. Позже фактор мобилизации липидов был назван токсогормоном L. Его определили в асцитической жидкости больных гепатомой и у мышей с саркомой-180. Соединение с аналогичными характеристиками присутствовало в сыворотке крови больных с клиническими проявлениями онкологической кахексии и отсутствовало у здоровых пациентов. Оно также не было обнаружено у больных со значительным снижением массы тела при болезни Альцгеймера. Содержание фактора мобилизации липидов в сыворотке крови больных злокачественными опухолями коррелировало со снижением массы тела, а при эффективном лечении уровень определяемого фактора снижался.
Несмотря на большое число исследований по изучению механизмов развития кахексии при раке, медиатор этого состояния до настоящего времени не выявлен. На первый взгляд кахексия представляется невыгодным состоянием для опухоли, так как смерть организма ведет и к умиранию опухоли. Однако рост новообразования сильно зависит от экзогенного поступления липидов и аминокислот, поэтому выработка опухолью факторов, способствующих процессам катаболизма тканей, необходима для повышения метаболизма в ней самой. В этом случае ингибиторы кахексии при раке с помощью отграничения опухоли от главного энергетического материала, вероятно, могут вызвать снижение опухолевого роста. Все полученные результаты и высказанные исследователями предположения, возможно, помогут разработать новые подходы к лечению опухолей.
Влияние организма на опухоль. Противоопухолевая резистентность организма
Механизмы противоопухолевой защиты организма функционируют на всех этапах развития опухолевого процесса. В свою очередь, опухоль довольно успешно защищается от действия противоопухолевых механизмов организма путем изоляции клеток от их влияния, а также нарушением работы самих этих механизмов, и в
первую очередь иммунных. Многие исследователи связывают начало развития опухолевого процесса с нарушениями механизмов противоопухолевой резистентности организма. Подтверждением этому является более частое развитие опухолей у человека при наследственных иммунодефицитах.
Механизмы противоопухолевой резистентности подразделяются на следующие группы:
1. Антиканцерогенные механизмы направлены на защиту организма от действия канцерогенных факторов.
Существуют различные механизмы, которые удаляют или предупреждают действие физических, химических и биологических канцерогенных факторов. Так, например, эффект различных видов ионизирующего излучения, сопровождающийся усиленным образованием губительных для клетки свободных радикалов кислорода, ткани организма устраняют различными антиоксидантами. Выявлена активация ряда микросомальных ферментов (например, в печени) и антиоксидантов при попадании в организм химических канцерогенов с целью предотвращения образования активного их метаболита и/или ускорения обезвреживания самого бластомогенного фактора. Важное место среди этих антиканцерогенных веществ занимают ингибиторы β-глюкуронидазы, которые предотвращают распад глюкуронидов и высвобождение канцерогенных соединений. Если химические канцерогены имеют свойства гаптенов, они могут инактивироваться антителами и в последующем фагоцитироваться. Биологические канцерогенные агенты, в частности онкогенные вирусы, могут быть ингибированы специфическими противовирусными антителами и интерфероном. Натуральные киллеры уничтожают комплекс «вирус+клетка» путем продукции активных форм кислорода, перекиси водорода, лизосомальных ферментов, протеаз и фосфолипаз. Кроме того, инактивация канцерогенов осуществляется за счет их выведения из организма почками (в составе мочи), печенью (в составе желчи), кишечником (в составе кала), потовыми железами (в составе пота).
2. Антимутационные механизмы направлены на предотвращение трансформации нормальных клеток в опухолевые, это требует подавления активности онкогенов.
На этапе возникновения онкогенов клетка активирует антионкогенные механизмы (супрессорные гены). Генетический фонд клетки защищен мощным ферментным аппаратом, обеспечиваю-
щим восстановление (репарацию) ДНК. С помощью эндо- и экзонуклеаз, щелочных фосфатаз и ДНК-полимераз клетки вырезают измененные нуклеотиды и за счет соответствующих комплементарных участков второй нити ДНК (если она не повреждена) воссоздают исходную, генетически запрограммированную нуклеотидную последовательность поврежденной нити. Особенно важна в этих механизмах роль гена-супрессора клеточного деления (антионкогена) р53 (см. раздел 13.3.5). Практически все известные канцерогены индуцируют в клетках репаративный синтез ДНК.
3. Антицеллюлярные механизмы направлены на обнаружение и уничтожение уже возникших опухолевых клеток.
При появлении опухолевых клеток включаются как неиммунные, так и иммунные механизмы, которые направлены на уничтожение или предупреждение их размножения. Защита хозяина включает механизмы распознавания и элиминации мутантных, трансформированных и опухолевых клеток эффекторами системы врожденной неспецифической резистентности и специфического противоопухолевого иммунитета в случае антигенных опухолей. Неспецифическое распознавание опухолевых клеток эффекторами неспецифической резистентности и подавление их роста связаны с комплексом межклеточных взаимодействий и индукцией сети различных цитокинов, создаваемой при кооперации дендритных клеток, активированных макрофагов, NK-клеток, нейтрофилов и опухолевых клеток. Преимуществом системы неспецифической резистентности по сравнению со специфическим противоопухолевым иммунитетом является ее постоянная готовность распознавать единичные опухолевые клетки независимо от того, экспрессируют они специфические опухолевые антигены или нет. Наиболее эффективный контроль врожденной резистентности над возникновением первичных опухолей может осуществляться в начале латентного периода, когда число опухолевых клеток невелико, а их эволюционные генетические изменения, как правило, минимальны. В это время только немногие трансформированные клетки могут «ускользнуть» от эффективного распознавания и элиминации и начать размножаться. Однако при прогрессии опухоли с последующим естественным отбором более жизнеспособных клеток последние приобретают вторичные фенотипические свойства, которые делают их резистентными к цитотоксической активности эффекторов системы врожденной резистентности. Например, опухолевые клетки адсорбируют на своей поверхности фибриноген,
который быстро превращается в фибрин. Фибриновая пленка защищает эти клетки от противоопухолевых факторов организма. При этом среди неиммунных механизмов резистентности организма следует выделить лаброцитарный эффект, который связан со способностью тучных клеток продуцировать гепарин, препятствующий образованию зищитной фибринной пленки на поверхности опухолевых клеток. Изоляции опухолевых клеток от факторов неспецифической резистентности служат редукция микрокровообращения в ткани опухоли, ускользание их от влияний глюкокортикоидов, ингибирующих процесс пролиферации (это происходит, например, из-за уменьшения количества рецепторов для гормонов на мембране опухолевых клеток).
Специфический противоопухолевый иммунитет формируется на поздних стадиях опухолевого роста и малоактивен. Слабая антигенность опухолей (за счет антигенной дивергенции, антигенной реверсии и антигенного упрощения опухолевых клеток), развитие иммунодефицитного состояния в организме являются основными факторами, обеспечивающими неэффективность противоопухолевого иммунитета. Появление иммунодефицита в процессе развития опухоли может быть связано с эндокринно-обменными нарушениями в организме и, в частности, с увеличением продукции кортикостероидов. Их действие приводит к угнетению иммунной системы, а проявляется это в угнетении лимфопролиферации и образования антител. Нарушение иммунной системы считается одним из важных факторов и условий в возникновении, развитии и прогрессии опухолевого процесса.
13.4. ТРАНСПЛАНТАЦИЯ КЛЕТОК, ТКАНЕЙ И ОРГАНОВ
Пересадка клеток (в том числе стволовых), тканей и органов находится в центре внимания современной медицины.
Наибольшие успехи достигнуты в клеточной трансплантологии, исторически связанной с переливанием крови, отдельных ее компонентов (эритроцитов, лейкоцитов, тромбоцитов) и трансплантацией костного мозга. Первое случайно успешное переливание цельной крови ягненка 15-летнему мальчику с лихорадкой и геморрагическим синдромом было выполнено во Франции в 1667 г. профессором математики и медицины Жаном-Батистом Дени и хирургом Эммерицем. Широкое научно обоснованное применение
метода стало возможным после открытия групп крови (конец XIX - начало XX в.) и изучения иммунологической совместимости донора и реципиента-больного.
Русским исследователям принадлежат выдающиеся достижения в теоретическом, экспериментальном и клиническом развитии трансплантологии. И.И. Мечников выдвинул идею о наращивании количества клеток посредством их трансплантации в организм. М.А. Новинский впервые в мире осуществил гомо- и гетеротрансплантацию опухолей. В.П. Филатов разработал методы гомотрансплантации роговицы и кожных стеблей. Н.П. Синицын осуществил гомотрансплантацию сердца лягушки. В.И. Демихов разработал технику гомотрансплантации головы собаки, а также гомотрансплантацию передней и задней частей туловища у собак (рис. 13-10). Собаки, оперированные В.И. Демиховым, жили в отдельных случаях несколько лет. Б.В. Петровский впервые провел успешную пересадку почки у людей.
С точки зрения хирургии основные проблемы трансплантации были решены в первой половине XX в., однако в большинстве случаев со временем происходило отторжение пересаженных тканей и органов. Широкое использование метода долгое время не представлялось возможным, пока в 1944 г. английский ученый П. Медавар не доказал, что успех во многом зависит от иммунологических факторов, прежде всего от совместимости по антигенам главного комплекса гистосовместимости (HLA у человека, H-2 у мышей). После этого стала успешно развиваться и совершенство-
 Рис. 13-10. Гомотрансплантация передней части туловища у собак по В.И. Демихову
Рис. 13-10. Гомотрансплантация передней части туловища у собак по В.И. Демихову
ваться техника трансплантации костного мозга для лечения заболеваний системы крови у детей и взрослых, прежде всего лейкозов, агранулоцитозов, апластической анемии, миелодиспластического синдрома.
Существуют две главные проблемы трансплантологии:
1. Технические, этические и юридические вопросы заготовки, криоконсервации (замораживания), доставки и пересадки клеток, тканей и органов.
2. Вопросы генетической, иммунологической и морфофункциональной совместимости трансплантата. Так, наибольшее количество поверхностных трансгшантационных HLA-антигенов находится на лимфоидных клетках селезенки, лимфатических узлов и костного мозга, в меньшей степени (по убыванию концентрации) в ткани печени и легких, кишечника, почки, сердечной мышцы, желудка, аорты, мозга. Неравномерное распределение антигенов является одним из патогенетических факторов, объясняющих различный клинический успех при пересадке тех или иных органов и тканей.
В любом случае ответная реакция организма на трансплантацию является патологическим процессом, связанным с хирургической травмой, токсическим воздействием наркоза. Кроме того, пересаженная биологическая ткань, даже собственная (аутологичная), ставится в условия, неестественные по отношению к ее обычному месту существования (гетеротопия Вирхова). Р. Вирхов считал гетеротопию одним из основных условий для патологического состояния ткани.
С точки зрения иммунологии различают аутологичный, аллогенный, изогенный и ксеногенный типы трансплантации.
Аутологичная трансплантация (аутотрансплантация) собственного биологического материала позволяет избежать иммунологического конфликта. В настоящее время широко применяют пересадку кожи человека с одного места на другое для лечения ожогов. Пересаживают отрезки тонкого кишечника на место удаленного пищевода, кровеносные сосуды одному и тому же больному. Широко применяется аутотрансплантация в целях восстановительной пластики для замещения дефектов лица после ранения. В.П. Филатов ввел в практику медицины знаменитый метод, получивший название «филатовского стебля». При этом куски кожи и подкожной клетчатки вырезают из области живота или бедер, делают из них «стебель», который приживляют сначала на руке. Потом
 Рис. 13-11. Восстановление дефекта носа по В.П. Филатову - миграция ножки стебля к дефекту носа
Рис. 13-11. Восстановление дефекта носа по В.П. Филатову - миграция ножки стебля к дефекту носа
с руки стебель пересаживают на лицо и выкраивают из него нос или другие части поврежденного лица. Эффективность этого метода весьма высока, и он широко применяется в настоящее время (рис. 13-11).
Аллогенная трансплантация (аллоили гомотрансплантация) - обмен биологическим материалом между представителями одного и того же вида животных или между разными людьми, которые не являются генетически идентичными. Успех и неудача во многом определяется степенью тканевой совместимости донора и реципиента. Так, примером гомотрансплантации является переливание крови одной группы по системе АВ0. Тем не менее возможен иммунологический конфликт по другим антигенам эритроцитов. Пересадка органов и тканей (сердца, печени, почки, легких отдельно или в комбинации) от одного человека к другому также широко применяется хирургами. Однако преодолеть иммунологическую несовместимость между неродственными людьми достаточно эффективно еще не удалось. Для этой цели применяются различные подходы (см. ниже).
Изогенная трансплантация (изотрансплантация) осуществляется между генетически тождественными однояйцевыми близнецами. При пересадке биологического материала у животных одной генетически чистой линии того же пола говорят о сингенной трансплантации.
Ксеногенная трансплантация (ксеноили гетеротрансплантация) -
это пересадка тканей, клеток и органов в пределах двух разных биологических видов. Трансплантация гетерогенных клеток, тканей и органов также была предметом интенсивного изучения в начале XX в. В истории медицины известна попытка пересадки мужских половых желез от обезьян человеку с целью его омолаживания (Э. Штейнах, С. Воронов). Временный стимулирующий эффект в этих случаях определяется действием половых гормонов. Применялись для трансплантации эмбриональные клетки и ткани
животных и человека. Результаты такой терапии крайне противоречивы и носили скорее коммерческий характер, без серьезного патогенетического обоснования.
Гетеротрансплантация надпочечников, селезенки и других органов проводится в медицине с целью так называемой неспецифической стимулирующей терапии. Она не нашла широкого распространения вследствие неизбежного возникновения резкого иммунологического конфликта, связанного с сенсибилизированными лимфоцитами и специфическими антителами.
С точки зрения места пересадки выделяют:
• ортотопическую трансплантацию, когда клетки (ткань, орган) вводятся в аналогичную ткань;
• гетеротопическую трансплантацию, при которой биологический материал пересаживают в несвойственное ему место. Например, костный мозг трансплантируют под капсулу почки, а клетки поджелудочной железы - в переднюю брюшную стенку или сальник.
Быстрое развитие медицинского материаловедения с 70-х гг. XX в., обусловленное конверсией военной промышленности и применением инновационных технологий в области медицины, привело к появлению термина «имплантация» - введение в организм для возмещения утраченной структуры и функции искусственных и/или природных (коллаген) материалов и изделий, которые называются имплантаты. Современные имплантаты создаются преимущественно из полимеров, металлов и их сплавов, керамических материалов, углерода. Они не обладают свойствами иммуногенности и утилизируются в организме в результате: 1) активации гигантских многоядерных клеток инородных тел (рис. 13-12, см. цв. вклейку), осуществляющих клеточную деградацию материала; 2) (электро)химического и ферментативного растворения.
С точки зрения биомеханики, структура биологических тканей и органов, в отличие от искусственных материалов, обладает одновременно свойствами упругости, эластичности и твердости (например, кость). Для воспроизведения структуры живой ткани при конструировании протезов используют сочетание различных искусственных материалов. В таком случае материал (имплантат) называют композитным. Для улучшения функциональных свойств создают гибридные имплантаты, комбинируя искусственные материалы с биологическими молекулами (ферменты, цитокины, коллаген и т.п.), клетками и тканями.
В настоящее время наибольшие успехи достигнуты в области эндопротезирования крупных суставов (бедренный, коленный, голеностопный, плечевой, локтевой). При этом срок службы имплантатов, состоящих из металла, керамики и полимера, достигает 15-20 лет.
Несмотря на тот факт, что введение имплантата не вызывает иммунологического конфликта, для предотвращения реакции отторжения применяют биологически совместимые изделия, не вызывающие асептического (неинфекционного) воспаления, интоксикации и аллергизации организма. Наиболее биосовместимым считается имплантат, имеющий как можно более полное структурно-функциональное соответствие с биологическим органом или тканью (биомиметический принцип создания имплантатов). Имплантат, функционирующий в организме, интегрированный в его кровеносную систему и выполняющий требуемые задачи заместительной терапии, называется искусственным органом (тканью).
Воздействие организма реципиента на трансплантат. Каждая пересаженная ткань или целый орган попадают в организм реципиента в условиях: 1) почти полной денервации (за исключением собственных вегетативных узлов и их аксонов); 2) резкого нарушения кровообращения и питания пересаженного органа; 3) резкой клеточной и гуморальной иммунной реакции со стороны организма реципиента.
Эти условия неизбежно вызывают тяжелые деструктивные изменения пересаженной ткани или органа, гибель части клеточного материала, что приводит к ответной воспалительной реакции со стороны окружающих трансплантат тканей. В случаях гомо-, гетеро- и даже аутотрансплантации эти процессы могут привести к структурно-функциональной несостоятельности трансплантата, в крайнем случае - к гибели и отторжению трансплантата. Реакция отторжения трансплантата по своему типу и механизму относится к аллергическим реакциям замедленного типа, связанным с клеточным иммунитетом. Тем не менее отмечается также феномен «острого отторжения» кожного лоскута или почки, связанный с циркуляцией в крови специфических антител.
Деструктивные и реактивные изменения, развивающиеся в месте приживления трансплантата, наиболее показательны при пересадке аллогенного кожного лоскута. Через 6-7 дней после пересадки наблюдаются набухание эндотелия и базальных мембран
сосудов, отек, геморрагии, дистрофические изменения паренхимы органа. Позже возникают фибриноидный некроз, тромбоз крупных внутриорганных сосудов.
С первых же дней вокруг пересаженной ткани или органа развивается воспалительная инфильтрация, прежде всего вокруг кровеносных сосудов. Инфильтрат состоит из лимфоидных клеток, гистиоцитов, плазмоцитов. Соотношение этих клеток бывает различным в зависимости от вида трансплантируемой ткани и стадии развития отторжения трансплантата. К 10-14-му дню наступает отторжение. После отторжения в ткани происходит процесс рубцевания и эпителизации.
Вторичный трансплантат от того же донора отторгается в среднем в два раза быстрее, без латентного периода, что говорит о развитии специфического трансплантационного иммунитета.
Иммунология реакции отторжения трансплантата. Отторжение трансплантата происходит вследствие тканевой несовместимости донора и реципиента (см. главу 7).
Воздействие трансплантата на организм реципиента. При трансплантации генетически неродственным новорожденным животным различных иммунных клеток от взрослого животного (клетки селезенки, костного мозга, лимфатических узлов) у части животных развивается так называемая болезнь рант (от англ. runt - малорослый, карликовый), или «болезнь отставания», «гомологическая болезнь».
Сущность болезни отставания роста заключается в том, что иммунокомпетентные клетки взрослого донора реагируют на ткани реципиента как на чужеродный для них антигенный материал. Они внедряются в лимфатические органы и селезенку, разрушают лимфоидные и другие клетки и ткани реципиента, вырабатывают против них антитела. В целом этот процесс называется реакцией трансплантата против хозяина (РТПХ). Сила РТПХ зависит от многих причин: 1) природы и количества трансплантируемых клеток; 2) степени генетических различий между донором и реципиентом; 3) состояния иммунитета у реципиента; 4) места трансплантации.
РТПХ у взрослых развивается в случае пересадки аллогенных клеток системы крови пациентам с подавленным иммунитетом, например, при иммунодефиците, химиоили радиотерапии опухолевых заболеваний. РТПХ при пересадке костного мозга для лечения лейкозов может иметь двоякое значение:
1) лечебный противоопухолевый эффект маловыраженной или контролируемой РТПХ, который называется «реакция трансплантата против опухоли». В основе лежит конкуренция здоровых кроветворных клеток донора с опухолевым клоном, в некоторых случаях приводящая к его подавлению;
2) исход РТПХ в острую или хроническую вторичную болезнь, часто приводящую к гибели реципиента.
Острая вторичная болезнь развивается у взрослых в 50-70% случаев после приживления аллогенных клеток с летальностью до 60%. Хроническая вторичная болезнь отмечается у 40% больных через 3-15 мес после трансплантации как самостоятельная форма или исход острой формы болезни. Клинические проявления I-IV степени выраженности связаны с иммунным поражением кожи, серозных и слизистых оболочек, желудочно-кишечного тракта и паренхиматозных органов.
Пути преодоления тканевой несовместимости (формирование толерантности к трансплантату). Преодоление тканевой несовместимости является важнейшей задачей при пересадке органов и тканей. Существуют неспецифические и специфические методы преодоления тканевой несовместимости.
К неспецифическим методам относятся: 1) подавление иммунологической реактивности организма реципиента с помощью различных иммунодепрессантов (циклоспорин А, цитостатические препараты, антилимфоцитарная сыворотка, облучение γ-лучами и лучами Рентгена); 2) создание иммунологической устойчивости (толерантности) организма-хозяина (реципиента) к трансплантируемым донорским тканям (органам). С этой целью (экспериментально) эмбрионам и новорожденным вводят различные дозы трансплантата, далее во взрослом состоянии - ткани.
Специфическим методом является, например, подбор иммунологически совместимых пар донора и реципиента.