Нормальная физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. 2010. - 832 с.
|
|
|
|
ГЛАВА 25. ОРГАНЫ ДЫХАНИЯ
Дыхание - газообмен кислорода и углекислого газа между клетками организма и внешней средой состоит из следующих этапов: внешнее дыхание (происходит в органах дыхания), транспорт газов во внутренней среде организма (происходит в крови) и тканевое дыхание.
• Внешнее дыхание - поступление воздуха (вдох) и отведение воздуха (выдох). Воздух внешней среды поступает по дыхательным путям к респираторному отделу лёгких, где осуществляется двусторонняя диффузия газов через аэрогематический барьер (т.е. между полостью альвеол и просветом кровеносных капилляров межальвеолярных перегородок). Функция внешнего дыхания рассматривается в этой главе.
• Транспорт газов в крови рассмотрен в главе 24.
• Тканевое дыхание -
двусторонняя диффузия газов из просвета кровеносных капилляров к
митохондриям клеток внутренних органов - рассмотрено в главах 23 и 24.
Термин «тканевое дыхание» имеет и более широкое значение - утилизация O2 в метаболизме клеток, точнее - окислительное фосфорилирование (взрослый человек в состоянии покоя на
Внешнее дыхание
Внешнее дыхание - основная функция аппарата дыхания. Помимо функции внешнего дыхания, органы дыхания выполняют множество сопряжённых и дополнительных функций [регуляция КЩР, голосообразование, обоняние (см. гл. 12), кондиционирование воздуха], а также эндокринную, метаболическую и иммунологические функции.
• Аппарат дыхания состоит из дыхательных путей, респираторного отдела лёгких, грудной клетки (включая её костно-хрящевой каркас и нервно-мышечную систему), сосудистой системы лёгких, а также нервных центров регуляции дыхания.
• Функция внешнего дыхания - вентиляция и перфузия ткани лёгких.
Ф Вентиляция лёгких (V) - функция воздухоносных путей. Ф Перфузия респираторного отдела Q - важная характеристика функции внешнего дыхания.
Лёгочная вентиляция
Функцию внешнего дыхания осуществляют лёгкие, состоящие из воздухоносных путей и респираторного отдела (респираторная поверхность).
• Воздухоносные пути (рис. 25-1, А): здесь происходит активный перенос воздуха путём конвекции (за счёт разности давлений) из атмосферы к респираторной поверхности и в обратном направлении. Начиная от трахеи трубки воздухоносных путей разделяются дихотомически (надвое), образуя последовательно бронхи (и бронхиолы): главные - долевые - сегментарные - дольковые - ацинарные (терминальные) - респираторные. Активный перенос воздуха осуществляется за счёт работы дыхательных мышц, обеспечивающих дыхательные движения с частотой (f) от 12 за 1 мин. Другими словами, функция воздухоносных путей - вентиляция лёгких (V). Выдох в норме при спокойном дыхании является пассивным.
Ф Вдох в покое в среднем продолжается 2 с. При вдохе дыхательные мышцы, увеличивая размеры грудной полости, на- гнетают атмосферный воздух в дыхательные пути. Во время этого процесса они производят работу по преодолению сопротивления в дыхательных путях и сопротивления структур грудной клетки. При вдохе активно увеличивается объ- ём грудной полости и пассивно увеличивается объём лёгких. Часть энергии сокращения мышц при вдохе накапливается в упругих эластических структурах грудной клетки и лёг- ких.
Ф Выдох в покое в среднем продолжается 3 с. В состоянии покоя выдох осуществляется пассивно (в том числе за счёт растянутых эластических структур). При нагрузках на орга-
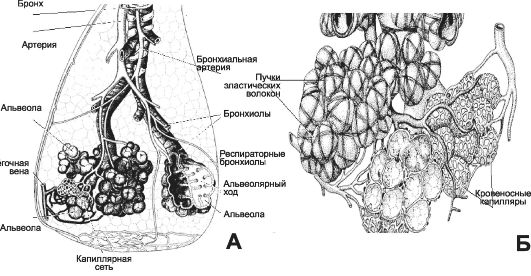
Рис. 25-1. Воздухопроводящий и респираторный отделы лёгкого [11]. А - схема сосудистого и бронхиального дерева дольки лёгкого. В верхней части рисунка - воздухоносные пути, в нижней части - респираторный отдел в виде двух ацинусов. Ветвления артерий и вен малого круга кровообращения практически повторяют ход разветвлений воздухоносных путей; Б - группа альвеол в составе ацинуса, окружённая кровеносными капиллярами системы малого круга кровообращения и множеством эластических структур.
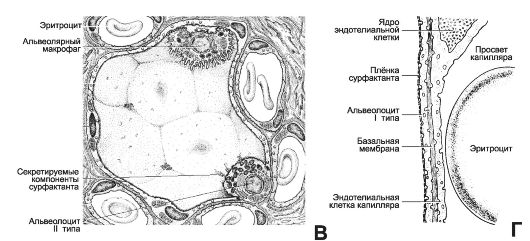
Рис. 25-1. Окончание. В - альвеола находится в окружении пяти срезов через кровеносные капилляры, рас- положенные в межальвеолярных перегородках. Поверхность альвеол образована плоскими клетками (респираторные альвеолоциты), входящими в состав аэрогематического барьера. Помимо множества респираторных альвеолоцитов (альвеолоциты типа I), в стенку альвеолы вмонтированы единичные эпителиальные клетки, синтезирующие компоненты сурфактанта (альвеолоциты типа II), а на поверхности альвеолы находятся альвеолярные макрофаги; Г - аэрогематический барьер образован (слева направо, из полости альвеолы до просвета кровеносного капилляра) плёнкой сурфактанта, респираторным альвеолоцитом, его базальной мембраной, базальной мембраной эндотелиальнои клетки и эндотелиальнои клеткой. Между базальными мембранами альвеолоцита и эндотелия расположены компоненты межклеточного матрикса (в том числе эластические структуры), но диффузия газов наиболее эффективно происходит именно через аэрогематический барьер, его толщина в минимальном варианте составляет около 0,5 мкм.
низм, когда возрастает потребность в кислороде, необходима дополнительная работа дыхательных мышц. При выдохе уменьшается объём грудной полости и лёгких. Φ Дыхательные мышцы подразделяются на осуществляющие вдох (инспираторные, мышцы вдоха) и выдох (экспираторные, мышцы выдоха), а инспираторные дыхательные мышцы - на основные и вспомогательные.
♦ Инспираторные мышцы
■ Основные (обеспечивают
вдох в состоянии покоя): диафрагма, наружные межрёберные, внутренние
межхрящевые. При дыхании в состоянии покоя купол диафрагмы смещается
вертикально примерно на
■ Вспомогательные мышцы (лестничные, грудино- ключично-сосцевидные, трапециевидные, большие и малые грудные и ряд других) включаются в обеспечение вдоха при значительной потребности организма в кислороде.
♦ Экспираторные мышцы - внутренние межрёберные, а также внутренние и наружные косые, прямые и поперечные мышцы живота. При сокращении брюшных мышц возрастает давление в брюшной полости, это приподнимает диафрагму и вызывает уменьшение объёма грудной полости.
♦ Тип дыхания. Изменение объёма грудной клетки у мужчин и женщин происходит преимущественно за счёт перемещений диафрагмы (брюшной, или диафрагмальный тип дыхания). Ранее полагали, что для женщин характерен так называемый грудной (рёберный) тип дыхания, при котором активное участие в увеличение объёма грудной клетки принимают сокращающиеся наружные межрёбер- ные мышцы.
Φ Сопротивление (R). Работа, выполняемая дыхательными мышцами, направлена на преодоление всех видов сопро- тивления: сопротивление движению воздуха в дыхательных путях (около 80%), на сопротивление тканей, т.е. структур лёгкого и органов грудной и брюшной полости (около 20%), а также сил гравитации. Различают вязкое (неэластичное) и упругое (эластическое) сопротивление. На долю вязкого сопротивления приходится примерно 60%, на долю упругого - около 40% всего сопротивления. ♦ Вязкое сопротивление обусловлено аэродинамическим сопротивлением воздухоносных путей (примерно 90% всего вязкого сопротивления) и неэластическими свойствами органов и тканей (около 10%).
■ Аэродинамическое сопротивление воздухоносных путей зависит от характера и скорости потока в просвете путей и от суммарной площади поперечного сечения путей.
• Характер потока (рис. 25-2) может быть ламинарным, турбулентным или сочетать свойства того и другого (промежуточный тип). Характеристики ламинарного потока описьгвает закон Пуазейля: поток воздуха, или объём вдоха (дыхательный объём, см. ниже) - VE прямо пропорционален разности давлений (ΔΡ) и обратно пропорционален сопротивлению (R). На практике потоки воздуха измеряются (пневмотахометрия, флоуметрия) при помощи пневмотахометра (флоуметр).
- Суммарная площадь поперечного сечения воздухоносных путей увеличивается по мере уменьшения калибра трубок. В воздухоносных путях трубки разделяются дихотомически; от трахеи (единственная трубка) до альвеолярных ходов (см. рис. 25-1, А) и альвеол (суммарное количество около 350 млн) начитывают 23 последовательных поколения трубок. Так, на уровне поколения 0 (трахея) суммарная площадь сечения около 2,5 см2, на уровне терминальных бронхиол (поколение 16) - 180 см2, респираторных бронхиол (от 18-го поколения) - около 1000 см2 и далее >10 000 см2. Соответственно резко уменьшается скорость потока. Бронхиолы (трубки без хряща в их стенке) начинаются от 11-го поколения. Начиная с 17-го поколения появляются
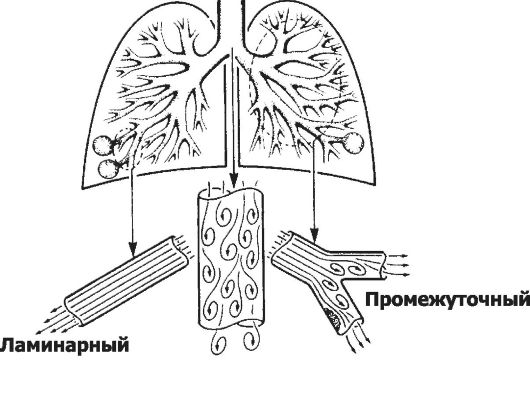
Рис. 25-2. Характер потока в воздухоносных путях. Ламинарный поток перемещается спокойно, скорость движения воздуха небольшая, наблюдается в мелких воздухоносных путях. Турбулентность потока возникает при значительной скорости его перемещения (например, в крупных воздухоносных путях) вследствие трения о стенки трубок, в местах изменения конфигурации трубок (сужения, перегибы, разветвления). Промежуточный тип движения наблюдается в крупных и средних бронхах, особенно в местах их разветвлений и сужений.
альвеолы (респираторный отдел лёгкого). Суммарный объём трубок от трахеи до терминальных бронхиол включительно (т.е. трубок, не принимающих участия в газообмене, проводящие воздухоносные пути) составляет анатомически мёртвое пространство (около 150 мл у мужчин, более 125 мл у женщин). Суммарный объём всех трубок вместе с альвеолами составляет величину около 5800 мл (общая ёмкость лёгких). ♦ Упругое сопротивление определяется эластичностью органов и тканей (в первую очередь эластическими структурами в составе лёгкого, вмонтированными практически
во все воздухоносные пути, их особенно много на уровне альвеол) и силами поверхностного натяжения на границе раздела фаз (преимущественно на покрытой сурфактантом поверхности альвеол). На долю эластических структур приходится примерно 40%, на долю поверхностного натяжения около 60% от всего упругого сопротивления. Φ Давление в дыхательном аппарате. При осуществлении дыхательного цикла в альвеолах и во внутриплевральном пространстве лёгких изменяется давление. Наибольшее значение для осуществления вдоха и выдоха, а также для оценки параметров, определяющих функции внешнего дыхания, имеют альвеолярное (PA), внутриплевральное (PPL) и транспульмональное (PTP) давление (рис. 25-3).
♦ Альвеолярное давление (PA) - давление воздуха внутри лёгочных альвеол. PA - динамический (изменяющийся) параметр, характеризующий потоки воздуха, зависящий от сопротивления в лёгком и напрямую не контролируемый сознанием.
■ Дыхательная пауза. В состоянии покоя (вне вдоха и вы- доха) давление во всех частях дыхательной системы и во всех альвеолах равно атмосферному (PB), т.е. PA составляет
■ Вдох. Во время вдоха PA уменьшается до -1 см вод.ст., и поток воздуха течёт к альвеолам.
■ Выдох. На выдохе PA увеличено до +
♦ Внутриплевральное давление (PPL) - давление жидкости в узком пространстве между висцеральной и париетальной плеврой. Значение PPL контролируется мозгом посредством сокращения дыхательных мышц. PPL имеет два компонента - статический (-PTP) и динамический (PA). PPL создаётся направленной внутрь эластической тягой лёгких и уравновешивающей её эластической тягой грудной клетки, направленной наружу. PPL в покое составляет -4-5 см вод.ст. (0,3-0,5 кПа). Во время вдоха сила тяги грудной клетки наружу увеличивает отрицательное PPL, доводя его до -7,5 см вод.ст.
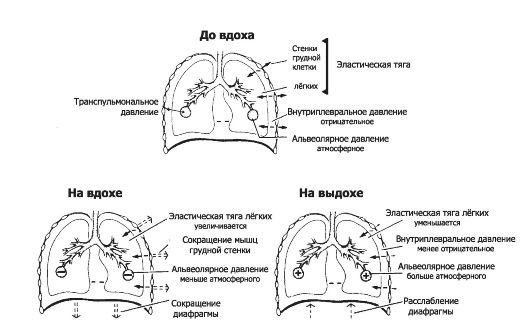
Рис. 25-3. Направления сил в течение дыхательного цикла. Пояснения в тексте.
• ♦ Транспульмональное давление (PTP) - разность между альвеолярным и внутриплевральным давлением (PA - PPL). PTP - статический параметр, не влияющий на потоки воздуха и прямо не контролируемый мозгом. Нормально PTP составляет на выдохе -3-4 см вод.ст., на вдохе -9-
стерол и 10% - белки. Общее количество сурфактанта в лёгких крайне невелико. На
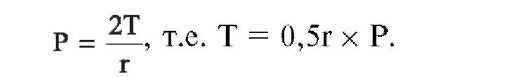
♦ T альвеол без сурфактанта равно примерно 50 дин/см, T альвеол с нормальным количеством сурфактанта на их поверхности колеблется от 5 до 30 дин/см.
♦ Сурфактант необходим для начала дыхания при рождении ребёнка. До рождения лёгкие находятся в спавшемся состоянии. Ребёнок после рождения делает несколько сильных дыхательных движений, лёгкие расправляются, а сурфактант удерживает их от спадения (коллапса). Недостаток или дефекты сурфактанта вызывают тяжёлое заболевание (синдром дыхательного дистресса). Поверхностное натяжение в лёгких у таких детей высокое, поэтому многие альвеолы находятся в спавшемся состоянии.
Вдобавок к снижению поверхностного натяжения альвеол и поддержанию альвеолярной устойчивости, сурфактант помогает
предотвратить отёк лёгких. Внутрь направленные сократительные силы, которые стремятся вызвать спадение альвеол, также имеют тенденцию к понижению интерстициального давления, которое «тянет» жидкость из капилляров. Сурфактант противодействует этой тенденции, понижая силы поверхностного натяжения.
Другим механизмом поддержания стабильности альвеол является взаимная поддержка прилежащих альвеол. Например, если группа альвеол стремится к спадению, то окружающие альвеолы развивают значительные тянущие силы.
Функциональная организация лёгочного кровообращения Φ Кровоснабжение лёгких осуществляется из двух источников - лёгочных артерий лёгочного ствола, начинающегося от правого желудочка (малый круг кровообращения), и бронхиальных артерий (ветви грудной части аорты, большой круг кровообращения).
♦ Лёгочные артерии содержат дезоксигенированную венозную кровь, их разветвления следуют вместе с разветвлениями воздухоносных путей и распадаются на капилляры межальвеолярных перегородок. После газообмена кровь собирается в бассейн лёгочных вен.
♦ С функциональной точки зрения лёгочные сосуды классифицируются как экстраальвеолярные (лёгочные артерии и вены) и альвеолярные (артериолы, капилляры и венулы).
♦ Бронхиальные артерии содержат оксигенированную кровь, кровоснабжают по преимуществу проводящие воздухо- носные пути. Венозная кровь оттекает в бассейн лёгоч- ных вен и в значительно меньшей степени в непарную вену.
Лёгочное кровообращение не является региональным, подобно почечному, печёночному или коронарному, поскольку оно получает полностью весь сердечный выброс. Изменения сопротивления лёгочных сосудов оказывают то же действие в правом желудочке, что и изменения системного сосудистого сопротивления в левом желудочке. Кровь в лёгочных кровеносных сосудах занимает более 40% массы лёгких. Общий объём крови в лёгочной циркуляции (от главной лёгочной артерии к левому предсердию) составляет около 500 мл, или 10% общего объёма циркулирующей крови (5000 мл). Лёгочные вены содержат больше крови (270 мл), чем артерии (150 мл). Объём крови в лёгочных капиллярах приблизительно ра-
вен ударному выбросу правого желудочка (около 80 мл) в большинстве физиологических состояний.
Вторичные функции лёгочного кровообращения, облегчающие обмен газов
В дополнение к обмену газов лёгочное кровообращение имеет три вторичных функции: оно служит фильтром, метаболическим органом и резервуаром крови.
Лёгочные сосуды предохраняют организм от тромбов (кровяные сгустки) и эмболов (жировые частицы и воздушные пузырьки). Лёгочные артериолы и капилляры улавливают тромбы и эмболы и предотвращают их попадание в жизнеопасные коронарные, мозговые и почечные сосуды. Клетки эндотелия, выстилающие лё- гочные сосуды, выделяют фибринолитические вещества, которые способствуют растворению тромбов. Эмболы, особенно воздушные, абсорбируются через лёгочно-капиллярные стенки. Если крупный тромб закрывает большой лёгочный сосуд, возникшие тяжёлые нарушения обмена газов могут вызвать смерть.
В системе лёгочной циркуляции происходит метаболизм вазоактивных гормонов (см. в конце главы).
Лёгкие служат резервуаром крови. Приблизительно 500 мл, или 10% общего объёма циркулирующей крови, содержится в сосудах лёгких. Во время геморрагического шока часть этой крови мобилизуется для поддержания сердечной деятельности.
Гемодинамические особенности лёгочного кровообращения
В сравнении с системным кровообращением лёгочное кровообращение характеризуется высокой скоростью протока, низким давлением и низким сопротивлением. Стенки лёгочной артерии намного тоньше аорты, они содержат мало эластина и гладких мышц и более податливы. Лёгочные вены также тонкостенны и высокоподатливы. В отличие от системных капилляров, которые образуют сеть трубчатых сосудов, взаимодействующих между собой, лёгочные капилляры формируют сеть, соединённую со стенкой альвеол, и кровь течёт тонким слоем.
Среднее артериальное лёгочное давление равно
градиенте давления в
Важным свойством лёгочного кровообращения является его способность уменьшать сопротивление при повышении давления в лёгоч- ной артерии, вызванном увеличением сердечного выброса. Аналогичный феномен наблюдается в венозном русле лёгких: повышение лёгочного венозного давления приводит к падению сопротивления. Отвечают за это свойство два локальных механизма. Один связан с раскрытием дополнительных капилляров в верхних отделах лёгких, находящихся частично или полностью в закрытом состоянии из-за низкого перфузионного давления при обычном состоянии организма. Как только кровоток усиливается, под влиянием повышенного давления коллапсированные сосуды раскрываются, снижая общее сопротивление. Другой механизм заключается в растяжении капилляров в силу тонкости и высокой податливости их стенок.
Падение сопротивления лёгочных сосудов в ответ на увеличение сердечного выброса оказывает два полезных действия. Оно препятствует тенденции ускоренного движения крови при одновременном усилении кровотока, поддерживая тем самым адекватное время для обмена газов. Оно также способствует увеличению общей поверхности капилляров, улучшая условия диффузии O2 и CO2.
Сопротивление лёгочных сосудов увеличивается при большом и малом объёме лёгких. Большой объём легких увеличивает диа- метр альвеол, снижает трансмуральное давление в альвеолярных сосудах. Альвеолярные сосуды спадаются, и сопротивление возрастает. При малых объёмах лёгких сопротивление лёгочных сосудов увеличивается вследствие возросшего плеврального давления, компрессирующего экстраальвеолярные сосуды.
Оценка функции внешнего дыхания
Характеризуя функции внешнего дыхания, применяют множество показателей, позволяющих оценивать разные стороны венти- ляции лёгких и перфузии респираторного отдела (в том числе при обструктивных и рестриктивных заболеваниях лёгких).
При исследовании функции внешнего дыхания изучают лёгоч- ные объёмы и ёмкости (V), объёмные скорости потока (V) и диффузионную ёмкость (D).
Лёгочные объёмы (V) определяются с помощью спирометра. Ряд параметров спирограммы выражают в относительных величинах (%), диапазоном нормы считают 80-120%. Для оценки лёгочной вентиляции используют значения нижерассмотренных четырёх статичных лёгочных объёмов (см. рис. 25-4); дыхательного объёма, резервного объёма вдоха, резервного объёма выдоха и остаточного объёма лёгкого.
Φ Дыхательный объём (ДО) - объём воздуха, поступающего в лёгкие за один вдох или выходящий из лёгких при последующем выдохе при спокойном дыхании (норма 0,4-0,5 л, у детей - 3-5 мл/кг). Поскольку организм потребляет больше O2 (~250 мл/мин), чем образует CO2 (~200 мл/мин), объ- ём воздуха на вдохе примерно на 4% больше объёма воздуха на выдохе. Поэтому для более точных исследований изме- ряют объём выдоха (ОВ).
■ Альвеолярный объём (АО) - часть дыхательного объё- ма, участвующая в газообмене.
■ Анатомически мёртвое пространство - часть пространства дыхательных путей, которая заполнена воздухом, не участвующим в газообмене, - остаток от (ДО - АО) - около 155 мл, примерно 30% дыхательного объёма. Мёртвое пространство не ограничивается только воздухопроводящими путями. Иногда газы в альвеолах не участвуют в газообмене, и эти газы становятся частью неиспользованного воздуха, например, если вдыхаемый воздух распределяется в альвеолах, не имеющих кровотока (альвеолярное мёртвое пространство). Сум- ма двух мёртвых пространств является физиологическим мёртвым пространством. У здоровых людей физиологическое мёртвое пространство приблизительно равно анатомическому.
Φ Резервный объём вдоха (РОвд) - дополнительный объём воздуха (1,9-2,5 л), который можно вдохнуть после нор- мального вдоха.
Φ Резервный объём выдоха (РОвыд) - дополнительный объём воздуха (1,1-1,5 л), который можно выдохнуть после окон- чания нормального выдоха.
Φ Остаточный объём лёгкого (ООЛ) - объём воздуха (1,5-
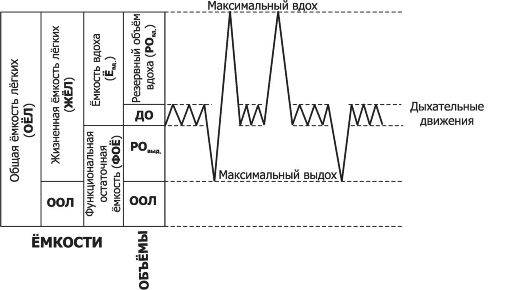
Рис. 25-4. Спирограмма лёгочных объёмов и ёмкостей [21]. Справа показана запись нескольких дыхательных движений с различной глубиной вдоха и выдоха, слева от записи дыхательных движений (первая колонка) названы разные лёгочные объёмы. ДО - дыхательный объём, РОвыд - резервный объём выдоха, ООЛ - остаточный объём лёгких. Три левые колонки - названия разных ёмкостей.
• Лёгочные ёмкости (рис. 25-4) являются суммой двух или более лёгочных объёмов.
Φ Ёмкость вдоха Ёвд = (ДО + РОвд) равна сумме дыхательного объёма (ДО) и резервного объёма вдоха (РОвд) - количества воздуха, которое можно максимально вдохнуть после нормального выдоха. Ёвд составляет 2,3-3,0 л.
Φ Функциональная остаточная ёмкость (ФОЁ) - объём воздуха, остающийся в лёгких в конце нормального выдоха (около
Φ Жизненная ёмкость лёгких (ЖЁЛ) равна сумме дыхательного объёма (ДО), резервного объёма вдоха (РО), резервного объёма выдоха (РО). Это максимальный объём воздуха (3,4-4,5 л), изгоняемый из лёгких вслед за максимальным вдохом: ЖЁЛ = ДО + РО + РО .
Φ Форсированная жизненная ёмкость лёгких - ФЖЁЛ (
дохе с максимальной силой и скоростью (см. ниже «Динамические лёгочные объёмы и ёмкости»). Φ Общая ёмкость лёгких (ОЁЛ) - максимальный объём воздуха (4,9-6,4 л), находящийся в лёгких после максимального вдоха, - равна сумме жизненной ёмкости лёгких (ЖЁЛ) и остаточного объёма лёгких (ООЛ).
♦ Отношение остаточного объёма лёгкого к общей ёмкости лёгких - ООЛ/ОЁЛ в норме меньше 0,25. Увеличение этого показателя вследствие увеличения ООЛ происходит при обструктивных заболеваниях, а вследствие уменьшения ОЁЛ - при рестриктивных заболеваниях. Φ Вышеперечисленные статические лёгочные объёмы и ём- кости отражают эластические свойства лёгких и грудной клетки.
• Динамические лёгочные объёмы и ёмкости отражают проходимость дыхательных путей. Получение некоторых из нижеперечисленных показателей требует применения не только спирометрии, но и других подходов (например, теста с разведением гелия).
Φ Минутный объём дыхания (МОД)
- количество воздуха, проходящего через воздухоносные пути каждую
минуту. МОД равен дыхательному объёму (ДО), умноженному на частоту
дыхательных движений в минуту (ЧДД) : МОД = ДО хЧДД. Так, как ДО в
норме составляет примерно
Φ Максимальная вентиляция лёгких (МВЛ) - максимальное количество воздуха, которое может быть провентилировано через лёгкие за 1 мин, - произведение частоты дыхательных движений (ЧДД) и ёмкости вдоха (Евд: МВЛ = ЧДД χ Е). Средние значения МВЛ у мужчин - 140 л/мин, у женщин - 130 л/мин.
Φ Объём форсированного выдоха за 1 с (ОФВ1) - объём воздуха, изгоняемого с максимальным усилием из лёгких в течение первой секунды выдоха после глубокого вдоха, т.е. часть ФЖЁЛ, выдыхаемая за первую секунду. Прежде всего ОФВ1 отражает состояние крупных дыхательных путей и часто выражается в процентах от жизненной ёмкости лёг- ких (ЖЁЛ). Нормальное значение ОФВ1 = 75% ЖЁЛ.
Φ Пик объёмной скорости выдоха (мощность выдоха - максимальная объёмная скорость, которую пациент может развить при форсированном выдохе, - показатель проходимости дыхательных путей на уровне трахеи и крупных бронхов. Зависит от мышечного усилия пациента.
• Φ Резерв дыхания (РД) характеризует возможность увеличения лёгочной вентиляции (в норме 85-90%) и рассчитывается по разности максимальной вентиляции лёгких (МВЛ) и минутного объёма дыхания МОД. Другие исследования функции лёгких
Φ Диффузионная способность (диффузионная ёмкость, Дс) - показатель, по которому судят, насколько эффективно газ из альвеол переносится в лёгочный капиллярный кровоток, отражает состояние альвеолярно-капиллярной мембраны - аэрогематического барьера.
Φ Кривая податливости (растяжимости). Эластичность лёгких (способность растянутого материала возвращаться в ис- ходное нерастянутое положение) определяет соотношение изменений лёгочных объёмов (V) и изменения транспульмонального давления (Ртр).
♦ Кривая «давление-объём». Зависимость транспульмонального давления от объёма частей дыхательной системы ото- бражается в виде кривой растяжимости лёгких (рис. 25-5).
♦ Податливость, или растяжимость (C),
- количественный показатель, характеризующий упругие свойства лёг-
ких, определяется по наклону кривых «давление-объём» (P-V) над уровнем
дыхательного объёма. Общая податливость обоих лёгких (C) у взрослого
человека составляет около 200 мл воздуха на
♦ Изменения эластической тяги лёгкого имеют обратное влияние на кривую податливости.
Φ Объёмная скорость выдоха - максимальная скорость прохождения воздушного потока в дыхательных путях во время форсированного (максимального) выдоха.
Φ Коэффициент лёгочной вентиляции (КЛВ, в норме 1/7) - отношение дыхательного объёма (ДО) к сумме объёмов резервного выдоха (РОВЫД) и остаточного объёма воздуха (ООВ) .
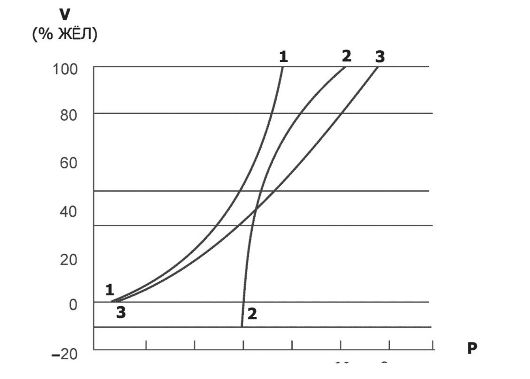
Рис. 25-5. Кривые, изображающие растяжимость частей дыхательной системы [21]. 1 - грудная клетка, 2 - лёгкие, 3 - весь дыхательный аппарат.
Альвеолярная вентиляция
• Газы в альвеолах. В воздухоносные пути извне поступает воздух (смесь газов), содержащий в основном азот и кислород и значительно меньше диоксида углерода, аргона и других инертных газов. Поскольку вдыхаемый воздух увлажняется, парциальное (частичное, при условии что доля конкретного газа в смеси газов равна 1) давление кислорода (Po2) в воздухоносных путях уменьшается (табл. 25-1).
Таблица 25-1. Парциальное давление газов (мм рт.ст.) в воздухоносных путях и крови [4]
Ро2 | Рсо2 | Рн2о | PN2 | Р суммарное | |
Вдыхаемый воздух (сухой) | 159 | 0 | 0 | 601 | 760 |
Воздух в бронхах (увлажнённый) | 150 | 0 | 47 | 563 | 760 |
Воздух в альвеолах* | 102 | 40 | 47 | 571 | 760 |
Артериальная кровь | 90 | 40 | 47 | 571 | 760 |
Венозная кровь | 40 | 46 | 47 | 571 | 705** |
* При дыхательном коэффициенте (R) 0,8.
** Суммарное давление газов в венозной крови меньше, чем в артериальной, так как Po2 уменьшено больше, чем увеличено Po2.
• Дыхательный коэффициент (R) - отношение Осо2 (скорость поступающего в альвеолы из крови, т.е. образующегося при метаболизме, диоксида углерода) к Оо2 (скорость вдыхаемого кислорода). Значение R зависит от преобладания в пище углеводов (практически углеводное питание) или жиров и варьирует от 0,7 до 1,0 (обычно 0,8).
• Характеристики альвеолярной вентиляции
Φ Альвеолярная и лёгочная вентиляция. В отличие от лёгочной вентиляции, осуществляемой только при вдохе, альвеолярная вентиляция происходит постоянно.
Φ РАсо2 и альвеолярная вентиляция. Зависимость между альвеолярной вентиляцией и Paco2 обратная и не зависит от выдыхаемого диоксида углерода.
Φ Влияние гравитации. В положении стоя альвеолы в верхушечной части лёгких до начала вдоха расширены больше, чем в нижних долях, так как зависящее от тяжести лёг- кого внутриплевральное давление PPL на верхушке лёгкого меньше, чем в его основании [величина внутриплеврального давления (PPL) через транспульмональное давление (PTP) определяет величину альвеолярного давления (PA) (PPL = PA - PTP)]. Поэтому альвеолярная вентиляция больше в верхушечных частях лёгкого.
Φ Влияние сопротивления и податливости. В разных ацинусах (в том числе в зависимости от длины ведущих к ним воздухоносных путей) сопротивление и податливость различны, что также определяет различную величину альвеолярной вентиляции.
Перфузия
Перфузия - процесс, в ходе которого дезоксигенированная кровь лёгочных артерий проходит через лёгкие и оксигенируется. Другими словами, между полостью альвеолы и просветом капил- ляра межальвеолярных перегородок происходит газообмен путём простой диффузии газов по градиенту их концентрации (в соответствии с законом Фика). В частности, чем меньше структур между полостью альвеолы и просветом капилляра, тем эффективнее диффузия. Диффузионный путь при газообмене оценивают в 0,2- 3,0 мкм. Таким образом, для оценки лёгочного газообмена важны характеристики перфузии (Q), альвеолярной вентиляции (VA),а также вентиляционно-перфузионные отношения (VA/Q).
• Лёгочные артерии (диаметр около
Φ Лёгочное сосудистое сопротивление. На характеристики лё- гочного кровотока влияют гравитация (g), альвеолярное давление (PA), градиент артериального и венозного кровотока (P - P ) и лёгочное сосудистое сопротивление (RPV):
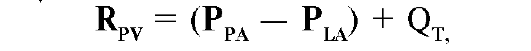
где PPA - давление в лёгочной артерии (правом желудочке), PLA - давление в левом желудочке, QT- скорость потока (сердечный выброс).
♦ Нормально RPV составляет
♦ Малая величина RPV позволяет значительно увеличить при необходимости перфузию лёгких (в основном за счёт увеличения внутреннего диаметра сосудов и мобилизации временно выключенных сосудов, но не за счёт увеличения внутриартериального давления).
Φ Внутрисосудистое давление (табл.
25-2). Диаметр артерий и артериол малого круга кровообращения больше
диаметра сосудов аналогичного калибра в большом круге кровообращения, а
стенка лёгочных сосудов значительно тоньше и податливее, поэтому
сопротивление току крови невелико. Перепад внутрисосудистого давления
между лёгочной артерией и левым желудочком составляет всего
В то же время это обстоятельство может привести к застою крови в лёгочной циркуляции с нарушениями фильтрации через стенку капилляров и развитием отёка лёгкого (см. рис. 25-6).
Таблица 25-3. Среднее давление в кровеносных сосудах лёгкого у взрослого мужчины в положении лёжа на спине [4]
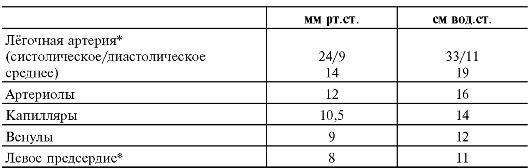
*Измеряют при катетеризации.
Φ Капилляры
♦ Объём крови в капиллярах взрослого человека в состоянии покоя составляет около 75 мл (при этом заполнены не все капилляры). При необходимости (например, при физической нагрузке) объём крови, находящейся в лё- гочных капиллярах, возрастает до 200 мл (при этом «открываются» дополнительные капилляры).
♦ Суммарная площадь эндотелия кровеносных капилляров оценивается в
♦ Капилляры и PA. Внутриплевральное (PPL) и интерстициальное давление (см. рис. 25-6) не влияет на капиллярный кровоток. В то же время значения альвеолярного давления (PA) важны для состояния капиллярного кровотока, вплоть до его прекращения.
• Лимфоотток. Из интерстициального пространства межальвеолярных перегородок интерстициальная жидкость, образующая за счёт фильтрации из кровеносных капилляров, оттекает не только по лёгочным венам, но и по лимфатическим сосудам (рис. 25-6). Этот объём лимфооттока в норме составляет примерно 30 мл/ч.
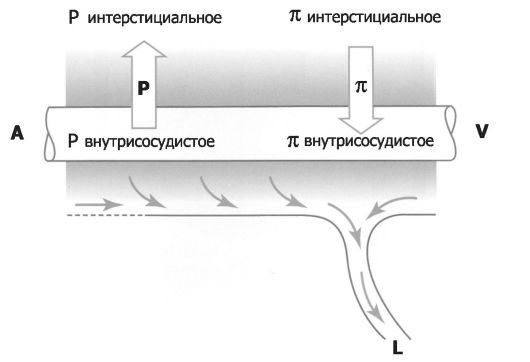
Рис. 25-6. Баланс интерстициальной жидкости межальвеолярных перегородок (иллюстрация к уравнению Старлинга) [4]. Нормально-разные силы, действующие на содержание жидкости в интерстиции, обусловливают фильтрацию жидкости из кровеносных капилляров (A-V). Из интерстиция эта жидкость оттекает по лимфатическим сосудам (L). A - артериальный конец капилляра, V - венозный конец капилляра, P - гидростатическое давление, π - коллоидное осмотическое (онкотическое) давление.
• Интерстициальная жидкость. На динамичный объём интерстициальной жидкости в межальвеолярных перегородках влияет ряд факторов, описываемых уравнением Старлинга:
Поток жидкости (мл/мин) = Kfc[(Pv - R] - δΛ(πγ - π.)], ♦ где Kfc - коэффициент фильтрации из капилляров, P - давление, v - внутрикапиллярный, i - интерстициальный, δά - коэффициент проницаемости для макромолекул, π - коллоидное осмотическое (онкотическое) давление.
• Парциальное давление газов лёгочного кровотока (см. табл. 25-1), а также pH крови - параметры, важные для оценки функции лёгких. Они указывают на состояние газообмена между лёгкими и кровью.
Φ Po2 при отсутствии патологии снижается с возрастом вследствие утраты лёгкими эластичности (Po2 в норме составля-
• ет
(рис. 25-7).
Φ Зона 1 (PA > Pa > Pv) в верхушке лёгкого возникает тогда, когда альвеолярное давление становится больше, чем артериальное. В этом случае лёгочные капилляры коллапсированы, кровоток прекращается. Зона 1 практически у здоровых людей не встречается, поскольку пульсовое артериальное давление поддерживает капилляры частично в открытом состоянии в верхушке лёгких. Зона 1 может возникать в тех случаях, когда повышается альвеолярное давление или уменьшается лёгочное артериальное давление.
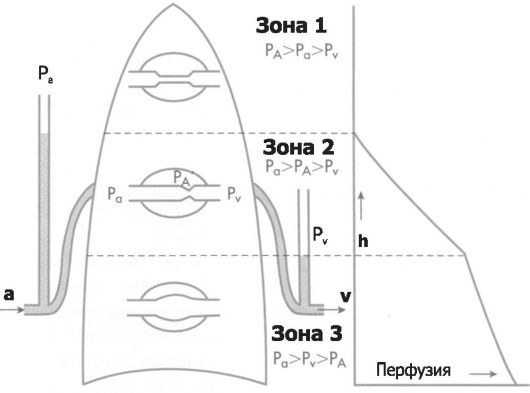
Рис. 25-7. Зоны лёгкого, различающиеся параметрами перфузии [4]. Слева - схема лёгкого, по центру - границы зон и их номера, справа - величина перфузии. PA - альвеолярное давление, Pa - артериальное давление, Pv - венозное давление, a - артериальный кровоток, v - венозный кровоток, h - расстояние области лёгкого от начала лёгочного ствола.
Например, условия для зоны 1 создаются при искусственной вентиляции лёгких. Потеря крови или низкое кровяное давление способствует созданию зоны 1, понижая лёгочное артериальное давление. Условия формирования зоны 1 могут создаваться у космонавтов во время спуска.
Φ Зона 2 (Pa > PA > Pv) - средняя часть лёгкого, где артериальное давление за счёт гидростатического давления выше, чем альвеолярное. Венозное давление меньше альвеолярного. В результате условия кровотока в зоне 2 определяются разностью артериального и альвеолярного давления. Функциональное значение этого явления заключается в том, что венозное давление в зоне 2 не влияет на кровоток (иными словами, снижение венозного давления не будет увеличивать капиллярный кровоток в этой зоне).
Φ Зона 3 (Pa > Pv > PA) - нижние две трети лёгкого. Здесь перфузию определяет разность между Pa и Pv. Значение PA практически роли не играет.
• Регуляция лёгочного кровотока Φ Кислород (точнее - изменение PaO2) вызывает либо вазодилатацию, либо вазоконстрикцию.
♦ Вазодилатация. Под влиянием повышения PaO2 (например, при помещении в камеру с повышенным содержанием кислорода - гипербарическая оксигенация или при вдыхании 100% кислорода - кислородная подушка) лёгочное сосудистое сопротивление (RPV) уменьшается, а перфузия увеличивается.
♦ Вазоконстрикция. Под влиянием пониженного PaO2 (например, при подъёме в горы) RPV увеличивается, а перфузия уменьшается.
Φ Биологически активные вещества (вазоконстрикторы и вазодилататоры), воздействующие на ГМК кровеносных сосудов, многочисленны, но их эффекты локальны и кратковременны. Диоксид углерода (повышенное PaC02) также оказывает незначительное, преходящее и локальное сосудосуживающее воздействие на просвет кровеносных сосудов.
♦ Лёгочные вазодилататоры - простациклин, оксид азота, ацетилхолин, брадикинин, дофамин, β-адренергические лиганды.
♦ Вазоконстрикторы - тромбоксан A2, α-адренергические лиганды, ангиотензины, лейкотриены, нейропептиды, серотонин, эндотелин, гистамин, Пг, повышенное PaCO2.
Вентиляционно-перфузионные отношения
Для оценки лёгочного газообмена, помимо характеристики перфузии (Q) и вентиляции (V), также важно вентиляционно- перфузионное отношение (VA/Q). Это отношение оценивают для отдельной альвеолы (в этом случае значение VA- альвеолярная вентиляция), для лёгких в целом (в этом случае значение Q равно значению сердечного выброса) и для участка лёгочной ткани.
Φ В целом в лёгких VA/Q составляет 0,8 (в норме допускается физиологический дисбаланс V/Q, эквивалентный 2% шунтирования лёгочной артериальной крови напрямую в лёгочную венозную циркуляцию без газообмена). Оценка вентиляционно-перфузионных отношений позволяет сделать три вывода.
Вентиляция и лёгочный кровоток являются гравитационнозависимыми; поток воздуха и поток крови увеличиваются в нижних частях лёгкого.
Кровоток показывает пятикратное различие между верхушкой и основанием лёгких, в то время как вентиляция различается в два раза. Это вызывает гравитационно-зависимые региональные вариации в соотношениях VA/Q от 0,6 в основании до 3 в верхушке лёгкого.
Кровоток является пропорционально большим, чем вентиляция в основании, а вентиляция пропорционально больше кровотока в верхушке лёгкого.
Контроль вентиляции
Общая схема регуляции дыхания (вентиляции) приведена на рис. 25-8. Функцию нервной регуляции дыхания выполняют ды- хательные нейроны - множество нервных клеток, расположенных в стволовой части мозга. Контроль дыхательных движений (эфферентная нервная импульсация к дыхательным мышцам) осуществляется как непроизвольно (автоматический ритм дыхательных нейронов стволовой части мозга, на рисунке - «генератор ритма»), так и произвольно (в этом случае эфферентная нервная импульса- ция поступает к дыхательным мышцам, минуя дыхательные нейроны ствола мозга; на рисунке: «высшие отделы ЦНС» - «спинной мозг» - «дыхательные мышцы»). Адекватное функционирование этих и других контуров регуляции дыхания обеспечивает нормальное дыхание (эупноэ).
Регуляция дыхания направлена на выполнение двух задач: вопервых, на автоматическую генерацию частоты и силы сокращения дыхательных мышц, во-вторых - на подстройку ритма и глубины дыхательных движений к реальным потребностям организма (в первую очередь, к изменениям метаболических параметров в виде ∆Po2, ∆Pco2 и ΔρΗ артериальной крови и ∆Pco2 и ΔρΗ межклеточной жидкости мозга).
Система регуляции дыхания состоит из трёх основных блоков: рецепторного (хемо- и барорецепторы, регистрирующие и переда- ющие информацию в мозг), регуляторного, или контролирующего (совокупность дыхательных нейронов) и эффекторного (дыхательные мышцы, непосредственно осуществляющие вентиляцию лёгких). На рис. 25-8 представлены блоки, образующие систему
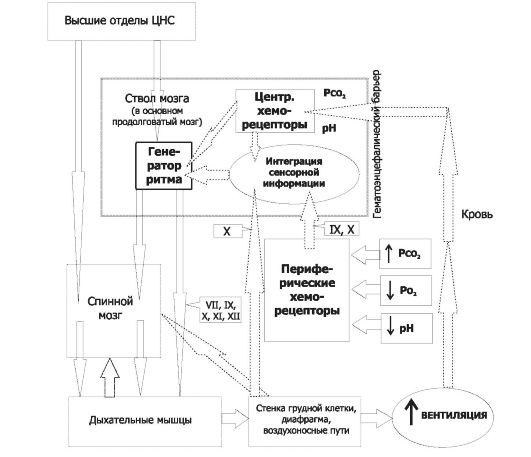
Рис. 25-8. Нервный контроль вентиляции [2]. Связи между контролирующими (нервные центры), исполнительными (дыхательные мышцы) и чувствительными (хемо- и механорецепторы) блоками показаны стрелками, в том числе пунктирными для восходящей (афферентной) импульсации, а точечными для нисходящей (эфферентной) импульсации. Римскими цифрами обозначены черепные нервы: VII - лицевой (содержит двигательные, чувствительные и парасимпатические волокна), IX - языкоглоточный (повреждение нерва сопровождается нарушением глотания, анестезией верхней трети глотки, снижением нёбных и глоточных рефлексов), X - блуждающий (содержит двигательные, чувствительные и вегетативные волокна), XI - добавочный (иннервирует грудино-ключично-сосцевидную и трапециевидную мышцы), XII - подъязычный (иннервирует мышцы языка, грудино-подъязычную, грудино-щитовидную и лопаточноподъязычную мышцы). В правой части схемы стрелки относятся к крови в кровеносной системе. Жирным прямоугольником выделены структуры ствола мозга, паренхима которого отделена от циркулирующей крови гематоэнцефалическим барьером (см. рис. 25-11).
регуляции дыхания: контролирующие (нервные центры), исполнительные (дыхательные мышцы), рецепторные (хемо- и механорецепторы), - и связи между этими блоками. Таким образом, вся система регуляции дыхания состоит из нескольких взаимосвязанных регуляторных контуров.
• Нервные центры расположены в стволе мозга (в основном в составе продолговатого мозга). Схема регуляции дыхания предусматривает наличие генератора ритма дыхательных движений и центра интеграции сенсорной информации. Под терминами «генератор ритма» и «интегратор сенсорной информации» следует понимать абстрагированные интегральные понятия, а не конкретные нервные структуры, так как соответствие анатомических структур рассматриваемым понятиям установлено далеко не во всех случаях.
Φ Генератор ритма включает нейроны, расположенные преимущественно в составе продолговатого мозга, а также моста и некоторых других отделов ствола мозга. Разные группы нейронов генерируют разного спектра пачки импульсов - потенциалы действия (ПД) - на разных фазах дыхательных движений, в том числе либо преимущественно во время вдоха (инспираторные нейроны), либо преимущественно во время выдоха (экспираторные нейроны). Карта расположения инспираторных и экспираторных нейронов в составе структур продолговатого мозга приведена на рис. 25-9.
♦ Входящие сигналы. Генератор ритма получает нисходящую из коры головного мозга импульсацию, а также нервные сигналы от нервных клеток интегратора сенсорной информации и непосредственно от центральных хе- морецепторов.
♦ Выходящие сигналы. Нервная импульсация от генератора ритма направляется к иннервирующим дыхательные мышцы двигательным нервным клеткам соответствующих ядер черепных нервов (VII, IX-XII) и к мотонейронам передних рогов спинного мозга (их аксоны в составе спинномозговых нервов направляются к дыхательным мышцам).
■ Механизм ритмической активности генератора не установлен. Предложено несколько моделей, которые учитывают индивидуальные особенности электрогенной
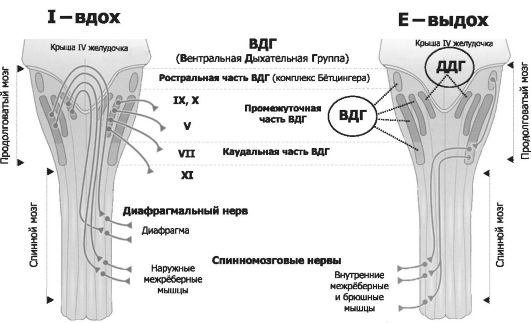
Рис. 25-9. Инспираторные (слева, Inspiration) и экспираторные (справа, Expiration) группы нейронов и их связи с дыхательными мышцами [2]. Дор- сальный (сзади) вид на продолговатый и спинной мозг (мозжечок удалён). Римскими цифрами обозначены черепные нервы. Вся совокупность дыхательных нейронов подразделяется с анатомической точки зрения на вентральную и дорсальную дыхательные группы (ВДГ и ДДГ соответственно). И ВДГ, и ДДГ представлены билатерально, т.е. дублированы. Дорсальная дыхательная группа (ДДГ) содержит преимущественно инспираторные нервные клетки (в том числе нейроны важного комплекса ядер вегетативной нервной системы - ядер одиночного пути, получающих сенсорную информацию от внутренних органов грудной и брюшной полости по нервным волокнам языкоглоточного и блуждающего нервов). Вентраль- ная дыхательная группа (ВДГ) содержит как инспираторные, так и экспираторные нейроны. В рострокаудальном направлении ВДГ состоит из ростральной части - комплекс Бётцингера (содержит в основном экспираторные нервные клетки, в том числе позадилицевого ядра), промежуточной (содержит преимущественно инспираторные нейроны двойного и околодвойного ядер) и каудальной (экспираторные нейроны позади двойного ядра) частей. Направление импульсации от дыхательных нейронов: 1) от нервных клеток ДРГ к ВДГ, а также к премоторным нейронам, да- лее к мотонейронам и основным инспираторным мышцам; 2) от промежуточной части ВДГ в конечном счёте к основным и вспомогательным инспираторным мышцам; 3) от каудальной части ВДГ к дополнительным экспираторным мышцам.
мембраны, состоящей из групп однотипных нервных клеток (например, наличие разных ионных каналов), спектр синаптических связей (в том числе осуществляемых при помощи разных нейромедиаторов), наличие пейсмейкерных (со свойствами водителя ритма) дыхательных нейронов (таковые обнаружены) или пейсмейкерных свойств локальных нейронных сетей. Нет ясности и в вопросе о том, является ли ритмическая активность свойством ограниченной группы нервных клеток или свойством всей совокупности дыхательных нейронов.
• Φ Интегратор сенсорной информации получает чувствительную информацию от разнообразных хемо- и механорецепторов, расположенных в органах дыхания и дыхательных мышцах, по ходу магистральных кровеносных сосудов (периферические хеморецепторы), а также в продолговатом мозге (центральные хеморецепторы). Помимо этих прямых сигналов, интегратор получает множество информации, опосредованной различными структурами мозга (в том числе и от высших отделов ЦНС). Импульсация от нервных клеток интегратора, направляясь к нейронам генератора ритма, модулирует характер разрядов от них. Чувствительные структуры, сигналы: от которых прямо или опосредованно (через интегратор сенсорной информации) влияют на ритмическую активность генератора ритма, включают периферические и центральные хеморецепторы, барорецепторы стенки артерий, механорецепторы лёгких и дыхательных мышц. Наиболее существенное значение для деятельности генератора ритма имеет осуществляемый периферическими и центральными хеморецепторами контроль pH и газов крови. Φ Периферические хеморецепторы (каротидные и аортальные тельца) регистрируют в артериальной крови pH, PO2 (PaO2) и PCO2, они особенно чувствительны к уменьшению PaO2 (гипоксемии) и в меньшей степени к увеличению PCO2 (гиперкапнии) и уменьшению pH (ацидозу). ♦ Каротидное тельце (рис. 25-10) состоит из скоплений клеток (клубочков, гломусов), погружённых в густую сеть кровеносных капилляров (интенсивность перфузии телец максимальна в организме, в 40 раз больше перфузии го-
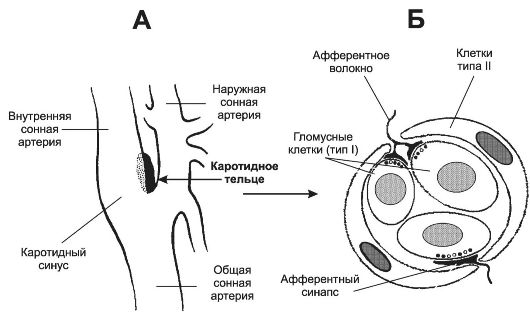
Рис. 25-10. Каротидный (сонный) синус и каротидное (сонное) тельце [11].
А - каротидный синус - расширение просвета внутренней сонной артерии непосредственно у места её ответвления от общей сонной артерии. В стенке артерии в области расширения имеются многочисленные барорецепторы, регистрирующие значения АД и передающие эту информацию в ЦНС по нервным волокнам, которые проходят в составе синусного нерва (Херинга) - ветви языкоглоточного нерва. Каротидное тельце находится в области бифуркации общей сонной артерии; Б - клубочек каротидного тельца состоит из 2-3 клеток типа I (гломусные клетки), окружённых поддерживающими клетками (тип II). Клетки типа I образуют синапсы с терминалями афферентных нервных волокон.
ловного мозга). Каждый клубочек содержит 2-3 хемо- чувствительные гломусные клетки, образующие синапсы с терминальными разветвлениями нервных волокон синусного нерва - ветви языкоглоточного нерва. В тельцах также находятся нервные клетки симпатического и парасимпатического отделов вегетативной нервной системы. На этих нейронах и на гломусных клетках заканчиваются преганглионарные симпатические и парасимпатические нервные волокна, а на гломусных клетках также постганглионарные нервные волокна из верхнего шейного симпатического узла [терминали этих волокон содержат светлые (ацетилхолин) или гранулярные (катехоламины) синаптические пузырьки].
■ Гломусные клетки связаны друг с другом при помощи щелевых контактов, в их плазмолемме находятся потенциалзависимые ионные каналы, клетки могут генерировать ПД и содержат разные синаптические пузырьки, включающие ацетилхолин, дофамин, норадреналин, вещество P и метионин-энкефалин.
■ Механизм регистрации ΔΡο2, ∆Pco2 и ΔρΗ окончательно не установлен, но он приводит к блокаде К+-каналов, что вызывает деполяризацию плазмолеммы гломусных клеток, открытие потенциалзависимых Са2+-каналов, внутриклеточное увеличение [Са2+] и секрецию нейромедиаторов.
■ Синапсы между гломусными клетками и афферентами синусного нерва. Под влиянием освобождаемых из гломусных клеток нейромедиаторов в терминалях генерируется постсинаптический потенциал и далее ПД. Эти чувствительные нейроны в свою очередь образуют синапсы с дыхательными нейронами ядра одиночного пути в составе дорсальной дыхательной группы (см. рис. 25-9).
♦ Аортальные (парааортальные) тельца рассыпаны по вну- тренней поверхности дуги аорты и содержат гломусные хемочувствительные клетки, образующие синапсы с афферентами блуждающего нерва.
Ф Центральные хеморецепторы (нервные клетки стволовой части мозга) регистрируют в межклеточной жидкости мозга pH и PCO2, они особенно чувствительны к увеличению PCO2 (гиперкапния), а часть из них - к уменьшению pH (ацидоз). Существенно, что центральные хеморецепторы расположены кнутри от гематоэнцефалического барьера, т.е. они отделены от крови в системе общей циркуляции и, в частности, находятся в более кислой среде, чем наблюдается в то же самое время в крови.
♦ Гематоэнцефалический барьер (рис. 25-11) изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров, клетки которого связаны между собой цепочками плотных контактов, - основа гема- тоэнцефалического барьера. Гематоэнцефалический барьер функционирует как фильтр. Наибольшей проницае-
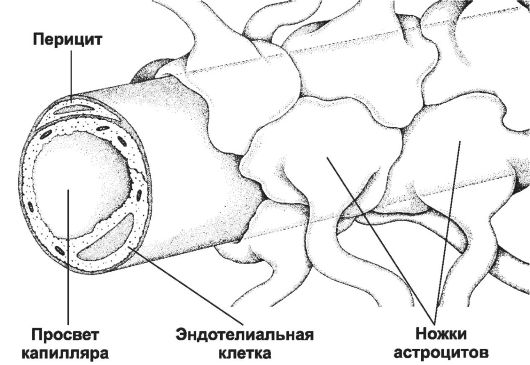
Рис. 25-11. Гематоэнцефалический барьер образован эндотелиальными клетками кровеносных капилляров мозга. Базальная мембрана, окружающая эндотелий и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера [11].
мостью обладают вещества нейтральные (например, O2 и CO2,) и растворимые в липидах (например, никотин, этиловый спирт, героин), но проницаемость ионов (например, Na+, Cl-, H+, HCO3-) низка. ♦ Чувствительные к ацидозу (хемочувствительные к ∆Pco2 и ApH) нейроны, активность которых влияет на лёгоч- ную вентиляцию, обнаружены в вентролатеральной части продолговатого мозга, в двойном ядре, ядрах одиночного пути продолговатого мозга, а также в гипоталамусе, голубоватом месте и ядрах шва моста. Многие из этих хемочувствительных нейронов относятся к серотонинергическим нервным клеткам. Барорецепторы стенки артерий и вен. Эти механорецепторы реагируют на изменения давления в просвете и стенке сосудов, они образованы терминалями волокон, проходящих в составе блуждающего и языкоглоточного нерва. Бароре-
цепторы особенно многочисленны в дуге аорты, сонных артериях (см. рис. 25-10, А), лёгочном стволе, лёгочных артериях и в стенке крупных вен большого и малого круга кровообращения. Барорецепторы участвуют в рефлекторной регуляции кровообращения и дыхания, увеличение АД может привести к рефлекторной гиповентиляции или даже остановке дыхания (апноэ), а снижение АД способно вызвать гипервентиляцию. Φ Рецепторы воздухоносных путей и респираторного отдела регистрируют изменения объёмов лёгких, наличие посторонних частиц и раздражающих веществ и проводят информацию по нервным волокнам блуждающего и языкоглоточного (от верхних отделов воздухоносных путей) нервов к нейронам дорсальной дыхательной группы (см. рис. 25-9). К рецепторам этой группы относятся медленно адаптирующиеся рецепторы растяжения, быстро адаптирующиеся ирритантные рецепторы и J-рецепторы.
♦ Медленно адаптирующиеся рецепторы растяжения расположены среди гладкомышечных клеток, составляющих стенку воздухоносных путей. Они реагируют на увеличение объёма лёгочной ткани (раздувание ткани лёгкого), регистрируя растяжение стенки воздухоносных путей, и проводят пачки импульсов по миелинизированным нервным волокнам. Особенность этих механорецепторов - медленная адаптируемость (при возбуждении рецепторов импульсная активность продолжается длительное время). Эти рецепторы возбуждаются при расширении просвета воздухоносных путей (бронходилатация) и запускают рефлекс Геринга-Брейера (при раздувании лёгкого уменьшается дыхательный объём и учащается дыхание; другими словами, рефлекс Геринга-Брейера направлен на то, чтобы подавить длительность вдоха и увеличить продолжительность выдоха). Одновременно и рефлекторно возникает тахикардия (увеличение ЧСС).
♦ Быстро адаптирующиеся (ирритантные) рецепторы расположены между эпителиальными клетками слизистой оболочки крупных воздухоносных путей. Они (как и медленно адаптирующиеся рецепторы растяжения) реагируют на сильное раздувание лёгочной ткани, но главным
образом на действие поступающих при вдохе раздражающих ткани едких газов (например, аммиака), табачного дыма, пыли, холодного воздуха, а также на наличие в стенке воздухоносных путей гистамина (освобождается из тучных клеток при аллергических реакциях), Пг и брадикининов (поэтому их также называют ирритантными - раздражающими - рецепторами). Возбуждение от рецепторов распространяется по миелинизированным афферентным нервным волокнам блуждающего нерва. Особенность этих рецепторов - быстрая адаптируемость (при возбуждении рецепторов импульсная активность практически прекращается в течение одной секунды). При возбуждении ирритантных рецепторов увеличивается сопротивление воздухоносных путей, рефлекторно возникает задержка дыхания и кашель.
♦ J-рецепторы (от англ. juxtacapillary - околокапиллярные) расположены в межальвеолярных перегородках, являются хемо- и механорецепторами. J-рецепторы возбуждаются при перерастяжении ткани лёгкого, а также при воздействии различных экзо- и эндогенных химических соединений (капсаицин, гистамин, брадикинин, серотонин, простагландины). Пачки импульсов от этих рецепторов направляются в ЦНС по безмиелиновым нервным волокнам (C-волокна) блуждающего нерва. Стимуляция этих рецепторов вызывает рефлекторную задержку дыхания и появление частого, поверхностного дыхания в последующем, сужение просвета воздухоносных путей (бронхоконстрикции), увеличение секреции слизи, а также падение АД и урежение ЧСС (брадикардия).
Φ Внелёгочные рецепторы
♦ Рецепторы лица и носовой полости. Их стимуляция при погружении в воду рефлекторно вызывает остановку дыхания, брадикардию, чиханье.
♦ Рецепторы носоглотки и глотки. При их возбуждении развивается сильное инспираторное усилие («шмыгание»), перемещающее посторонний материал из носоглотки в глотку. Эти рецепторы важны и для глотания, когда одновременно закрывается гортанная щель (впрочем, ново- рождённые могут дышать и глотать одновременно).
♦ Рецепторы гортани. Их раздражение рефлекторно вызывает остановку дыхания (апноэ), кашель и сильные экспираторные движения, необходимые, чтобы предупредить попадание постороннего материала в дыхательные пути (аспирация).
♦ Механорецепторы суставов и мышц (в том числе нервномышечные веретёна). Поступающая от них информация необходима для рефлекторной регуляции мышечного сокращения. Возбуждение этих рецепторов в какой-то степени обусловливает ощущение одышки (диспноэ), воз- никающей в том случае, когда дыхание требует больших усилий (например, при обструкции дыхательных путей).
♦ Болевые и температурные рецепторы. Изменения вентиляции могут возникать в ответ на раздражение различных афферентных нервов. Так, в ответ на боль часто наблюдается задержка дыхания, за которой следует гипервентиляция.
• ЦНС и лёгочная вентиляция. ЦНС не только функционирует в качестве генератора ритма (см. рис. 25-8) и модулятора этого центрального генератора («интегратор сенсорной информации» на рисунке), не только влияет на активность генератора ритма в связи с выполнением других функций воздухоносных путей (голосообразование и обоняние), но и модулирует параметры ритма дыхания при выполнении других функций, контролируемых ЦНС (например, жевание, глотание, рвота, дефекация, терморегуляция, различные эмоции, пробуждение от сна и т.д.). К таким отделам ЦНС относятся, в частности, ретикулярная формация моста, лимбическая доля большого мозга, гипоталамус промежуточного мозга, кора большого мозга. Φ Сон и дыхание. Дыхание во время сна контролируется менее строго, чем во время бодрствования; в то же время сон оказывает сильнейшее воздействие на параметры дыхания, в первую очередь на чувствительность хеморецепторов к APco2 и на ритм дыхания.
■ В течение фазы «медленного» сна ритм дыхания в целом становится более регулярным, чем в состоянии бодрствования, но чувствительность хеморецепторов к APco2 снижается, как и эфферентные влияния на дыхательные мышцы и мышцы глотки.
■ Во время фазы «быстрого» сна происходит дальнейшее снижение чувствительности к APco2, но ритм дыхания становится нерегулярным (вплоть до отсутствия всякого ритма).
■ Заметной чертой фазы быстрого сна является общее снижение мышечного тонуса. Мышцы гортани, глотки и языка участвуют в расслаблении, которое может обусловить обструкцию верхних дыхательных путей. Частым последствием сужения дыхательных путей во время сна является храп.
■ Функция внешнего дыхания и гомеостаз Адекватное выполнение функции внешнего дыхания весьма
важно для поддержания многих параметров гомеостаза, в первую очередь кислотно-щелочного равновесия (КЩР), насыщения крови кислородом (Pao2) и содержания в крови диоксида углерода - CO2 (Paco2). Эти вопросы (в том числе и буферные системы крови) рассматриваются в главе 27.
Φ Наряду с мощными и быстродействующими химическими системами в организме функционируют органные механизмы компенсации и устранения сдвигов КЩР. К наиболее эффективным физиологическим механизмам регуляции КЩР относят процессы, протекающие в лёгких, почках, печени и ЖКТ.
♦ Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР, изменяя объём альвеолярной вентиляции. Система внешнего дыхания в течение нескольких минут способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вен- тиляции лёгких в два раза повышает рН крови примерно на 0,2; снижение вентиляции на 25% может уменьшить рН на 0,3-0,4.
■ Снижение рН в жидкостях организма (плазма крови, спинномозговая жидкость) является мощным стимулом учащения и углубления дыхательных движений. Вследствие этого лёгкие выделяют избыток CO2 (образующийся при диссоциации угольной кислоты). В результате содержание H+ (HCO3- + H+ = H2CO3 - H2O + CO2) в плазме крови и других жидкостях организма уменьшается.
■ Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов. Это приводит к уменьшению альвеолярной вентиляции и к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием H+, - показатель рН снижается.
Гипоксия
Дыхание (внешнее дыхание в лёгких, транспорт газов в крови и тканевое дыхание) направлено на снабжение клеток, тканей, органов и организма кислородом. Недостаточное выполнение функции дыхания приводит к развитию кислородного голодания - гипоксии.
• Терминология. Гипоксия (кислородное голодание, кислородная недостаточность) - состояние, возникающее в результате того, что организм недостаточно обеспечивается кислородом и/или нарушается усвоение кислорода в ходе тканевого дыхания. Гипоксемия (уменьшение по сравнению с должным уровнем напряжения и содержания кислорода в крови) нередко сочетается с гипоксией. Аноксия (отсутствие кислорода и прекращение процессов биологического окисления) и аноксемия (отсутствие кислорода в крови) в целостном живом организме не наблюдаются, эти состояния относятся к экспериментальным или специальным (перфузия отдельных органов) ситуациям.
Дыхательные адаптивные механизмы
Приспособление (адаптация) системы дыхания к мышечной работе, к условиям необычной среды (пониженное и повышенное баро- метрическое давление, гипоксия, загрязнённая среда и т.д.), а также правильная диагностика и лечение дыхательных расстройств определяются тем, насколько глубоко поняты основные физиологические принципы дыхания и газообмена. Ряд респираторных заболеваний - результат неадекватной вентиляции, в то время как другие - результат затруднённой диффузии через аэрогематический барьер.
• Действие повышенного барометрического давления (гипербария). Давление при погружении в воду увеличивается на 1 атм на каждые
• Φ Кислород. При Po2 около
Другие функции органов дыхания
Помимо внешнего дыхания, органы дыхания выполняют ряд дополнительных функций. К ним относятся обоняние, голосо- образование, защитная и метаболическая функции.
Обоняние
Организация и функции обонятельного анализатора рассмотрены в главе 12.
Звукообразование и речь
Гортань рострально отделена от глотки надгортанником, каудально ограничена первым хрящевым полукольцом трахеи и вы- полняет две функции: предотвращает попадание пищи в трахею, смещая надгортанник и смыкая голосовую щель, и обеспечивает звукообразование.
• Голосовые связки - верхние и нижние складки слизистой оболочки в средней части гортани - образуют соответственно ложные и истинные голосовые связки. Пространство между истинными голосовыми связками - голосовая щель. Во время дыхания голосовая щель открыта. Напряжение голосовых связок регулируют мышцы гортани, натягивающие маленькие хрящи, которые находятся на задней стороне гортани, и большой черпаловидный хрящ. При сокращении мышц голосовые связки приближаются друг к другу, и проходящий через голосовую щель воздух заставляет их вибрировать. Чем быстрее воздух проходит через голосовую щель, тем громче звук. Чем ближе связки находятся друг к другу, тем звук выше; чем слабее они натянуты, тем звук ниже.
• Звукообразование - сложный процесс, при котором координируется деятельность дыхательных мышц, мышц гортани, голосовых связок, губ и языка. Голосовые связки могут производить музыкальные звуки широкого диапазона (тоны), а резонанс звуков (наличие обертонов) зависит в первую очередь от околоносовых пазух. Качество звуков определяется также формой грудной клетки, гортани, носоглотки, языка и губ.
• Голоса детей того и другого пола имеют одинаковый диапазон звуков. При пубертате голоса мальчиков «ломаются», так как под воздействием тестостерона объём гортани увеличивается, а голосовые связки удлиняются.
Кондиционирование воздуха
Воздухоносные пути функционируют как установка для кондиционирования воздуха. Характеристики внешнего воздуха: температура, влажность, загрязнённость различными частицами, в том числе с аллергенными свойствами (пыльца растений, домашняя пыль с клещами и др.), наличие микроорганизмов, раздражающих летучих соединений и т.д. - варьируют весьма значительно. Но к респираторной поверхности альвеол (практически к внутрен-
ней среде организма) должен поступать увлажнённый воздух температуры внутренней среды, не содержащий в идеале посторонних частиц. Функцию доведения воздуха до необходимых кондиций и выполняют воздухоносные пути. При этом особо важное значение имеют площадь поверхности воздухоносных путей и мощная сеть кровеносных сосудов слизистой оболочки (особенно носовых ходов), слизистая плёнка на поверхности эпителия и координированная активность мерцательных ресничек, альвеолярные макрофаги и компоненты иммунной системы органов дыхания.
• Полости носа и носоглотка
Φ Посторонние частицы диаметром более 15 мкм задерживаются волосами преддверия носа, а частицы диаметром более 10 мкм осаждаются слизью на поверхности носовых ходов и носоглотки.
Φ Согревание вдыхаемого воздуха происходит главным образом в носовых ходах, чему способствует наличие в их слизистой оболочке тонкостенных полостей, выстланных эндотелием и окружённых ГМК. Обычно эти полости находятся в спавшемся состоянии, но они способны, растягиваясь, накапливать значительное количество крови, что увеличивает толщину слизистой оболочки, существенно уменьшая диаметр носовых ходов и тем самым облегчая тепловой обмен между кровью и воздухом. В эти тонкостенные полости кровь поступает по артериолам, имеющим сфинктеры и регулирующим приток, а оттекает по венулам с большим количеством циркулярно ориентированных ГМК (сфинктеры, регулирующие отток). В зависимости от реальной ситуации (терморецепторы постоянно регистрируют температуру воздуха), к артериолам и венулам поступают по двигательным нервным окончаниям вегетативного отдела нервной системы импульсы, регулирующие степень сокращения ГМК этих сосудов.
• Трахея и бронхи. Здесь происходит осаждение посторонних частиц, дальнейшее увлажнение воздуха и направленный наружу так называемый мукоцилиарный транспорт - постоянное движение слизи по поверхности эпителия.
Φ Посторонние частицы диаметром менее 10 мкм фиксируются слизью, находящейся на поверхности трахеи и бронхов, а также бронхиол.
Φ Плёнка слизи толщиной 5-10 мкм располагается островками над слоем жидкости (толщина 2-5 мкм), окружающей мерцательные реснички эпителия. Слизь имеет свойства геля, характеризуется небольшой вязкостью и значительной эластичностью, содержит 96% воды и электролитов, гликопротеины и молекулы белка (в том числе лизоцим и лактоферрин).
♦ Слизь секретируют бокаловидные клетки в составе поверхностного эпителия трахеи и бронхов, а также секре- торные клетки желёз, находящихся под эпителием.
♦ Воздухоносные пути взрослого человека ежесуточно секретируют около 100 мл слизи, из них 90 мл абсорбиру- ется эпителиальными клетками, а около 10 мл, передвигаясь по поверхности эпителия, достигает глотки, где и проглатывается.
♦ Плёнка слизи, находящаяся на поверхности эпителия, не откашливается. Откашливаемое содержимое просвета воздухоносных путей - мокрота. Мокрота, помимо слизи, секретируемой всеми железами воздухоносных путей, содержит различные дегенерирующие клетки, а также микроорганизмы.
♦ Секреция слизи из желёз находится под парасимпатическим (ацетилхолин), симпатическим (адреналин и норадреналин) и пептидергическим контролем (VIP). Секреция слизи значительно возрастает под влиянием выделяющегося из тучных клеток гистамина, а также ряда производных арахидоновой кислоты, поступающих из разных источников.
• Мукоцилиарный транспорт - система постоянной очистки (клиренса) воздухоносных путей (трахеи и бронхов). За- грязнённая вдыхаемыми частицами плёнка слизи удаляется из воздухоносных путей при её постоянном перемещении по направлению к выходу из дыхательной системы (в глотку) с последующим проглатыванием (в носоглотке слизь перемещается также по направлению к глотке). Такое постоянное движение слизистой плёнки обеспечивается за счёт направленных к глотке синхронных и волнообразных колебаний ресничек, находящихся на поверхности реснитчатых клеток. Эта система клиренса весьма эффективна: осаждённые в плёнке
слизи частицы удаляются за минуты и часы (скорость мукоцилиарного транспорта в трахее и главных бронхах составляет 5-20 мм/мин, по мере уменьшения калибра трубок скорость уменьшается и в мелких бронхах и бронхиолах варьирует от 0,5 до 1,0 мм/мин). Сами реснички в покое окружены жидкостью, лишь верхушка реснички погружена в плёнку слизи. Φ Мерцательные реснички совершают скоординированные, всегда однонаправленные и локально синхронные биения с частотой 900-1200 в минуту. Каждое биение состоит из бы- строго сгибания вертикально ориентированной реснички и медленного её разгибания. В начале сгибания верхушки ресничек с силой перемещаются внутри плёнки слизи, толкая её в направлении сгибания, после сгибания и при разгибании ресничка оказывается в слое жидкости, и лишь при полном разгибании верхушка реснички погружается в плёнку слизи. Φ Транспорт ионов и воды. Реснитчатые клетки эпителия при помощи ионоспецифичных каналов транспортируют из межклеточных пространств стенки воздухоносных путей на поверхность эпителия Cl-, а с поверхности эпителия - Na+ (чрезэпителиальньгй транспорт). Одновременно с этими ионами перемещается и вода. Баланс между секрецией Cl- и абсорбцией Na+ прямо влияет на толщину слоя жидкости, окружающей мерцательные реснички, и тем самым определяет активность ресничек, прямо пропорциональную толщине слоя жидкости. Φ Регуляция клиренса. Клетки эпителия (как поверхностного, так и в составе желёз) воздухоносных путей имеют рецепторы для многих биологически активных веществ. В зависимости от вида активированных рецепторов реакция эпителиальных клеток может быть различной: стимуляция активного ионного транспорта и увеличение частоты биения ресничек происходит через Р2-адренергические, М3-холинергические, VIP-, NK1- (тахикининов) рецепторы относящегося к кальцитониновому гену пептида, фактора активации тромбоцитов PAF и брадикинина. Брадикинин, а также гистамин стимулируют выделение ПгЕ2, (бронходилататор), гистамин - оксида азота (NO), а TNF-α, ИЛ-1 и γ-ИФН индуцируют синтез оксида азота (NO) и разных цитокинов.
• Бронхиолы и респираторный отдел. В стенке бронхиол в норме отсутствуют бокаловидные клетки (у курильщиков табака и при хронических бронхитах бокаловидные клетки обнаруживаются вплоть до респираторных бронхиол) и железы, а по мере приближения к респираторной поверхности исчезают и реснитчатые клетки. Поэтому в этих мелких воздухопроводящих трубках отсутствует система мукоцилиарного транспорта, и частицы диаметром менее 0,5 мкм в виде аэрозоля достигают респираторной поверхности. Тем не менее и здесь функционирует система очистки воздуха (клиренса), обеспечиваемой альвеолярными макрофагами, клетками Клара, сурфактантом, а также перемещением воздуха при дыхательных движениях (что способствует удалению взвешенных частиц). Φ Альвеолярные макрофаги расположены на поверхности альвеол, с помощью длинных отростков они прикрепляются к поверхности эпителия и активно перемещаются по ней. Функции альвеолярных макрофагов многообразны.
♦ Фагоцитоз. Макрофаги фагоцитируют остатки сурфактанта, погибшие клетки, микроорганизмы, частицы аэрозоля и пылевые частицы.
♦ Антимикробная и противоопухолевая активность макрофагов опосредована кислородными радикалами, протеазами и различными цитокинами.
♦ Антитрипсин. Альвеолярные макрофаги секретируют α1-антитрипсин - гликопротеин из семейства сериновых протеаз, защищающий эластин альвеол от расщепления эластазой лейкоцитов. Мутация генаα1-антитрипсина - причина врождённой эмфиземы лёгких (поражение эластического каркаса альвеол).
♦ Антигенпредставляющая функция выражена слабо. Более того, альвеолярные макрофаги вырабатывают факторы, ингибирующие функцию T-лимфоцитов, что снижает иммунный ответ.
♦ Пути миграции. Нагруженные фагоцитированным материалом макрофаги мигрируют в различных направлениях: вверх по бронхиолам и мелким бронхам, где макрофаги попадают в слизистую плёнку, и внутрь - в межальвеолярные перегородки, где они составляют 10-15% всех клеток перегородок.
Φ Сурфактант имеет несколько функций: 1) предотвращает контакт поверхности альвеолоцитов с посторонними частицами и инфекционными агентами, попадающими в альвеолы с вдыхаемым воздухом; 2) обволакиваемые сурфактантом частицы аэрозоля транспортируются из альвеол в бронхиальную систему, из которой они удаляются мукоцилиарным транспортом; 3) сурфактант опсонизирует микроорганизмы, что облегчает их фагоцитоз альвеолярными макрофагами; 4) сурфактант снижает поверхностное натяжение и тем самым стабилизирует мелкие дыхательные пути.
Φ Клетки Клара расположены в терминальных бронхиолах между реснитчатыми клетками и формируют дистальные (безреснитчатые) участки эпителия. Эти клетки секретируют гликозаминогликаны, определяющие консистенцию секрета бронхиол, а также служат источником липопротеинов для сурфактанта терминальных бронхиол. Наконец, клетки Клара участвуют в инактивации поступающих с вдыхаемым воздухом токсинов при помощи холестерол монооксигеназы (цитохром Р450).
Просвет воздухоносных путей
Воздухоносные пути не спадаются, а их просвет постоянно изменяется и регулируется в связи с реальной ситуацией. Спадение просвета воздухоносных путей предотвращает наличие в их стенке плотных структур, образованных в начальных отделах костной, а далее - хрящевой тканью. Величину просвета воздухоносных путей изменяют также складки слизистой оболочки, ГМК (тонус ГМК) и эластические структуры стенки. На состояние просве- та бронхиального дерева значительное влияние оказывает и тонус ГМК кровеносных сосудов, находящихся в тесном контакте с бронхиальным деревом.
• Тонус ГМК воздухоносных путей регулируют нейромедиаторы, гормоны, метаболиты арахидоновой кислоты. Эффекты зависят от наличия соответствующих рецепторов. ГМК стенки воздухоносных путей имеют м-холинорецепторы, рецепторы гистамина, а- и β-адренорецепторы и др. Нейромедиаторы секретируются из терминалей нервных окончаний вегетативного отдела нервной системы (для блуждающего нерва - ацетилхолин; для нейронов симпатического ствола - норадреналин).
Φ Бронхоконстрикция. Сужение просвета воздухоносных путей вызывается ацетилхолином, веществом Р, нейрокинином A, гистамином, ПгГ_)2, тромбоксаном TXA2, лейкотриенами LTC4, LTD4, LTE4.
Φ Бронходилатация. VIP, адреналин, брадикинин, ПгЕ2 вызывают расширение просвета воздухоносных путей.
• Тонус ГМК бронхиальных сосудов
Φ Вазоконстрикция. Сокращение ГМК бронхиальных сосудов вызывают адреналин, лейкотриены LTC4, LTD4, LTE4, ангиотензин II, эндотелин.
Φ Вазодилатация. Расслабляющее действие на ГМК сосудов бронхов оказывают гистамин, брадикинин, VIP, ПгD2, тромбоксан TXA2, оксид азота (NO), простациклин I2.
Иммунная защита
Слизистая оболочка воздухоносных путей участвует в защитных иммунных реакциях. В состав эпителия входят отдельные лим- фоциты и антигенпредставляющие клетки Лангерханса (см. рис. 25-12), тогда как собственный слой слизистой оболочки содержит значительное количество различных иммунокомпетентных клеток (T- и B-лимфоциты; синтезирующие Ig плазматические клетки; макрофаги и дендритные клетки). Особенности иммунной системы дыхательных путей: специальные антигенпредставляющие клетки (дендритные и Лангерханса), постоянное наличие в эпителии лимфоцитов, трансэпителиальный перенос IgA на поверхность эпителия, выраженность аллергических реакций немедленного типа (тип I реакций гиперчувствительности), при которых происходит дегрануляция тучных клеток и освобождение из них гистамина и других медиаторов, оказывающих мощный бронхоконстрикторный эффект и значительно усиливающих секрецию желёз.
• Антигенпредставляющие клетки. Дендритные клетки и клетки Лангерханса (рис. 25-12) - главные антигенпредставляющие клетки лёгкого. Их особенно много в верхних дыхательных путях. С уменьшением калибра бронхов количество этих клеток уменьшается. Как антигенпредставляющие, лёгочные клетки Лангерханса и дендритные клетки экспрессируют молекулы MHC I и MHC II. Эти клетки имеют рецепторы Fc-фрагмента IgG, фрагмента C3bi-комплемента, ИЛ-2. Клетки синтезируют ряд цитокинов, включая ИЛ-1, ИЛ-6, фактор некроза опу-
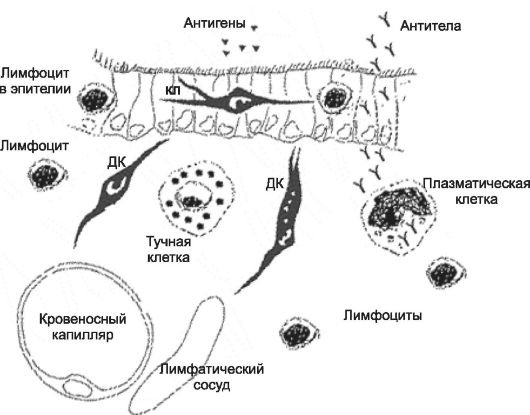
Рис. 25-12. Иммунокомпетентные клетки стенки бронха [11]. Над однослойным эпителием схематически даны Аг (треугольники) и АТ (в виде буквы Y). В нижней части рисунка изображены просветы кровеносного капилляра (слева) и лимфатического сосуда (справа). В собственном слое слизистой оболочки (средняя часть рисунка) слева направо: лимфоцит, дендритная клетка (ДК), тучная клетка, плазматическая клетка, лимфоциты. Дендритные клетки в паренхиму лёгких поступают с кровью. Часть из них мигрирует в эпителий внутрилёгочных воздухоносных путей и дифференцируется в клетки Лангерханса (КЛ). Последние захватывают Аг и переносят его в регионарные лимфатические узлы.
• холи α (TNF-α); стимулируют T-лимфоциты, проявляя повышенную активность в отношении Аг (аллергенов), впервые оказавшихся в организме. Плазматические клетки. Клоны этих клеток дифференцируются из B-лимфоцитов и отвечают за синтез АТ (IgG, IgE, IgA). IgG попадают в кровь и циркулируют в ней в составе фракции γ-глобулинов, IgE принимают участие в местных аллергических реакциях, IgA транспортируются через эпителиальные
• клетки при помощи опосредованного рецепторами эндоцитоза (см. гл. 2 и рис. 2-12) и последующего экзоцитоза на поверхность воздухоносных путей и здесь нейтрализуют Аг. Тучные клетки морфологически и функционально сходны с базофилами крови, но это различные клеточные типы. Тучная клетка, как и базофил, происходит из предшественника в костном мозге, но окончательную дифференцировку проходит в соединительной ткани. Их особенно много в коже, в слизистой оболочке органов дыхательной и пищеварительной системы, вокруг кровеносных сосудов. Тучные клетки содержат многочисленные крупные гранулы (модифицированные лизосомы). В плазмолемму встроены различные рецепторы, в том числе рецепторы к Fc-фрагменту IgE. Φ Гранулы. Тучные клетки синтезируют и накапливают в гранулах разнообразные биологически активные вещества, медиаторы и ферменты: гепарин (гепаринсульфат), гистамин, триптазу, химазу, эластазу, дипептидазу, активатор плазминогена, кислые гидролазы, фактор хемотаксиса эозинофилов (ECF), фактор хемотаксиса нейтрофилов (NCF). Основной компонент гранул - отрицательно заряженный сульфатированный гликозаминогликан гепарин, синтезируемый и запасаемый исключительно тучными клетками. Секретируемый клеткой гепарин связывает циркулирующий в крови антитромбин III, резко усиливая его противо- свёртывающую активность. Гистамин вызывает сокращение ГМК, гиперсекрецию слизи, увеличение проницаемости сосудов и развитие отёка. Триптаза способствует расщеплению фибриногена, конверсии компонента комплемента С3 в анафилатоксин С3а, активации коллагеназы, деградации фибронектина. Триптаза, химаза, карбоксипептидаза В, другие протеазы и кислые гидролазы, выделяясь из дегранулирующей клетки, вызывают разрушение тканевого матрикса. При активации тучных клеток (наряду с секрецией содержимого гранул) образуются метаболиты арахидоновой кислоты - Пг, тромбоксан TXA2 и лейкотриены. Эти медиаторы обладают вазо- и бронхоактивными свойствами. Из мембранных фосфолипидов также образуется фактор активации тромбоцитов (PAF), относящийся к наиболее сильным спазмогенам.
Φ Функции. Тучные клетки участвуют в воспалительных и аллергических реакциях.
Φ Дегрануляция. Аг-связытающие Fab-фрагменты молекулы IgE специфически реагируют с Аг, попавшим в организм. Сформированный иммунный комплекс взаимодействует с рецепторами Fc-фрагментов IgE, встроенных в клеточную мембрану тучной клетки. Это взаимодействие и является сигналом к дегрануляции с высвобождением гистамина и других биологически активных веществ и развёртывани- ем острой аллергической реакции, проявляющейся резким расширением просвета венул и увеличением проницаемости их стенки (развивается отёк). Одновременно усиливается секреторная активность клеток и просвет воздухоносных путей заполняется слизью, а также происходит сокращение ГМК стенки воздухоносных путей и уменьшение их просвета. Подобную картину можно наблюдать при аллергических реакциях (например, при бронхиальной астме, аллергическом рините, крапивнице).
Метаболические функции лёгких
В лёгких метаболизирует ряд биологически активных веществ.
• Ангиотензины. Декапептид ангиотензин I (обладает слабой сосудосуживающей активностью) конвертируется в мощный вазоконстриктор - октапептид ангиотензин II. Конверсию катализирует ангиотензинпревращающий фермент эндотелиальных клеток капилляров альвеол.
• Инактивация. Многие биологически активные вещества частично или полностью инактивируются в лёгких. Так, брадикинин инактивируется на 80% при помощи ангиотензинпревращающего фермента. С помощью соответствующих ферментов в лёгких инактивируются ПгE1,ПгE2, (но не ПгA1, ПгА2 ПгI2), лейкотриены, серотонин и норадреналин. В лёгких инактивируется также серотонин, но не ферментативно, а путём выведения из крови.
• Производные арахидоновой кислоты. Некоторые вазоактивные и бронхоактивные вещества метаболизируют в лёгких и могут освобождаться в кровоток. Наиболее важными среди них являются метаболиты арахидоновой кислоты: лейкотриены, вызывающие сужение воздухоносных путей и участвующие в
воспалительных реакциях, и Пг (мощные вазоконстрикторы или вазодилататоры).
Обобщение главы
Основной функцией лёгких является обмен газов, включающий ряд этапов: вентиляцию, поступление газа, кровоток, сопряжение кровотока и потока воздуха и транспорт газа.
Альвеолярно-капиллярная мембрана образует огромную поверхность взаимодействия газа и крови для диффузии кислорода и диоксида углерода.
Движение воздуха в лёгкие и из них связано с альвеолярным давлением.
Отрицательное альвеолярное давление создаёт движение воздуха внутрь лёгких во время вдоха, а положительное альвеолярное давление - из лёгких во время выдоха.
Альвеолярная вентиляция - количество свежего воздуха, поступающего в альвеолы и регулирующего уровень диоксида углерода в крови.
Податливость является мерой растяжимости лёгких.
Сурфактант и межальвеолярное взаимодействие поддерживают устойчивость альвеол.
Турбулентность воздухопотока существенно влияет на сопротивление воздухопроводящих путей.
Работа дыхания требуется для растяжения лёгких и для того, чтобы преодолеть сопротивление воздухопроводящих путей.
Лёгочное кровообращение является системой высокого потока, низкого сопротивления и низкого давления.
Первичной причиной, вызывающей уменьшение лёгочного сосудистого сопротивления при увеличении сердечного выброса, является одномоментное раскрытие (вербовка) лёгочных капилляров.
Гравитация вызывает региональные различия в вентиляционноперфузионных соотношениях в лёгких.
Лёгочная вентиляция контролируется положительными и отрицательными системами обратной связи автоматически в зависи- мости от потребления кислорода и кислотно-щёлочного баланса и произвольно путём координации активности.
Нормальное содержание газов в артериальной крови поддерживается на стабильном уровне, а работа дыхания минимальна,
несмотря на изменение активности, колебания во внешней среде и в лёгочной функции.
Основной дыхательный ритм генерируется нейронами в мозговом стволе и может модифицироваться дыхательными рефлексами.
Частота и глубина дыхания в конечном счёте регулируются нервными окончаниями блуждающего нерва, чувствительными к растяжению лёгких.
Вегетативные нервы и афферентные волокна блуждающего нерва обеспечивают локальный контроль воздухопроводящей функции.
Pco2 артериальной крови - наиболее важный фактор, определяющий характер дыхания у человека в состоянии покоя.
Центральные хеморецепторы реагируют только на изменения Pco2 в артериальной крови; периферические хеморецепторы определяют изменения Ро2, Pco2 и pH в артериальной крови.