Нормальная физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. 2010. - 832 с.
|
|
|
|
ГЛАВА 18. ЭНДОКРИННАЯ СИСТЕМА
Для эндокринной системы ключевым является понятие «гормон». Гормоны - межклеточные гуморальные химические регуляторы - секретируются во внутреннюю среду организма (преимущественно в кровь) из специализированных (эндокринных) клеток и действуют на клетки-мишени, содержащие молекулы рецепторов к конкретным гормонам. Такое дистантное (через кровоток) взаимодействие между клетками-продуцентами гормонов и клетками- мишенями известно как эндокринная регуляция. Паракринная регуляция подразумевает эффекты гормонов, влияющих путём диффузии на соседние клетки-мишени, а аутокринная - непосредственно на секретирующие эти гормоны клетки (см. рис. 4-7). Имеется также много других «неклассических» продуцирующих гормоны желёз. Сюда относится ЦНС, почки, желудок, тонкая кишка, кожа, сердце и плацента. Новейшие исследования в клеточной и молекулярной биологии постоянно расширяют наши представления об эндокринной системе, например открытие лептина - гормона, образующегося из жировых клеток.
Информационные межклеточные взаимодействия, осуществляемые гормонами, укладываются в указанную ниже последовательность событий: «сигнал (гормон) - рецептор - (второй посредник) - физиологический ответ». Физиологические концентрации гормонов, осуществляющих гуморальную регуляцию функций, колеблются в пределах 10-7-10-12 М, т.е. гормоны эффективны в крайне низких концентрациях.
Разнообразные гормоны и гормональные системы регулируют практически все функции организма, включая метаболизм, репродукцию, рост и развитие, водный и электролитный баланс и поведение. Регуляцию активности многих эндокринных желёз осуществляют при помощи механизмов обратной связи гипофиз и гипоталамус.
Синтез некоторых гормонов (адреналин, норадреналин и др.) непосредственно не зависит от регулирующего влияния гипофиза и контролируется симпатической нервной системой.
Химия гормонов
По химической структуре гормоны, а также другие биологически активные вещества регуляторного характера (например, фак- торы роста, интерлейкины, интерфероны, хемокины, ангиотензины, Пг и ряд других) подразделяются на пептидные, стероидные, производные аминокислот и арахидоновой кислоты.
• Пептидные гормоны относятся к полярным веществам, которые не могут непосредственно проникать через биологические мембраны. Поэтому для их секреции используется механизм экзоцитоза. По этой же причине рецепторы пептидных гормонов встроены в плазматическую мембрану клетки-мишени, а передачу сигнала к внутриклеточным структурам осуществляют вторые посредники.
• Стероидные гормоны - минералокортикоиды, глюкокортикоиды, андрогены, эстрогены, прогестины, кальцитриол. Эти соединения - производные холестерола - относятся к неполярным веществам, поэтому они свободно проникают через биологические мембраны. По этой причине секреция стероидных гормонов происходит без участия секреторных пузырьков. По этой же причине рецепторы неполярных молекул расположены внутри клетки-мишени. Такие рецепторы в общем виде называются ядерными.
• Производные аминокислот - тирозина (йодсодержащие гормоны щитовидной железы, норадреналин, адреналин и дофамин), гистидина (гистамин), триптофана (мелатонин и серотонин).
• Производные арахидоновой кислоты (эйкозаноиды, или простаноиды). Эйкозаноиды (от греч. eikosi - двадцать) состоят (как и арахидоновая кислота) из 20 атомов углерода. К ним относятся простагландины (Пг), тромбоксаны, простациклины, лейкотриены, гидроксиэйкозотетраеноевая (HETE, от англ. hydroxyeicosatetraenoic) и эпоксиэйкозотриеноевая кислоты, а также производные этих кислот. Все эйкозаноиды обладают высокой и разносторонней физиологической активностью, многие из них функционируют только внутри клетки.
Механизмы действия гормонов на клетки-мишени
Информационные межклеточные взаимодействия, реализуемые в эндокринной системе, предусматривают такую последовательность событий:
гормон - рецептор клетки-мишени - (второй посредник) - ответ
клетки-мишени
Каждый гормон оказывает на клетку-мишень регулирующий эффект тогда и только тогда, когда он в качестве лиганда свя- зывается со специфичным для него белком-рецептором в составе клетки-мишени.
Циркуляция в крови. Гормоны циркулируют в крови либо свободно, либо в комплексе со связывающими их белками (T4, Т3, стероидные гормоны, инсулиноподобные факторы роста, гормон роста). Связывание с такими белками существенно увеличивает время полужизни гормонов. Так, T4 в составе комплекса циркулирует около 1 нед, тогда как время полужизни свободного T4 составляет несколько минут.
Обобщение раздела
Эндокринная система интегрирует функции органов и систем посредством гормонов, которые секретируются как из классиче- ских эндокринных желёз, так и из органов и тканей, первичная функция которых не является эндокринной.
Гормоны могут посылать сигналы клеткам, которые их вырабатывают (аутокринная регуляция), или соседним клеткам (пара- кринная регуляция), классические эндокринные железы выделяют химические сигналы в кровь, которые достигают отдалённых тканевых мишеней.
Клетки-мишени распознают гормоны в зависимости от специфических высокородственных рецепторов, которые могут располагаться на поверхности клеток, внутри цитоплазмы или на мишени клеточного ядра.
Гормональные сигналы организованы в иерархическую систему обратных связей, каскады, усиливающие эффекты в миллионы раз и подчас определяющие характер выделяемого секрета.
Большинство гормонов оказывает разнообразное воздействие и обладают способностью наряду с другими гормонами контролировать жизненно важные параметры.
Химически гормоны могут быть метаболитами отдельных аминокислот, пептидов или метаболитами холестерина и в зависимо-
сти от их растворимости транспортироваться в кровь в свободном (амины и пептиды) или в связанном с транспортными белками виде (стероидные и тиреоидные гормоны).
ГОРМОНЫ И ИХ ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
В этом разделе дана физиологическая характеристика различных гормонов, синтезируемых и секретируемых клетками эндокринной системы.
ГИПОТАЛАМО-ГИПОФИЗАРНАЯ СИСТЕМА
Часть промежуточного мозга - гипоталамус - и отходящий от его основания гипофиз анатомически и функционально составляют единое целое - гипоталамо-гипофизарную эндокринную систему (см. рис. 16-2, В, Г).
Гипоталамус
В нейросекреторных нейронах гипоталамуса синтезируются нейропептиды, поступающие в переднюю (рилизинг-гормоны) и заднюю (окситоцин и вазопрессин) доль гипофиза.
Рилизинг-гормоны
Гипоталамические рилизинг-гормоны (от англ. releasing hormone) - группа нейрогормонов, мишенями которых являются эндокринные клетки передней доли гипофиза. С функциональной точки зрения рилизинг-гормоны подразделяются на либерины (рилизинг-гормоны, способствующие усилению синтеза и секреции соответствующего гормона в эндокринных клетках передней доли гипофиза) и статины (рилизинг-гормоны, подавляющие синтез и секрецию гормонов в клетках-мишенях). К гипоталамическим либеринам относятся соматолиберин, гонадолиберин, тиреолиберин и кортиколиберин, а статины представлены соматостатином и пролактиностатином.
• Соматостатин - мощный регулятор функций эндокринной и нервной системы, ингибирующий синтез и секрецию множества гормонов и секретов.
• Соматолиберин. Гипоталамический соматолиберин стимулирует секрецию гормона роста в передней доле гипофиза.
• Гонадолиберин (люлиберин) и пролактиностатин. Ген LHRH
кодирует аминокислотные последовательности для гонадолиберина и пролактиностатина. Гонадолиберин - важнейший нейрорегулятор репродуктивной функции; он стимулирует синтез и секрецию ФСГ и ЛГ в продуцирующих гонадотрофы клетках, а пролактиностатин подавляет секрецию пролактина из лактотрофных клеток передней доли гипофиза. Люлиберин - декапептид.
• Тиреолиберин - трипептид, который синтезируется многими нейронами ЦНС (в том числе нейросекреторными нейронами паравентрикулярного ядра). Тиреолиберин стимулирует секрецию пролактина из лактотрофов и тиреотропина из тиреотрофов передней доли гипофиза.
• Кортиколиберин синтезируется в нейросекреторных нейронах паравентрикулярного ядра гипоталамуса, плаценте, Т-лимфоцитах. В передней доле гипофиза кортиколиберин стимулирует синтез и секрецию АКТГ и других продуктов экспрессии гена проопиомеланокортина.
• Меланостатин подавляет образование меланотропинов. Либерины и статины по аксонам гипоталамических нейронов
достигают
срединного возвышения, где они секретируются в кровеносные сосуды
портальной системы кровотока, далее по воротным венам гипофиза эти
нейрогормоны поступают в переднюю долю гипофиза и регулируют активность
её эндокринных клеток (табл. 18-
Таблица 18-1. Эффекты гипоталамических нейрогормонов на секрецию гормонов аденогипофиза [11]
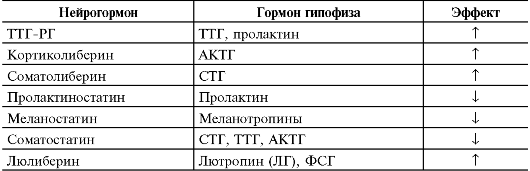
• Роль дофамина. Промежуточный продукт метаболизма тирозина и предшественник норадреналина и адреналина - катехоловый амин дофамин (3-гидрокситирамин), поступающий к клеткам передней доли гипофиза через кровь, - ингибирует секрецию ФСГ, лютропина (ЛГ), ТТГ и пролактина.
Гормоны задней доли гипофиза
Нанопептиды
вазопрессин и окситоцин синтезируются в перикарионах нейросекреторных
нейронов паравентрикулярного и супраоптического ядер гипоталамуса,
транспортируются по их аксонам в составе гипоталамо-гипофизарного пути в
заднюю долю гипофиза, где и секретируются в кровь (см. рис. 16-
• Вазопрессин (аргинин-вазопрессин, антидиуретический гормон - АДГ) оказывает антидиуретический (регулятор реабсорбции воды в канальцах почки) и сосудосуживающий (вазоконстриктор) эффекты (эти эффекты гормона вызывают повышение системного АД). Главная функция АДГ - регуляция обмена воды (поддержание постоянного осмотического давления жидких сред организма), что происходит в тесной связи с обменом натрия.
Секрецию АДГ стимулируют гиповолемия через барорецепторы каротидной области, гиперосмоляльность через осморецепторы гипоталамуса, переход в вертикальное положение, стресс, состояние тревоги.
Секрецию АДГ подавляют алкоголь, α-адренергические агонисты, глюкокортикоиды.
• Окситоцин стимулирует сокращение ГМК миометрия в родах, при оргазме, в менструальной фазе, секретируется при раздражении соска и околососкового поля и стимулирует сокращение миоэпителиальных клеток, составляющих альвеолы лактирующей молочной железы (рефлекс молокоотделения).
Передняя доля гипофиза
В передней доле синтезируются и секретируются так называемые тропные гормоны и пролактин. Тропными называют гормоны, мишенями которых являются другие эндокринные клетки.
По химической структуре гормоны аденогипофиза являются либо пептидными гормонами, либо гликопротеинами.
• Гликопротеины - тиреотропный гормон и гонадотропины (лютеинизирующий гормон - ЛГ и фолликулостимулирующий гормон - ФСГ).
• Полипептидные гормоны - гормон роста, адренокортикотропный гормон (АКТГ) и пролактин. При экспрессии гена проопиомеланокортина, помимо АКТГ, происходит синтез и секреция ряда других пептидов: β- и γ-липотропинов, меланокортинов (α-, β- и γ-меланотропины), β-эндорфина, АКТГподобного пептида, при этом установлено, что меланотропины выполняют гормональную функцию; функции остальных пептидов изучены недостаточно.
Гормоны роста
Гормон роста (соматотрофный гормон - СТГ, соматотропин) нормально синтезируется только в ацидофильных клетках (сома- тотрофы) передней доли гипофиза. Другой гормон роста - хорионический соматомаммотрофин (плацентарный лактоген). Эффекты гормонов роста опосредуют инсулиноподобные факторы роста - соматомедины. Гормоны роста - анаболики, они стимулируют рост всех тканей.
• Регуляторы экспрессии (табл. 18-2).
Таблица 18-2. Стимулирующее и подавляющее влияние на секрецию гор- мона роста
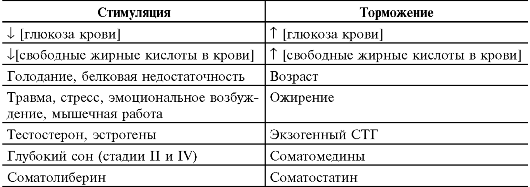
• Суточная периодичность секреции. СТГ поступает в кровь циклически - «взрывами секреции», чередующимися с периодами прекращения секреции (продолжительность такого цик-
ла измеряется минутами). Пик секреции СТГ приходится на третью и четвёртую фазы сна.
• Возрастные изменения секреции СТГ. Содержание СТГ в плазме крови максимально в раннем детском возрасте, постепенно оно уменьшается с возрастом и составляет в 5-20 лет 6 нг/мл (с пиком в стадии пубертата), в 20-40 лет 3 нг/мл, после 40 лет - 1 нг/мл.
• Функции
СТГ - анаболический гормон, стимулирующий рост всех клеток за счёт увеличенного поступления в клетки аминокислот и усиления синтеза белка. Наиболее очевидны долговременные эффекты СТГ на рост костей. При этом мишенями СТГ являются клетки эпифизарной хрящевой пластинки длинных трубчатых костей и остеобласты периоста и эндоста.
Метаболические эффекты СТГ двухфазны, направлены на поддержание уровня глюкозы в крови и на обеспечение энергетических затрат организма.
Начальная фаза (инсулиноподобный эффект). СТГ увеличивает поглощение глюкозы мышцами и жировой тканью, а также поглощение аминокислот и синтез белка мышцами и печенью. Одновременно СТГ угнетает липолиз в жировой ткани. Через несколько минут развивается отсроченная фаза эффектов СТГ.
Отсроченная фаза (антиинсулиноподобный, или диабетогенный эффект). Спустя несколько десятков минут происходит угнетение поглощения и утилизации глюкозы (содержание глюкозы в крови увеличивается) и усиление липолиза (содержание свободных жирных кислот в крови увеличивается).
Обмен белка. СТГ стимулирует поступление аминокислот и синтез белка в клетках (анаболический эффект).
Жировой обмен. СТГ усиливает липолиз, освобождающиеся при этом жирные кислоты используются для пополнения энергетических затрат клеток.
В итоге под влиянием СТГ изменяется очерёдность использования веществ, необходимых для получения энергии: используются жиры, а не углеводы или белки. Поскольку СТГ имеет анаболический эффект, это приводит к увеличению массы тела без накопления жиров.
• Циркуляция в крови. Время полужизни СТГ в крови составляет около 25 мин. Примерно 40% выделившегося СТГ образует комплекс с СТГ-связывающим белком, при этом продолжительность полужизни СТГ значительно возрастает.
• Рецептор СТГ относится (вместе с рецепторами пролактина, ряда интерлейкинов и эритропоэтина) к семейству цитокиновых рецепторов (связанные с тирозинкиназой рецепторы). СТГ связывается также с рецептором пролактина.
• Соматомедины C и A (полипептиды из 70 и 67 аминокислотных остатков соответственно) опосредуют эффекты СТГ, выступая в качестве аутокринных факторов роста. Оба соматомедина имеют выраженную структурную гомологию с проинсулином, поэтому их также называют инсулиноподобными факторами роста. Рецепторы соматомединов, как и рецептор инсулина, относятся к рецепторным тирозинкиназам. Соматомедин C, связываясь с его рецепторами, стимулирует синтез гипофизарного СТГ и гипоталамического соматостатина и подавляет синтез гипоталамического соматолиберина.
Адренокортикотропный гормон
Адренокортикотропный гормон (АКТГ, кортикотропин). Структуру АКТГ кодирует ген проопиомеланокортина.
• Суточный ритм. Секреция АКТГ начинает расти после засыпания и достигает пика при пробуждении.
• Функции. АКТГ стимулирует синтез и секрецию гормонов коры надпочечников (преимущественно глюкокортикоида кортизола).
• Рецепторы АКТГ (АКТГ связывается с рецептором меланокортина типа 2) относятся к мембранным, связанным с G-белком (активирует аденилатциклазу, что при помощи цАМФ в конечном счёте активирует многочисленные ферменты синтеза глюкокортикоидов).
Меланокортины
Меланокортины (меланотропины) контролируют пигментацию кожи и слизистых оболочек. Экспрессия АКТГ и меланокортинов в значительной степени сочетается. Меланостатин подавляет секрецию меланотропинов (вероятно, и АКТГ). Известно несколько типов рецепторов меланокортинов; через тип 2 этих рецепторов осуществляется также воздействие АКТГ.
Гонадотропные гормоны
К этой группе относят гипофизарные фоллитропин (фолликулостимулирующий гормон - ФСГ) и лютропин (ЛГ, лютеинизи- рующий гормон), а также хорионический гонадотропин (ХГТ) плаценты.
• Фолликулостимулируюший гормон (ФСГ, фоллитропин) у женщин вызывает рост фолликулов яичника, у мужчин регулирует сперматогенез (мишени ФСГ - клетки Сертоли).
• Лютеинизирующий гормон (ЛГ, лютропин) стимулирует синтез тестостерона в клетках Ляйдига яичек (у мужчин ЛГ иногда называют стимулирующим интерстициальные клетки гормоном), синтез эстрогенов и прогестерона в яичниках, стимулирует овуляцию и образование жёлтого тела в яичниках.
• Хорионический гонадотропин (ХГТ) синтезируется клетками трофобласта с 10-12-го дня развития. При беременности ХГТ взаимодействует с клетками жёлтого тела и стимулирует синтез и секрецию прогестерона.
Тиреотропный гормон
Тиреотропный гормон гликопротеиновой природы (ТТГ, тиреотропин) стимулирует синтез и секрецию йодсодержащих гормонов щитовидной железы (T3 и T4). Тиреотропин стимулирует дифференцировку эпителиальных клеток щитовидной железы (кроме так называемых светлых клеток, синтезирующих тиреокальцитонин) и их функциональное состояние (включая синтез тиреоглобулина и секрецию T3 и T4).
Пролактин
Пролактин ускоряет развитие молочной железы и стимулирует секрецию молока. Синтез пролактина происходит в ацидофильных аденоцитах (лактотрофы) передней доли гипофиза. Количество лактотрофов составляет не менее трети всех эндокринных клеток аденогипофиза. При беременности объём передней доли удваивается за счёт увеличения числа лактотрофов (гиперплазия) и увеличения их размеров (гипертрофия). Главная функция пролактина - стимуляция функции молочной железы.
Обобщение раздела
Гипоталамо-гипофизарная ось представлена гипоталамусом, передним и задним гипофизом.
Аргинин-вазопрессин и окситоцин синтезируются в нейронах гипоталамуса, аксоны которых заканчиваются в задней доле гипо- физиза.
Аргинин-вазопрессин увеличивает реабсорбцию воды почками в ответ на увеличение осмолярности крови или уменьшение объёма крови.
Окситоцин стимулирует отдачу молока молочной железой в ответ на сосание и мышечное сокращение матки в ответ на расши- рение шейки матки во время родов.
Гормоны АКТГ, СТГ, пролактин, ЛГ, ФСГ, ТТГ синтезируются в передней доле гипофиза и выделяются в ответ на гипоталамиче- ские рилизинг-гормоны, поступающие в кровь воротной циркуляции гипофиза.
ШИШКОВИДНОЕ ТЕЛО
Шишковидное тело (corpus рineale) - небольшой (5-8 мм) вырост промежуточного мозга, соединённый ножкой со стенкой третьего желудочка (рис. 18-1). Из паренхиматозных клеток этой железы - пинеалоцитов - в ликвор и кровь секретируется произ-
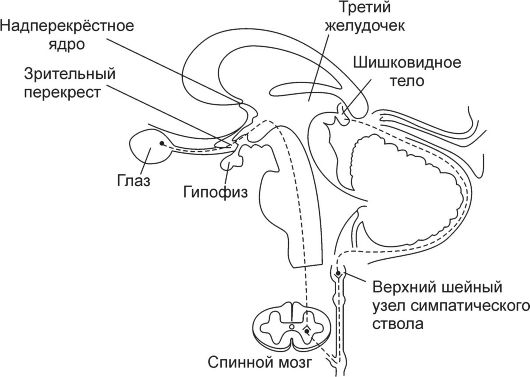
Рис. 18-1. Топография и иннервация шишковидной железы.
водное триптофана - мелатонин. Орган снабжён многочисленными постганглионарными нервными волокнами от верхнего шейного симпатического узла. Железа принимает участие в реализации циркадианных (околосуточных) ритмов.
• Околосуточный ритм. Циркадианный ритм - один из биологических ритмов (суточная, помесячная, сезонная и годовая ритмика), скоординированный с суточной цикличностью вращения Земли, несколько не соответствует 24 ч. Многие физиологические процессы, в том числе гипоталамическая нейросекреция, подчиняются околосуточному ритму.
• Мелатонин (И-ацетил-5-метокситриптамин) секретируется в ликвор и кровь преимущественно в ночные часы. Содержание мелатонина в плазме в ночное время составляет у детей в возрасте от 1 до 3 лет 250 пг/мл, у подростков - 120 пг/мл и у людей в возрасте 50-70 лет - 20 пг/мл. В то же время в течение дня содержание мелатонина составляет всего около 7 пг/мл у лиц любого возраста.
Регуляция экспрессии мелатонина происходит при взаимодействии норадреналина с α- и β-адренорецепторами пинеалоцитов: связанный с рецепторами G-белок (активация аденилатциклазы) в конечном счёте вызывает увеличение транскрипции гена арилалкиламин-Л^-ацетилтрансферазы - основного фермента синтеза мелатонина. Полная же цепочка событий - от сетчатки до пинеалоцитов - такова (см. рис. 18-1).
♦ Изменение освещённости сетчатки через зрительный тракт и дополнительные пути оказывают влияние на разряды нейронов надперекрёстного ядра (ростровентральная часть гипоталамуса).
■ Сигналы: от сетчатки к гипоталамусу возникают не в палочках и колбочках, а в других клетках (возможно, амакринных) сетчатки, содержащих фотопигменты группы криптохромов.
■ Надперекрёстное ядро содержит так называемые эндогенные часы - неизвестной природы генератор био- логических ритмов (включая околосуточный), контролирующий продолжительность сна и бодрствования, пищевое поведение, секрецию гормонов и т.д. Сигнал
генератора - гуморальный фактор, секретируемый из надперекрёстного ядра (в том числе в ликвор).
♦ Сигналы: от надперекрёстного ядра через нейроны: паравентрикулярного ядра (n. paraventricularis) активируют преганглионарные симпатические нейроны боковых столбов спинного мозга (columna lateralis).
♦ Симпатические преганглионарны:е нервны:е волокна активируют нейроны верхнего шейного узла симпатического ствола.
♦ Постганглионарные симпатические волокна от верхнего шейного узла секретируют норадреналин, взаимодей- ствующий с адренорецепторами плазмолеммы пинеалоцитов.
Эффекты мелатонина изучены: плохо, но известно, что мелатонин в гипоталамусе и гипофизе инициирует транскрипцию гена Period-1 (один из генов, имеющих отношение к так называемым эндогенным часам).
• Рецепторы мелатонина - трансмембранные гликопротеины, связанный с G-белком (активация аденилатциклазы), - обнаружены: в гипофизе, надперекрёстном ядре (n. suprachiasmaticus) гипоталамуса, в сетчатке, некоторых областях ЦНС и ряде других органов.
ЩИТОВИДНАЯ ЖЕЛЕЗА
В клетках щитовидной железы происходит синтез двух химически и функционально разных классов гормонов - йодсодержащих (синтезируются в эпителиальных фолликулах железы) и продуктов экспрессии кальцитониновых генов (синтезируются в так называемых светлых клетках фолликулов - С-клетках).
• Йодсодержащие гормоны железы - производные тирозина. Тироксин (T4) и трийодтиронин (Т3) усиливают обменные процессы, ускоряют катаболизм белков, жиров и углеводов, увеличивают ЧСС и сердечныгй выброс; они необходимы: для нормального развития ЦНС.
• Кальцитонин (32-аминокислотный пептид) и катакальцин (21-аминокислотный пептид). Их функции антагонистичны эффектам ПТГ - гормона паращитовидной железы: кальцитонин уменьшает [Са2+] в крови, стимулирует минерализацию
кости, усиливает почечную экскрецию Са2+, фосфатов и Na+ (уменьшается их реабсорбция в канальцах почки).
• Относящиеся к кальцитониновому гену пептиды α и β (37 аминокислот) экспрессируются в ряде нейронов ЦНС и на периферии (особенно в связи с кровеносными сосудами). Их роль - участие в ноцицепции, пищевом поведении, а также в регуляции тонуса сосудов. Рецепторы к этим пептидам найдены в ЦНС, сердце, плаценте.
Йодсодержащие гормоны
Синтез и секреция йодсодержащих гормонов происходит в эпителиальных фолликулах щитовидной железы. Эти фолликулы имеют различную величину и форму (преимущественно округлую), состоят из стенки (образована одним слоем фолликулярных клеток) и полости фолликула, содержащей так называемый коллоид. Функцию фолликулярных клеток стимулирует тиреотропин. Фолликулярные клетки могут иметь различную высоту (от низкокубической до цилиндрической), что зависит от интенсивности их функционирования: высота клеток пропорциональна напряжённости осуществляемых в них процессов. Полный цикл синтеза и секреции йодсодержащих гормонов происходит между фолликулярными клетками и коллоидом
(рис. 18-2).
Синтез йодсодержащих гормонов
Синтез и секреция T4 и T3 - многоэтапный процесс, находящийся под активирующим влиянием ТТГ.
• Поглощение йода. Йод в виде органических и неорганических соединений поступает в ЖКТ с пищей и питьевой водой. Транспорт йода из кровеносных капилляров в железу происходит за счёт встроенных в плазматическую мембрану базальной части фолликулярных клеток, составляющих молекулы трансмембранного переносчика ионов натрия и йода (так называемая йодная ловушка). Из верхушечной части фолликулярных клеток I- поступает в коллоид при помощи анионного транспортёра (пендрин).
Суточная потребность организма в йоде составляет 150- 200 мкг. Дефицит йода развивается при недостаточном поступлении йода с пищей и водой. Уменьшение синтеза
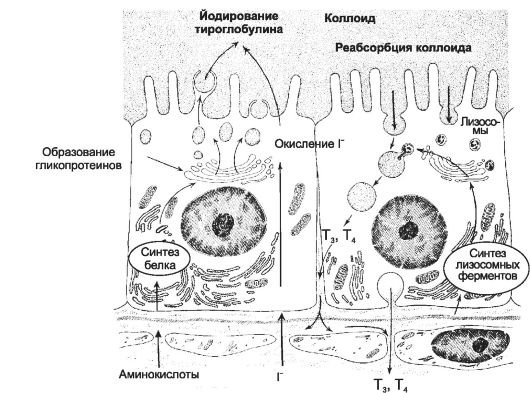
Рис. 18-2. Этапы синтеза и секреции йодсодержащих гормонов [11]. В левой части рисунка направление процессов показано снизу вверх (из просвета кровеносных капилляров в фолликулярные клетки и далее в коллоид), в правой части рисунка - сверху вниз (из коллоида в фолликулярные клетки и далее в просвет капилляров).
тиреоидных гормонов возникает, когда потребление йода
уменьшается ниже 10 мкг/сут. Соотношение концентраций I- в железе и концентрации
• I- в сыворотке крови в норме составляет 25:1. Окисление йода (I- - I+) происходит при помощи йодидпероксидазы (тиреопероксидаза) сразу после поступления в коллоид. Этот же фермент катализирует присоединение окисленного йода к остаткам тирозина в составе молекул тиреоглобулина.
• Тиреоглобулин. Этот содержащий 115 остатков тирозина гликопротеин синтезируется в фолликулярных клетках и секретируется в коллоид. Это так называемый незрелый тиреоглобулин.
• Йодирование тиреоглобулина
Созревание тиреоглобулина происходит примерно в течение 2 сут на верхушечной поверхности фолликулярных клеток путём его йодирования при помощи тиреопероксидазы.
Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина, вследствие чего образуются монойодтирозины и дийодтирозины. Гормональной активностью моно- и дийодтирозины не обладают; оба соединения выделяются из фолликулярных клеток, но быстро захватываются обратно и дейодинируются. Две молекулы дийодтирозина конденсируются с образованием йодтиронина (Т4), а монойодтирозин и дийодтирозин - с образованием йодтиронина (Т3).
Зрелый тиреоглобулин (полностью йодированный) - прогормон йодсодержащих гормонов, форма их хранения в коллоиде.
• Эндоцитоз и расщепление тиреоглобулина
По мере необходимости зрелый тиреоглобулин поступает (интернализуется) из коллоида в фолликулярные клетки путём опосредованного рецепторами Л-ацетилглюкозамина эндоцитоза.
Содержащие тиреоглобулин эндоцитозные пузырьки сливаются с лизосомами, где происходит расщепление тиреоглобулина и освобождение Т3 и Т4.
• Секреция T3 и T4
Образовавшиеся при расщеплении тиреоглобулина аминокислоты используются для новых процессов синтеза, а Т3 и Т4 из базальной части фолликулярных клеток поступают в кровь.
В норме щитовидная железа секретирует 80-100 мкг Т4 и 5 мкг Т3 в сутки. Ещё 22-25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях, преимуще- ственно в печени.
Регуляция синтеза йодтиронинов
Синтез и секрецию йодтиронинов регулирует гипоталамогипофизарная система по механизму обратной связи (рис. 18-3).
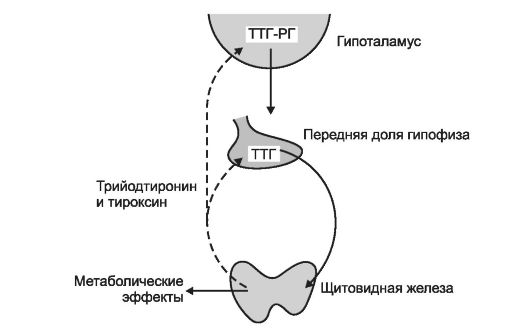
Рис. 18-3. Регуляторные взаимоотношения между гипоталамусом, аденогипофизом и щитовидной железой. Активирующие влияния - сплошная линия, тормозящие влияния - пунктирная линия. ТТГ-РГ - тиреотропин-рилизинг-гормон. Стимул для повышения секреции ТТГ-РГ и ТТГ - снижение концентрации йодтиронинов в крови.
Тироксин
Тироксин {β-[(3,5-дийодо-4-гидроксифенокси)-3,5-дийодофенил] аланин, или 3,5,3',5'-тетрайодтиронин, C15H11I4NO4, Т4, мол. масса 776,87} образуется из пары дийодтирозинов. Тироксин - основной йодсодержащий гормон, на долю T4 приходится не менее 90%
всего содержащегося в крови йода.
• Транспорт в крови. Не более 0,05% Т4 циркулирует в крови
• в свободной форме, практически весь тироксин находится в связанной с белками плазмы форме. Главный транспортный белок - тироксинсвязывающий глобулин (связывает 80% Т4), на долю тироксинсвязывающего преальбумина, а также альбумина приходится 20% Т4. Время циркуляции в крови (время полужизни) T4 около 7 дней, при гипертиреозе 3-4 дня, при гипотиреозе - до 10 дней.
• L-форма тироксина физиологически примерно вдвое активнее рацемической (DZ-тироксин), D-форма гормонально не активна.
• Дейодирование наружного кольца тироксина, частично происходящее в щитовидной железе, осуществляется преимущественно в печени и вызывает образование Т3.
• Реверсивный трийодтиронин. Дейодирование внутреннего кольца тироксина происходит в щитовидной железе, преимущественно в печени и частично в почке. В результате образуется реверсивный (обратный) Т3 - 3,3',5'-трийодтиронин, rT3 (от англ. reverse), обладающий после рождения незначительной физиологической активностью.
Содержание rT3 в амниотической жидкости намного выше, чем содержание rT3 в крови матери. Это означает, что преобладающий йодсодержащий гормон плода - rT3.
Трийодтиронин
Трийодтиронин [3,5,3'-трийодтиронин, или 4-(3-йодо-4- гидроксифенокси)-3,5-дийодофенилаланин, C15H12I3NO4, мол. масса 650,98] образуется из монойодтиронина и дийодтиронина (в щитовидной железе синтезируется около 15% циркулирующего в крови T3, остальной трийодтиронин образуется при монодейодировании наружного кольца тироксина, происходящем преимущественно в печени). На долю T3 приходится лишь 5% содержащегося в крови йода, но Т3 имеет существенное значение для организма и для реализации эффектов йодсодержащих гормонов.
• Транспорт в крови. Не более 0,5% Т3 циркулирует в крови в свободной форме, практически весь трийодтиронин находится в связанной форме.
• Время циркуляции в крови (время полужизни) T3 составляет около 1,5 дня.
• Физиологическая активность T3 примерно в четыре раза выше, чем у тироксина, но время полужизни намного меньше. Биологическая активность и T3, и T4 обусловлена несвязанной фракцией.
• Катаболизм йодтиронинов. Т3 и Т4 конъюгируются в печени с глюкуроновой или серной кислотой и секретируются с желчью, всасываются в кишечнике, дейодируются в почках и выделяются с мочой.
Рецепторы тиреоидных гормонов
Ядерные рецепторы тиреоидных гормонов - факторы транскрипции. Известно не менее трёх подтипов этих рецепторов: α1, α2 и β. α1- и β-подтипы - трансформирующие гены ERBA1 и ERBA2 соответственно.
Функции йодсодержащих гормонов
Функции йодсодержащих гормонов многочисленны. Т3 и Т4 усиливают интенсивность обменных процессов, ускоряют катаболизм белков, жиров и углеводов, увеличивают ЧСС и сердечный выброс; они необходимы для нормального развития ЦНС. Крайне разнообразные эффекты йодсодержащих гормонов на клеткимишени (ими практически являются все клетки организма) объясняются увеличением синтеза белков и потребления кислорода.
• Синтез белков увеличивается в результате активации транскрипции в клетках-мишенях, в том числе гена гормона роста. Йодтиронины расцениваются как синергисты гормона роста. При дефиците Т3 клетки гипофиза теряют способность к синтезу СТГ.
• Потребление кислорода возрастает в результате увеличения активности Na+-, К+-АТФазы.
• Печень. Йодтиронины ускоряют гликолиз, синтез холестерола и синтез желчных кислот. В печени и жировой ткани Т3 повышает чувствительность клеток к эффектам адреналина (стимуляция липолиза в жировой ткани и мобилизация гликогена в печени).
• Мышцы. Т3 увеличивает потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность к действию адреналина.
• Теплопродукция. Йодтиронины участвуют в формировании ответной реакции организма на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина.
• Гиперйодтиронинемия. Очень высокие концентрации йодтиронинов тормозят синтез белков и стимулируют катаболические процессы, что приводит к развитию отрицательного азотистого баланса.
• Физиологические эффекты действия гормонов щитовидной железы приведены в табл. 18-3.
• Оценка функций щитовидной железы
Ф Радиоиммунологический анализ позволяет прямо измерять содержание Т3, Т4, ТТГ.
Ф Поглощение гормонов смолами - непрямой метод определения связывающих гормоны белков.
Ф Индекс свободного тироксина - оценка свободного Т4.
Ф Тест стимуляции ТТГ тиролиберином определяет секрецию в кровь тиреотропина в ответ на внутривенное введение тиролиберина.
Ф Тесты выявления АТ к рецепторам ТТГ выявляют гетерогенную группу Ig, связывающихся с рецепторами ТТГ эндокринных клеток щитовидной железы и изменяющих её функциональную активность.
Ф Сканирование щитовидной железы при помощи изотопов технеция (99п1Тс) позволяет выявить области пониженного накопления радионуклида (холодные узлы), обнаружить эктопические очаги щитовидной железы или дефект паренхимы органа. 99тТс накапливается только в щитовидной железе, период полувыведения составляет всего 6 ч.
Ф Исследование поглощения радиоактивного йода при помощи йода-123 (123I) и йода-131 (131I).
Ф Содержание йода в питьевой воде. Проводится йодирование воды на водопроводных станциях.
Ф Пищевая соль. В России запрещено выпускать нейодированную пищевую соль.
• Тиреоидный статус определяет эндокринную функцию щитовидной железы. Эутиреоидия - отсутствие отклонений. Заболевание щитовидной железы можно предположить при появлении симптомов недостаточности эндокринной функции (гипотиреоз), избыточных эффектов тиреоидных гормонов (гипертиреоз) либо при очаговом или диффузном увеличении щитовидной железы (зоб).
Таблица 18-3. Физиологическое действие тиреоидных гормонов
Объект действия | Специфическое действие |
Развитие ЦНС | Торможение репликации нервных клеток Стимуляция роста тел нервных клеток Стимуляция ветвления дендритов Стимуляция скорости миелинизации аксонов |
Окончание табл. 18-3
Рост тела | Стимуляция экспрессии гормона роста в соматотрофах Стимуляция синтеза многих структурных и ферментативных белков Ускорение кальцификации костей |
Основной обмен организма | Регуляция скорости окислительного фосфорилирования, теплопродукции тела и потребления кислорода (эффект теплопродукции) |
Метаболические процессы в организме | Стимуляция ассимиляционных и диссимиляционных механизмов углеводного, жирового и белкового метаболизма |
Кальцитонин и катакальцин
С-клетки (произносят «си-клетки», от англ. calcitonin - кальцитонин) в составе фолликулов называют также парафолликулярными. Ген CALC1 содержит нуклеотидные последовательности, кодирующие пептидные гормоны кальцитонин, катакальцин и относящийся к кальцитониновому гену пептид α. В щитовидной железе синтезируются регуляторы обмена Са2+ - кальцитонин и катакальцин, пептид α в нормальной щитовидной железе не экспрессируется.
• Кальцитонин - пептид, содержащий 32 аминокислотных остатка, мол. масса 3421.
Ф Регулятор экспрессии - [Са2+] плазмы крови. Внутривенное введение кальция хлорида значительно увеличивает секрецию кальцитонина. β-Адренергические агонисты, дофамин, эстрогены, гастрин, холецистокинин, глюкагон и секретин также стимулируют секрецию кальцитонина.
Ф Функции кальцитонина многообразны. Кальцитонин - один из регуляторов кальциевого обмена; функции кальцитонина антагонистичны функциям гормона паращитовидной железы.
♦ Уменьшение содержания Са2+ в крови (паратиреокрин увеличивает содержание Са2+).
♦ Стимуляция минерализации кости (ПТГ усиливает резорбцию кости).
♦ Усиление почечной экскреции Са2+, фосфатов и Na+ (уменьшается их реабсорбция в канальцах почки).
♦ Желудочная и панкреатическая секреция. Кальцитонин уменьшает кислотность желудочного сока и содержание амилазы и трипсина в соке поджелудочной железы.
♦ Гормональная регуляция состояния костной ткани (см. ниже).
• Ф Рецептор кальцитонина относится к семейству рецепторов секретина, при связывании кальцитонина с рецептором в клетках-мишенях (например, остеокластах) увеличивается содержание цАМФ. Катакальцин - пептид, состоящий из 21 аминокислотного
остатка, - выполняет те же функции, что и кальцитонин.
Обобщение раздела
Основными тиреоидными гормонами являются тироксин (T4) и трийодтиронин (T3), в состав которых входит йод.
Расщепление тиреоглобулина внутри фолликулярных клеток высвобождает тиреоидные гормоны из щитовидной железы.
ТСГ регулирует синтез и выделение тиреоидных гормонов пу- тём активации аденилатциклазы и генерации цАМФ.
Концентрация тиреоидных гормонов в крови регулирует выделение ТСГ из передней доли гипофиза.
В периферических тканях фермент 5'-дейодиназа дейодинизирует T4 в физиологически активный гормон T3.
Тиреоидные гормоны являются важнейшими регуляторами развития ЦНС.
Тиреоидные гормоны стимулируют рост, регулируя выделение гормона роста из гипофиза, и оказывают прямое действие на ткани мишени, такие как кости.
Тиреоидные гормоны регулируют основной и промежуточный обмен веществ путем воздействия на синтез АТФ в митохондриях и через экспрессию генов, управляющих метаболическими ферментами.
Повышенная возбудимость и увеличение скорости метаболизма, приводящее к потере веса, свидетельствуют об избытке тирео- идного гормона (гипертиреоидизм).
Снижение величины основного обмена, приводящее к избыточному весу, характеризует дефицит тиреоидного гормона (гипотиреоидизм).
ОКОЛОЩИТОВИДНЫЕ ЖЕЛЕЗЫ
Четыре небольшие паращитовидные железы расположены на задней поверхности и под капсулой щитовидной железы.
• Поскольку паращитовидные железы топографически связаны с щитовидной железой, при её хирургической резекции существует опасность удаления паращитовидных желёз. При этом развиваются гипокальциемия, тетания, судороги; возможна смерть.
Функция околощитовидных желёз - синтез и секреция Са2+- регулирующего пептидного гормона паратиреокрина (ПТГ). ПТГ вместе с кальцитонином и катакальцином щитовидной железы, а также с витамином D регулирует обмен кальция и фосфатов.
Гормоны
В паращитовидной железе синтезируются и секретируются в кровь паратиреокрин (ПТГ) и относящийся к ПТГ белок. Эти гор- моны кодируют разные гены, но физиологическое значение относящегося к ПТГ белка значительно шире.
Паратиреокрин
Паратиреокрин (паратирин, паратгормон, гормон паращитовидной железы, паратиреоидный гормон, ПТГ) - полипептид из 84 аминокислотных остатков.
• Регуляторы экспрессии ПТГ
Ф [Са2+] сыворотки - главный регулятор секреции ПТГ. Ионы Са2+ взаимодействуют с рецепторами Са2+ (Са2+-сенсор) главных клеток паращитовидных желёз.
♦ Гипокальциемия (↓[Са2+] в крови) усиливает секрецию
ПТГ.
♦ Гиперкальциемия ↑[Са2+] в крови) уменьшает секрецию
ПТГ.
■ Са2+-сенсор - трансмембранный гликопротеин, обнаруженный в главных клетках околощитовидных желёз, а также в эпителии почечных канальцев. Связывание Са2+ с рецептором стимулирует фосфолипазу C, что приводит к освобождению ИТФ и диацилглицерола с последующим выбросом Са2+ из его внутриклеточных депо. Увеличение внутриклеточного [Са2+] активирует
протеинкиназу C. Конечный результат - подавление секреции ПТГ.
Витамин D - вспомогательный регулятор экспрессии гена ПТГ. Рецепторы витамина D (кальцитриола) относятся к ядерным факторам транскрипции. Связывание комплекса «кальцитриол-рецептор кальцитриола» с ДНК угнетает транскрипцию гена ПТГ.
Ионы магния. Пониженное содержание Mg2+ стимулирует секрецию ПТГ, избыток Mg2+ оказывает на неё тормозящий эффект.
Секреция ПТГ увеличивается под влиянием активации β-адренергических рецепторов и цАМФ.
• Рецепторы ПТГ - трансмембранные гликопротеины, связанные с G-белком, - в значительном количестве содержатся в костной ткани (остеобласты) и корковой части почек (эпителий извитых канальцев нефрона). Известны два типа рецепторов ПТГ: тип I связывает ПТГ и относящийся к ПТГ белок, тип II - только ПТГ. При связывании лигандов с рецептором в клетках-мишенях не только увеличивается внутриклеточное содержание цАМФ, но и происходит активация фосфолипазы C (освобождение ИТФ и диацилглицерола, выброс Са2+ из его внутриклеточных депо, активация Са2+-зависимых протеинкиназ).
• Функции. ПТГ поддерживает гомеостаз кальция и фосфатов. Ф ПТГ увеличивает содержание кальция в крови, усиливая резорбцию кости и вымывание кальция из костей, а также усиливая канальцевую реабсорбцию кальция в почках.
Ф ПТГ стимулирует образование кальцитриола в почках, кальцитриол же усиливает всасывание кальция и фосфатов в кишечнике.
Ф ПТГ уменьшает реабсорбцию фосфатов в канальцах почки и усиливает их вымывание из костей.
Обмен минералов и костная ткань
Кости формируют скелет организма, защищают и поддерживают жизненно важные органы, выполняют функцию депо кальция для нужд всего организма. В кости имеются две линии клеток - созидающая (остеогенные клетки - остеобласты - остеоциты) и разрушающая (многоядерные остеокласты). Клетки костной ткани
окружены костным матриксом. Различают незрелый (неминерализованный) костный матрикс - остеоид и зрелый (обызвествлён- ный, или кальцифицированный) костный матрикс.
Костный матрикс
Зрелый костный матрикс составляет 50% сухой массы кости и состоит из неорганической (50%) и органической (25%) частей и
воды (25%).
• Органическая часть. Органические вещества костного матрикса синтезируют остеобласты. К макромолекулам органического матрикса относятся коллагены (коллаген типа I - 90-95% и коллаген типа V) и неколлагеновые белки (остеонектин, остеокальцин, протеогликаны, сиалопротеины, морфогенетические белки, протеолипиды, фосфопротеины), а также гликозаминогликаны (хондроитинсульфат, кератансульфат).
• Неорганическая часть в значительном количестве содержит два химических элемента - кальций (35%) и фосфор (50%), образующие кристаллы гидроксиапатита - [Ca10(PO4)6(OH)2H2O]. В состав неорганической части кости также входят бикарбонаты, цитраты, фториды, соли Mg2+, K+, Na+.
Ф Кристаллы гидроксиапатита соединяются с молекулами коллагена через остеонектин. Такая связка делает кости ис- ключительно устойчивыми к растяжению и сжатию.
Ф В организме взрослого человека содержится около
Минерализация остеоида
Остеоид - неминерализованный органический костный матрикс вокруг остеобластов, синтезирующих и секретирующих его компоненты. В дальнейшем остеоид минерализуется за счёт активности щелочной фосфатазы. Этот фермент осуществляет гидролиз эфиров фосфорной кислоты с образованием ортофосфата, который взаимодействует с Ca2+, что приводит к образованию осадка в виде аморфного фосфата кальция Ca3(PO4)2 и последующему формированию из него кристаллов гидроксиапатита.
Для нормальной минерализации остеоида особенно необходим 1α,25-дигидроксихолекальциферол (активная форма витами- на D3 - кальцитриол). Способствуя всасыванию кальция и фосфора в кишечнике, кальцитриол обеспечивает их необходимую концентрацию для запуска кристаллизационных процессов в костном матриксе. Прямо воздействуя на остеобласты, кальцитриол повышает активность щелочной фосфатазы в этих клетках, способствуя минерализации костного матрикса.
Клетки костной ткани
• Остеобласты активно синтезируют и секретируют вещества костного матрикса практически через всю поверхность клетки, что даёт возможность остеобласту окружить себя матриксом со всех сторон. По мере снижения синтетической и секреторной активности остеобласты становятся остеоцитами, замурованными в костный матрикс. И остеобласты, и остеоциты экспрессируют рецепторы ПТГ и кальцитриола.
• Остеоциты - зрелые неделящиеся клетки, расположенные в костных полостях, или лакунах. Тонкие отростки остеоцитов находятся в канальцах, отходящих в разные стороны от костных полостей (лакунарно-канальцевая система). Остеоциты поддерживают структурную целостность минерализованного матрикса, участвуют в регуляции обмена Ca2+ в организме. Эта функция остеоцитов находится под контролем со стороны Ca2+ плазмы крови и различных гормонов. Лакунарноканальцевая система заполнена тканевой жидкостью, через которую осуществляется обмен веществ между остеоцитами и кровью. В канальцах постоянно циркулирует жидкость, что поддерживает диффузию метаболитов и обмен между лакунами и кровеносными сосудами надкостницы. Концентрация Ca2+ и PO43- в лакунарно-канальцевой жидкости превышает критический уровень для спонтанного осаждения солей Ca2+, что указывает на наличие секретируемых костными клетками ингибиторов осаждения, контролирующих процесс минерализации.
• Остеокласты - крупные многоядерные клетки системы мононуклеарных фагоцитов. Предшественники остеокластов - моноциты. Для дифференцировки остеокластов необходимы колониестимулирующий фактор макрофагов (M-CSF) и
кальцитриол, а для их активизации - ИЛ-6 и продуцируемый остеобластами фактор дифференцировки остеокластов (лиганд остеопротегерина). Остеокласты расположены в области резорбции (разрушения) кости (рис. 18-4, I). Ф Гофрированная каёмка остеокласта (рис. 18-4, II) - многочисленные цитоплазматические выросты, направленные к поверхности кости. Через мембрану выростов из остеокласта выделяется большое количество H+ и Cl-, что создаёт и поддерживает в замкнутом пространстве лакуны кислую среду (pH около 4), оптимальную для растворения солей кальция костного матрикса. Образование H+ в цитоплазме остеокласта катализирует карбоангидраза II. Остеокласты содержат многочисленные лизосомы, ферменты которых (кислые гидролазы, коллагеназы, катепсин K) разрушают органическую часть костного матрикса.
Гормональная регуляция
Регуляция роста
Синтез макромолекул костного матрикса стимулируют кальцитриол, ПТГ, соматомедины, трансформирующий фактор роста β, полипептидные факторы роста из кости.
• Соматомедины стимулируют анаболические процессы в скелетных тканях (синтез ДНК, РНК, белка, включая протеогликаны), а также сульфатирование гликозаминогликанов. Активность соматомединов определяется гормоном роста (соматотропин).
• Витамин C необходим для образования коллагена. При дефиците этого витамина замедляется рост костей и заживление переломов.
• Витамин A поддерживает образование и рост кости. Недостаток витамина тормозит остеогенез и рост костей. Избыток витамина A вызывает зарастание эпифизарных хрящевых пластинок и замедляет рост кости в длину.
Регуляция минерализации
Кальцитриол, необходимый для всасывания Ca2+ в тонком кишечнике, поддерживает процесс минерализации. Кальцитриол стимулирует минерализацию на уровне транскрипции, усиливая экспрессию остеокальцина. Дефицит витамина D3 приводит к на-
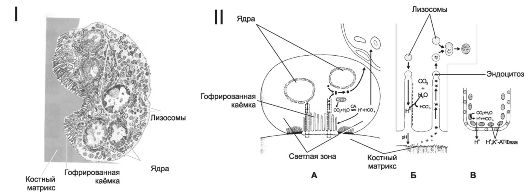
Рис. 18-4. Костная ткань. I - остеокласт [11]. Цитоплазматические выросты гофрированной каёмки направлены к поверхности костного матрикса. В цитоплазме содержатся многочисленные лизосомы; II - остеокласт и резорбция кости [11]. При взаимодействии остеокласта с поверхностью минерализованного костного матрикса карбоангидраза II (СА II) катализирует образование Н+ и НС03". Н+ при помощи протонной Н+-, К+-АТФазы активно выкачивается из клетки, что приводит к закислению замкнутого пространства лакуны. Гидролитические ферменты лизосом расщепляют фрагменты костного матрикса: А - остеокласт на поверхности кости, Б - часть гофрированной каёмки, В - часть клеточной мембраны остеокласта в области гофрированной каёмки.
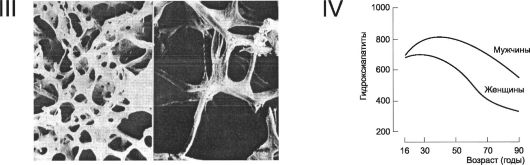
Рис. 18-4. Продолжение. Ill - трабекулы костной ткани. Слева - в норме, справа - остеопороз; IV - воз- растная динамика костной массы. Для гидроксиапатита даны относительные значения.
рушению минерализации кости, что и наблюдают при рахите у детей и при остеомаляции у взрослых. Регуляция резорбции
• Резорбцию кости усиливают ПТГ, интерлейкины-1, и -6, трансформирующий фактор роста α, Пг. Резорбцию кости поддерживают йодсодержащие гормоны щитовидной железы.
• Усиление резорбции под действием ПТГ не связано с прямым влиянием этого гормона на остеокласты, так как эти клетки не имеют рецепторов ПТГ. Активирующее влияние ПТГ и кальцитриола на остеокласты осуществляется опосредованно - через остеобласты. ПТГ и кальцитриол стимулируют образование фактора дифференцировки остеокластов - лиганда остеопротегерина.
• Резорбцию кости и активность остеокластов подавляют кальцитонин (через рецепторы в плазмолемме остеокластов) и γ-интерферон.
• Эстрогены ингибируют выработку ретикулярными клетками костного мозга колониестимулирующего фактора макрофагов (M-CSF), необходимого для образования остеокластов, что тормозит резорбцию кости.
Обобщение раздела
Уменьшение содержания кальция в плазме крови ниже нормального уровня вызывает появление спонтанных потенциалов действия в нервных окончаниях, приводящих к судорожным сокращениям скелетных мышц.
Около половины циркулирующего кальция находится в свободной или ионизированной форме, около 10% связано с небольши- ми анионами и примерно 40% - с белками плазмы. Большая часть фосфора циркулирует в крови в виде ортофосфатов.
Основная часть употребляемого с пищей кальция не всасывается в ЖКТ и выделяется с калом. Напротив, фосфаты почти полно- стью абсорбируются в ЖКТ и выделяются из организма с мочой.
Уменьшение содержания ионизированного кальция в плазме стимулирует секрецию ПТГ - полипептидного гормона, выделяемого паращитовидными железами. ПТГ играет жизненно важную роль в гомеостазисе кальция и фосфора и действует на кости, почки и кишечник, повышая концентрацию кальция и снижая концентрацию фосфатов в плазме.
В печени и почках в результате целой цепи реакций витамин D превращается в активный гормон 1,25-дигидрооксиферол. Этот гормон стимулирует всасывание кальция в кишечнике и, следовательно, способствует повышению концентрации кальция в плазме.
Кальцитонин - полипептидный гормон, который выделяется щитовидной железой и действует, понижая концентрацию кальция в плазме.
НАДПОЧЕЧНИКИ
Надпочечники - парные органы, расположенные ретроперитонеально у верхних полюсов почки на уровне Th12 и L1. Формально это две железы - кора и мозговая часть, - имеющие разное происхождение (кора надпочечников развивается из мезодермы, хромаф- финные клетки мозговой части - производные клеток нервного гребня). Ралична и химическая структура синтезируемых гормонов: клетки коры надпочечников синтезирует стероидные гормоны (минералокортикоиды, глюкокортикоиды и предшественники андрогенов), хромаффинные клетки мозговой части - катехоловые амины. В то же время с функциональной точки зрения каждый надпочечник входит в состав единой системы быстрого реагирования на стрессовую ситуацию, обеспечивающей выполнение поведенческой реакции «беги или нападай». В этом контексте важны следующие обстоятельства, функционально обеспечивающие связь между симпатическим отделом нервной системы, хромаффинными клетками и глюкокортикоидами.
• Гуморальным эффектором реакции «беги или нападай» является выбрасываемый в кровоток из мозговой части надпочечников адреналин.
• Хромаффинные клетки образуют синапсы с преганглионарными симпатическими нейронами и расцениваются как постганглионарные клетки эфферентной симпатической иннервации, выбрасывающие в кровь адреналин в ответ на синаптическую секрецию ацетилхолина и его связывание с никотиновыми холинорецепторами.
• В мозговую часть надпочечников поступает содержащая глюкокортикоиды кровь из корковой части органа. Другими словами, синтез и секреция адреналина из хромаффинных клеток находятся под контролем глюкокортикоидов.
Кора надпочечников
Эпителиальные стероидогенные клетки коры надпочечников - в зависимости от их функции и морфологии - выглядят по-разному. Непосредственно под капсулой органа расположены клетки клубочковой зоны (занимают 15% общего объёма коры), глубже лежат клетки пучковой зоны (70% объёма коры), а на границе с мозговым веществом - клетки сетчатой зоны. В разных зонах коры надпочечников синтезируются разные группы стероидных гормонов: минералокортикоиды, глюкокортикоиды и предшественники андрогенов.
• Минералокортикоиды (клубочковая зона). Альдостерон - основной минералокортикоид. Его задача - поддерживать баланс электролитов в жидкостях организма; в почке альдостерон увеличивает реабсорбцию ионов натрия (в результате задержки натрия увеличивается содержание воды в организме и повышается АД), увеличивает экскрецию ионов калия (потеря калия вызывает гипокалиемию), а также реабсорбцию хлора, бикарбоната и экскрецию ионов водорода. Синтез альдостерона стимулируется ангиотензином II.
• Глюкокортикоиды (пучковая и сетчатая зоны). Кортизол - основной глюкокортикоид, на его долю приходится 80% всех глюкокортикоидов. Остальные 20% - кортизон, кортикостерон, 11-дезоксикортизол и 11-дезоксикортикостерон. Глюкокортикоиды контролируют метаболизм белков, углеводов и жиров, подавляют иммунные реакции, а также обладают противовоспалительным эффектом. Синтез глюкокортикоидов стимулируется тропным гормоном аденогипофиза - АКТГ.
• Предшественники андрогенов (пучковая и сетчатая зоны). Дегидроэпиандростерон и андростендион - предшественники андрогенов, их дальнейшие превращения происходят вне надпочечника и рассматриваются в главе 19. Гонадотропные гормоны гипофиза не влияют на секрецию половых гормонов в сетчатой зоне.
Глюкокортикоиды
Основной естественный глюкокортикоид, секретируемый надпочечниками, - кортизол (объём секреции - от 15 до 20 мг/сут, концентрация кортизола в крови около 12 мкг/100 мл). Для кортизола, а также для регулирующих его синтез и секрецию кортиколи-
берина и АКТГ характерна выраженная суточная периодичность. При нормальном ритме сна секреция кортизола увеличивается по- сле засыпания и достигает максимума при пробуждении. В качестве ЛС в клинической практике обычно применяют синтетические глюкокортикоиды (дексаметазон, преднизолон, метилпреднизон и др.). Практически всем глюкокортикоидам присущи одновременно и эффекты минералокортикоидов.
• Регуляция секреции глюкокортикоидов (рис. 18-5).
Активирующие (нисходящие) влияния. Непосредственный активатор синтеза и секреции кортизола - АКТГ. АКТГ выделяется клетками передней доли гипофиза под действием кортиколиберина, поступающего в кровь гипоталамо-гипофизарной воротной системы из гипоталамуса. Стрессовые стимулы активируют всю нисходящую систему влияний, вызывая быстрое выделение кортизола. Кортизол оказывает различные метаболические эффекты, направленные на устранение повреждающей природы стресса.
Восходящее (тормозное) влияние по принципу отрицательной обратной связи оказывает кортизол, подавляющий секрецию АКТГ в передней доле гипофиза и кортиколибери- на в гипоталамусе. В результате уменьшается концентрация кортизола в плазме в то время, когда организм не подвергается воздействию стресса.
• Метаболизм
Связанные и свободные формы. Более 90% глюкокортикоидов циркулирует в крови в связи с белками - альбумином и связывающим кортикоиды глобулином (транскортин). Около 4% кортизола плазмы - свободная фракция.
Время циркуляции определяется прочностью связывания с транскортином (время полужизни кортизола - до 2 ч, кортикостерона - менее 1 ч).
Водорастворимые формы. Модификация липофильного кортизола осуществляется преимущественно в печени; формируются конъюгаты с глюкуронидом и сульфатом. Мо- дифицированные глюкокортикоиды - водорастворимые соединения, способные к экскреции.
Экскреция. Конъюгированные формы глюкокортикоидов секретируются с желчью в ЖКТ, из них 20% теряется с ка-
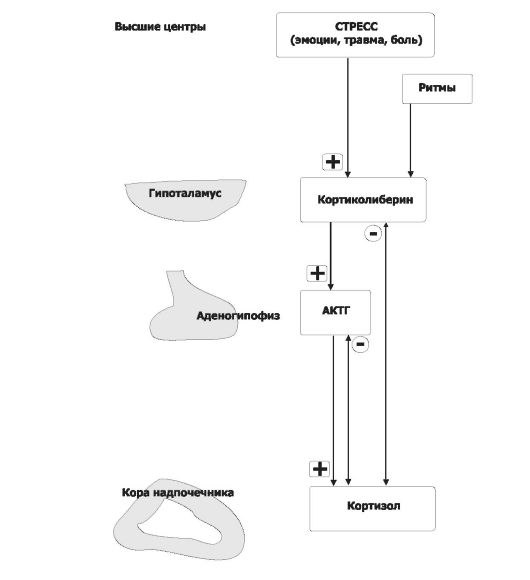
Рис. 18-5. Регуляторные контуры в системе «гонадолиберин-АКТГ-кор- тизол». Символами «+» и «-» обозначены стимулирующие и тормозящие влияния.
лом, 80% всасывается в кишечнике. Из крови 70% глюко-
• кортикоидов экскретируется с мочой. Функции глюкокортикоидов разнообразны - от регуляции метаболизма до модификации иммунологического и воспалительного ответов.
Углеводный обмен. Основные события разворачиваются между скелетными мышцами, жировыми депо организма и печенью. Основные пути метаболизма - стимуляция глю-
конеогенеза, синтез гликогена и уменьшение потребления глюкозы внутренними органами (кроме головного мозга). Основной эффект - увеличение концентрации глюкозы в крови.
♦ Глюконеогенез - синтез глюкозы за счёт аминокислот, лактата и жирных кислот, т.е. неуглеводных субстратов.
■ В скелетных мышцах глюкокортикоиды усиливают распад белков. Образующиеся аминокислоты поступают в печень.
■ В печени глюкокортикоиды стимулируют синтез ключевых ферментов обмена аминокислот - субстратов глюконеогенеза.
♦ Синтез гликогена усиливается за счёт активации гликогенсинтетазы. Запасаемый гликоген легко превращается в глюкозу путём гликогенолиза.
Липидный обмен. Кортизол увеличивает мобилизацию жирных кислот - источник субстратов для глюконеогенеза.
♦ Липолиз усиливается в конечностях.
♦ Липогенез усиливается в других частях тела (туловище и лицо).
Белки и нуклеиновые кислоты.
♦ Анаболический эффект в печени.
♦ Катаболический эффект в других органах (особенно в скелетных мышцах).
Иммунная система. В высоких дозах глюкокортикоиды выступают как иммунодепрессанты (применяются как средство, предупреждающее отторжение трансплантированных органов, при тяжёлой псевдопаралитической миастении - myasthenia gravis - результат появления аутоантител к никотиновым рецепторам ацетилхолина).
Воспаление. Глюкокортикоиды имеют выраженный проти- вовоспалительный эффект.
Синтез коллагена. Глюкокортикоиды при длительном применении ингибируют синтетическую активность фибробластов и остеобластов, в результате развиваются истончение кожи и остеопороз.
Скелетные мышцы. Длительное применение глюкокортикоидов поддерживает катаболизм мышц, что приводит к их атрофии и мышечной слабости.
Φ Воздухоносные пути. Введение глюкокортикоидов может уменьшить отёк слизистой оболочки, развивающийся, на- пример, при бронхиальной астме.
Φ Физиологические реакции органов и систем организма, вызываемые кортизолом, приведены в табл. 18-4.
Таблица 18-4. Физиологические реакции на кортизол
Органы и системы | Эффекты |
Гипоталамус | Прекращение секреции кортиколиберина и вазопрессина |
Гипофиз | Подавление образования и выделения АКТГ |
Сердце и сосуды | Потенцирование сосудосуживающего действия катехоламинов и их лигандов |
Дыхательная система | Ускоренное образование сурфактанта |
Почки | Повышение скорости клубочковой фильтрации |
Мышцы | Снижение чувствительности к инсулину, усиление катаболизма белков |
Система иммунитета | Подавление иммунных реакций (иммуносупрессия) |
Костная система | Усиление резорбции кости, подавление остеогенеза |
Соединительная ткань | Уменьшение синтеза коллагена |
Жировая ткань | Блокирование поглощения глюкозы липоцитами |
Альдостерон
Альдостерон - основной минералокортикоид. Нормальная концентрация альдостерона в крови около 6 нг на 100 мл, объём секре- ции - от 150 до 250 мкг/день. Другие стероиды надпочечника, расцениваемые как глюкокортикоиды (кортизол, 11-дезоксикортизол, 11-дезоксикортикостерон, кортикостерон), имеют и минералокортикоидную активность, хотя по сравнению с альдостероном их суммарный вклад в минералокортикоидную активность не столь велик.
• Регуляторы синтеза и секреции (рис. 18-6).
Φ Ангиотензин II - компонент ренин-ангиотензиновой системы - главный регулятор синтеза и секреции альдостерона. Этот пептид стимулирует выброс альдостерона.
Φ Сердечный натрийуретический фактор (атриопептин) ингибирует синтез альдостерона.
Φ Na+. Эффекты гипо- и гипернатриемии реализуются через ренин-ангиотензиновую систему.
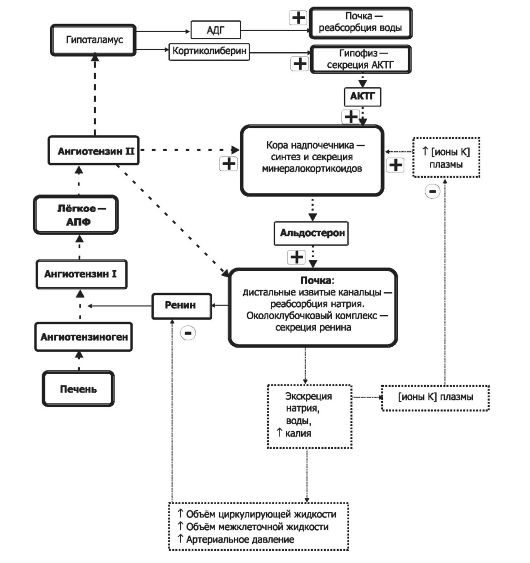
Рис. 18-6. Поддержание баланса в жидкостях организма. Символами «+» и «-» обозначены стимулирующие и тормозящие влияния. АПФ - ангиотензинпревращающий фермент.
Φ К+. Эффекты ионов калия не зависят от содержания в крови Na+ и ангиотензина II.
♦ Гиперкалиемия стимулирует секрецию альдостерона.
♦ Гипокалиемия тормозит секрецию альдостерона. Φ Простагландины.
♦ E1 и E2 стимулируют синтез альдостерона.
♦ F1a и F2a тормозят секрецию минералокортикоидов.
Φ Травмы и стрессовые состояния увеличивают секрецию альдостерона за счёт активирующего влияния АКТГ на кору надпочечников.
• Метаболизм. Альдостерон практически не связывается с белками плазмы крови, по этой причине время его циркуляции в крови (время полужизни) не превышает 15 мин. Альдостерон из крови удаляется печенью, где он трансформируется в экскретируемый почками тетрагидроальдостерон-3-глюкуронид.
• Рецептор альдостерона - внутриклеточный (ядерный) полипептид - связывает альдостерон и активирует транскрипцию генов, в первую очередь генов Na+-, К+-АТФазы и сочетанного трансмембранного переносчика Na+, К+ и Cl-. Рецепторы альдостерона обнаружены в эпителиальных клетках почечных канальцев, слюнных и потовых железах. Высокоаффинный рецептор в системах in vitro также связывает кортизол, но in vivo взаимодействие кортизола и рецептора практически не происходит, так как внутриклеточная 11β- гидроксистероиддегидрогеназа превращает кортизол в кортизон, плохо связывающийся с рецептором минералокортикоидов. Следовательно, глюкокортикоид кортизол не проявляет в клетках-мишенях эффекта минералокортикоида.
• Функция минералокортикоидов - поддержание баланса электролитов в жидкостях организма - осуществляется благодаря влиянию на реабсорбцию ионов в почечных канальцах (дистальные извитые канальцы и начальный отдел собирательных трубочек). Φ Na+. Альдостерон усиливает реабсорбцию ионов натрия.
В результате задержки натрия увеличивается содержание воды в организме и повышается АД.
Φ К+. Альдостерон увеличивает экскрецию ионов калия. Потеря калия вызывает гипокалиемию.
Φ Cl-, HCO3-, Н+. Альдостерон усиливает реабсорбцию хлора, бикарбоната и почечную экскрецию ионов водорода.
Хромаффинная ткань
Эндокринную функцию мозговой части надпочечника выполняют происходящие из нервного гребня хромаффинные клетки, формирующие также параганглии. Мелкие скопления и одиночные хромаффинные клетки находятся также в сердце, почках, симпатических ганглиях. Для хромаффинных клеток характерны содержащие либо адреналин (их большинство), либо норадреналин гранулы с электронно-плотным содержимым, которое с бихроматом калия даёт хромаффинную реакцию. В гранулах также содержатся АТФ и хромогранины.
Катехоловые амины
• Синтез. Катехоламины синтезируются из тирозина по цепочке: тирозин (превращение тирозина катализирует тирозин-гидроксилаза) - ДОФА (ДОФА-декарбоксилаза) - дофамин (дофамин-β-гидроксилаза) - норадреналин (фенилэтаноламин-N-метилтрансфераза) - адреналин.
Φ ДОФА (диоксифенилаланин). Эта аминокислота выделена из бобов Vicia faba как антипаркинсоническое средство применяется её L-форма - леводопа (Х-ДОФА, леводофа, 3-гидрокси-L-тирозин, L-дигидроксифенилаланин).
Φ Дофамин - 4-(2-аминоэтил)пирокатехол.
Φ Норадреналин [2-амино-1-(3,4-дигидроксифенил)этанол] - деметилированный предшественник адреналина. Фермент синтеза норадреналина (дофамин-β-гидроксилаза) секретируется из хромаффинных клеток и норадренергических терминалей вместе с норадреналином.
Φ Адреналин - l-1-(3,4-дигидроксифенил)-2-(метиламино)этанол - только гуморальный фактор, в синаптической передаче не участвует.
• Секреция. При активации симпатической нервной системы хромаффинные клетки выбрасывают в кровь катехоловые амины (преимущественно адреналин). Вместе с катехоламинами из гранул выделяются АТФ и белки. Адреналинсодержащие клетки содержат также опиоидные пептиды (энкефалины) и секретируют их вместе с адреналином.
• Метаболизм адреналина и других биогенных аминов происходит под влиянием катехол-О-метилтрансферазы и моноаминоксидаз. В результате образуются экскретируемые с мочой
метанефрины и ванилилминдальная кислота соответственно. Время полураспада катехоламинов в плазме составляет около 2 мин. У здорового мужчины в положении лёжа содержание в крови норадреналина составляет около 1,8 нмоль/л, адреналина - 16 нмоль/л и дофамина - 0,23 нмоль/л. Эффекты. Катехоламины обладают широким спектром действия (воздействие на гликогенолиз, липолиз, глюконеогенез, существенное влияние на сердечно-сосудистую систему). Вазоконстрикция, параметры сокращения сердечной мышцы и другие эффекты катехоловых аминов реализуются через α- и β-адренергические рецепторы на поверхности клетокмишеней (ГМК, секреторные клетки, кардиомиоциты). Рецепторы катехоловых аминов - адренергические. Φ Адренорецепторы клеток-мишеней (включая синаптические) связывают норадреналин, адреналин и различные адренергические ЛС (активирующие - агонисты, адреномиметики, блокирующие - антагонисты, адреноблокаторы). Адренергические рецепторы подразделяются на α- и β-подтипы. Среди α- и β-адренорецепторов различают α1- (например, постсинаптические в симпатическом отделе вегетативной нервной системы), α2- (например, пресинаптические в симпатическом отделе вегетативной нервной системы и постсинаптические в головном мозге), β1- (в частности, кардиомиоциты), β2- и β3-адренорецепторы. Адренорецепторы связаны с G-белком.
♦ Все подтипы β2-адренорецепторов активируют аденилатциклазу и увеличивают внутриклеточное содержание цАМФ.
♦ α2-Адренорецепторы ингибируют аденилатциклазу и уменьшают внутриклеточное содержание цАМФ.
♦ α1-Адренорецепторы активируют фосфолипазу C, что увеличивает (посредством ИТФ и диацилглицерола) внутрицитоплазматическое содержание ионов Ca2+.
Эффекты, опосредуемые разными подтипами адренергических рецепторов - см. также главу 15.
♦ α1
■ Гликогенолиз. Усиление.
■ ГМК сосудов и мочеполовой системы. Сокращение.
♦ α2
■ ГМК ЖКТ. Расслабление.
■ Липолиз. Подавление.
■ Инсулин, ренин. Подавление секреции.
■ Кардиомиоциты. Увеличение силы сокращения.
■ Липолиз. Усиление.
■ Инсулин, глюкагон, ренин. Усиление секреции.
■ ГМК бронхов, ЖКТ, кровеносных сосудов, мочеполовой системы. Расслабление.
■ Печень. Усиление гликогенолиза и глюконеогенеза.
■ Мышцы. Усиление гликогенолиза.
■ Липолиз. Усиление.
Аварийная функция симпатоадреналовой системы
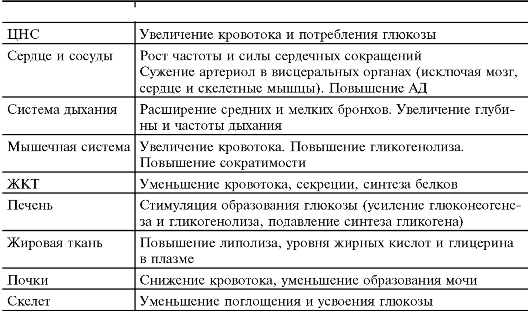
«Аварийная функция симпатоадреналовой системы» («реакция борьбы», ситуация «беги или нападай»), как часто называют разнообразные эффекты внезапного повышенного выброса адреналина в кровь, представлена в табл. 18-5.
Таблица 18-5. Физиологические изменения при реакции «борьбы»
Обобщение раздела
Надпочечная железа состоит из наружной коры, окружающей внутренний мозговой слой. Кора содержит три гистологически различных зоны (снаружи внутрь) - клубочковую, пучковую и сетчатую.
Гормоны, секретируемые корой надпочечников, включают глюкокортикоиды, минералокортикоид альдостерон и надпочечниковые андрогены.
Глюкокортикоиды кортизол и кортикостерон синтезируются в пучковой и сетчатой зоне коры надпочечников.
Минералокортикоид альдостерон синтезируется в клубочкой зоне коры надпочечников.
АКТГ увеличивает синтез глюкокортикоидов и андрогенов в клетках пучковой и сетчатой зоны, повышая внутриклеточное со- держание цАМФ.
Ангиотензин II и ангиотензин III стимулируют синтез альдостерона в клетках клубочковой зоны, увеличивая содержание каль- ция в цитозоле и активируя протеинкиназу C.
Глюкокортикоиды связываются с глюкокортикоидными рецепторами, находящимися в цитозоле клеток-мишеней. Глюкокортикоидсвязанный рецептор перемещается к ядру и связывается с элементами, ответственными за глюкокортикоидные ответы в молекуле ДНК, чтобы увеличить или уменьшить транскрипцию специфических генов.
Глюкокортикоиды необходимы, чтобы организм адаптировался к нагрузкам, повреждениям и стрессам.
Хромаффинные клетки мозгового слоя надпочечников синтезируют и секретируют катехоламины: адреналин и норадреналин.
Катехоламины взаимодействуют с адренергическими рецепторами: αρ α2, β1, и β2, - которые опосредуют клеточные эффекты гормонов.
Такие стимулы, как повреждение, гнев, боль, холод, изнурительная работа и гипогликемия, вызывают импульсы в холинерги- ческих преганглионарных волокнах, иннервирующих хромаффинные клетки, что приводит к секреции катехоламинов.
Противодействуя гипогликемии, катехоламины стимулируют образование глюкозы в печени, освобождение молочной кислоты из мышц и липолиз в жировой ткани.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Поджелудочная железа содержит от полумиллиона до двух миллионов мелких скоплений эндокринных клеток - островков Лангерханса. В островках идентифицировано несколько типов эндокринных клеток, синтезирующих и секретирующих пептидные гормоны: инсулин (β-клетки, 70% всех островковых клеток), глюкагон (α-клетки, 15%), соматостатин (δ-клетки), панкреатический полипептид (PP-клетки, seu F-клетки) и у детей младшего возраста - гастрины (G-клетки, seu D-клетки).
• Инсулин - главный регулятор энергетического обмена в организме - контролирует обмен углеводов (стимуляция гликолиза и подавление глюконеогенеза), липидов (стимуляция липогенеза), белков (стимуляция синтеза белка), а также стимулирует пролиферацию клеток (митоген). Основные органы-мишени инсулина - печень, скелетные мышцы и жировая ткань.
• Глюкагон - антагонист инсулина - стимулирует гликогенолиз и липолиз, что ведёт к быстрой мобилизации источников энергии (глюкоза и жирные кислоты). Ген глюкагона кодирует также структуру так называемых энтероглюкагонов - глицентина и глюкагоноподобного пептида-1 - стимуляторов секреции инсулина.
• Соматостатин подавляет в островках поджелудочной железы секрецию инсулина и глюкагона.
• Панкреатический полипептид состоит из36 аминокислотных остатков. Его относят к регуляторам пищевого режима (в частности, этот гормон угнетает секрецию экзокринной части поджелудочной железы). Секрецию гормона стимулируют богатая белком пища, гипогликемия, голодание, физическая нагрузка.
• Гастрины I и II (идентичные 17-аминокислотные пептиды отличаются наличием сульфатной группы у тирозила в положении 12) стимулируют секрецию соляной кислоты в желудке. Стимулятор секреции - гастриносвобождающий гормон, ингибитор секреции - соляная кислота. Рецептор гастрина/холецистоки- нина обнаружен в ЦНС и слизистой оболочке желудка.
Инсулин
Транскрипция гена инсулина приводит к образованию мРНК препроинсулина, содержащей последовательности A, C и B, а так-
же нетранслируемые 3"- и 5"-концы. После трансляции образуется полипептидная цепочка проинсулина, состоящая на N-конце из последовательных доменов B, C и A. В комплексе Гольджи протеазы расщепляют проинсулин на три пептида: A (21 аминокислота), B (30 аминокислот) и C (31 аминокислота). Пептиды A и B, интегрируясь при помощи дисульфидных связей, образуют димер - инсулин. Секреторные гранулы содержат эквимолярные количества гормонально-активного инсулина и не имеющего гормональной активности C-пептида, а также следы проинсулина.
Секреция инсулина
Количество инсулина, секретируемого на фоне относительного голодания (например, утром до завтрака), составляет около 1 ЕД/ч; оно возрастает в 5-10 раз после приёма пищи. В среднем в течение дня взрослый здоровый мужчина секретирует 40 ЕД (287 ммоль) инсулина.
• Содержимое секреторных гранул β-клеток поступает в кровь в результате экзоцитоза, вызванного увеличением содержания внутриклеточного Ca2+. Именно внутриклеточный кальций (точнее T[Ca2+]) является непосредственным и главным сигналом к секреции инсулина. Способствуют экзоцитозу также активированная Т[цАМФ] протеинкиназа A и активированная T [диацилглицерол] протеинкиназа C, которые фосфорилируют некоторые белки, принимающие участие в экзоцитозе. Регуляторы секреции инсулина Стимулируют секрецию инсулина гипергликемия (повышенное содержание глюкозы в плазме крови), гиперкалиемия, некоторые аминокислоты, ацетилхолин, глюкагон и некоторые другие гормоны, приём пищи, а также производные сульфонилмочевины.
♦ Глюкоза - главный регулятор секреции инсулина
■ При повышенном содержании глюкозы в плазме крови (более
■ Вошедшие в клетку молекулы сахара подвергаются гликолизу, в результате чего в цитоплазме возрастает содержание АТФ.
■ Увеличенное содержание внутриклеточного АТФ закрывает чувствительные к АТФ и к [K+] калиевые каналы плазматической мембраны, что неизбежно приводит к её деполяризации.
■ Деполяризация плазматической мембраны β-клеток открывает потенциалчувствительные кальциевые каналы плазматической мембраны, в результате в клетку из межклеточного пространства входят ионы кальция.
■ Увеличение [Ca2+] в цитозоле стимулирует экзоцитоз секреторных гранул, инсулин этих гранул оказывается вне β-клеток.
♦ Гиперкалиемия
■ Повышение содержания К+ во внутренней среде организма блокирует чувствительные к [K+] калиевые каналы плазматической мембраны, что приводит к её деполяризации.
■ Дальнейшие события разворачивается так, как описано выше (см. пункты 4 и 5).
♦ Аминокислоты (в особенности аргинин, лейцин, аланин и лизин) поступают в β-клетки при помощи трансмембранного переносчика аминокислот и метаболизируют в митохондриальном цикле трикарбоновых кислот, в результате чего в клетке возрастает содержание АТФ. Дальнейшие события разворачивается так, как описано выше (см. пункты 3-5).
♦ Производные сульфонилмочевины блокируют калиевые каналы в плазмолемме β-клеток, взаимодействуя с рецептором сульфонилмочевины в составе К+- и АТФ-чувствительных калиевых каналов плазматической мембраны, что приводит к её деполяризации. Дальнейшие события разворачивается так, как описано выше (см. пункты 4 и 5).
♦ Ацетилхолин, секретируемый из окончаний нервных волокон правого блуждающего нерва, взаимодействует с мускариновыми холинергическими рецепторами плазматической мембраны, связанными с G-белком. G-белок активирует фосфолипазу C, что приводит к отщеплению от фосфоинозитол-бифосфата фосфолипидов клеточной мембраны двух вторых посредников - цитозольного ИТФ и мембранного диацилглицерола.
■ ИТФ, связываясь с его рецепторами, стимулирует выброс Ca2+ из цистерн гладкой эндоплазматической сети, что приводит к экзоцитозу секреторных гранул с инсулином.
■ Диацилглицерол активирует протеинкиназу C, что приводит к фосфорилированию некоторых белков, прини- мающих участие в экзоцитозе, в результате происходит секреция инсулина.
♦ Холецистокинин взаимодействует с его рецепторами (свя- занные с G-белком рецепторы). G-белок активирует фосфолипазу C. Дальнейшие события происходят так, как описано выше для ацетилхолина.
♦ Гастрин связывается с рецептором холецистокинина типа B. Дальнейшие события происходят так, как описано выше для холецистокинина и ацетилхолина.
♦ Гастрин-рилизинг-гормон также стимулирует секрецию инсулина.
♦ Глюкагонподобный пептид-1 (см. ниже) - самый мощный стимулятор секреции инсулина.
• Ингибиторы секреции инсулина
♦ Адреналин и норадреналин (через α2-адренорецепторы и уменьшение содержания цАМФ) подавляют секрецию инсулина. Посредством β-адренорецепторов (увеличивается содержание цАМФ) эти агонисты стимулируют секрецию инсулина, но в островках Лангерханса преобладают α-адренорецепторы, в результате наблюдается угнетение секреции инсулина.
■ Физическая нагрузка сопровождается активацией симпатического отдела нервной системы и поглощением глюкозы (как источника энергии) скелетными мышцами, что при одновременном гипогликемическом (снижающем содержание сахара в плазме крови) эффекте инсулина может привести к выраженной гипогликемии (это в первую очередь сказывается на функциях мозга). В таком контексте подавляющий секрецию инсулина эффект адреналина и норадреналина представляется весьма уместным.
■ Стресс. Подавляющая секрецию инсулина роль адреналина особенно велика во время развития стресса, когда симпатическая система возбуждена. Адреналин одно-
временно повышает концентрацию глюкозы и жирных кислот в плазме крови. Смысл этого двойного эффекта следующий: адреналин вызывает мощный гликогенолиз в печени, вызывая в течение нескольких минут выделение значительного количества глюкозы в кровь, и в это же время оказывает прямое липолитическое воздействие на клетки жировой ткани, повышая в крови концентрацию жирных кислот. Следовательно, адреналин создаёт возможности для использования жирных кислот в условиях стресса.
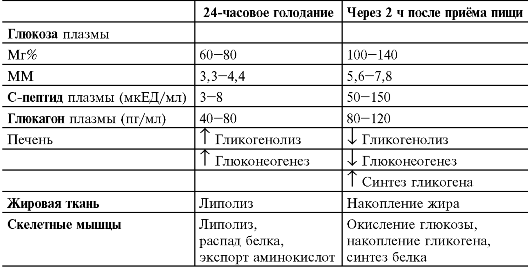
♦ Соматостатин и нейропептид галанин, связываясь со своими рецепторами, вызывают уменьшение внутриклеточного содержания цАМФ и подавляют секрецию инсулина. Φ Пищевой режим имеет исключительно важное значение как для секреции инсулина и содержания глюкозы в плазме крови, так и для зависимого от инсулина обмена белка, жиров и углеводов в органах-мишенях инсулина (табл. 18-6).
Таблица 18-6. Влияние голодания и приёма пищи на содержание и эф- фекты инсулина [4]
Метаболизм инсулина. Инсулин и C-пептид в крови циркулируют в свободной форме 3-5 мин. Более половины инсулина расщепляется в печени сразу же при поступлении в этот орган по портальным венам. C-пептид не разрушается в печени, а выделяется через почки. По этим причинам достоверным лабораторным по-
казателем секреции инсулина является не сам гормон (инсулин), а именно C-пептид.
Физиологические эффекты инсулина
• Органы-мишени инсулина. Основные мишени инсулина - печень, скелетные мышцы, клетки жировой ткани. Поскольку инсулин является главным регулятором метаболизма молекул - источников энергетического обмена в организме, - именно в этих органах проявляются основные физиологические эффекты инсулина на обмен белков, жиров и углеводов.
• Функции инсулина разнообразны (регуляция обмена источников энергии - углеводов, липидов и белков). В клетках-мишенях инсулин стимулирует трансмембранный перенос глюкозы и аминокислот, синтез белка, гликогена и триглицеридов, гликолиз, а также рост и пролиферацию клеток, но подавляет протеолиз, липолиз и окисление жиров (см. подробнее ниже).
• Скорость проявления эффектов инсулина. Физиологические эффекты инсулина по скорости их наступления после взаимодействия гормона с его рецепторами подразделяют на быстрые (развиваются в течение секунд), медленные (минуты) и отсроченные (табл. 18-7).
Таблица 18-7. Долговременность эффектов инсулина [2]

Влияние инсулина на обмен углеводов
• Печень. Инсулин оказывает на гепатоциты следующие эффекты: Φ глюкоза постоянно поступает в клетки печени через трансмембранный переносчик GLUT2; инсулин мобилизует дополнительный трансмембранный переносчик GLUT4, способствуя его встраиванию в плазматическую мембрану гепатоцитов;
Φ способствует синтезу гликогена из поступающей в гепато-
циты глюкозы, увеличивая транскрипцию гена глюкокина-
зы и активируя гликогенсинтазу; Φ предупреждает распад гликогена, ингибируя активность гли-
когенфосфорилазы и глюкозо-6-фосфатазы; Φ стимулирует гликолиз и окисление углеводов, активируя глю-
кокиназу, фосфофруктокиназу и пируваткиназу; Φ активирует метаболизм глюкозы через гексозомонофосфат-
ный шунт;
Φ ускоряет окисление пирувата, активируя пируватдегидрогеназу;
Φ подавляет глюконеогенез, ингибируя активность фосфоенолпируваткарбоксикиназу, фруктозо-1,6-бифосфатазу и глюкозо-6-фосфатазу.
• Скелетные мышцы. В скелетных мышцах инсулин:
Φ активирует поступление глюкозы в саркоплазму посредством
трансмембранного переносчика GLUT4, способствуя его
встраиванию в плазматическую мембрану; Φ способствует синтезу гликогена из поступающей в гепато-
циты глюкозы, увеличивая транскрипцию гена гексокиназы
и активируя гликогенсинтазу; Φ стимулирует гликолиз и окисление углеводов, активируя гек-
сокиназу, фосфофруктокиназу и пируваткиназы;
• Жировая ткань. Инсулин влияет на метаболизм адипоцитов следующим образом:
Φ активирует поступление глюкозы в саркоплазму посредством
трансмембранного переносчика GLUT4, способствуя его
встраиванию в плазматическую мембрану; Φ стимулирует гликолиз, что способствует образованию
α-глицерофосфата, идущего на построение триглицеридов; Φ ускоряет окисление пирувата, активируя пируватдегидро-
геназу и ацетил-КоА-карбоксилазу, что благоприятствует
синтезу свободных жирных кислот.
• ЦНС. Инсулин практически не оказывает влияния ни на транспорт глюкозы в нервные клетки, ни на их метаболизм. Нейроны головного мозга отличаются от клеток других органов тем, что они используют как основной источник энергии преимущественно глюкозу, а не жирные кислоты. Более того, нервные клетки не способны синтезировать глюкозу. Именно поэтому бесперебойное поступление глюкозы в головной мозг столь важно для функционирования и выживания нейронов.
• Другие органы. Как и ЦНС, многие органы (например, почка и кишечник) не чувствительны к инсулину.
Гомеостаз глюкозы
Содержание глюкозы во внутренней среде организма должно находиться в строго ограниченных пределах. Так, натощак концентрация глюкозы в плазме крови колеблется в пределах 60-90 мг% (нормогликемия), увеличивается до 100-140 мг% (гипергликемия) в течение одного часа после еды и обычно в течение 2 ч возвращается к нормальным значениям. Существуют ситуации, когда концентрация глюкозы в плазме крови уменьшается до 60 мг% и ниже (гипогликемия). Необходимость поддерживать постоянную концентрацию глюкозы в крови диктуется тем, что мозг, сетчатка и некоторые другие органы и клетки в качестве источника энергии используют преимущественно глюкозу. Так, в промежутки между приёмами пищи основная часть глюкозы, находящаяся во внутренней среде организме, используется для метаболизма мозга.
• Гомеостаз глюкозы поддерживается следующими механизмами. Φ Печень демпфирует колебания концентрации глюкозы. Так,
когда содержание глюкозы в крови повышается до высоких концентраций после приёма пищи и объём секреции инсулина увеличивается, более 60% глюкозы, всосавшейся из кишечника, депонируется в печени в форме гликогена. В последующие часы, когда концентрация глюкозы и се- креция инсулина снижаются, печень выделяет глюкозу в кровь.
Φ Инсулин и глюкагон реципрокно регулируют нормальное содержание глюкозы в крови. Повышенное по сравнению с нормой содержание глюкозы посредством механизма обратной связи действует на β-клетки островков Лангерханса и вызывает повышенную секрецию инсулина, что приводит
концентрацию глюкозы к норме. Пониженное по сравнению с нормой содержание глюкозы тормозит образование инсулина, но стимулирует секрецию глюкагона, что приводит содержание глюкозы к норме.
Φ Гипогликемия оказывает прямое влияние на гипоталамус, который возбуждает симпатическую нервную систему. В результате адреналин секретируется из надпочечников и увеличивает выделение глюкозы печенью.
Φ Продолжительная гипогликемия стимулирует выделение СТГ и кортизола, которые уменьшают скорость потребления глюкозы большинством клеток организма, благодаря чему концентрация глюкозы в крови возвращается к нормальному уровню.
• После приёма пищи всосавшиеся в кишечнике моносахариды:, триглицериды и аминокислоты по системе воротной вены поступают в печень, где различные моносахариды превращаются в глюкозу. Глюкоза в печени хранится в виде гликогена (синтез гликогена происходит также в мышцах), в печени окисляется лишь малая часть глюкозы. Глюкоза, не использованная гепатоцитами, оказывается в системе общей циркуляции и поступает в различные органы, где окисляется до воды и CO2 и обеспечивает энергетические потребности этих органов. Φ Инкретины. При поступления химуса в кишечник из эндокринных клеток его стенки во внутреннюю среду организма выделяются так называемые инкретины: желудочный ингибирующий пептид, энтероглюкагон (глицентин) и глюкагоноподобный пептид 1, - потенцирующие вызванную глюкозой секрецию инсулина. Φ Всасывание глюкозы из просвета кишечника осуществляют встроенные в апикальную плазматическую мембрану энтероцитов Na+-зависимые котранспортёры ионов натрия и глюкозы, требующие (в отличие от переносчиков глюкозы GLUT) затрат энергии. Напротив, выход глюкозы из энтероцитов во внутреннюю среду организма, происходящий через плазмолемму их базальной части, осуществляется пу- тём облегчённой диффузии. Φ Выделение глюкозы через почки
♦ Фильтрация молекул глюкозы из просвета кровеносных капилляров почечных телец в полость капсулы Боумена-
Шумлянского осуществляется пропорционально концентрации глюкозы в плазме крови.
♦ Реабсорбция. Обычно вся глюкоза реабсорбируется в первой половине проксимальных извитых канальцев со скоростью 1,8 ммоль/мин (320 мг/мин). Реабсорбция глюкозы происходит (как и её всасывание в кишечнике) при помощи сочетанного переноса ионов натрия и глюкозы.
♦ Секреция. Глюкоза у здоровых лиц не секретируется в просвет канальцев нефрона.
♦ Глюкозурия. Глюкоза появляется в моче, когда её содержание в плазме крови превышает
• Между приёмами пищи глюкоза поступает в кровь из печени, где образуется за счёт гликогенолиза (распад гликогена до глюкозы) и глюконеогенеза (образование глюкозы из аминокислот, лактата, глицерола и пирувата). Из-за малой активности глюкозо-6-фосфатазы глюкоза не поступает в кровь из мышц.
Φ В покое содержание
глюкозы в плазме крови составляет 4,5-5,6 мМ, а общее содержание
глюкозы (расчёты для взрослого здорового мужчины) в
Φ Между приёмами пищи преобладают гликогенолиз, глюконеогенез и липолиз. Даже при непродолжительном голодании (24-48 ч) развивается обратимое состояние, близкое к сахарному диабету, - голодный диабет. При этом нейроны начинают использовать в качестве источника энергии кетоновые тела.
• При физической нагрузке потребление глюкозы возрастает в несколько раз. При этом увеличиваются гликогенолиз, липолиз и глюконеогенез, регулируемые инсулином, а также функциональными антагонистами инсулина (глюкагон, катехоламины, СТГ, кортизол).
Φ Глюкагон. Эффекты глюкагона см. ниже. Φ Катехоламины. Физическая нагрузка через гипоталамические центры (гипоталамический глюкостат) активирует
симпатоадреналовую систему. В результате уменьшается выброс инсулина из β-клеток, увеличивается секреция глю- кагона из α-клеток, возрастает поступление в кровь глюкозы из печени, усиливается липолиз. Катехоламины также потенцируют рост потребления кислорода митохондриями, вызванный T3 и T4. Φ Благодаря гормону роста увеличивается содержание глюкозы в плазме крови, так как усиливается гликогенолиз в печени, уменьшается чувствительность мышц и жировых клеток к инсулину (в результате уменьшается поглощение ими глюкозы), а также стимулируется выброс глюкагона из α-клеток.
Φ Глюкокортикоиды стимулируют гликогенолиз и глюконеогенез, но подавляют транспорт глюкозы из крови в разные клетки.
• Глюкостат. Регуляция глюкозы, содержащейся во внутренней среде организма, имеет целью поддерживать гомеостаз этого сахара в пределах нормальных значений (концепция глюкостата) и осуществляется на разных уровнях. Выше рассмотрены механизмы, позволяющие поддерживать гомеостаз глюкозы на уровне поджелудочной железы и органов-мишеней инсулина (периферический глюкостат). Считают, что центральную регуляцию содержания глюкозы (центральный глюкостат) осуществляют чувствительные к инсулину нервные клетки гипоталамуса, посылающие далее сигналы активации симпатоадреналовой системы, а также к синтезирующим кортиколиберин и соматолиберин нейронам гипоталамуса. Поскольку содержание глюкозы во внутренней среде организма отклоняется от нормальных значений, о чём судят по содержанию глюкозы в плазме крови, развивается гипергликемия или гипогликемия.
Φ Гипогликемия - снижение содержания глюкозы в крови менее 3,33 ммоль/л. Гипогликемия может возникать у здоровых лиц после нескольких дней голодания. Клинически гипогликемия проявляется при снижении уровня глюкозы ниже 2,4-3,0 ммоль/л. Ключ к диагностике гипогликемии - триада Уипла: нервно-психические проявления при голодании, глюкоза крови менее 2,78 ммоль/л, купирование приступа пероральным или внутривенным введением рас-
твора декстрозы (40-60 мл 40% раствора глюкозы). Крайнее проявление гипогликемии - гипогликемическая кома. Φ Гипергликемия. Массовое
поступление глюкозы во внутреннюю среду организма вызывает рост её
содержания в крови - гипергликемию (содержание глюкозы в плазме крови
превышает
Влияние инсулина на жировой обмен
• Печень. Инсулин в гепатоцитах:
Φ способствует синтезу жирных кислот из глюкозы, активируя ацетил-КоА-карбоксилазу и синтазу жирных кислот. Жирные кислоты, присоединяя α-глицерофосфат, превращаются в триглицериды;
Φ подавляет окисление жирных кислот вследствие увеличенного превращения ацетил-КоА в малонил-КоА. Малонил-КоА ингибирует активность карнитин-ацилтрансферазы (транспортирует жирные кислоты из цитоплазмы в митохондрии для их β-окисления и превращения в кетокислоты. Другими словами, инсулин оказывает антикетогенный эффект.
• Жировая ткань. В липоцитах инсулин способствует превращению свободных жирных кислот в триглицериды и их отложению в виде жира. Этот эффект инсулина осуществляется несколькими путями. Инсулин:
Φ увеличивает окисление пирувата, активируя пируватдегидрогеназу и ацетил-КоА-карбоксилазу, что благоприятствует синтезу свободных жирных кислот;
Φ увеличивает транспорт глюкозы в липоциты, последующее превращение которой способствует появлению α-глицерофосфата;
Φ способствует синтезу триглицеридов из α-глицерофосфата и свободных жирных кислот;
Φ предупреждает расщепление триглицеридов на глицерол и свободные жирные кислоты, ингибируя активность гормончувствительной триглицеридлипазы;
Φ активирует синтез липопротеинлипазы, транспортируемой к клеткам эндотелия, где этот фермент расщепляет триглицериды хиломикронов и липопротеинов очень низкой плот- ности.
Воздействие инсулина на белковый обмен и рост организма
Инсулин в печени, скелетных мышцах, а также в других органах-мишенях и клетках-мишенях стимулирует синтез белка и подавляет его катаболизм. Другими словами, инсулин - сильный анаболический гормон. Анаболическое влияние инсулина реализуется несколькими путями. Инсулин:
• стимулирует поглощение аминокислот клетками;
• усиливает транскрипцию генов и трансляцию мРНК;
• подавляет распад белков (особенно мышечных) и тормозит их высвобождение в кровь;
• уменьшает скорость глюконеогенеза из аминокислот. Анаболические эффекты инсулина и гормона роста синергич-
ны. Это не в последнюю очередь определяется тем обстоятельством, что эффекты гормона роста осуществляются посредством инсулиноподобного фактора роста - соматомедина C.
Глюкагон и глюкагоноподобные пептиды
Ген глюкагона содержит последовательности, кодирующие структуру нескольких физиологически родственных гормонов с эф- фектами глюкагона. В результате транскрипции образуется мРНК препроглюкагона, но эта мРНК по-разному расщепляется (дифференциальный сплайсинг) в α-клетках островков Лангерханса и эндокринных L-клетках слизистой оболочки верхних отделов тонкого кишечника, вызывая образование разных мРНК проглюкагона.
Φ Глицентин состоит из 69 аминокислотных остатков, стимулирует секрецию инсулина и желудочного сока, а также принимает участие в регуляции моторики ЖКТ. Глицентин обнаружен также в нервных клетках гипоталамуса и ствола мозга.
Φ Глюкагоноподобный пептид-1 (аминокислотные последовательности 7-37) - самый мощный стимулятор вызванной глюкозой секреции инсулина (именно поэтому, в частности, тест на толерантность к глюкозе проводят перорально, а не внутривенно). Это пептид подавляет желудочную секрецию и расценивается как физиологический медиатор чувства насыщения. Пептид синтезируется также в нейронах паравентрикулярного ядра гипоталамуса и нейронах центрального ядра миндалевидного тела. Обе группы нерв- ных клеток принимают непосредственное участие в регуляции пищевого поведения.
Φ Глюкагоноподобный пептид-2 стимулирует пролиферацию клеток кишечных крипт и всасывание в тонком кишечнике.
Секреция глюкагона
Внутриклеточные события, обеспечивающие секрецию глюкагона из α-клеток, происходят по тем же механизмам, что и секреция инсулина из β-клеток (см. выше раздел «Регуляторы секреции инсулина»), но те же внеклеточные сигналы:, запускающие секрецию глюкагона, зачастую (но не всегда!) приводят к противоположным результатам.
• Стимулируют секрецию глюкагона аминокислоты (в особенности аргинин и аланин), гипогликемия, инсулин, гастрин, холецистокинин, кортизол, физическая нагрузка, голодание, β-адренергические стимуляторы, приём пищи (особенно богатой белком).
• Подавляют секрецию глюкагона глюкоза, инсулин, соматостатин, секретин, свободные жирные кислоты, кетоновые тела, α-адренергические стимуляторы.
Время полужизни глюкагона в крови - около 5 мин.
Физиологические эффекты глюкагона
Основная мишень глюкагона - печень (гепатоциты), в меньшей степени - адипоциты и поперечнополосатая мышечная ткань (в том числе кардиомиоциты). Рецептор глюкагона расположен в плазмолемме клеток-мишеней, он связытвает только глюкагон и посредством G-белка активирует аденилатциклазу. Мутации гена глюкагонового рецептора становятся причиной инсулиннезависимого сахарного диабета. Глюкагон расценивают как антагонист инсулина, этот гормон стимулирует гликогенолиз и липолиз, что
ведёт к быстрой мобилизации источников энергии (глюкоза и жирные кислоты). В то же время глюкагон обладает кетогенным эффектом, т.е. стимулирует образование кетоновых тел.
• Глюкагон увеличивает содержание глюкозы (способствует гипергликемии) в плазме крови. Этот эффект реализуется несколькими путями.
Φ Стимуляция гликогенолиза. Глюкагон, активируя гликогенфосфорилазу и ингибируя гликогенсинтазу в гепатоцитах, вызывает быстрый и выраженный распад гликогена и высвобождение глюкозы в кровь.
Φ Подавление гликолиза. Глюкагон ингибирует ключевые ферменты гликолиза (фосфофруктокиназа, пируваткиназа) в печени, что приводит к увеличению содержания глюкозо- 6-фосфата в гепатоцитах, его дефосфорилированию и освобождению глюкозы в кровь.
Φ Стимуляция глюконеогенеза. Глюкагон усиливает транспорт аминокислот из крови в гепатоциты и одновременно ак- тивирует основные ферменты глюконеогенеза (пируваткарбоксилаза, фруктозо-1,6-дифосфатаза), что способствует увеличению содержания глюкозы в цитоплазме клеток и её поступлению в кровь.
• Глюкагон способствует образованию кетоновых тел, стимулируя окисление жирных кислот: поскольку ингибируется активность ацетил-КоА-карбоксилазы, уменьшается содержание ингибитора карнитин-ацилтрансферазы - малонил-КоА, что вызывает усиленное поступление жирных кислот из цитоплазмы в митохондрии, где происходит их β-окисление и превращение в кетокислоты. Другими словами, в отличие от инсулина, глюкагон оказывает кетогенный эффект.
Обобщение раздела
Распределение альфа-, бета-, дельта- и F-клеток внутри каждого из островков Лангерханса имеет определённый паттерн, свидетельствующий о том, что возможна паракринная регуляция секреции.
Уровень глюкозы в плазме является первичным физиологическим регулятором секреции инсулина и глюкагона. Аминокислоты, жирные кислоты и некоторые желудочно-кишечные гормоны также принимают участие в этом процессе.
Инсулин оказывает анаболическое влияние на углеводный, жировой и белковый метаболизм в тканях, являющихся мишенью его действия.
Воздействие глюкагона на углеводный, жировой и белковый метаболизм первично проявляется в печени и носит катаболический характер.
ЯИЧКИ
В яичках синтезируются стероидные андрогены и α-ингибин. Их физиологическое значение рассмотрено в главе 19, здесь при- ведены краткие характеристики гормонов.
• Стероидные андрогены вырабатываются интерстициальными клетками Ляйдига (тестостерон и дигидротестостерон) и клетками сетчатой зоны коры надпочечников (дегидроэпиандростерон и андростендион, обладающие слабой андрогенной активностью).
Φ Тестостерон - основной циркулирующий андроген. В эмбриогенезе андрогены контролируют развитие плода по мужскому типу. В период полового созревания они стимулируют становление признаков мужского пола. С наступлением половой зрелости тестостерон необходим для поддержания сперматогенеза, вторичных половых признаков, секреторной активности предстательной железы и семенных пузырьков.
Φ Дигидротестостерон. 5α-Редуктаза катализирует превращение тестостерона в дигидротестостерон в клетках Ляйдига, простате, семенных пузырьках.
• α-Ингибин. Этот гликопротеидный гормон синтезируется в клетках Сертоли извитых семенных канальцев и блокирует синтез гипофизарного ФСГ.
ЯИЧНИКИ
В яичниках синтезируются стероидные женские половые гормоны, гликопротеиновые гормоны ингибины и пептидной природы релаксины. Их физиологическое значение рассмотрено в главе 19, здесь приведены краткие характеристики гормонов.
• Женские половые гормоны эстрогены (эстрадиол, эстрон, эстриол) и прогестины (прогестерон) - стероиды.
Φ Эстрогены в период полового созревания стимулируют становление признаков женского пола. У женщин детородного возраста эстрогены активируют пролиферацию фолликулярных клеток, а в эндометрии контролируют пролиферативную фазу менструального цикла.
♦ Эстрадиол (17β-эстрадиол, Е2) - 17β-эстра-1,3,5(10)- триен-3,17-диол - образуется из тестостерона путём его ароматизации, обладает выраженной эстрогенной ак- тивностью. Образование ароматических С18-эстрогенов из С19-андрогенов катализирует ароматаза, называемая также эстрогенсинтазой. Синтез этого фермента в яичнике индуцируется ФСГ.
♦ Эстрон (Е1) - 3-гидроксиэстра-1,3,5(10)-триен-17-он - метаболит 17β-эстрадиола, образуется путём ароматизации андростендиона, имеет небольшую эстрогенную ак- тивность, выделяется с мочой беременных.
♦ Эстриол - 16α,17β-эстри-1,3,5(10)-триен-3,16,17-триол - образуется из эстрона. Этот слабый эстроген экскретируется с мочой беременных, в значительном количестве присутствует в плаценте.
♦ Рецептор эстрогенов относится к ядерным рецепторам, полипептид из 595 аминокислотных остатков, имеет вы- раженную гомологию с протоонкогеном v-erbA.
• Φ Прогестерон относится к прогестинам, его синтезируют клетки жёлтого тела яичника в лютеиновой стадии овариально-менструального цикла, а также клетки хориона при наступлении беременности. Прогестерон в эндометрии контролирует секреторную фазу менструального цикла и существенно увеличивает порог возбудимости ГМК миометрия. Стимулируют синтез прогестерона ЛГ и ХГТ. Рецептор прогестинов относится к ядерным факторам транскрипции; вследствие генных дефектов рецептора не возникает изменений эндометрия, характерных для секреторной фазы менструального цикла. Релаксины - пептидные гормоны из семейства инсулинов, синтезируются клетками жёлтого тела и цитотрофобластом, при беременности оказывают расслабляющий эффект на ГМК миометрия, а перед родами способствуют размягчению лонного сочленения и шейки матки.
• Ингибины, синтезируемые в яичнике, подавляют синтез и секрецию гипоталамического гонадолиберина и гипофизарного
ФСГ.
ПЛАЦЕНТА
Плацента синтезирует множество гормонов и других биологически активных веществ, имеющих важное значение для нормаль- ного течения беременности и развития плода.
Пептидные гормоны (в том числе нейропептиды и рилизинггормоны): хорионический гонадотропин (ХТГ), плацентарного вариант гормона роста, соматомаммотропины хорионические 1 и 2 (плацентарные лактогены), тиреотропин (ТТГ), тиреолиберин (ТТГ-РГ), кортиколиберин (АКТГ-РГ), гонадолиберин, соматолиберин, соматостатин, вещество P, нейротензин, нейропептид Y, пептид, относящийся к АКТГ, гликоделин A (белок, связьвающий инсулиноподобные факторы роста), ингибины.
Стероидные гормоны: прогестерон, эстрон, эстрадиол, эстриол.
ПОЧКИ
Разные клетки почек синтезируют значительное количество веществ, обладающих гормональными эффектами.
• Ренин не является гормоном, этот фермент (протеаза, субстратом которой служит ангиотензиноген) - начальное звено в системе «ренин-ангиотензиноген-ангиотензины» (ренинангиотензиновая система), важнейшем регуляторе системного АД. Ренин синтезируется в видоизменённых (эпителиоидных) ГМК стенки приносящих артериол почечных телец, входящих в состав околоклубочкового комплекса, и секретируется в кровь. Регуляторы синтеза и секреции ренина: 1) опосредуемая β-адренорецепторами симпатическая иннервация (стимуляция секреции ренина); 2) ангиотензины (по принципу отрицательной обратной связи); 3) рецепторы плотного пятна в составе околоклубочкового комплекса (регистрация содержания NaCl в дистальных канальцах нефрона); 4) барорецепторы в стенке приносящей артериолы почечных телец.
• Кальцитриол (1α, 25-дигидроксихолекальциферол) - активная форма витамина D3 - синтезируется в митохондриях проксимальных извитых канальцев, способствует всасыванию
кальция и фосфатов в кишечнике, стимулирует остеобласты (ускоряет минерализацию костей). Образование кальцитриола стимулируется ПТГ и гипофосфатемией (пониженное содержание фосфатов в крови), подавляется гиперфосфатемией (повышенное содержание фосфатов в крови).
• Эритропоэтин - содержащий сиаловую кислоту белок - синтезируется интерстициальными клетками, стимулирует эритропоэз на стадии формирования проэритробластов. Основной стимул к выработке эритропоэтина - гипоксия (снижение рО2 в тканях, в том числе зависящее от количества циркулирующих эритроцитов).
• Вазодилататоры - вещества, расслабляющие ГМК стенки кровеносных сосудов, расширяющие их просвет и тем самым снижающие АД. В частности, брадикинин и некоторые простагландины (Пг) синтезируется в интерстициальных клетках мозгового вещества почки.
Φ Брадикинин - нонапептид, образованный из декапептида каллидина (лизил-брадикинин, кининоген, брадикининоген), который в свою очередь отщепляется от α2-глобулина под действием пептидаз - калликреинов (кининогенины).
Φ Простагландин E2 расслабляет ГМК кровеносных сосудов почки, уменьшая тем самым сосудосуживающие эффекты симпатической стимуляции и ангиотензина II.
СЕРДЦЕ
Натрийуретические факторы (предсердный фактор - атриопептин) синтезируют кардиомиоциты правого предсердия и некоторые нейроны ЦНС. Мишени натрийуретических пептидов - клетки почечных телец, собирательных трубочек почки, клубочковой зоны коры надпочечников, ГМК сосудов. Функции натрийуре- тических факторов - контроль объёма внеклеточной жидкости и гомеостаза электролитов (угнетение синтеза и секреции альдостерона, ренина, вазопрессина). Эти пептиды оказывают сильный сосудорасширяющий эффект и снижают АД.
ЖЕЛУДОК И КИШЕЧНИК
В стенке трубчатых органов ЖКТ содержится огромное количество разнообразных эндокринных клеток (энтероэндокринные
клетки), секретирующих гормоны. Вместе с вырабатывающими различные нейропептиды клетками собственной нервной системой ЖКТ (энтеральная нервная система) энтероэндокринная система регулирует множество функций пищеварительной системы (рассмотрены в гл. 21). Здесь же для примера назовём пептидные гормоны гастрин, секретин и холецистокинин.
• Гастрин стимулирует секрецию HCl париетальными клетками слизистой оболочки желудка.
• Секретин стимулирует выделение бикарбоната и воды из секреторных клеток желёз двенадцатиперстной кишки и поджелудочной железы.
• Холецистокинин стимулирует сокращения желчного пузыря и выделение ферментов из поджелудочной железы.
РАЗНЫЕ ОРГАНЫ
Клетки различных органов вырабатывают множество химических веществ регуляторного характера, формально не относящихся к гормонам и эндокринной системе (например, Пг, интерфероны, интерлейкины, факторы роста, гемопоэтины, хемокины и др.).
• Эйкозаноиды влияют на сократимость ГМК сосудов и бронхов, изменяют порог болевой чувствительности и участвуют в регуляции многих функций организма (поддержание гемостаза, регуляция тонуса ГМК, секреция желудочного сока, поддержание иммунного статуса и т.д.). Например, в лёгких ПгD2 и лейкотриен С4 - мощные сократительные агонисты ГМК воздухоносных путей, их эффекты соответственно в 30 и в 1000 раз сильнее эффектов гистамина. В то же время ПгЕ2 - вазодилататор, а лейкотриены D4 и Е4 - вазоконстрикторы, они также увеличивают проницаемость стенки кровеносных сосудов.
Φ Пг при физиологических значениях pH плохо проникают через биологические мембраны. Их трансмембранный транспорт осуществляют специальные белки-транспортёры, встроенные в клеточные мембраны.
Φ Рецепторы Пг встроены в плазматическую мембрану клетокмишеней и связаны с G-белками.
• Гистамин - мощный стимулятор секреции соляной кислоты в желудке, важнейший медиатор немедленных аллергических
реакций и воспаления, вызывает сокращение ГМК воздухоносных путей и бронхоконстрикцию, но в то же время является сосудорасширяющим агентом для мелких сосудов.
• Интерфероны - гликопротеины, имеющие антивирусную активность; выделяют по крайней мере четыре типа интерферонов (α, β, γ, ω).
• Интерлейкины (не менее 31) - цитокины, действующие как факторы роста и дифференцировки лимфоцитов и других клеток.
• Факторы роста стимулируют рост и дифференцировку, а иногда и трансформацию (озлокачествление) различных клеток. Известно несколько десятков факторов роста: эпидермальный, фибробластов, гепатоцитов, нервов и др.
• Хемокины (несколько десятков) - небольшие секреторные белки, в первую очередь регулирующие перемещения лейкоцитов. Примеры наименований хемокинов: фракталкин, лимфотактин, фактор хемотаксиса моноцитов, ИЛ-18, эутактин и множество других.
• Колониестимулирующие факторы - белковые факторы, необходимые для выживания, пролиферации и дифференцировки гемопоэтических клеток. Они носят имя клеток, на которые оказывают стимулирующее влияние: колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), колониестимулирующий фактор макрофагов (M-CSF) и колониестимулирующий фактор многих клеточных типов (ИЛ-3). Эти факторы вырабатывают макрофаги, T-лимфоциты, эндотелий, фибробласты.
Лептин - гормон, образующийся в адипоцитах, воздействует на гипоталамус, понижая потребление пищи и увеличивая расход энергии.
Адипонектин - гормон, образующийся так же, как и лептин, в адипоцитах, но действующий как антагонист лептина.