Нормальная физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. 2010. - 832 с.
|
|
|
|
ГЛАВА 23. СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Сердечно-сосудистая система представлена сердцем, кровеносными сосудами и кровью. Она обеспечивает кровоснабжение органов и тканей, транспортируя к ним кислород, метаболиты и гормоны, доставляя CO2 из тканей в лёгкие, а другие продукты метаболизма - в почки, печень и другие органы. Эта система также переносит различные клетки, находящиеся в крови, как внутри системы, так и между сосудистой системой и межклеточной жидкостью. Она обеспечивает распространение воды в организме, участвует в работе иммунной системы. Другими словами, основная функция сердечно-сосудистой системы - транспортная. Эта система также жизненно необходима для регуляции гомеостаза (например, для поддержания температуры тела, кислотно-щелочного равновесия - КЩР и др.).
СЕРДЦЕ
Движение крови по сердечно-сосудистой системе осуществляется сердцем, являющимся мышечным насосом, который разделён на правую и левую части. Каждая из частей представлена двумя камерами - предсердием и желудочком. Непрерывная работа миокарда (сердечной мышцы), характеризуется чередованием систолы (сокращения) и диастолы (расслабления).
• Из левых отделов сердца кровь нагнетается в аорту, через артерии и артериолы поступает в капилляры, где и происходит обмен между кровью и тканями. Через венулы кровь направляется в систему вен и далее в правое предсердие. Это большой круг кровообращения - системная циркуляция.
• Из правого предсердия кровь поступает в правый желудочек, который перекачивает её через сосуды лёгких. Это малый круг кровообращения - лёгочная циркуляция.
Сердце сокращается в течение жизни человека до 4 млрд раз, выбрасывая в аорту и способствуя поступлению в органы и ткани до 200 млн л крови. В физиологических условиях сердечный выброс составляет от 3 до 30 л/мин. При этом кровоток в различных органах (в зависимости от напряжённости их функционирования) варьирует, увеличиваясь при необходимости приблизительно вдвое.
Оболочки сердца
Стенки всех четырёх камер имеют три оболочки: эндокард, миокард и эпикард.
• Эндокард выстилает изнутри предсердия, желудочки и лепестки клапанов - митрального, трёхстворчатого, клапана аорты и клапана лёгочного ствола.
• Миокард состоит из рабочих (сократительных), проводящих и секреторных кардиомиоцитов.
Ф Рабочие кардиомиоциты содержат сократительный аппарат и депо Ca2+ (цистерны и трубочки саркоплазматического ретикулума). Эти клетки при помощи межклеточных контактов (вставочные диски) объединены в так называемые сердечные мышечные волокна - функциональный синцитий (совокупность кардиомиоцитов в пределах каждой камеры сердца).
Ф Проводящие кардиомиоциты образуют проводящую систему сердца, в том числе так называемые водители ритма.
Ф Секреторные кардиомиоциты. Часть кардиомиоцитов предсердий (особенно правого) синтезирует и секретирует вазо- дилататор атриопептин - гормон, регулирующий АД.
• Функции миокарда: возбудимость, автоматизм, проводимость и сократимость.
Ф Под влиянием различных воздействий (нервной системы, гормонов, различных ЛС) функции миокарда изменяются: влияние на частоту автоматических сокращений сердца (ЧСС) обозначают термином «хронотропное действие» (может быть положительным и отрицательным), влияние на силу сокращений (т.е. на сократимость) - «инотропное действие» (положительное или отрицательное), воздействие на скорость предсердно-желудочкового проведения (что отражает функцию проводимости) - «дромотропное действие» (положительное или отрицательное), на возбудимость -
«батмотропное действие» (также положительное или отрицательное).
• Эпикард формирует наружную поверхность сердца и переходит (практически слит с ним) в париетальный перикард - париетальный листок околосердечной сумки, содержащей 5-20 мл перикардиальной жидкости.
Клапаны сердца
Эффективная насосная функция сердца зависит от однонаправленного движения крови из вен в предсердия и далее в желудочки, создаваемого четырьмя клапанами (на входе и выходе обоих желудочков, рис. 23-1). Все клапаны (атриовентрикулярные и полулунные) закрываются и открываются пассивно.
• Предсердно-желудочковые клапаны: трёхстворчатый клапан в правом желудочке и двустворчатый (митральный) клапан в левом - препятствуют обратному поступлению крови из желудочков в предсердия. Клапаны закрываются при градиенте давления, направленном в сторону предсердий, т.е. когда давление в желудочках превышает давление в предсердиях. Когда же давление в предсердиях становится выше давления в желудочках, клапаны открываются.
• Полулунные клапаны: аортальные и лёгочной артерии - расположены на выходе из левого и правого желудочков соответственно. Они предотвращают возврат крови из артериальной системы в полости желудочков. Оба клапана представлены тремя плотными, но очень гибкими «кармашками», имеющими полулунную форму и прикреплёнными симметрично вокруг клапанного кольца. «Кармашки» открыты в просвет аорты или лёгочного ствола, и когда давление в этих крупных сосудах начинает превышать давление в желудочках (т.е. когда последние начинают расслабляться в конце систолы), «кармашки» расправляются кровью, заполняющей их под давлением, и плотно смыкаются по своим свободным краям - клапан захлопывается (закрывается).
Тоны сердца
Выслушивание (аускультация) стетофонендоскопом левой половины грудной клетки позволяет услышать два тона сердца - I
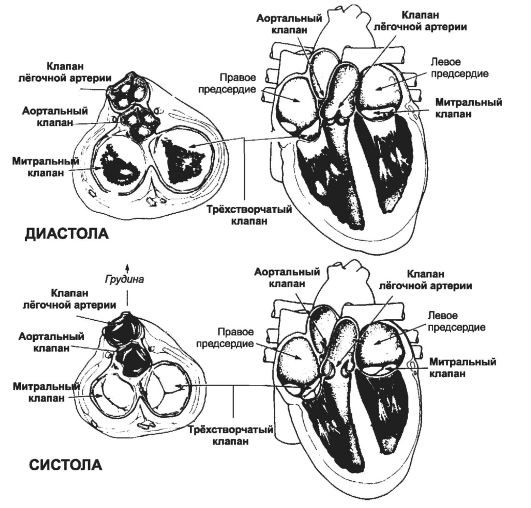
Рис. 23-1. Клапаны сердца. Слева - поперечные (в горизонтальной плоскости) срезы через сердце, зеркально развёрнутые относительно схем справа. Справа - фронтальные срезы через сердце. Вверху - диастола, внизу - систола.
и II. I тон связан с закрытием АВ-клапанов в начале систолы, II - с закрытием полулунных клапанов аорты и лёгочной артерии в конце систолы. Причина возникновения тонов сердца - вибрация напряжённых клапанов сразу же после закрытия совместно с
вибрацией прилежащих сосудов, стенки сердца и крупных сосудов в области сердца.
Продолжительность I тона составляет 0,14 с, II тона - 0,11 с. II тон сердца имеет более высокую частоту, чем I. Звучание I и II тонов сердца наиболее близко передаёт сочетание звуков при произнесении словосочетания «ЛАБ-ДАБ». Помимо I и II тонов, иногда можно выслушать дополнительные тоны сердца - III и IV, в подавляющем большинстве случаев отражающие наличие сердечной патологии.
Кровоснабжение сердца
Стенку сердца снабжают кровью правая и левая венечные (коронарные) артерии. Обе венечные артерии отходят от основания аорты (вблизи места прикрепления створок аортального клапана). Задняя стенка левого желудочка, некоторые отделы перегородки и большая часть правого желудочка кровоснабжаются правой венечной артерией. Остальные отделы сердца получают кровь из левой венечной артерии.
Ф
При сокращении левого желудочка миокард пережимает венечные артерии и
поступление крови к миокарду практически прекращается - 75% крови по
венечным артериям притекает к миокарду во время расслабления сердца
(диастола) и низкого сопротивления сосудистой стенки. Для адекватного
коронарного кровотока диастолическое давление крови не должно
опускаться ниже
Иннервация сердца
Работу сердца контролируют сердечные центры продолговатого мозга и моста через парасимпатические и симпатические волокна (рис. 23-2). Холинергические и адренергические (преимущественно безмиелиновые) волокна образуют в стенке сердца несколько
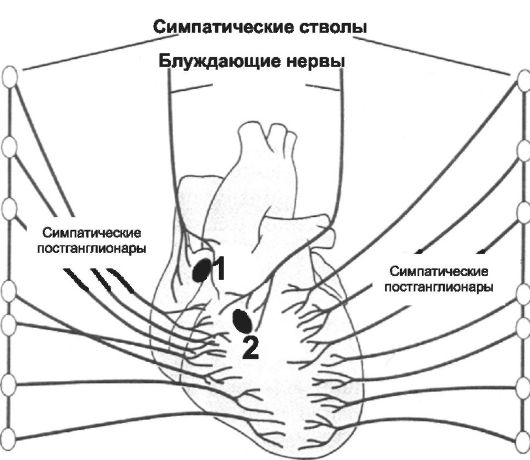
Рис. 23-2. Иннервация сердца. 1 - синусно-предсердный узел, 2 - предсердно-желудочковый узел (АВ-узел).
нервных сплетений, содержащих внутрисердечные ганглии. Скопления ганглиев в основном сосредоточены в стенке правого пред- сердия и в области устьев полых вен.
• Парасимпатическая иннервация. Преганглионарные парасимпатические волокна для сердца проходят в составе блуждающего нерва с обеих сторон. Волокна правого блуждающего нерва иннервируют правое предсердие и образуют густое сплетение в области синусно-предсердного узла. Волокна левого блуждающего нерва подходят преимущественно к АВ-узлу. Именно поэтому правый блуждающий нерв оказывает влияние главным образом на ЧСС, а левый - на АВ-проведение. Желудочки имеют менее выраженную парасимпатическую иннервацию.
Ф Эффекты парасимпатической стимуляции: сила сокращений предсердий уменьшается - отрицательный инотропный эффект, ЧСС снижается - отрицательный хронотропный эффект, предсердно-желудочковая задержка проведения увеличивается - отрицательный дромотропный эффект.
• Симпатическая иннервация. Преганглионарные симпатические волокна для сердца идут от боковых рогов верхних грудных сегментов спинного мозга. Постганглионарные адренергические волокна образованы аксонами нейронов, содержащихся в ганглиях симпатической нервной цепочки (звёздчатый и отчасти верхний шейный симпатические узлы). Они подходят к органу в составе нескольких сердечных нервов и равномерно распределяются по всем отделам сердца. Терминальные ветви пронизывают миокард, сопровождают венечные сосуды и подходят к элементам проводящей системы. Миокард предсердий имеет более высокую плотность адренергических волокон. Каждый пятый кардиомиоцит желудочков снабжается адренергической терминалью, заканчивающейся на расстоянии 50 мкм от плазмолеммы кардиомиоцита.
Ф Эффекты симпатической стимуляции: сила сокращений предсердий и желудочков увеличивается - положительный инотропный эффект, ЧСС возрастает - положительный хронотропный эффект, интервал между сокращениями предсердий и желудочков (т.е. задержка проведения в АВ-соединении) укорачивается - положительный дромотропный эффект.
• Афферентная иннервация. Чувствительные нейроны ганглиев блуждающих нервов и спинномозговых узлов (C8-Th6) образуют свободные и инкапсулированные нервные окончания в стенке сердца. Афферентные волокна проходят в составе блуждающих и симпатических нервов.
СВОЙСТВА МИОКАРДА
Основные свойства сердечной мышцы - возбудимость; автоматизм; проводимость, сократимость.
Возбудимость
Возбудимость - свойство отвечать на раздражение электрическим возбуждением в виде изменений мембранного потенциала (МП) с последующей генерацией ПД. Электрогенез в виде МП и ПД определяется разностью концентраций ионов по обе стороны мембраны, а также активностью ионных каналов и ионных насосов. Через поры ионных каналов ионы проходят по электро-
химическому градиенту, тогда как ионные насосы обеспечивают движение ионов против электрохимического градиента. В кардиомиоцитах наиболее распространённые каналы - для ионов Na+, K+, Ca2+ и Cl-.
• МП покоя кардиомиоцита составляет -90 мВ. Стимуляция порождает распространяющийся ПД, который вызывает сокращение (рис. 23-3). Деполяризация развивается быстро, как в скелетной мышце и нерве, но, в отличие от последних, МП возвращается к исходному уровню не сразу, а постепенно.
• Деполяризация длится около 2 мс, фаза плато и реполяризация продолжаются 200 мс и более. Как и в других возбудимых тканях, изменение внеклеточного содержания K+ влияет на МП; изменения внеклеточной концентрации Na+ воздействуют на величину ПД.
Ф Быстрая начальная деполяризация (фаза 0) возникает вследствие открытия потенциалзависимых быстрых ?+-каналов, ионы Na+ быстро устремляются внутрь клетки и меняют заряд внутренней поверхности мембраны с отрицательного на положительный.
Ф Начальная быстрая реполяризация (фаза 1) - результат закрытия Na+-каналов, входа в клетку ионов Cl- и выхода из неё ионов K+.
Ф Следующая продолжительная фаза плато (фаза 2 - МП некоторое время сохраняется приблизительно на одном уровне) - результат медленного открытия потенциалзависимых Ca^-каналов: ионы Ca2+ поступают внутрь клетки, равно как ионы и Na+, при этом ток ионов K+ из клетки сохраняется.
Ф Конечная быстрая реполяризация (фаза 3) возникает в результате закрытия Ca2+-каналов на фоне продолжающегося выхода K+ из клетки через K+-каналы.
Ф В фазе покоя (фаза 4) происходит восстановление МП за счёт обмена ионов Na+ на ионы K+ посредством функ- ционирования специализированной трансмембранной системы - Na+-, К+-насоса. Указанные процессы касаются именно рабочего кардиомиоцита; в клетках водителя ритма фаза 4 несколько отличается.
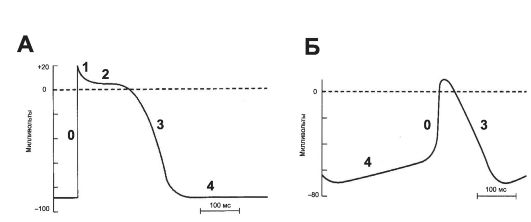
Рис. 23-3. Потенциалы действия. А - желудочек; Б - синусно-предсердный узел; В - ионная проводимость. I - ПД, регистрируемый с поверхностных электродов, II - внутриклеточная регистрация ПД, III - механический ответ; Г - сокращение миокарда. АРФ - абсолютная рефрактерная фаза, ОРФ - относительная рефрактерная фаза. О - деполяризация, 1 - начальная быстрая реполяризация, 2 - фаза плато, 3 - конечная быстрая реполяризация, 4 - исходный уровень.
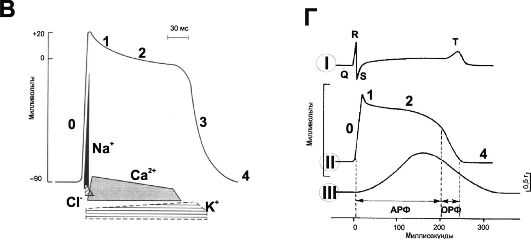
Рис. 23-3. Окончание.
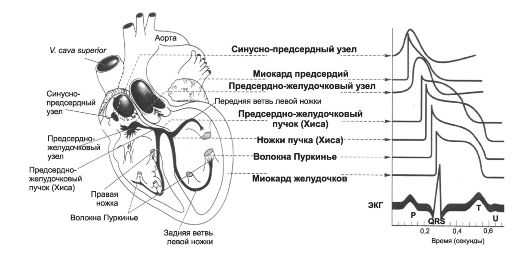
Рис. 23-4. Проводящая система сердца (слева). Типичные ПД [синусового (синусно-предсердного) и АВ-узлов (предсердно-желудочкового), других частей проводящей системы и миокарда предсердий и желудочков] в корреляции с ЭКГ (справа).
Автоматизм и проводимость
Автоматизм - способность пейсмейкерных клеток инициировать возбуждение спонтанно, без участия нейрогуморального контроля. Возбуждение, приводящее к сокращению сердца, возникает в специализированной проводящей системе сердца и распространяется посредством неё ко всем частям миокарда.
Проводящая система сердца. Структуры, входящие в состав проводящей системы сердца, - синусно-предсердный узел, межузловые предсердные пути, АВ-соединение (нижняя часть проводящей системы предсердий, прилегающая к АВ-узлу, собственно АВ-узел, верхняя часть пучка Хиса), пучок Хиса и его ветви, система волокон Пуркинье (рис. 23-4).
Водители ритма. Все отделы проводящей системы способны генерировать ПД с определённой частотой, определяющей в конечном счёте ЧСС, т.е. быть водителем ритма. Однако синуснопредсердный узел генерирует ПД быстрее других отделов проводя- щей системы и деполяризация от него распространяется в другие участки проводящей системы прежде, чем они начнут спонтанно возбуждаться. Таким образом, синусно-предсердный узел - основной водитель ритма, или водитель ритма первого порядка. Частота его
спонтанных разрядов определяет частоту биений сердца (в среднем 60-90 в минуту).
Пейсмейкерные потенциалы
МП пейсмейкерных клеток после каждого ПД возвращается к пороговому уровню возбуждения. Этот потенциал, называемый препотенциалом (пейсмейкерным потенциалом), - триггер для следующего потенциала (рис. 23-5, А). На пике каждого ПД после деполяризации возникает калиевый ток, запускающий процессы реполяризации. Когда калиевый ток и выход ионов K+ уменьшаются, мембрана начинает деполяризоваться, формируя первую часть препотенциала. Открываются Са2+-каналы двух типов: временно открывающиеся Са2+в-каналы и длительно действующие
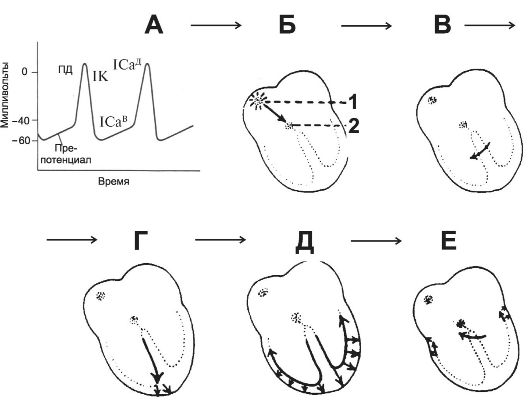
Рис. 23-5. Распространение возбуждения по сердцу. А - потенциалы пейсмейкерной клетки. IK, 1Сад, 1Сав - ионные токи, соответствующие каждой части пейсмейкерного потенциала; Б-Е - распространение электрической активности в сердце: 1 - синусно-предсердный узел, 2 - предсердно-желудочковый (АВ-) узел. Пояснения в тексте.
Са2+д-каналы. Кальциевый ток, идущий по Са2+в-каналам, образует препотенциал, кальциевый ток в Са2+д-каналах создаёт ПД.
Распространение возбуждения по сердечной мышце
Деполяризация, возникающая в синусно-предсердном узле, распространяется радиально по предсердиям и затем сходится (конвергирует) в АВ-соединении (рис. 23-5). Деполяризация предсердий полностью завершается в течение 0,1 с. Так как проведение в АВ-узле происходит медленнее по сравнению с проведением в миокарде предсердий и желудочков, возникает предсердно-желудочковая (АВ-) задержка длительностью 0,1 с, после которой возбуждение распространяется на миокард желудочков. Предсердно-желудочковая задержка сокращается при стимуляции симпатических нервов сердца, тогда как под влиянием раздражения блуждающего нерва её длительность возрастает.
От основания межжелудочковой перегородки волна деполяризации с большой скоростью распространяется по системе волокон Пуркинье ко всем частям желудочка в течение 0,08-0,1 с. Деполяризация миокарда желудочка начинается с левой стороны межжелудочковой перегородки и распространяется прежде всего вправо сквозь среднюю часть перегородки. Затем волна деполяризации проходит по перегородке вниз к верхушке сердца. Вдоль стенки желудочка она возвращается к АВ-узлу, переходя с субэндокардиальной поверхности миокарда на субэпикардиальную.
Сократимость
Сердечная мышца сокращается, если содержание внутриклеточного кальция превышает 100 ммоль. Этот подъём внутриклеточной концентрации Са2+ связан со входом внеклеточного Са2+ во время ПД. Поэтому весь этот механизм называют единым процессом возбуждение-сокращение. Способность сердечной мышцы развивать усилие без каких-либо изменений длины мышечного волокна называется сократимостью. Сократимость сердечной мышцы, главным образом, определяется способностью клетки удерживать Са2+. В отличие от скелетной мышцы ПД в сердечной мышце сам по себе, если Са2+ не поступает внутрь клетки, не может вызвать высвобождения Са2+. Следовательно, в отсутствие наружного Са2+ сокращение сердечной мышцы невозможно. Свойство сократимости миокарда обеспечивается контрактильным аппаратом кардио-
миоцитов, связанных в функциональный синцитий при помощи ионопроницаемых щелевых контактов. Это обстоятельство син- хронизирует распространение возбуждения от клетки к клетке и сокращение кардиомиоцитов. Увеличение силы сокращений миокарда желудочков - положительный инотропный эффект катехоламинов - опосредовано Р1-адренорецепторами (через эти рецепторы действует также симпатическая иннервация) и цАМФ. Сердечные гликозиды также усиливают сокращения сердечной мышцы, оказывая ингибирующее влияние на К+-АТФазу в клеточных мембранах кардиомиоцитов. Пропорционально увеличению частоты сердечных сокращений возрастает усилие сердечной мышцы (феномен лестницы). Этот эффект связывают с накоплением Са2+ в саркоплазматическом ретикулуме.
ЭЛЕКТРОКАРДИОГРАФИЯ
Сокращения миокарда сопровождаются (и обусловлены) высокой электрической активностью кардиомиоцитов, что форми- рует изменяющееся электрическое поле. Колебания суммарного потенциала электрического поля сердца, представляющего алгебраическую сумму всех ПД (см. рис. 23-4), можно зарегистрировать с поверхности тела. Регистрацию этих колебаний потенциала электрического поля сердца на протяжении сердечного цикла осуществляют при записи электрокардиограммы (ЭКГ) - последовательности положительных и отрицательных зубцов (периоды электрической активности миокарда), часть которых соединяется так называемой изоэлектрической линией (периоды электрического покоя миокарда).
Вектор электрического поля (рис. 23-6, А). В каждом кардиомиоците при его деполяризации и реполяризации на границе воз- буждённого и невозбуждённого участков возникают близко прилегающие друг к другу положительные и отрицательные заряды (элементарные диполи). В сердце одновременно возникает множество диполей, направление которых различно. Их электродвижущая сила - вектор, характеризующийся не только величиной, но и направлением: всегда от меньшего заряда (-) к большему (+). Сумма всех векторов элементарных диполей образует суммарный диполь - вектор электрического поля сердца, постоянно ме- няющийся во времени в зависимости от фазы сердечного цикла. Условно считают, что в любой фазе вектор исходит из одной точ-
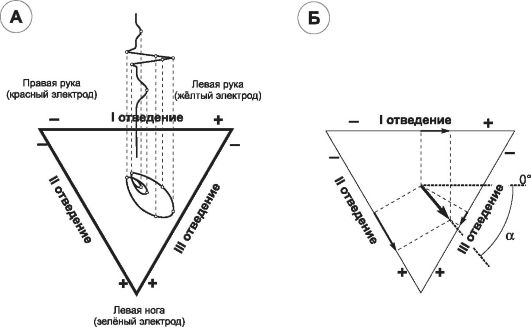
Рис. 23-6. Векторы электрического поля сердца [19]. А - схема построения ЭКГ по векторэлектрокардиографии. Три основных результирующих вектора (деполяризации предсердий, деполяризации желудочков и реполяризации желудочков) образуют три петли при векторэлектрокардиографии; при развёртке этих векторов по оси времени получают обычную кривую ЭКГ; Б - треугольник Эйнтховена. Объяснение в тексте. α - угол между электрической осью сердца и горизонталью.
ки, названной электрическим центром. Значительную часть цикла результирующие векторы направлены от основания сердца к его верхушке. Выделяют три основных результирующих вектора: деполяризации предсердий, деполяризации и реполяризации желудочков. Направление результирующего вектора деполяризации желудочков - электрическая ось сердца (ЭОС).
Треугольник Эйнтховена. В объёмном проводнике (тело человека) сумма потенциалов электрического поля в трёх вершинах равностороннего треугольника с источником электрического поля в центре треугольника всегда будет равна нулю. Тем не менее разница потенциалов электрического поля между двумя вершинами треугольника не равна нулю. Такой треугольник с сердцем в его центре - треугольник Эйнтховена - ориентирован во фронтальной плоскости тела человека; рис. 23-7, Б); при снятии ЭКГ тре-
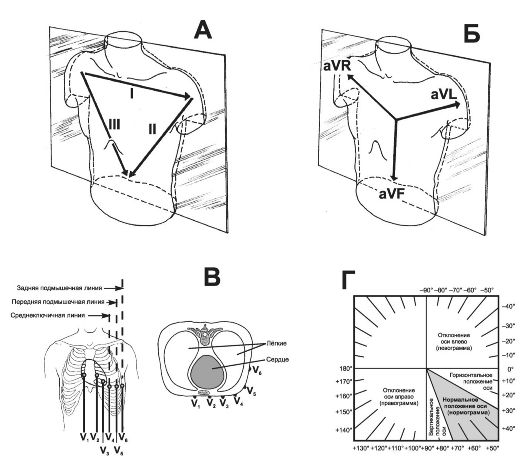
Рис. 23-7. Отведения при ЭКГ [19]. А - стандартные отведения; Б - усиленные отведения от конечностей; В - грудные отведения; Г - варианты положения электрической оси сердца в зависимости от значения угла α. Объяснения в тексте.
угольник создают искусственно, располагая электроды на обеих руках и левой ноге. Две точки треугольника Эйнтховена с разницей потенциалов между ними, изменяющейся во времени, обозначают как отведение ЭКГ.
Отведения ЭКГ. Точками для формирования отведений (их всего 12 при записи стандартной ЭКГ) выступают вершины треугольника Эйнтховена (стандартные отведения), центр треугольника (усиленные отведения) и точки, расположенные непосредственно над сердцем (грудные отведения).
• Стандартные отведения. Вершины треугольника Эйнтховена - электроды на обеих руках и левой ноге. Определяя разницу потенциалов электрического поля сердца между двумя вершинами треугольника, говорят о регистрации ЭКГ в стандартных отведениях (рис. 23-7, А): между правой и левой руками - I стандартное отведение, между правой рукой и левой ногой - II стандартное отведение, между левой рукой и левой ногой - III стандартное отведение.
• Усиленные отведения от конечностей. В центре треугольника Эйнтховена при суммировании потенциалов всех трёх электродов формируется виртуальный «нулевой», или индифферентный, электрод. Разницу между нулевым электродом и электродами в вершинах треугольника Эйнтховена регистрируют при снятии ЭКГ в усиленных отведениях от конечностей (рис. 23-8, Б): aVL - между «нулевым» электродом и электродом на левой руке, aVR - между «нулевым» электродом и электродом на правой руке, aVF - между «нулевым» электродом и электродом на левой ноге. Отведения называются усиленными, поскольку их приходится усиливать ввиду небольшой (по сравнению со стандартными отведениями) разницы потенциалов электрического поля между вершиной треугольника Эйнтховена и «нулевой» точкой.
• Грудные отведения - точки поверхности тела, расположенные непосредственно над сердцем на передней и боковой поверхности грудной клетки (рис. 23-7, В). Устанавливаемые на эти точки электроды называются грудными, равно как и отведения, формирующиеся при определении разницы: потенциалов электрического поля сердца между точкой установления грудного электрода и «нулевым» электродом, - грудные отведения V1-V6.
Электрокардиограмма
Нормальная электрокардиограмма (рис. 23-8, Б) состоит из основной линии (изолиния) и отклонений от неё, называемых зубцами и обозначаемых латинскими буквами Р, Q, R, S, Т, U. Отрезки ЭКГ между соседними зубцами - сегменты. Расстояния между различными зубцами - интервалы.
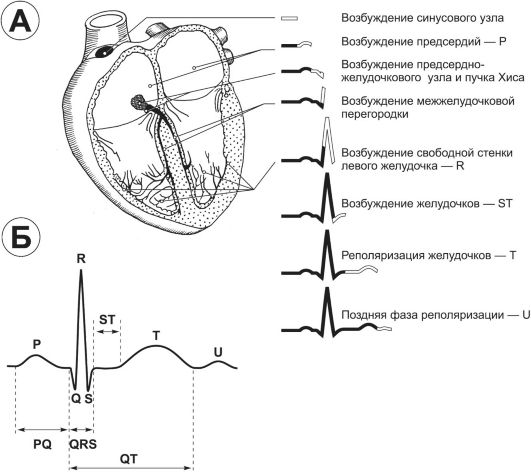
Рис. 23-8. Зубцы и интервалы. А - формирование зубцов ЭКГ при последовательном возбуждении миокарда; Б - зубцы нормального комплекса PQRST. Объяснения в тексте.
Основные зубцы, интервалы и сегменты ЭКГ представлены на рис. 23-8, Б.
Зубец P соответствует охвату возбуждением (деполяризацией) предсердий. Длительность зубца Р равна времени прохождения возбуждения от синусно-предсердного узла до АВ-соединения и в норме у взрослых не превышает 0,1 с. Амплитуда Р - 0,5-2,5 мм, максимальна в отведении II.
Интервал P-Q(R) определяют от начала зубца Р до начала зубца Q (или R, если Q отсутствует). Интервал равен времени прохождения возбуждения от синусно-предсердного
узла до желудочков. В норме у взрослых продолжительность интервала P-Q(R) составляет 0,12-0,20 с при нормальной ЧСС. При тахиили брадикардии P-Q(R) меняется, его нормальные величины определяют по специальным таблицам.
Комплекс QRS равен времени деполяризации желудочков. Состоит из зубцов Q, R и S. Зубец Q - первое отклонение от изолинии книзу, зубец R - первое после зубца Q отклонение от изолинии кверху. Зубец S - отклонение от изолинии книзу, следующее за зубцом R. Интервал QRS измеряют от начала зубца Q (или R, если Q отсутствует) до окончания зубца S. В норме у взрослых продолжительность QRS не превышает 0,1 с.
Сегмент ST - расстояние между точкой окончания комплекса QRS и началом зубца Т. Равен времени, в течение которого желудочки остаются в состоянии возбуждения. Для клинических целей важно положение ST по отношению к изолинии.
Зубец Т соответствует реполяризации желудочков. Аномалии Т неспецифичны. Они могут встречаться у здоровых лиц (астеников, спортсменов) при гипервентиляции, трево- ге, приёме холодной воды, лихорадке, подъёме на большую высоту над уровнем моря, а также при органических поражениях миокарда.
Зубец U - небольшое отклонение кверху от изолинии, регистрируемое у части людей вслед за зубцом Т, наиболее выраженное в отведениях V2 и V3. Природа зубца точно не известна. В норме максимальная его амплитуда не превышает
Интервал Q-T представляет электрическую систолу желудочков. Равен времени деполяризации желудочков, варьирует в зависимости от возраста, пола и ЧСС. Измеряется от начала комплекса QRS до окончания зубца Т. В норме у взрослых продолжительность Q-T колеблется от 0,35 до 0,44 с, однако его продолжительность очень сильно зависит
от ЧСС.
Нормальный ритм сердца. Каждое сокращение возникает в синусно-предсердном узле (синусовый ритм). В покое частота уда-
ров сердца колеблется в пределах 60-90 в минуту. ЧСС уменьшается (брадикардия) во время сна и увеличивается (тахикардия) под влиянием эмоций, физической работы, лихорадки и многих других факторов. В молодом возрасте частота ударов сердца возрастает во время вдоха и уменьшается во время выдоха, особенно при глубоком дыхании, - синусовая дыхательная аритмия (вариант нормы). Синусовая дыхательная аритмия - феномен, возникающий вследствие колебаний тонуса блуждающего нерва. Во время вдоха импульсы от рецепторов растяжения лёгких угнетают тормозящие влияния на сердце сосудодвигательного центра в продолговатом мозге. Количество тонических разрядов блуждающего нерва, постоянно сдерживающих ритм сердца, уменьшается, и ЧСС возрастает.
Электрическая ось сердца
Наибольшую
электрическую активность миокарда желудочков обнаруживают в период их
возбуждения. При этом равнодействующая возникающих электрических сил
(вектор) занимает опреде- лённое положение во фронтальной плоскости
тела, образуя угол α (его выражают в градусах) относительно
горизонтальной нулевой линии (I стандартное отведение). Положение этой
так называемой электрической оси сердца (ЭОС) оценивают по величине
зубцов комплекса QRS в стандартных отведениях (рис. 23-
Приблизительная оценка положения электрической оси сердца. Чтобы запоминить отличия правограммы от левограммы, студен-
ты применяют остроумный школярский приём, состоящий в следующем. При рассматривании своих ладоней загибают большой и указательный пальцы, а оставшиеся средний, безымянный и мизинец отождествляют с высотой зубца R. «Читают» слева направо, как обычную строку. Левая рука - левограмма: зубец R максимален в I стандартном отведении (первый самый высокий палец - средний), во II отведении уменьшается (безымянный палец), а в III отведении минимален (мизинец). Правая рука - правограмма, где ситуация обратная: зубец R нарастает от I отведения к III (равно как и высота пальцев: мизинец, безымянный, средний).
Причины отклонения электрической оси сердца. Положение электрической оси сердца зависит от внесердечных факторов.
У людей с высоким стоянием диафрагмы и/или гиперстенической конституцией ЭОС принимает горизонтальное положение или даже возникает левограмма.
У высоких худых людей с низким стоянием диафрагмы ЭОС в норме расположена более вертикально, иногда вплоть до правограммы.
НАСОСНАЯ ФУНКЦИЯ СЕРДЦА
Сердечный цикл
Сердечный цикл - это последовательность механических сокращений отделов сердца в течение одного сокращения. Сердечный цикл длится от начала одного сокращения до начала следующего и начинается в синусно-предсердном узле с генерации ПД. Электрический импульс обусловливает возбуждение миокарда и его сокращение: возбуждение последовательно охватывает оба предсердия и вызывает систолу предсердий. Далее возбуждение через АВ-соединение (после АВ-задержки) распространяется на желудочки, вызывая систолу последних, повышение в них давления и изгнание крови в аорту и лёгочную артерию. После выброса крови миокард желудочков расслабляется, давление в их полостях па- дает, и сердце подготавливается к следующему сокращению. Последовательные фазы сердечного цикла представлены на рис. 23-9, а суммарная характеристика различных событий цикла - на рис. 23-10 (фазы сердечного цикла обозначены буквами латиницы от A до G).
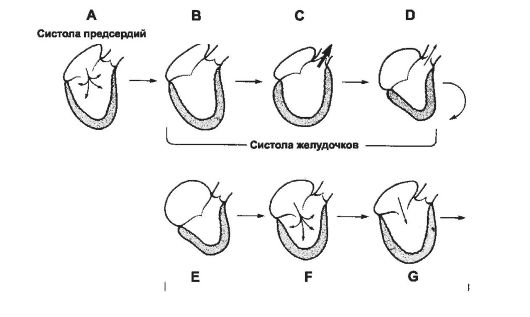
Рис. 23-9. Сердечный цикл. Схема. A - систола предсердий; B - изоволемическое сокращение; C - быстрое изгнание; D - медленное изгнание; E - изоволемическое расслабление; F - быстрое наполнение; G - медленное наполнение.
Систола предсердий (А, длительность 0,1 с). Пейсмейкерные клетки синусного узла деполяризуются, и возбуждение распространяется по миокарду предсердий. На ЭКГ регистрируется зубец P (см. рис. 23-10, нижняя часть рисунка). Сокращение предсердия повышает давление и вызывает дополнительное (помимо самотёч- ного) поступление крови в желудочек, немного повышая конечное диастолическое давление в желудочке. Митральный клапан открыт, аортальный - закрыт. В норме 75% крови из вен поступает через предсердия непосредственно в желудочки самотёком, до сокращения предсердий. Сокращение предсердий добавляет 25% объёма крови при наполнении желудочков.
Систола желудочка (B-D, длительность 0,33 с). Волна возбуждения проходит через АВ-соединение, пучок Хиса, волокна Пуркинье и достигает клеток миокарда. Деполяризация желудочка выражается комплексом QRS на ЭКГ. Начало сокращения желудочков сопровождается повышением внутрижелудочкового давления, закрытием предсердно-желудочковых клапанов и возникновением I тона сердца.
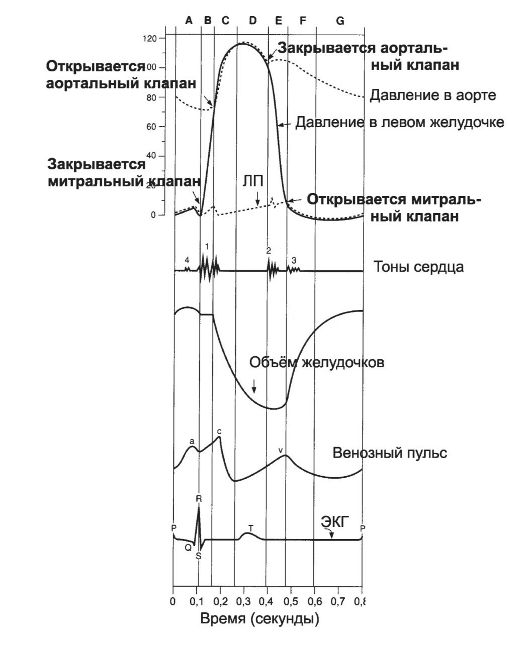
Рис. 23-10. Суммарная характеристика цикла сердца [5]. A - систола предсердий; B - изоволемическое сокращение; C - быстрое изгнание; D - медленное изгнание; E - изоволемическое расслабление; F - быстрое наполнение; G - медленное наполнение.
Период изоволемического (изометрического) сокращения (B).
Немедленно после начала сокращения желудочка давление в нём резко повышается, но изменений внутрижелудочкового объёма не возникает, так как все клапаны прочно закрыты, а кровь, как и любая жидкость, несжимаема. Необходимо 0,02-0,03 с, чтобы в желудочке развилось давление на полулунные клапаны аорты и лёгочной артерии, достаточное, чтобы преодолеть их сопротивление и открытие. Следовательно, во время этого периода желудочки сокращаются, но изгнания крови не происходит. Термин «изоволемический (изометрический) период» означает, что имеется напряжение мышцы, но укорочения мышечных волокон нет. С этим периодом совпадает минимальное системное
давление, называемое для большого круга кровообращения диастолическим АД. Φ Период изгнания (C, D). Как только давление в левом желудочке становится выше
Φ Конец систолы совпадает с возникновением II тона сердца. Сократительная сила мышцы уменьшается очень быстро. Возникает обратный ток крови в направлении полулунных клапанов, закрывающий их. Быстрое падение давления в полости желудочков и закрытие клапанов способствует вибрации их напряжённых створок, создающих II тон сердца.
Диастола желудочков (E-G) имеет длительность 0,47 с. В этот период на ЭКГ регистрируется изоэлектрическая линия вплоть до начала следующего комплекса PQRST.
Φ Период изоволемического (изометрического) расслабления (E). В этот период все клапаны закрыты, объём желудочков не изменён. Давление падает почти так же быстро, как оно увеличивалось во время периода изоволемического сокращения. Поскольку кровь продолжает поступать в предсердия из венозной системы, а давление в желудочках приближается к диастолическому уровню, давление в предсердиях достигает своего максимума. Φ Период наполнения (F, G). Период быстрого наполнения (F) - время, в течение которого желудочки быстро за- полняются кровью. Давление в желудочках меньше, чем в предсердиях, предсердно-желудочковые клапаны открыты, кровь из предсердий поступает в желудочки, и объём желудочков начинает увеличиваться. По мере наполнения желудочков податливость миокарда их стенок снижается и
скорость наполнения уменьшается (период медленного наполнения, G).
Объёмы
Во время диастолы объём каждого желудочка возрастает в среднем до 110-120 мл. Этот объём известен как конечно-диастолический. После систолы желудочков объём крови уменьшается примерно на 70 мл - так называемый ударный объём сердца. Остающийся после завершения систолы желудочков конечно-систолический объём составляет 40-50 мл.
Φ Если сердце сокращается сильнее, чем обычно, то конечносистолический объём уменьшается на 10-20 мл. При по- ступлении в сердце большого количества крови во время диастолы конечно-диастолический объём желудочков может возрасти и до 150-180 мл. Суммарное возрастание конечно-диастолического объёма и уменьшение конечно- систолического объёма могут увеличить ударный объём сердца вдвое по сравнению с нормой.
Диастолическое и систолическое давление
Механика работы левого желудочка определяется диастолическим и систолическим давлением в его полости.
• Диастолическое давление (давление в полости левого желудочка во время диастолы) создаётся прогрессивно увеличивающимся количеством крови; давление непосредственно перед систолой называют конечно-диастолическим. До тех пор пока объём крови в несокращающемся желудочке не станет выше 120 мл, диастолическое давление практически не изменяется, и при этом объёме кровь свободно поступает в желудочек из предсердия. После 120 мл диастолическое давление в желудочке нарастает быстро отчасти оттого, что фиброзная ткань стенки сердца и перикард (а также частично миокард) исчерпали возможности своей растяжимости.
• Систолическое давление. Во время сокращения желудочка систолическое давление увеличивается даже в условиях небольшого объёма, но достигает максимума при объёме желудочка в 150-170 мл. Если же объём увеличивается ещё значительнее, то систолическое давление падает, поскольку актиновые и миозиновые филаменты мышечных волокон миокарда растягиваются слишком сильно. Максимальное систолическое
давление для нормального левого желудочка составляет 250-
Преднагрузка и постнагрузка
• Преднагрузка для сокращающегося сердца - величина конечно-диастолического давления, создаваемая наполнением желудочка.
• Постнагрузка работающего сердца - давление в артерии, выходящей из желудочка.
Φ В нормальных условиях увеличение преднагрузки вызывает повышение сердечного выброса по закону Франка- Старлинга (сила сокращения кардиомиоцита пропорциональна величине его растяжения). Повышение постнагрузки вначале снижает ударный объём и сердечный выброс, но затем кровь, остающаяся в желудочках после ослабленных сокращений сердца, накапливается, растягивает миокард и, также по закону Франка-Старлинга, увеличивает ударный объём и сердечный выброс.
Работа, производимая сердцем
• Ударный объём - количество крови, изгоняемой сердцем при каждом сокращении. Ударная производительность сердца - количество энергии каждого сокращения, превращаемое сердцем в работу по продвижению крови в артерии. Значение ударной производительности (УП) рассчитывают, умножая ударный объём (УО) на АД.
УП = УО χ АД.
Φ Чем выше АД или УО, тем больше работа, выполняемая сердцем. Ударная производительность зависит также от предна- грузки. Увеличение преднагрузки (конечно-диастолического объёма) повышает ударную производительность.
• Сердечный выброс (СВ; минутный объём) равен произведению ударного объёма на частоту сокращений (ЧСС) в минуту.
СВ = УО χ ЧСС.
• Минутная производительность сердца (МПС) - общее количество энергии, превращаемой в работу в течение одной мину-
ты. Она равна ударной производительности, умноженной на количество сокращений в минуту.
МПС = УП χ ЧСС.
Контроль насосной функции сердца
В состоянии покоя сердце нагнетает от 4 до
Гетерометрическая саморегуляция (механизм ФранкаСтарлинга)
• Количество крови, которую перекачивает сердце каждую минуту, практически полностью зависит от поступления крови в сердце из вен, обозначаемого термином «венозный возврат». Присущую сердцу внутреннюю способность приспосабливаться к изменяющимся объёмам притекающей крови называют механизмом (законом) Франка-Старлинга: чем больше мышца сердца растянута поступающей кровью, тем больше сила сокращения и тем больше крови поступает в артериальную систему. Таким образом, наличие в сердце саморегуляторного механизма, определяемого изменениями длины мышечных волокон миокарда, позволяет говорить о гетерометрической саморегуляции сердца.
• В эксперименте влияние изменяющейся величины венозного возврата на нагнетательную функцию желудочков демонстрируется на так называемом сердечно-лёгочном препарате (рис. 23-11, А).
• Молекулярный механизм эффекта Франка-Старлинга заключается в том, что растяжение миокардиальных волокон созда- ёт оптимальные условия взаимодействия филаментов миозина и актина, что позволяет генерировать сокращения большей силы.
• Факторы, регулирующие конечно-диастолический объём в физиологических условиях.

Рис. 23-11. Механизм Франка-Старлинга [5]. А - схема эксперимента (препарат «сердце-лёгкие»). 1 - контроль сопротивления, 2 - компрессионная камера, 3 - резервуар, 4 - объём желудочков; Б - инотропный эффект.
Φ Растяжение кардиомиоцитов увеличивается вследствие повышения: Φ силы сокращений предсердий; Φ общего объёма крови;
Φ венозного тонуса (также повышает венозный возврат к сердцу);
Φ насосной функции скелетных мышц (для передвижения крови по венам - в итоге увеличивается венозный возврат; насосная функция скелетных мышц всегда увеличивается во время мышечной работы);
Φ отрицательного внутригрудного давления (также увеличивается венозный возврат).
Φ Растяжение кардиомиоцитов уменьшается вследствие:
Φ вертикального положения тела (вследствие уменьшения венозного возврата);
Φ увеличения внутриперикардиального давления;
Φ уменьшившейся податливости стенок желудочков.
Влияние симпатического и блуждающего нервов на насосную функцию сердца
Эффективность насосной функции сердца контролируется импульсами симпатического и блуждающего нервов.
• Симпатические нервы. Возбуждение симпатической нервной системы может повысить ЧСС с 70 в минуту до 200 и даже до 250. Симпатическая стимуляция увеличивает силу сокращений сердца, повышая тем самым объём и давление выкачиваемой крови. Симпатическая стимуляция может повысить производительность сердца в 2-3 раза дополнительно к росту минутного объёма, вызванного эффектом Франка-Старлинга (рис. 23-11, Б). Торможение симпатической нервной системы можно использовать, чтобы снизить насосную функцию сердца. В норме симпатические нервы сердца постоянно тонически разряжаются, поддерживая более высокий (на 30% выше) уровень производительности сердца. Поэтому если симпатическая активность сердца будет подавлена, то, соответственно, уменьшится частота и сила сокращений сердца, вследствие чего уровень насосной функции снизится не менее чем на 30% по сравнению с нормой.
• Блуждающий нерв. Сильное возбуждение блуждающего нерва может на несколько секунд полностью остановить сердце, однако затем сердце обычно «ускользает» из-под влияния блуждающего нерва и продолжает сокращаться медленнее - на 40% реже, чем в норме. Стимуляция блуждающего нерва может уменьшить силу сокращений сердца на 20-30%. Волокна блуждающего нерва распределяются главным образом в предсердиях, и их мало в желудочках, работа которых определяет силу сокращений сердца. Этим объясняется тот факт, что возбуждение блуждающего нерва больше влияет на уменьшении ЧСС, чем на уменьшение силы сокращений сердца. Однако заметное уменьшение ЧСС вместе с некоторым ослаблением силы сокращений может снижать до 50% и более производительность сердца, особенно когда оно работает с большой нагрузкой.
СИСТЕМНОЕ КРОВООБРАЩЕНИЕ
Кровеносные сосуды - замкнутая система, в которой кровь непрерывно циркулирует от сердца к тканям и обратно к сердцу.
Системный кровоток, или большой круг кровообращения, включает все сосуды, получающие кровь от левого желудочка и заканчивающиеся в правом предсердии. Сосуды, расположенные между правым желудочком и левым предсердием, составляют лёгочный кровоток, или малый круг кровообращения.
Структурно-функциональная классификация
В зависимости от строения стенки кровеносного сосуда в сосудистой системе различают артерии, артериолы, капилляры, венулы и вены, межсосудистые анастомозы, микроциркуляторное русло и гематические барьеры (например, гематоэнцефалический). Функционально сосуды подразделяются на амортизирующие (артерии), резистивные (концевые артерии и артериолы), прекапиллярные сфинктеры (концевой отдел прекатиллярньгх артериол), обменные (капилляры и венулы), ёмкостные (вены), шунтирующие (артериовенозные анастомозы).
Физиологические параметры кровотока
Ниже приведены основные физиологические параметры, необходимые для характеристики кровотока.
• Систолическое давление - максимальное давление, достигаемое в артериальной системе во время систолы. В норме систолическое давление равно в среднем
• Диастолическое давление - минимальное давление, возникающее во время диастолы, составляет в среднем
• Пульсовое давление. Разность между систолическим и диастолическим давлением называют пульсовым давлением.
• Среднее артериальное давление (САД) ориентировочно оценивают по формуле:
• САД = Систолическое АД + 2 (диастолическое АД) : 3.
Φ
Среднее АД в аорте (90-100 мм рт.ст.) по мере разветвления артерий
постепенно снижается. В концевых артериях и ар- териолах давление резко
падает (в среднем до
• Площадь поперечного сечения. Диаметр аорты взрослого человека составляет
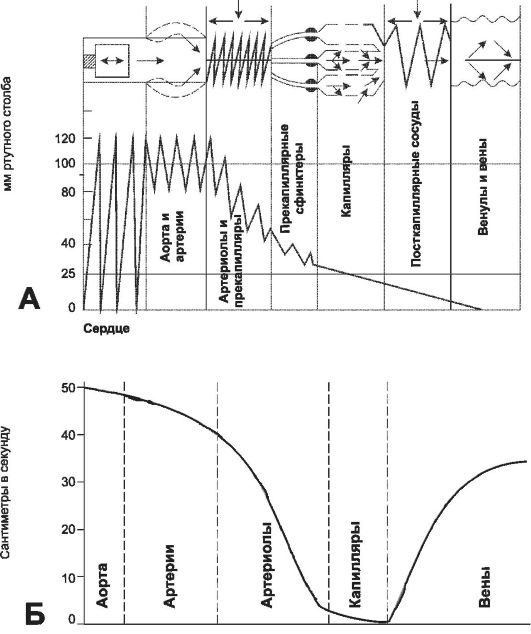
Рис. 23-12. Значения АД (А) и линейной скорости кровотока (Б) в различных сегментах сосудистой системы [21].
возрастает. На уровне артериол площадь поперечного сечения составляет около 800 см2, а на уровне капилляров и вен - 3500 см2. Площадь поверхности сосудов значительно умень- шается, когда венозные сосуды соединяются, образуя полую вену с площадью поперечного сечения в 7 см2.
• Линейная скорость тока крови обратно пропорциональна площади поперечного сечения сосудистого русла. Поэтому средняя скорость движения крови (рис. 23-12, Б) выше в аорте (30 см/с), постепенно снижается в мелких артериях и минимальна в капиллярах (0,026 см/с), общее поперечное сечение которых в 1000 раз больше, чем в аорте. Средняя скорость кровотока снова увеличивается в венах и становится относительно высокой в полой вене (14 см/с), но не столь высокой, как в аорте.
• Объёмная скорость кровотока (обычно выражают в миллилитрах в минуту или литрах в минуту). Общий кровоток у взрослого человека в состоянии покоя - около 5000 мл/мин. Именно это количество крови выкачивается сердцем каждую минуту, поэтому его называют также сердечным выбросом.
• Скорость кровообращения (скорость кругооборота крови) можно измерить на практике: от момента, когда препарат солей жёлчных кислот вводят в локтевую вену, до того как появится ощущение горечи на языке (рис. 23-13, А). В норме скорость кровообращения составляет 15 с.
• Сосудистая ёмкость. Размеры сосудистых сегментов определяют их сосудистую ёмкость. Артерии содержат около 10% общего количества циркулирующей крови (ОЦК), капилляры - около 5%, венулы и небольшие вены - примерно 54% и большие вены - 21%. Камеры сердца вмещают остающиеся 10%. Венулы и небольшие вены обладают большой ёмкостью, что делает их эффективным резервуаром, способным накапливать большие объёмы крови.
Методы измерения кровотока
• Электромагнитная флоуметрия основана на принципе генерации напряжения в проводнике, движущемся через магнитное поле, и пропорциональности величины напряжения скорости движения. Кровь является проводником, магнит располагается вокруг сосуда, а напряжение, пропорциональное объёму кровотока, измеряется электродами, расположенными на поверхности сосуда.
• Допплерометрия использует принцип прохождения ультразвуковых волн через сосуд и отражения волн от эритроцитов и лейкоцитов. Частота отражённых волн меняется - возрастает пропорционально скорости тока крови.
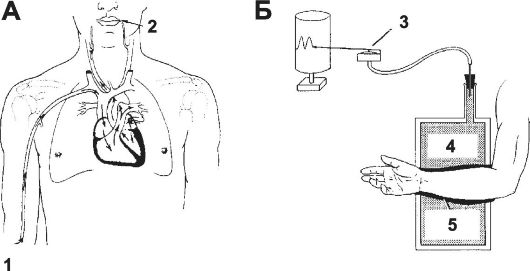
Рис. 23-13. Определение времени кровотока (А) и плетизмография (Б). 1 -
место инъекции маркёра, 2 - конечная точка (язык), 3 - регистратор объёма, 4 - вода, 5 - резиновый рукав.
• Измерение сердечного выброса осуществляют прямым методом Фика и методом индикаторного разведения. Метод Фика основан на косвенном подсчёте минутного объёма кровообращения по артериовенозной разнице O2 и определении объёма кислорода, потребляемого человеком в минуту. В методе индикаторного разведения (радиоизотопный метод, метод термодилюции) применяют введение индикаторов в венозную систему и затем - взятие проб из артериальной системы.
• Плетизмография. Информацию о кровотоке в конечностях получают с помощью плетизмографии (рис. 23-13, Б).
Φ Предплечье помещают в заполненную водой камеру, соеди- нённую с прибором, который записывает колебания объёма жидкости. Изменения объёма конечности, отражающие изменения в количестве крови и интерстициальной жидкости, смещают уровень жидкости и регистрируют плетиз- мографом. Если венозный отток конечности выключается, то колебания объёма конечности являются функцией артериального кровотока конечности (окклюзионная венозная плетизмография).
Физика движения жидкости в кровеносных сосудах
Принципы и уравнения, используемые, чтобы описать движения идеальных жидкостей в трубках, часто применяют, объясняя
поведение крови в кровеносных сосудах. Однако кровеносные сосуды - не жёсткие трубки, а кровь - не идеальная жидкость, а двухфазная система (плазма и клетки), поэтому характеристики кровообращения отклоняются (иногда весьма заметно) от теоретически рассчитанных.
• Ламинарный поток. Движение крови в кровеносных сосудах можно представить как ламинарное (т.е. обтекаемое, с параллельным течением слоёв). Слой, прилежащий к сосудистой стенке, практически неподвижен. Следующий слой движется с небольшой скоростью, в слоях ближе к центру сосуда скорость движения нарастает, а в центре потока она максимальна. Ламинарное движение сохраняется, пока не достигнет некоторой критической скорости. Выше критической скорости ламинарный поток становится турбулентным (вихревым). Ламинарное движение бесшумно, турбулентное движение порождает звуки, при должной интенсивности слышимые стетофонендоскопом.
• Турбулентный поток. Возникновение турбулентности зависит от скорости потока, диаметра сосуда и вязкости крови. Сужение артерии увеличивает скорость кровотока через место сужения, создаёт турбулентность и звуки ниже места сужения. Примеры шумов, воспринимаемых над стенкой артерии, - шумы над участком сужения артерии, вызванным атеросклеротической бляшкой, и тоны Короткова при измерении АД. При анемии наблюдают турбулентность в восходящей аорте, вызванную снижением вязкости крови, отсюда и систолический шум.
• Формула Пуазейля. Соотношение между током жидкости в длинной узкой трубке, вязкостью жидкости, радиусом трубки и сопротивлением определяется по формуле Пуазейля:
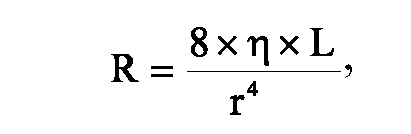
где R - сопротивление трубки, η - вязкость протекающей жидкости, L - длина трубки, r - радиус трубки. Φ Поскольку сопротивление обратно пропорционально чет- вёртой степени радиуса, в организме кровоток и сопротив- ление существенно меняются в зависимости от небольших изменений калибра сосудов. Например, кровоток через со-
суды удваивается, если их радиус увеличивается только на 19%. Когда радиус увеличивается в 2 раза, сопротивление уменьшается на 6% от исходного уровня. Эти выкладки позволяют понять, почему органный кровоток столь эффективно регулируется минимальными изменениями просвета артериол и почему вариации диаметра артериол оказывают такое сильное воздействие на системное АД.
• Вязкость и сопротивление. Сопротивление кровотоку определяется не только радиусом кровеносных сосудов (сопротивление сосудов), но и вязкостью крови. Вязкость плазмы примерно в 1,8 раза больше, чем воды. Вязкость цельной крови в 3-4 раза превышает вязкость воды. Следовательно, вязкость крови в значительной степени зависит от гематокрита, т.е. от процентного содержания эритроцитов в крови. В крупных сосудах увеличение гематокрита вызывает ожидаемое повышение вязкости. Однако в сосудах диаметром менее 100 мкм, т.е. в артериолах, капиллярах и венулах, изменения вязкости на единицу изменений гематокрита намного меньше, чем в больших сосудах.
Φ Изменения гематокрита сказываются на периферическом сопротивлении, главным образом, крупных сосудов. Тя- жёлая полицитемия (увеличение количества эритроцитов разной степени зрелости) повышает периферическое сопротивление, увеличивая работу сердца. При анемии периферическое сопротивление понижено, отчасти за счёт уменьшения вязкости.
Φ В сосудах эритроциты стремятся расположиться в центре текущего потока крови. Следовательно, вдоль стенок сосу- дов движется кровь с низким гематокритом. Ответвления, отходящие от крупных сосудов под прямыми углами, могут получать непропорционально меньшее количество эритроцитов. Этим феноменом, называемым скольжением плазмы, можно объяснить, почему гематокрит капиллярной крови постоянно на 25% ниже, чем в остальных частях тела.
• Критическое давление закрытия просвета сосудов. В жёстких трубках соотношение между давлением и потоком гомогенной жидкости линейное, в сосудах такой зависимости нет. Если давление в мелких сосудах уменьшается, то кровоток останавливается раньше, чем давление падает до нуля. Это
касается прежде всего давления, продвигающего эритроциты через капилляры, диаметр которых меньше, чем размеры эритроцитов. Ткани, окружающие сосуды, оказывают на них постоянное небольшое давление. Если внутрисосудистое давление становится ниже тканевого, сосуды спадаются. Давление, при котором кровоток прекращается, называют критическим давлением закрытия.
• Растяжимость и податливость сосудов. Все
сосуды растяжимы. Это свойство играет важную роль в кровообращении.
Так, растяжимость артерий способствует формированию непрерывного тока
крови (перфузии) через систему мелких сосудов в тканях. Из всех сосудов
наиболее податливы тонкостенные вены. Небольшое повышение венозного
давления вызывает депонирование значительного количества крови,
обеспечивая ёмкостную (аккумулирующую) функцию венозной системы.
Растяжимость сосудов определяют как увеличение объёма в ответ на
повышение давления, выраженное в миллиметрах ртутного столба. Если
давление в
КРОВОТОК В АРТЕРИЯХ И АРТЕРИОЛАХ
Пульс
Пульс - ритмические колебания стенки артерий, вызываемые повышением давления в артериальной системе в момент систолы. Во время каждой систолы левого желудочка в аорту поступает новая порция крови. Это вызывает растяжение проксимального участка стенки аорты, так как инерция крови препятствует немедленному движению крови по направлению к периферии. Повы- шение давления в аорте быстро преодолевает инерцию кровяного столба, и фронт волны давления, растягивающий стенку аорты, распространяется всё дальше и дальше по артериям. Этот процесс и является пульсовой волной - распространением пульсового давления по артериям. Податливость стенки артерий сглаживает пульсовые колебания, постоянно уменьшая их амплитуду по направлению к капиллярам (рис. 23-14, Б).
• Сфигмограмма (рис. 23-14, А). На кривой пульса (сфигмограмме) аорты различают подъём (анакрота), который возникает
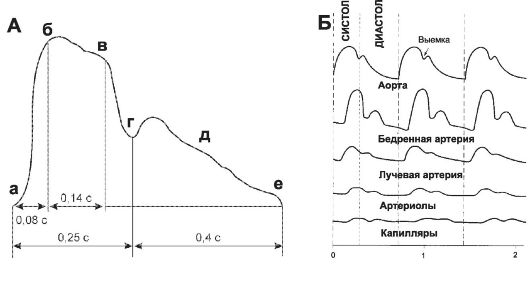
Рис. 23-14. Артериальный пульс. A - сфигмограмма. аб - анакрота, вг - систолическое плато, де - катакрота, г - вырезка (выемка) [21]; Б - движение пульсовой волны в направлении мелких сосудов. Происходит затухание пульсового давления.
под действием крови, выброшенной из левого желудочка в момент систолы, и спад (катакрота), происходящий в момент диастолы. Выемка на катакроте возникает за счёт обратного движения крови к сердцу в момент, когда давление в желудочке становится ниже давления в аорте и кровь по градиенту давления устремляется обратно в направлении желудочка. Под влиянием обратного тока крови полулунные клапаны закрываются, волна крови отражается от клапанов и создаёт небольшую вторичную волну повышения давления (дикроти- ческий подъём).
• Скорость пульсовой волны: аорта - 4-6 м/с, мышечные артерии - 8-12 м/с, мелкие артерии и артериолы - 15-35 м/с.
• Пульсовое давление - разность между систолическим и диастолическим давлением - зависит от ударного объёма сердца и податливости артериальной системы. Чем больше ударный объём и чем больше крови поступает в артериальную систему во время каждого сокращения сердца, тем больше пульсовое давление. Чем меньше податливость артериальной стенки, тем больше пульсовое давление.
• Затухание пульсового давления. Прогрессирующее уменьшение пульсаций в периферических сосудах называют затуханием пульсового давления. Причины ослабления пульсового давления - сопротивление движению крови и податливость сосудов. Сопротивление ослабляет пульсацию за счёт того, что некоторое количество крови должно передвигаться впереди фронта пульсовой волны, чтобы растянуть очередной сегмент сосуда. Чем больше сопротивление, тем больше затруднений возникает. Податливость приводит к затуханию пульсовой волны, потому что в более податливых сосудах впереди фронта пульсовой волны должно пройти больше крови, чтобы вызвать увеличение давления. Таким образом, степень ослабления пульсовой волны прямо пропорциональна общему периферическому сопротивлению.
Измерение артериального давления
Прямой метод. В некоторых клинических ситуациях АД измеряют, вводя в артерию иглы с датчиками давления. Этот прямой способ определения показал, что АД постоянно колеблется в границах некоторого постоянного среднего уровня. На записях кривой АД наблюдают три вида колебаний (волн) - пульсовые (совпадают с сокращениями сердца), дыхательные (совпадают с дыхательными движениями) и непостоянные медленные (отражают колебания тонуса сосудодвигательного центра).
Непрямой метод. На практике систолическое и диастолическое АД измеряют непрямым способом, используя аускультативный метод Рива-Роччи с определением тонов Короткова (рис. 23-15).
• Систолическое АД. Полую резиновую камеру (находящуюся внутри манжеты, которую можно фиксировать вокруг нижней половины плеча), соединённую системой трубок с резиновой грушей и манометром, накладывают на плечо. Стетоскоп устанавливают над переднелоктевой артерией в локтевой ямке. Накачивание воздуха в манжету сдавливает плечо, а показания манометра регистрируют величину давления. Манжету, наложенную на плечо, раздувают, пока давление в ней не превысит уровень систолического, а затем медленно выпускают из неё воздух. Как только давление в манжете оказывается меньше систолического, кровь начинает пробиваться через артерию, сдавленную манжетой, - в момент пика систоли-
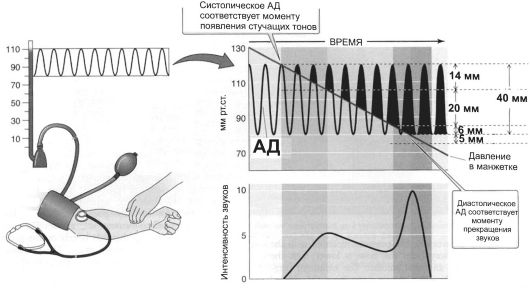
Рис. 23-15. Измерение артериального давления [2].
ческого АД в переднелоктевой артерии начинают прослушиваться стучащие тоны, синхронные с ударами сердца. В этот момент уровень давления манометра, связанного с манжеткой, показывает величину систолического АД.
• Диастолическое АД. По мере снижения давления в манжете характер тонов изменяется: они становятся менее стучащими, более ритмичными и приглушёнными. Наконец, когда давление в манжетке достигает уровня диастолического АД и артерия более не сдавлена во время диастолы, тоны исчезают. Момент полного их исчезновения свидетельствует, что давление в манжете соответствует диастолическому АД.
• Тоны Короткова. Возникновение тонов Короткова обусловлено движением струи крови через частично сдавленный участок артерии. Струя вызывает турбулентность в сосуде, расположенном ниже манжетки, что вызывает вибрирующие звуки, слышимые через стетофонендоскоп.
• Погрешность. При аускультативном методе определения систолического и диастолического АД возможны расхождения от значений, полученных при прямом измерении давления (до 10%). Автоматические электронные тонометры, как правило, занижают значения и систолического, и диастолическо-
го АД на 10%.
• Факторы, влияющие на величины АД
Φ Возраст. У здоровых людей величина систолического АД возрастает со
Φ Пол. У женщин систолическое и диастолическое АД ниже между 40 и 50 годами, но выше в возрасте 50 лет и старше.
Φ Масса тела. Систолическое и диастолическое АД непосредственно коррелирует с массой тела человека: чем больше масса тела, тем выше АД.
Φ Положение тела. Когда человек встаёт, сила тяжести изменяет венозный возврат, уменьшая сердечный выброс и АД. Компенсаторно увеличивается ЧСС, вызывая повышение систолического и диастолического АД и общего периферического сопротивления.
Φ Мышечная деятельность. АД повышается во время работы. Систолическое АД увеличивается за счёт того, что усиливаются сокращения сердца. Диастолическое АД вначале понижается за счёт расширения сосудов работающих мышц, а затем интенсивная работа сердца приводит к повышению диастолического АД.
ВЕНОЗНОЕ КРОВООБРАЩЕНИЕ
Движение крови по венам осуществляется в результате насосной функции сердца. Венозный кровоток усиливается также во время каждого вдоха за счёт отрицательного внутриплеврального давления (присасывающее действие) и за счёт сокращений сдавливающих вены скелетных мышц конечностей (в первую очередь ног).
Венозное давление
Центральное венозное давление - давление в крупных венах в месте их впадения в правое предсердие - в среднем составляет около
способностью сердца откачивать кровь из правого предсердия и правого желудочка в лёгкие и возможностью крови поступать из периферических вен в правое предсердие (венозный возврат). Если сердце работает интенсивно, то давление в правом желудочке снижается. Напротив, ослабление работы сердца повышает давление в правом предсердии. Любые воздействия, ускоряющие приток крови в правое предсердие из периферических вен, повышают давление в правом предсердии.
Периферическое венозное давление. Давление в венулах равно 12-18 мм рт.ст. Оно уменьшается в крупных венах примерно до
• Влияние внутрибрюшного давления. В брюшной полости в положении лёжа давление составляет
• Гравитация и венозное давление. На поверхности тела давление жидкой среды равно атмосферному. Давление в организме растёт по мере продвижения вглубь от поверхности тела. Это давление - результат воздействия силы тяжести воды, поэтому оно называется гравитационным (гидростатическим) давлением. Влияние гравитации на сосудистую систему обусловлено массой крови в сосудах (рис. 23-16, А).
• Мышечный насос и клапаны вен. Вены нижних конечностей окружены скелетными мышцами, сокращения которых сдавливают вены. Пульсация соседних артерий также оказывает сдавливающее влияние на вены. Поскольку венозные клапаны препятствуют обратному движению, кровь движется к сердцу. Как показано на рис. 23-16, Б, клапаны вен ориентированы на продвижение крови в направлении сердца.
• Присасывающее действие сокращений сердца. Изменения давления в правом предсердии передаются большим венам. Давление в правом предсердии резко падает во время фазы изгнания систолы желудочков, потому что предсердножелудочковые клапаны втягиваются в полость желудочков,
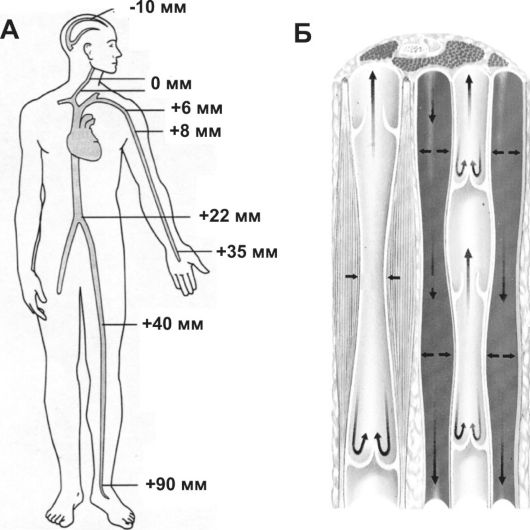
Рис. 23-16. Венозный кровоток. А - действие гравитации на венозное давление в вертикальном положении; Б - венозный (мышечный) насос и роль венозных клапанов.
увеличивая ёмкость предсердия. Происходит всасывание крови в предсердие из крупных вен, и поблизости от сердца ве- нозный кровоток становится пульсирующим.
Депонирующая функция вен
Более 60% объёма циркулирующей крови находится в венах в силу их высокой податливости. При большой кровопотере и паде- нии АД возникают рефлексы с рецепторов каротидных синусов и других рецепторных сосудистых областей, активирующие симпатические нервы вен и вызывающие их сужение. Это приводит к восстановлению многих реакций системы кровообращения, нарушенных кровопотерей. Действительно, даже после потери 20% общего объёма крови система кровообращения восстанавливает свои
нормальные функции за счёт высвобождения резервных объёмов крови из вен. В целом к специализированным участкам крово- обращения (так называемые депо крови) относят:
• печень, синусы которой могут высвобождать для кровообращения несколько сотен миллилитров крови;
• селезёнку, способную высвобождать для кровообращения до 1000 мл крови;
• крупные вены брюшной полости, накапливающие более 300 мл крови;
• подкожные венозные сплетения, способные депонировать несколько сотен миллилитров крови.
ТРАНСПОРТ КИСЛОРОДА И УГЛЕКИСЛОТЫ
Транспорт газов крови рассматривается в главе 24.
МИКРОЦИРКУЛЯЦИЯ
Функционирование сердечно-сосудистой системы поддерживает гомеостатическую среду организма. Функции сердца и пе- риферических сосудов скоординированы для транспорта крови в капиллярную сеть, где осуществляется обмен между кровью и тканевой жидкостью. Перенос воды и веществ через стенку сосудов осуществляется посредством диффузии, пиноцитоза и фильтрации. Эти процессы происходят в комплексе сосудов, известном как микроциркуляторные единицы. Микроциркуляторная единица состоит из последовательно расположенных сосудов. Это концевые (терминальные) артериолы - метартериолы - прекапиллярные сфинктеры - капилляры - венулы. Кроме того, в состав микроциркуляторных единиц включают артериовенозные анастомозы.
Организация и функциональная характеристика
Функционально сосуды микроциркуляторного русла подразделяются на резистивные, обменные, шунтирующие и ёмкостные.
• Резистивные сосуды
Φ Резистивные прекапиллярные сосуды - мелкие артерии, терминальные артериолы, метартериолы и прекапиллярные сфинктеры. Прекапиллярные сфинктеры регулируют функции капилляров, отвечая за:
Φ количество открытых капилляров;
Φ распределение капиллярного кровотока; Φ скорость капиллярного кровотока; Φ эффективную поверхность капилляров; Φ среднее расстояние для диффузии.
Φ Резистивные посткапиллярные сосуды - мелкие вены и венулы, содержащие в своей стенке ГМК. Поэтому, несмотря на небольшие изменения в сопротивлении, они оказывают заметное воздействие на капиллярное давление. Соотношение прекапиллярного и посткапиллярного сопротивления определяет величину капиллярного гидростатического давления.
• Обменные сосуды. Эффективный обмен между кровью и внесосудистым окружением происходит через стенку капилляров и венул. Максимальная интенсивность обмена наблюдается на венозном конце обменных сосудов, потому что они более проницаемы для воды и растворов.
• Шунтирующие сосуды - артериовенозные анастомозы и магистральные капилляры. В коже шунтирующие сосуды участвуют в регуляции температуры тела.
• Ёмкостные сосуды - небольшие вены, обладающие высокой степенью податливости.
• Скорость кровотока. В артериолах скорость кровотока составляет 4-5 мм/с, в венах - 2-3 мм/с. Эритроциты продвигаются через капилляры поодиночке, меняя свою форму из-за узкого просвета сосудов. Скорость движения эритроцитов - около 1 мм/с.
• Прерывистый кровоток. Ток крови в отдельном капилляре зависит прежде всего от состояния прекапиллярных сфинктеров и метартериол, которые периодически сокращаются и расслабляются. Период сокращения или расслабления может занимать от 30 с до нескольких минут. Такие фазные сокращения - результат ответной реакции ГМК сосудов на локальные химические, миогенные и нейрогенные влияния. Наиболее важный фактор, ответственный за степень открытия или закрытия метартериол и капилляров, - концентрация кислорода в тканях. Если содержание кислорода в ткани уменьшается, частота прерывистых периодов кровотока возрастает.
• Скорость и характер транскапиллярного обмена зависят от природы транспортируемых молекул (полярные или неполярные
вещества, см. гл. 2), наличия в капиллярной стенке пор и эндотелиальных фенестр, базальной мембраны эндотелия, а также от возможности пиноцитоза через стенку капилляра.
• Транскапиллярное движение жидкости определяется соотношением, которое впервые описал Старлинг, между капиллярной и интерстициальной гидростатической и онкотической силами, действующими через капиллярную стенку. Это движение можно описать следующей формулой:
V=Kfx[(P1-P2)-(Pз-P4)], где V - объём жидкости, проходящей через стенку капилляра за 1 мин; Kf - коэффициент фильтрации; P1 - гидростатическое давление в капилляре; P2 - гидростатическое давление в интерстициальной жидкости; P3 - онкотическое давление в плазме; P4 - онкотическое давление в интерстициальной жидкости. Коэффициент капиллярной фильтрации (Kf) - объём жидкости, фильтруемой за 1 мин
• Капиллярное гидростатическое давление - основной фактор, контролирующий транскапиллярное движение жидкости, - определяется АД, периферическим венозным давлением, прекапиллярным и посткапиллярным сопротивлением. На артериальном конце капилляра гидростатическое давление составляет 30-40 мм рт.ст., а на венозном - 10-15 мм рт.ст. Повышение артериального, периферического венозного давления и посткапиллярного сопротивления или уменьшение прекапиллярного сопротивления будут увеличивать капиллярное гидростатическое давление.
• Онкотическое давление плазмы определяется
альбуминами и глобулинами, а также осмотическим давлением электролитов.
Онкотическое давление на всём протяжении капилляра оста- ётся
относительно постоянным, составляя
• Интерстициальная жидкость образуется путём фильтрации из капилляров. Состав жидкости аналогичен таковому в плазме крови, исключая более низкое содержание белка. На коротких расстояниях между капиллярами и клетками тканей диффузия обеспечивает быстрый транспорт через интерстиций не толь-
ко молекул воды, но и электролитов, питательных веществ с небольшой молекулярной массой, продуктов клеточного об- мена, кислорода, углекислого газа и других соединений.
• Гидростатическое давление интерстициальной жидкости колеблется в пределах от -8 до +
• Онкотическое давление интерстициальной жидкости определяется количеством белка, проникающего через стенку капилляров в интерстициальное пространство. Общее количество белка в
Движение жидкости через стенку капилляра
Среднее капиллярное давление на артериальном конце капилляров на 15-25 мм рт.ст. больше, чем на венозном конце. В силу этой разницы давлений кровь фильтруется из капилляра на артериальном конце и реабсорбируется на венозном.
• Артериальная часть капилляра
Φ Продвижение жидкости на артериальном конце капилляра определяется коллоидно-осмотическим давлением плазмы (
• составляют фильтрующее давление, вызывающее переход 0,5% плазмы на артериальном конце капилляра в интерстициальное пространство. Венозная часть капилляра. В табл. 23-1 представлены силы, определяющие движение жидкости на венозном конце капилляра.
Таблица 23-1. Движение жидкости на венозном конце капилляра

Φ Таким образом, разность давлений, направленных внутрь и наружу капилляра, составляет
ЛИМФАТИЧЕСКАЯ СИСТЕМА
Лимфатическая система - сеть сосудов и лимфатических узлов, возвращающих интерстициальную жидкость в кровь (рис. 23-17, Б).
Образование лимфы
Объём жидкости, возвращающийся в кровоток посредством лимфатической системы, составляет 2-3 л в день. Вещества с вы-
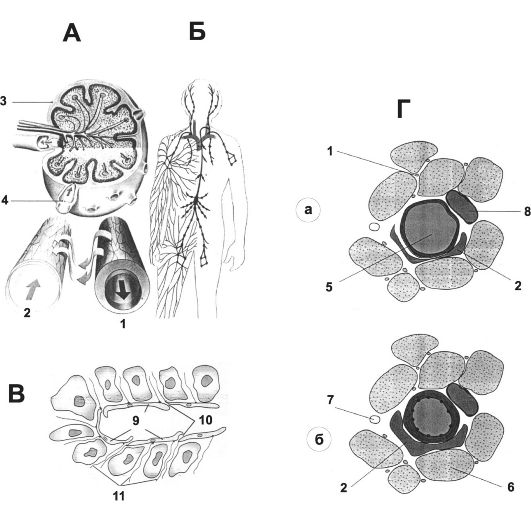
Рис. 23-17. Лимфатическая система. А - строение на уровне микроциркуляторного русла; Б - анатомия лимфатической системы; В - лимфатический капилляр. 1 - кровеносный капилляр, 2 - лимфатический капилляр, 3 - лимфатические узлы, 4 - лимфатические клапаны, 5 - прекапиллярная артериола, 6 - мышечное волокно, 7 - нерв, 8 - венула, 9 - эндотелий, 10 - клапаны, 11 - поддерживающие филаменты; Г - сосуды микроциркуляторного русла скелетной мышцы. При расширении артериолы (а) прилежащие к ней лимфатические капилляры сдавливаются между ней и мышечными волокнами (вверху), при сужении артериолы (б) лимфатические капилляры, напротив, расширяются (внизу). В скелетных мышцах кровеносные капилляры значительно меньше лимфатических.
сокой молекулярной массой (прежде всего белки) не могут абсорбироваться из тканей другим путём, кроме лимфатических капилляров, имеющих специальное строение.
• Состав лимфы. Поскольку 2/3 лимфы поступает из печени, где содержание белка превышает
• Вхождение интерстициальной жидкости в лимфатические капилляры (рис. 23-17, В, Г). Эндотелиальные клетки лимфатических капилляров прикрепляются к окружающей соединительной ткани так называемыми поддерживающими филаментами. В местах контакта эндотелиальных клеток конец одной эндотелиальной клетки перекрывает кромку другой клетки. Перекрывающие края клеток образуют подобие клапанов, выступающих внутрь лимфатического капилляра. Когда давление интерстициальной жидкости повышается, эти клапаны регулируют поступление интерстициальной жидкости в просвет лимфатических капилляров. В момент заполнения капилляра, когда давление в нём превысит давление интерстициальной жидкости, входные клапаны закрываются.
• Ультрафильтрация из лимфатических капилляров. Стенка лимфатического капилляра - полупроницаемая мембрана, поэтому часть воды возвращается в интерстициальную жидкость путём ультрафильтрации. Коллоидно-осмотическое давление жидкости в лимфатическом капилляре и интерстициальной жидкости одинаково, но гидростатическое давление в лимфатическом капилляре превышает таковое интерстициальной жидкости, что приводит к ультрафильтрации жидкости и концентрированию лимфы. В результате этих процессов концентрация белков в лимфе повышается примерно в 3 раза.
• Сдавление лимфатических капилляров. Движения
мышц и органов вызывают сдавление лимфатических капилляров. В скелетных
мышцах лимфатические капилляры расположены в адвентиции прекапиллярных
артериол (см. рис. 23-
ся между ними и мышечными волокнами, при этом входные клапаны закрываются. При сужении артериол входные клапаны, напротив, открываются, и интерстициальная жидкость поступает в лимфатические капилляры.
Движение лимфы
• Лимфатические капилляры. Лимфоток
в капиллярах минимален, если давление интерстициальной жидкости
отрицательное (например, составляет менее -6 мм рт.ст.). Повышение
давления выше
• увеличение проницаемости кровеносных капилляров;
• увеличение коллоидно-осмотического давления интерстициальной жидкости;
• повышение давления в артериальных капиллярах;
• уменьшение коллоидно-осмотического давления плазмы.
• Лимфангионы. Повышения интерстициального давления недостаточно, чтобы обеспечить лимфоток против сил гравитации. Пассивные механизмы оттока лимфы: пульсация артерий, влияющая на перемещение лимфы в глубоких лимфатических сосудах, сокращения скелетных мышц, движения диафрагмы - не могут обеспечить лимфоток в вертикальном положении тела. Указанную функцию активно обеспечивает лимфатический насос. Сегменты лимфатических сосудов, ограниченные клапанами и содержащие в стенке ГМК (лимфангионы), способны автоматически сокращаться. Каждый лимфангион функционирует как отдельный автоматический насос. Наполнение лимфангиона лимфой вызывает сокращение, и лимфа перекачивается через клапаны в следующий сегмент и так далее, вплоть до поступления лимфы в кровоток. В крупных лимфатических сосудах (например, в грудном протоке) лимфатический насос создаёт давление 50-100 мм рт.ст.
• Грудные протоки. В состоянии покоя через грудной проток проходит до 100 мл лимфы в час, через правый лимфатический проток - около 20 мл. Ежедневно в кровоток поступает 2-3 л лимфы.
МЕХАНИЗМЫ РЕГУЛЯЦИИ КРОВОТОКА
Изменения pO2, рСО2 крови, концентрация Н+, молочной кислоты, пирувата и ряда других метаболитов оказывают локальное воздействие на стенку сосудов и регистрируются находящимися в стенке сосудов хеморецепторами, а также барорецепторами, реаги- рующими на давление в просвете сосудов. Эти сигналы поступают в ядра солитарного тракта продолговатого мозга. Продолговатый мозг выполняет три важнейшие сердечно-сосудистых функции: 1) генерирует тонические возбуждающие сигналы к симпатическим преганглионарным волокнам спинного мозга; 2) интегрирует сердечно-сосудистые рефлексы и 3) интегрирует сигналы от гипо- таламуса, мозжечка и лимбических отделов коры головного мозга. Ответы ЦНС осуществляет двигательная вегетативная иннервация ГМК стенки сосудов и миокарда. Кроме того, существует мощная система гуморальных регуляторов ГМК стенки сосудов (вазоконстрикторы и вазодилататоры) и проницаемости эндотелия. Основной параметр регуляции - системное артериальное давление.
Локальные регуляторные механизмы
Саморегуляция. Способность тканей и органов регулировать собственный кровоток - саморегуляция. Сосуды многих органов обладают внутренней способностью компенсировать умеренные изменения перфузионного давления, изменяя сопротивление сосудов таким образом, чтобы кровоток оставался относительно постоянным. Механизмы саморегуляции функционируют в почках, брыжейке, скелетных мышцах, мозге, печени и миокарде. Различают миогенную и метаболическую саморегуляцию.
Φ Миогенная саморегуляция. Саморегуляция частично обусловлена сократительным ответом ГМК на растяжение. Это миогенная саморегуляция. Как только давление в сосуде начинает расти, кровеносные сосуды растягиваются и ГМК, окружающие их стенку, сокращаются. Φ Метаболическая саморегуляция. Сосудорасширяющие вещества имеют свойство накапливаться в работающих тканях, что играет свою роль в саморегуляции. Это метаболическая саморегуляция. Уменьшение кровотока приводит к накоплению сосудорасширяющих веществ (вазодилататоры), и сосуды расширяются (вазодилатация). Когда кровоток уси-
ливается, эти вещества удаляются, что приводит к ситуации
поддержания сосудистого тонуса. Сосудорасширяющие эффекты. Метаболические изменения, вызывающие расширение сосудов в большинстве тканей, - уменьшение pO2 и pH. Эти изменения обусловливают расслабление артериол и прекапиллярных сфинктеров. Увеличение pCO2 и осмоляльности также расслабляет сосуды. Прямое сосудорасширяющее действие CO2 наиболее выражено в тканях мозга и коже. Повышение температуры оказывает непосредственное сосудорасширяющее действие. Температура в тканях в результате повышения метаболизма повышается, что также способствует вазодила- тации. Молочная кислота и ионы K+ расширяют сосуды мозга и скелетных мышц. Аденозин расширяет сосуды сердечной мышцы и препятствует выделению вазоконстриктора норадреналина.
Эндотелиальные регуляторы
• Простациклин и тромбоксан A2. Простациклин образуется эндотелиальными клетками и содействует сосудорасширению. Тромбоксан A2 выделяется из тромбоцитов и способствует вазоконстрикции.
• Эндогенный релаксирующий фактор - оксид азота (NO). Эн-
дотелиальные клетки сосудов под воздействием различных веществ и/или условий синтезируют так называемый эндогенный релаксирующий фактор (оксид азота - NO). NO активирует в клетках гуанилатциклазу, необходимую для синтеза цГМФ, в итоге оказывающего расслабляющее воздействие на ГМК сосудистой стенки. Подавление функции NO-синтазы заметно повышает системное АД. В то же время эрекция полового члена связана с выделением NO, вызывающего расширение и наполнение кровью кавернозных тел.
• Эндотелины - 21-аминокислотные пептиды - представлены тремя изоформами. Эндотелин-1 синтезируется эндотелиальными клетками (особенно эндотелием вен, коронарных артерий и артерий мозга). Это мощный вазоконстриктор.
Гуморальная регуляция кровообращения
Циркулирующие в крови биологически активные вещества воздействуют на все отделы сердечно-сосудистой системы. К гу- моральным сосудорасширяющим факторам (вазодилататоры) от-
носятся кинины, VIP, предсердный натрийуретический фактор (атриопептин), а к гуморальным вазоконстрикторам - вазопрессин, норадреналин, адреналин и ангиотензин II.
Вазодилататоры
• Кинины. Два сосудорасширяющих пептида (брадикинин и каллидин - лизил-брадикинин) образуются из белков-предшественников кининогенов под действием протеаз, называемых калликреинами. Кинины вызывают:
Φ сокращение ГМК внутренних органов, расслабление ГМК
сосудов и снижение АД; Φ увеличение проницаемости капилляров; Φ увеличение кровотока в потовых и слюнных желёз и экзо-
кринной части поджелудочной железы.
• Предсердный натрийуретический фактор атриопептин: Φ увеличивает скорость клубочковой фильтрации;
Φ снижает АД, уменьшая чувствительность ГМК сосудов к
действию многих сосудосуживающих веществ; Φ тормозит секрецию вазопрессина и ренина.
Вазоконстрикторы
• Норадреналин и адреналин. Норадреналин - мощный сосудосуживающий фактор; адреналин оказывает менее выраженный сосудосуживающий эффект, а в некоторых сосудах вызывает умеренную вазодилатацию (например, при усилении сократительной активности миокарда расширяет венечные артерии). Стресс или мышечная работа стимулирует выделение норадреналина из симпатических нервных окончаний в тканях и оказывает возбуждающее воздействие на сердце, вызывает сужение просвета вен и артериол. Одновременно усиливается секреция норадреналина и адреналина в кровь из мозгового слоя надпочечников. Поступая во все области тела, эти вещества оказывают на кровообращение такой же сосудосуживающий эффект, как и активация симпатической нервной системы.
• Ангиотензины. Ангиотензин II обладает генерализованным сосудосуживающим действием. Ангиотензин II образуется из ангиотензина I (слабое сосудосуживающее действие), который, в свою очередь, формируется из ангиотензиногена под воздействием ренина.
• Вазопрессин (антидиуретический гормон, АДГ) обладает выраженным сосудосуживающим действием. Предшественники вазопрессина синтезируются в гипоталамусе, транспортируются по аксонам в заднюю долю гипофиза и оттуда поступают в кровь. Вазопрессин также увеличивает реабсорбцию воды в почечных канальцах.
НЕЙРОГЕННЫЙ КОНТРОЛЬ КРОВООБРАЩЕНИЯ
В основе регуляции функций сердечно-сосудистой системы находится тоническая деятельность нейронов продолговатого мозга, активность которых меняется под влиянием афферентных импульсов от чувствительных рецепторов системы - баро- и хеморецепторов. Сосудодвигательный центр продолговатого мозга постоянно взаимодействует с гипоталамусом, мозжечком и корой головного мозга для координированной функции сердечно-сосудистой системы таким образом, чтобы ответ на изменения в организме был абсолютно согласованным и многоплановым.
Сосудистые афференты
• Барорецепторы особенно многочисленны в дуге аорты и в стенке крупных вен, лежащих близко к сердцу. Эти нервные окончания образованы терминалями волокон, проходящих в составе блуждающего нерва.
• Специализированные сенсорные структуры. В рефлекторной регуляции кровообращения участвуют каротидный синус и каротидное тельце (см. рис. 23-18, В, 25-10, А), а также подобные им образования дуги аорты, лёгочного ствола, правой подключичной артерии.
Φ Каротидный синус расположен вблизи бифуркации общей сонной артерии и содержит многочисленные барорецепто- ры, импульсация от которых поступает в центры, регулирующие деятельность сердечно-сосудистой системы. Нервные окончания барорецепторов каротидного синуса - терминали волокон, проходящих в составе синусного нерва (Херинга) - ветви языкоглоточного нерва.
Φ Каротидное тельце (рис. 25-10, Б) реагирует на изменения химического состава крови и содержит гломусные клетки, образующие синаптические контакты с терминалями афферентных волокон. Афферентные волокна для каротидного
тельца содержат вещество Р и относящиеся к кальцитониновому гену пептиды. На гломусных клетках заканчиваются также эфферентные волокна, проходящие в составе синусного нерва (Херинга), и постганглионарные волокна из верхнего шейного симпатического ганглия. Терминали этих волокон содержат светлые (ацетилхолин) или гранулярные (катехоламины) синаптические пузырьки. Каротидное тельце регистрирует изменения рСО2 и рО2, а также сдвиги рН крови. Возбуждение передаётся через синапсы на афферентные нервные волокна, по которым импульсы поступают в центры, регулирующие деятельность сердца и сосудов. Афферентные волокна от каротидного тельца про- ходят в составе блуждающего и синусного нервов.
Сосудодвигательный центр
Группы нейронов, расположенные билатерально в ретикулярной формации продолговатого мозга и нижней трети моста, объединяют понятием «сосудодвигательный центр» (см. рис. 23-18, В). Этот центр передаёт парасимпатические влияния через блуждающие нервы к сердцу и симпатические влияния через спинной мозг и периферические симпатические нервы к сердцу и ко всем или почти всем кровеносным сосудам. Сосудодвигательный центр включает две части - сосудосуживающий и сосудорасширяющий центры.
• Сосуды. Сосудосуживающий центр постоянно передаёт сигналы частотой от 0,5 до 2 Гц по симпатическим сосудосуживающим нервам. Это постоянное возбуждение обозначают термином симпатический сосудосуживающий тонус, а состояние постоянного частичного сокращения ГМК кровеносных сосудов - термином вазомоторный тонус.
• Сердце. Одновременно сосудодвигательный центр контролирует деятельность сердца. Латеральные отделы сосудодвигательного центра передают возбуждающие сигналы через симпатические нервы к сердцу, увеличивая частоту и силу его сокращений. Медиальные отделы сосудодвигательного центра через моторные ядра блуждающего нерва и волокна блуждающих нервов передают парасимпатические импульсы, урежающие ЧСС. Частота и сила сокращений сердца увеличиваются одновременно с сужением сосудов тела и уменьшаются одновременно с расслаблением сосудов.
• Влияния, действующие на сосудодвигательный центр: Φ прямая стимуляция (CO2, гипоксия);
Φ возбуждающие влияния нервной системы из коры больших полушарий через гипоталамус, от болевых рецепторов и рецепторов мышц, от хеморецепторов каротидного синуса и дуги аорты;
Φ ингибирующие влияния нервной системы из коры больших полушарий через гипоталамус, из лёгких, от барорецепто- ров каротидного синуса, дуги аорты и лёгочной артерии.
Иннервация кровеносных сосудов
Все кровеносные сосуды, содержащие в своей стенке ГМК (т.е. за исключением капилляров и части венул), иннервируются мо- торными волокнами из симпатического отдела вегетативной нервной системы. Симпатическая иннервация мелких артерий и артериол регулирует кровоток в тканях и АД. Симпатические волокна, иннервирующие венозные ёмкостные сосуды, управляют объёмом крови, депонированной в венах. Сужение просвета вен уменьшает венозную ёмкость и увеличивает венозный возврат.
• Норадренергические волокна. Их влияние заключается в сужении просвета сосудов (рис. 23-18, А).
• Симпатические сосудорасширяющие нервные волокна. Резистивные сосуды скелетных мышц, помимо сосудосуживающих симпатических волокон, иннервированы сосудорасширяющими холинергическими волокнами, проходящими в составе симпатических нервов. Кровеносные сосуды сердца, лёгких, почек и матки также иннервируются симпатическими холинергическими нервами.
• Иннервация ГМК. Пучки норадренергических и холинергических нервных волокон образуют сплетения в адвентициальной оболочке артерий и артериол. Из этих сплетений варикозные нервные волокна направляются к мышечной оболочке и оканчиваются на её внешней поверхности, не проникая к глубжележащим ГМК. Нейромедиатор достигает внутренних частей мышечной оболочки сосудов путём диффузии и распространения возбуждения от одной ГМК к другой посредством щелевых контактов.
• Тонус. Сосудорасширяющие нервные волокна не пребывают в состоянии постоянного возбуждения (тонуса), тогда как

Рис. 23-18. Контроль кровообращения со стороны нервной системы. А - двигательная симпатическая иннервация сосудов; Б - аксон-рефлекс. Антидромные импульсы обусловливают выделение вещества Р, расширяющего сосуды и увеличивающего проницаемость капилляров; В - механизмы продолговатого мозга, контролирующие АД. ГЛ - глутамат; НА - норадреналин; АХ - ацетилхолин; А - адреналин; IX - языкоглоточный нерв; X - блуждающий нерв. 1 - каротидный синус, 2 - дуга аорты, 3 - барорецепторные афференты, 4 - тормозные вставочные нейроны, 5 - бульбоспинальный путь, 6 - симпатические преганглионары, 7 - симпатические постганглионары, 8 - ядро одиночного пути, 9 - ростральное вентролатеральное ядро.
сосудосуживающие волокна обычно проявляют тоническую активность. Если перерезать симпатические нервы (что обозначают термином «симпатэктомия»), то кровеносные сосуды расширяются. В большинстве тканей сосуды расширяются в результате уменьшения частоты тонических разрядов в сосудосуживающих нервах.
• Аксон-рефлекс. Механическое или химическое раздражение кожи может сопровождаться локальным расширением сосудов. Полагают, что при раздражении тонких безмиелиновых кожных болевых волокон ПД не только распространяются в центростремительном направлении к спинному мозгу (ортодромно), но и по эфферентным коллатералям (антидромно) поступают к кровеносным сосудам иннервируемой данным нервом области кожи (рис. 23-18, Б). Этот местный нервный механизм называют аксон-рефлексом.
Регуляция артериального давления
АД поддерживается на необходимом рабочем уровне с помощью рефлекторных контролирующих механизмов, функционирующих на основании принципа обратной связи.
• Барорецепторный рефлекс. Один
из хорошо известных нервных механизмов контроля АД - барорецепторный
рефлекс. Барорецепторы имеются в стенке почти всех крупных артерий в
области грудной клетки и шеи, особенно много барорецепторов в каротидном
синусе и в стенке дуги аорты. Барорецепторы каротидного синуса (см.
рис. 25-10) и дуги аорты не реагируют на АД в пределах от 0 до 60-80 мм
рт.ст. Рост давления выше этого уровня вызывает ответную реакцию,
которая прогрессивно возрастает и достигает максимума при АД около
Φ Усиленная импульсация от барорецепторов, вызванная подъ- ёмом АД, поступает в продолговатый мозг, тормозит со-
судосуживающий центр продолговатого мозга и возбуждает центр блуждающего нерва. В результате расширяется просвет артериол, уменьшается частота и сила сердечных сокращений. Другими словами, возбуждение барорецепторов рефлекторно вызывает снижение АД за счёт уменьшения периферического сопротивления и сердечного выброса. Φ Низкое АД оказывает противоположное действие, что при- водит к его рефлекторному повышению до нормального уровня. Снижение давления в области каротидного синуса и дуги аорты инактивирует барорецепторы, и они перестают оказывать тормозящее влияние на сосудодвигательный центр. В итоге последний активируется и вызывает повышение АД.
• Хеморецепторы каротидного синуса и аорты. Хеморецепторы - хемочувствительные клетки, реагирующие на недостаток кислорода, избыток углекислого газа и водородных ионов, - расположены в каротидных и аортальных тельцах. Хеморецепторные нервные волокна от телец вместе с барорецепторными волокнами идут в сосудодвигательный центр продолговатого мозга. При уменьшении АД ниже критического уровня хеморецепторы стимулируются, поскольку снижение кровотока уменьшает содержание O2 и увеличивает концентрацию CO2 и H+. Таким образом, импульсация от хеморецепторов возбуждает сосудодвигательный центр и способствует повышению АД.
• Рефлексы с лёгочной артерии и предсердий. В стенке обоих предсердий и лёгочной артерии имеются рецепторы растяжения (рецепторы низкого давления). Рецепторы низкого давления воспринимают изменения объёма, происходящие одновременно с изменениями АД. Возбуждение этих рецепторов вызывает рефлексы параллельно с барорецепторными рефлексами.
• Рефлексы с предсердий, активирующие почки. Растяжение предсердий вызывает рефлекторное расширение афферентных (приносящих) артериол в клубочках почек. Одновременно сигнал поступает из предсердия в гипоталамус, уменьшая секрецию АДГ. Комбинация двух эффектов - увеличения клубочковой фильтрации и уменьшения реабсорбции жидкости - способствует уменьшению объёма крови и возвращению его к нормальному уровню.
• Рефлекс с предсердий, контролирующий ЧСС. Увеличение
давления в правом предсердии вызывает рефлекторное увеличение ЧСС
(рефлекс Бейнбриджа). Рецепторы растяжения предсердия, вызывающие
рефлекс Бейнбриджа, передают афферентные сигналы через блуждающий нерв в
продолговатый мозг. Затем возбуждение возвращается обратно к сердцу по
симпатическим путям, увеличивая частоту и силу сокращений сердца. Этот
рефлекс препятствует переполнению кровью вен, предсердий и лёгких. Артериальная гипертензия. Нормальное
систолическое и диастолическое давление составляет 120/80 мм рт.ст.
Артериальной гипертензией называют состояние, когда систолическое
давление превышает
Контроль сердечного ритма
Практически все механизмы, контролирующие системное АД, в той или иной мере изменяют ритм сердца. Стимулы, ускоряющие ритм сердца, также повышают АД. Стимулы, замедляющие ритм сокращений сердца, снижают АД. Имеются и исключения. Так, если рецепторы растяжения предсердий раздражены, повышается ЧСС и возникает артериальная гипотензия. Повышение внутричерепного давления вызывает брадикардию и повышение АД. В сумме учащают ритм сердца уменьшение активности барорецепторов в артериях, левом желудочке и лёгочной артерии, увеличение активности рецепторов растяжения предсердий, вдох, эмоциональное возбуждение, болевые раздражения, мышечная нагрузка, норадреналин, адреналин, гормоны щитовидной железы, лихорадка, рефлекс Бейнбриджа и чувство ярости, а урежают ритм сердца увеличение активности барорецепторов в артериях, левом желудочке и лёгочной артерии, выдох, раздражение болевых волокон тройничного нерва и повышение внутричерепного давления.
Обобщение главы
Сердечно-сосудистая система является транспортной системой, доставляющей необходимые вещества тканям организма и удаляющей продукты метаболизма. Она также отвечает за доставку крови через лёгочную циркуляцию для поглощения кислорода из лёгких и выделения углекислого газа в лёгкие.
Сердце является мышечным насосом, разделённым на правую и левую части. Правое сердце накачивает кровь в лёгкие; левое сердце - во все оставшиеся системы организма.
Давление создаётся внутри предсердий и желудочков сердца за счёт сокращений сердечной мышцы. Однонаправленно открываю- щиеся клапаны предотвращают обратный поток между камерами и обеспечивают поступательное движение крови через сердце.
Артерии транспортируют кровь от сердца к органам; вены - от органов к сердцу.
Капилляры являются основной системой обмена между кровью и внеклеточной жидкостью.
Клетки сердца не нуждаются в сигналах из нервных волокон для генерации потенциалов действия.
Клетки сердца проявляют свойства автоматизма и ритмичности.
Плотные контакты, соединяющие клетки внутри миокарда, позволяют сердцу электрофизиологически вести себя как функцио- нальный синцитий.
Открытие потенциалзависимых натриевых каналов и потенциалзависимых кальциевых каналов и закрытие потенциалзависимых калиевых каналов отвечают за деполяризацию и формирование потенциала действия.
Потенциалы действия в кардиомиоцитах желудочков имеют продлённое плато фазы деполяризации, ответственное за создание длительного рефрактерного периода в клетках сердца.
Синусно-предсердный узел инициирует электрическую активность в нормальном сердце.
Норадреналин увеличивает автоматическую активность и скорость проведения потенциалов действия; ацетилхолин уменьшает их.
Электрическая активность, возникшая в синусно-предсердном узле, распространяется по мускулатуре предсердия, через предсердножелудочковый узел и волокна Пуркинье к мускулатуре желудочка.
Предсердно-желудочковый узел задерживает поступление потенциалов действия в миокард желудочков.
Электрокардиограмма отображает варьирующие во времени разности электрических потенциалов между реполяризованными и деполяризованными участками сердца.
ЭКГ обеспечивает клинически ценную информацию о скорости, ритме, формах деполяризации и массе электрически активной сердечной мышцы.
ЭКГ отображает изменения в метаболизме сердца и электролитах плазмы так же, как и эффекты лекарственных средств.
Сократимость сердечной мышцы изменяется под влиянием инотропных вмешательств, которые включают изменения частоты сердца, при симпатической стимуляции или содержании в крови катехоламинов.
Кальций входит в клетки сердечной мышцы во время плато потенциала действия и побуждает выделение внутриклеточного каль- ция из запасов в саркоплазматическом ретикулуме.
Сократимость мышцы сердца связана с изменениями количества кальция, выделяющегося из саркоплазматической сети, под воздействием входящего в кардиомиоциты экстраклеточного кальция.
Изгнание крови из желудочков подразделяется на быструю и медленную фазы.
Ударный объём - количество крови, выбрасываемой из желудочков во время систолы. Имеется разница между желудочковым конечно-диастолическим и конечно-систолическим объёмами.
Желудочки не освобождаются полностью от крови во время систолы, оставляя резидуальный объём для следующего цикла на- полнения.
Наполнение желудочков кровью подразделяется на периоды быстрого и медленного наполнения.
Тоны сердца во время сердечного цикла имеют отношение к открытию и закрытию клапанов сердца.
Сердечный выброс - производное от ударного объёма и частоты сокращений сердца.
Объём ударного выброса определяют конечно-диастолическая длина миокардиоцитов, постнагрузка и сократимость миокарда.
Энергия сердца зависит от растяжения стенок желудочков, частоты сердцебиений, ударного объёма и сократимости.
Сердечный выброс и системное сосудистое сопротивление определяют величину артериального давления.
Ударный объём и податливость стенок артерий - главные факторы пульсового давления.
Артериальная податливость уменьшается, в то время как артериальное давление повышается.
Центральное венозное давление и сердечный выброс взаимосвязаны.
Микроциркуляция контролирует транспорт воды и веществ между тканями и кровью.
Перенос газов и жирорастворимых молекул осуществляется пу- тём диффузии через эндотелиальные клетки.
Транспорт водорастворимых молекул происходит за счёт диффузии через поры между прилежащими эндотелиальными клетками.
Диффузия веществ через стенку капилляров зависит от концентрационного градиента вещества и проницаемости капилляра к этому веществу.
Фильтрация или абсорбция воды через капиллярную стенку осуществляется через поры между прилежащими эндотелиальны- ми клетками.
Гидростатическое и осмотическое давление являются первичными силами для фильтрации и абсорбции жидкости сквозь ка- пиллярную стенку.
Соотношение посткапиллярного и прекапиллярного давления является основным фактором капиллярного гидростатического давления.
Лимфатические сосуды выводят излишки воды и белковых молекул из интерстициального пространства между клетками.
Миогенная саморегуляция артериол представляет собой ответную реакцию ГМК стенки сосудов на увеличение давления или растяжения.
Промежуточные продукты метаболизма вызывают расширение артериол.
Оксид азота (NO), вьделяющийся из клеток эндотелия, является главным местным сосудорасширяющим фактором.
Аксоны симпатической нервной системы выделяют норадреналин, который суживает артериолы и венулы.
Ауторегуляция кровотока через некоторые органы поддерживает кровоток на постоянном уровне в условиях, когда изменяется артериальное давление.
Симпатическая нервная система действует на сердце через β-адренорецепторы; парасимпатическая - через мускариновые холинергические рецепторы.
Симпатическая нервная система действует на кровеносные сосуды главным образом через α-адренорецепторы.
Рефлекторный контроль кровяного давления осуществляет- ся нейрогенными механизмами, управляющими частотой сердца, ударным объёмом и системным сопротивлением сосудов.
Барорецепторные и сердечно-лёгочные рецепторы важны для регуляции краткосрочных изменений артериального давления.
Ренин-ангиотензин-альдостероновая система, аргинин-вазопрессин и предсердный натрийуретический пептид играют важную роль в долговременной гормональной регуляции объёма крови и артериального давления.