Патофизиология Новицкого, Е.Д. Гольдберга Тома 1 и 2 - 2009 г.
|
|
|
|
ГЛАВА 17 ПАТОФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ
Жизнедеятельность организма возможна при постоянном поступлении в организм пищевых веществ: белков, жиров, углеводов и, кроме того, воды, минеральных солей и витаминов. При этом вода, минеральные соли и витамины усваиваются в неизменном виде, в котором поступают в составе пищи. Белки, жиры и углеводы подвергаются физическим и химическим превращениям в желудочно-кишечном тракте, после чего продукты их метаболизма всасываются из пищеварительного тракта и поступают в кровь и лимфу. Пищеварение - это превращение пищевых продуктов в соединения, лишенные видовой специфичности, их всасывание и участие в межуточном обмене.
К функциям пищеварительного тракта относятся: секреторная - выработка ферментов, соляной кислоты, желчи и т.д., которые обеспечивают переваривание за счет физико-химических воздействий и ферментативной переработки пищи; двигательная и эвакуаторная - механическая обработка пищи за счет измельчения, перемешивания и передвижения по желудочно-кишечному тракту; всасывательная - активное проникновение конечных продуктов переваривания, воды, солей, витаминов, минеральных веществ через слизистую желудочно-кишечного тракта в кровь и лимфу; экскреторная (выделительная) - во-первых, это один из экстраренальных путей выведения метаболитов из кровотока для обеспечения гомеостаза (например, при уремии мочевина выводится через слизистую пищеварительного тракта, вызывая образование симптоматических язв), во-вторых, экскреторная функция обеспечивает участие пищеварительной системы в межорганном обмене нутриентов (нутриенты - не пищевые, а питательные вещества; за сутки в норме в желудочно-кишечный тракт выделяется до 80 г белка и 20 г жира, которые вместе с экзогенными белками и жи-
рами перевариваются, всасываются и используются в организме); эндокринная - синтез собственных гормонов (холецистокинин, секретин, энтерогастрон и т.д.), а также функция пищеварительного тракта, которая тесно связана с системой крови - синтез внутреннего фактора Касла, при недостатке которого развивается В12-дефицитная анемия.
Недостаточность пищеварения - состояние желудочно-кишечного тракта, при котором не обеспечивается достаточного усвоения поступающей в организм пищи. В результате в организме развиваются отрицательный азотистый баланс, гипопротеинемия, гиповитаминозы, явления неполного голодания, истощение организма, нарушение реактивности. Недостаточность пищеварения может развиваться при нарушении работы всего пищеварительного тракта или его отделов. Еще И.П. Павлов отмечал удивительную слаженность и закономерность в работе пищеварительньгх желез. Эта взаимозависимость особенно ярко выступает в условиях патологии, когда нарушение деятельности какого-либо участка пищеварительного тракта закономерно вызывает расстройство функций других его отделов.
17.1. ОСНОВНЫЕ ПРИЧИНЫ НАРУШЕНИЯ ПИЩЕВАРЕНИЯ
К нарушениям пищеварения могут привести:
1) врожденные аномалии пищеварительного тракта;
2) погрешности в питании (недоброкачественная, грубая пища, сухоядение, несбалансированное питание с дефицитом белка, витаминов, микроэлементов, прием чрезмерно горячей или холодной пищи и т.д.);
3) возбудители некоторых инфекций (брюшной тиф, дизентерия, пищевая токсикоинфекция и др.);
4) попадание в желудочно-кишечный тракт ядов (солей тяжелых металлов, ядов растительного происхождения и др.);
5) действие ионизирующей радиации;
6) опухоли;
7) послеоперационные состояния;
8) психотравмы, отрицательные эмоции, физическое перенапряжение;
9) наркомания, алкоголизм, курение.
Патология органов желудочно-кишечного тракта может развиться в результате прямого или опосредованного повреждающего действия этиологических факторов.
Примером прямого повреждающего действия этиологического фактора может явиться развитие эзофагита и некротических изменений пищевода с формированием в последующем стриктуры (рубцового сужения) этого органа после приема уксусной эссенции.
Опосредованное повреждающее действие этиологических факторов реализуется через нарушения нервно-гуморальной регуляции органов пищеварения. При этом вначале повреждение может формироваться или в нервной системе, или в каком-либо другом органе желудочно-кишечного тракта. Если вначале возникают нарушения в нервной системе под влиянием ядов, химикатов, стрессоров и т.д., это может привести к патологической импульсации из ЦНС на периферию, что способствует нарушению функции органов пищеварения, например, развитию язвы желудка после черепно-мозговой травмы или контузий. Если вначале возникает повреждение какоголибо органа желудочно-кишечного тракта, это приводит к обильной афферентной импульсации от больного органа в ЦНС. В ЦНС формируется стойкая патологическая доминанта, возникает патологическая ответная импульсация из ЦНС на периферию, что приводит к нарушению функции других органов пищеварения. Расстройство функции одного отдела желудочно-кишечного тракта вызывает нарушения в других отделах по механизму «висцеро-висцерального» рефлекса. Например, при язве желудка развивается реактивный панкреатит или реактивный гепатит.
17.2. ОСНОВНЫЕ ПАТОГЕНЕТИЧЕСКИЕ ФАКТОРЫ НЕДОСТАТОЧНОСТИ ПИЩЕВАРЕНИЯ
К основным патогенетическим факторам в развитии недостаточности пищеварения относят:
1. Нарушение аппетита.
2. Нарушение обработки пищи в полости рта и ее прохождении по пищеводу.
3. Нарушение пищеварения в желудке.
4. Нарушение пищеварения в кишечнике.
17.2.1. Нарушения аппетита
Ощущения голода и сытости обусловлены активностью пищевого центра, который представляет функциональное объединение несколь-
ких нервных образований на различных уровнях ЦНС. Это сложный гапоталамо-лимбико-ретикулокортикальный комплекс. Важную роль в этом комплексе отводят гипоталамусу. В норме процесс принятия пищи регулируется двумя гипоталамическими центрами: вентролатеральным - «центр голода» и вентромедиальным - «центр насыщения», которые находятся в реципрокных отношениях. Ведущий отдел - центр голода, от него идет возбуждение всего пищевого центра. Существует несколько теорий возникновения чувства голода.
Считается, в частности, что возбуждение нейронов центра голода может возникать в результате снижения уровня глюкозы в крови (глюкостатическая теория) или при действии метаболитов цикла Кребса (метаболическая). Чувство голода наступает также при уменьшении содержания аминокислот (аминоацидостатическая теория) и уровня жирных кислот и триацилглицеролов в крови (липостатическая), а также при уменьшении температуры тела (термостатическая) и в результате импульсации от механорецепторов желудка при его «голодных» сокращениях (локальная теория) (подробнее см. в разделе 12.5).
Важную роль в регуляции потребления пищи, возникновения чувства голода и чувства насыщения играют пептидные гормоны. Усиление пищевой мотивации и активацию пищевого поведения вызывают избыток инсулина, пентагастрин, окситоцин, активация парасимпатической нервной системы. При активации центра насыщения, напротив, возникает сдерживающая импульсация на центр голода, и активность последнего падает. Возбуждение нейронов центра насыщения вызывают глюкоза, лептин, холецистокинин, панкреатический глюкагон, соматостатин, активация симпатической нервной системы, а также серотонин. Уровень мозгового серотонина особенно увеличивается после употребления пищи, богатой углеводами и белками, когда повышается прохождение через гематоэнцефалический барьер предшественника серотонина - аминокислоты триптофана. Известно, что в основе многих депрессий лежит снижение уровня мозгового серотонина, и тогда при депрессии развивается гиперфагия.
Различают следующие расстройства аппетита: патологическое усиление - гиперрексия (от греч. hyper - сверх, чрезмерно, orexis - аппетит), патологическое снижение вплоть до анорексии (от греч. an - отрицание) и отвращения к пище.
Патологическое усиление аппетита часто сочетается с повышенным потреблением пищи - полифагией (от греч. poly - много,
phagein - есть). При резком повышении аппетита говорят о булимии (bus - бык, linos - голод, синоним - волчий голод). В эксперименте гиперрексию вызывают разрушением вентромедиальных ядер гипоталамуса или химическим повреждением их ауротиоглюкозой (C6H11AuSO5), вводимой парентерально. Патологическое усиление аппетита можно наблюдать при ряде заболеваний центральной нервной системы (слабоумие, неврозы, опухоли задней черепной ямки) и эндокринных желез (сахарный диабет, опухоли поджелудочной железы, продуцирующие инсулин, - инсуломы, тиреотоксикоз).
Патологическое снижение аппетита вплоть до анорексии можно воспроизвести в эксперименте, разрушая вентролатеральные ядра гипоталамуса. При этом исчезает чувство голода, и животные отказываются от еды вплоть до афагии - полного прекращения приема пищи.
Различают следующие виды анорексии:
1. Динамическая анорексия. Является одним из симптомов при заболеваниях органов желудочно-кишечного тракта и гепатобилиарной системы. Она может быть связана с нарушением функций рецепторов пищеварительного тракта, а также носить условнорефлекторный характер, т.е. вызывать боль, чувство дискомфорта. Такого рода диспепсия может быть симптомом ряда заболеваний желудка (например, рака желудка) и кишечника. В последнем случае ее нужно четко дифференцировать от ситофобии, или болезни Эмкомффта, когда аппетит сохранен, но употребление пищи может быть сниженным. Ситофобия развивается, например, при болезни Крона (регионарный илеит), особенно в случаях частичной непроходимости кишечника, или у больных с язвенной болезнью желудка после частичной или тотальной гастрэктомии. Анорексия может предшествовать также синдрому желтухи при гепатитах.
2. Интоксикационная анорексия. Отмечается при ряде интоксикаций, отравлений и вследствие тяжелых длительных заболеваний (опухоли, инфекции). В ее основе лежит снижение возбудимости пищевого центра. Она является важным симптомом у больных, страдающих хронической почечной недостаточностью, и отмечается при интоксикациях лекарственными препаратами, в частности сердечными гликозидами, снотворными, наркотическими средствами.
3. Невротическая анорексия. Причиной ее развития являются отрицательные эмоции, стрессовые ситуации, сильное возбуждение головного мозга.
4. Нервно-психическая анорексия. Проявляется при психогенных нарушениях, в частности при органических поражениях центральной нервной системы. В этих случаях анорексия часто сопровождает синдром депрессии и может быть проявлением сознательного резкого ограничения приема пищи при навязчивом представлении об излишней полноте.
5. Нейродинамическая анорексия. Развивается вследствие реципрокного торможения пищевого центра при рвоте, болевых синдромах (печеночная, почечная, кишечная колики, инфаркт миокарда и др.).
В ряде случаев анорексию трудно отнести к одному из перечисленных видов, она часто носит смешанный характер. Например, выраженная анорексия при тяжелой хронической сердечной недостаточности и легочной недостаточности объясняется не только недостатком кислорода в органах желудочно-кишечного тракта и гепатобилиарной системы, но и тяжелыми обменными нарушениями, нередко присутствием лекарственной интоксикации.
17.2.2. Нарушения обработки пищи в полости рта и ее прохождения по пищеводу
17.2.2.1. Нарушение жевания
Патология пищеварения может быть обусловлена нарушениями начальной его фазы - жевания. Жевание - это механический процесс измельчения пищи в ротовой полости, выполняемый височно-нижнечелюстными суставами, а также зубами, наличие которых определяет площадь жевательной поверхности. Наиболее частой причиной нарушения жевания являются болезни зубов - кариес и пародонтоз. Кариес - это индуцированное бактериями прогрессирующее разрушение минеральных и органических компонентов наружной эмали и расположенного под ней дентина и основная причина потери зубов. Прогрессирующее течение кариеса осложняется воспалением пульпы и периодонта.
Пародонтоз - это тяжелое заболевание полости рта, при котором возникают дистрофические изменения пародонта, что влечет за собой расшатывание и выпадение зубов. Патогенез кариеса и пародонтоза не вполне ясен. Играют роль нарушения в обмене веществ, особенно белковом, гиповитаминозы, несбалансированность питания, нарушения пищеварения, всасывания и другие факторы.
Нарушение жевания связано с уменьшением количества зубов,
которые испытывают функциональную перегрузку. Это приводит к деформации зубных рядов и прикуса, что еще больше усугубляет расстройство жевания. Разжевывание пищи нарушается при аномалиях прикуса, травмах, огнестрельных ранениях нижней части лица, когда происходят переломы челюстных костей, вывихи и переломы зубов.
Нарушение жевания возникает при патологии жевательной мускулатуры. Ее функция страдает при инфекциях, нарушениях иннервации, травмах, огнестрельных ранениях. Так, при столбняке, менингите отмечается тонический спазм (тризм) жевательной мускулатуры. При неврите тройничного нерва возникает резкая боль при жевании (что может служить причиной ошибочного удаления здоровых зубов), в ряде случаев развивается периферический паралич жевательных мышц.
На процесс жевания влияют и нарушения в височно-нижнечелюстных суставах, которые возникают, например, при ревматоидном артрите.
Воспалительные процессы в полости рта - пульпиты, стоматиты, гингивиты нарушают процесс жевания, являются очагом инфекции, могут вызывать сенсибилизацию организма и аллергические заболевания внутренних органов.
При нарушении разжевывания пищи происходят изменения в деятельности желудка: страдает его моторика, так как плохо прожеванная пища медленнее переваривается и дольше в нем задерживается, вызывая изменения слизистой. Этому способствует и уменьшение рефлекторного отделения желудочного и панкреатического соков. Грубая, плохо измельченная пища травмирует слизистую пищеварительного тракта, особенно пищевода и желудка, вызывая повреждения поверхностного эпителия.
17.2.2.2. Нарушение слюноотделения
Секреция слюны важна для акта глотания, а также для смачивания и формирования пищевого комка. Это происходит благодаря содержанию в слюне муцинов (гликопротеины слюны), обволакивающих пищевой комок. Слюна, кроме муцина, содержит амилазу (птиалин), участвующую в переваривании углеводов, лизоцим. Ее секреция необходима и для очищения полости рта, что предотвращает скопление бактерий. Содержащийся в ней бикарбонатный
буфер поддерживает значение рН полости рта около 7. Слюна служит растворителем пищевых веществ.
Увеличение слюноотделения (гиперсаливация) возникает в результате непосредственной или рефлекторной стимуляции центра слюноотделения в продолговатом мозгу или секреторных нервов слюнных желез. Наиболее сильными стимуляторами слюноотделения являются вкусовые ощущения. При гиперсаливации у взрослого человека за сутки может выделиться до 8-14 л слюны, что влечет за собой обезвоживание и потерю бикарбонатов и калия, которые в большом количестве содержатся в слюне. Гиперсаливация возможна при поражении центральной нервной системы, воспалительных процессах в полости рта, заболеваниях пищевода (рефлюкс-эзофагит), гельминтозах, токсикозе беременных, действии некоторых лекарств (пилокарпин, физостигмин).
Слюноотделение обычно снижается ночью. Объем слюны, выделяемой за сутки, составляет 1000 мл и более, и около 90% ее вырабатывается околоушными (выделение серозного секрета с малым количеством органических компонентов) и подчелюстными железами (выделение смешанного секрета - серозные и слизистые компоненты). На состав слюны влияют скорость ее секреции и действие гормонов (эстрогены, андрогены, глюкокортикоиды, пептидные гормоны). При заглатывании большого количества слюны происходит нейтрализация желудочного сока и нарушение пищеварения в желудке. Длительная потеря слюны вызывает обменные расстройства, нарушение кислотно-щелочного равновесия, истощение организма. Обычно при гиперсаливации слюна полностью не заглатывается. Она вытекает наружу, вызывая мацерацию и воспаление слизистой губ и кожи лица. Возможно попадание слюны в дыхательные пути и инфицирование микробами, находящимися в полости рта.
Уменьшение слюноотделения (гипосаливация) может происходить при патологических процессах в тканях слюнных желез (силаденит, опухоли). Воспаление слюнных желез (силаденит) обычно связано с наличием в протоке одной из них слюнного камня (сиалолитиаз). Слюнные камни оказывают механическое препятствие току слюны и повышают давление в слюнных протоках. При этом нарушается ток слюны, возникают боли и припухание железы во время приема пищи; паренхима железы может атрофироваться. Гипосаливация отмечается при центральном торможении секреции слюнных желез, возникающем при стрессе, болевом синдроме. Она наблю-
дается при воздействии ряда медикаментов антихолинергического действия (атропин, метацин, скополамин), некоторых антидепрессантов. Слюноотделение уменьшается при лихорадке, ряде эндокринных заболеваний (тиреотоксикоз, сахарный диабет), поражениях нервной системы (повреждения основания мозга, сухотка спинного мозга и др.), при воздействии ионизирующей радиации (вследствие лучевой терапии опухолей головы и шеи), обезвоживании. При уменьшении или прекращении секреции слюны развивается ксеростомия - сухость в полости рта. Возникает нарушение разжевывания пищи и ее проглатывания. Ксеростомия обусловлена дисфункцией слюнных желез и может быть временной или постоянной. Факторами, вызывающими временную ксеростомию, являются эмоциональный стресс, некоторые лекарственные препараты, такие, как атропин, антигистаминные средства, трициклические антидепрессанты и фенотиазины. Развитие стойкой ксеростомии происходит при облучении полости рта, что связано с атрофией слюнных желез.
Гипосаливация и ксеростомия являются симптомами болезни Шегрена - системного аутоиммунного заболевания, при котором резко снижается секреция желез пищеварительного тракта, слюнных желез, отмечается сухость синовиальных оболочек (плевра, перикард).
При гипосаливации в полости рта - на языке и деснах образуется налет из слущенного эпителия, что служит питательной средой для микрофлоры. В норме в 1 мл слюны содержится 108-109 бактерий: стрептококки, диплококки, спирохеты, лактобациллы, актиномицеты, грибы рода Candida, часто вирус Herpes simplex и др. При гипосаливации и ксеростомии микрофлора полости рта усиливает свой рост, и возникают воспалительные процессы ротовой полости, ухудшающие пищеварение и служащие очагом инфекции для возможных септических осложнений.
17.2.2.3. Нарушение глотания
Глотание - сложный рефлекторный акт, имеющий три фазы: ротовую (произвольную), глоточную (непроизвольную быструю) и пищеводную (непроизвольную медленную).
Дисфагия (нарушение глотания) определяется как ощущение «застревания» или препятствия прохождения пищи через полость рта, глотку или пищевод.
Нормальный транспорт пищевого комка через глотательный канал, образованный глоткой и пищеводом, зависит от размеров пищевого комка, диаметра просвета канала, его перистальтического сокращения, состояния глотательного центра.
Дисфагия, вызванная слишком большим размером пищевого комка или сужением просвета глотательного канала, называется механической. Дисфагия, связанная с некоординированными или слабыми перистальтическими сокращениями стенок канала, а также с нарушением глотательного центра, называется двигательной дисфагией.
Механическая дисфагия может быть обусловлена внутренним или наружным сдавлением просвета глотательного канала. Пищевод здорового человека благодаря эластичности его стенки имеет способность растягиваться до 4 см в диаметре. Если же эта способность ограничена до 2,5 см, возможна дисфагия, а при ограничении до 1,3 см дисфагия будет развиваться всегда. Причины развития механической дисфагии многочисленны. Они могут быть связаны, прежде всего, с изменением просвета канала (при слишком большом размере пищевого комка или попадании инородного тела). Возможно внутреннее сужение канала за счет воспалительного процесса (стоматит, фарингит, эпиглоттит, эзофагит), доброкачественных стриктур (пептические - под воздействием щелочей, кислот либо лекарственных препаратов, воспалительные - болезнь Крона, кандидоз, ишемические, послеоперационные, радиационные, врожденные), злокачественных (первичный рак, метастазы) или доброкачественных (ангиома, папиллома, полип) опухолей. Наружное сдавление глотательного канала может быть связано с шейным спондилитом, остеофитами позвоночника, заглоточным абсцессом, абсцессом средостения, увеличением щитовидной железы, аневризмой аорты, опухолями средостения, поджелудочной железы, гематомой (после ваготомии) и др.
Двигательная дисфагия возникает вследствие нарушения инициирования глотательного рефлекса, повреждения скелетных мышц глотки и пищевода или гладких мышц пищевода. Так, многие заболевания ЦНС приводят к дисфагии. Наиболее тяжелые расстройства глотания отмечаются при поражении ствола мозга, где располагаются нервные структуры, ответственные за иннервацию глоточной части участка прохождения пищевого комка. При этом происходят тяжелые нарушения начальной фазы глотания,
нередко труднообратимые. При цереброваскулярных заболеваниях результатами дисфагии могут стать аспирационная пневмония, дегидратация организма, потеря массы. Механизмы глотания нарушаются при таких заболеваниях ЦНС, как полиомиелит и болезнь Паркинсона, для которых характерны дизартрия, дисфагия из-за слабости мышц глотки и языка, амиотрофический латеральный склероз с возможной аспирацией во время или после глотания. Причиной дисфагии может стать также дистрофия мышц языка и глотки, что сопровождается носоглоточной регургитацией и носовым звучанием. Возможны поперхивания, аспирация пищей из-за слабости мышц, поднимающих глотку. Больные обычно переходят на медленный прием мелкоизмельченной пищи, а при прогрессировании нарушения глотания кормление осуществляется через носовой зонд. Подобные состояния развиваются, например, при дерматомиозите с нарушением функций верхнего пищеводного сфинктера и проксимальной поперечно-полосатой мускулатуры пищевода. При ряде заболеваний - столбняке, бешенстве, истерии - отмечается спазм глотательной мускулатуры. При этих заболеваниях может развиваться фагофобия - страх глотания и поэтому отказ от него, что, возможно, связано со страхом аспирации. К отказу от глотания может привести и болезненное глотание, например, при воспалительном процессе. Globus histericus - это ощущение «кома» в горле. Некоторые больные ощущают прохождение пищи по пищеводу, что может быть обусловлено и психосоматическими расстройствами.
Расстройство глотания отмечается при ботулизме, что вызвано нарушением передачи импульсов с нервов на мышцы, участвующие в акте глотания. При расстройстве глотания в большей степени затрудняется проглатывание воды, так как для этого необходимо максимальное закрытие отверстий, ведущих в нос и трахею, что возможно при интенсивном сокращении глотательной мускулатуры. Проглатывание воды резко нарушается при бешенстве, что послужило поводом к суждению о «водобоязни» при этой болезни.
Причинами развития двигательной (нейромышечной) дисфагии является и повреждение гладких мышц пищевода. Это отмечается при ахалазии пищевода, ряде коллагеновых болезней, особенно при склеродермии и метаболической нейромиопатии, связанной с приемом алкоголя, сахарным диабетом.
17.2.2.4. Нарушение двигательной функции пищевода
Двигательная функция пищевода может быть пониженной (гипокинез, или атония) или повышенной (гиперкинез). Атонию воспроизводят в эксперименте путем высокого перерезания n. vagus (И.П. Павлов), что вызывает снижение перистальтики пищевода и в связи с этим замедление продвижения пищевого комка. Затруднение продвижения пищи по пищеводу может произойти вследствие его спастического сокращения. Экспериментально спазм кардиальной части пищевода можно получить при раздражении симпатического нерва.
Основные двигательные расстройства, поражающие тело пищевода, наблюдаются при ахалазии, гастроэзофагальной рефлюксной болезни, диффузном спазме пищевода и склеродермии.
При ахалазии (отсутствии нормальной проходимости кардиального отдела пищевода) нарушается координация перистальтики из-за потери тормозной нервной регуляции гладких мышц тела пищевода и нижнего пищеводного сфинктера. Последний при глотании не может расслабиться в достаточной степени. В связи с этим пища задерживается в пищеводе, и он растягивается (мезофагия). Основными причинами ахалазии пищевода могут быть первичное неврологическое нарушение с поражением ствола мозга, блуждающего нерва, дегенеративные изменения интрамуральных нервных сплетений: мейснеровского и ауэрбаховского, а также гладких мышц пищевода. Основным механизмом этих нарушений является дефицит нейротрансмиттера, необходимого для мышечной релаксации. Вероятнее всего им является вазоактивный интестинальный полипептид (ВИП), что подтверждается снижением его уровня у больных с ахалазией кардии в сравнении со здоровыми. Под действием ВИП из нейронов пищевода высвобождается оксид азота, который является вазодилататором и одновременно релаксантом гладкой мускулатуры. Установлено, что при ахалазии уровень оксида азота в дистальных гладких мышцах пищевода снижается.
Довольно ранними признаками заболевания являются ощущения наполнения и сдавливания в груди. При прогрессировании болезни нарастает затруднение проглатывания пищи, связанное с чувством переполнения пищевода, возможен заброс (рефлюкс, регургитация) пищи в полость рта, что говорит о ее задержке в расширенном пищеводе. Эти нарушения усиливаются при эмо-
циональном стрессе и быстрой еде. Задержка пищи в пищеводе вызывает отвращение к ней и ведет к снижению массы больного. Регургитация пищи усиливается во время еды. Нередко в рот попадает непереваренная пища, съеденная несколько часов назад, возможна аспирация пищи в дыхательные пути (что может стать причиной смерти или служить причиной аспирационной пневмонии). Клиническими проявлениями ахалазии, кроме дисфагии и регургитации, могут быть боли в грудной клетке, которые объясняются высокой сократительной активностью пищевода, а также воспалительным процессом в его слизистой из-за застоя пищи. Вторично возникает изжога, связанная не с гастроэзофагальным рефлюксом, а с ферментативным расщеплением пищи в самом пищеводе и образованием большого количества молочной кислоты.
Другой вид патологии - чрезмерное расслабление нижнего пищеводного сфинктера (НПС, гастроэзофагальный сфинктер), что способствует желудочно-пищеводному рефлюксу. Снижение давления в НПС или увеличение числа эпизодов его спонтанного расслабления может быть связано с первичным дефектом гладких мышц сфинктера, в том числе обусловленным нарушением нервной регуляции (при снижении функции блуждающего нерва) либо снижением продукции гастрина, регулирующего функцию данного сфинктера. У детей первого года жизни этот сфинктер развит недостаточно, и поэтому после кормления легко наступает срыгивание пищи, которое нарастает при перекорме. Недостаточность НПС, способствующая желудочно-пищеводному рефлюксу, может отмечаться при системной склеродермии, беременности, а также у курящих. Часто недооценивают действие ряда лекарственных средств, которые могут снижать тонус гладких мышц, в том числе и НПС, и задерживать опорожнение желудка, способствуя таким образом появлению желудочно-пищеводного рефлюкса. Это может иметь место при применении нитратов, М-холинолитиков, трициклических антидепрессантов, прогестерона, простагландинов, антагонистов кальция, седативных средств, эуфиллина, β-адреноблокаторов, наркотических средств. Снижает тонус сфинктера и ряд пищевых продуктов, например алкоголь, шоколад, мята, жареные и жирные продукты, мука. Некоторые напитки с низким уровнем рН усиливают симптомы рефлюкса при эзофагите. К таким напиткам относятся кока-кола, пепси-кола (рН 2,5), красное вино (рН 3,25), апельсиновый сок (рН 3,5).
В результате заброса и длительной экспозиции желудочного содержимого в пищеводе возникают воспалительно-дегенеративные изменения, развивается желудочно-пищеводная (гастроэзофагальная) рефлюксная болезнь (рефлюкс-эзофагит). В развитии этой болезни важную роль, кроме снижения тонуса НПС, имеет значение нарушение пищеводной перистальтики, механизмов очищения пищевода от соляной кислоты (тщеводный клиренс): химического очищения - за счет уменьшения нейтрализующего действия слюны, бикарбонатов пищеводной слизи; и объемного очищения - из-за угнетения вторичной перистальтики и снижения тонуса стенки грудного отдела пищевода. Определенное значение придается повреждающим свойствам рефлюктанта (соляная кислота, пепсин, желчные кислоты), снижению резистентности слизистой оболочки пищевода к ацидопептическому повреждению, увеличению объема желудочного содержимого за счет гиперсекреции, задержке пищи в желудке, повышению внутрибрюшного давления и предрасположенности к недостаточности сфинктера.
Нормальная величина рН в пищеводе (5,5-7,0) снижается в случае рефлюкса до уровня ниже 4,0. О патологическом рефлюксе говорят в случае, когда число его эпизодов за сутки более 50 или когда продолжительность рефлюкса превышает 5 мин, а общая продолжительность периода, в течение которого отмечается падение интрапищеводного уровня рН ниже 4,0, превышает 1 ч в сутки. При выраженной степени рефлюкс-эзофагита отмечаются сливающиеся эрозии, покрытые экссудатом или отторгающимися некротическими массами, которые располагаются в дистальном отделе пищевода. Эрозивно-язвенный рефлюкс-эзофагит осложняется стриктурами; возможно замещение плоского неороговевающего эпителия слизистой пищевода цилиндрическим эпителием (пищевод Баррета). Наличие пищевода Баррета приводит к развитию наиболее грозного осложнения рефлюкс-эзофагита - аденокарциноме.
Диффузный спазм пищевода, так же как и ахалазия, связан с потерей тормозного контроля за гладкой мускулатурой пищевода при нормальном функционировании НПС. Возникают беспорядочные интенсивные сокращения всех отделов пищевода, что может вызывать загрудинные боли. Эти боли напоминают стенокардию и также снимаются нитратами, снижающими тонус пищевода. Как вторичное осложнение наблюдается дисфагия.
Причиной двигательной дисфагии может быть и системная склеродермия с поражением пищевода. Это заболевание относится к коллагенозам. Наряду с поражением кожи и мышц изменяются внутренние органы. Наиболее часто среди органов пищеварения поражается именно пищевод. Происходит прогрессирующее замещение гладкой мускулатуры пищевода и НПС плотной фиброзной тканью, что приводит к потере перистальтики пищевода и снижению давления НПС. Возникают дисфагия и кислый гастроэзофагальный рефлюкс (изжога, кислая отрыжка, срыгивание). Возможно образование пищевода Баррета.
Нарушение прохождения пищи по пищеводу возникает при образовании в нем дивертикулов - выпячивания стенки. В дивертикуле могут застаиваться и загнивать пищевые массы. Возможно истончение стенки дивертикула с последующим разрывом, кровотечением и инфицированием средостения.
Грыжи пищеводного отверстия диафрагмы - в 10% случаев это постоянная, круговая диафрагмальная грыжа, чаще (в 90% случаев) встречается непостоянная, скользящая грыжа, появляющаяся в случае усиления перистальтики. Причинами образования грыж являются: резкое усиление внутрибрюшинного давления при усиленной физической нагрузке и врожденное недоразвитие соединительнотканных структур. При развитии грыж пищеводного отверстия развивается рефлюкс-эзофагит, возможно ущемление грыж с возникновением пищеводно-желудочного кровотечения.
Гипертрофия кардии - наследственное заболевание, для которого характерно увеличение массы циркулярных мышц нижней части пищевода с одновременным повышением их тонуса. В результате скорость перемещения пищи замедляется, пищевод растягивается, появляются чувство дискомфорта и загрудинная боль.
Варикозное расширение вен внутри стенки пищевода возникает при портальной гипертензии. В случае резкого растяжения пищевода при рвоте возможен разрыв этих истонченных сосудов, что в 40% случаев приводит к летальному исходу.
17.2.3. Нарушения пищеварения в желудке
Нарушения пищеварения в желудке связаны с расстройством его функций: секреторной, резервуарной, эвакуаторной, двигательной, всасывательной, выделительной и др.
17.2.3.1. Нарушение секреторной функции желудка
Нарушение секреторной функции желудка включает в себя изменения количества желудочного сока, кислотности, образования пепсина и слизи. Соляная кислота и пепсин необходимы для химической обработки пищи. Главным стимулятором образования соляной кислоты служит гастрин, вырабатываемый G-клетками желудочно-кишечного тракта. Гастрин стимулирует выделение HCl и ферментов желудка, усиливает кровообращение желудка (является трофическим гормоном), усиливает моторику антрального отдела желудка, но тормозит опорожнение желудка, стимулирует выделение инсулина. Секрецию гастрина увеличивают: раздражение вагуса, прием белковой пищи, избыток ионов Са, прием кофеина, этанола. Секрецию гастрина снижают: гиперсекреция HCl, действие соматостатина, секретина, глюкагона.
Основными стимуляторами секреции соляной кислоты в желудке, кроме гастрина, являются гистамин и ацетилхолин. В ответ на раздражение n. vagus повышается концентрация гастрина, вырабатываемого G-клетками антрального отдела желудка, что ведет к повышению секреции соляной кислоты (синтетический аналог гастрина - пентагастрин используется в качестве стимулятора секреции НС1). Гастрин и ацетилхолин активируют специфические рецепторы, связанные с системой кальций/протеинкиназа С. После активации соответствующих механизмов происходит стимуляция водородно-калиевых (H+/K+) АТФазных каналов, приводящая к продукции и выделению ионов водорода.
Желудок выделяет до 2 л жидкости в сутки. Количественные изменения секреции желудочного сока выражаются в увеличении (гиперсекреции) и уменьшении (гипосекреции). Это может сочетаться с изменениями выработки соляной кислоты париетальными клетками и пепсиногена - главными клетками, расположенными в трубчатых железах преимущественно дна и тела желудка. Выработка соляной кислоты может повышаться (гиперхлоргидрия) или понижаться (гипохлоргидрия). Возможны сочетания гиперсекреции с гиперхлоргидрией и гипосекреции с гипо- и ахлоргидрией.
К методам исследования секреторной функции желудка относят метод фракционного желудочного зондирования и РН-метрию. Метод фракционного желудочного зондирования заключается в получении желудочного сока через зонд, введенный в желудок на-
тощак через 12 ч после приема пищи. При этом получают: «тощаковую» порцию - отсасывают содержимое из желудка через 5 минут после введения зонда, «базальную» секрецию - 4 порции через каждые 15 минут в течение одного часа, «стимулированную секрецию» - 4 порции через каждые 15 минут в течение одного часа после стимуляции раздражителем. Применяют субмаксимальную стимуляцию гистамином (0,01%, 0,1 мл/10 кг массы) и максимальную стимуляцию пентагастрином (6 мкг/кг массы, синтетический препарат гастрина) или гисталонгом (2 мкг/кг). В каждой порции сока определяют: объем, кислотность (свободная, связанная с белками и общая НС1), дебит-НС1 - абсолютная кислотная продукция за 1 час, содержание пепсина (по способности желудочного сока переваривать белки), коэффициент расслоения (по соотношению жидкого и плотного слоев) (табл. 17-1).
Таблица 17-1. Нормальные показатели желудочного сока
Показатели | Натощак | Базальная секреция | Стимулированная секреция |
Объем желудочного сока, мл | 5-40 | ||
Часовое напряжение, мл | 50-100 | 100-140 | |
Общая НС1, титр. ед. | 20-30 | 40-50 | 60-100 |
Свободная НС1, титр. ед. | 0-15 | 20-40 | 65-85 |
Дебит-час НС1, мэкв ммоль/ч | Не определяется | 1,5-5,5 55-100 | 8-14 300-500 |
Дебит-час пепсина, мг/ч | Не определяется | 10-40 | 50-90 |
Коэффициент расслоения, жидкий/ плотный | Не определяется | 1:1-1:2 | 1:1-1:2 |
Необходимо отметить, что термин «свободная HC1» является условным (ионы водорода связываются белковыми молекулами и ионами бикарбоната, поэтому можно разделить ионы водорода на связанные и свободные). В связи с этим отсутствие свободной соляной кислоты не говорит об ахлоргидрии, а только констатирует снижение концентрации водородных ионов до рН 3,5 и ниже. Судить о повышенной или о пониженной кислотообразующей функции желудка следует по определению абсолютной продукции (дебит) соляной кислоты (ммоль/ч), где учитывается количество секреции
желудочного сока в миллилитрах (мл) и концентрация общей соляной кислоты в миллимолях (ммоль) в каждой порции желудочного сока в фазах базальной и стимулированной секреции.
О нарушении кислотообразования судят с учетом возраста, пола (у женщин кислотность ниже на 20%) и массы больного (с увеличением массы показатели кислотности нарастают). Учитывая большую вариабельность в показателях секреторной функции желудка, о нарушениях ее говорят только при грубых отклонениях от нормальных показателей секреции с учетом погрешностей метода определения данной функции. К недостаткам метода относят: необходимость непрерывного отсоса желудочного сока, исследование in vitro, определение в основном только общей НС1. Кроме того, при оценке этим методом дебит соляной кислоты зависит от того, чем и что титруют (могут быть примеси слизи, желчи, которые имеет щелочную рН).
Более точным методом оценки кислотообразующей функции желудка является рН-метрия - пристеночное определение рН. Его проводят с помощью специальных приборов с рН-зондами, которые обследуемому вводят трансназально (через нос). Можно проводить 3-часовую рН-метрию и суточное мониторирование рН. К достоинствам этого метода относят: возможность проводить рНметрию в каждом отделе желудка, функциональные пробы стимулирующего и угнетающего характера и подбирать соответствующую лекарственную терапию, определять истинную ахлоргидрию, что имеет большое значение в диагностике предракового состояния при атрофических гастритах.
Пищеварение при гиперсекреции и гиперхлоргидрии. При гиперсекреции и гиперхлоргидрии отмечается натощак наличие кислого желудочного сока более 50 мл с концентрацией соляной кислоты до 40 ммоль.
Стимуляция секреторной функции желудка осуществляется
при участии блуждающего нерва посредством гастрина, гистамина, глюкокортикоидов, инсулина, тироксина и др. Кроме того, некоторые лекарства, острая и горячая пища, специфические компоненты пищи, такие, как пептиды, аминокислоты, кофеин, алкоголь, кальций, которые стимулируют выработку гастрина, могут стимулировать желудочную секрецию.
В рефлекторную фазу секреция желудочного сока усиливается от вида, запаха и вкуса пищи, что происходит через влияние п. vagus. В желудочную фазу секреции отмечается механическое рас-
тяжение желудка пищей, воспринимаемое рецепторами растяжения в стенке желудка, что реализуется через рефлекторные дуги, включающие блуждающий нерв.
Гиперхлоргидрия в желудке отмечается при синдроме Золлингера- Эллисона (гастринома), обусловленном гастринобразующей опухолью, которая располагается в поджелудочной железе (65-75%) или в других органах (желудок, двенадцатиперстная кишка (ДПК), печень, яички, брыжейка, лимфатические узлы, жировая клетчатка брюшной полости). Обычно это множественная опухоль. Выделение гастрина клетками опухоли вызывает стойкую желудочную гиперсекрецию, с которой связаны основные проявления болезни: язвообразование, расстройство пищеварения и диарея. Более чем у 90% больных с гастриномами развиваются язвенные дефекты верхних отделов желудочно-кишечного тракта. Язвы резистентны к стандартной терапии, имеют непрерывно-рецидивирующее течение, склонны к тяжелым осложнениям: перфорации, пенетрации и кровотечениям. Даже хирургическая операция по поводу осложнений язв не останавливает рецидивирование болезни. Кроме пептических язв, общими проявлениями синдрома Золлингера- Эллисона служат диарея и синдром малдигестии (нарушение переваривания). Патогенез диареи при этом синдроме сложен и в основном связан с гиперсекрецией желудочного сока, достигающей нескольких литров в день. Кроме того, причиной диареи может быть инактивация панкреатических ферментов желудочным соком повышенной кислотности, что приводит к стеаторее и к синдрому малдигестии. Из-за снижения рН в тонкой кишке повреждается слизистая оболочка с развитием синдрома мальабсорбции (нарушение всасывания). Возможно развитие «секреторной» диареи, так как гипергастринемия повышает секрецию калия и уменьшает абсорбцию натрия и воды в тонкой кишке.
Кроме стимулирующего воздействия на секрецию кислоты, гастрин обладает выраженным трофическим действием на ткани желудочно-кишечного тракта. Он усиливает синтез ДНК и белков в клетках слизистой оболочки желудка и в других тканях. Гипергастринемия при синдроме Золлингера-Эллисона вызывает два синергических эффекта: гиперстимуляцию париетальных клеток желудка и, как следствие, значительное увеличение секреции кислоты и количества секретирующих париетальных клеток.
Главным дифференциально-диагностическим признаком этого синдрома является гипергастринемия. Средний уровень гастрина у
здоровых и больных язвенной болезнью - меньше 150 нг/мл, уровень же гастрина у больных с синдромом Золлингера-Эллисона значительно выше - >1000 нг/мл. В то же время необходимо знать, что гипергастринемия может быть не только первичной, способствующей повышению уровня соляной кислоты (как это имеет место при синдроме Золлингера-Эллисона), но и вторичной вследствие гипо- и ахлоргидрии. Наиболее частая причина гипергастринемии - атрофия фундальной слизистой желудка, так как соляная кислота является основным ингибитором высвобождения гастрина. Отсутствие соляной кислоты приводит к неугнетаемой секреции гастрина, гиперплазии клеток антрального отдела желудка, что часто имеет место при пернициозной анемии. В связи с этим определение кислоты желудочного сока играет важную роль в дифференциальной диагностике синдрома гипергастринемии.
Раннее выявление и удаление опухоли являются основой для лечения синдрома Золлингера-Эллисона.
При гиперсекреции соляной кислоты возникают условия для стойкого спазма привратника, так как для нейтрализации чрезмерно кислого содержимого желудка в ДПК требуется много времени. При спазме привратника пища длительное время находится в желудке, желудок переполнен, возможно возникновение изжоги, отрыжки кислым, иногда рвоты, возникает болевой синдром, снижается эвакуаторная функция желудка. В кишечник поступает более гомогенная пища, снижается перистальтика кишечника, появляется склонность к запорам, аутоинтоксикация.
Пищеварение при гипосекреции и гипохлоргидрии. Снижение секреции желудочного сока развивается при увеличении тонуса симпатической нервной системы, действии глюкагона, секретина, холецистокинина, энтерогастрона. Секретин, холецистокинин, энтерогастрон относят к дуоденальному тормозному механизму желудочной секреции. Соматостатин в норме ингибирует освобождение гастрина и секрецию соляной кислоты в желудке. Снижение секреции желудочного сока развивается также при значительных структурных изменениях, касающихся железистого слоя желудка, уменьшении количества клеток, продуцирующих желудочный сок.
При снижении кислотообразования пепсин не активен, и белки не перевариваются. Больные могут жаловаться на отрыжку «тухлым», так как уменьшается бактерицидное действие соляной кислоты, усиливаются процессы гниения и брожения. Снижение выработки соляной кислоты приводит к избыточной колонизации
желудочно-кишечного тракта бактериями. Эвакуация пищевого химуса из желудка обычно ускоряется, так как нейтрализация его в ДПК происходит быстро. Создаются условия для зияния привратника. Быстро поступающие в ДПК большие порции желудочного содержимого хуже пропитываются дуоденальным соком. Дуоденальное пищеварение страдает из-за снижения желудочной секреции и секреции панкреатического сока, выделение которого стимулируется соляной кислотой. Пищевой грубый химус, не подготовленный для всасывания, поступает в нижележащие отделы кишки. Усиливается перистальтика, вызывающая диарею, нарастают синдромы малдигестии (нарушение в основном полостного пищеварения) и мальабсорбции (нарушение всасывания). Ранним признаком последнего является стеаторея (после приема жирных продуктов питания). Снижается масса тела, возникают гиповитаминозы, нарушения электролитного обмена, обезвоживание, значительные обменные расстройства.
Ахлоргидрия может сочетаться с ахилией (отсутствием в желудочном соке пепсина). Выделяют функциональную и органическую ахилию. При функциональной ахилии желудочная активность и деятельность главных клеток сохранены, но функция их заторможена. Это обратимое состояние, возникновение которого возможно при стрессовых ситуациях, авитаминозах (цинга, пеллагра). Отмечается нестойкий характер ахилии, меняющийся в зависимости от раздражителя секреции и условий проведения исследования. Органическая ахилия развивается при выраженном атрофическом гастрите. Функциональная неполноценность, а затем и структурные изменения в деятельности главных клеток развиваются позднее, чем в обкладочных клетках. Органическая ахилия всегда сопряжена с тяжелым синдромом малдигестии и нередко сочетается с пернициозной (В12-дефицитной) анемией.
17.2.3.2. Нарушение резервуарной и эвакуаторной функций желудка
Эвакуация пищевых масс из желудка в ДПК происходит, когда пища становится жидкой, а предыдущая порция кислого химуса нейтрализуется дуоденальным соком. Патология эвакуации выражается в ускорении или замедлении эвакуации.
Ускорение эвакуации наблюдается при гипосекреции желудочного сока, ахилии, ахлоргидрии, приеме гипоосмолярной пищи, а также пищи, богатой углеводами.
Замедление эвакуации отмечается при гиперсекреции желудочного сока, попадании в желудок большого количества пищи, особенно плохо разжеванной, на измельчение которой (до размера менее 1 мм) требуется много времени. При попадании в желудок большого объема пищи нарушаются «просеивание» крупных ее частиц и их измельчение, осуществляемое за счет сокращения антрального отдела, что, в свою очередь, ухудшает абсорбцию пищевых веществ. Растяжение желудка большим объемом пищи усиливает перистальтические сокращения антрального отдела и проталкивание пищи к привратнику и ДПК, что может сопровождаться болевыми ощущениями. Замедление эвакуации отмечается также при приеме гипертонических растворов и гиперосмолярной, белковой и особенно жирной пищи, способствующей выработке энтерогастрона в слизистой кишечника, который относят к дуоденальному тормозному механизму (тормозит моторику). Замедляется опорожнение желудка при перерастяжении ДПК и уменьшении секреции панкреатического сока и желчи, которые нейтрализуют кислый химус. Резервуарная и эвакуаторная функции страдают при оперативных вмешательствах на органах брюшной полости, желудке, при частичной его резекции, наложении гастроэнтерального анастомоза, рубцовых изменениях желудка вследствие язвенной болезни либо после химических ожогов. Все это препятствует нормальному прохождению пищевого химуса и нарушает функции перемешивания и эвакуации.
Эвакуаторная функция снижается после травм живота, при нарушении кровообращения органов брюшной полости. Кроме того, иногда при острых, особенно кишечных инфекциях возможно рефлекторное торможение тонуса и перистальтики желудка с нарушением функции эвакуации. Расстраивается эта функция у пожилых людей вследствие атрофии слизистой желудка и, возможно, под влиянием медикаментов, при стенозе привратника у взрослых в результате опухолей, рубцового сужения или при врожденном пилоростенозе - гипертрофии мышц слоя пилорического отдела желудка.
При замедлении эвакуации отмечается задержка в желудке пищевых масс, жидкости, газов. Стенка желудка растягивается, истончается, ослабляются его перистальтика и тонус, снижается секреция желудочного сока. При длительной задержке пищевых масс расширенный желудок оказывает давление на диафрагму, ДПК, возникают тошнота, рвота, что ведет к потере жидкости, хлори-
дов. Как следствие этого, могут возникнуть нарушение кислотнощелочного равновесия в сторону алкалоза, обезвоживание, коллапс и кома.
17.2.3.3. Нарушение двигательной функции желудка
В норме движения желудка выражаются в виде перистальтики - волнообразного сокращения стенки желудка, которое продвигает пищу от кардиального к пилорическому отделу, и перистолы - тонического напряжения мускулатуры, которое способствует размельчению пищи.
При патологических состояниях перистальтика желудка может быть усиленной (гипертонус) либо ослабленной (гипотонус, атония)
(рис. 17-1).
Возникновение нарушений со стороны двигательной активности желудка связано в основном с непосредственным ответом гладких мышц на влияние целого ряда нейромедиаторов и гормонов при участии рецепторов. Возможна патология гладкой мускулатуры и пейсмекера желудка (например, при хирургической перерезке блуждающего нерва). Стволовая ваготомия приводит к повышению тонуса проксимальных отделов желудка с одновременным снижением фазной активности его дистальных отделов. Из желудка при этом ускоряется эвакуация жидкости и замедляется эвакуация твердого химуса. При повышении тонуса n. vagus
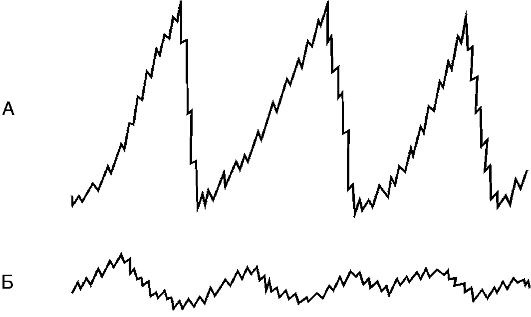 Рис. 17-1. Гастрограмма: А - гипертонус желудка; Б - гипотонус желудка
Рис. 17-1. Гастрограмма: А - гипертонус желудка; Б - гипотонус желудка
усиливаются ритм и сила сокращений желудка, и ускоряется эвакуация его содержимого в ДПК. Напротив, активация симпатических нервов снижает ритм, силу сокращений желудка и скорость распространения перистальтической волны.
На моторную активность желудка оказывают влияние гастроинтестинальные гормоны и гормоны общего действия. Секретин, холецистокинин-панкреозимин, энтерогастрон, глюкагон угнетают моторику желудка и скорость эвакуации из него пищи. Усиление моторики желудочно-кишечного тракта происходит под влиянием гастрина, мотилина, гистамина, серотонина, инсулина.
Угнетают моторику желудка гипосекреция желудочного сока (гипо- и ахлоргидрия), бульбогастрон, глюкагон, лихорадка, голодание.
Среди других причин расстройств двигательной активности желудка нередко отмечают действие целого ряда лекарственных препаратов, в частности гипотензивных средств, особенно антагонистов кальция, в большей степени длительно действующих (пролонгированных), группы раувольфии, производных α-метилдопы, психотропных, антихолинергических препаратов, нитратов, спазмолитиков.
Нарушение двигательной активности желудка отмечается и при заболеваниях эндокринной (гипотиреоз, гиперпаратиреоз, сахарный диабет), нервной (менингит, энцефалит, опухоль мозга) систем, ряде инфекционных болезней (болезнь Боткина, кишечные инфекции), нарушениях метаболизма, электролитных расстройствах, нередко при психических заболеваниях (нейрогенная анорексия, неукротимая рвота). В каждой из перечисленных болезней наличие расстройств двигательной активности желудка может быть связано со сложным механизмом, включающим нарушения нервной, гормональной регуляции, электрического ритма и функций гладкой мускулатуры желудка. Так, например, нарушение опорожнения желудка может развиться при длительном течении сахарного диабета, осложненного висцеральной нейропатией, которая проявляется расстройством вегетативных функций не только желудка, но и желчного пузыря, мочевого пузыря, кишечника. Гастропарез у больных сахарным диабетом чаще всего обусловлен висцеральной нейропатией, но не исключено влияние и снижающих содержание сахара препаратов, психогенных факторов.
Первичное изменение мускулатуры желудка может иметь место при ряде коллагенозов, в частности при склеродермии и дермато-
миозите. Значительные нарушения двигательной активности желудка отмечаются при хирургических операциях.
Нарушения двигательной функции желудка проявляются такими симптомами, как изжога, отрыжка, икота, тошнота и рвота.
Изжога (pyrosis) - ощущение тепла или жжения в нижнем отделе пищевода (может локализоваться за грудиной или в верхней части эпигастральной области), распространяющееся снизу вверх - из эпигастральной области до шеи. Изжога, как правило, является результатом заброса кислого (рН<4,0) содержимого желудка или желчи в пищевод с антиперистальтической волной при открытом кардиальном сфинктере (т.е. связана с гастроэзофагальным рефлюксом). На уровне контакта с желудочным содержимым возникает спазм пищевода, выше - его антиперистальтика. Интенсивность проявлений этого зависит от концентрации кислоты в желудочном содержимом, частоты и длительности его контакта со слизистой оболочкой пищевода. Изжога усиливается после еды, особенно обильной, при наклонах туловища, в положении лежа, при патологии мышц брюшного пресса. Она может сопровождаться самопроизвольным появлением во рту жидкости, которая может быть кислой, солоноватой (содержимое желудка или «кислая отрыжка») или горькой, имеющей желтый или зеленый цвет (желчь).
Изжога может возникнуть после употребления ряда пищевых продуктов: жиров, кислых фруктовых соков, томатов, чеснока, лука, перца и т.д. или лекарственных препаратов, снижающих тонус нижнего пищеводного сфинктера, - теофиллина, прогестерона, антидепрессантов, нитратов, антагонистов кальция и др. Изжога обычно уменьшается при глотании слюны, питье воды и наиболее отчетливо при приеме антацидных препаратов.
Отрыжка (eructatio) - внезапное попадание в полость рта небольшой порции содержимого желудка или пищевода. Обычно в желудке содержится небольшое количество газов (газовый пузырь), стимулирующих его двигательную и секреторную функции. Небольшое количество воздуха заглатывается во время еды. От 20 до 60% газа, находящегося в кишечнике, приходится на долю заглатываемого воздуха (доказательством этого является наличие азота и кислорода, присутствующих в атмосфере и не продуцирующихся в пищеварительном тракте). Накопление воздуха в желудке может вызвать ощущение переполнения, перерастяжения его после еды, что доказывается при рентгенологическом исследовании
брюшной полости. Острое растяжение желудка проглатываемым воздухом чаще возникает после обильного приема пищи и сопровождается выраженным болевым синдромом, напоминающим стенокардию. В положении лежа на спине может развиться синдром желудочного пузыря, когда находящийся в желудке воздух оказывается загнанным в ловушку (ниже места соединения пищевода с желудком) давлением расположенной над ним жидкости, так что этот воздух невозможно отрыгнуть.
Аэрофагия (заглатывание воздуха вне приема пищи) чаще наблюдается при неврогенных состояниях.
Различают отрыжку воздухом и отрыжку пищей. Отрыжка пищей может быть кислой или горькой (примесь желчи), а также гнилостной (при застое пищи в желудке). Стойкая отрыжка пищей является характерным симптомом недостаточности кардиального сфинктера и ряда заболеваний органов брюшной полости: язвенной болезни желудка и ДПК, активного гастродуоденита, гастроэзофагальной рефлюксной болезни, рака желудка, пищевода. При атрофическом гастрите, когда зияет привратник, повышенное газообразование в желудке нередко связано с газообразованием в кишечнике, при этом газ беспрепятственно попадает в желудок. Отрыжка, особенно горьким, чаще возникает при патологии гепатобилиарной системы. Кроме того, отрыжка может возникнуть рефлекторно, например, при заболеваниях сердечно-сосудистой системы.
Часть проглатываемого воздуха проходит дальше через привратник в кишечник, что вызывает его вздутие. Воздух может оказаться в ловушке в селезеночном изгибе толстой кишки (это синдром левого изгиба ободочной кишки), когда возникает ощущение переполнения в левом верхнем квадранте живота с возможной иррадиацией в левую половину грудной клетки. Облегчение боли нередко возникает после дефекации или выделения газов из кишечника.
Икота (singultus) наступает в результате сочетания быстрого спазма диафрагмы, судорожного сокращения желудка и внезапного сильного вдоха при сужении голосовой щели. Икота может наблюдаться при заболеваниях желудочно-кишечного тракта и других органов брюшной полости, при этом чаще возникает рефлекторно при возбуждении центра диафрагмального нерва. Наблюдается икота и при заболеваниях средостения, плевры, брюшины, когда происходит непосредственное раздражение диафрагмы или диафрагмального нерва.
Тошнота (nausea) - это неприятное безболезненное субъективное ощущение надвигающегося желания выполнить рвотный акт. Тошнота чаще предшествует рвоте, чем сопутствует ей. Однако тошнота и рвота могут возникнуть независимо друг от друга. При тошноте возникают различные физиологические реакции. В связи с близким расположением к центру рвоты ядер языкоглоточного и лицевого нервов (которые иннервируют слюнные железы) нередко наблюдается гиперсаливация. При тошноте часто развивается тахикардия, вероятно, как следствие стрессорной реакции на возможную рвоту. Возникают слабость, повышенное потоотделение, бледность кожных покровов, похолодание конечностей, падение артериального давления вследствие возбуждения парасимпатического, а затем и симпатического отделов вегетативной нервной системы. Возможно развитие гипотензии с брадикардией (вазовагальный синдром). При тошноте нарушается моторика желудочно-кишечного тракта и снижается секреторная функция желудка. Ощущение тошноты связывают с антиперистальтическими движениями желудка. Тошнота часто сопровождается анорексией, т.е. утратой желания есть или отказом от пищи. Вслед за продолжающейся в течение некоторого времени тошнотой и кратковременными периодами позывов на рвоту развивается последовательность непроизвольных висцеральных и соматических двигательных актов, приводящих к возникновению рвоты.
Рвота (vomitus) - сложный рефлекторный акт, в результате которого содержимое желудка извергается наружу. В процессе рвоты желудок играет сравнительно пассивную роль. Выталкивание его содержимого обеспечивается мышцами живота. При расслаблении дна желудка и желудочно-пищеводного сфинктера происходит увеличение внутрибрюшного давления из-за непроизвольного сокращения диафрагмы и брюшной стенки (наружных косых мышц живота). Такое сокращение вместе с происходящим сокращением привратника приводит к выталкиванию содержимого желудка в пищевод. Повышение внутрибрюшного давления способствует дальнейшему продвижению содержимого по пищеводу в полость рта. Рефлекторный подъем мягкого неба во время рвоты предотвращает попадание содержимого желудка в носовую часть глотки, а рефлекторное закрытие голосовой щели и угнетение дыхания препятствуют аспирации содержимого желудка в дыхательные пути.
При рвоте возникают нарушения моторики желудочно-кишечного тракта. Тонус дна желудка и перистальтика желудка обычно
снижаются, тонус же ДПК и проксимального отдела тощей кишки повышается, и перистальтика может принимать обратное направление (антиперистальтика). В последнем случае возникает дуоденогастральный рефлюкс, и это объясняет примесь желчи в рвотных массах из двенадцатиперстной кишки. Роль антиперистальтики при рвоте хорошо показана в экспериментах на животных (кошки, собаки), которым в полость желудочков мозга вводились вещества, стимулирующие рвоту. Установлено, что перед актом рвоты наблюдается изменение электрической активности кишечника с усилением электропотенциалов в проксимальном направлении. Клинически антиперистальтика кишечника проявляется частым присутствием содержимого кишечника в рвотных массах. При кишечной непроходимости возможна рвота с примесью кала.
Рвотный акт находится под контролем двух функционально различных центров, расположенных в продолговатом мозгу: рвотного центра и хеморецепторной тригерной зоны. Эти центры располагаются рядом с другими центрами ствола мозга, регулирующими вегетативные функции. Афферентный путь рвотного рефлекса идет по чувствительным волокнам блуждающего нерва в центр рвоты, который расположен в нижней части дна IV желудочка, рядом с дыхательным и кашлевым центрами. Центробежные импульсы к эффекторам распространяются по двигательным волокнам блуждающего нерва, по диафрагмальному, спинным и чревным нервам (рис. 17-2).
Рвотный центр контролирует и объединяет в единое целое рвотный акт. Он получает афферентные сигналы от кишечника, из других частей тела, из вышерасположенных кортикальных центров, особенно из аппарата внутреннего уха и триггерной хеморецепторной зоны. Важными эфферентными проводящими путями при рвоте являются диафрагмальные нервы (к диафрагме), спинно-мозговые нервы (к мышцам брюшной стенки) и висцеральные эфферентные нервы (к желудку и пищеводу).
Чаще рвота возникает при раздражении рецепторов желудка недоброкачественной пищей, токсическими веществами, в частности суррогатами алкоголя, а также при высокой возбудимости этих рецепторов в условиях патологии. В таких случаях рвоту называют желудочной. Рефлексогенными зонами рвотного акта являются также задняя стенка глотки, илеоцекальная область кишки. Возможна стимуляция центра рвоты с рецепторов брюшины, желчных протоков, желчного пузыря, почек, мочевых путей, коронарных
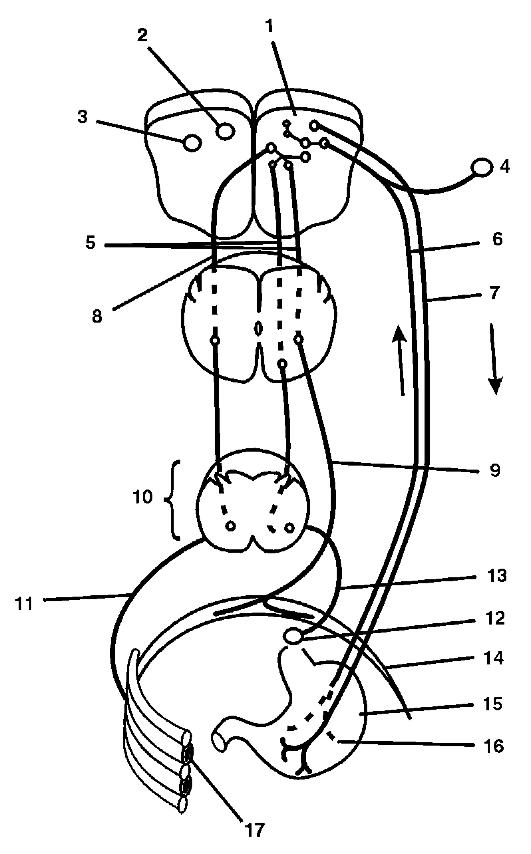 Рис. 17-2. Схема рвотного рефлекса: 1 - рвотный центр; 2 - дорсальное моторное ядро блуждающего нерва; 3 - nucl. et tr. solitaruis; 4 - g. nodosum; 5 - tr. reticulo-spinalis ventralis; 6 - афферентные волокна блуждающего нерва; 7 - эфферентные волокна блуждающего нерва; 8 - tr. reticulospinal lateralis; 9 - n. frenicus; 10 - грудной отдел спинного мозга; 11 - n. intercostalis; 12 - g. coeliacum; 13 - n. splanchnicus; 14 - диафрагма; 15 - желудок; 16 - чувствительные волокна блуждающего нерва; 17 - наружные мышцы живота
Рис. 17-2. Схема рвотного рефлекса: 1 - рвотный центр; 2 - дорсальное моторное ядро блуждающего нерва; 3 - nucl. et tr. solitaruis; 4 - g. nodosum; 5 - tr. reticulo-spinalis ventralis; 6 - афферентные волокна блуждающего нерва; 7 - эфферентные волокна блуждающего нерва; 8 - tr. reticulospinal lateralis; 9 - n. frenicus; 10 - грудной отдел спинного мозга; 11 - n. intercostalis; 12 - g. coeliacum; 13 - n. splanchnicus; 14 - диафрагма; 15 - желудок; 16 - чувствительные волокна блуждающего нерва; 17 - наружные мышцы живота
сосудов, перепончатого лабиринта внутреннего уха и др. Рвоту, вызываемую импульсами с периферических рефлексогенных зон, называют периферической.
Рвота может иметь центральное происхождение и возникать при патологических процессах в области IV желудочка (опухоль либо воспалительный процесс). Центр рвоты может раздражаться ядами или токсинами, при токсикозах беременных, употреблении токсических продуктов, лекарственных препаратов, нарушении обмена веществ при почечной и печеночной недостаточности, при кетоацидозе и т.д. Рвота может возникнуть по механизму условного рефлекса - при неприятном запахе, виде несъедобной пищи. В лаборатории И.П. Павлова в 1914 г. была воспроизведена
условно-рефлекторная рвота у собаки при сочетании индифферентного раздражителя (звук дудки) с инъекциями апоморфина.
Рвота может быть острой, что наблюдается при отравлении как защитная реакция, направленная на очищение желудочнокишечного тракта от токсинов, веществ недоброкачественной пищи. Острая рвота может быть связана с острым процессом в брюшной полости, таким, как кишечная непроходимость, ущемление грыжи, что сопряжено и с болевым синдромом. Острая боль с явлением рвоты возникает при перфорации язвы желудка и двенадцатиперстной кишки, остром аппендиците. Подобный симптом не всегда связан с патологией желудочно-кишечного тракта, а может быть обусловлен и патологическим процессом в гепатобилиарной системе (острый холецистит, острый гепатит, острый панкреатит, желчекаменная болезнь), патологией сердечно-сосудистой системы (острый инфаркт миокарда, расслаивающая аневризма аорты), почек (нефролитиаз). Повторная рвота, чаще после приема пищи, облегчающая состояние больного, характерна для язвенной болезни желудка или двенадцатиперстной кишки в период обострения. При стенозе привратника рвота возникает чаще к вечеру и пищей, съеденной накануне.
Рвота, особенно повторная, приводит к целому ряду метаболических нарушений. Чаще всего это метаболический алкалоз, гипокалиемия и гипонатриемия. Метаболический алкалоз является следствием повышения концентрации бикарбонатов в плазме крови, что обусловлено: 1) снижением концентрации H+ во внеклеточной жидкости; 2) потерей жидкости, содержащей хлориды в больших концентрациях, чем концентрация бикарбонатов во внеклеточной жидкости; 3) увеличением концентрации бикарбонатов при введении соды и иных веществ, превращающихся в бикарбонат во внеклеточной жидкости.
Гипокалиемия развивается в результате потери калия с рвотой и его малого поступления с пищей. Гипонатриемия также развивается вследствие выведения натрия с рвотными массами и, возможно, с мочой по причине метаболического алкалоза.
17.2.3.4. Нарушение всасывательной функции желудка
В норме эта функция невелика. При патологических состояниях желудка она может значительно усиливаться. Так, при застое пищи в желудке через его стенку могут всасываться полипептиды, что
вызывает интоксикационный синдром и аллергизацию организма. Усиление этой функции может отмечаться при воспалительнодистрофических процессах, в частности при хроническом гастрите, когда слизистая оболочка желудка становится проницаемой для токсинов и продуктов переваривания пищи.
17.2.3.5. Нарушение выделительной функции желудка
Выделительная (экскреторная) функция желудка является одним из экстраренальных путей выведения метаболитов из кровотока для обеспечения гомеостаза. В полость желудка выделяются продукты обмена, а также попавшие в организм вещества, пребывание которых в нем излишне или вредно. Экскреторная функция желудка благоприятствует деятельности почек, предохраняя их от излишнего напряжения. Роль этой функции особенно возрастает при различных патологических состояниях организма или при чрезвычайных воздействиях на него, вызывающих выраженные изменения в обмене веществ. Экскреторная функция желудка тесно взаимосвязана с другими его функциями, что обеспечивается общими регуляторными механизмами.
Стенкой желудка могут выделяться в его полость циркулирующие в крови метаболиты (мочевина, мочевая кислота, креатин, креатинин). И.П. Павлов подчеркивал роль выделительной функции желудка как важного фактора дезинтоксикации организма, как «физиологической меры защиты». Так, например, при хронической почечной недостаточности содержание мочевины, креатинина в желудочном соке и в слюне значительно нарастает. С усилением экскреции стенкой желудка продуктов клеточного распада связывают развитие гастритических изменений в слизистой желудка после тяжелых инфекционных заболеваний и других болезней.
У собак, подвергнутых перегреванию, отмечается появление в желудочном соке молочной кислоты. Экскреция желудком большого количества азотосодержащих веществ отмечается у подопытных животных при полном голодании. Подобная ситуация при длительном голоде возникает и у человека. Эти вещества затем всасываются в кишечнике и используются организмом для питания жизненно важных органов. Так, у больных с длительными хроническими гнойными процессами отмечается непрерывная секреция желудочного сока, где концентрация соляной кислоты снижена, а присутствует высокое содержание азотистых веществ. Последние
всасываются в кишечнике. Однако процесс всасывания отстает от экскреции, и это один из факторов, которые способствуют так называемому раневому истощению.
Желудочная секреция регулируется холинергическими структурами вегетативной нервной системы. Стимуляция α- и β-адренорецепторов мобилизует экскреторную функцию желудка. В пусковую фазу желудочного пищеварения экскреторная способность желудочных желез ниже, чем в завершенную, в механизме которой ведущую роль играют гуморальные факторы. К стимуляторам экскреторной функции желудка относятся кортикостероиды, простагландины Е, гипоксия; тормозящее влияние на нее оказывают минералокортикоиды.
О выделительной функции желудка судят по скорости появления в желудочном соке введенного внутривенно раствора краски нейтрального красного (нейтральрот), который в норме появляется там через 12-15 мин. При секреторной недостаточности желудка, особенно при атрофии слизистой, выделение краски значительно запаздывает (до 30-45 мин), при повышенной кислотности - несколько ускоряется (до 8-10 мин).
17.2.3.6. Язвенная болезнь
Язвенная болезнь - хроническое, циклически рецидивирующее заболевание, при котором нарушаются общие и местные механизмы нервной и гуморальной регуляции секреторно-трофической деятельности гастрогепатопанкреатической системы и образуется язвенный дефект слизистой оболочки в желудке или (и) в ДПК, часто на фоне активного гастрита и дуоденита, ассоциированных с Helicobacter pylori, склонное к прогрессированию и развитию осложнений, угрожающих жизни больного.
Язвенная болезнь встречается у 6-10% взрослого населения, чаще у мужчин в возрасте до 50 лет. У 60-70% больных язвенная болезнь формируется в юношеском и молодом возрасте. У подростков и молодых мужчин чаще развивается язвенная болезнь двенадцатиперстной кишки, у женщин и мужчин старших возрастных групп - язвенная болезнь желудка. У 1/3 больных с язвенной болезнью желудка в дальнейшем развивается язвенная болезнь двенадцатиперстной кишки.
Язвенная болезнь - самостоятельное заболевание. Острые (симптоматические) изъязвления всегда вторичны, например, при
лечении стероидными гормонами, салицилатами, бутадионом, при циррозе печени, острой почечной недостаточности и т.д.
Этиология и патогенез язвенной болезни
Язвенная болезнь - полиэтиологична. Главными этиологическими факторами язвенной болезни желудка и двенадцатиперстной кишки являются бактерия Helicobacter pylori и нервно-психический стресс.
В настоящее время есть все основания рассматривать язвенную болезнь как инфекционное заболевание, так как доказана связь между развитием язвенной болезни и инфицированностью Helicobacter pylori (НР). Австралийские ученые Р. Уоррен и Б. Маршалл в 2005 г. получили Нобелевскую премию за «неожиданное и потрясающее» открытие, которое они сделали в 1982 г.: установили, что причиной гастритов и язвенной болезни желудка и двенадцатиперстной кишки является бактерия - НР. Когда Б. Маршалл выделил чистую культуру бактерии, он провел на себе опыт самозаражения, и у него развился острый гастрит. В качестве средства лечения он использовал антибиотикотерапию. В результате этого открытия появилась обоснованная возможность лечить язвенную болезнь антибиотиками, что увеличило частоту излечения язвенной болезни и уменьшило число рецидивов заболевания.
Установлено, что у больных с язвенной болезнью двенадцатиперстной кишки НР обнаруживается в 90-95% случаев, у больных язвенной болезнью желудка - в 80% случаев. Оценку наличия бактерии проводят с помощью серологического анализа крови, иммуноферментного анализа, бактериологического исследования кусочка биопсии слизистой.
Helicobacter pylori является грамотрицательной анаэробной палочкой, которая имеет жгутик и способна вырабатывать уреазу. Этот возбудитель обнаруживается в слизистой оболочке антрального отдела желудка, выявляясь иногда и у здоровых, без какихлибо патологических изменений, но значительно чаще (до 95%) у больных гастритом или язвенной болезнью (рис. 17-3). При попадании в просвет желудка с заглатываемой слюной или с поверхности гастроскопа, желудочного (дуоденального) зонда НР оказывается в сложной для обитания среде (кислое содержимое желудка). Однако благодаря своей уреазной активности бактерии могут существовать в этих условиях. Мочевину, поступающую из
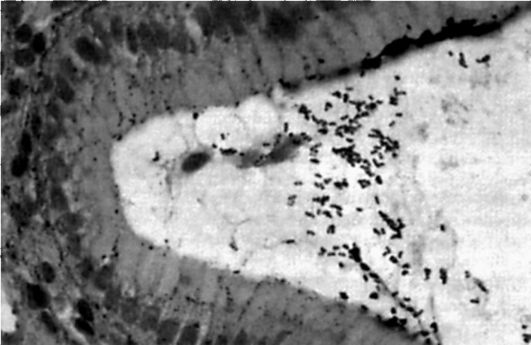 Рис. 17-3. Микрофотография Helicobacter pylori (окрашивание серебром). Видны многочисленные бактерии на поверхности желудочного эпителия (по Т.Л. Лапиной, 2000)
Рис. 17-3. Микрофотография Helicobacter pylori (окрашивание серебром). Видны многочисленные бактерии на поверхности желудочного эпителия (по Т.Л. Лапиной, 2000)
кровеносного русла, путем пропотевания через стенку капилляров, уреаза превращает в аммиак и СО2, которые и нейтрализуют соляную кислоту желудочного сока, создавая вокруг бактериальной клетки локальное ощелачивание. Аммиак действует раздражающе на G-клетки APUD-системы, увеличивая секрецию гастрина и соответственно НС1.
Жгутики и спиралевидная форма бактерий обеспечивают активное продвижение вперед, и НР в окружении уреазы и аммиака проникает из просвета желудка в слой слизи, где процесс продвижения продолжается. Кроме локального ощелачивания, вокруг бактерий идет снижение вязкости желудочной слизи - муцин разрушается, и НР достигает через защитный слизистый барьер покровно-ямочного эпителия слизистой желудка. Происходит адгезия НР на покровно-ямочный эпителий антрального отдела желудка. Часть микробов пенетрирует в собственную пластинку через межэпителиальные контакты. В эпителиальных клетках возникают дистрофические изменения, что снижает их функциональную активность. Интенсивное размножение и колонизация HP на слизистой антрального отдела желудка ведут к повреждению эпителия вследствие действия фосфолипаз. Выделяют ульцирогенный штамм НР, который синтезирует цитотоксины, активирующие фосфолипазу. В этом случае вероятность изъязвления слизистой оболочки желудка очень велика. Идет разрушение защитных бел-
ковых компонентов, муцина, что открывает путь НР вглубь слизистой оболочки. Аммиак, воздействуя на эндокринные клетки антрального отдела желудка, уменьшает количество D-клеток, вырабатывающих соматостатин, и соответственно падает его концентрация. Выброс гастрина выходит из-под контроля D-клеток, что приводит к гипергастринемии, повышению массы париетальных клеток и гиперпродукции соляной кислоты. Таким образом, инфицирование НР может быть первичным, а повышение секреции соляной кислоты - вторичным звеном в патогенезе язвенной болезни желудка. В подслизистом слое формируется воспалительный инфильтрат (состоящий из нейтрофилов, лимфоцитов, макрофагов, плазматических и тучных клеток), происходит некроз эпителия с образованием язвенного дефекта.
Патогенез язвы ДПК сложнее, чем язвы желудка. НР избирательно заселяют только метаплазированный эпителий и не поражают нормальную слизистую ДПК. Желудочная метаплазия (замещение цилиндрических клеток эпителия ДПК клетками желудочного эпителия) наблюдается у 90% больных дуоденальной язвой. Метаплазия позволяет НР внедряться в клетки слизистой оболочки луковицы ДПК, делая их менее устойчивыми к повреждению соляной кислотой, пепсином, желчью. Длительный заброс в луковицу ДПК кислого желудочного содержимого создает благоприятные условия для развития желудочной метаплазии ее эпителия. Риск развития дуоденальной язвы при выраженном антральном гастрите и проксимальном дуодените, ассоциированных с НР, превышает контрольные в 50 раз, а при нормальной слизистой он практически равен нулю.
Интересно отметить, что инфицированность НР достаточно высока - инфицированность на севере России составляет 50%, на юге и востоке России достигает 80 и 90% соответственно. Только 1/8 инфицированных НР людей заболевает язвенной болезнью.
Однако язвенная болезнь - это не классическая инфекция и одного инфицирования НР недостаточно для ее возникновения.
К главным этиологическим факторам язвенной болезни относят также нервно-психический стресс. Под влиянием длительных или часто повторяющихся психоэмоциональных перенапряжений (тяжелые нервные потрясения, профессиональные неудачи и семейные драмы) нарушается координирующая функция коры головного мозга в отношении подкорковых образований и особенно гипоталамуса. Возникает стойкое возбуждение центров ве-
гетативной нервной системы. Обильная патологическая парасимпатическая импульсация из ЦНС приводит к гиперсекреции НС1 и гипермоторике желудка. Обильная патологическая симпатическая импульсация из ЦНС приводит к выбросу катехоламинов в синапсах и мозговом веществе надпочечников, что вызывает трофические и гемодинамические нарушения в слизистой желудка. Активация гипоталамо-гипофизарно-надпочечниковой системы вызывает усиленную выработку глюкокортикоидов, что влечет за собой гиперсекрецию желудочного сока, спазм сосудов, катаболический эффект (увеличенный распад и сниженный синтез белка). Все вышесказанное обусловливает формирование язвенных дефектов, уменьшение выработки слизи и снижение регенерации.
К предрасполагающим факторам язвенной болезни относят генетические маркеры: высокий уровень продукции НС1 - максимальной кислотопродукции желудка (в результате генетически обусловленного увеличения массы обкладочных клеток и их чувствительности к гастрину); высокий уровень пепсиногена 1 в сыворотке крови - «ульцирогенная фракция пепсиногена»; избыточное выделение гастрина G- клетками в ответ на прием пищи; I группа крови (у этих людей на слизистой оболочке желудка имеются адгезивные рецепторы к Helicobacter pylori); генетически обусловленное уменьшение выработки ряда защитных субстанций (защищающих слизистую от протеолиза), в том числе a1-антитрипсин - ингибитор сериновой протеазы, a2-макроглобулины (составляют 97% общего содержания макроглобулинов плазмы крови - неспецифических ингибиторов протеаз и универсальных регуляторов иммунной системы).
Факторами, способствующими развитию болезни, являются алиментарные факторы (острая, горячая пища, специи, приправы), вредные привычки (курение и злоупотребление крепкими спиртными напитками, определенную роль в развитии язвенной болезни отводят употреблению кофе), ульцирогенные лекарственные средства. Особенно опасны длительные перерывы в приеме пищи, прежде всего у лиц с повышенной секрецией и кислотностью желудочного сока.
Все этиологические факторы потенциируют друг друга и приводят к формированию факторов «агрессии». В конечном итоге, быть или не быть язвенной болезни, определяется соотношением факторов «защиты» и факторов «агрессии».
К факторам «агрессии» относят прежде всего инфицирование НР и разрушение слизисто-бикарбонатного барьера, а также вы-
сокий кислотно-пептический фактор. Причинами гиперсекреции соляной кислоты являются гиперплазия париетальных клеток, повидимому, генетически обусловленная ваготония и гиперпродукция гастрина. Известно, что главные стимуляторы секреции НСb - гистамин, гастрин, ацетилхолин. Кроме того, известно, что недостаточная выработка глюкагона и особенно соматостатина также способствует язвообразованию (рис. 17-4).
Патогенетическим фактором в реализации болезни, наряду с высоким кислотно-пептическим фактором, является гастродуоденальная дисмоторика. Если у здорового человека идет ритмичное поступление желудочного содержимого в ДПК - 3 сокращения в 1 мин, то у больных язвенной болезнью в ДПК констатируются 15-минутные периоды низкого уровня рН. Высокая кислотность не может поддерживать нормальную перистальтику, происходит «закисление» ДПК. Длительный контакт кислого содержимого со слизистой ведет к язвообразованию. «Закисление» ДПК нередко связано с дискинезией и снижением ее ощелачивающей функции в связи с нарушением выработки бикарбонатов панкреатического и билиарного секретов.
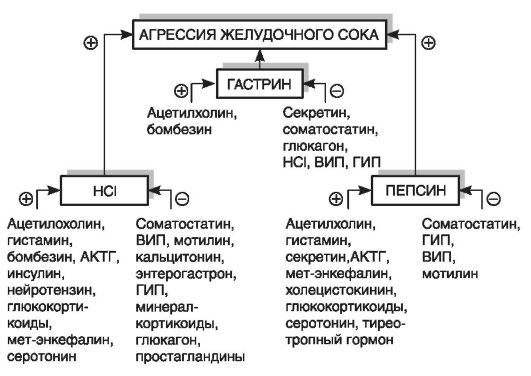 Рис. 17-4. Факторы,
стимулирующие и ингибирующие агрессию желудочного сока (по Г.Е.
Самониной, 1997). АКТГ - адренокортикотропный гормон, ВИП - вазоактивный
интестинальный полипептид, ГИП - гастринингибирующий пептид
Рис. 17-4. Факторы,
стимулирующие и ингибирующие агрессию желудочного сока (по Г.Е.
Самониной, 1997). АКТГ - адренокортикотропный гормон, ВИП - вазоактивный
интестинальный полипептид, ГИП - гастринингибирующий пептид
Определенное значение в развитии язвенной болезни придается дуоденогастральному рефлюксу (ДГР) - забросу желчи (желчных кислот) в желудок. Желчь, воздействуя на слизистую желудка, приводит к нарушению слизистого барьера и к повышению кислотнопептических свойств желудочного сока из-за стимуляции эндокринного аппарата желудка (прежде всего усиливается выработка гастрина). Дискинезия ДПК, особенно по гипомоторному типу, понижение тонуса антрального отдела желудка способствуют ДГР, делают его продолжительным и интенсивным. Доказано, что ДГР встречается значительно чаще при сочетании язвенной болезни с заболеваниями гепатобилиарной системы, особенно с желчекаменной болезнью.
К факторам «агрессии» относят нарушение дуоденального тормозного механизма (недостаточную выработку в ДПК секретина, холецистокинина, энтерогастрона), нарушение обмена биогенных аминов - гистамина и серотонина, выделяющихся в основном из энтерохромафинных клеток слизистой оболочки желудка. Гистамин стимулирует секрецию НС1 через Н2-рецепторы, связанные с цАМФ. В период обострения язвенной болезни процессы синтеза гистамина обычно усиливаются, что влечет за собой появление свободного гистамина в крови. По одной из гипотез, гистамин выполняет роль медиатора парасимпатической нервной системы. Согласно другой широко распространенной точке зрения, гистамин является промежуточным звеном в реализации действия гастрина на секреторные клетки. Изменяется капиллярное кровообращение, повышается проницаемость сосудистой стенки, усиливается выработка пепсина (гистамин - мощный стимулятор главных клеток). Гистамин и серотонин, выполняя роль активаторов кининовой системы (активируют брадикинин), вызывают значительные расстройства микроциркуляции, страдает кровообращение и трофика слизистой оболочки желудка. В норме биогенные амины обезвреживаются за счет аминооксидаз кишечной стенки.
Защитный барьер слизистой оболочки желудка состоит из трех частей: 1) надэпителиальной (слизь, бикарбонаты); 2) эпителиальной (клетки эпителия и их репарация, простагландины, гормоны роста); 3) субэпителиальной (кровоснабжение, микроциркуляция).
Слизистая желудка постоянно подвергается воздействию соляной кислоты, пепсина, а при дуоденогастральном рефлюксе - и воздействию желчных кислот, панкреатических ферментов. В защитном барьере желудка первой линией защиты от повреждающих
факторов являются клетки слизистой оболочки. Это поверхностные клетки и секреторные добавочные, секретирующие слизь и бикарбонаты. За счет этих веществ создается физико-химический барьер, который представляет собой гель, поддерживающий рН нейтральной среды у поверхности эпителия. Все поверхностные эпителиальные клетки, выстилающие желудок и ДПК, синтезируют и секретируют бикарбонаты (рис. 17-5). Слизистая проксимальной части ДПК вырабатывает бикарбонатов в 2 раза больше, чем вся слизистая желудка. Важная роль в поддержании базального уровня секреции бикарбонатов и слизи отводится и эндогенным простагландинам. Слизь, ее нерастворимая фракция, бикарбонаты защищают слизистую оболочку желудка от воздействия соляной кислоты и пепсина. Слизистый барьер предотвращает обратную диффузию Н+ из просвета желудка в кровь. Длительный же контакт слизистой с кислой средой и изменения в составе слизи (в период обострения язвенной болезни в слизи уменьшается содержание сиаловых кислот и гликопротеидов, нейтрализующих соляную кислоту) ведут к прорыву слизистого барьера и возникновению обратной диффузии ионов водорода. В ответ на это высвобождается гистамин из тучных клеток (тканевые базофилы желудка) и рефлекторно возбуждается холинергическая система, отмечаются
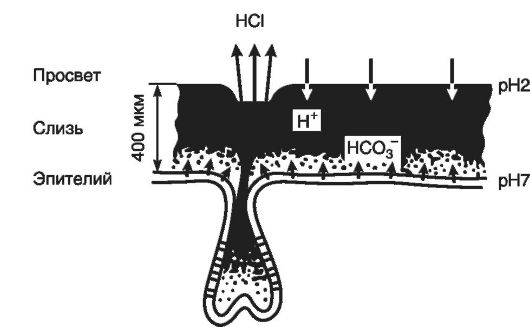 Рис. 17-5. Диаграмма, иллюстрирующая предполагаемый слизебикарбонатный барьер. Ионы НСО3,
секретируемые в слой слизи, нейтрализуют медленно диффундирующие к
эпителию Н+. Эта зона позволяет небольшому количеству бикарбонатов
предохранять слизистую оболочку от большого количества кислоты в
просвете (по L. Turberg, 1985)
Рис. 17-5. Диаграмма, иллюстрирующая предполагаемый слизебикарбонатный барьер. Ионы НСО3,
секретируемые в слой слизи, нейтрализуют медленно диффундирующие к
эпителию Н+. Эта зона позволяет небольшому количеству бикарбонатов
предохранять слизистую оболочку от большого количества кислоты в
просвете (по L. Turberg, 1985)
венозный стаз, переполнение капилляров, усиливается продукция соляной кислоты и пепсина - все это способствует образованию пептической язвы.
В поддержании устойчивости слизистой оболочки желудка и ДПК к факторам агрессии важную роль играют способность клеток к быстрому обновлению (репарация), хорошее состояние кровообращения и секреция химических медиаторов защиты (простагландины, гормон роста). Известно, что слизистая оболочка желудка и ДПК после повреждения обычно быстро восстанавливается (в течение 15-30 мин). Этот процесс идет не за счет деления клеток, а в результате движения их из покровно-ямочного эпителия желудка вдоль базальной мембраны и закрытия дефекта в участке поврежденного эпителия. Простагландины, особенно простагландин Е2, способствуют повышению защитных свойств слизистой оболочки желудка, так как угнетают активность париетальных клеток, стимулируют секрецию слизи и бикарбонатов и улучшают кровоснабжение слизистой оболочки, снижая обратную диффузию ионов водорода и ускоряя регенерацию. Секреция их осуществляется главными, добавочными и париетальными клетками слизистой оболочки желудка.
Субэпителиальная часть защитного барьера слизистой оболочки желудка включает в себя оптимальное кровоснабжение и микроциркуляцию.
Кроме того, к факторам «защиты» относят щелочную реакцию слюны, панкреатического сока, желчи; оптимальную моторику и эвакуацию желудка; а также механизм дуоденального торможения кислото- и пепсинообразования (выработка холецистокинина, секретина, энтерогастона двенадцатиперстной кишкой).
Когда факторы «агрессии» перевешивают на чаше весов, формируется язва, она становится очагом афферентной импульсации в ЦНС, где возникает патологическая доминанта. В процесс вовлекаются другие органы и системы организма (печень, поджелудочная железа и т.д.), болезнь становится хронической (рис. 17-6).
Клиника язвенной болезни включает болевой синдром, который характеризуется периодичностью (зависит от приема пищи, «голодные» боли), сезонностью (обострения весной и осенью), ритмичностью (ночные, дневные - от суточных ритмов выделения желудочно-кишечных соков). Болевой синдром является ведущим субъективным проявлением болезни в фазе обострения. Синдром диспепсических расстройств характеризуется изжогой, отрыжкой,
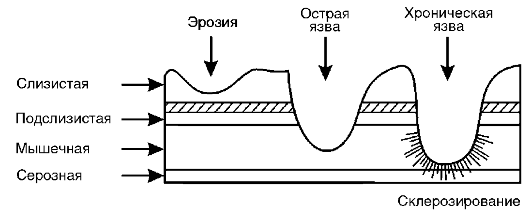 Рис. 17-6. Острые и хронические повреждения оболочек, составляющих стенки желудка и тонкого кишечника (по Brooks, 1985)
Рис. 17-6. Острые и хронические повреждения оболочек, составляющих стенки желудка и тонкого кишечника (по Brooks, 1985)
нередко срыгиванием с саливацией. Аппетит остается хорошим, при дуоденальных язвах даже увеличивается (болезненнное чувство голода). Запоры возникают у 50% больных, беспокоят даже больше, чем болевые ощущения.
К осложнениям язвенной болезни относятся кровотечения (малое - до 500 мл, среднее - до 1000 мл, большое - до 1500 мл, массивное - более 1500 мл), постгеморрагическая анемия (легкая, средняя, тяжелая), пенетрация (в малый сальник, желудочноободочную, печеночно-двенадцатиперстную связку, поджелудочную железу, поперечно-ободочную кишку, печень, желчный пузырь и т.д.), перфорация (в свободную брюшную полость, полость малого сальника), стеноз (компенсированный, субкомпенсированный, декомпенсированный), малигнизация (характерна для язвенной болезни желудка, язвенная болезнь двенадцатиперстной кишки не озлокачествляется), реактивный гепатит, реактивный панкреатит, перивисцерит (перигастрит, перидуоденит).
Исходы язвенной болезни: рубцевание и заживление; стеноз привратника и деформация желудка в результате рубцевания; пожизненное существование язвенной болезни; малигнизация; летальный исход обычно в результате кровотечения или перфорации.
Экспериментальные язвы желудка. Для воспроизведения язвы желудка в эксперименте наиболее часто используются следующие методы:
1. Повреждение слизистой желудка физическими и химическими раздражителями (горячая вода, ляпис, кислоты, кротоновое масло и др.). В стенке желудка развивается острое воспаление и
происходит образование язвенных дефектов, которые обычно быстро заживают.
2. Нарушение кровообращения в стенке желудка или ДПК (перевязка, эмболия, склерозирование сосудов). Кровоток обычно восстанавливается за счет анастомозов, и образующиеся язвы быстро заживают.
3. Длительное введение лекарств, усиливающих желудочную секрецию (атофан, гистамин, пентагастрин, пилокарпин и др.), с последующим образованием язвенного дефекта.
4. Хроническое раздражение n. vagus с усилением желудочной секреции и нарушением микроциркуляции в стенке желудка.
5. Экспериментальные неврозы с дополнительным введением желудочного сока. У собак язвы желудка возникали при сочетании срыва высшей нервной деятельности с ежедневным двухчасовым орошением слизистой желудка желудочным соком.
6. Наложение лигатуры на привратник с сохранением его проходимости (метод Шейя). При этом в желудке крыс через 1-2 суток появлялись эрозии и иногда язвы вследствие сдавления сосудов и раздражающего воздействия лигатуры на n. vagus, что вызывало значительное нарушение кровообращения.
7. Введение гастроцитотоксической сыворотки, полученной путем иммунизации животных-доноров гомогенатом ткани желудка. Например, кролика иммунизируют тканью желудка собаки и полученную сыворотку, содержащую противожелудочные антитела, вводят внутривенно интактной собаке-реципиенту. Антитела взаимодействуют с тканью желудка животного-реципиента и вызывают повреждение этой ткани в результате реакции антиген-антитело.
Описанные методы экспериментального моделирования язв вызывают в основном острые язвенные дефекты. По механизму возникновения и особенностям течения (обычно быстро заживают) они принципиально отличаются от язвенной болезни, больше воспроизводя картину симптоматических язв человека. Однако частично удается моделировать отдельные проявления этого заболевания, что ориентирует в разрабатываемой противоязвенной терапии.
17.2.4. Нарушения пищеварения в кишечнике
Пищеварение в тонкой кишке обеспечивает деполимеризацию питательных веществ до стадии, в которой они всасываются в
кровь и лимфу. Пищеварение в тонкой кишке сначала происходит в ее полости (полостное пищеварение), а затем в зоне кишечного эпителия с помощью ферментов, фиксированных на его микроворсинках, и в гликокаликсе (пристеночное пищеварение). Полостное и пристеночное пищеварение осуществляется кишечными ферментами и ферментами поджелудочной железы.
Важную роль в нарушении пищеварения в кишечнике играют нарушения желчеотделения, внешней секреции поджелудочной железы, а также нарушения секреторной, всасывательной, двигательной, выделительной функций кишечника.
17.2.4.1. Нарушение желчеотделения
Желчь продуцируется гепатоцитами и секретируется в кишечник (в ДПК) в объеме 500 мл в сутки. В ней содержатся желчные кислоты, желчные пигменты, холестерин и другие липиды, а также щелочная фосфатаза.
Желчные кислоты и их соли (натриевая и калиевая) необходимы для всасывания жира. Когда желчные кислоты попадают через проток и сфинктер Одди в ДПК, они смешиваются с перевариваемыми липидами и жирорастворимыми витаминами, образуя мицеллы (водорастворимые комплексы). Мицеллы участвуют в эмульгировании жиров, увеличивают площадь поверхности для гидролиза и готовят жиры для всасывания. Гепатоциты вырабатывают холевую и хенодезоксихолевую кислоты - первичные желчные кислоты. Под влиянием бактерий тонкой кишки они модифицируются во вторичные желчные кислоты (дезоксихолевую, метохолевую и урсохолевую). Желчные кислоты реабсорбируются в тонкой кишке и попадают в систему воротной вены для рециркуляции. При поступлении в печень по механизму отрицательной обратной связи они угнетают синтез новых желчных кислот, т.е. происходит процесс кишечно-печеночной циркуляции желчных кислот. Без этой циркуляции наступает нарушение всасывания жиров, так как печень не в состоянии обеспечить синтез новых желчных кислот, необходимых для поступающих в кишечник липидов (рис. 17-7). Изменения состава желчи происходят под действием клеток желчных протоков, которые выделяют в желчь бикарбонат и воду (регулируется секретином). Окончательная желчь, выделяющаяся в ДПК, имеет щелочную реакцию и изоосмолярна плазме крови. Данный процесс регулируется также и холецистокинином. Эти гормоны
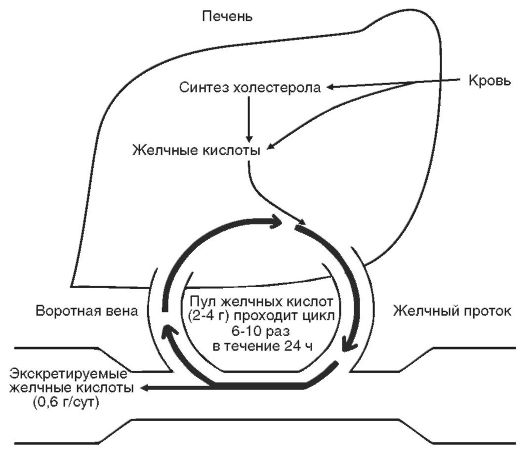
Рис. 17-7. Кишечно-печеночная циркуляция желчных кислот (по Р. Шмидту и Г. Тевсу, 1996)
обладают и синергическим действием на секрецию сока поджелудочной железы.
Недостаточное поступление желчи в кишечник называется гипохолией, а полное прекращение ее поступления - ахолией. Это возможно при закупорке общего желчного протока камнем, реже глистами, вследствие воспаления или сдавления опухолью, увеличенными лимфатическими узлами, рубцовой тканью ворот печени. При гипохолии, особенно ахолии, нарушается переваривание и всасывание жиров. Липаза панкреатического сока при отсутствии желчи малоактивна, жиры не эмульгированы, и их контакт с липолитическими ферментами затруднен. Страдает процесс всасывания жирных кислот, так как для этого необходимо образование водорастворимых комплексов с желчными кислотами. Нарушается также всасывание холестерина и жирорастворимых витаминов, так как они всасываются, как и пищевые жиры. Нарушение переваривания жиров проявляется стеатореей (stear, atos - сало, жир; rhoe - течение) - избыточным содержанием жиров в кале. С калом при
этом выводится до 70-80% съеденных жиров. В кишечнике нерасщепленные жиры обволакивают пищевой химус и затрудняют действие амилолитических и протеолитических ферментов дуоденального сока, активность которых при недостаточном поступлении желчи в кишечник снижается. Сорбционные свойства кишечного эпителия также страдают из-за недостатка желчных кислот, нарушается пристеночное пищеварение. Это влечет за собой нарушения пищеварения и всасывания белков и углеводов. Неусвоение жиров способствует потере через кишечник жирорастворимых витаминов. Развиваются гиповитаминозы. Вследствие гиповитаминоза А возникает дерматит, замедляется рост, снижается зрение вплоть до слепоты (ксероофтальмия). Недостаток витамина К ведет к нарушению свертывания крови и повышенной кровоточивости, витамина D, регулирующего всасывание Ca2+ в тонкой кишке, - к рахиту и остеомаляции, а дефицит витамина E - к нарушениям со стороны нервной системы (в виде мозжечковых расстройств).
При гипохолии ослабляется перистальтическая активность кишечника, что ведет к усилению метеоризма, гниения, брожения, так как уменьшается бактерицидное действие желчи.
17.2.4.2. Нарушение внешней секреции поджелудочной железы
Объем секрета поджелудочной железы составляет 1500 мл в сутки. Он выделяется в тонкую кишку и содержит ферменты, гидролизирующие белки, жиры и углеводы. Регуляция секреции осуществляется гормонами - холецистокинином (стимулирует секрецию ферментов) и секретином (стимулирует секрецию бикарбонатов). Регуляция панкреатической секреции осуществляется через блуждающий нерв.
Основными причинами нарушений внешней секреции поджелудочной железы являются: 1) недостаточная продукция секретина при ахлоргидрии; 2) неврогенное торможение функции поджелудочной железы (при ваготомии, отравлении атропином); 3) развитие аллергических реакций; 4) воздействие различными химическими веществами (отравление фосфором, свинцом, ртутью, кобальтом); 5) травмы брюшной полости; 6) токсикоинфекции (брюшной тиф, паратифы); 7) хронические инфекции (туберкулез, малярия); 8) алиментарные факторы (избыточный прием пищи, животных жиров и др.); 9) разрушение поджелудочной железы опухолевым процессом; 10) закупорка и сдавление протока опухолью; 11) дуо-
дениты - воспалительные процессы в ДПК любой этиологии (инфекционные, паразитарные и др.), ведущие к уменьшению образования секретина, с последующей гипосекрецией поджелудочной железы; 12) воздействие алкоголем, усиливающим выброс соляной кислоты, что ведет к стимуляции выработки секретина с избыточным выделением панкреатического секрета; 13) острые и хронические панкреатиты.
Этиология и патогенез острого панкреатита. Основными этиологическими факторами (в 70% случаев) острого панкреатита являются желчекаменная болезнь и прием алкоголя. Возникновение острых алкогольных панкреатитов объясняется не только токсическим воздействием алкоголя. Алкоголь стимулирует выброс соляной кислоты, которая, воздействуя на слизистую двенадцатиперстной кишки, усиливает секрецию секретина. Последний является мощным стимулятором панкреатической секреции, избыточное выделение которой ведет к повышению давления в протоках железы и развитию острого панкреатита. Кроме того, крепкие алкогольные напитки способствуют отеку слизистой ДПК, что вызывает спазм фатерова соска с последующим повышением давления в панкреатических протоках. Известно и непосредственное воздействие алкоголя на сосуды поджелудочной железы, вызывающее их спазм. Это ведет к ишемии органа с гибелью ацинозных клеток и к активации ферментов в ткани железы. Прием алкоголя в дозе, превышающей 100 г/сут в течение нескольких лет, может привести к преципитации панкреатических ферментов в мелких протоках и формированию белковых пробок. Более редкими причинами развития острого панкреатита являются травмы живота, гиперлипидемия (особенно I и IV типа), прием некоторых лекарственных препаратов (азотиаприн, сульфазалазин, фуросемид, кортикостероиды, эстрогены), инфекции (эпидемический паротит, болезнь Боткина, сальмонеллез), оперативные вмешательства, диагностическая ретроградная холангиопанкреатография, анатомические аномалии панкреатического протока (стриктуры, опухоли), гиперкальциемия, уремия, сосудистые поражения, наследственная предрасположенность.
Рассматриваются 3 механизма развития острого панкреатита. Наиболее принята теория самопереваривания ткани железы, согласно которой протеолитические ферменты - трипсиноген, химотрипсиноген, проэластаза и фосфолипаза А активируются внутри протока поджелудочной железы. Полагают, что некоторые факто-
ры (эндо- и экзотоксины, в частности алкоголь, вирусные инфекции, ишемия и травма) активируют проферменты, т.е. в условиях патологии трипсиноген может активироваться в железе под влиянием кофермента цитокиназы, выделяющейся из поврежденных клеток паренхимы. Важную роль в развитии панкреатита играет и ингибитор трипсин, который в норме в достаточном количестве содержится в поджелудочной железе и препятствует превращению трипсиногена в трипсин. При большой активности трипсина ингибиторы антиферментной системы истощаются, и возникает их дефицит. Это используется как тест в диагностике острого панкреатита: чем выше содержание трипсиногена в сыворотке крови, тем меньше ингибитора трипсина. При дефиците этого фактора отмечается активный переход трипсиногена в трипсин. Усиленная активность протеолитических ферментов, особенно трипсина, приводит к перевариванию ткани поджелудочной железы и к активации других ферментов - эластазы и фосфолипазы. Происходит переваривание активными ферментами клеточных мембран, развивается протеолиз, отек, интерстициальное воспаление, повреждение сосудов, коагуляционный, жировой некроз (стеатонекроз) и некроз паренхимы железы. Повреждение и разрушение клеток ведут к высвобождению активированных ферментов. Переваривающее действие ферментов сказывается и на периферии. С этим связан феномен «уклонения ферментов в кровь», вызывающий развитие некротических процессов в других органах. При попадании липазы в кровь возможны некрозы отдаленных органов с тяжелой последующей интоксикацией. Процесс может осложниться перитонитом и абсцессами брюшной полости. Трипсин активирует панкреатический калликреин, вызывающий образование каллидина и брадикинина, которые усиливают повреждение ткани железы. Идет дальнейшая активация кининовой системы. Активация и высвобождение брадикинина и гистамина вызывают различные гемодинамические расстройства. Расширяются сосуды, повышается проницаемость их стенок и развивается отек железы. Выход жидкости и белка в ткани ведет к снижению онкотического давления и развитию панкреатического коллапса, иногда со смертельным исходом. Этот коллапс можно воспроизвести в эксперименте при внутривенном введении животному панкреатического сока. Если сок предварительно прокипятить, то коллапс не разовьется.
Вторая теория - это теория «общего канала». Благодаря анатомической особенности у большинства людей (у 80%) имеется об-
щий желчный и панкреатический проток, что облегчает рефлюкс желчи в проток поджелудочной железы. Однако в норме давление в панкреатическом протоке в 2 раза выше, чем в общем желчном протоке (200 мм вод. ст.). Это предохраняет от заброса желчи и кишечного содержимого в протоки поджелудочной железы. Заброс желчи может отмечаться при гипертонусе сфинктера Одди или гипермоторной дискинезии желчных путей. Частое развитие панкреатита при желчекаменной болезни объясняется происходящим повышением давления в желчевыводящей системе. Это обеспечивает заброс инфицированной желчи под большим давлением в панкреатический проток, что вызывает химическое повреждение ткани железы, повышает ее ферментативную активность. Фосфолипаза желчи активирует трипсиноген. При желчекаменной болезни приступы острого панкреатита могут быть связаны с преходящей обтурацией фатерова соска желчными камнями. Заброс кишечного содержимого возможен при зиянии фатерова соска или при гипертонической дискинезии ДПК, возникающей при воспалении, воздействии алиментарных и других факторов. При этом попадающая в железу энтеропептидаза активирует трипсиноген. Образовавшийся трипсин оказывает аутокаталитическое действие - активирует трипсиноген и другие протеолитические ферменты. Так, если в эксперименте ввести в проток поджелудочной железы небольшое количество трипсина, то происходит выраженный некроз ее ткани, поскольку образуются активные протеолитические ферменты.
Третья теория объясняет развитие панкреатита обструкцией панкреатического протока и гиперсекрецией. Обструкция (спазм сфинктера Одди, отек ДПК и др.) вызывает задержку выделения панкреатического секрета с последующей активацией ферментов внутри железы.
При панкреатите развиваются 3 стадии: острый приступ (отек, возможно панкреонекроз), стадия неполного излечения с персистирующим хроническим воспалением или деструкцией панкреатического протока и затем стадия хронического воспаления с экзокринной недостаточностью поджелудочной железы. С развитием фиброзных изменений в ткани железы, связанных с перенесенным острым панкреатитом, наступает внешнесекреторная (экзокринная) недостаточность поджелудочной железы, характерная для хронического панкреатита. В железе уменьшается, а затем полностью прекращается (при склерозировании, сморщивании органа) об-
разование пищеварительных ферментов (панкреатическая ахилия). Нарушаются полостное пищеварение (в полости тонкой кишки) и всасывание. В первую очередь резко страдает переваривание и всасывание жиров. Жиры до 60-80% не усваиваются и в повышенном количестве выводятся с калом (стеаторея - выделение с калом более 5 г в сутки или более 5-6% от введенного изотопа - триолеат-глицерина J131). Отмечается полифекалия, при копрологическом исследовании в кале много нейтрального жира (так как нарушается расщепление жиров до жирных кислот). Стеаторея вызывает потерю организмом кальция, который экскретируется вместе с жирами в виде нерастворимых мыл (в кале, кроме нейтрального жира, будут мыла). Наряду с ионами кальция теряются и ионы магния, цинка, которые также образуют мыла с невсосавшимися жирами. Развиваются синдромы гипокальциемии, гипомагниемии. В меньшей степени и позднее нарушается переваривание белка (не усваивается до 30-40%). Об этом свидетельствует появление большого количества мышечных волокон в кале (креаторея), особенно после приема мясной пищи. Переваривание углеводов также нарушается. Отмечается снижение объема секреции поджелудочной железы, гидрокарбонатов в панкреатическом соке (после стимуляции секретином 1 мг/кг массы) и ферментов - амилазы, трипсина, липазы (после стимуляции панкреозимином 1,5 мг/кг массы). Расстройство пищеварения усугубляется диспепсическим симптомокомплексом. Возникает синдром диареи, развивается синдром малдигестии, идет прогрессирующая потеря массы тела (в случае отсутствия заместительной терапии).
17.2.4.3. Нарушение секреторной функции тонкой кишки
Расстройства секреторной функции кишечника могут зависеть от уменьшения количества отделяемого сока, снижения содержания и активности его ферментов и нарушений пристеночного пищеварения. Они часто обусловлены интестинальными энзимопатиями - недостаточной продукцией ферментов в тонкой кишке. Энзимопатии могут быть врожденными и приобретенными.
Чаще встречается дисахаридная недостаточность (врожденный дефицит ферментов - дисахаридаз) и особенно дефицит лактазы, сахаразы и изомальтазы (см. раздел 12.4.1). Значительно реже встречается недостаточность трегалазы - фермента, расщепляющего дисахарид трегалозу, содержащийся в грибах, водорослях и у
насекомых (у некоторых народов Востока доля его в пище значительна). При дефиците трегалазы плохо переносятся грибы, особенно молодые. К редким формам пептидазной недостаточности относится врожденный дефицит энтерокиназы (энтеропептидазы). Энтерокиназа является ключевым ферментом протеолитических процессов в кишечнике. Она активирует панкреатический трипсиноген, переводя его в активный протеолитический энзим - трипсин. В этом случае у детей наблюдаются тяжелые нарушения белкового обмена, гипопротеинемия, отеки, диарея, синдром мальабсорбции. Больных лечат экстрактами поджелудочной железы.
К врожденным энтеропатиям относится и глютеновая болезнь. При развитии этой болезни нарушается расщепление глютена (белковый компонент клейковины, склеивающий составные части некоторых злаков: пшеницы, ржи, ячменя, овса). Существуют две основные теории патогенеза глютеновой болезни. Согласно первой интестинальные эпителиальные клетки, участвующие в процессе переваривания глютена, лишены соответствующей пептидазы или протеазы. В связи с этим не происходит расщепления и последующего всасывания глютена. Заболевание рассматривают как метаболический дефект, из-за которого непереваренный глютен и продукты его неполного расщепления оказывают токсическое действие на слизистую тонкой кишки.
Согласно второй теории первичную роль играют иммунологические реакции на глютен. Нерасщепленный глютен, взаимодействуя с иммуноцитами слизистой, приводит к их сенсибилизации, в частности к сенсибилизации лимфоцитов. В результате этого образуются различные продукты иммуногенеза - антитела к глютену, иммунизированные лимфоциты, лимфокины, вызывающие повреждение кишечного эпителия с нарушением его переваривающей и всасывающей функций. Существуют доказательства участия генетических факторов в патогенезе глютеновой болезни. Основными диагностическими критериями ее являются: мальабсорбция, субтотальная или тотальная атрофия слизистой тонкой кишки, клинический эффект от безглютеновой диеты.
Приобретенные энзимопатии могут быть связаны с недостаточной продукцией как одного (моноэнзимопатии), так и нескольких (полиэнзимопатии) ферментов кишечного сока. Они сопровождаются вздутием кишечника (метеоризм), диареей и ведут к другим проявлениям синдрома малдигестии.
Проявления интестинальных энзимопатий - метеоризм, диарея и развитие синдрома малдигестии. Нарушение преимущественно полостного пищеварения (синдром малдигестии) возникает вследствие многих причин: некомпенсированного снижения секреторной функции желудка, тонкой кишки, поджелудочной железы, желчеотделения. Существенную роль в его возникновении играют нарушения двигательной функции желудочно-кишечного тракта: застой содержимого вследствие спазма, стеноза или сдавления кишки, ускорение пассажа пищевого химуса из-за усиленной перистальтики.
В клинической картине малдигестии могут преобладать признаки нарушения пищеварения в различных отделах желудочнокишечного тракта. Различают желудочную, кишечную и панкреатическую формы. Возникновение желудочной формы связано обычно с атрофическим гастритом, приводящим к секреторной недостаточности. Возможно развитие желудочной формы и при декомпенсированном стенозе привратника, раке желудка. Клинически она характеризуется потерей аппетита, ощущением тяжести, распирания и давления в эпигастральной области после еды, метеоризмом, диареей, отрыжкой воздухом, пищей с тухлым запахом. При исследовании желудочной секреции выявляют ахилию, ахлоргидрию.
При кишечной форме, связанной с хроническим воспалительным процессом в тонкой кишке, при развитии интестинальных энзимопатий выявляются урчание, переливание в кишечнике, вздутие живота, метеоризм, неустойчивый стул с преобладанием поносов. При нарушении кишечного полостного пищеварения чаще находят кишечную стеаторею, когда преобладают жирные кислоты, мыла, амилорею, креаторею, повышенное содержание аммиака. О степени нарушения полостного пищеварения судят по уровню ферментов (энтерокиназы и щелочной фосфатазы) в кишечном содержимом и кале, а также по характеру гликемической кривой при нагрузке крахмалом и исследованию всасывания жиров при последовательной нагрузке триолеат-глицерином J131 и олеиновой кислотой, меченной J131.
Возникновение панкреатической формы малдигестии связывают с внешнесекреторной недостаточностью поджелудочной железы. В клинике преобладают анорексия, метеоризм, коликообразные боли в животе, обильные «панкреатогенные» поносы. При копрологическом анализе выявляются стеаторея панкреатического типа
(за счет нейтрального жира), амилорея, креаторея. При заболеваниях кишечника нередко наблюдается сочетание всех трех форм нарушения полостного пищеварения.
17.2.4.4. Нарушение пристеночного (мембранного) пищеварения в кишечнике
Помимо нарушения полостного пищеварения в кишечнике (синдром малдигестии) может возникать нарушение пристеночного (мембранного) пищеварения, которое осуществляется в зоне кишечного эпителия с помощью ферментов, фиксированных на его микроворсинках и в гликокаликсе. В гликокаликсе ферменты расщепляют продукты полостного гидролиза - олигомеры, образующиеся из крупномолекулярных веществ и адсорбирующиеся в зоне исчерченной каймы энтероцитов, до димеров. На цитоплазматической мембране микроворсинок расщепление идет до конечного продукта - мономеров, которые поступают в энтероциты и далее - в кровь и лимфу, т.е. всасываются.
Микроворсинки апикальной мембраны энтероцитов представляют собой мельчайшие цитоплазматические выросты, длина которых составляет 1 мкм, ширина - 0,1 мкм. Благодаря такой структуре активная поверхность пищеварения возрастает в 30 раз. Расстояние между ворсинками колеблется от 10 до 20 нм, и поэтому в щеточную кайму проникают только мелкие молекулы. Микробы, размеры которых составляют несколько микрометров, не способны проникать через нее - это своеобразный бактериальный фильтр. Процессы пристеночного пищеварения совершаются на огромной поверхности. Слизистая тонкой кишки имеет складки, ворсинки и микроворсинки, увеличивающие ее внутреннюю поверхность в 300-500 раз.
Ферменты, последовательно осуществляющие пристеночное пищеварение, имеют двоякое происхождение. Часть их адсорбируется из полости тонкой кишки (куда они поступают в составе панкреатического и кишечного соков), и они связываются с гликокаликсом микроворсинок. Другая часть переносится из энтероцитов (кишечного эпителия), фиксируясь на цитоплазматических мембранах микроворсинок. Основными кишечными ферментами, участвующими в пристеночном гидролизе углеводов, являются D-глюкозидазы (мальтаза, трегалаза и др.), β-галактаза (лактаза), глюкоамилаза (-изоамилаза), инвертаза и др. Гидролиз олиго- и дипептидов осуществляется несколькими пептидазами фосфорных эфиров (например, щелочной фосфатазой), а липидов - липазами.
Причинами нарушения пристеночного пищеварения могут быть:
1) нарушения структуры ворсинок и микроворсинок, уменьшение их числа на единицу поверхности (А.М. Уголев). Это характерный признак хронических заболеваний тонкой кишки, где морфологическим субстрактом являются воспалительные, дистрофические и склеротические изменения слизистой оболочки. Развитие атрофических изменений слизистой тонкой кишки, преимущественно ворсинок, отмечается при дизентерии, холере;
2) изменение ферментного слоя кишечной поверхности в результате генетической или приобретенной недостаточности ферментов, участвующих в пристеночном пищеварении. Первичная недостаточность пристеночного пищеварения, как правило, развивается у детей в раннем возрасте при расширении пищевого рациона с включением в него новых продуктов, содержащих непереносимый дисахарид. Приобретенная недостаточность чаще является следствием заболеваний тонкой кишки - хронического энтерита, а также вирусного гепатита и других инфекций;
3) расстройства кишечной перистальтики, что приводит к нарушению переноса пищевых веществ из полости кишки на поверхность энтероцитов, например хронические энтериты, болезни Уиппла, болезни Крона и другие заболевания тонкой кишки;
4) недостаточность полостного пищеварения, когда малорасщепленные крупные молекулы не проходят в щеточную кайму эпителия ворсинок.
Клиническая картина недостаточности пристеночного пищеварения аналогична диспепсии при синдроме недостаточности всасывания. Отмечаются упорные поносы, кал жидкий, обильный, пенистый. С целью уточнения диагноза определяют активность ферментов (амилазы, липазы) при последовательной их дезорбции в гомогенатах биопсии слизистой оболочки тонкой кишки, полученных при еюноскопии. Часть биоптата исследуют морфологически, что позволяет обнаружить воспалительные, атрофические изменения слизистой. Сопоставление активности определяемых ферментов в десорбируемых фракциях позволяет вывести кривые активности ферментов, которые характеризуют взаимоотношения полостного и мембранного пищеварения. Нарушение пристеночного пищеварения при хронических энтеритах определяется и с помощью других методических приемов.
17.2.4.5. Нарушение всасывания в кишечнике
Нарушения всасывания проявляются в его замедлении или патологическом усилении. Замедление всасывания лежит в основе синдрома мальабсорбции (от франц. mal - болезнь), обусловленного нарушением всасывания в тонкой кишке одного или нескольких пищевых веществ. Диапазон клинических проявлений синдрома мальабсорбции варьирует от отсутствия видимых его признаков до выраженной потери массы тела. Он сочетает симптомы диареи, стеатореи, белковой недостаточности, гиповитаминоза. Синдром мальабсорбции может быть первичным (врожденным или наследственно обусловленным) или вторичным (приобретенным). Врожденное нарушение всасывания встречается в клинической практике редко. Чаще всего это патология детского возраста, обусловленная, например, врожденными нарушениями транспорта (недостаточность ферментов-переносчиков) аминокислот в тонкой кишке. Так, с этим связаны синдром нарушения всасывания нейтральных аминокислот (болезнь Хартнапа - пеллагрические изменения кожи, мозжечковая атаксия); синдром нарушения всасывания цистеина и основных аминокислот, синдром снижения всасывания многих аминокислот (синдром Лоу - врожденная катаракта, глаукома, гипертония, остеопороз, умственная отсталость), снижение всасывания лизина (врожденная лизинурия -непереносимость белков, диарея, рвота, отставание в развитии) и др. Возможно врожденное нарушение всасывания глюкозы и галактозы. В слизистой тонкой кишки таких больных отсутствует фермент глюкозо-6-фосфатаза. При врожденном нарушении абсорбции фруктозы в слизистой оболочке имеется дефицит фруктозо-1-фосфатальдолазы, отвечающей за ее транспорт. Происходит изолированное нарушение всасывания данных веществ, возникают диарея и боли в животе. Первичная мальабсорбция витамина В12 или фолиевой кислоты ведет к развитию мегалобластной анемии.
Вторичное нарушение всасывания более распространено. Оно связано с такими заболеваниями кишечника, печени, поджелудочной железы и других органов, как:
1) недостаточное расщепление пищи в желудке (из-за ахлоргидрии, субтотальной резекции желудка, стволовой ваготомии) или двенадцатиперстной кишке;
2) экзокринная панкреатическая недостаточность (хронический панкреатит, рак, кистозный фиброз, резекция поджелудочной железы);
3) заболевания печени (хронические гепатиты, циррозы) и обструкция желчных путей (камни желчного пузыря или рак головки поджелудочной железы), что связано с недостаточностью желчных кислот, поступающих в ДПК;
4) ишемическая энтеропатия с возможным инфарктом кишечника (например, при отравлении свинцом, мезентериальном атеросклерозе);
5) воспаление тонкой кишки различной этиологии (острые и особенно хронические энтериты с развитием изменений в слизистой тонкой кишки вплоть до атрофии, что уменьшает ее всасывательную поверхность), болезнь Крона (с поражением ДПК или подвздошной кишки);
6) дисбактериоз, когда особенно страдает абсорбция жира и витамина В12, так как микробы вызывают деконъюгацию желчных кислот в кишечнике и поглощают витамин В12;
7) лучевая (радиационная) энтеропатия, связанная с облучением кишечника, например при лечении онкологических заболеваний, что вызывает отек слизистой, позднее - атрофию ворсинок и истончение слизистой оболочки. Поражение подвздошной кишки приводит к дефициту витамина В12 и нарушению кишечнопеченочного обмена желчных кислот;
8) резекция части тонкой кишки (синдром короткой кишки), связанная с травмой, тонкокишечной непроходимостью, сосудистыми тромбоэмболиями, тяжелой болезнью Крона и др.;
9) кишечная непроходимость в верхних отделах кишки, когда пищевые массы не поступают в дистальные ее отделы;
10) двигательные расстройства кишечника, в частности при ускоренной перистальтике, когда уменьшается время контакта химуса с всасывательной поверхностью тонкой кишки;
11) закупорка лимфатических путей (лимфангиоэктазия кишечника, болезнь Уиппла, лимфома);
12) сердечно-сосудистые болезни (перикардиты, застойная сердечная недостаточность IIБ-III стадии, васкулиты);
13) иммунодефицит, эндокринные нарушения (сахарный диабет, гипо- и гиперпаратиреоз, синдром Золлингера-Эллисона).
Вследствие нарушения всасывания развивается синдром мальабсорбции, который характеризуется, помимо изменений со стороны желудочно-кишечного тракта, патологическими изменениями со стороны других органов и систем (табл. 17-2).
Нередко возникает вздутие живота, обычно после еды, связанное с приемом молока, повышенное газообразование. Отмечается диарея в связи с накоплением в полости кишечника осмотически активных веществ, ускорением транзита по кишечнику и гиперэкссудацией. Наблюдается полифекалия с остатками непереваренной пищи. Возникает стеаторея - признак нарушения всасывания жира (потери жира с калом составляют более 5 г/сутки, доходя до 10 г/сутки и более).
Важным клиническим симптомом нарушения всасывания является потеря массы (при I степени мальабсорбции - до 5-10 кг, при II степени - свыше 10 кг, при III степени - свыше 20 кг). Возникают признаки гипоавитаминозов, трофические расстройства. Кожа становится сухой, с пониженным тургором, волосы - сухими, тусклыми, отмечается выпадение волос. Наблюдаются изменения ногтевых пластинок, их ломкость, а также болезни десен, гиперемия языка, сглаженность его сосочков, что объясняется дефицитом витаминов В2, В6, В12, никотиновой кислоты. Отмечается кровоточивость десен, связанная с дефицитом витамина С. Нередко развиваются полиневриты, нарушение зрения, обусловленные дефицитом витамина A. При тяжелом синдроме мальабсорбции ухудшается всасывание микроэлементов. Вследствие дефицита кальция возникает остеопороз, вплоть до остеомаляции. Нарушение всасывания железа ведет к развитию железодефицитной анемии. За счет нарушения всасывания белков развивается гипопротеинемия с последующим отечным синдромом. Могут наблюдаться нарушения деятельности эндокринных желез по типу плюригландулярной недостаточности - развитие эндокринопатии с поражением гипофиза, надпочечников, половых желез.
Таблица 17-2. Патогенез клинических проявлений недостаточности всасывания
Патогенез | Проявления недостаточности всасывания |
Нарушение всасывания жиров, углеводов, белков, уменьшение поступления в организм калорий | Снижение массы тела |
Нарушение всасывания аминокислот, гипопротеинемия | Периферические отеки |
Окончание табл. 17-2
Дефицит витамина D, остеопороз и остеомаляция в результате нарушения всасывания белков и кальция | Оссалгии (боли в костях), миопатия |
Дефицит витаминов группы В | Периферические невриты |
Нарушение всасывания кальция и магния | Парестезии, тетания |
Уменьшение всасывания белков, витамина В12, фолиевой кислоты, железа | Анемия |
Нарушение всасывания витамина К, дефицит витамина А | Геморрагии Ночная слепота (гемералопия, ксерофтальмия) |
Дефицит рибофлавина (В2) | Хейлит |
Дефицит витаминов В2, В6, В12, никотиновой кислоты | Глоссит |
Дефицит никотиновой кислоты | Дерматит |
Патологическое усиление всасывания может быть связано с повышенной проницаемостью кишечной стенки (например, при ее артериальной гиперемии или раздражении эпителия кишечника). Усиление всасывания легко развивается у детей раннего возраста, когда проницаемость кишечной стенки довольно высока. При этом быстро всасываются и вызывают интоксикацию продукты неполного расщепления пищевых веществ. В неизмененном виде может всасываться белок коровьего молока или куриного яйца, что вызывает сенсибилизацию организма с развитием аллергических реакций.
17.2.4.6. Нарушение двигательной функции кишечника
Моторная деятельность тонкой кишки обеспечивает перемешивание пищевого содержимого с пищеварительными секретами, продвижение химуса и повышение внутрикишечного давления, способствующего фильтрации некоторых компонентов в кровь и лимфу.
Расстройства двигательной функции кишечника проявляются в ускорении или замедлении перистальтики и чередовании этих процессов, а также в нарушении ритмической сегментации, происходящей за счет преимущественно циркулярного слоя мышц и
маятникообразных сокращений, обеспечивающих взаимодействие продольного и циркулярного слоев мышц. По длине кишки в норме одновременно движется несколько перистальтических волн. При расстройствах моторной деятельности кишечника отмечаются антиперистальтические сокращения, когда волна движения идет в обратном (оральном) направлении. Тонические сокращения могут иметь очень небольшую скорость и иногда не распространяться, что обусловливает сужение просвета кишки на большом протяжении.
Моторная активность кишечника возбуждается через парасимпатические нервные волокна. Важную роль коры головного мозга в регуляции моторики доказывает то, что моторика усиливается даже при мысли о вкусной пище, а при отрицательном отношении к еде, наоборот, тормозится. При страхе иногда наблюдается бурная перистальтика кишечника («нервный понос»). Моторика тонкой кишки зависит от физических и химических свойств химуса. Так, повышают ее активность грубая пища (черный хлеб, овощи) и жиры. На моторику кишечника влияет и ряд гуморальных веществ, действуя непосредственно на мышечные волокна и через рецепторы на нейроны интрамуральных нервных ганглиев. Так, усиление моторики тонкой кишки наблюдается при повышении уровня вазопрессина, брадикинина, серотонина, гистамина, холиномиметиков, холецистокинина - панкреозимина и пептидов (мотилина, гастрина). Обычно основной эмпирический ритм постоянный - около 8 сокращений в минуту. Однако в целом ряде случаев он учащен, например при тиреотоксикозе.
Торможение моторной активности кишечника происходит под влиянием симпатических волокон. Моторная активность снижается при голодании. У человека после 24-36 ч голодания она составляет 34% исходной.
Двигательная (моторная) функция тонкой кишки играет важную роль в эффективности абсорбции нутриентов из ее просвета. Благодаря сократительной функции кишечника происходит смешивание и продвижение содержимого в полости кишки, что не позволяет образоваться высокой концентрации продуктов гидролиза в одном пристеночном слое, создавая диффузионный барьер. В экспериментальных условиях доказано, что при высокой скорости транзита химуса по кишке снижается ее способность к абсорбции. Например, это происходит при включении в диету грубоволокнистых продуктов. Содержание глюкозы в крови становится в 2 раза меньше, чем при диете без грубых волокон.
Ускорение перистальтики. В результате ускорения перистальтики пищевая кашица продвигается по кишечнику быстрее и развивается понос (diarrhoea).
Диарея может быть острая (не превышает 2-3 недели) и хроническая (длится 4-6 недель и более), инфекционная и неинфекционная, воспалительная и невоспалительная. По механизму развития различают следующие типы диареи: гиперсекреторный (гиперэкссудативный) и гиперосмолярный, гипо- и гиперкинетический.
Гиперсекреторный тип диареи характеризуется повышенной секрецией воды и электролитов в просвет кишки. Это связано с воздействием на слизистую кишечника бактериальных эндотоксинов (при холере, кишечных инфекциях), желчных и жирных кислот, глюкагона, простагландинов и целого ряда слабительных средств (бисакодил, касторовое масло, фенолфталеин). Патогенез бактериальной диареи обусловлен двумя механизмами: инвазией бактерий в слизистую оболочку и гиперсекрецией, вызванной энтеротоксинами. Гиперсекреторная диарея отмечается и при увеличении гидростатического давления вследствие поражения лимфатической системы кишечника (при лимфоэктазах, амилоидозе кишечника, лимфоме, болезни Уиппла) и правожелудочковой сердечной недостаточности. Стул обычно при этом типе диареи обильный, водяной.
Очень тяжелые поносы (так называемая водная диарея) могут быть обусловлены избыточной продукцией вазоактивного интестинального полипептида, который в норме содержится в желудочно-кишечном тракте, в основном в стенке тонкой кишки. Он подавляет секрецию соляной кислоты, стимулирует кишечную и панкреатическую секреции, повышает концентрацию цАМФ в слизистой тонкой кишки. Вазоактивный интестинальный полипептид (ВИП) продуцируют некоторые опухоли - ганглионейробластомы (чаще у детей) и аденомы островковой ткани (не α- и не β-клеточная) поджелудочной железы - ВИПомы (синдром Вернера-Моррисона - «панкреатическая холера»). Воздействуя на специфические рецепторы эпителия кишечника, ВИП активирует аденилатциклазу и повышает уровень цАМФ. Это вызывает увеличение секреции воды и электролитов, вследствие чего развивается профузный водянистый понос (осмотическая плотность стула близка к осмотической плотности плазмы). Наступает обезвоживание (теряется более 3 л в сутки, иногда до 20 л), прогрессирует ги-
покалиемия (усиленная потеря калия со стулом), метаболический ацидоз, кахексия (при отсутствии стеатореи). Вследствие влияния ВИП на сосудистый тонус у части больных отмечаются приливы (ощущение жара в течение 2-3 мин) с пурпурным окрашиванием лица и верхней половины туловища, а у другой части развивается сахарный диабет. Определяется повышенный уровень циркулирующего ВИП, однако этот показатель имеет большой процент ложноположительных и ложноотрицательных результатов. Хроническая диарея может быть проявлением и других эндокринных опухолей, которые вырабатывают стимуляторы секреции. Например, при карциноме щитовидной железы диарея обусловлена повышенной секрецией кальцитонина и других пептидов.
С избыточным образованием цАМФ связан понос при холере. Токсин холерного вибриона (холероген) в комплексе со специфическим рецептором с1т1-ганглиозидом активирует аденилциклазу, катализирующую образование цАМФ. Развивается тяжелая водная диарея. Следует отметить, что при холере слизистая оболочка кишки остается нормальной и сохраняется ее абсорбционная способность. Это создает основу для проведения пероральной регидратации растворами, содержащими простые сахара и хлорид натрия (первые стимулируют абсорбцию последнего).
При гиперосмолярном типе диареи имеет место снижение абсорбции воды и электролитов. Такой тип диареи отмечается при нарушениях всасывания, что наблюдается при глютеновой болезни, ишемической болезни тонкой кишки, врожденных дефектах всасывания, при хроническом панкреатите, раке поджелудочной железы, дефиците желчных кислот (например, при механической желтухе), недостаточном времени контакта химуса с кишечной стенкой (при резекции тонкой кишки, энтероанастомозах) и т.д. Отмечаются полифекалия и стеаторея. Так, при резекции подвздошной кишки и некоторых заболеваниях тонкой кишки (например, при болезни Крона) может возникнуть диарея вследствие нарушения всасывания желчных кислот и свободных жирных кислот, стимулирующих секрецию жидкости в толстой кишке. В легких случаях тормозится всасывание только желчных кислот. В особенно тяжелых (резекция более 100 см терминального отдела подвздошной кишки) ухудшается всасывание как желчных кислот, так и солей, что, в свою очередь, обусловливает нарушение переваривания и всасывания жирных кислот. Последние, попадая в толстую кишку, вызывают диарею. При других формах
стеатореи, например при панкреатогенной недостаточности, неабсорбированные триацилглицеролы достигают толстой кишки, где гидролизуются микроорганизмами до жирных кислот, что также обусловливает диарею.
Гипо- и гиперкинетический типы диареи обусловлены стимуляцией: нейрогенной, например при синдроме раздраженного кишечника, диабетической энтеропатии; гормональной (серотонин, секретин, панкреозимин); фармакологической (слабительные средства - изофенин, фенолфталеин). Возможно замедление транзита содержимого кишечника при склеродермии, синдроме слепой кишки. Стул обычно жидкий или кашицеобразный, необильный.
Замедление перистальтики. При замедлении перистальтики тормозится продвижение пищевого химуса по кишечнику, и развиваются запоры (obstipatio). При запоре увеличиваются интервалы между актами дефекации по сравнению с индивидуальной физиологической нормой или систематически недостаточно опорожняется кишечник. Частота стула весьма вариабильна и может меняться в зависимости от привычки опорожнять кишечник через определенное время, характера питания, климатических и других факторов. У большинства людей стул бывает раз в сутки, у части - 2 раза и у значительно меньшего процента (7%) - 3 раза в сутки и более. Как правило, хроническую задержку опорожнения кишечника более чем на 48 ч рассматривают как запор.
Терминальный отдел пищевого тракта, осуществляя абсорбцию воды и минеральных солей, принимает участие в регуляции водносолевого обмена. Основные функции толстой кишки (формирование, продвижение, удержание и выброс каловых масс) реализуются путем взаимодействия следующих компонентов моторики - тонуса кишечной стенки, различных по силе и протяженности перистальтических волн, их координации и дискоординации. Двигательная активность толстой кишки находится под влиянием нервных, эндокринных, физических и алиментарных факторов. Кроме того, характерным является участие в регуляции моторики микрофлоры и эмоционально-психической сферы человека.
Наиболее полно этиологические и патогенетические факторы учитывает классификация А.В. Фролькис, выделяющая запоры: 1) алиментарные; 2) неврогенные (дискинетические, рефлекторные), вследствие подавления позывов к дефекации, при органических заболеваниях ЦНС; 3) гиподинамические; 4) вследствие воспалительных заболеваний кишечника; 5) проктогенные; 6) механи-
ческие; 7) вследствие аномалий развития толстой кишки; 8) токсические; 9) медикаментозные; 10) эндокринные; 11) вследствие нарушений водно-электролитного обмена.
Запоры могут быть проявлением механических препятствий в кишечнике: заворот сигмовидной кишки, дивертикулиты, инвагинация, грыжи, опухоль, рубцы, каловые камни и др. Выделяют проктогенные запоры, т.е. обусловленные патологическими процессами в анальной области прямой кишки (геморрой, трещины заднего прохода и перианальные абсцессы). Их связывают с подавлением позывов к дефекации из-за сильных болей и со спазмом анального сфинктера, механически препятствующим выходу каловых масс. Возможны так называемые старческие запоры, связанные с атонией кишечника. Нарушения двигательной активности кишечника могут быть связаны и с эндокринной патологией. К запорам эндокринного происхождения относят дискинезию кишечника у женщин во время беременности, после родов, в климактерическом периоде. Так, во время беременности и после родов наблюдается относительная гипотония мускулатуры кишечника, обусловленная гормональными изменениями в организме женщины. Хронические запоры развиваются при гипотиреозе, что связано с характерным замедлением транзита по кишечнику. Подобная ситуация возникает и при гиперкальциемии.
По характеру двигательных нарушений выделяют гипер- и гипокинетические запоры. Гиперкинетические запоры возникают при спазме стенки кишки, затрудняющем продвижение пищевого химуса по кишечнику. Спазм чаще развивается в участках кишечника, где имеют место усиленные сокращения (сфинктер Вали, переход слепой кишки в восходящую и ободочную кишку и др.). Гиперкинетический тип запоров возможен при отравлении ртутью, свинцом, сулемой, при приеме медикаментов (препараты железа, кальция, транквилизаторы, ганглиоблокаторы и др.). Возможно развитие этого типа запоров под влиянием эмоций и психотических состояний (психогенные запоры). Они возникают как реакция на неблагоприятные условия для опорожнения кишечника, т.е. отрицательные эмоции, например при необходимости совершать акт дефекации в негигиенической обстановке, могут приводить к его непроизвольному подавлению. При многократных «торможениях» дефекации позывы исчезают и развиваются привычные запоры. Этот вид запоров может возникнуть под влиянием и других психогенных факторов (психическое перенапряжение, депрессия,
шизофрения, наркомания), а также может быть связан с влиянием висцеро-висцеральных рефлексов с желудка, поджелудочной железы, желчных путей и др.
Изменение объема кишечного содержимого, состава кишечной микрофлоры, расстройство желудочно-кишечного рефлюкса могут приводить к ослаблению пропульсивной моторики, т.е. к развитию гипокинетических запоров. Достаточно часто к запорам приводят скудное питание, прием легкоусвояемой, бедной клетчаткой пищи (механически и химически щадящие диеты). Использование химически очищенных, полностью растворимых в воде продуктов, применяемых в космических полетах, обусловливает урежение частоты стула до 1 раза в 5-7 дней, возникают алиментарные запоры. В летний период, когда потребляется много фруктов и овощей, частота запоров снижается. Доказана роль пищевых волокон в стимуляции опорожнения кишечника. Отруби увеличивают суточное количество фекалий, ускоряют кишечный транзит. Запоры усугубляются сухоядением (высыхание каловых масс), недостатком в диете солей кальция и калия, чрезмерным перевариванием пищевых масс в желудке, например при гиперхлоргидрии. Кроме того, недостаточное, а также несвоевременное потребление пищи приводит к нарушению желудочно-кишечного рефлюкса, стимулирующего большие перистальтические волны. Поэтому лица, пренебрегающие завтраком, нерегулярно принимающие пищу, часто страдают запорами. Гипокинетические запоры возникают и при отсутствии физических упражнений (при гиподинамии).
К первичным моторным расстройствам аноректальной области и тазового дна относятся врожденные нарушения перистальтики кишечника при болезни Гиршпрунга, подвижной слепой и сигмовидной кишке и врожденном спланхноптозе. При болезни Гиршпрунга отмечается аномалия развития толстой кишки, характеризующаяся хроническим застоем кишечного содержимого, расширением ободочной кишки с гипертрофией ее стенки. Сущность болезни заключается в полном отсутствии или дефиците интрамуральных нервных ганглиев. Так, полностью отсутствуют ганглионарные клетки ауэрбахова сплетения во внутреннем анальном сфинктере, прямой и сигмовидной кишке. Пораженный участок кишечника сужен, не перистальтирует, кишечное содержимое над местом поражения застаивается, происходит расширение вышележащих отделов толстой кишки (мегаколон). Стенка кишки гипертрофируется, так как перистальтика усиливается вследствие необ-
ходимости преодолевать суженный неперистальтирующий участок. Установлено, что в этом участке резко снижены концентрации ВИП и вещества P, которые в норме стимулируют перистальтику кишечника. При длинной зоне поражения нарастает картина кишечной непроходимости. Стула обычно не бывает 3-7 дней, в редких случаях он самостоятельный, большей частью - только после клизмы.
Кишечная непроходимость (ileus) - нарушение проходимости кишечника вследствие нарушения его функций или механического препятствия. Кишечная непроходимость может быть врожденной, что обусловлено неправильным развитием кишечной трубки во внутриутробном периоде, и приобретенной. Приобретенная кишечная непроходимость по патогенезу разделяется на механическую, динамическую и тромбоэмболическую.
Механическая непроходимостьсвязана с механическим закрытием просвета кишки опухолью, каловыми камнями (копростаз), гельминтами, инородными телами или обусловлена сдавлением кишки извне опухолью, рубцом. Механическая непроходимость развивается при завороте кишки, инвагинации, ущемлении кишечной петли в грыжевом отверстии, при спаечном процессе в брюшной полости. Выделяют следующие ее причины: 1) внекишечное сдавление кишки, например при спайках брюшной полости, грыжах (наружные и внутренние); 2) внутреннее сдавление кишки (дивертикулез, рак, региональный энтерит, или болезнь Крона); 3) обтурация, например желчными камнями или при инвагинации.
Чаще всего причинами непроходимости тонкой кишки становятся спайки брюшной полости и наружные грыжи, а толстой кишки - раковая опухоль, дивертикулит (сигмовидная кишка) и заворот. Механическая непроходимость может быть обтурационной и странгуляционной. При обтурационной непроходимости просвет кишки закрыт, но кровообращение в ее стенке первоначально не нарушено, при странгуляционной, наряду с обструкцией просвета кишечника, происходит сдавление сосудов и нервов брыжейки, что обусловливает крайне тяжелую клиническую картину. Быстрое нарушение питания стенки кишки ведет к ее некрозу. При смешанной непроходимости, наряду с перекрытием просвета кишки, происходит постепенное сдавление ее брыжейки с нарушением кровоснабжения кишечной стенки.
Динамическая непроходимость возникает при спазме (спастическая), что может наблюдаться при отравлении солями тяжелых
металлов, заболеваниях желчных путей и других органов брюшной полости или параличе кишечной мускулатуры (паралитическая), когда перистальтика кишечника резко ослабевает вплоть до полного прекращения. Это возникает при тяжелых длительных операциях на брюшной полости, травмах.
Тромбоэмболическая (гемостатическая) непроходимость кишечника развивается в результате нарушения кровообращения в кишечной стенке при тромбозе (эмболии) или параличе ее сосудов. Тромбоз или эмболия кишечных артерий может быть проявлением выраженного атеросклероза, сердечной недостаточности, может осложнять мерцательную аритмию, имплантацию искусственных сердечных клапанов или тяжелые пороки сердца. Вовлечение в процесс крупных артериальных сосудов кишечника возможно и при системных васкулитах.
Патогенез кишечной непроходимости сложен. Происходит растяжение кишки при скоплении в ней газов и жидкого содержимого проксимальнее обтурированного сегмента. Скопившаяся в кишке жидкость состоит из слюны, желудочного сока, желчных и панкреатических ферментов. В первые 12-24 ч обструкции снижается двигательная активность кишки, замедляется транспорт натрия и, следовательно, воды из просвета расширенной кишки в кровь. Через 24 ч натрий и вода накапливаются в просвете кишки, что сопровождается ее растяжением и потерей жидкости. Внутрикишечное давление нарастает, возникает рвота. Наступает странгуляция (резко нарушается кровообращение) в связи с выраженным растяжением кишки проксимальнее участка окклюзии. Интрамуральный кровоток снижается настолько, что наступает некроз кишки. При нарушении ее кровоснабжения усиленно размножается патогенная бактериальная флора с последующим развитием перитонита. Высокое стояние диафрагмы из-за вздутия кишечника вызывает нарушение легочной вентиляции с развитием ателектазов в легких. Нарушается отток крови в системе нижней полой вены. Потеря тканями организма жидкости и электролитов может носить выраженный характер. В результате быстро наступают обезвоживание и сгущение крови. В крови снижается содержание хлоридов, которые вместе с водой переходят в брюшную полость, увеличивается содержание аммиака, мочевины и других продуктов гниения, образующихся в кишечнике и всасывающихся в кровь. Развивается тяжелая кишечная аутоинтоксикация. Нарастающая гиповолемия ведет к развитию острой почечной недоста-
точности, шоку и смерти больного. При полной обтурации газы и кал не отходят. Кровь в кале определяется редко, только иногда при инвагинационной форме окклюзии. Возможна каловая рвота, чаще при непроходимости тонкой кишки, чем толстой.
Выделяют псевдонепроходимость кишечника, в основе которой лежат выраженные нарушения моторики, что способствует растяжению кишки, возникновению болей в животе, тошноты и даже рвоты. Псевдонепроходимость может быть первичной и вторичной. При первичной, или идиопатической, псевдообструкции нарушение двигательной активности кишки обусловлено аномалией симпатической иннервации или ее мышечного слоя, и у больного отсутствует какое-либо системное заболевание. При вторичной псевдонепроходимости расширение толстой или/и тонкой кишки связано с вовлечением в процесс мышечного слоя, например при аутоиммунных заболеваниях (дерматомиозите, склеродермии, амилоидозе) либо автономной висцеральной нервной системы при эндокринных заболеваниях - сахарном диабете, микседеме. Вторичная псевдонепроходимость может развиться при хронических заболеваниях нервной системы (болезнь Паркинсона, цереброваскулярная болезнь), а также может быть связана с побочным действием ряда лекарственных препаратов (антагонисты кальция, холинолитики, β-адреноблокаторы, психотропные и др.).
Нарушения дефекации. Могут возникнуть в следующих ситуациях:
1) при сильных психических потрясениях (страх, испуг) выпадает влияние коры головного мозга на спинномозговой центр дефекации, и при этом дефекация наступает непроизвольно (рефлекторно);
2) при повреждениях n. pelvici, n. hypogastrici дефекация нарушается, так как расстраивается функция мышц, участвующих в этом акте;
3) при воспалительных процессах в прямой кишке (при проктитах любой этиологии) повышается чувствительность ее рецепторов и возникают ложные позывы к дефекации (тенезмы);
4) при травмах пояснично-крестцового отдела спинного мозга вследствие выключения центра дефекации возникает недержание каловых масс либо отсутствуют позывы к дефекации. Кроме того, в связи с нарушением работы мышц брюшного пресса опорожнение прямой кишки может быть неполным, и могут возникать запоры;
5) при снижении мышечного тонуса и физической активности у престарелых, лежачих больных нарушается акт дефекации, появляются ощущение переполнения прямой кишки, позывы к дефекации, развиваются запоры или парадоксальная диарея (когда жидкий кал проходит через дистальные каловые камни).
Метеоризм (скопление газов в кишечнике, его вздутие). Через пищеварительный тракт здоровых людей каждые сутки проходит большое количество газов. Газы поступают в кишечник вместе с вдыхаемым воздухом и частично диффундируют из крови. Определенное количество газов образуется в кишечнике в результате ферментативных процессов и жизнедеятельности кишечной микрофлоры. В среднем за сутки образуется около 500 см3 газов. Однако это может быть усилено аэрофагией или повышенным образованием газов кишечными бактериями. Газообразование нарастает при синдроме мальабсорбции, особенно при употреблении в пищу таких продуктов, как бобы, горох, цветная и кочанная капуста, характеризующихся высоким содержанием неперевариваемых полисахаридов. При задержке газов в кишечнике в условиях брожения и гниения возрастает количество углекислоты, метана, сероводорода. При этом нарушается кровообращение в кишечной стенке, перераздражаются ее механо- и хеморецепторы. Может возникнуть ряд рефлекторных сдвигов: торможение диуреза, нестабильность артериального давления. Из-за высокого стояния диафрагмы нарушается дыхание. Тормозится секреция пищеварительных желез, усиливается гипотония кишечника, что еще более усугубляет метеоризм. Создается «порочный круг».
17.2.4.7. Нарушение выделительной функции кишечника
Главные механизмы экскреции (сорбция веществ мембранами, различные виды мембранного транспорта) лежат в основе межорганного обмена нутриентов, ведущую роль в котором играет пищеварительная система. Термин «нутриенты» (питательные вещества) в данном случае является более точным, так как происходит от слова «nutrition» - питание. Известно, что в деятельности желудочнокишечного тракта, помимо собственно пищеварения, есть и другая сторона, связанная с выделением в его полость значительного количества эндогенных веществ, которые вместе с экзогенными перевариваются, всасываются и способствуют ассимиляции нутриентов во всем организме. В организме сложилось согласованное
взаимодействие между разными органами для получения необходимых нутриентов и снабжения ими друг друга, что способствует нормальному течению и хорошей координации обмена веществ во всем организме. Некоторые ткани, благодаря их специализированному обмену, способны интенсивно синтезировать определенные вещества и не только удовлетворять в них свою собственную потребность, но и экспортировать их с кровью для использования другими тканями. Например, мышцы при голодании выделяют в кровь аминокислоты с разветвленной углеводной цепью, усиленно используемые мозгом. Почки интенсивно выделяют в кровь серин, используемый затем почти всеми тканями организма.
Участие пищеварительной системы в межорганном обмене нутриентов выражается: а) в кругообороте белковых веществ между кровью и пищеварительной системой; б) в кругообороте некоторых минеральных веществ, в частности цинка; в) в экспорте фосфолипидов и прочих соединений печенью для использования их другими, бурно пролиферирующими тканями; г) в выделении эндогенных нутриентов при периодической деятельности желудочнокишечного тракта в условиях голода.
Кругооборот нутриентов представляет интерес в клиническом аспекте. Где бы ни происходило нарушение их кругооборота (в местах выделения эндогенного вещества, его транспорта или в зоне всасывания в кишечнике), во всех случаях может возникать вторичная недостаточность данного вещества в организме.
Роль кишечника в обмене веществ определяется не только его всасывательной деятельностью, но и способностью выделять белок и другие вещества из крови. Доказана роль пищеварительного тракта в потере эндогенного белка. Для объективной оценки роли желудочно-кишечного тракта в переваривании и всасывании белка необходимо знать скорость синтеза и распада белка в организме. Результаты исследования с меченым альбумином свидетельствуют о том, что в норме 10-20% альбуминов может выводиться через кишечник. Выделение белка из кровяного русла в желудочнокишечный тракт осуществляется с помощью простой диффузии. При этом транссудация происходит не через клетки слизистой, а через межклеточное пространство его эпителия. Количество белка, проходящее в кишечник, пропорционально гидростатическому давлению и концентрации плазменного белка в экстраваскулярном пространстве. Подсчитано, что за сутки в физиологических условиях у человека в полость пищеварительного тракта выделяется 80 г
белка. Однако у здорового человека потеря его с фекалиями незначительна. Большая часть выделившегося в желудочно-кишечный тракт белка подвергается ферментативному расщеплению до аминокислот, которые всасываются наряду с продуктами гидролиза экзогенных нутриентов. Этот процесс способствует обеспечению постоянства аминокислотного гомеостаза. Часть белка поступает в желудочно-кишечный тракт с секретами пищеварительных желез, часть - теряется с клетками десквамированного эпителия. Кроме того, в просвет кишечника за сутки выделяется примерно 20 г жира. Экспериментальные исследования показали, что холестерин, триацилглицеролы, ряд фосфолипидов выделяются только в составе слущивающихся эпителиальных клеток, и лишь свободные жирные кислоты могут выделяться путем транссудации. У здоровых людей липиды, выщеляющиеся в кишечник, практически полностью реабсорбируются, и потеря их с калом ничтожна. Со слущенными клетками поступают в просвет желудочно-кишечного тракта и другие вещества - железо, фолиевая кислота и т.д.
При увеличении выделительной функции может развиваться синдром «экссудативной энтеропатии» - протеинизнуряющая энтеропатия - потеря белка в связи с повышенным его выделением в желудочно-кишечный тракт. Основной механизм повышенной потери белка с калом - это увеличение его транссудации в просвет желудочно-кишечного тракта, возникающее при повышении давления в лимфатических сосудах кишечника. В связи с этим транссудация белка в кишечник усиливается у больных с закупоркой или стазом кишечных лимфатических путей (гранулематоз, неопластические процессы, лимфангиоэктазии в кишечнике, констриктивный перикардит). Возможна экссудация белка через воспаленную или изъязвленную слизистую. Белки теряются и при разрушении слизистой оболочки (ворсинчатого и поверхностного эпителия), что нарушает регуляцию их диффузии по межклеточным пространствам.
Как самостоятельное заболевание этот синдром встречается довольно редко (первичная экссудативная энтеропатия - идиопатическая интестинальная лимфангиоэктазия). Вторичные же экссудативные энтеропатии довольно часты - около 90 заболеваний сопровождается этим синдромом. Симптоматические экссудативные энтеропатии наблюдаются при гигантском гипертрофическом гастрите (болезнь Менетрие), при состояниях после резекции желудка, при ряде заболеваний кишечника (тропическая, нетро-
пическая спру, острый гастроэнтерит, болезнь Крона, язвенный колит), при циррозах печени, констриктивном перикардите, сердечной недостаточности, при генерализованных лимфосаркомах, нефротическом синдроме, лучевой болезни и др.
Вследствие потери белка с калом (протеинореи) при экссудативной энтеропатии имеют место выраженная гипопротеинемия со значительным снижением содержания альбуминов в крови и диспротеинемия. Выраженная гипопротеинемия вызывает снижение в крови онкотического давления с последующей транссудацией жидкости из капилляров в ткани, при этом развиваются отеки, вторичный альдостеронизм с задержкой выделения воды и ионов натрия из организма. С калом теряется и ряд важнейших биологически активных веществ белковой природы - прежде всего иммуноглобулины. Это обусловливает снижение концентрации иммуноглобулинов различных классов, трансферрина, церулоплазмина и др. Вследствие гипогаммаглобулинемии, дефицита иммуноглобулинов возникают иммунодефицитные состояния со склонностью к вторичным инфекциям. Снижается и содержание в крови липопротеинов, холестерина. Наряду с протеинореей отмечается выраженная энзиморея. Больные теряют с калом пищеварительные ферменты (энтерокиназу и др.), ряд ингибиторов ферментов (альфа1-антитрипсин и др.), кальций и другие вещества.
Скорость синтеза и разрушения альбумина определяют при введении радиоактивного альбумина внутривенно для исследования уровня радиоактивности в сыворотке крови. Экссудативную энтеропатию подтверждают сниженное количество внутрисосудистого и общего пула альбумина, его неизменный или ускоренный синтез, заметно укороченный период «жизни» и увеличение потерь белка с калом. Разработан и неинвазивный метод диагностики экссудативной энтеропатии, не требующий использования радиоактивных изотопов. Метод основан на определении интестинального клиренса альфа1-антитрипсина. Этот антифермент при его определении в кале и крови становится эндогенным маркером потери белка с фекалиями. Содержание его у здоровых лиц составляет 0,4 мг/г сухой массы кала, при интенсивной лимфангиоэктазии - 16,2 мг/г, у больных с болезнью «трансплантат против хозяина» с экссудативной энтеропатией - 18,8-
38,8 мг/г.
17.2.4.8. Кишечная аутоинтоксикация
Кишечная аутоинтоксикация развивается при снижении кишечной секреции, кишечной непроходимости, механическом и токсическом повреждении слизистой оболочки кишки и т.д. Желудочно-кишечный тракт у человека и животных является естественной средой обитания микроорганизмов. Особенно богата микрофлорой толстая кишка. У позвоночных число микробов в ней составляет 1010-1011/г кишечного содержимого. В тонкой кишке их количество значительно меньше благодаря бактерицидным свойствам желудочного сока и, вероятно, эндогенным антимикробным факторам тонкой кишки. За сутки с калом выделяются триллионы бактерий. Микрофлора кишечника вызывает в нем процессы брожения и гниения, но в норме они выражены нерезко. Образующиеся токсические вещества выводятся из организма или обезвреживаются, и интоксикации не наступает. Процессы брожения и гниения усиливаются при снижении кишечной секреции и нарастании метеоризма, что обычно сопровождает запоры. Наиболее выражена интоксикация при кишечной непроходимости. Существенное значение имеют механическое и токсическое повреждения слизистой оболочки кишки. В патологический процесс вовлекается нервный аппарат кишечника, что приводит к нарушению его двигательной и секреторной функций и усугубляет трофические расстройства в кишечной стенке. Развивается дисбактериоз, характеризующийся уменьшением количества микроорганизмов, которые постоянно присутствуют в кишечнике (бифидумбактерии, кишечная палочка, лактобактерии). Нарушается соотношение бактерий в различных отделах кишечника с усиленным размножением условно-патогенной и появлением патогенной флоры. Возникает вторичная ферментопатия. Все это приводит к усилению процессов брожения и гниения. Аминокислоты превращаются в токсические вещества: сероводород, скатол, крезол, индол, фенол и др. При декарбоксилировании аминокислот образуются биогенные амины: гистамин, кадаверин, путресцин. Частично они обезвреживаются в кишечной стенке под влиянием аминооксидаз. Однако при избытке этих веществ они всасываются в кровь и по системе воротной вены поступают в печень. В печени индол и скатол обезвреживаются путем связывания серной и глюкуроновой кислотами (образуются индоксилсерная, скатоксилсерная, индоксилглюкуроновая и скатоксилглюкуроновая кислоты). Другие ток-
сические вещества в печени дезаминируются, окисляются, также превращаясь в безвредные соединения. Частично они экскретируются почками. Если же токсических веществ образуется много и процессы гниения в кишечнике продолжаются длительное время, то происходит перегрузка обезвреживающей функции печени. При развитии печеночной недостаточности основное значение по выведению циркулирующих в крови токсинов приобретают почки. Но если функциональное состояние почек страдает, то явления кишечной интоксикации нарастают. Находясь в кишечнике, токсические вещества рефлекторно оказывают влияние на различные органы и системы. Кроме чувства распирания в животе, вздутия, урчания в кишечнике, тошноты, возникает неприятный вкус во рту, появляются разбитость, слабость, быстрая утомляемость, головные боли, снижение аппетита, бессонница, депрессия. При хронической кишечной интоксикации могут возникать дистрофические изменения в органах, в том числе миокарде.
Циркулирующие в крови токсические вещества воздействуют на рецепторы сосудов и центры головного мозга. Это может приводить к нарушениям деятельности сердечно-сосудистой системы в виде снижения артериального давления, ослабления сердечных сокращений. Возможно угнетение дыхания. Уменьшение запасов гликогена в печени и гипогликемия могут привести к коматозному состоянию. Хроническая кишечная интоксикация ведет к анорексии и тяжелому нарушению пищеварения вследствие угнетения желез пищеварительного тракта.
17.3. ПОСЛЕДСТВИЯ УДАЛЕНИЯ РАЗЛИЧНЫХ ОТДЕЛОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Первые опыты по изучению этого вопроса были проведены в экспериментальной лаборатории Е.С. Лондона. Удаление кардиального отдела желудка у собак вело к булимии и полифагии. Прием пищи часто заканчивался рвотой, которая напоминала приступ удушья и сопровождалась сокращением шейных мышц. Особенности рвоты объяснялись тем, что она возникала при наличии пищи в пищеводе (пищеводная рвота).
Выключение привратника (наложение гастроэнтероанастомоза) вызывало нарушение эвакуации пищевого химуса из желудка,
тем более выраженное, чем на более нижележащий отдел тонкой кишки накладывался анастомоз. Удаление дна желудка вело к нарушению его резервуарной и секреторной функций. Расстройства были более выражены при полном удалении желудка, однако его функции постепенно брали на себя нижележащие отделы пищеварительного тракта.
После хирургических операций, таких, как пилоропластика, гастрэктомия, антрэктомия, приводящих к нарушению функций антрального отдела желудка или привратника, из-за быстрой эвакуации содержимого желудка в кишечник у ряда больных наблюдается специфический симптомокомплекс, известный как «демпинг-синдром». Ранний демпинг-синдром развивается в течение первого часа после еды, когда появляются чувство быстрого насыщения, жидкий стул, вздутие и боли в животе. Отмечаются также вегетативные реакции в виде покраснения лица, потливости, тахикардии. Эти симптомы связаны с поступлением большого количества гипертонического химуса из желудка или его культи в проксимальные отделы тонкой кишки. При этом происходит рефлекторная стимуляция моторики, обусловливающая диарею и внезапное увеличение содержания жидкости в тонкой кишке, что ведет к ее растяжению. Вследствие этого возможна гиповолемия. Симптоматика усиливается в результате высвобождения кишечных гормонов и вазоактивных медиаторов (брадикинин, серотонин и др.), которые и вызывают вегетативные расстройства. Поздний демпинг-синдром включает в себя головокружение, головные боли, дрожание, сердцебиение, потливость, голод, спутанность сознания и иногда обмороки через 1,5-3 ч после еды. Симптомы могут появиться и раньше, если пищевые продукты содержат большое количество простых углеводов, особенно сахарозу. Этот синдром обусловлен гипогликемией. Вначале происходит быстрое увеличение количества глюкозы в крови (гипергликемия) из-за резкого поступления сахаросодержащих компонентов пищи из желудка в проксимальные отделы тонкой кишки, которое сменяется гипогликемией. Быстрое всасывание углеводов стимулирует высвобождение инсулина, который циркулирует в крови дольше, чем глюкоза, и в конечном итоге развивается гипогликемия.