Патофизиология Новицкого, Е.Д. Гольдберга Тома 1 и 2 - 2009 г.
|
|
|
|
ГЛАВА 21 ПАТОФИЗИОЛОГИЯ НЕРВНОЙ СИСТЕМЫ
21.1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ НЕРВНЫХ РАССТРОЙСТВ
21.1.1. Причины и условия возникновения нарушений деятельности нервной системы
Патогенные факторы, вызывающие повреждения нервной системы, имеют экзогенную либо эндогенную природу. Экзогенные патогенные факторы могут быть нейротропными, поражающими определенные структуры нервной системы, т.е. специфическими. Неспецифические этиологические факторы повреждают не только нервную, но и другие ткани. К экзогенным факторам, поражающим нервную систему, относятся биологические возбудители: вирусы (бешенство, полиомиелит), микробы (лепра), растительные токсины (стрихнин, кураре), микробные токсины (ботулинический, столбнячный), спирты (этиловый, метиловый), ядохимикалии (хлорофос), отравляющие вещества и др. Специфическим для человека патогенным фактором является слово. Оно может вызвать нарушения психической деятельности, поведения, расстройства различных функций по условно-рефлекторному механизму.
Эндогенные патогенные факторы делятся на первичные и вторичные. К первичным относятся наследственные нарушения деятельности генетического и хромосомного аппаратов нейронов. С ними связаны наследственные болезни нервной системы (болезнь Дауна, эндогенные психозы и др.), нарушения кровообращения в различных отделах ЦНС, ишемия и др.
К вторичным эндогенным патогенным воздействиям относятся поражения внутренних органов и систем, когда нервная ткань вовлекается в патологический процесс в ходе развития основного заболевания (печеночная энцефалопатия, уремическая кома, диабетические нейропатии и комы и т.д.).
Этиологичекие факторы вызывают изменения в нервной системе. Последние играют роль патогенетических факторов: изменения нейронов, нарушение выделения и рецепции нейромедиаторов, приобретенные альтерации генома нейронов, изменения межнейрональных отношений, нервной трофики, образование антител к нервной ткани, нарушение работы антисистем (противоболевой, противосудорожной и др.). Типовыми патогенетическими изменениями могут быть формирование агрегатов гиперактивных нейронов, представляющих собой генераторы патологически усиленного возбуждения (ГПУВ), образование патологических детерминант, патологических систем и патологической доминанты.
Понимание особенностей патогенеза и знание механизмов развития патологического процесса необходимы для проведения адекватной патогенетической терапии. Так, бесполезно лечить вызванные столбнячным токсином поражения ЦНС только противостолбнячной сывороткой, нейтрализующей столбнячный токсин, так как последний уже связался с нервными элементами и вызвал соответствующие изменения в ЦНС (в частности, повреждение белков, участвующих в выделении тормозных передатчиков). Терапия на этой стадии должна быть направлена на устранение последствий действия столбнячного токсина (подавление гиперактивности нейронов, борьба с судорогами и др.). Применение противостолбнячной сыворотки на данной стадии необходимо для нейтрализации новых порций столбнячного токсина, продуцируемого в ране столбнячной палочкой.
Реализация патогенных воздействий зависит от их силы и продолжительности - чем сильнее и длительнее эти воздействия, тем значительнее их эффект. Однако даже слабые патогенные воздействия, если они продолжительны и постоянны, могут вызывать глубокие и устойчивые изменения нервной системы. Например, при дробном, повторяющемся введении нейротропных токсинов (столбнячный, ботулинический и др.) их суммарная доза, вызывающая патологический эффект и гибель животного, может быть меньше той, которая вызывает аналогичный эффект при однократном введении всей дозы токсина (феномен Беринга). Ежедневная электрическая стимуляция структур мозга током подпороговой силы, не сопровождающаяся видимой реакцией, обусловливает нарастание судорожной готовности мозга. С течением времени на те же подпороговые воздействия животное отвечает уже судорогами (феномен «раскачки», или киндлинг). В повседневной жизни
длительно действуют многие стрессорные, неврозогенные факторы, профессиональные вредности и т. п.
Факторы, не вызывающие патологии исходно нормальной нервной системы, могут приобрести патогенное значение для нервной системы, измененной предыдущими патологическими процессами, при генетически обусловленной предрасположенности, повышенной возбудимости и пр. Лимбические структуры, в частности гиппокамп, более других способны развивать и сохранять патологическую гиперактивность, которая может быть вызвана даже однократным патогенным воздействием.
Важную роль в сохранении патологических эффектов играет пластичность нервной системы - способность закреплять возникшие изменения. Это свойство обеспечивает возможность ее развития, образования новых связей, обучения, структурных перестроек и др. Однако пластичность - слепая сила, она закрепляет не только биологически полезные, но и патологические изменения. Благодаря пластичности закрепляются возникшие структурнофункциональные патологические изменения в нервной системе (например, синаптические нарушения, образовавшиеся генераторы возбуждения, патологические системы и др.). С пластичностью связаны во многих случаях хронизация патологического процесса и его устойчивость к лечебным воздействиям.
Патогенетические изменения в нервной системе представляют собой два рода явлений. Первое из них - повреждение и разрушение морфологических структур, функциональных связей и физиологических систем. Оно обозначено И.П. Павловым как «полом» и является результатом непосредственного действия патогенного агента. Другое явление заключается в возникновении новых, патологических интеграций из измененных нервных структур.
Сам «полом» не является развитием патологического процесса. Он играет роль причины и условия этого развития, которое осуществляется собственными эндогенными механизмами поврежденной нервной системы.
На уровне межнейрональных отношений такой интеграцией является агрегат гиперактивных нейронов, на уровне межклеточных отношений - новая организация, состоящая из измененных отделов ЦНС - патологическая система. Таким образом, собственно патогенез нервных расстройств характеризуется не только разрушением, но и возникновением патологических образований - агрегата нейронов и патологической системы, т.е. происходит раз-
рушение физиологических и формирование патологических систем.
21.1.2. Поступление патогенных агентов в нервную систему
Существуют два основных пути поступления патогенных агентов в ЦНС - из крови (через сосудистую стенку) и по нервным стволам.
В первом случае патогенный агент (токсическое вещество, вирусы, микробы и др.) должен преодолеть гематоэнцефалический барьер (ГЭБ), который образуется сосудистой стенкой (эндотелиоцитами), а также глиальными элементами (астроцитами). ГЭБ осуществляет активный и избирательный транспорт из крови в мозг питательных и других биологически активных веществ, необходимых для деятельности мозга. Одновременно он защищает мозг от непосредственного действия находящихся в крови патогенных агентов. У плодов и новорожденных ГЭБ более проходим. Ряд токсических агентов (стрихнин, спирты, некоторые фармакологические препараты) сравнительно хорошо проходят ГЭБ. Для биологических возбудителей (вирусы, микробы) в норме ГЭБ практически непроницаем. Однако в условиях патологии при действии ряда физических и химических факторов усиливается проницаемость ГЭБ, что утяжеляет патологический процесс. Так, сильный длительный стресс способствует поступлению вируса гриппа в мозг.
Путями поступления ряда патогенных агентов в ЦНС являются нервные стволы. Невральный путь характерен для столбнячного токсина, вирусов полиомиелита, бешенства и др. Входными воротами для столбнячного токсина является мионевральный синапс, откуда токсин поступает по двигательным волокнам в спинной и продолговатый мозг (рис. 21-1). В ЦНС токсины (столбнячный), вирусы, антитела к нервной ткани могут распространяться от нейрона к нейрону внутри нервных отростков (с аксотоком) и по межнейрональным пространствам.
21.1.3. Механизмы защиты нервной системы
К тканевым барьерным механизмам следует добавить также защитную функцию различных оболочек мозга и нервов. Защиту нейрона и его отростков обеспечивают окружающие глиальные и
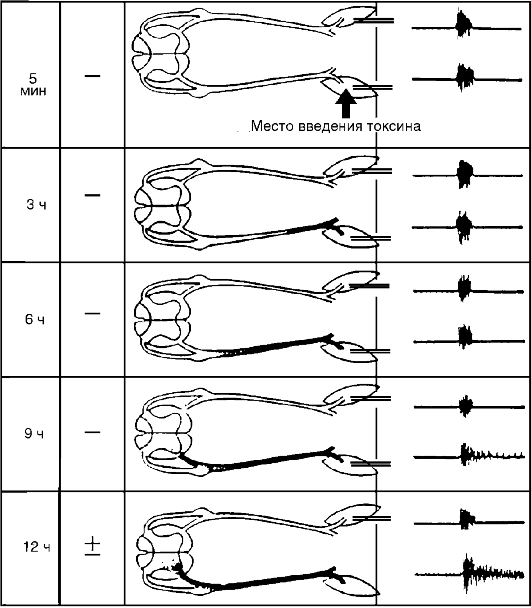 Рис. 21-1. Продвижение
столбнячного токсина по невральному пути и развитие местного столбняка.
Токсин, введенный в икроножную мышцу крысы, поступает через
мионевральный синапс в двигательные волокна и по ним через передние
корешки достигает передних рогов люмбосакральных сегментов спинного
мозга, где действует на мотонейроны и связанные с ним вставочные
нейроны, нарушая их торможение. Вследствие этого указанные нейроны
растормаживаются, гиперактивируются и образуют генератор патологически
усиленного возбуждения, который продуцирует поток импульсов. Последние
поступают по двигательным волокнам в мышцу и вызывают повышение
электрической активности и тоническое сокращение (гипертонус) мышцы.
Участок нерва, переднего корешка и переднего рога, содержащие
столбнячный токсин, затемнены
Рис. 21-1. Продвижение
столбнячного токсина по невральному пути и развитие местного столбняка.
Токсин, введенный в икроножную мышцу крысы, поступает через
мионевральный синапс в двигательные волокна и по ним через передние
корешки достигает передних рогов люмбосакральных сегментов спинного
мозга, где действует на мотонейроны и связанные с ним вставочные
нейроны, нарушая их торможение. Вследствие этого указанные нейроны
растормаживаются, гиперактивируются и образуют генератор патологически
усиленного возбуждения, который продуцирует поток импульсов. Последние
поступают по двигательным волокнам в мышцу и вызывают повышение
электрической активности и тоническое сокращение (гипертонус) мышцы.
Участок нерва, переднего корешка и переднего рога, содержащие
столбнячный токсин, затемнены
шванновские клетки, а также мембрана самого нейрона. Нервная система защищена также иммунологическим барьером.
Защитную роль играют специальные регуляционные «уравновешивающие» (по И.П. Павлову) механизмы, направленные на предупреждение и ликвидацию возникающих изменений. В условиях патологии указанный принцип реализуется в деятельности антисистем (Г.Н. Крыжановский). Антисистема активируется или формируется вместе с образованием патологической системы, ограничивая развитие последней и подавляя ее деятельность. Например, при возникновении чрезмерной боли активируется антиноцицептивная система, регулирующая болевую чувствительность. Активация антиноцицептивной системы купирует возникновение болевого синдрома.
Антиэпилептическая система контролирует уровень возбуждения в различных отделах ЦНС. Электрическая стимуляция каудального ядра моста, относящегося к антиэпилептической системе, подавляет активность в эпилептическом очаге в коре головного мозга.
Тоническая активность антисистемы является одним из механизмов поддержания устойчивого состояния здоровья. Недостаточная деятельность антисистем представляет собой условие развития патологического процесса. Например, недостаточность антиноцицептивной системы ведет к появлению повышенной болевой чувствительности и формированию болевых синдромов; недостаточность антиэпилептической системы обусловливает предрасположенность к судорогам.
21.1.4. Выпадение функций нервной системы
Выпадение той или иной функции нервной системы может быть обусловлено либо разрушением, либо угнетением деятельности структур, осуществляющих данную функцию. Примером выпадения функции вследствие повреждения (разрушения) структуры может быть вялый паралич мышцы при гибели иннервирующих ее мотонейронов спинного мозга, пораженных вирусом полиомиелита, либо при перерыве или дегенерации двигательного нерва. При повреждении структур, относящихся к сенсорным системам, выпадают соответствующие виды чувствительности (болевая, зрительная и пр.).
Степень выпадения функции определяется не только количеством пораженных нервных клеток. Вокруг очага поражения
в мозговой ткани возникает зона обратимо поврежденных и заторможенных нейронов. Торможение играет роль охранительного механизма («охранительное торможение» по И.П. Павлову), предохраняя нейроны, обратимо поврежденные, от функциональной нагрузки, которая может способствовать их гибели. В связи с выключением этих нейронов из выполнения функции увеличивается степень функционального дефекта; такая ситуация имеет место при полиомиелите, травмах ЦНС и др. Восстановление в том или ином объеме функции при лечебных воздействиях связано не с регенерацией нейронов (нейроны не регенерируют), а с улучшением состояния и нормализацией деятельности обратимо поврежденных нейронов и со снятием охранительного торможения.
Выпадение функции при возникновении структурных дефектов проявляется не сразу. Оно происходит, когда повреждение достигло такого размера, что уже стали недостаточными механизмы компенсации и перекрытия нарушенной функции. Иначе говоря, на этой стадии патологический процесс достиг значительного развития, а не начинается, как принято думать. В таких случаях врач имеет дело с уже довольно запущенной болезнью. Вот почему терапия бывает не всегда эффективна даже на этой, ранней стадии и столь важна диагностика патологических изменений на доклинической стадии процесса.
Выпадение функции, обусловленное угнетением деятельности структур ЦНС, может возникнуть также при усилении тормозного влияния. Так, если гиперактивируются отделы продолговатого мозга, которые в норме оказывают тормозное влияние на рефлексы спинного мозга, то связанная со спинными рефлексами функция выпадает. Известны рефлекторные выпадения чувствительности, истерические параличи, суггестивные (самовнушаемые, или гипнотические) нарушения движений и чувствительности и другие феномены тормозного подавления функции.
21.1.5. Исходы патологических процессов в нервной системе
Начавшийся в нервной системе патологический процесс в условиях продолжающегося патогенного воздействия может прогрессировать, если преодолеваются санирующие механизмы. Результатом этого будет либо гиперактивация, либо деструкция и гибель нейронов. Если процесс охватывает жизненно важные отделы ЦНС, то наступает смерть организма.
Напротив, при активации и развитии санирующих механизмов патологический процесс ликвидируется, восстанавливаются нарушенные функции, наступает вначале клиническое улучшение, а затем и выздоровление.
Если саногенетические механизмы достаточны лишь для ограничения патологического процесса и купирования его развития, в частности, если они не ликвидируют патологические системы, а лишь ограничивают их развитие, то процесс может приостановиться. В этих условиях происходит хронизация патологического процесса. Ей способствуют продолжающиеся патогенные воздействия. Они обусловливают новые повреждения, поддерживают патологические системы и нарушают санирующие механизмы. Хронизация патологического процесса связана с укреплением и стабилизацией патологических систем.
На поздних стадиях, когда происходит восстановление функций в необходимом объеме и полностью исчезают клинические признаки патологического процесса, могут сохраняться скрытые структурно-функциональные изменения в виде следов от бывшего патологического процесса.
Феномен восстановления признаков исчезнувшего патологического процесса на базе следовых реакций при новом патогенном воздействии получил название феномена «второго удара» (А.Д. Сперанский). В эксперименте по методу «второго удара» была показана возможность воспроизведения нервно-дистрофических язв после их исчезновения, судорожного синдрома после клинической ликвидации столбняка, различных тканевых и метаболических изменений. После исчезновения у собаки признаков невроза, вызванного наводнением (Ленинград, 1924 г.), нарочитый пуск воды по полу кабины вызвал у животного рецидив невроза. При нервных и психических болезнях часто возникают рецидивы клинически исчезнувших признаков нейропатологических синдромов в связи с вторичными патогенными воздействиями. Подобные явления имеют место и при болезнях нервной регуляции функций внутренних органов (см. раздел 21.8).
Вторичный патогенный агент, если он неспецифический, т.е. не тот же, который был причиной данной болезни, не может вызвать на базе следовых реакций всю болезнь. При действии схожих агентов могут возникнуть отдельные симптомы бывшей патологии (рис. 21-2).
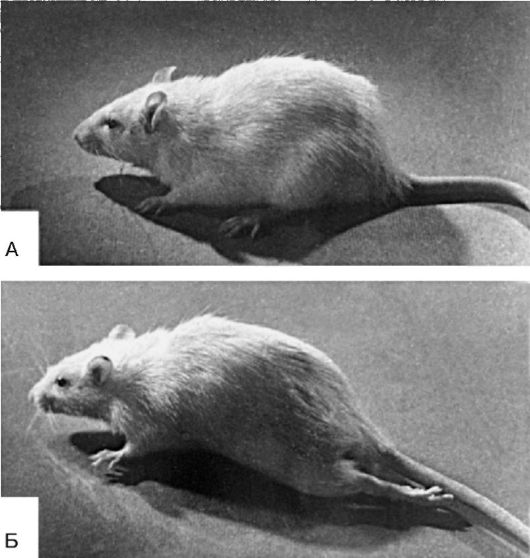 Рис.
21-2. Возникновение экстензии бывшей «столбнячной» лапы под влиянием
фенола: А - крыса, у которой был местный столбняк (экстензорная
ригидность) левой задней конечности, в настоящее время ригидность
отсутствует; Б - та же крыса после подкожного введения фенола (2 мл 2%
раствора), который активирует систему эфферентного выхода в спинном
мозгу - возник экстензорный тонус левой задней конечности
Рис.
21-2. Возникновение экстензии бывшей «столбнячной» лапы под влиянием
фенола: А - крыса, у которой был местный столбняк (экстензорная
ригидность) левой задней конечности, в настоящее время ригидность
отсутствует; Б - та же крыса после подкожного введения фенола (2 мл 2%
раствора), который активирует систему эфферентного выхода в спинном
мозгу - возник экстензорный тонус левой задней конечности
21.2. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ В НЕРВНОЙ СИСТЕМЕ 21.2.1. Дефицит торможения. Растормаживание
В покое и деятельном состоянии нейроны испытывают постоянные тормозные влияния. При возбуждении нейронов происходит ослабление тормозных процессов. Такое растормаживание является дозированным, оно контролируется и соответствует необходимому уровню активности нейрона, поэтому имеет физиологический характер.
При растормаживании, имеющем патологический характер, нейрон становится гиперактивным и выходит из-под контроля. Патологическое растормаживание возникает при значительном и неконтролируемом дефиците торможения. Такое состояние имеет место в условиях прямого повреждения тормозных механизмов, при избирательном действии на них некоторых токсинов (например, столбнячного токсина, стрихнина).
Дефицит торможения и растормаживание встречаются практически при всех формах патологии нервной системы, поэтому они
относятся к типовым патологическим процессам нервной системы. Дефицит торможения играет существенную роль в формировании и деятельности ГПУВ.
Характерным экспериментальным синдромом растормаживания является децеребрационная ригидность. Она вызывается, по Шеррингтону, перерезкой ствола мозга между передним и задним четверохолмием. В этих условиях происходит выпадение тормозных влияний со стороны супраспинальных структур и особенно красных ядер, и проявляются возбуждающие тонические влияния вестибулярных ядер Дейтерса на мотонейроны спинного мозга, особенно γ-мотонейроны, которые в норме находятся под тормозным контролем со стороны красных ядер. Перерыв (например, путем перерезки задних корешков) расторможенной, патологически усиленной γ-петли на уровне спинного мозга ведет к исчезновению ригидности соответствующих мышц. Поэтому данный вид децеребрационной ригидности называют также γ-ригидностью (Р. Гранит).
При выпадении тормозных влияний растормаживаются и гиперактивируются прежде всего те нейроны, которые в норме находятся в состоянии тонического возбуждения. У человека и многих животных такими нейронами являются нейроны мышц, выполняющих антигравитационную функцию. Вследствие этого у децеребрированной кошки голова запрокидывается вверх, передние и задние лапы вытягиваются, хвост поднимается и т.п. У человека при выпадении моторных корковых влияний (например, после геморрагического инсульта) возникает спастическая флексорная установка верхней и экстензорная установка нижней конечностей (поза Вернике-Манна).
Целый ряд патологических рефлексов возникает в условиях выпадения влияний со стороны коры и подкорковых образований; эти рефлексы являются результатом растормаживания центров спинного или продолговатого мозга. Они представляют собой гиперболизированные неконтролируемые реакции, которые являлись нормальными в раннем постнатальном периоде и затем были подавлены при развитии регулирующих влияний со стороны высших отделов ЦНС. К ним относятся рефлекс Бабинского (растопыривание пальцев ноги вместо их сгибания при раздражении подошвы), хватательный, сосательный и другие рефлексы.
При полном перерыве спинного мозга могут проявляться заложенные генетически и подавленные с возрастом спинальные ав-
томатизмы в виде сравнительно координированных сгибательноразгибательных движений конечностей. Если растормаживаются и гиперактивируются тормозные нейроны, то возникает патологически усиленный тормозной эффект, который может проявиться в виде угнетения и выпадения функции.
21.2.2. Денервационный синдром
Денервационный синдром представляет собой комплекс изменений, возникающих в постсинаптических нейронах, органах и тканях после выпадения нервных влияний на эти структуры. Денервированная структура (мышца, нейрон) приобретает повышенную чувствительность к физиологически активным веществам (закон Кеннона-Розенблюта). Основным проявлением денервационного синдрома в мышце является исчезновение концевой пластинки - зоны мышечного волокна, где сосредоточен весь его холинергический аппарат. Вместо нее появляются новые ацетилхолиновые рецепторы на всем протяжении мышечного волокна, и в связи с этим происходит повышение общей чувствительности к ацетилхолину всего волокна (А.Г. Гинецинский, Н.М. Ашмарина). Этот эффект связан главным образом с выпадением трофических влияний нерва. Другой характерный признак - фибриллярные подергивания денервированной мышцы. Этот эффект отражает реакцию мышечных денервированных волокон на поступающий к ним из разных сторонних источников ацетилхолин.
При денервации в мышце и других тканях появляются свойства, присущие ранним, в частности, эмбриональным стадиям развития. Это явление возникает как результат патологического растормаживания супрессированных в норме генов.
21.2.3. Деафферентация
Импульсация, поступающая в нейрон, из какого бы источника она ни исходила, является для нейрона афферентной. Выключение этой афферентации представляет собой деафферентацию нейрона. Последняя может быть обусловлена либо выпадением поступающей импульсации (при перерыве нервных путей, нарушении выделения нейромедиаторов пресинаптическими окончаниями), либо блокадой воспринимающих рецепторов на постсинаптическом нейроне (при действии токсинов, фармакологических средств и др.).
Многие явления при деафферентации нейрона представляют собой выражение денервационного синдрома. Полной деафферентации нейрона не происходит, так как нейроны ЦНС обладают огромным количеством афферентных входов. Тем не менее и при частичной деафферентации возникает повышение возбудимости нейрона или его отдельных участков и нарушение тормозных механизмов. В силу этого при деафферентации группа нейронов может приобрести свойства ГПУВ.
В клинике под феноменом деафферентации имеют в виду синдромы, возникающие при выпадении афферентной стимуляции с периферии. Эти синдромы можно воспроизвести в эксперименте путем перерезки соответствующих задних корешков спинного мозга. Движения конечности, иннервируемой деафферентированными таким образом сегментами спинного мозга, становятся размашистыми, плохо координированными. Кроме того, такая конечность способна осуществлять спонтанные движения в такт с дыханием (феномен Орбели-Кунстман), что обусловлено растормаживанием и повышением возбудимости деафферентированных нейронов спинного мозга.
21.2.4. Спинальный шок
Спинальный шок возникает после перерыва спинного мозга и представляет собой глубокое, но обратимое угнетение двигательных и вегетативных рефлексов, осуществляющихся ниже перерыва. Угнетение рефлексов связано с выпадением активирующей стимуляции со стороны головного мозга. У лягушек, у которых зависимость спинного мозга от головного значительно меньше, чем у высших животных, спинальный шок длится несколько минут, у человекообразных обезьян и человека - несколько месяцев.
У человека полная арефлексия после перерыва спинного мозга является начальной стадией полной параплегии. В дальнейшем происходит постепенное восстановление двигательных и вегетативных рефлексов. Вначале появляются сгибательные рефлексы пальцев, имеющие характер патологических рефлексов (рефлекс Бабинского и др.), после этого осуществляются более значительные и затем генерализованные спинальные рефлексы и движения типа спинальных автоматизмов.
21.2.5. Нарушение нервной трофики. Нейродистрофический процесс
Трофика клетки и дистрофический процесс. Трофика клетки - комплекс процессов, обеспечивающих ее жизнедеятельность и поддержание генетически заложенных свойств. Расстройство трофики представляет собой дистрофию, развивающиеся дистрофические изменения составляют дистрофический процесс.
Нейродистрофический процесс. Это развивающееся нарушение трофики, которое обусловлено выпадением или изменением нервных влияний. Оно может возникать как в периферических тканях, так и в самой нервной системе. Выпадение нервных влияний заключается: 1) в прекращении стимуляции иннервируемой структуры в связи с нарушением выделения или действия нейромедиатора; 2) в нарушении секреции или действия комедиаторов - веществ, которые выделяются вместе с нейромедиаторами и играют роль нейромодуляторов, обеспечивающих регуляцию рецепторных, мембранных и метаболических процессов; 3) в нарушении выделения и действия трофогенов. Трофогены (трофины) - вещества различной, преимущественно белковой природы, осуществляющие собственно трофические эффекты поддержания жизнедеятельности и генетически заложенных свойств клетки. Источником трофогенов являются: 1) нейроны, из которых трофогены поступают с антероградным (ортоградным) аксоплазматическим током в клетки-реципиенты (другие нейроны или иннервируемые ткани на периферии); 2) клетки периферических тканей, из которых трофогены поступают по нервам с ретроградным аксоплазматическим током в нейроны (рис. 21-3); 3) глиальные и шванновские клетки, которые обмениваются с нейронами и их отростками трофическими веществами. Вещества, играющие роль трофогенов, образуются также из сывороточных и иммунных белков. Трофическое воздействие могут оказывать некоторые гормоны. В регуляции трофических процессов принимают участие пептиды, ганглиозиды, некоторые нейромедиаторы.
К нормотрофогенам относятся различного рода белки, способствующие росту, дифференцировке и выживанию нейронов и соматических клеток, сохранению их структурного гомеостаза (например, фактор роста нервов).
В условиях патологии в нервной системе вырабатываются трофические вещества, вызывающие устойчивые патологические
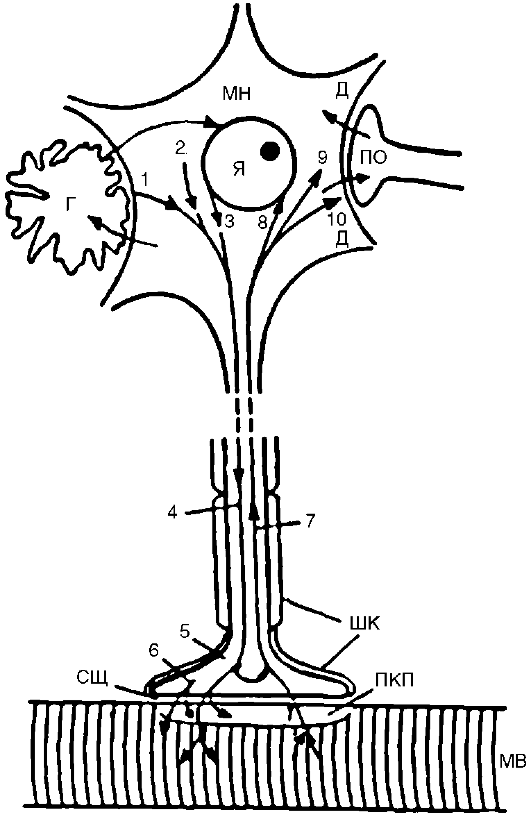 Рис. 21-3. Трофические
связи мотонейрона и мышцы. Вещества из тела мотонейрона (МН), его
мембраны 1, перикариона 2, ядра 3 транспортируются с антероградным
аксоплазматическим током 4 в терминаль 5. Отсюда они, а также вещества,
синтезируемые в самой терминали 6, поступают транссинаптически через
синаптическую щель (СЩ) в концевую пластинку (КП) и в мышечное волокно
(МВ). Часть неиспользованного материала поступает обратно из терминали в
тело нейрона с ретроградным аксоплазматическим током
Рис. 21-3. Трофические
связи мотонейрона и мышцы. Вещества из тела мотонейрона (МН), его
мембраны 1, перикариона 2, ядра 3 транспортируются с антероградным
аксоплазматическим током 4 в терминаль 5. Отсюда они, а также вещества,
синтезируемые в самой терминали 6, поступают транссинаптически через
синаптическую щель (СЩ) в концевую пластинку (КП) и в мышечное волокно
(МВ). Часть неиспользованного материала поступает обратно из терминали в
тело нейрона с ретроградным аксоплазматическим током
7. Вещества, образующиеся в мышечном волокне и концевой пластинке, поступают транссинаптически в обратном направлении в терминаль и далее с ретроградным аксоплазматическим током 7 в тело нейрона - к ядру
8, в перикарион 9, к мембране дендритов 10. Некоторые из этих веществ могут поступать из дендритов (Д) транссинаптически в другой нейрон через его пресинаптическое окончание (ПО) и из этого нейрона далее в другие нейроны. Между нейроном и мышцей происходит постоянный обмен веществами, поддерживающими трофику, структурную целостность и нормальную деятельность обоих образований. В этом обмене принимают участие глиальные клетки (Г). Все указанные образования создают регионарную трофическую систему (или трофический контур)
изменения клеток-реципиентов (патотрофогены, по Г.Н. Крыжановскому). Такие вещества синтезируются, например в эпилептических нейронах - поступая с аксоплазматическим током в другие нейроны, они могут индуцировать у этих нейронов-реципиентов эпилептические свойства. Патотрофогены могут распространяться по нервной системе, как по трофической сети, что является одним из механизмов распространения патологического процесса. Патотрофогены образуются и в других тканях.
Дистрофический процесс в денервированной мышце. Синтезируемые в теле нейрона и транспортируемые в терминаль с аксоплазматическим током вещества, выделяются нервным окончанием и поступают в мышечные волокна (см. рис. 21-3), выполняя функцию трофогенов. Эффекты нейротрофогенов видны из опытов с перерезкой двигательного нерва: чем выше произведена перерезка, т.е. чем больше сохранилось трофогенов в периферическом отрезке нерва, тем позднее наступает денервационный синдром. Нейрон вместе с иннервируемой им структурой (например, мышечным волокном) образует регионарный трофический контур, или регионарную трофическую систему (см. рис. 21-3). Если осуществить перекрестную реиннервацию мышц с разными исходными структурно-функциональными характеристиками (реиннервация «медленных» мышц волокнами от нейронов, иннервировавших «быстрые» мышцы, и наоборот), то реиннервированная мышца приобретает в значительной мере новые динамические характеристики: «медленная» становится «быстрой», «быстрая» - «медленной».
В денервированном мышечном волокне возникают новые трофогены, которые активируют разрастание нервных волокон (sprouting). Указанные явления исчезают после реиннервации.
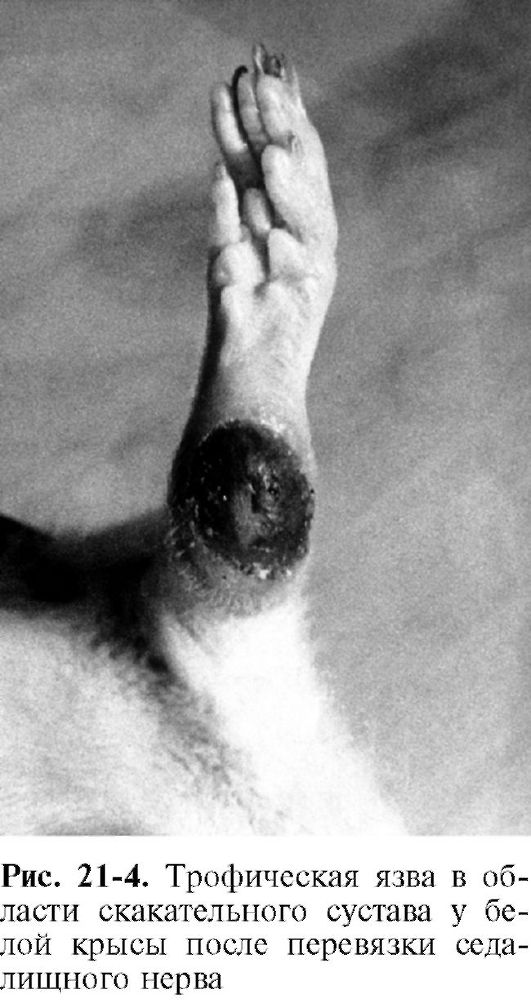
Нейродистрофический процесс в других тканях. Взаимные трофические влияния существуют между каждой тканью и ее нервным аппаратом. При перерезке афферентных нервов возникают дистрофические изменения кожи. Перерезка седалищного нерва, который является смешанным (чувствительным и двигательным), вызывает образование дистрофической язвы в области скакательного сустава (рис. 21-4). С течением времени язва может увеличиться в размерах и охватить всю стопу.
Классический опыт Ф. Мажанди (1824), послуживший началом разработки всей проблемы нервной трофики, заключается в перерезке у кролика первой ветви тройничного нерва. В результа-
 те
такой операции развивается язвенный кератит, вокруг язвы возникает
воспаление, и со стороны лимба в роговицу врастают сосуды, которые в ней
в норме отсутствуют. Врастание сосудов является выражением
патологического растормаживания сосудистых элементов - в дистрофически
измененной роговице исчезает фактор, который тормозит в норме рост в нее
сосудов, и появляется фактор, который активирует этот рост.
те
такой операции развивается язвенный кератит, вокруг язвы возникает
воспаление, и со стороны лимба в роговицу врастают сосуды, которые в ней
в норме отсутствуют. Врастание сосудов является выражением
патологического растормаживания сосудистых элементов - в дистрофически
измененной роговице исчезает фактор, который тормозит в норме рост в нее
сосудов, и появляется фактор, который активирует этот рост.
Дополнительные факторы нейродистрофического процесса. К факторам, участвующим в развитии нейродистрофического процесса, относятся: сосудистые изменения в тканях, нарушения гемо- и лимфомикроциркуляции, патологическая проницаемость сосудистой стенки, нарушение транспорта в клетку питательных и пластических веществ. Важным патогенетическим звеном является возникновение в дистрофической ткани новых антигенов в результате изменений генетического аппарата и синтеза белка, образуются антитела к тканевым антигенам, возникают аутоиммунный и воспалительный процессы. В указанный комплекс патологических процессов входят также вторичное инфицирование язвы, развитие инфекционных повреждений и воспаления. В целом нейродистрофические поражения тканей имеют сложный многофакторный патогенез (Н.Н. Зайко).
Генерализованный нейродистрофический процесс. При повреждениях нервной системы могут возникать генерализованные формы нейродистрофического процесса. Одна из них проявляется в виде поражения десен (язвы, афтозный стоматит), выпадения зубов, кровоизлияния в легких, эрозии слизистой и кровоизлияния в желудке (чаще в области привратника), в кишечнике, особенно в
области буагиниевой заслонки, в прямой кишке. Поскольку такие изменения возникают сравнительно регулярно и могут иметь место при разных хронических нервных повреждениях, они получили название стандартной формы нервной дистрофии (А.Д. Сперанский). Часто указанные изменения возникают при повреждении высших вегетативных центров, в частности, гипоталамуса (при травмах, опухолях), в эксперименте при наложении стеклянного шарика на турецкое седло.
Все нервы (двигательные, чувствительные, вегетативные), какую бы функцию они ни выполняли, являются одновременно трофическими (А.Д. Сперанский). Нарушения нервной трофики составляют важное патогенетическое звено болезней нервной системы и нервной регуляции соматических органов, поэтому коррекция трофических изменений является необходимой частью комплексной патогенетической терапии.
21.3. ПАТОЛОГИЯ НЕЙРОНА
21.3.1. Нарушение проведения возбуждения
Распространение возбуждения по нервному волокну обеспечивается последовательным сочетанием одних и тех же процессов: деполяризацией участка мембраны волокна, входом в этом участке Na+, деполяризацией соседнего участка мембраны, входом в этом участке Na+ и т.д.
При недостаточном входе Na+ нарушается генерация потенциала действия, и проведение прекращается. Такой эффект имеет место при блокаде Na+-каналов местными анестетиками (новокаин, лидокаин и др.) и рядом других химических агентов. Специфическим блокатором Na+-каналов является тетродотоксин - яд, вырабатывающийся во внутренних органах рыбы фугу.
Исходная разность концентрации Na+ и Ка+ по обе стороны мембраны (Na+ в 10-15 раз больше снаружи, К+ в 50-70 раз больше внутри), необходимая для генерации потенциала действия, восстанавливается и поддерживается активным транспортом ионов Na+/K+-насосом. Он выкачивает наружу Na+, поступивший внутрь (в цитоплазму) во время возбуждения, в обмен на наружный К+, который вышел наружу во время возбуждения. Деятельность насоса, роль которого выполняет встроенная в мембрану Na+/К+- АТФаза, обеспечивается энергией, высвобождающейся при рас-
щеплении АТФ. Дефицит энергии ведет к нарушению работы насоса, что обусловливает неспособность мембраны генерировать потенциал действия и проводить возбуждение. Такой эффект вызывают разобщители окислительного фосфорилирования (например, динитрофенол) и другие метаболические яды, а также ишемия и длительное охлаждение участка нерва. Ингибируют насос и как следствие этого нарушают проводимость сердечные гликозиды (например, уабаин, строфантин) в больших дозах.
Проведение возбуждения по аксону нарушается при различных видах патологии периферических нервов и нервных волокон в ЦНС - при воспалительных процессах, рубцовых изменениях нерва, сдавлении нервных волокон, демиелинизации волокон (аллергические процессы, рассеянный склероз), ожогах и др. Проведение возбуждения прекращается при дегенерации аксона.
21.3.2. Нарушение аксонального транспорта и дендритов
Аксональный транспорт из тела нейрона в нервное окончание и из нервного окончания в тело нейрона осуществляется при участии нейрофиламентов, микротрубочек и контрактильных актино- и миозиноподобных белков, сокращение которых зависит от содержания Са2+ в среде и от энергии расщепления АТФ. Вещества, разрушающие микротрубочки и нейрофиламенты (колхицин, винбластин и др.), недостаток АТФ, метаболические яды, создающие дефицит энергии (динитрофенол, цианиды), нарушают аксоток. Аксональный транспорт страдает при дегенерации аксона, вызываемой недостатком витамина В6 и витамина B1 (болезнь берибери), промышленными ядами (акриламидом, гексахлорофосом), солями тяжелых металлов (свинца), фармакологическими препаратами (дисульфирамом), алкоголем, при диабете, сдавлении нервов и дистрофических повреждениях нейрона. При перерыве аксона возникает уоллеровская дегенерация (распад) его периферической части и ретроградная дегенерация центральной части. Эти процессы связаны с нарушением трофики в обеих частях аксона.
Расстройства аксонального транспорта трофогенов и веществ, необходимых для образования и выделения медиаторов нервным окончанием, обусловливают развитие дистрофических изменений нейронов и иннервируемых тканей и нарушение синаптических процессов. Распространение с аксональным транспортом патотрофогенов, антител к нервной ткани и к нейромедиаторам приводит
к вовлечению в патологический процесс нейронов в других отделах ЦНС.
Дендриты и их шипики являются самыми ранимыми структурами нейрона. При старении шипики и ветви дендритов редуцируются, при некоторых дегенеративных и атрофических заболеваниях мозга (старческое слабоумие, болезнь Альцгеймера) они исчезают. Дендрошипиковый аппарат страдает при гипоксии, ишемии, сотрясении мозга, стрессорных и невротизирующих воздействиях.
21.3.3. Патология структурных элементов нейронов
Значительную роль в патологии нейрона играют нарушения внутриклеточного структурного гомеостаза. В норме процессы изнашивания и распада внутриклеточных структур и нейрональных мембран уравновешиваются процессами их обновления и регенерации. Совокупность этих процессов составляет динамический структурный гомеостаз.
Повреждения как клеточной (цитоплазматической), так и внутриклеточных мембран возникают при различных патогенных воздействиях и сами являются причиной дальнейшей патологии нейрона.
Усиленное перекисное окисление липидов (ПОЛ) нейрональных мембран оказывает влияние не только на мембранные, но и на другие внутриклеточные процессы.
Практически нет патологического процесса в нервной системе, при котором не возникало бы усиленного ПОЛ. Оно имеет место при эпилепсии, эндогенных психозах (например, шизофрении, маниакально-депрессивном синдроме), при неврозах, стрессах и повреждениях, при ишемии, хронической гипоксии, функциональных перегрузках нейронов и пр. С ним связана дальнейшая гиперактивация нейронов.
Вследствие увеличения проницаемости мембран происходит выход из нейрона различных веществ, в том числе антигенов, которые вызывают образование антинейрональных антител, что приводит к развитию аутоиммунного процесса. Нарушение барьерных свойств мембран обусловливает возрастание тока ионов Са2+ и Na+ в нейрон и К+ - из нейрона; эти процессы в сочетании с недостаточностью энергозависимых Na+-, K+- и Са2+-насосов (их деятельность изменяется также под влиянием усиленного ПОЛ) приводят к частичной деполяризации мембраны. Увеличенный вход Ca2+ не
только вызывает гиперактивацию нейрона, но и при чрезмерном его содержании в клетке ведет к патологическим изменениям метаболизма и внутриклеточным повреждениям (см. главу 3).
Нормализация перекисного окисления липидов и стабилизация нейрональных мембран должны быть частью комплексной патогенетической терапии различных форм патологии нервной системы.
Для жизнедеятельности нейрона, который как высокодифференцированная клетка не способен митотически делиться, внутриклеточная регенерация является единственным способом структурного обновления нейронов и поддержания их целостности. К ней относятся синтез белков, образование внутриклеточных органелл, митохондрий, мембранных структур, рецепторов, рост нервных отростков (аксоны, дендриты, дендритные шипики) и др.
Процессы внутриклеточной регенерации требуют высокого энергетического и трофического обеспечения и полноценного метаболизма клетки. При повреждениях нейрона, возникновении энергетического и трофического дефицита, нарушениях деятельности генома страдает внутриклеточная регенерация, падает пластический потенциал клетки, распад внутриклеточных структур не уравновешивается ими.
21.3.4. Энергетический дефицит
Потребность нейронов в энергообеспечении - самая высокая из всех клеток организма, и нарушение энергообеспечения является одной из распространенных причин патологии нейрона. Энергетический дефицит может быть первичным - при действии метаболических ядов (например, динитрофенола, цианидов) либо вторичным - при различных повреждениях, нарушениях кровообращения, шоке, отеке, общих судорогах, усиленной функциональной нагрузке и др. Дефицит энергии относится к разряду типовых внутриклеточных патологических процессов (см. главу 3).
Главными условиями развития энергетического дефицита являются недостаток кислорода и значительное повреждение митохондрий, в которых синтезируется основной носитель энергии - АТФ. Причиной дефицита энергии может быть также недостаток субстрата окисления, в частности глюкозы, которая является для мозга основным субстратом окисления. Нейроны коры не имеют запасов глюкозы и потребляют ее непосредственно из крови (глюкоза свободно проходит ГЭБ), поэтому они особенно чувстви-
тельны к гипогликемии. Мозг потребляет около 20% от всей находящейся в крови глюкозы. Инсулиновые шоки, применяемые для лечения некоторых психозов, связаны с глубокой гипогликемией и протекают с потерей сознания и нередко с судорогами. При ряде патологических состояний (травматический шок, кровопотеря) мозг может дольше обеспечиваться кислородом и глюкозой благодаря перераспределению крови и уменьшению их потребления другими тканями. Для быстрейшего восстановления деятельности мозга после общих судорог необходим достаточно высокий уровень глюкозы в крови. Энергетический дефицит усугубляется нарушением цикла Кребса.
При глубоком нарушении окислительного фосфорилирования и синтеза макроэргов источником энергии становится анаэробный гликолиз. Он имеет характер компенсаторного механизма, однако его эффект не может восполнить дефицит энергии, а нарастающее увеличение содержания молочной кислоты в мозгу оказывает отрицательное влияние на деятельность нейронов и усугубляет отек мозга.
21.3.5. Эффекты ишемии и гипоксии
В связи с высокой потребностью в энергии нейроны ЦНС нуждаются в значительном кислородном обеспечении. Нейрон коры головного мозга потребляет 250-450 мкл О2/мин (для сравнения - глиоцит и гепатоцит потребляют до 60 мкл О2). Снижение потребления кислорода мозгом всего лишь на 20% может вызвать потерю сознания у человека. Исчезновение импульсной активности нейронов возникает уже в первые десятки секунд ишемии мозга. Через 5-6 мин после начала асфиксии наступает глубокое и нередко необратимое нарушение деятельности мозга. Гибель нейрона при ишемии является результатом осуществления комплекса взаимосвязанных внутриклеточных процессов (рис. 21-5).
При аноксии головного мозга в первую очередь страдает кора. Гибель всего мозга означает «мозговую смерть», которая проявляется в полном исчезновении биоэлектрической активности. Филогенетически более старые структуры ЦНС (спинной мозг, ствол головного мозга) менее чувствительны к асфиксии, чем молодые (подкорка и особенно кора). Поэтому при запоздалом оживлении организма может наступить декортикация.
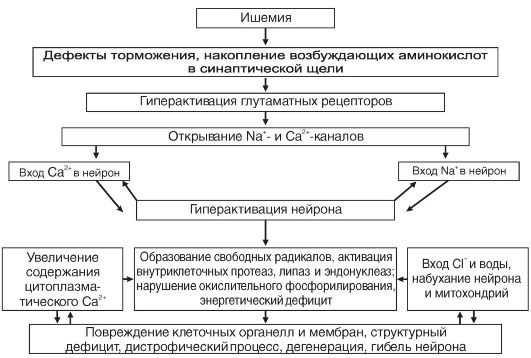 Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембран
Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембран
Весьма чувствительны к аноксии тормозные механизмы. Одним из следствий этого является растормаживание неповрежденных структур ЦНС. На ранних стадиях ишемии, когда нейроны мозга еще способны давать реакцию, они могут гиперактивироваться. На поздних стадиях ишемии гиперактивация нейронов сменяется их инактивацией.
С поступлением Na+ в нейрон связана первая, острая фаза поражения нейрона. Возрастание концентрации Na+ в цитозоле нейрона приводит к повышению осмолярности, что обусловливает вход воды в нейрон и его набухание. В дальнейшем повышение осмолярности нейрона связано также с накоплением в нем Са2+, молочной кислоты, неорганического фосфора. С входом Са2+ в нейрон связана вторая фаза повреждения нейрона. Увеличение количества Са2+, поступающего в нейрон, обусловливается активацией глутаматных рецепторов в связи с усиленным выделением глутамата нервными окончаниями при ишемии. Антагонисты глутаматных рецепторов и антагонисты Са2+ (блокаторы Са2+-каналов) способ-
ны предотвратить ишемическую дегенерацию нейронов и оказать лечебный эффект.
Повреждение нейрона происходит не только во время ишемии, но и в связи с реперфузией мозга и возобновлением циркуляции крови. Именно они могут представлять главную опасность. Большую роль в реперфузионных постишемических повреждениях играют: новая волна поступления Са2+ в нейрон, ПОЛ (перекисное окисление липидов) и процессы свободнорадикального окисления, усиленные в связи с действием поступающего кислорода. Увеличивается содержание молочной кислоты из-за поступления глюкозы в условиях нарушения окислительного фосфорилирования и возросшего анаэробного гликолиза. Происходит отек мозга за счет поступления воды из крови при возобновлении циркуляции.
В сложный комплекс Са2+-индуцируемых внутриклеточных повреждений входят: альтерация внутриклеточных белков, усиленный фосфолипазный гидролиз и протеолиз, разрушение внутриклеточных структур, повреждение цитоплазматической и внутриклеточных мембран, набухание нейронов, нарушение деятельности генома. При критическом возрастании интенсивности этих процессов происходят необратимые повреждения и гибель нейрона, возникает так называемая кальциевая смерть1.
На поздних стадиях патологического процесса, вызванного ишемией мозга, а также при хронизации процесса возникает новый комплекс вторичных изменений - дегенеративно-дистрофические процессы, нарушения энзимных и метаболических систем, сосудистые изменения, образование антител к мозговой ткани, аутоиммунная агрессия и др. Они составляют патогенетическую структуру постишемической энцефалопатии, которая может продолжать развиваться (прогредиентное развитие). Эти процессы, а также изменения в других системах и органах с их последствиями имеют место и после реанимации организма, особенно если она была затяжной и поздней. В своей совокупности они составляют патогенетическую структуру постреанимационной болезни (В.А. Неговский) (см. раздел 1.4.2).
1 Нарушение внутриклеточного гомеостаза Са2+
может иметь место не только при ишемии, но и при других формах
патологии нервной системы, при чрезмерной и длительной гиперактивации
нейрона, особенно в условиях энергетического дефицита, при усиленном
действии глутамата и пр. Оно относится к типовым внутриклеточным патологическим процессам.
Гипоксия той или иной степени сопровождает многие (если не все) формы патологии мозга. Являясь типовым и неспецифическим процессом, она, однако, может вносить значительный вклад в его развитие. Вместе с тем умеренная гипоксия может стимулировать метаболические и пластические процессы в нейроне, способствовать адаптации и повышению резистентности, повышать трофический и пластический потенциал нейрона, усиливать адаптационные возможности мозга.
21.3.6. Синаптическая стимуляция и повреждение нейронов
Возбуждающая синаптическая стимуляция может играть важную роль в развитии патологии нейрона. Усиленная и длительная синаптическая стимуляция сама по себе вызывает функциональное перенапряжение нейрона, которое может завершиться дегенерацией внутриклеточных структур. Эти повреждения усиливаются при нарушениях микроциркуляции и мозгового кровообращения, действии токсических факторов.
Первостепенное значение синаптическая стимуляция имеет при развитии аноксических (ишемических) повреждений. Культура тканей нейронов становится чувствительной к аноксии лишь после установления синаптических контактов между нейронами. Синаптическая стимуляция реализуется через действие возбуждающих аминокислот (глутамат, аспартат, L-гомоцистеинат), причем эти повреждения подобны тем, которые возникают при ишемии и связаны с увеличенным содержанием внутриклеточного Са2+. Этот эффект известен как нейротоксическое (или цитотоксическое) действие возбуждающих аминокислот. С синаптической гиперактивацией, действием возбуждающих аминокислот и гипоксией связаны повреждение и гибель нейронов при эпилептическом статусе и в постишемическом периоде. При этом к патогенному действию указанных факторов присоединяется энергетический дефицит.
В связи с изложенным становятся понятными благоприятные эффекты (т.е. ослабление синаптического воздействия) уменьшения функциональной нагрузки, предотвращение дополнительных раздражений, «охранительное», по И.П. Павлову, торможение обратимо поврежденных нейронов.
21.3.7. Нарушение деятельности нейрона при изменении процессов внутриклеточной сигнализации
После восприятия рецептором сигнала (связывания рецептором нейромедиатора, гормона и др.) в нейроне возникает каскад цепных метаболических процессов, обеспечивающих необходимую активность нейрона. Важную роль в этих процессах играют так называемые усилительные, или пусковые, ферменты и образующиеся под их влиянием вещества-посредники, вторичные мессенджеры (см. главу 20).
Совокупность каскадных мембранных и внутриклеточных процессов составляет эндогенную усилительную систему нейрона, которая может обеспечить многократное усиление входного сигнала и возрастание его эффекта на выходе из нейрона. Так, каскад метаболических процессов аденилатциклазного пути может усилить эффект стимула в 107-108 раз. Благодаря этому возможны выявление и реализация слабого сигнала, что имеет особое значение в условиях патологии, при нарушении синаптического проведения.
Многие изменения функций нейрона связаны с действием патогенных агентов на определенные звенья систем внутриклеточной сигнализации. Фармакологическая коррекция деятельности нейрона и эффекты лечебных средств также реализуются через соответствующие изменения этих систем. Так, холерный и коклюшный токсины действуют на процессы, связанные с активностью мембранных G-белков, активирующих или угнетающих аденилатциклазу. Ксантины (теофиллин, кофеин) обусловливают накопление цАМФ, что приводит к усилению деятельности нейрона. При действии ряда противосудорожных препаратов (например, дифенилгидантоина, карбамазепина, бензодиазепинов) и психотропных средств (например, трифтазина) угнетаются разные пути фосфорилирования белков, благодаря чему снижается активность нейронов. Ионы лития, применяемые при лечении некоторых эндогенных психозов, ослабляют деятельность системы фосфоинозитидов. С усиленным входом Са2+ связана эпилептизация нейронов, блокада этого входа антагонистами Са2+ подавляет эпилептическую активность.
21.3.8. Гиперактивность нейрона
Гиперактивность нейрона обусловлена значительным, выходящим из-под контроля нарушением баланса между возбуждением и
торможением нейрона в пользу возбуждения. В функциональном отношении она заключается в продуцировании нейроном усиленного потока импульсов, который может иметь различный характер: высокочастотные потенциалы действия; отдельные разряды; разряды, сгруппированные в пачки, и пр. Особый вид гиперактивности представляет собой пароксизмальный деполяризационный сдвиг (ПДС) в мембране, на высоте которого возникает высокочастотный разряд (рис. 21-6). Такой вид гиперактивности рассматривается как проявление эпилептизации нейрона.
Указанный сдвиг баланса между возбуждением и торможением может быть обусловлен либо первичным усиленным возбуждением нейрона, преодолевающим тормозной контроль, либо первичной недостаточностью тормозного контроля. Первый механизм реализуется значительной деполяризацией мембраны и усиленным входом Na+ и Са2+ в нейрон, второй - расстройством механизмов, обеспечивающих гиперполяризацию мембраны: нарушением выхода К+ из нейрона и входа Cl- в нейрон.
Существенным эндогенным регулятором активности нейрона является γ-аминомасляная кислота (ГАМК). Она вызывает торможение нейрона при связывании со своим рецептором. В результате усиливается поступление Cl- в нейрон.
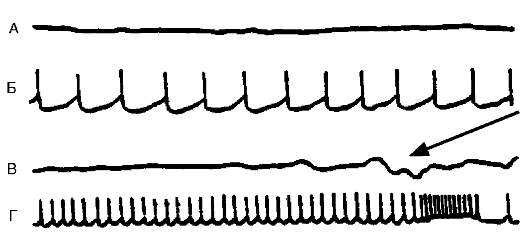 Рис. 21-6. Различные
виды спонтанной активности нейрона в эпилептическом очаге, вызванном
столбнячным токсином в двигательной зоне коры головного мозга кошки.
Кривые А и В - потенциалы, регистрируемые с поверхности мозга в
эпилептическом очаге (ЭкоГ). Кривые Б и Г - запись электрической
активности нейронов, выполненные с помощью внутриклеточного отведения.
Нейрон может генерировать с разной частотой регулярные потенциалы
действия. На кривой Г показано завершение потенциала высокочастотными
разрядами. В это время на ЭкоГ (кривая В) в зоне очага появляется
спайковый разряд (указан стрелкой)
Рис. 21-6. Различные
виды спонтанной активности нейрона в эпилептическом очаге, вызванном
столбнячным токсином в двигательной зоне коры головного мозга кошки.
Кривые А и В - потенциалы, регистрируемые с поверхности мозга в
эпилептическом очаге (ЭкоГ). Кривые Б и Г - запись электрической
активности нейронов, выполненные с помощью внутриклеточного отведения.
Нейрон может генерировать с разной частотой регулярные потенциалы
действия. На кривой Г показано завершение потенциала высокочастотными
разрядами. В это время на ЭкоГ (кривая В) в зоне очага появляется
спайковый разряд (указан стрелкой)
При растормаживании нейрона в связи с ослаблением торможения и деполяризацией мембраны происходит усиление поступления Са2+ в нейрон. Кроме того, Са2+, находясь уже в цитозоле, нарушает поступление С1- в нейрон, ослабляя, таким образом, изнутри ГАМКергическое торможение. С этим связана эпилептизация нейрона, возникающая под влиянием конвульсантов, которые нарушают ГАМКергическое торможение. Многие конвульсанты (например, пенициллин, коразол и др.) оказывают сложное действие на нейрон, одновременно активируя возбуждающие и инактивируя тормозные механизмы.
Хроническая стимуляция нейрона (например, при прямом электрическом раздражении, синаптическом воздействии, под влиянием возбуждающих аминокислот и др.) даже слабой интенсивности может с течением времени привести к гиперактивации нейрона. С другой стороны, выключение афферентации нейрона также обусловливает его гиперактивацию. Этот эффект объясняется повышением чувствительности нейрона и нарушением тормозных процессов.
Таким образом, патологическая гиперактивация нейронов, их эпилептизация представляет сложный комплекс разнообразных мембранных и внутриклеточных процессов. Для подавления эпилептической активности целесообразно комплексное применение веществ, нормализующих основные патогенетические звенья процесса. Среди корригирующих воздействий первостепенное значение имеют блокада поступления Са2+ и восстановление тормозного контроля.
21.4. ГЕНЕРАТОРЫ ПАТОЛОГИЧЕСКИ УСИЛЕННОГО ВОЗБУЖДЕНИЯ (ГПУВ) 21.4.1. Понятие и общая характеристика
Расстройство деятельности ЦНС возникает при воздействии достаточно мощного потока импульсов, способного преодолеть механизмы регуляции и тормозного контроля других отделов ЦНС и вызвать их патологическую активность. Столь мощный поток импульсов продуцируется группой гиперактивных нейронов, образующих генератор патологически усиленного возбуждения (Г.Н. Крыжановский).
ГПУВ - это агрегат гиперактивных взаимодействующих нейронов, продуцирующий неконтролируемый поток импульсов. Интенсивность и характер этого потока не соответствуют поступающему сигналу и определяются только особенностями структурно-функциональной организации генератора. Вследствие того, что нейроны генератора активируют друг друга, генератор способен самоподдерживать свою активность, не нуждаясь в постоянной дополнительной стимуляции извне.
Возникая при повреждениях нервной системы, генератор становится патогенетическим фактором развития процесса. Его образование имеет характер универсального механизма и является типовым патологическим процессом, осуществляющимся на уровне межнейрональных отношений. Электрофизиологическим выражением деятельности генератора служат суммарные потенциалы составляющих его нейронов. В качестве примера таких потенциалов можно привести электрическую активность, регистрируемую в области генератора в гигантоклеточном ядре продолговатого мозга (рис. 21-7) и в эпилептическом очаге в коре головного мозга, который является одним из видов генератора.
Патогенетическое значение ГПУВ. Основное патогенетическое значение генератора заключается в том, что он гиперактивирует тот отдел ЦНС, в котором он возник или с которым он непосредственно связан, вследствие чего этот отдел приобретает значение патологической детерминанты (см. разд. 21.5), формирующей патологическую систему (см. разд. 21.6). Поскольку патологические системы лежат в основе соответствующих нервных расстройств (нейропатологических синдромов), образование генератора является начальным звеном этих расстройств.
21.4.2. Образование и деятельность генераторов патологически усиленного возбуждения
Генератор может образовываться при действии разнообразных веществ экзогенной или эндогенной природы, вызывающих либо нарушение механизмов тормозного контроля (что влечет за собой растормаживание и гиперактивацию нейронов), либо непосредственную гиперактивацию нейронов. В последнем случае тормозные механизмы сохранены, но они функционально неэффективны и не способны нормализовать деятельность нейронов. Во всех случаях обязательным условием образования и деятельности гене-
 Рис. 21-7. Характер
вызванной активности в гигантоклеточном ядре кошки в норме и при
формировании в нем генератора после введения столбнячного токсина: А -
реакция на слабое одиночное раздражение икроножного нерва; реакция того
же гигантоклеточного ядра на одиночное раздражение той же силы того же
нерва при формировании в ядре генератора через 2 ч (Б), 3 ч (В) и 4 ч
(Г) после введения в ядро столбнячного токсина: длительные, возрастающие
со временем по частоте и амплитуде послеразряды, которые могут
продолжаться неопределенное долгое время, - генерирование интенсивного
самосдерживающего возбуждения
Рис. 21-7. Характер
вызванной активности в гигантоклеточном ядре кошки в норме и при
формировании в нем генератора после введения столбнячного токсина: А -
реакция на слабое одиночное раздражение икроножного нерва; реакция того
же гигантоклеточного ядра на одиночное раздражение той же силы того же
нерва при формировании в ядре генератора через 2 ч (Б), 3 ч (В) и 4 ч
(Г) после введения в ядро столбнячного токсина: длительные, возрастающие
со временем по частоте и амплитуде послеразряды, которые могут
продолжаться неопределенное долгое время, - генерирование интенсивного
самосдерживающего возбуждения
ратора является недостаточность торможения составляющих его нейронов.
Примером образования генератора при первичном нарушении торможения могут быть генераторы, возникающие при действии столбнячного токсина, стрихнина, пенициллина и других конвульсантов. Примером образования генератора при первичной гиперактивации
нейронов могут быть генераторы, возникающие при усиленной и продолжительной синаптической стимуляции, действии возбуждающих аминокислот (в частности, глутамата), неглубокой ишемии и постишемической реперфузии ЦНС. Генератор может возникать также при деафферентации нейронов после перерезки нервов и спинного мозга, с чем связаны деафферентационные болевые синдромы.
На ранних стадиях развития генератора, когда тормозные механизмы еще сохранены, а возбудимость нейронов невысока, генератор активируется достаточно сильными стимулами, поступающими через определенный вход в составляющую его группу нейронов. На поздних стадиях, когда возникает глубокая недостаточность тормозных механизмов и значительно повышается возбудимость нейронов, генератор может активироваться различными стимулами из разных источников, а также спонтанно.
21.5. ПАТОЛОГИЧЕСКАЯ ДЕТЕРМИНАНТА
21.5.1. Понятие и общая характеристика
Образование генератора не всегда имеет своим следствием возникновение патологических реакций. При блокаде распространения генерируемого возбуждения механизмами тормозного контроля генератор оказывается функционально изолированным и не вызывает системных патологических эффектов. Патология возникает, если гиперактивируемый под влиянием генератора отдел ЦНС активно влияет на другие образования ЦНС, вовлекает их в патологическую реакцию и объединяет их в новую организацию - патологическую систему (Г.Н. Крыжановский). Во многих случаях, в частности на ранних стадиях образования патологической системы и в острых случаях, такой гиперактивный отдел ЦНС определяет характер деятельности патологической системы, он приобретает значение патологической детерминанты. Роль патологической детерминанты может играть любое образование ЦНС (отдел, ядро, нервный центр и пр.).
Патогенетическое значение патологической детерминанты. Патологическая детерминанта является формирующим, ключевым и управляющим звеном патологической системы. Возникновение детерминанты относится к разряду типовых патологических процессов, реализующихся на системном уровне.
Примером патологической детерминанты в коре головного мозга является мощный эпилептический очаг, под влиянием которого формируется комплекс из разрозненных, более слабых очагов эпилептической активности. Такой очаг формирует эпилептический комплекс, представляющий собой патологическую (эпилептическую) систему. Если подавить с помощью фармакологических средств или хирургически удалить детерминантный очаг, то ком-
плекс распадается и вместо него вновь возникают отдельные эпилептические очаги.
21.5.2. Возникновение и деятельность патологической детерминанты
Детерминанта может объединять структуры ЦНС в патологическую систему и определять характер активности этих структур. Если ослабляется регуляция структур, которые воспринимают импульсацию от нейронов детерминанты, то детерминанта подчиняет их своим влияниям.
На ранних стадиях развития нервных расстройств патологическая детерминанта активируется специфическими стимулами, т.е. раздражениями, которые адекватны для образования ЦНС, ставшего детерминантой (например, световыми раздражениями, если детерминантой являются образования в системе зрительного анализатора, болевыми - если детерминанта возникла в системе болевой чувствительности и пр.). Эта закономерность распространяется и на расстройства высшей нервной деятельности, невротические реакции: их детерминанта облегченно активируется при действии тех раздражителей, которые обусловили ее образование (например, те же конфликтные невротизирующие ситуации и пр.). Указанные особенности определяют специфику провоцирующих воздействий, вызывающих приступы при нервных расстройствах.
На поздних стадиях детерминанта может активироваться стимулами различной природы, в связи с чем приступы могут провоцироваться разными воздействиями. Кроме того, патологическая детерминанта может активироваться случайно в связи со спонтанной активацией генератора.
Отделы ЦНС, испытывающие длительное влияние патологической детерминанты, с течением времени могут сами становиться детерминантами. Вначале такая вторичная детерминанта зависима от первичной: она исчезает, если ликвидируется первичная детерминанта. В дальнейшем вторичная детерминанта может приобрести самостоятельное патогенетическое значение. Иногда вторичная детерминанта оказывается более сильной, чем первичная, и становится ведущей. Установление первичной и вторичной детерминант имеет важное значение для понимания патогенетических особенностей нервных расстройств, их правильной диагностики и патогенетической терапии.
Патологическая детерминанта является наиболее резистентной частью патологической системы. При подавлении патологической системы или при ее естественной ликвидации детерминантная структура сохраняется еще тогда, когда другие образования системы уже нормализовались и вышли из ее состава («детерминанта умирает последней»). При восстановлении патологической системы под влиянием новых воздействий раньше других активируется детерминантная структура («детерминанта воскресает первой»).
21.6. ПАТОЛОГИЧЕСКАЯ СИСТЕМА
21.6.1. Понятие и общая характеристика
Патологическая система - новая патодинамическая организация, возникающая в ЦНС в условиях повреждения, деятельность которой имеет биологически отрицательное значение (Г.Н. Крыжановский). Главным признаком патологической системы является ее дезадаптивное или прямое патогенное значение для организма. Этот признак отличает патологическую систему от физиологической, деятельность которой имеет адаптивное значение и направлена на достижение полезного для организма результата.
В одних случаях патологическая система возникает в результате гиперактивации и выхода из-под контроля физиологической системы, в других - путем вовлечения поврежденных и неповрежденных образований ЦНС в новую, не существовавшую ранее структурно-функциональную организацию.
Возникновение патологической системы представляет собой следующий этап развития патологического процесса. Формирование и деятельность патологической системы относятся к разряду типовых патологических процессов, реализующихся на уровне системных отношений.
Наглядным примером деятельности патологической системы является патологический чесательный рефлекс. Он возникает при создании генератора в брахиальном отделе спинального аппарата чесательного рефлекса. Аппарат чесательного рефлекса становится патологической детерминантой, которая превращает физиологический чесательный рефлекс в патологический. Животное начинает расчесывать задней лапой зону проекции рефлекса. Эти расчесывания возникают спонтанно. С течением времени, по мере развития патологической системы, они становятся все более
частыми, продолжительными и ожесточенными и могут завершаться раздиранием тканей. Животное не в состоянии прекратить эти расчесывания, несмотря на их бесполезность и вредящий эффект. Подобного рода неукротимое насильственное поведение наблюдается при многих формах патологии нервной системы у человека.
21.6.2. Структурно-функциональная организация и особенности деятельности патологической системы
На рис. 21-8 представлена принципиальная схема организации патологической системы. Ключевым управляющим звеном является патологическая детерминанта с ее механизмом гиперактивации в виде генератора (блок Г-Д). Промежуточные (блок П) и центральные эфферентные звенья (блок ЦЭ) развивают деятельность, которая соответствует особенностям активности патологической детерминанты. Если патологическая система имеет выход на периферию, то в ее структуру входит и периферический орган, который становится органом-мишенью (блок ОМ). В этом случае деятельность патологической системы проявляется в виде измененной функции органа - патологического эффекта (блок ПЭф). Если конечным звеном патологической системы являются структуры
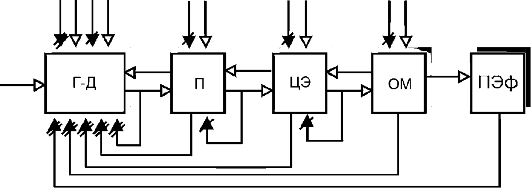 Рис. 21-8. Принципиальная
схема организации патологической системы: Г-Д - патологическая
детерминанта с генератором патологически усиленного возбуждения; П -
промежуточные центральные звенья; ЦЭ - центральные эфферентные звенья;
ОМ - орган-мишень; ПЭф - конечный патологический эффект. Стрелки с
белыми треугольниками - возбуждающие связи; стрелки с черными
треугольниками - тормозные связи; перечеркнутые двумя чертами черные
треугольники - глубокая недостаточность тормозных связей, одной чертой -
относительная недостаточность
Рис. 21-8. Принципиальная
схема организации патологической системы: Г-Д - патологическая
детерминанта с генератором патологически усиленного возбуждения; П -
промежуточные центральные звенья; ЦЭ - центральные эфферентные звенья;
ОМ - орган-мишень; ПЭф - конечный патологический эффект. Стрелки с
белыми треугольниками - возбуждающие связи; стрелки с черными
треугольниками - тормозные связи; перечеркнутые двумя чертами черные
треугольники - глубокая недостаточность тормозных связей, одной чертой -
относительная недостаточность
мозга, то ее эффект выражается в нарушении соответствующих функций мозга.
От всех звеньев патологической системы идут обратные отрицательные связи к тем же звеньям и к детерминанте. Однако в отличие от физиологической системы, где подобные связи регулируют деятельность системы, в патологической системе они функционально неэффективны, так как не корригируют (или плохо корригируют) патологическую детерминанту, которая вследствие недостаточности тормозных механизмов выходит из-под контроля. Тормозные механизмы относительно недостаточны и в других отделах патологической системы. Поэтому система в целом практически выходит из-под общего интегративного контроля ЦНС. Наряду с этим, благодаря постоянной активности, положительные связи между частями патологической системы упрочиваются, проведение возбуждения по этим связям облегчается. Вследствие этого с течением времени патологическая система становится все более резистентной к регулирующим влияниям со стороны антисистемы и мозга и в целом к лечебным воздействиям.
На ранних стадиях процесса патологическая система вслед за патологической детерминантой активируется специфическими для нее раздражителями, на поздних стадиях она может активироваться различными, в том числе случайными, стимулами, а также спонтанно. Поэтому на поздних стадиях приступы, характерные для деятельности данной патологической системы (например, эпилептические припадки, эмоциональные аффекты, приступы боли и пр.), могут провоцироваться различными раздражениями, возникать спонтанно, становясь все более частыми, продолжительными и интенсивными.
В начальной стадии патологическая система зависима от патологической детерминанты, она активируется при возбуждении детерминанты и исчезает при ее ликвидации. На поздних стадиях вследствие упрочения структуры патологической системы последняя менее зависима от детерминанты и может продолжать действовать и после ее удаления.
21.6.3. Патогенетическое значение патологической системы
Патологические системы лежат в основе разнообразных нервных расстройств, относящихся к различным сферам деятельности нервной системы, поэтому их образование имеет значение практически универсального патогенетического фактора.
Деятельность патологической системы клинически выражается в виде нейропатологического синдрома или симптомов. Каждый синдром имеет свою патологическую систему. Простые, линейные патологические системы проявляются в виде симптомов или мономорфных синдромов. Примером сравнительно простой патологической системы является патологическая система описанного выше патологического чесательного рефлекса. Многозвеньевые, разветвленные патологические системы служат патогенетической основой сложных полиморфных синдромов. В качестве примера таких патологических систем можно привести паркинсонизм, эмоционально-поведенческие расстройства и др.
Последовательно реализующаяся патогенетическая триада «генератор - патологическая детерминанта - патологическая система» является механизмом возникновения различных нервных расстройств.
Это положение лежит в основе воспроизведения экспериментальных моделей различных нейропатологических синдромов: центральных болей спинального происхождения (генератор в дорзальных рогах спинного мозга); невралгии тройничного нерва (генератор в каудальном ядре тройничного нерва); таламического болевого синдрома (генератор в интраламинарном ядре таламуса); вестибулопатии - крыса вертится вокруг продольной оси своего тела (генератор в вестибулярном ядре Дейтерса); фотогенной эпилепсии (генератор в системе зрительного анализатора - в латеральном коленчатом теле); патологически удлиненного сна (генератор в сомногенной системе); сложного психоаффективного патологического состояния (генератор в эмоциогенной системе); патологическое пищедобывательное поведение типа насильственной формы поведения (генератор в латеральном гипоталамусе); паркинсонического синдрома (генератор в хвостатых ядрах).
Один из важных механизмов функционирования патологической системы заключается в том, что она подавляет активность физиологических систем, в том числе и антисистем, и компенсаторные процессы. Этот механизм способствует развитию патологического процесса, особенно при продолжающемся действии этиологического фактора.
21.6.4. Ликвидация и восстановление патологической системы
В отличие от физиологической системы, которая после достижения запрограммированного биологически полезного (адаптивного)
результата ликвидируется, патологическая система может действовать неопределенно долгое время. Это связано с сохранением патологической детерминанты и закреплением положительных связей между частями патологической системы. Ликвидация патологической системы обусловлена ослаблением влияний патологической детерминанты и активацией антисистем. Она может происходить естественным путем при мобилизации саногенетических механизмов и при действии лечебных средств.
Ликвидация патологической системы осуществляется по единой закономерности - происходит последовательная нормализация деятельности тех частей системы, которые испытывают наименьшее влияние со стороны патологической детерминанты. Поэтому редукция патологической системы осуществляется за счет выхода из нее наименее зависимых от патологической детерминанты частей системы. Дольше других сохраняется патологическая детерминанта. При ее исчезновении может остаться локальный, ослабленный генератор, не вызывающий значимых патологических эффектов. Затем исчезает и генератор. При активации следов от бывшей патологической системы последняя может восстановиться. Так происходит рецидив нервных расстройств, в основе которых лежит патологическая система.
Удаление патологической системы за счет центральных эфферентных частей (см. рис. 21-8, блоки ЦЭ и ОМ) при соответствующих лечебных воздействиях ведет к исчезновению клинических симптомов или синдромов, так как в этих условиях она не может проявиться в виде нарушения функций органа-мишени. Однако при этом остаются другие части патологической системы и сохраняется угроза ее восстановления. Лечение, направленное на нормализацию лишь эфферентных звеньев и органа-мишени патологической системы, является не патогенетическим, а симптоматическим.
Вместе с тем указанная редукция патологической системы может оказаться клинически эффективной. Удаление патологической системы ведет к снижению резистентности оставшейся ее части из-за снижения числа положительных связей, укрепляющих эту систему. Уменьшение числа звеньев системы способствует ее дестабилизации и ликвидации. Важно, что уменьшается дезорганизующее влияние патологической системы на другие системы ЦНС.
На ранних стадиях устранение патологической детерминанты приводит к ликвидации патологической системы. На поздних ста-
диях в связи с образованием вторичных детерминант патологическая система может либо восстанавливаться, либо продолжать существовать и после ликвидации первичной патологической детерминанты. Закрепление патологической системы ведет к хронизации патологического процесса и соответствующих нервных расстройств.
Борьба с патологическими системами, особенно со сложными и застарелыми формами, весьма трудна и не всегда эффективна. Она требует комплексной патогенетической терапии, направленной на ликвидацию патологической детерминанты и нормализацию других звеньев патологической системы, на активацию антисистем, усиление общего контроля и других саногенетических механизмов, и должна сочетаться с этиологической терапией для предотвращения действия патогенных факторов, поддерживающих патологические системы.
21.7. НАРУШЕНИЯ ДОМИНАНТНЫХ ОТНОШЕНИЙ
21.7.1. Понятие и общая характеристика доминанты
Доминантой, по определению А.А. Ухтомского, является господствующая в данный момент функциональная структура ЦНС - центр, физиологическая система. Доминирование данной структуры над другими осуществляется путем сопряженного торможения этих структур. Доминантные отношения имеют важное значение для деятельности нервной системы: благодаря торможению других систем действующая в данный момент физиологическая система не испытывает помех. Это обеспечивает достижение запрограммированного результата в необходимой мере, без искажений. Нарушения доминантных отношений могут иметь место при различных формах патологии нервной системы, они представляют собой типовой патологический процесс, осуществляющийся на уровне системных отношений.
21.7.2. Виды нарушений доминантных отношений и их патогенетическое значение
Нарушение доминантных отношений выражается либо в виде их недостаточности, либо в виде их чрезмерного усиления. И в том, и в другом случае возникает патология.
При недостаточности доминантных отношений деятельность активной в данный момент системы нарушается из-за влияния на нее других систем. В этих условиях результат деятельности данной системы не соответствует тому, который должен быть достигнут. При глубоком нарушении доминантных отношений такой результат вообще не может быть достигнут.
При чрезмерном усилении доминантных отношений патология заключается в том, что физиологические системы и другие структуры ЦНС испытывают сильное торможение в связи с деятельностью доминирующей системы. Гиперактивная патологическая система приобретает значение патологической доминанты - она вызывает угнетение физиологических систем.
В норме физиологическая доминанта и детерминанта представляют собой рабочие принципы деятельности нервной системы. Доминанта благодаря торможению других систем обеспечивает возможность нормальной деятельности активной в данный момент системы, детерминанта же определяет особенности деятельности этой системы. Доминанта является механизмом межсистемных отношений, детерминанта - механизмом внутрисистемных отношений.
21.8. БОЛЕЗНИ НЕРВНОЙ РЕГУЛЯЦИИ
21.8.1. Понятие и общая характеристика
Расстройства функции возникают не только вследствие повреждения молекулярных и клеточных процессов, но и в результате нарушения регуляции этих процессов. Если нарушение регуляции играет главную патогенетическую роль, возникающие расстройства имеют характер дизрегуляционной патологии, или болезней регуляции. Когда страдает нервная регуляция, возникают болезни нервной регуляции (Г.Н. Крыжановский).
При болезнях нервной регуляции начальным звеном развития патологического процесса являются изменения в аппарате регуляции или первичное повреждение органа-мишени. Патологически измененная регуляция деятельности органа представляет фактор, который обусловливает развитие вторичных или дальнейших изменений в органе-мишени.
Нарушения нервной регуляции могут быть обусловлены изменениями как в центральных, так и в периферических звеньях аппарата регуляции. Клиническим выражением деятельности этих
ПС являются соответствующие синдромы. В том случае, если органами-мишенями служат внутренние органы, возникает нейровисцеральная патология. Если патологической детерминантой становятся вегетативные центры, возникающие синдромы представляют собой вегетативную патологию.
Примеры болезней нервной регуляции. Болезни нервной регуляции составляют обширный класс разнообразных расстройств. К ним относятся нейрогенные формы сердечных аритмий и гипертонии, вегетативные диэнцефальные пароксизмы, нейрогенные дискинезии внутренних полостных органов (желудок, кишечник, желчный пузырь, фаллопиевые трубы, матка и пр.), некоторые формы язвы желудка и двенадцатиперстной кишки, бронхиальной астмы, диабета, глаукомы, различного рода вегетативные кризы, так называемые пароксизмальные состояния и пр.
Те формы патологии, которые в обиходе нередко обозначаются как «неврозы внутренних органов» (например, «кардиальный невроз», «невроз желудка» и пр.), представляют собой болезни нервной регуляции. Они относятся к невротическим расстройствам с определенными патологическими системами, органами-мишенями которых являются соответствующие висцеральные органы. Вовлечение того или иного образования в структуру патологической системы зависит от того, будут ли преодолены механизмы регуляции этого образования влияниями детерминанты. Важное значение имеют также собственные механизмы регуляции органа-мишени. Так, в обычных условиях при экспериментальных сердечных аритмиях, вызываемых созданием генератора в ЦНС, нарушения ритма сердца начинают проявляться лишь при длительном действии генератора. Если же предварительно вызвать изменения реактивности сердца или его незначительное повреждение, которое само по себе не проявляется, то в этих условиях при образовании генератора аритмии возникают быстро.
Болезни регуляции, в том числе и болезни нервной регуляции, врач обычно относит к так называемой функциональной патологии, говоря, что органических изменений нет. В органе-мишени выраженные структурные изменения могут проявляться на более поздних стадиях процесса.
21.8.2. Принципы лечения болезней нервной регуляции
Лечение, направленное лишь на нормализацию измененной функции внутреннего органа, является не патогенетическим, а
симптоматическим. Его результат обычно непродолжителен, и при отмене поддерживающей терапии может возникнуть рецидив. Патогенетическое лечение должно заключаться в ликвидации патологической системы, в нормализации аппарата нервной регуляции. Важно применение комплексной патогенетической терапии в виде сочетанного воздействия на аппарат регуляции, другие части патологической системы и на орган-мишень. Этиологическая терапия должна заключаться в устранении факторов, вызывающих и поддерживающих расстройства нервной регуляции.
21.9. ПАТОФИЗИОЛОГИЯ БОЛИ
21.9.1. Понятие и общая характеристика
Боль представляет собой сложное психоэмоциональное неприятное ощущение, реализующееся специальной системой болевой чувствительности и высшими отделами мозга. Она сигнализирует
о воздействиях, вызывающих повреждение ткани, или об уже существующих повреждениях. Систему восприятия и передачи болевого сигнала называют также ноцицептивной системой1.
Различают физиологическую и патологическую боль. Физиологическая боль имеет значение адаптивного защитного механизма. Она сигнализирует о действиях повреждающих агентов, об уже возникших повреждениях и о развитии патологических процессов в тканях. Физиологическая боль активирует защитные процессы и поведенческие реакции, направленные на устранение действия болевого (алгогенного) фактора и последствий этого действия.
Люди с врожденной или приобретенной (например, при травмах, инфекционных поражениях) патологией ноцицептивной системы, лишенные болевой чувствительности, не замечают повреждений, что может привести к тяжелым последствиям.
Патологическая боль имеет дезадаптивное и патогенное значение. Различные виды патологической боли проявляются в качестве характерных для нее синдромов и симптомов, которые отсутствуют при физиологической боли. Сюда относятся каузалгия, гиперпатия, первичная и вторичная гипералгезия, расширение и появление новых алгогенных рецептивных зон, персистирующая боль, спонтанные приступы боли, сохранение боли после прекра-
1 От лат. посеге - повреждать и сереге - воспринимать. Соответствующая терминология (ноцицептивное воздействие, ноцицепторы и др.) введена Шеррингтоном.
щения действия провоцирующего раздражителя и другие феномены. Патологическая боль осуществляется той же ноцицептивной системой, но измененной в условиях патологии.
Патологическая боль обусловливает развитие структурнофункциональных изменений и повреждений во внутренних органах, в частности в сердечно-сосудистой системе, дистрофию тканей, нарушение вегетативных реакций, изменения деятельности нервной, эндокринной и иммунной систем, психоэмоциональной сферы и поведения. Чрезвычайная боль может вызвать тяжелый шок, неукротимая хроническая боль может быть причиной инвалидизации. Патологическая боль становится патогенетическим фактором развития новых патологических процессов и приобретает значение самостоятельного нейропатологического синдрома или даже болезни. Патологическая боль плохо корригируется и борьба с ней затруднительна. Если патологическая боль возникает вторично (при тяжелых соматических болезнях, злокачественных образованиях и др.), то нередко она становится главным объектом лечебных вмешательств, имеющих целью уменьшить мучения больного.
21.9.2. Патологическая боль периферического происхождения
Этот вид патологической боли возникает при хроническом раздражении рецепторов боли (ноцицепторов), повреждении ноцицептивных волокон, спинно-мозговых ганглиев и задних корешков. Эти структуры становятся источником интенсивной и нередко постоянной ноцицептивной стимуляции. Ноцицепторы могут активироваться при хронических воспалительных процессах (например, при артритах), действии продуктов распада тканей (например, при опухолях) и др. Хронически повреждаемые (например, при сдавливании рубцами, разросшейся костной тканью и пр.) и регенерирующие чувствительные нервы, дегенеративно измененные (при действии различных вредностей, эндокринопатиях), и демиелинизированные волокна весьма чувствительны к различным гуморальным воздействиям, даже к тем, на которые они не реагируют в нормальных условиях (например, к действию адреналина, К+ и др.). Участки таких волокон становятся эктопическим источником постоянной и значительной ноцицептивной стимуляции.
Особую роль подобного источника играет неврома - образование из хаотически разросшихся нервных волокон, которое возникает при их неупорядоченном и затрудненном росте. Эти окончания
чувствительны к различным механическим, температурным, химическим и эндогенным воздействиям (например, к катехоламинам). Поэтому приступы боли при невромах, а также при повреждениях нервов могут быть спровоцированы разными факторами (например, при эмоциональном стрессе, действии адреналина).
Ноцицептивная стимуляция с периферии может вызвать приступ боли в том случае, если она преодолевает так называемый «воротный контроль» в задних рогах (Мелзак, Уолл), состоящий из аппарата тормозных нейронов желатинозной субстанции. Эти нейроны регулируют поток входящей в задние рога и восходящей ноцицептивной стимуляции. Такой эффект может иметь место при интенсивной афферентной стимуляции либо при недостаточности тормозных механизмов «воротного контроля».
21.9.3. Патологическая боль центрального происхождения
Этот вид патологической боли связан с гиперактивацией ноцицептивных нейронов на спинальном и супраспинальном уровнях. Такие нейроны образуют агрегаты, которые представляют собой генераторы патологически усиленного возбуждения. При образовании генератора в задних рогах спинного мозга возникает центральный болевой синдром спинального происхождения (рис. 21-9, А,1), при образовании в ядрах тройничного нерва - тригеминальная невралгия (рис. 21-9, А,2), в ядрах таламуса - таламический болевой синдром (рис. 21-9, А,3).
На ранних этапах патологического процесса приступ боли, обусловленный активацией генератора, провоцируется ноцицептивными стимулами с определенного, непосредственно связанного с генератором рецептивного поля; на поздних стадиях приступ провоцируется стимулами различной интенсивности с разных рецепторных полей, а также может возникать спонтанно. Особенность приступа боли (пароксизмальный, непрерывный, кратковременный, продолжительный и пр.) зависит от особенностей функционирования генератора и патологической системы. Характер же самой боли (тупая, острая, локализованная, диффузная и др.) определяется тем, какие образования ноцицептивной системы стали частями патологической алгической системы.
Генератор в центральном аппарате ноцицептивной системы может возникать, например, в дорзальных рогах при длительной ноцицептивной стимуляции с периферии. В этих условиях боль первона-
 Рис. 21-9. Центральные
болевые синдромы спинального 1, тригеминального 2 и таламического 3
происхождения. При образовании генератора в дорсальных рогах люмбальных
сегментов (L4-L5) слева (А, 1) возникает центральный болевой синдром
спинального происхождения: во время приступа боли крыса взвизгивает
(фонограмма - верхняя кривая, Б, 1) и усиленно вылизывает и даже
выкусывает зону проекции боли на левом бедре (заштрихована, В, 1),
которая лишается шерсти и эрозируется. При образовании генератора в
каудальном ядре тройничного нерва (А, 2) возникает невралгия тройничного
нерва: во время приступа боли крыса взвизгивает и вычесывает зону
проекции боли на мордочке (заштрихована, В, 2). При образовании
генератора в интрамедиальном ядре таламуса (А, 3) возникает таламический
болевой синдром с мигрирующими по телу зонами проекции боли (В, 3)
Рис. 21-9. Центральные
болевые синдромы спинального 1, тригеминального 2 и таламического 3
происхождения. При образовании генератора в дорсальных рогах люмбальных
сегментов (L4-L5) слева (А, 1) возникает центральный болевой синдром
спинального происхождения: во время приступа боли крыса взвизгивает
(фонограмма - верхняя кривая, Б, 1) и усиленно вылизывает и даже
выкусывает зону проекции боли на левом бедре (заштрихована, В, 1),
которая лишается шерсти и эрозируется. При образовании генератора в
каудальном ядре тройничного нерва (А, 2) возникает невралгия тройничного
нерва: во время приступа боли крыса взвизгивает и вычесывает зону
проекции боли на мордочке (заштрихована, В, 2). При образовании
генератора в интрамедиальном ядре таламуса (А, 3) возникает таламический
болевой синдром с мигрирующими по телу зонами проекции боли (В, 3)
чально периферического происхождения приобретает центральный компонент и становится болевым синдромом спинального происхождения. Такая ситуация имеет место при каузалгии, невромах и повреждениях афферентных нервов, при невралгиях и пр.
Генератор в центральном ноцицептивном аппарате может возникнуть также при деафферентации, в связи с повышением чувствительности деафферентированных ноцицептивных нейронов и нарушением тормозного контроля. Деафферентационные болевые синдромы могут появляться после ампутации конечностей, перерезки нервов и задних корешков, после перерыва или перерезки спинного мозга. При этом больной может ощущать боль в лишенной чувствительности или в несуществующей части тела (например, в несуществующей конечности, в частях тела ниже перерезки спинного мозга). Такого типа патологическая боль получила название фантомной (от слова «fantom» - призрак). Она обусловлена деятельностью центрального генератора, активность которого уже не зависит от ноцицептивной стимуляции с периферии.
Генератор в центральных отделах ноцицептивной системы может возникать при инфекционных повреждениях этих отделов (герпетические и сифилитические повреждения), травмах, токсических воздействиях. В эксперименте такие генераторы и соответствующие болевые синдромы воспроизводятся путем введения в соответствующие отделы ноцицептивной системы веществ, вызывающих нарушение тормозных механизмов (столбнячный токсин, пенициллин), либо активирующих ноцицептивные нейроны (ионы калия и пр.).
В центральном аппарате ноцицептивной системы могут образовываться вторичные генераторы. Так, после образования генератора в задних рогах спинного мозга через определенное время может возникнуть вторичный генератор в таламусе. Нередко при локализации первичного генератора в спинном мозгу, с целью предотвращения поступления из него импульсации в головной мозг, производят частичную (перерыв восходящих трактов), а в тяжелых случаях даже полную перерезку проводящих путей спинного мозга.
21.9.4. Патологическая алгическая система
Возникший в афферентном входе (дорзальные рога спинного мозга или каудальное ядро тройничного нерва) генератор сам по себе не способен вызвать патологическую боль. Локальный генератор в спинном мозгу может обусловить региональные изменения: облегчение флексорного рефлекса, изменение активности мотонейронов и др.
Патологическая боль как страдание и как синдром возникает, если в процесс вовлекаются и другие отделы системы болевой чувствительности, в частности структуры головного мозга, ответственные за проявления чувства боли, ее эмоциональную окраску.
Участие этих структур в формировании патологической боли заключается не просто в их ответах на поступающие ноцицептивные сигналы, как при физиологической боли. Отдел системы болевой чувствительности, в котором возник генератор, становится гиперактивным и приобретает способность изменять функциональное состояние нейронов других уровней. Из первично и вторично измененных образований системы болевой чувствительности формируется и закрепляется пластическими процессами новая патологическая интеграция - патологическая алгическая система (ПАС). Тот отдел системы болевой чувствительности, под влиянием которого образуется патологическая алгическая система, играет роль детерминанты ПАС.
Если патологическая алгическая система оказывается несформированной, если в нее не входят высшие отделы системы болевой чувствительности - таламус и кора головного мозга, - болевой синдром поведенчески не проявляется. Такая ситуация может иметь место в том случае, если ноцицептивные нейроны в дорзальном роге недостаточно активны и не образуют генератора либо если высшие отделы системы болевой чувствительности обладают эффективным тормозным контролем. В обоих случаях роль контролирующего механизма, препятствующего формированию и деятельности патологической алгической системы, играет антиноцицептивная система.
В табл. 21-1 представлены уровни и образования системы болевой чувствительности, входящие в патологическую алгическую систему, которая возникает вследствие усиленной ноцицептивной стимуляции с периферии. Эти образования составляют основной ствол ПАС, от них идут связи к различным отделам ЦНС, вовлечение которых в патологический процесс вызывает дополнительные синдромы. К последним относятся вегетативные нарушения, изменения сердечно-сосудистой системы и микроциркуляции, дизрегуляция функций внутренних органов, эндокринной и иммунной систем, психоэмоциональные расстройства и др.
Течение болевого синдрома и характер приступов боли зависят от особенностей активации и деятельности ПАС. Важную роль в этом процессе играют особенности активации генератора, с ко-
торым связана активность ПАС. При значительном нарушении тормозных механизмов и повышенной возбудимости нейронов происходит их гиперсинхронизация, и генератор разряжается быстронарастающим потоком импульсов. Если этот поток вызывает столь же быструю и усиленную активацию патологической алгической системы, то приступ боли имеет пароксизмальный характер. Если генератор развивает свою активность медленно и так же медленно активируется ПАС, то интенсивность боли при приступе медленно нарастает; при тонической активности генератора и ПАС боль постоянная.
Таблица 21-1. Уровни и образования измененной системы болевой чувствительности, составляющие основной ствол патологической алгической системы
Периферические отделы | Сенситизированные ноцицепторы, очаги эктопического возбуждения (поврежденные и регенерирующие нервы, демиелинизированные участки нервов, неврома); группы гиперактивированных нейронов спинальных ганглиев |
Спинальный уровень | Агрегаты гиперактивных нейронов (генераторы) в афферентных ноцицептивных реле - в дорсальных рогах спинального мозга и в ядрах спинального тракта тройничного нерва (каудальное ядро) |
Супраспинальный уровень | Ядра ретикулярной формации ствола, ядра таламуса, сенсомоторная и орбитофронтальная кора, эмоциогенные структуры |
21.9.5. Антиноцицептивная система
Ноцицептивная система имеет свой функциональный антипод - антиноцицептивную систему, которая контролирует деятельность структур ноцицептивной системы.
Антиноцицептивная система состоит из разнообразных нервных образований, относящихся к разным отделам и уровням организации ЦНС, начиная с афферентного входа в спинном мозгу и кончая корой головного мозга. Каждое релейное переключение в ноцицептивной системе имеет свой аппарат контроля за активностью составляющих его ноцицептивных нейронов. Ноцицептивная и антиноцицептивная системы составляют общую систему болевой
чувствительности, определяющую характер ноцицептивной сигнализации, меру ее восприятия и реакцию на нее.
Антиноцицептивная система играет существенную роль в механизмах предупреждения и ликвидации патологической боли. Включаясь в реакцию при ноцицептивных раздражениях, она ослабляет восходящий поток ноцицептивной стимуляции и интенсивность болевого ощущения, благодаря чему боль остается под контролем и не приобретает патологического характера. При нарушении же деятельности антиноцицептивной системы ноцицептивные раздражения даже небольшой интенсивности вызывают чрезмерную боль. Такой эффект имеет место, например, при врожденной или приобретенной недостаточности антиноцицептивных механизмов спинного мозга, в частности при недостаточности «воротного контроля», при нарушениях проведения возбуждения по толстым волокнам, активирующим этот контроль, при травмах, инфекционных поражениях ЦНС и пр.
В случаях недостаточности антиноцицептивной системы необходима ее дополнительная и специальная активация. Последняя осуществляется различными способами. Эффективна прямая электростимуляция антиноцицептивных структур мозга, которая может вызвать подавление даже тяжелой патологической боли (рис. 21-10). Многие анальгетики, в частности опиоидные, оказывают свой эффект не только путем прямого подавляющего воздействия на ноцицептивные нейроны и блокады синаптической передачи возбуждения, но и через активацию структур антиноцицептивной системы. Через активацию антиноцицептивной системы действуют и немедикаментозные средства подавления боли (например, акупунктура). Электростимуляция толстых волокон, активирующая «воротный контроль» и другие механизмы антиноцицептивной системы, используется в клинике для подавления многих видов болей, особенно периферического происхождения.
Вместе с тем гиперактивация антиноцицептивной системы может обусловить неадекватную гипоалгезию и даже глубокое подавление болевой чувствительности. Такие эффекты возникают при формировании генератора в структурах антиноцицептивной системы. Истерические выпадения болевой чувствительности, аналгезия, возникающая при тяжелом стрессе и некоторых психозах, связаны также с усиленной активностью антиноцицептивной системы.
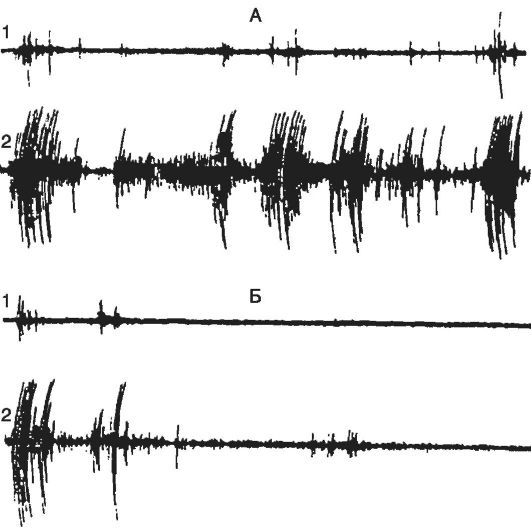 Рис. 21-10. Подавление
болевого синдрома спинального происхождения, вызванного генератором в
дорсальных рогах люмбальных сегментов спинного мозга, при
электростимуляции дорсального ядра шва продолговатого мозга: А -
приступы боли, проявляющиеся в виде взвизгиваний (фонограмма 1),
двигательных реакций (актограмма 2); перемещения с места на место,
усиления вылизывания и кусания в зоне проекции боли; Б - исчезновение
приступа боли во время электростимуляции дорсального ядра шва (отмечено
горизонтальной чертой)
Рис. 21-10. Подавление
болевого синдрома спинального происхождения, вызванного генератором в
дорсальных рогах люмбальных сегментов спинного мозга, при
электростимуляции дорсального ядра шва продолговатого мозга: А -
приступы боли, проявляющиеся в виде взвизгиваний (фонограмма 1),
двигательных реакций (актограмма 2); перемещения с места на место,
усиления вылизывания и кусания в зоне проекции боли; Б - исчезновение
приступа боли во время электростимуляции дорсального ядра шва (отмечено
горизонтальной чертой)
21.9.6. Нейрохимические механизмы боли
Функциональные нейрофизиологические механизмы деятельности системы болевой чувствительности реализуются нейрохимическими процессами на различных уровнях ноцицептивной и антиноцицептивной систем.
Периферические ноцицепторы активируются под влиянием многих эндогенных биологически активных веществ - гистамина, субстанции Р, кининов, простагландинов и др. Важную роль в проведении возбуждения в первичных ноцицептивных нейронах
играет субстанция Р. Ее рассматривают как медиатор боли. Капсаицин (вещество, содержащееся в красном перце) вызывает нарушение синтеза субстанции Р; введение капсаицина интратекально в область спинного мозга вызывает длительную аналгезию; с действием капсаицина может быть связан обезболивающий эффект перцового пластыря. В вышележащих уровнях ноцицептивной системы также имеется субстанция Р, однако проведение в них возбуждения осуществляется в основном теми нейромедиаторами, которые присущи нейронам этих уровней. В процессах проведения возбуждения в разных отделах ноцицептивной системы принимают участие различные нейропептиды, которые, как и в других отделах ЦНС, играют роль нейромодуляторов.
Нейрохимические механизмы деятельности антиноцицептивной системы реализуются эндогенными нейропептидами и классическими нейромедиаторами. Аналгезия вызывается, как правило, сочетанным или последовательным действием нескольких передатчиков.
Эффективными эндогенными анальгетиками являются опиоидные нейропептиды (энкефалины, эндорфин). Они угнетающе действуют на передаточные нейроны и активирующе - на нейроны антиноцицептивной системы, стимулируют систему диффузного ноцицептивного тормозного контроля (ДНТК), изменяют активность нейронов высших отделов мозга, воспринимающих ноцицептивную стимуляцию и участвующих в формировании болевого ощущения. Их эффекты реализуются также через действие серотонина, норадреналина и других нейромедиаторов. Аналгезию вызывают также и другие нейропептиды (нейротензин, холецистокинин, бомбезин, ангиотензин, вазопрессин и др.). Субстанция Р также может вызывать аналгезию и подавление даже патологической боли при ее действии на антиноцицептивные структуры, например на дорзальное ядро шва.
Из классических нейромедиаторов важную роль в осуществлении анальгетических эффектов играют серотонин, норадреналин, допамин, ГАМК. Серотонин является медиатором антиноцицептивной системы на спинальном уровне. Вместе с тем одна из частей серотонинергической системы принимает участие в деятельности ноцицептивной системы, она расширяет поля ноцицептивной чувствительности.
Норадреналин также является медиатором нисходящей антиноцицептивной системы, он подавляет активность ноцицептив-
ных нейронов задних рогов спинного мозга и ядер тройничного нерва. Кроме того, норадреналин подавляет болевые механизмы и на супраспинальном уровне. Его аналгезирующее действие связано с активацией α-адренорецепторов, а также с вовлечением серотонинергической системы. Поэтому активатор центральных α-адренорецепторов клофелин вызывает выраженный анальгетический эффект.
ГАМК принимает участие в подавлении активности ноцицептивных нейронов и боли на спинальном уровне. Нарушение ГАМКергических тормозных процессов (например, путем воздействия на задние рога столбнячного токсина, пенициллина и др.) вызывает образование в них генератора и тяжелый болевой синдром спинального происхождения. В среднем и продолговатом мозгу ГАМК может тормозить нейроны антиноцицептивных структур и ослаблять механизмы обезболивания на этом уровне.
21.9.7. Принципы лечения патологической боли
Основной принцип лечения патологической боли состоит в подавлении гиперактивности ноцицептивных нейронов и образуемых ими генераторов и в ликвидации патологической алгической системы, лежащей в основе болевого синдрома.
Эта цель достигается сочетанием двух воздействий: 1) влиянием на неспецифические, стандартные базисные процессы гиперактивации нейронов, образования и деятельности генератора, которые принципиально одинаковы в разных отделах ЦНС; 2) влиянием на специфические нейрохимические процессы, с которыми связана деятельность ноцицептивных нейронов, генераторов и разных ноцицептивных патологических систем (патологической алгической системы).
Коррекция базисных процессов гиперактивации нейронов и образования генератора может быть осуществлена с помощью антиконвульсантов (антиэпилептических средств). Так, высокий лечебный эффект дает использование антиэпилептического препарата карбамазепина (тегретол, финлепсин) для лечения тригеминальной невралгии и других болевых синдромов, особенно острого пароксизмального характера. Подавляют некоторые болевые синдромы и другие антиконвульсанты.
Первостепенное значение для подавления гиперактивности ноцицептивных нейронов имеет блокада поступления в них Са2+, которая осуществляется с помощью Са2+-антагонистов.
Поскольку ноцицептивные и антиноцицептивные эффекты реализуются на разных уровнях и притом не одним, а несколькими медиаторами, целесообразно применение комплексной патогенетической терапии в виде сочетанного влияния на разные звенья патологической алгической системы с целью ее подавления и антиноцицептивной системы с целью ее активации. Кроме того, важно также воздействовать на психоэмоциональные, сосудистые и другие вегетативные и тканевые компоненты патологической боли. Необходимо ликвидировать действие этиологического фактора, поддерживающего патологические изменения в ноцицептивной системе.