Патофизиология Новицкого, Е.Д. Гольдберга Тома 1 и 2 - 2009 г.
|
|
|
|
ГЛАВА 8 АЛЛЕРГИЯ. АУТОИММУННЫЕ РАССТРОЙСТВА
8.1. АЛЛЕРГИЯ
Аллергия (от греч. alios - иной, ergon - действую) - это типовой иммунопатологический процесс, развивающийся при контакте с антигеном (гаптеном) и сопровождающийся повреждением структуры и функции собственных клеток, тканей и органов. Вещества, вызывающие аллергию, называют аллергенами.
Понятие «аллергия» было предложено в 1906 г. австрийским патологом и педиатром Клеменсом Пирке для определения состояния измененной реактивности, которое он наблюдал у детей при сывороточной болезни и инфекционных заболеваниях. Говоря об аллергическом состоянии организма, его часто отождествляют с терминами «гиперчувствительность», «повышенная чувствительность», подразумевая способность организма болезненно реагировать на безвредные для большинства индивидов вещества (пыльца трав и деревьев, цитрусовые и др.). В 1923 г. А. Кока и Р. Кук ввели термин «атопия» (от греч. atopos - необычный). В современном понимании аллергия включает в себя практически все иммунологически опосредованные реакции повышенной чувствительности (реакции I, II, III, IV типов), в то время как к атопии относят клинические формы аллергических реакций только реагинового типа, которые возникают у людей, имеющих семейную предрасположенность к данной патологии. Таким образом, когда используют термин «атопия», то имеют в виду семейную склонность к сенсибилизации естественными (чаще ингаляционными) аллергенами.
Основу аллергии составляет сенсибилизация (или иммунизация) - процесс приобретения организмом повышенной чувствительности к тому или иному аллергену. Иными словами, сенсибилиза-
ция - это процесс выработки аллергенспецифических антител или лимфоцитов. Различают сенсибилизацию пассивную и активную1.
Однако сама по себе сенсибилизация (иммунизация) заболевания не вызывает - лишь повторный контакт с тем же аллергеном может привести к повреждающему эффекту.
Таким образом, аллергия - это качественно измененная (патологическая) форма иммунологической реактивности организма. При этом аллергия и иммунитет имеют общие свойства:
1. Аллергия, как и иммунитет, является формой видовой реактивности, которая способствует сохранению вида, хотя для отдельного индивида она имеет не только положительное, но и отрицательное значение, поскольку может вызвать развитие заболевания или (в ряде случаев) гибель.
2. Аллергия, так же как иммунитет, носит защитный характер. Суть этой защиты - локализация, инактивация и элиминация антигена (аллергена).
3. В основе аллергии лежат иммунные механизмы развития - реакция «антиген-антитело» (АГ+АТ) или «антигенсенсибилизированный лимфоцит» («АГ+ сенсибилизированный лимфоцит»).
Аллергические заболевания занимают важное место среди болезней, характеризующих картину современной патологии. В большинстве стран мира отмечается неуклонный рост числа аллергических заболеваний, значительно превышающий в ряде случаев заболеваемость злокачественными опухолями и сердечнососудистыми заболеваниями. Аллергия в наши дни становится, по существу, национальным бедствием для многих стран мира.
Высокий уровень заболеваемости аллергией - обратная сторона прогресса, своего рода «плата за цивилизацию». Загрязнение биосферы токсичными, раздражающими и сенсибилизирующими веществами, стресс, выраженная химизация условий труда и быта, злоупотребление фармакологическими средствами способствуют постоянному напряжению гомеостатических механизмов с вовлечением резервных возможностей организма, создают почву для
1 Пассивная сенсибилизация развивается у неиммунизированного реципиента при введении готовых антител (сыворотки) или лимфоидных клеток (при пересадке лимфоидной ткани) от активно сенсибилизированного донора. Активная сенсибилизация развивается при поступлении аллергена в организм в связи с образованием антител и иммунокомпетентных лимфоцитов при активации его собственной иммунной системы.
срыва адаптации, развития различных заболеваний, в том числе и аллергических.
К факторам внешней среды, вызывающим массовую аллергизацию населения в современных условиях, относятся:
1. Массовая вакцинация населения против многих инфекционных заболеваний (корь, дифтерия, коклюш и т.д.). Известно, что коклюшная вакцина повышает чувствительность тканей к гистамину, вызывает блокаду β-адренергических рецепторов в бронхиальной ткани, играет роль адъюванта для синтеза аллергических антител.
2. Расширение практики парентерального введения в лечебных целях сывороток, не проходящих инактивацию и обезвреживание в желудочно-кишечном тракте.
3. Широкая миграция населения в географические зоны, не свойственные для данной нации или расы (например, частота бронхиальной астмы у канадских эскимосов значительно ниже, чем у проживающего в тех же регионах белого населения).
4. Увеличивающееся с каждым годом распространение простых и сложных химических веществ, потенциальных аллергенов, окружающих человека (лекарства, препараты бытовой химии, пестициды и гербициды в сельском хозяйстве и др.).
5. Ухудшение экологической ситуации и загрязнение окружающей среды (воздуха, воды) химическими соединениями, изменяющими специфичность существующих аллергенов.
Считается, что в среднем аллергические заболевания охватывают около 10% населения земного шара.
8.1.1. Механизмы перехода защитной иммунной реакции в аллергическую (реакцию повреждения)
Не всегда ясно, каким образом наследственная предрасположенность к аллергии реализуется в болезнь. Существенными являются следующие механизмы:
1. Повышенная проницаемость кожных, слизистых и гистогематических барьеров, ведущая к проникновению в организм антигенов, которые в обычных условиях либо не поступают, либо поступают ограниченно. Эти нарушения могут быть как отражением генетической предрасположенности, так и следствием воспалительных процессов в кишечнике или дыхательных путях.
2. Особенности иммунного ответа, которые характеризуются дисфункцией иммунокомпетентных клеток, нарушением количества образующихся антител, дисбалансом разных классов иммуноглобулинов.
3. Изменение образования и соотношения различных медиаторов иммунного ответа, способствующее развитию воспаления (у больных аллергией повышен уровень секреции и высвобождения провоспалительных медиаторов по сравнению со здоровыми людьми, а продукция противовоспалительных медиаторов снижена).
4. Повышенная чувствительность периферических тканей к медиаторам аллергии.
5. Нарушение фагоцитоза.
8.1.2. Критерии аллергического состояния
Условно можно выделить 4 группы критериев: генетические, иммунологические, функциональные и специфические (аллергологические).
1. Генетические критерии. Давно известно, что предрасположенность к аллергическим заболеваниям (особенно атопическим) может передаваться по наследству. Так, при отеке Квинке у родителей данное заболевание у детей имеет место в 50% случаев. Показатель частоты случаев семейного аллергического ринита колеблется от 30 до 80%. Анализ родословных позволяет оценить степень риска аллергического заболевания. Так, у больных бронхиальной астмой выявляют наследственную предрасположенность к аллергическим заболеваниям в 55,3% случаев. Этот риск значительно возрастает при наличии аллергических заболеваний у родственников больного по восходящей, нисходящей и боковой линиям, достигая 80%.
В последние годы все более широкий масштаб приобретает проблема изучения генетических маркеров - факторов риска возникновения аллергического заболевания. В частности, проводятся исследования по изучению антигенов системы гистосовместимости (система HLA-антигенов). Так, антигены HLA-B13, HLA-Bw21, HLA-Bw35 достоверно чаще встречаются у больных бронхиальной астмой, повышая вероятность ее возникновения.
2. Иммунологические критерии. Иммунный статус человека - это совокупность лабораторных показателей, характеризующих количественную и функциональную активность клеток иммунной системы.
В последнее время в иммунологической практике довольно широкое применение нашло определение маркерного состава лимфоцитов с использованием моноклональной технологии. Изучение поверхностных антигенов лимфоцитов обнаруживает снижение содержания в крови аллергических больных регуляторных CD4+ T-лимфоцитов (Т-хелперов - Th) и цитотоксических CD8+ Т-клеток.
Наряду с этим известно, что у большинства людей с аллергическими заболеваниями отмечается повышенная концентрация иммуноглобулина (Ig) E в сыворотке крови. В связи с этим определение концентрации в крови общего IgE позволяет своевременно выделить группу риска того или иного аллергического заболевания и может служить решающим критерием состояния аллергии. Уровень IgE выше 20 МЕ/мл у ребенка расценивается как признак возможного атопического заболевания во взрослом состоянии. Важным критерием оценки аллергопатологического состояния является соотношение специфического и общего уровня IgE. Этот показатель указывает на наличие сенсибилизации.
3. Функциональные критерии. К предрасполагающим факторам, способным под влиянием внешней среды привести к развитию аллергического заболевания, относят врожденные и приобретенные функциональные дефекты: снижение активности β-адренорецепторов при атопии, повышение чувствительности бронхов к биологически активным веществам (гистамину, ацетилхолину), способствующее развитию бронхиальной астмы. Так, исследование проб с ингаляцией ацетилхолина и других симпатомиметиков у лиц с признаками угрозы возникновения бронхиальной астмы выявляет измененную реактивность бронхов более чем у 50% и скрытый бронхоспазм - у 77% обследованных.
Другим не менее значимым признаком аллергопатологии является гистаминопектическая активность сыворотки - способность связывать свободный гистамин (гистаминопексия). В норме гистаминопектическая активность сыворотки составляет 10-24 мкг/мл. При аллергии этот показатель существенно снижен или полностью отсутствует.
4. Специфические (аллергологические) критерии. Учет приведенных критериев позволяет прогнозировать возможность развития состояния сенсибилизации у обследуемого, подтверждает аллергическую природу процесса, однако основным критерием, дающим информацию об этиологии аллергического заболевания в каждом
конкретном случае, служит реакция АГ+АТ, положенная в основу аллергологических тестов - тестов специфической диагностики аллергических заболеваний.
Для выявления аллергопатологии используется комплекс методов, включающий кожные и элиминационные пробы, аллергологические тесты in vitro (радиоаллергосорбентный тест, тест Шелли, реакция дегрануляции тучных клеток, исследования на изолированных органах и др.).
Кожные тесты являются идентификаторами не только клинически выраженной аллергии, но и субклинических (скрытых) ее форм, т.е. показателем латентной сенсибилизации.
Важным и наиболее постоянным критерием аллергопатологии является выявление эозинофилии, которая свидетельствует в большинстве случаев о сенсибилизации организма. Однако необходимо учитывать, что содержание эозинофилов может меняться и в связи с другими причинами (злокачественные опухоли, болезни крови, паразитарные инвазии).
8.1.3. Этиология аллергических реакций и заболеваний
Вещества, вызывающие аллергическую реакцию, получили название аллергены. Они могут быть антигенами с многочисленными антигенными детерминантами и биологически активными веществами, представляющими смесь антигенов (пыльца трав, частицы эпидермиса). Аллергены обладают чужеродностью и часто - макромолекулярностью, хотя низкомолекулярные неполные антигены (гаптены) также могут обладать аллергенными свойствами, становясь антигенами только после соединения с белками тканей организма (метаболиты лекарств, простые химические вещества - йод, бром, хром, никель). При этом образуются так называемые комплексные (или конъюгированные) антигены, специфичность которых определяется специфичностью гаптена. По химической структуре аллергены являются белками, белково-полисахаридными комплексами (сывороточные, тканевые, бактериальные аллергены), могут быть полисахаридами или соединениями полисахаридов с липоидами (аллерген домашней пыли, бактериальные аллергены).
По происхождению аллергены подразделяются на эндо- и экзоаллергены.
Эндоаллергены - это собственные белки организма. Эндоаллергены подразделяются на естественные (первичные) и приобретенные.
К естественным (или врожденным) эндоаллергенам относятся антигены тканей, в норме изолированных от воздействия иммунной системы: хрусталика, нервной ткани, коллоида щитовидной железы, мужских и женских половых желез. Они могут оказаться в контакте с иммунной системой при повреждении барьерных тканей. В этом случае они воспринимаются как чужеродные и вызывают аллергию. Приобретенные (вторичные) эндоаллергены образуются из собственных нормальных белков организма, приобретающих свойства чужеродности в результате повреждения их структуры различными факторами внешней среды инфекционной и неинфекционной (холодовые, ожоговые, лучевые и т.д.) природы:.
Экзоаллергены - это аллергены, проникающие в организм из окружающей среды. По происхождению они подразделяются на инфекционные и неинфекционные. К инфекционным экзоаллергенам относятся микроорганизмы (вирусы, бактерии, грибки, паразиты) и продукты их жизнедеятельности, а к неинфекционным экзоаллергенам - бытовые, лекарственные, эпидермальные, пыльцевые и пищевые (животного и растительного происхождения).
В зависимости от пути проникновения в организм различают экзоаллергены:
• респираторные (пыльца, пыль, аэрозоли и т.д.);
• алиментарные (пищевые аллергены);
• контактные (к ним относятся низкомолекулярные вещества, способные проникать в организм через кожу и слизистые оболочки. Это медикаментозные мази, косметические кремы, красители, смолы и др.);
• парентеральные (лекарственные препараты и яды насекомых - пчел, комаров и др.);
• трансплацентарные (некоторые антибиотики, белковые препараты и др.).
Наиболее частыми этиологическими факторами, приводящими к развитию аллергии, являются:
1. Инфекционные агенты, из которых наиболее активны грибковые аллергены, менее активны - бактериальные, вирусные, паразитарные аллергены. Следует подчеркнуть, что структурные элементы бактерий очень часто могут действовать как адъюванты -
вещества, усиливающие иммунный ответ при введении с антигеном или гаптеном (например, при вакцинации), сенсибилизируя организм.
При этом инфекция, вызывая воспаление, приводит к повышению проницаемости слизистых оболочек и кожи, что, в свою очередь, способствует проникновению в организм других аллергенов и развитию полисенсибилизации.
2. Пыльца растений. Значительное место в общей аллергической заболеваемости занимают поллинозы (сезонный ринит, риноконъюнктивит) - аллергические заболевания, вызываемые пыльцой растений. В разных регионах России поллинозами страдает от 1 до 5% населения. На сенсибилизацию населения к пыльце в значительной мере влияют региональные особенности: распространенность тех или иных растений, степень агрессивности (аллергенности) пыльцы этих растений. Так, наибольшей аллергоопасностью в средней полосе России обладают береза, тимофеевка, мятлик, ежа сборная, овсяница луговая, полынь. В Краснодарском, Ставропольском краях основным растительным аллергеном является сорная трава - амброзия.
3. Домашняя пыль. От 4 до 15% населения страдает аллергией к домашней пыли. Состав домашней пыли весьма сложен: это и остатки органических веществ (шерсть, шелк, перхоть, перья, пыльца растений), и отходы пластмасс, синтетических тканей, различные виды грибов, бактерий и др. Однако главным аллергизирующим фактором домашней пыли являются микроскопические клещи семейства Dermatophagoides, которые и определяют ее аллергенную активность.
Важными факторами, влияющими на распространение клещей, являются температура воздуха и влажность. Поэтому более высокая сенсибилизация к клещам отмечается в регионах с влажным и теплым (среднегодовым) климатом.
4. Яды кровососущих насекомых. Сложной экологической обстановкой характеризуются такие регионы России, как Сибирь и Дальний Восток. Суровая длительная зима, вечная мерзлота, перепады температур (суточные и сезонные) - все это создает условия, способствующие размножению в колоссальных количествах кровососущих насекомых (москиты, мошки, комары и т.д.). Аллергия к ядам кровососущих насекомых вызывает тяжелые аллергические реакции в виде генерализованной экссудативной крапивницы, отека Квинке, лихорадки.
5. Химические вещества, металлы. Неуклонный рост химического производства, внедрение химии в быт увеличивают вероятность контакта с химическими веществами, обладающими сенсибилизирующими свойствами, и рост профессиональной аллергии, вызванной воздействием химических соединений. К наиболее распространенным химическим аллергенам относятся скипидар, эпоксидные смолы, красители, лаки и др. Воздействию металловаллергенов подвергаются значительные контингенты рабочих горнорудной и металлургической промышленности, жители крупных промышленных регионов. Воздействие таких металлов, как хром, никель, кобальт, марганец (электросварка, литейное, горнорудное производство), приводит к развитию аллергических дерматозов, к аллергическим заболеваниям органов дыхания. Одним из эффектов биологического действия бериллия, платины, палладия является сенсибилизация организма.
6. Лекарственные препараты. Особое значение в последние годы приобретает проблема лекарственной аллергии. Связано это с увеличением производства и внедрением в медицинскую практику высокоактивных, длительно действующих (адъювантных) лекарственных препаратов.
Возможность возникновения аллергического заболевания у конкретного индивидуума определяется характером, свойствами и количеством (при первом и повторном контактах) антигена, путем его поступления в организм, а также особенностями реактивности организма. Аллерген служит лишь провокатором, запускающей причиной аллергии, развитие (или отсутствие развития) которой определяется состоянием иммунной системы и индивидуальной реакцией организма на конкретный антиген. Так, у многих людей, получивших пенициллин, обнаруживаются антитела различных классов иммуноглобулинов к этому антибиотику, однако аллергические реакции на него развиваются только в ряде случаев.
8.1.4. Классификация аллергических реакций
С первых шагов изучения аллергии у человека (начиная с 1906 г.) делались попытки создать ее классификацию.
Долгое время существовала классификация, предложенная в 1930 г. Куком, согласно которой аллергические реакции разделяли на 2 большие группы:
1. Аллергические реакции (гиперчувствительность) немедленного типа.
2. Аллергические реакции (гиперчувствительность) замедленного типа.
В основу классификации положено время появления реакции после контакта с аллергеном: реакции немедленного типа развиваются через 15-20 мин, замедленного типа - через 24-48 ч.
Эта классификация, разработанная в клинике, не охватывала всего разнообразия проявлений аллергии, в связи с чем возникла необходимость классифицировать аллергические реакции с учетом особенностей их патогенеза.
Первую попытку разделить аллергические реакции с учетом особенностей их патогенеза предпринял А.Д. Адо (1963). Он разделил эти реакции по патогенезу на 2 группы:
1. Истинные аллергические реакции.
2. Ложные аллергические реакции (псевдоаллергические).
При истинных аллергических реакциях развивается повышенная чувствительность (сенсибилизация) к впервые попавшему в организм аллергену. При повторном воздействии (на уже сенсибилизированный организм) аллерген соединяется с образовавшимися антителами или лимфоцитами.
Ложные аллергические реакции возникают при первом контакте с аллергеном без предшествующей сенсибилизации. По внешним проявлениям они лишь напоминают аллергические, но не имеют основного, ведущего (иммунологического) механизма, характерного для истинных аллергических болезней (продукция антител, сенсибилизированных лимфоцитов).
В настоящее время разделение аллергических реакций основывается на классификации реакций гиперчувствительности по P.G.H. Gell и P.R.A. Coombs (см. главу 7), согласно которой выделяют аллергические реакции, развивающиеся по I (реагиновому, анафилактическому), II (цитотоксическому), III (иммунокомплексному) и IV (клеточно-опосредованному) типам иммунного повреждения.
При многих аллергических заболеваниях возможно одновременное развитие реакций гиперчувствительности нескольких типов. Установление ведущего из них важно для патогенетически обоснованной терапии. Например, при анафилактическом шоке участвуют механизмы I и III типов, при лекарственной аллергии - реакции I, II и III типов иммунного повреждения.
Аллергия у человека имеет чрезвычайно многообразные проявления: бронхиальная астма1, поллиноз2, крапивница, отек Квинке 3, атопический дерматит4, анафилактический шок5, сывороточная
1 Бронхиальная астма - хроническое рецидивирующее заболевание, в основе которого лежит IgE-зависимое воспаление дыхательных путей при действии аллергенов (пищевых, промышленных, лекарственных, эпидермальных, домашней пыли, пыльцы растений, антигенов клещей и др.), проявляющееся гиперреактивностью бронхов, обратимым сужением их просвета, хрипами в легких, кашлем, одышкой и приступами удушья.
2 Поллиноз (от лат. pollen - пыльца, устар. - сенная лихорадка) - аллергическое (IgE-зависимое) заболевание, развивающееся при контактах с пыльцой растений, характеризующееся острым воспалением слизистых оболочек дыхательных путей, глаз и кожи.
3 Крапивница - группа заболеваний, характеризующаяся воспалительными изменениями кожи и/или слизистых оболочек, появлением диффузной либо ограниченной сыпи в виде зудящих папул и волдырей различных размеров с выраженной зоной эритемы. Выделяют анафилактическую (IgE-опосредованную - в ответ на продукты питания, лекарственные средства, яды насекомых) и анафилактоидную (псевдоаллергическую - в ответ на гистаминсодержащие и гистаминвысвобождающие продукты питания, лекарственные, рентгеноконтрастные вещества, анестетики, предметы бытовой химии, действие ультрафиолетового излучения, высокой или низкой температуры, воды, в местах давления одежды, при физической нагрузке, эмоциональном перенапряжении) формы болезни.
Отек Квинке отличается от крапивницы вовлечением в патологический процесс подкожной клетчатки.
4 Атопический дерматит - хроническое рецидивирующее аллергическое (IgE- зависимое) воспаление кожи, сопровождающееся повышенной ее реактивностью (к бытовым, эпидермальным, грибковым, пыльцевым, пищевым аллергенам) и морфологическими изменениями (при обострении - эритема, отек, папулезновезикулярные высыпания, экссудация; в период ремиссии - сухость, шелушение, экскориация, лихенификация).
5 Анафилактический шок - острая (внезапная) системная аллергическая реакция, опосредованная IgE, наиболее часто развивающаяся при введении пенициллина и др. антибиотиков, сульфаниламидов, витаминов, лечебных сывороток, вакцин, рентгеноконтрастных средств и т.д., а также после укусов насекомых. Характеризуется падением артериального давления, изменениями кожи (гиперемия, высыпания, зуд), выраженным бронхоспазмом и отеком гортани с признаками удушья. Отек слизистой и спазм гладких мышц желудочно-кишечного тракта сопровождаются дисфагией, спастическими болями в животе, диареей, рвотой. Возможны коллапс с потерей сознания, остановка дыхания, судороги, непроизвольное мочеиспускание. Причинами смертельного исхода являются бронхоспазм, острая сердечно-сосудистая недостаточность и отек головного мозга.
болезнь1, поствакцинальные аллергические осложнения (лихорадка, гиперемия, отек, сыпь, феномен Артюса2).
Наряду с самостоятельными, чисто аллергическими заболеваниями, существуют заболевания (главным образом, инфекционные), где реакции гиперчувствительности участвуют как сопутствующие или вторичные механизмы: туберкулез, бруцеллез, лепра, скарлатина и ряд других.
8.1.5. Общий патогенез аллергических реакций
Независимо от того, к какому типу повреждения относится аллергическая реакция, в ее развитии можно выделить три стадии.
I. Стадия иммунных реакций (иммунологическая). Начинается с первого контакта организма с аллергеном и заключается в образовании в организме аллергических антител (или сенсибилизированных лимфоцитов) и их накоплении. В результате организм становится сенсибилизированным или повышенно чувствительным к специфическому аллергену. При повторном попадании в организм специфического аллергена происходит его комплексирование с антителами (с образованием комплекса АГ+АТ) или сенсибилизированными лимфоцитами (с образованием комплекса «АГ+сенсибилизированный лимфоцит»), которые и обусловливают следующую стадию аллергической реакции.
II. Стадия биохимических реакций (патохимическая). Суть ее состоит в выделении готовых и образовании новых биологически активных веществ (медиаторов аллергии) в результате сложных биохимических процессов, запускаемых комплексами АГ+АТ или «АГ+сенсибилизированный лимфоцит».
1 Сывороточная болезнь - иммунокомплексное аллергическое заболевание, возникающее при парентеральном введении с лечебной или профилактической целью сывороток или их препаратов, содержащих большое количество белка. Оно характеризуется образованием комплексов АГ+АТ, которые откладываются в эндотелии кровеносных сосудов и тканях. Проявляется лихорадкой, болью в суставах, эритемой и увеличением лимфатических узлов. Имеется взаимосвязь между количеством введенной сыворотки и тяжестью болезни.
2 Феномен Артюса - местная гиперергическая воспалительная реакция с некрозом тканей, опосредованная IgG-антителами и образованием комплексов АГ+АТ, преципитирующих в сосудистой стенке и тканях. Может возникать как осложнение при введении различных сывороток, вакцин и лекарственных препаратов (например, антибиотиков).
III. Стадия клинических проявлений (патофизиологическая).
Представляет собой ответную реакцию клеток, органов и тканей организма на образовавшиеся в предыдущей стадии медиаторы.
8.1.6. Аллергические реакции, развивающиеся по I типу гиперчувствительности
Аллергические реакции, формирующиеся по I типу иммунного повреждения, называют атопическими (реагиновыми, анафилактическими). Их развитие характеризуется следующими особенностями:
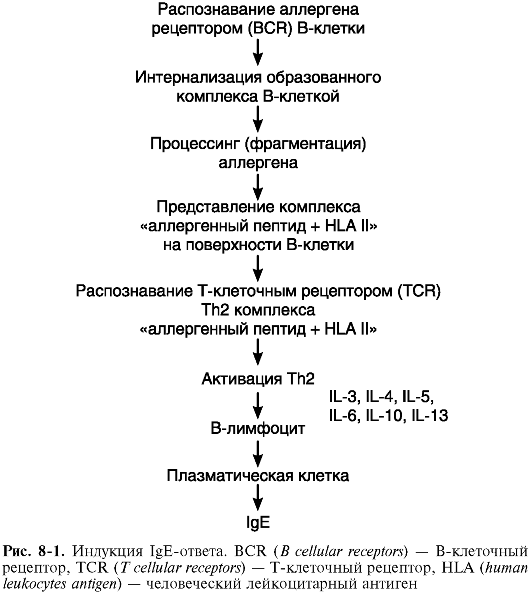
I. Стадия иммунных реакций. В норме человеческий организм толерантен к аллергенам окружающей среды. У лиц с наличием определенных молекулярных аномалий иммунной системы (в частности, при наличии очень высокой экспрессии специфических рецепторов (FceRI) на тучных клетках и базофилах крови, что определяется геном на 11-й хромосоме) при избыточном поступлении ряда веществ в организм развивается активный иммунный ответ - (сенсибилизация) к аллергенам. Этот вариант ответа является Тh2- зависимым, регулируется интерлейкином (IL) 4, IL-13, другими цитокинами и заканчивается образованием плазматических клеток, синтезирующих IgE и IgG4 (рис. 8-1). В ходе сенсибилизации происходит взаимодействие следующих клеток: дендритных (обеспечивают эндоцитоз аллергена, его процессинг и презентацию в комплексе с HLA II), Т-лимфоцитов-хелперов 2-го типа (вырабатывают цитокины соответствующего профиля, которые нужны для регуляции) и В-лимфоцитов (они сами могут выступать в качестве антигенпредставляющих, но главное - они дифференцируются в плазматические клетки-антителопродуценты и В-клетки памяти) (рис. 8-2). В-клетки памяти при повторном поступлении в организм причинно-значимого аллергена обеспечивают экспрессный (в течение 10-20 мин) ответ на него, что соответствует следующим стадиям патологического процесса. Течение сенсибилизации регулируется не только цитокинами профиля Тh2, но и соответствующими костимулирующими молекулами (CTLA-4, CD3OL, CD4OL, OX40 и др.). Второй тип рецепторов IgE - низкоспецифический FceRII (CD23) - экспрессируется на В-лимфоцитах, эозинофилах, макрофагах и тромбоцитах, обеспечивает проявления IgE-опосредованной цитотоксичности по отношению к паразитам, регуляцию синтеза IgE и ряд других функций.
 IgE
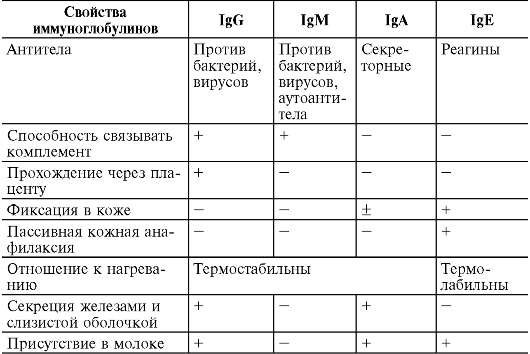
значительно отличаются по своим свойствам от других антител (см. табл.
8-1). Прежде всего, они обладают цитотропностью (цитофильностью), что
определяет трудность их обнаружения, так как они не участвуют в
серологических реакциях. Считается, что присущее IgE свойство
прикрепляться к клеткам и фиксироваться в тканях связано с
приобретенными в филогенезе дополнительными 110 аминокислотами на
Fс-фрагменте молекулы. Концентра-
IgE
значительно отличаются по своим свойствам от других антител (см. табл.
8-1). Прежде всего, они обладают цитотропностью (цитофильностью), что
определяет трудность их обнаружения, так как они не участвуют в
серологических реакциях. Считается, что присущее IgE свойство
прикрепляться к клеткам и фиксироваться в тканях связано с
приобретенными в филогенезе дополнительными 110 аминокислотами на
Fс-фрагменте молекулы. Концентра-
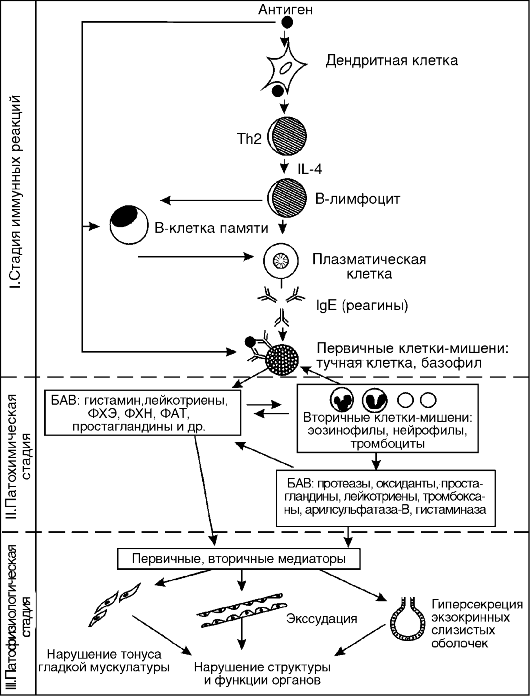 Рис. 8-2. Патогенез аллергических реакций I (реагинового, анафилактического) типа
Рис. 8-2. Патогенез аллергических реакций I (реагинового, анафилактического) типа
Таблица 8-1. Биологические свойства иммуноглобулинов
 Примечание. «+» - наличие; «±» - слабая выраженность, «-» - отсутствие свойства
Примечание. «+» - наличие; «±» - слабая выраженность, «-» - отсутствие свойства
ция IgE в сыворотке крови потому и низка, что синтезируемые в региональных лимфоузлах молекулы IgE в меньшей степени попадают в кровоток, так как в основном фиксируются в окружающих тканях. Разрушение или инактивация этого участка Fс-фрагмента нагреванием (до 56 °С) приводит к потере цитотропных свойств этих антител, т.е. они термолабильны.
Фиксация антител клетками происходит при помощи рецептора, встроенного в мембрану клеток. Самой высокой способностью связывать IgE-антитела обладают рецепторы для IgE, найденные на тучных клетках и базофилах крови, поэтому эти клетки получили название клетки-мишени I порядка. На одном базофиле может фиксироваться от 3000 до 300 000 молекул IgE. Рецептор для IgE обнаружен также на макрофагах, моноцитах, эозинофилах, тромбоцитах и лимфоцитах, однако их связывающая способность ниже. Эти клетки получили название клетки-мишени II порядка (рис. 8-3).
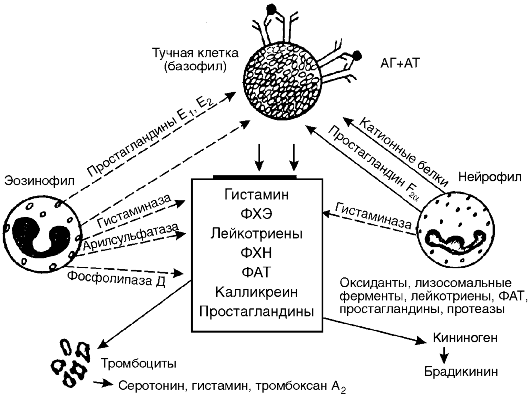 Рис. 8-3. Кооперация
клеток-мишеней и взаимодействие медиаторов аллергических реакций I
типа. ФХЭ - фактор хемотаксиса эозинофилов, ФХН - фактор хемотаксиса
нейтрофилов, ФАТ - фактор активации тромбоцитов
Рис. 8-3. Кооперация
клеток-мишеней и взаимодействие медиаторов аллергических реакций I
типа. ФХЭ - фактор хемотаксиса эозинофилов, ФХН - фактор хемотаксиса
нейтрофилов, ФАТ - фактор активации тромбоцитов
Связывание IgE на клетках - зависимый от времени процесс. Оптимальная сенсибилизация может наступить через 24-48 ч.
Итак, первичное попадание аллергена в организм через кооперацию дендритных клеток, Т- и В-лимфоцитов запускает сложные механизмы синтеза IgE, фиксирующихся на клетках-мишенях. Повторный контакт организма с этим аллергеном приводит к образованию комплекса АГ+АТ, связанного с поверхностью клеткимишени посредством молекул IgE. При этом условием, достаточным для активации и дегрануляции клеток-мишеней, является связывание аллергена по крайней мере с двумя соседними молекулами IgE. Начинается II стадия аллергической реакции.
II. Стадия биохимических реакций. В этой стадии основную роль играют тучные клетки и базофилы крови, т.е. клетки-мишени I порядка. Тучные клетки (тканевые базофилы) - это клетки соеди-
нительной ткани. Они обнаруживаются преимущественно в коже, дыхательных путях, по ходу кровеносных сосудов и нервных волокон. Тучные клетки имеют большие размеры (10-30 мкм) и содержат гранулы диаметром 0,2-0,5 мкм, окруженные перигранулярной мембраной. Гранулы тучных клеток и базофилов крови содержат медиаторы: гистамин, гепарин, фактор хемотаксиса эозинофилов (ФХЭ), фактор хемотаксиса нейтрофилов (ФХН) (табл. 8-2).
Таблица 8-2. Медиаторы аллергических реакций I типа

 Образование
комплекса АГА+Т, фиксированного на поверхности тучной клетки (или
базофила крови), приводит к стягиванию белков-рецепторов для IgE, клетка
активируется и секретирует медиаторы. Максимальная активация клетки
достигается связыванием нескольких сотен и даже тысяч рецепторов.
Образование
комплекса АГА+Т, фиксированного на поверхности тучной клетки (или
базофила крови), приводит к стягиванию белков-рецепторов для IgE, клетка
активируется и секретирует медиаторы. Максимальная активация клетки
достигается связыванием нескольких сотен и даже тысяч рецепторов.
В результате присоединения аллергена рецепторы приобретают энзиматическую активность и запускается каскад биохимических реакций. Активируются мембраносвязанные ферменты - фосфолипаза С и аденилатциклаза, катализирующие реакции с образованием соответственно инозитол-1,4,5-трифосфата, 1,2- диацижлицерина и цАМФ. Инозитол-1,4,5-трифосфат и цАМФ обеспечивают фосфорилирование и активацию Са2+-связывающего белка кальмодулина, мобилизующего Са2+ из эндоплазматического ретикулума клеток в цитоплазму, в присутствии которого при участии цАМФ и 1,2-диацилглицерина активируется протеинкиназа С. Протеинкиназа С осуществляет фосфорилирование и активацию ряда других внутриклеточных ферментов, в частности Са2+-зависимой фосфолипазы А2. При этом за счет Са2+- индуцированного сокращения микротрубочек гранулы «подтягиваются» к плазматической мембране, а 1,2-диацилглицерин, продукты его расщепления (моноацилглицерин, лизофосфатидиловая кислота) и активации фосфолипазы А2 (лизофосфатидилхолин) обусловливают слияние депонирующих гранул тучной клетки (или базофила крови) со стенкой мембраносвязанных канальцев и цитоплазматической мембраной, через которые медиаторы гранул (первичные) и медиаторы, образующиеся при активации клеток (вторичные; см. табл. 8-2), высвобождаются наружу. Источником
вновь образующихся медиаторов в клетках-мишенях являются продукты распада липидов: фактор активации тромбоцитов (ФАТ), простагландины, тромбоксаны и лейкотриены.
Следует отметить, что при псевдоаллергических реакциях (см. раздел 8.2) дегрануляция тучных клеток и базофилов может происходить и под влиянием неиммунологических активаторов, т.е. быть IgE-независимой.
В результате выделения из тучных клеток и базофилов факторов хемотаксиса нейтрофилов и эозинофилов последние скапливаются вокруг клеток-мишеней I порядка. Нейтрофилы и эозинофилы активируются и тоже высвобождают биологически активные вещества и ферменты. Часть из них являются также медиаторами повреждения (например, ФАТ, лейкотриены и др.), а часть (гистаминаза, арилсульфатаза, фосфолипаза D и др.) - ферментами, разрушающими определенные медиаторы повреждения. Так, арилсульфатаза эозинофилов вызывает разрушение лейкотриенов, гистаминаза - разрушение гистамина. Образующиеся простагландины группы E снижают высвобождение медиаторов из тучных клеток и базофилов.
III. Стадия клинических проявлений. В результате действия медиаторов повышается проницаемость сосудов микроциркуляторного русла, что сопровождается развитием отека и серозного воспаления. При локализации процесса на слизистых оболочках возникает гиперсекреция. В органах дыхания развивается бронхоспазм, который, наряду с отеком стенки бронхиол и гиперсекрецией мокроты, обусловливает резкое затруднение дыхания. Все эти эффекты клинически проявляются в виде приступов бронхиальной астмы, ринита, конъюнктивита, крапивницы (гиперемия и волдыри), кожного зуда, местного отека, диареи и др. В связи с тем что одним из медиаторов является ФХЭ, очень часто I тип аллергии сопровождается увеличением количества эозинофилов в крови, мокроте, серозном экссудате.
В развитии аллергических реакций I типа выделяют раннюю и позднюю стадии. Ранняя стадия появляется в течение первых 10-20 мин в виде характерных волдырей. В ней преобладает влияние первичных медиаторов, выделяемых тучными клетками и базофилами.
Поздняя стадия аллергической реакции развивается через 2-6 ч после контакта с аллергеном и в основном связана с действием вторичных медиаторов. Она характеризуется отеком, краснотой,
уплотнением кожи, которое формируется в течение 24-48 ч с последующим образованием петехий. Морфологически поздняя стадия характеризуется наличием дегранулированных тучных клеток, периваскулярной инфильтрации эозинофилами, нейтрофилами, лимфоцитами. Окончанию стадии клинических проявлений способствуют следующие обстоятельства:
а) в ходе стадии III удаляется повреждающее начало - аллерген. Активируется цитотоксическое действие макрофагов, стимулируется выделение энзимов, супероксидного радикала и других медиаторов, что очень важно для защиты против гельминтов;
б) благодаря в первую очередь ферментам эозинофилов устраняются повреждающие медиаторы аллергической реакции.
8.1.7. Аллергические реакции, развивающиеся по II (цитотоксическому) типу гиперчувствительности
Причиной цитотоксических реакций является возникновение в организме клеток с измененными компонентами цитоплазматической мембраны. Цитотоксический тип иммунного реагирования играет важную роль в иммунном ответе, когда в качестве антигена выступают микробы, простейшие, опухолевые или отработавшие свой срок клетки организма. Однако в условиях, когда нормальные клетки организма под влиянием повреждающего воздействия приобретают аутоантигенность, этот защитный механизм становится патогенным и реакция из иммунной переходит в аллергическую. Образующиеся к антигенам клеток аутоантитела соединяются с ними и вызывают их повреждение и лизис (цитолитическое действие).
Большую роль в процессе приобретения клетками аутоаллергенных свойств играет действие на них различных химических веществ (чаще лекарственных препаратов), лизосомальных ферментов фагоцитирующих клеток, бактериальных энзимов, вирусов. Они могут изменять антигенную структуру цитоплазматических мембран за счет конформационных превращений, присущих клетке антигенов, появления новых антигенов, образования комплексов с белками мембраны (в случае, когда аллерген является гаптеном). По одному из указанных механизмов может развиваться аутоиммунная гемолитическая анемия, тромбоцитопении, лейкопении и др. Цитотоксический механизм включается также при попадании в организм гомологичных антигенов, например, при
переливании крови в виде аллергических гемотрансфузионных реакций (на многократное переливание крови), при гемолитической болезни новорожденных.
В создание учения о цитотоксинах значительный вклад внесли выдающиеся русские ученые И.И. Мечников, Е.С. Лондон, А.А. Богомолец, Г.П. Сахаров. Свою первую работу о так называемых клеточных ядах (цитотоксинах) И.И. Мечников опубликовал еще в 1901 г.
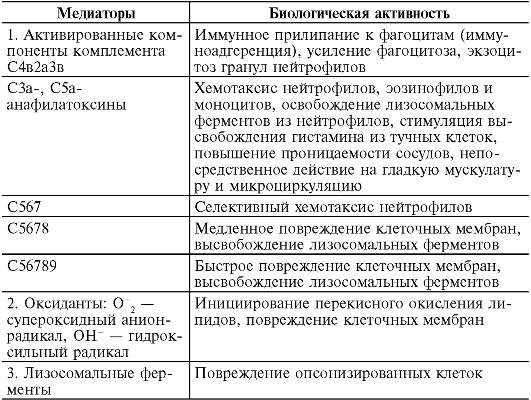
Реакции гиперчувствительности цитотоксического типа протекают следующим образом:
I. Стадия иммунных реакций. В ответ на появление аутоаллергенов начинается выработка аутоантител IgG- и ^М-классов. Они обладают способностью фиксировать комплемент и вызывать его активацию. Часть антител обладает опсонизирующими свойствами (усиливают фагоцитоз) и обычно не фиксирует комплемент. В ряде случаев после соединения с клеткой происходят конформационные изменения в области Fс-фрагмента антитела, к которому затем могут присоединяться клетки-киллеры (К-клетки).
II. Стадия биохимических реакций. На этой стадии появляются медиаторы, иные, чем в реакциях реагинового типа (см. табл. 8-3). Выделяют 3 типа ее реализации:
1. Комплементзависимый цитолиз. Комплексы АГ+АТ, фиксированные на поверхности измененной клетки, присоединяют и активируют комплемент (по классическому пути). Конечным этапом этой активации является образование медиаторов - компонентов комплемента: С4в2а3в; С3а; С5а; С567; С5678; С56789, лизирующих клетки.
2. Фагоцитоз. Фиксированные на измененных клетках организма IgG, IgM и СЗв-компоненты комплемента оказывают опсонизирующее действие, т.е. способствуют связыванию фагоцитов с поверхностью клеток-мишеней и их активации. Активированные фагоциты поглощают клетки-мишени и разрушают их при помощи лизосомальных ферментов (рис. 8-4).
3. Антителозависимая клеточная цитотоксичность. Реализуется путем присоединения клетки-киллера к Fc-фрагменту антител классов IgG и IgM (рис. 8-5), покрывающих измененные клеткимишени с последующим их лизисом с помощью перфоринов и продукции активных метаболитов кислорода (например, супероксидного анион-радикала), т.е. антитела служат своего рода «мостиком» между клеткой-мишенью и эффекторной клеткой. К эффек-
торным К-клеткам относят гранулоциты, макрофаги, тромбоциты, NK-клетки (натуральные киллеры - клетки из лимфоидной ткани без характерных маркеров Т- и В-клеток).
Таблица 8-3. Медиаторы аллергических реакций II типа
 III. Стадия клинических проявлений. Конечным
звеном комплемент- и антителозависимой цитотоксичности служат
повреждение и гибель клеток с последующим удалением их путем фагоцитоза.
Клетка-мишень является совершенно пассивным партнером в акте лизиса, и
ее роль заключается лишь в экспозиции антигена. После контакта с
эффекторной клеткой клетка-мишень гибнет, а эффекторная клетка выживает и
может взаимодействовать с другими мишенями. Гибель клетки-мишени
обусловлена тем, что в поверхностной мембране клетки образуются
цилиндрические поры диаметром от 5 до 16 нм. С появлением таких
трансмембранных каналов возникает осмотический ток (вход в клетку воды),
и клетка гибнет.
III. Стадия клинических проявлений. Конечным
звеном комплемент- и антителозависимой цитотоксичности служат
повреждение и гибель клеток с последующим удалением их путем фагоцитоза.
Клетка-мишень является совершенно пассивным партнером в акте лизиса, и
ее роль заключается лишь в экспозиции антигена. После контакта с
эффекторной клеткой клетка-мишень гибнет, а эффекторная клетка выживает и
может взаимодействовать с другими мишенями. Гибель клетки-мишени
обусловлена тем, что в поверхностной мембране клетки образуются
цилиндрические поры диаметром от 5 до 16 нм. С появлением таких
трансмембранных каналов возникает осмотический ток (вход в клетку воды),
и клетка гибнет.
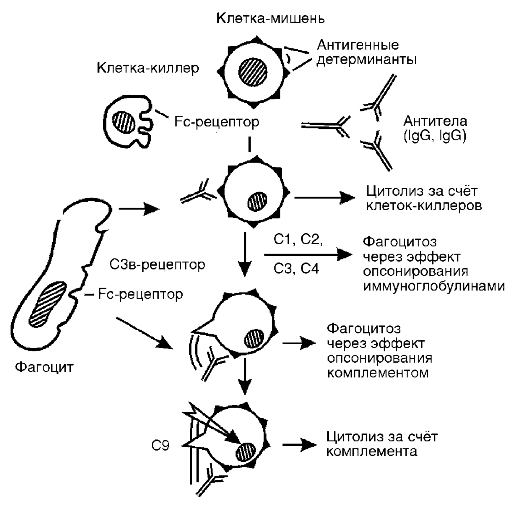 Рис. 8-4. Патогенез аллергических реакций II (цитотоксического) типа
Рис. 8-4. Патогенез аллергических реакций II (цитотоксического) типа
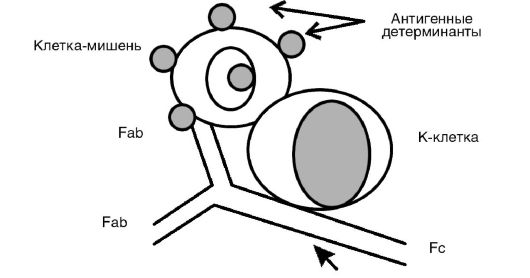
Рис. 8-5. К-клеточный лизис Fab- и Fc-фрагментами IgG
Однако действие цитотоксических антител не всегда заканчивается повреждением клеток. При этом имеет большое значение их количество. При малом количестве антител вместо повреждения возможен феномен стимуляции.
8.1.8. Аллергические реакции, развивающиеся по III (иммунокомплексному) типу гиперчувствительности
Повреждение при этом типе гиперчувствительности вызывается иммунными комплексами АГ+АТ. Вследствие постоянного контакта человека с какими-либо антигенами в его организме постоянно происходят иммунные реакции с образованием комплексов АГ+АТ. Эти реакции являются выражением защитной функции иммунитета и не сопровождаются повреждением. Однако при определенных условиях комплексы АГ+АТ могут вызывать повреждение и развитие заболевания. Концепция о том, что иммунные комплексы (ИК) могут играть роль в патологии, была высказана еще в 1905 г. К. Пирке и Б. Шиком. С тех пор группа заболеваний, в развитии которых основная роль отводится ИК, получила название болезней иммунных комплексов.
Причиной иммунокомплексных заболеваний являются: лекарственные препараты (пенициллин, сульфаниламиды и др.), антитоксические сыворотки, гомологичные γ-глобулины, пищевые продукты (молоко, яичные белки и др.), ингаляционные аллергены (домашняя пыль, грибы и др.), бактериальные и вирусные антигены, антигены мембран, ДНК клеток организма и др. Важно, что антиген имеет растворимую форму.
Течение реакций иммунных комплексов имеет следующий характер (рис. 8-6):
I. Стадия иммунных реакций. В ответ на появление аллергена или антигена начинается синтез антител, преимущественно IgG- и IgM-классов. Эти антитела называют также преципитирующими за их способность образовывать преципитаты при соединении с соответствующими антигенами.
При соединении антител с антигенами образуются ИК. Они могут образовываться местно, в тканях либо в кровотоке, что в значительной мере определяется путями поступления или местом образования антигенов (аллергенов).
В норме ИК удаляются из организма с помощью системы комплемента (компонентов С1-С5), эритроцитов и макрофагов.
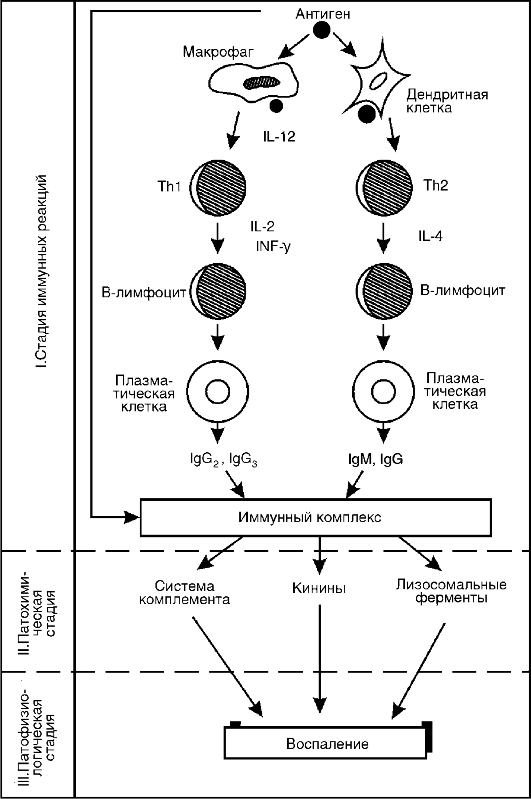 Рис. 8-6. Патогенез аллергических реакций III (иммунокомплексного) типа
Рис. 8-6. Патогенез аллергических реакций III (иммунокомплексного) типа
Эритроциты фиксируют ИК с помощью рецепторов CR1, предназначенных для связывания эритроцитов с С3в-фрагментом комплемента. Связывание с эритроцитами предохраняет ИК от контакта с сосудистой стенкой, поскольку основная часть эритроцитов следует в осевом кровотоке. В селезенке и печени нагруженные ИК эритроциты захватываются макрофагами (с помощью Fc-рецепторов). В связи с этим очевидно, что наследственные и приобретенные дефекты компонентов комплемента, а также рецепторного аппарата макрофагов и эритроцитов обусловливают накопление и циркуляцию в организме ИК с последующей их фиксацией на сосудистой стенке и в тканях, провоцируя воспаление. Наряду с этим патогенное значение ИК определяется их функциональными свойствами и локализацией вызываемых ими реакций.
От количества и соотношения молекул антигена и антител зависят величина комплекса и структура решетки. Так, крупнорешетчатые комплексы, образованные при избытке антител, быстро удаляются из кровотока ретикулоэндотелиальной системой. Преципитированные, нерастворимые ИК, образованные в эквивалентном соотношении, обычно легко удаляются при помощи фагоцитоза и не вызывают повреждения, за исключением случаев их высокой концентрации или образования в мембранах с фильтрующей функцией (в гломерулах, сосудистой оболочке глазного яблока). Небольшие комплексы, образованные при избытке антигена, циркулируют длительное время, но обладают слабой повреждающей активностью. Повреждающее действие обычно оказывают образующиеся в избытке растворимые, мелкие и средние комплексы (900-1000 КД). Они плохо фагоцитируются и долгое время циркулируют в организме.
Значение вида антител определяется тем, что их разные классы и подклассы обладают различной способностью активировать комплемент и фиксироваться через Fс-рецепторы на фагоцитирующих клетках. Так, и IgG1-3 связывают комплемент, а IgE и IgG4 - нет.
При образовании патогенных ИК развивается воспаление различной локализации. Решающую роль для циркулирующих в крови ИК играют проницаемость сосудов и наличие определенных рецепторов в тканях. При этом аллергическая реакция может быть общей (например, сывороточная болезнь) либо протекать с вовлечением в патологический процесс отдельных органов и тканей:
кожи (псориаз), сосудов (геморрагический васкулит), почек (волчаночный нефрит), легких (фиброзирующий альвеолит) и др.
II. Стадия биохимических реакций. Под влиянием ИК и в процессе их удаления образуется ряд медиаторов, основная роль которых заключается в обеспечении условий, способствующих фагоцитозу комплекса и его перевариванию. Однако при определенных условиях процесс образования медиаторов может оказаться чрезмерным, и тогда они оказывают повреждающее действие.
Основными медиаторами являются:
1. Комплемент, в условиях активации которого различные компоненты и субкомпоненты оказывают цитотоксическое действие. Ведущую роль играет образование С3, С4, С5, которые усиливают определенные звенья воспаления (С3в усиливает иммунную адгезию ИК к фагоцитам, С3а является анафилатоксином, как и С4а, и т.д.).
2. Лизосомальные ферменты, освобождение которых во время фагоцитоза усиливает повреждение базальных мембран, соединительной ткани.
3. Кинины, в частности брадикинин. При повреждающем действии ИК происходит активация фактора Хагемана, в результате из α-глобулинов крови под влиянием калликреина образуется брадикинин.
4. Гистамин и серотонин играют большую роль в аллергических реакциях III типа. Источником их являются тучные клетки, базофилы крови и тромбоциты. Они активируются С3а- и С5а- компонентами комплемента.
5. Супероксидный анион-радикал.
Действие всех перечисленных основных медиаторов характеризуется усилением протеолиза.
III. Стадия клинических проявлений. В результате появления медиаторов развиваются воспаление с альтерацией, экссудацией и пролиферацией, васкулиты, приводящие к появлению узловатой эритемы, узелкового периартериита. Могут возникать цитопении (например, гранулоцитопения). Вследствие активации фактора Хагемана и/или тромбоцитов иногда происходит внутрисосудистое свертывание крови.
Третий тип аллергических реакций является ведущим в развитии сывороточной болезни, экзогенных аллергических альвеолитов, некоторых случаев лекарственной и пищевой аллергии, аутоиммунных заболеваний (системная красная волчанка и др.). При
значительной активации комплемента развивается системная анафилаксия в виде шока.
8.1.9. Аллергические реакции, развивающиеся по IV (опосредованному Т-клетками) типу гиперчувствительности
Эта форма реактивности сформировалась на поздних этапах эволюции на основе иммунологических реакций и воспаления. Она направлена на распознавание и ограничение действия аллергена. IV тип иммунного повреждения лежит в основе многих аллергических и инфекционных заболеваний, аутоиммунных болезней, отторжения трансплантата, контактного дерматита (контактная аллергия), противоопухолевого иммунитета. Прототипом данной формы реагирования является туберкулиновая проба (реакция Манту), используемая в диагностике туберкулеза. Относительно позднее проявление этой реакции (не ранее чем через 6-8 ч в месте введения возникает покраснение, в дальнейшем эритема увеличивается с формированием через 24-48 ч после введения антигена воспалительной папулы (от лат. papula - выпуклость, прыщ) - инфильтрата округлой формы, возвышающегося над поверхностью кожи) позволило также назвать ее гиперчувствительностью замедленного типа (ГЗТ).
Этиология и особенности антигенной стимуляции при ГЗТ. Антигены, индуцирующие ГЗТ, могут иметь различное происхождение: микробы (например, возбудители туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, стрептококки, стафилококки), вирусы коровьей оспы, герпеса, кори, грибы, тканевые белки (например, коллаген), антигенные полимеры аминокислот, низкомолекулярные соединения. По химической природе антигены, которые способны вызвать ГЗТ, относятся, как правило, к белковым соединениям.
Белки, вызывающие ГЗТ, отличаются низкой молекулярной массой и «слабыми» иммуногенными свойствами. Поэтому они не способны в достаточной мере стимулировать антителообразование. Иммунологическая реакция при ГЗТ обладает рядом отличительных особенностей. Иммунный ответ направлен не только к гаптену, как это имеет место при реакциях немедленного типа, но и к белку-носителю, причем специфичность в отношении антигена при ГЗТ выражена гораздо сильнее, чем при реакциях немедленного типа.
Патогенез реакций гиперчувствительности IV типа имеет следующие особенности (рис. 8-7):
I. Стадия иммунных реакций. Поступающий в организм антиген чаще всего контактирует с макрофагом, обрабатывается им, а затем в переработанном виде передается ТЫ, имеющим на своей поверхности рецепторы для антигена. Они распознают антиген, а затем с помощью интерлейкинов запускают пролиферацию эффекторных Т-клеток воспаления с фенотипами CD4+ и CD8+, а также клеток памяти, позволяющих сформировать быстрый иммунный ответ при повторном попадании антигена в организм.
После одновременного связывания Т-клетки с антигеном и молекулами главного комплекса гистосовместимости (HLA) и последующего «двойного распознавания» антигена и продуктов HLA начинается пролиферация лимфоцитов и их трансформация в бласты.
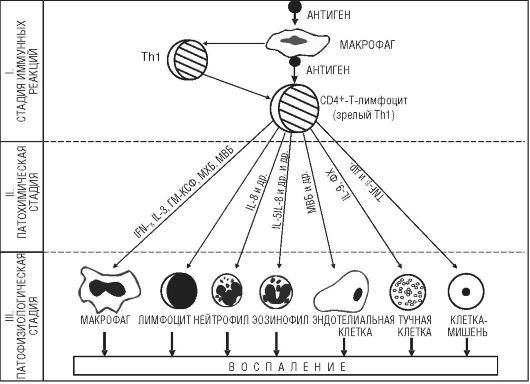 Рис. 8-7. Патогенез
аллергических реакций IV (клеточно-опосредованного) типа: ГМ-КСФ -
гранулоцитарно-макрофагальный колониестимулирующий фактор; МВБ -
макрофагальный воспалительный белок; МХБ - макрофагальный
хемоаттрактантный белок, Th (T-helper) - Т-хелпер
Рис. 8-7. Патогенез
аллергических реакций IV (клеточно-опосредованного) типа: ГМ-КСФ -
гранулоцитарно-макрофагальный колониестимулирующий фактор; МВБ -
макрофагальный воспалительный белок; МХБ - макрофагальный
хемоаттрактантный белок, Th (T-helper) - Т-хелпер
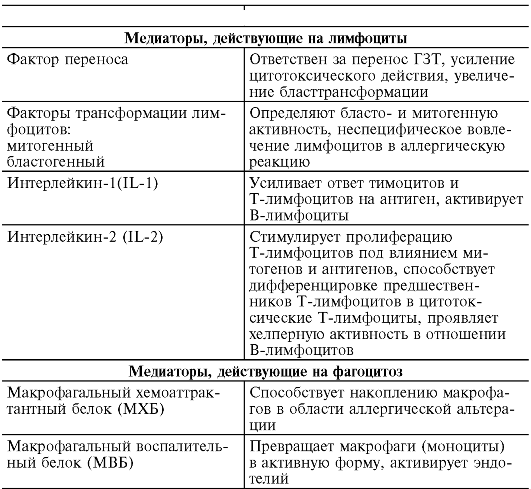
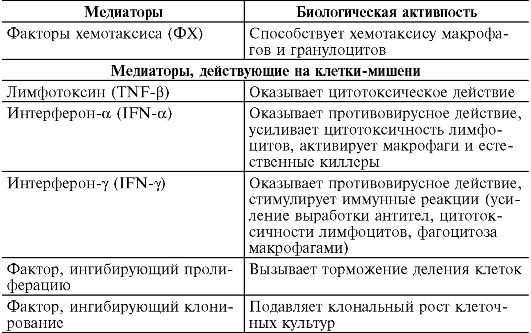
II. Стадия биохимических реакций. Антигенная стимуляция и бласттрансформация лимфоцитов сопровождаются образованием и выделением медиаторов - цитокинов (лимфокинов и монокинов), большинство из которых являются гликопротеинами. Медиаторы действуют на клетки-мишени (макрофаги и нейтрофилы, лимфоциты, фибробласты, стволовые клетки костного мозга, опухолевые клетки, остеокласты и др.), несущие на своей поверхности медиаторные рецепторы. Биологический эффект медиаторов разнообразен (табл. 8-4). Они изменяют клеточную подвижность, активируют клетки, участвующие в воспалении, способствуют пролиферации и созреванию клеток, регулируют кооперацию иммунокомпетентных клеток.
Таблица 8-4. Медиаторы аллергических реакций, опосредованных Т-клетками
 В зависимости от оказываемого эффекта медиаторы делятся на две большие группы:
В зависимости от оказываемого эффекта медиаторы делятся на две большие группы:
1) факторы, подавляющие функциональную активность клеток (макрофагальный хемоаттрактантный белок, TNF-β);
2) факторы, усиливающие функциональную активность клеток (фактор переноса; макрофагальный воспалительный белок; митогенный и хемотаксические факторы).
III. Стадия клинических проявлений зависит от природы этиологического фактора и той ткани, где «разыгрывается» патологический процесс. Это могут быть процессы, протекающие в коже, суставах, внутренних органах. В воспалительном инфильтрате преобладают мононуклеарные клетки (лимфоциты, моноциты/ макрофаги). Нарушение микроциркуляции в очаге повреждения объясняется повышением проницаемости сосудов под влиянием медиаторов (кинины, гидролитические ферменты), а также активацией свертывающей системы крови и усилением образования фибрина. Отсутствие значительного отека, так характерного для иммунных поражений при аллергических реакциях немедленного типа, связано с весьма ограниченной ролью гистамина в ГЗТ.
При гиперчувствительности IV типа иммунное повреждение развивается в результате:
1) прямого цитотоксического действия CD4+ и CD8+ Т-лимфоцитов на клетки-мишени (TNF-β и комплемент не принимают участия в этом процессе);
2) цитотоксического действия TNF-β (так как действие последнего неспецифично, повреждаться могут не только те клетки, которые вызвали его образование, но и интактные клетки в зоне его образования);
3) выделения в процессе фагоцитоза лизосомальных ферментов, повреждающих тканевые структуры (эти ферменты выделяют в первую очередь макрофаги).
Составной частью ГЗТ является воспаление, которое присоединяется к иммунной реакции действием медиаторов патохимической стадии. Как и при иммунокомплексном типе аллергических реакций, оно подключается в качестве защитного механизма, способствующего фиксации, разрушению и элиминации аллергена. Однако воспаление является одновременно фактором повреждения и нарушения функции тех органов, где оно развивается, и ему отводится важнейшая патогенетическая роль в развитии инфекционно-аллергических, аутоиммунных и некоторых других заболеваний.
8.2. ПСЕВДОАЛЛЕРГИЧЕСКИЕ РЕАКЦИИ
В аллергологической практике врачу-аллергологу все чаще приходится иметь дело с большой группой реакций, клинически часто не отличимых от аллергических. Эти реакции получили название псевдоаллергические (неиммунологические). Принципиальным их отличием от истинных аллергических реакций является отсутствие иммунологической стадии, т.е. в их развитии не принимают участие антитела или сенсибилизированные лимфоциты. Таким образом, при псевдоаллергиях выделяют только две стадии - патохимическую и патофизиологическую. В патохимической стадии псевдоаллергических реакций высвобождаются те же медиаторы, что и при истинных аллергических реакциях (гистамин, лейкотриены, продукты активации комплемента, калликреин-кининовой системы), что объясняет схожесть клинических симптомов.
Основными проявлениями псевдоаллергических реакций являются крапивница, отек Квинке, бронхоспазм, анафилактический шок.
По патогенезу различают следующие типы псевдоаллергических реакций:
1. Реакции, связанные с высвобождением медиаторов аллергии (гистамина и др.) из тучных клеток не в результате повреждения их комплексами АГ+АТ, а под действием факторов внешней среды
К IgE-независимым активаторам тучных клеток относятся антибиотики, миорелаксанты, опиаты, полисахариды, рентгеноконтрастные препараты, анафилатоксины (С3а, С5а), нейропептиды (например, субстанция Р), АТФ, IL-1 , IL-3 и др. Тучные клетки могут активироваться также под действием механического раздражения (уртикарный дермографизм) и физических факторов: холода (холодовая крапивница), ультрафиолетовых лучей (солнечная крапивница), тепла и физической нагрузки (холинергическая крапивница). Выраженным гистаминосвобождающим действием обладают многие пищевые продукты, в частности рыба, томаты, яичный белок, клубника, земляника, шоколад.
Однако повышение уровня гистамина в крови может быть связано не только с избыточным его высвобождением, но и с нарушением его инактивации гликопротеинами эпителия кишечника, белками плазмы (гистаминопексия), гистаминазой эозинофилов и печени, моноаминооксидазной системой. Процессы инактивации гистамина в организме нарушаются: при повышении проницаемости слизистой оболочки кишечника, когда создаются условия для избыточного всасывания гистамина; при избыточном поступлении гистамина в кишечник или его образовании в кишечнике; при нарушениях гистаминопектической активности плазмы; при патологии печени, в частности при токсических гепатитах (например, на фоне приема туберкулостатического препарата - изониазида), циррозе печени.
Кроме того, псевдоаллергические реакции, связанные с высвобождением медиаторов аллергии, могут развиваться у лиц, длительно применяющих ингибиторы ангиотензиногенпревращающего фермента (например, каптоприл, рамиприл и др.), участвующего в метаболизме брадикинина. Это приводит к повышению содержания брадикинина в крови и способствует развитию крапивницы, бронхоспазма, ринореи и др.
2. Реакции, связанные с нарушением метаболизма полиненасыщенных жирных кислот, в первую очередь арахидоновой кислоты. Так, при угнетении активности циклоксигеназы отмечается сдвиг метаболизма арахидоновой кислоты в направлении липоксигеназ-
ного пути. В результате образуется избыточное количество лейкотриенов. Развитие реакций этого типа может иметь место при действии нестероидных противовоспалительных препаратов, например аспирина.
3. Реакции, связанные с неконтролируемой активацией комплемента в связи с наследственным дефицитом ингибитора первого компонента комплемента (врожденный ангионевротический отек Квинке), а также обусловленные неиммунологической активацией комплемента по альтернативному пути при действии яда кобры, бактериальных липополисахаридов, тромболитических средств, наркотических анальгетиков, ряда ферментов (трипсин, плазмин, калликреин и др.). Активация системы комплемента приводит к образованию промежуточных продуктов (C3а, C5a), которые вызывают высвобождение медиаторов (в первую очередь гистамина) из тучных клеток, базофилов и тромбоцитов.
Дифференциальная диагностика истинных аллергических реакций и псевдоаллергии имеет важное практическое значение, так как тактика лечения больных с истинной и ложной аллергией принципиально отличается.
8.3. АУТОИММУННЫЕ РАССТРОЙСТВА
В норме в каждом организме присутствуют антитела, В- и Т-лимфоциты, направленные против антигенов собственных тканей (аутоантигенов). Аутоантигены подразделяются на обычные (к ним относится самый широкий набор белков и других макромолекул, из которых построен человеческий организм), «секвестрированные» (они присутствуют в тканях, недоступных для лимфоцитов, таких, как мозг, хрусталик глаза, коллоид щитовидной железы, семенники) и модифицированные (т.е. образующиеся при повреждениях, мутациях, опухолевом перерождении). Следует также отметить, что некоторые антигены (например, белки миокарда и почечных клубочков) являются перекрестно реагирующими по отношению к некоторым микробным антигенам (в частности, антигенам β-гемолитического стрептококка). Исследование аутоантител, направленных против аутоантигенов, позволило разделить их на три группы:
• естественные или физиологические (их большинство, они не могут при взаимодействии с аутоантигенами повреждать собственные ткани);
• антитела-«свидетели» (они соответствуют иммунологической памяти в отношении аутоантигенов, которые когда-либо образовывались вследствие случайных повреждений тканей);
• агрессивные или патогенные (они способны вызывать повреждение тканей, против которых направлены).
Само по себе наличие аутоантигенов, большинства аутоантител и аутореагирующих лимфоцитов не является патологическим явлением. Однако при наличии ряда дополнительных условий может запускаться и постоянно поддерживаться аутоиммунный процесс, который способствует развитию иммунного воспаления с деструкцией вовлеченных тканей, формированием фиброза и новообразованием сосудов, что в конечном счете приводит к утрате функции соответствующего органа. Важнейшими дополнительными условиями включения и поддержания аутоиммунного процесса являются:
• хронические вирусные, прионовые и другие инфекции;
• проникновение возбудителей с перекрестно реагирующими антигенами;
• наследственные или приобретенные молекулярные аномалии строения важнейших структурных и регуляторных молекул иммунной системы (включая молекулы, вовлеченные в контроль апоптоза);
• индивидуальные особенности конституции и обмена веществ, предрасполагающие к вялотекущему характеру воспаления;
• пожилой возраст.
Таким образом, аутоиммунный процесс - это иммунное воспаление, направленное против нормальных (неизмененных) антигенов собственных тканей и обусловленное образованием аутоантител и аутореактивных лимфоцитов (т.е. аутосенсибилизацией).
Условно патогенез аутоиммунных расстройств можно разделить на два этапа: индуктивный и эффекторный.
Индуктивный этап тесно связан со срывом иммунологической аутотолерантности. Толерантность к собственным антигенам организма является естественным состоянием, при котором деструктивная активность иммунной системы направлена только на внешние антигены. Процессы старения организма с иммунологической точки зрения обусловлены медленной отменой такой толерантности.
Имеется несколько механизмов, контролирующих поддержание долгосрочной аутотолерантности: клональная делеция, клональная анергия и иммуносупрессия, опосредованная Т-клетками.
Клональная делеция является формой центральной толерантности, которая формируется в ходе негативной селекции путем апоптоза Т-лимфоцитов (в тимусе) и В-лимфоцитов (в костном мозгу), имеющих высокоспецифические антигенраспознающие рецепторы к аутоантигенам. Клональная анергия - также форма центральной толерантности, которая характерна, главным образом, для В-клеток, имеющих BCR к растворенным аутоантигенам в низких концентрациях. При клональной анергии клетки не погибают, а становятся функционально неактивными.
Однако некоторые Т- и В-лимфоциты нередко избегают негативной селекции и при наличии дополнительных условий могут активироваться. Этому могут способствовать проникновение патогенов с перекрестными антигенами или поликлональными активаторами, сдвиг цитокинового профиля в сторону ТЫ, затяжной воспалительный процесс с поступлением в кровь и ткани множества медиаторов, которые могут модифицировать аутоантигены в очаге и др. Для сохранения толерантности периферические аутореактивные Т-лимфоциты должны быть подвержены апоптозу или стать анергичными под супрессивным влиянием цитокинов профиля Тh2. Если не происходит включение механизмов периферической толерантности, т.е. иммуносупрессии, опосредуемой Т-клетками, начинается развитие аутоиммунных расстройств. В значительной степени аутоиммунная патология (как и опухолевая прогрессия) - это дефицитность апоптоза. Описана летальная наследственная болезнь с дефектом гена, кодирующего Fas - одного из специализированных рецепторов для индукции апоптоза, которая проявляется лимфопролиферативным синдромом с системными симптомами, типичными для аутоиммунных заболеваний. Существенная роль в патогенезе многих форм аутоиммунной патологии отводится медленным вирусным и прионовым инфекциям, которые, вероятно, могут модифицировать процессы апоптоза и экспрессии важнейших регуляторных молекул. В последнее время исследуется роль ТЫ7 в развитии аутоиммунных болезней.
Одним из центральных аспектов патогенеза аутоиммунных болезней является наличие каких-либо молекулярных аномалий. Например, при ревматоидном артрите и ряде других патологий обнаружен дефект гликозилирования Fc-фрагмента собственных антител класса IgG, когда отмечается дефицит сиаловой кислоты и галактозы. Аномальные молекулы IgG образуют между собой конгломераты с сильными иммуногенными свойствами, которые ин-
дуцируют аутоиммунный ответ. Наличие молекулярных аномалий генов, ответственных за синтез цитокинов профиля Тh2, приводит к тому, что начавшийся аутоиммунный ответ не заканчивается восстановлением аутотолерантности.
Аутоиммунные болезни нередко развиваются в так называемых иммунологически привилегированных органах (мозг, хрусталик глаза, коллоид щитовидной железы, семенники); к таким патологиям относятся рассеянный склероз, симпатическая офтальмия, аутоиммунный тиреоидит Хасимото, иммунологическое бесплодие. Когда аутоантигены из этих органов оказываются в несвойственных местах (например, при травме тканевых барьеров) и имеются какие-либо дополнительные условия усиления их иммуногенности (дефицит Тп2-цитокинов, присутствие адъювантов и т.д.), включается аутоиммунный процесс.
Эффекторный этап любого аутоиммунного процесса протекает по одному или чаще нескольким (II, III, IV или V) типам гиперчувствительности по P.G.H. Gell и P.R.A. Coombs:
II тип: аутоиммунная гемолитическая анемия, пернициозная анемия, вульгарная пузырчатка, хроническая идиопатическая крапивница, тяжелая миастения (myasthenia gravis), аутоиммунный тиреоидит и др.;
III тип: системная красная волчанка, системные васкулиты и
др.;
IV тип: ревматоидный артрит, рассеянный склероз и др.;
V тип: иммуноопосредованный сахарный диабет I типа, болезнь Грейвса и др.
Реакции гиперчувствительности, развивающиеся по V (антирецепторному) типу, являются вариантом аутосенсибилизации, обусловленной формированием антител к компонентам клеточной поверхности (рецепторам), не обладающих комплементсвязывающей активностью. Результатом взаимодействия антител, направленных против антигенов-рецепторов, участвующих в физиологической активации клетки, является стимуляция клеток-мишеней. Такие реакции отмечаются при воздействии на клетку антител к рецепторам гормонов. Наиболее ярким их примером является образование тиреоидстимулирующих иммуноглобулинов, взаимодействующих с антигенными структурами рецептора тиреотропного гормона
(ТТГ), при болезни Грейвса1 (диффузный токсический зоб - ДТЗ), патогенез которой имеет следующие особенности:
I. Стадия иммунных реакций. При болезни Грейвса начальная фаза иммунопатологического процесса связана с миграцией и накоплением в щитовидной железе зрелых дендритных клеток, выполняющих функцию антигенпредставляющих клеток (АПК). Индукторами могут выступать антигены бактериального или вирусного происхождения, воспаление, стресс-реакция, а также йодсодержащие препараты (см. сноску). Процесс размножения и созревания дендритных клеток в щитовидной железе регулируется преимущественно грануломоноцитарным колониестимулирующим фактором (ГМ-КСФ). В эндосомах зрелых дендритных клеток происходит процессинг аутоантигена, в роли которого при болезни Грейвса выступает экстраклеточный домен рецептора к тиреотропному гормону (рТТГ) (субъединица А молекулы рТТГ). Далее процессируемый аутоантиген связывается с молекулами HLA-II и транспортируется на мембрану дендритной клетки. В результате создаются условия для включения в аутореактивный иммунный ответ CD4+ T-лимфоцитов (Th2). Взаимодействие между Th2 и дендритной клеткой осуществляется с помощью комплекса TCR/ CD3 при участии молекул адгезии (ICAM, LFA) и костимулирующих молекул (B7 на АПК и CD152 (CTLA-4) на Th2), которые взаимодействуют, связывая мембранные структуры Т-лимфоцита и дендритной клетки, и, наряду с секрецией IL-10 антигенпрезентирующими дендритными клетками, играют роль дополнительного сигнала Th2-активации.
II. Стадия биохимических реакций. Активированные CD4+ Т-клетки продуцируют цитокины (IL-4, IL-10, IFN-γ), индуцируя
1 Болезнь Грейвса является мультифакториальным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с генетической предрасположенностью (ассоциацией с гаплотипами HLA-B8, HLA-DR3 и HLA-DQA1O501 у европейцев, HLA-Bw36 - у японцев, HLA-Bw46 - у китайцев; CTLA-42 и др.) в патогенезе болезни Грейвса определенное значение придается психоэмоциональным и средовым факторам (стресс, инфекционно-воспалительные заболевания, прием в высоких концентрациях йода и йодсодержащих препаратов), в том числе «молекулярной мимикрии» между антигенами щитовидной железы и рядом стресс-протеинов, антигенов бактерий (Yersinia enterocolitica) и вирусов (например, вирусов группы герпеса).
CTLA-4 (cytotoxic T-lymphocyte-associated serine esterase 4) - Т-клеточный рецептор, ингибирующий пролиферацию Т-лимфоцитов и отвечающий за формирование иммунологической толерантности.
процесс дифференцировки В-лимфоцитов в плазматические клетки и продукцию ими специфических антител (IgG) к рецептору ТТГ (АТ-рТТГ). АТ-рТТГ связываются с рецептором ТТГ и приводят его в активное состояние, запуская аденилатциклазу, опосредующую наработку цАМФ, стимуляцию пролиферации тиреоцитов (что приводит к диффузному разрастанию железы), захват йода железой, синтез и высвобождение тиреоидных гормонов (трийодтиронина - Т3, тироксина - Т4).
Существует и другой путь инициации продукции тиреоидстимулирующих антител к рТТГ. В первую стадию на поверхности дендритных клеток экспрессируются белки СD1, которые распознаются натуральными киллерами (NК-клетками) и CD8+ Т-лимфоцитами. Активированные NK-клетки и СD8+ Т-клетки продуцируют цитокины (IL-4, IFN-γ), побуждающие экспрессию HLA-II, активацию Th2-лимфоцитов и формирование гуморальной реакции иммунитета.
Одновременно с образованием эффекторных лимфоцитов генерируются клетки памяти. В дальнейшем по мере прогрессирования патологического процесса арсенал АПК в щитовидной железе расширяется за счет макрофагов и В-лимфоцитов, которые обладают способностью активировать клетки памяти. Синтез IgG- аутоантител приобретает лавинообразный и непрерывный характер, поскольку не блокируется по принципу отрицательной обратной связи.
III. Стадия клинических проявлений. Клиническая картина болезни Грейвса определяется синдромом тиреотоксикоза (классическая триада симптомов - зоб, экзофтальм, тахикардия, а также похудение, потливость, нервозность, тремор, общая и мышечная слабость, быстрая утомляемость и др.). Характерный признак болезни Грейвса - претибиальная микседема1. При инструментальном обследовании (ультразвуковое исследование, сцинтиграфия) обнаруживается диффузное увеличение щитовидной железы, усиление захвата радиоактивного йода железой. Данные лабораторных исследований обнаруживают наличие высоких концентраций тиреоидных гормонов (Т3, Т4) в крови. В 70-80% случаев болезни Грейвса, наряду с АТ-рТТГ, могут определяться высокие уровни
1 Претибиальная микседема - это плотный отек передней поверхности голеней, имеющий вид асимметричных желтых или красновато-бурых бляшек, формирующийся в результате отложения в коже кислых гликозаминогликанов, в частности гиалуроновой кислоты; возможен зуд.
антител к тиреоидной пероксидазе (АТ-ТПО) и тиреоглобулину (АТ-ТГ), оказывающие цитолитическое действие.
Клиническая симптоматика аутоиммунных болезней характеризуется хроническим прогредиентным течением с деструктивными проявлениями в органах-мишенях.
Существует пять патогенетических классов аутоиммунных болезней.
Класс А. Первичные аутоиммунные болезни с наследственной предрасположенностью. В зависимости от вовлеченности одного или нескольких органов в этом классе выделяют органоспецифические болезни (например, аутоиммунный тиреоидит), промежуточные (например, аутоиммунная патология печени и желудочнокишечного тракта) и органонеспецифические (коллагенозы).
Класс В. Вторичные аутоиммунные болезни (например, алкогольный цирроз печени, хроническая лучевая болезнь).
Класс С. Аутоиммунные болезни на основе генетических дефектов комплемента (например, некоторые формы наследственной гемолитической анемии).
Класс D. Аутоиммунные болезни, связанные с медленными вирусными и прионовыми инфекциями (например, вилюйский энцефалит, болезнь Альцгеймера и др.).
Класс Е. Комбинированные формы.
Диагностика основана на выявлении специфических аутоантител и аутореактивных Т-лимфоцитов (табл. 8-5), гистологических и иных специальных исследованиях.
Таблица 8-5. Специфические маркеры аутоиммунных болезней
Аутоиммунная патология | Иммунологический маркер |
Аутоиммунная гемолитическая анемия | Аутоантитела против Rh-антигена |
Пернициозная анемия | Аутоантитела против внутреннего фактора Касла |
Вульгарная пузырчатка | Аутоантитела против кадхерина эпидермиса |
Хроническая идиопатическая крапивница | Аутоантитела против FceRI |
Тяжелая миастения (myasthenia gravis) | Аутоантитела против ацетилхолиновых рецепторов |
Окончание табл. 8-5
Аутоиммунная патология | Иммунологический маркер |
Аутоиммунный тиреоидит | Аутоантитела к первому (тиреоглобулин) и второму коллоидным антигенам, к тиреоидной пероксидазе (микросомальный антиген) |
Системная красная волчанка Аутоантитела против ДНК, рибосом | |
Ревматоидный артрит | Т-клетки, специфичные к коллагену II; аутоантитела к Fc-фрагменту собственных IgG с дефектом гликозилирования |
Иммуноопосредованный сахарный диабет I типа | Т-клетки, специфичные к эндоантигену β-клеток островков Лангерганса |
Рассеянный склероз | Т-клетки, специфичные к основному белку миелина |
Лечение аутоиммунньгх болезней связано с попытками восстановления аутотолерантности, назначением противовоспалительных антимедиаторных препаратов, включая кортикостероиды, а также генной терапией.