Нормальная физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. 2010. - 832 с.
|
|
|
|
ГЛАВА 7. ФИЗИОЛОГИЯ СОКРАТИТЕЛЬНЫХ ЭЛЕМЕНТОВ
Двигательные функции, осуществляемые сократительными элементами мышечных тканей (поперечнополосатое скелетное МВ, кардиомиоциты, ГМК) и немышечными контрактильными клетками (миоэпителиальные, миофибробласты и др.), обеспечивает актомиозиновый хемомеханический преобразователь. В скелетных МВ и кардиомиоцитах содержатся сократительные единицы - саркомеры (рис. 7-1), это поперечнополоcатые мышцы; в ГМК саркомеров нет, это гладкие мышцы. Сократительную функцию скелетной мышечной ткани (произвольная мускулатура) контролирует нервная система (соматическая двигательная иннервация). Непроизвольные мышцы (сердечная и гладкая) имеют вегетативную двигательную иннервацию, а также развитую систему гуморального контроля за их сократительной активностью. Все мышечные элементы способны к генерации ПД, распространяющихся по клеточной мембране (сарколемма).
СКЕЛЕТНАЯ МЫШЦА
У человека более 600 скелетных мышц (около 40% массы тела). Они обеспечивают осознанные и осознаваемые произвольные движения тела и его частей. Структурно-функциональная единица скелетной мышцы - скелетное мышечное волокно (МВ) (см. рис. 7-1).
Мышечное волокно
Большинство
скелетных мышц начинается и заканчивается сухожилиями; скелетные МВ
расположены параллельно друг другу, поэтому сила сократившихся МВ
суммируется. Скелетное МВ имеет форму протяжённого цилиндра длиной до
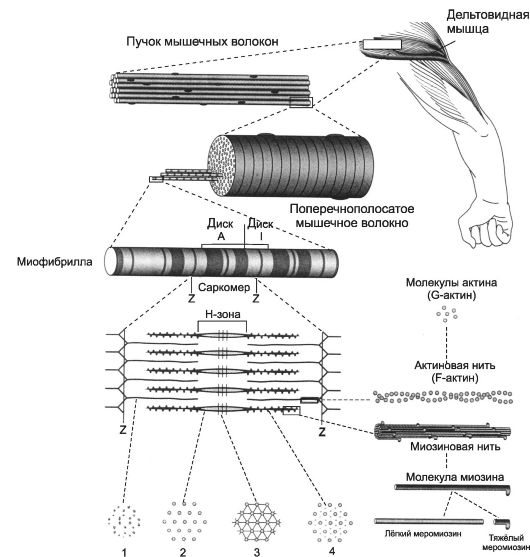
Рис. 7-1. Скелетная мышца состоит из поперечнополосaтых мышечных волокон [11]. Значительный объём МВ занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл - саркомер, сформированный из толстых (миозиновых) и тонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано слева и слева внизу. G-актин - глобулярный, F-актин - фибриллярный актин.
относят к двум структурам - плазматической мембране МВ и окружающей её базальной мембране. От поверхности МВ отходят трубковидные впячивания сарколеммы - поперечные трубочки (Т-трубочки), контактирующие с элементами саркоплазматического ретикулума - СР (депо Ca2+) (рис. 7-3). Помимо миофибрилл и СР, в саркоплазме (миоплазме, цитоплазме) МВ расположены энергетические станции - митохондрии и гранулы гликогена. Все МВ в мышцах подразделяются на экстрафузальные (иннервированы α-мотонейронами и осуществляют сократительную функцию) и интрафузальные (иннервированы γ-мотонейронами и образуют чувствительные структуры мьшщ). Экстрафузальные МВ подразделяются на фазные (осуществляют быстрые сокращения) и тонические (специализируются на поддержании статического напряжения). Произвольная мускулатура человека практически полностью состоит из фазных МВ, генерирующих ПД и в ответ на стимуляцию отвечающих быстрым сокращением.
Миофибриллы
Каждая миофибрилла содержит около 1500 толстых и 3000 тонких нитей. Поперечная исчерченность скелетного МВ (см. рис. 7-1 и 7-3) определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков), изотропных и анизотропных, - светлых (Isotropic, I-диски) и тём- ных (Anisotropic, А-диски) дисков. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких (актиновых) и толстых (миозиновых) нитей: толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z-линия. Участок миофибриллы между соседними Z-линиями определяют как саркомер.
• Саркомер - часть миофибриллы, расположенная между двумя последовательными Z-дисками. В состоянии покоя при полностью растянутой мышце длина саркомера составляет 2 мкм. При такой длине саркомера актиновые (тонкие) нити лишь частично перекрывают миозиновые (толстые) нити. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера. Толстые нити занимают центральную часть сaркомера - А-диск (содержащий только толстые нити участок сaркомера - Н-зона, в середи-
не которой проходит М-линия). I-диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А-диск (тёмный) и две половины I-диска (светлого), формула саркомера - 0,5А + I + 0,5А. Во время сокращения длина A-диска не меняется, а длина I-диска укорачивается, что и послужило основанием для создания теории, объясняющей сокращение мышцы механизмом скольжения (теория скольжения) тонких актиновых нитей вдоль толстых миозиновых.
• Толстая нить (рис. 7-2, Б). Каждая миозиновая нить состоит из 300-400 молекул миозина и С-белка. Миозин (рис. 7-2, В) - гексaмер (две тяжёлые и четыре лёгкие цепи). Тяжёлые цепи - две спирально закрученные полипептидные нити, несущие на своих концах глобулярные головки. В области головок с тяжёлыми цепями связаны лёгкие цепи. Каждую миозиновую нить связывает с Z-линией гигантский белок титин. С толстыми нитями связаны небулин, миомезин, креатинфосфокиназа и другие белки.
• Тонкая нить (рис. 7-2, А) имеет длину около 1 мкм и состоит из двойной спирали F-актина в кооперации с двумя нитями тропомиозина, белков тропонинового комплекса и ассоциированных с тонкой нитью и образующих её поддерживающий каркас α-актинина, десмина и небулина.
Φ Актин. Молекулы глобулярного актина (G-актин, мол. масса 45 000) полимеризуются и образуют фибриллярный актин (F-актин). С одним из G-актинов связана молекула АДФ; считается, что именно это место - активный участок, где происходит взаимодействие с головкой миозина.
Φ Тропомиозин. Молекулы имеют молекулярную массу 70 000 и длину 40 нм и укладываются конец в конец в желобке между двумя спирально закрученными цепочками F-актина. В состоянии покоя молекулы тропомиозина «закрывают» активные участки актиновых нитей и предотвращают взаимодействие актина и миозина.
Φ Тропонины. Этот комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм и образован тремя глобулярными субъединицами - тропонинами T (связывается с тропомиозином), I (препятствует взаимодействию актина и миозина) и С (Ca2+-связьraающий белок).
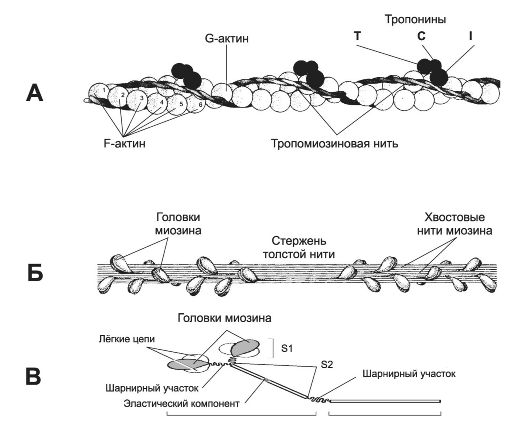
Рис. 7-2. Тонкая и толстая нити в составе миофибрилл [11]. А - тонкая нить (две спирально скрученные нити фибриллярного актина - F-актин). В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина трёх типов. Б - толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. В - молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и об- ладает активностью АТФазы.
Φ α-Актинин, десмин и виментин - белки, связанные с тонкими нитями; они входят в состав Z-линии, в которую вплетён один конец тонкой нити; второй конец расположен между толстыми нитями и связан с ними при помощи небулина.
Саркоплазматическая сеть и Т-трубочки
Саркоплазма содержит обильную эндоплазматическую сеть (саркоплазматический ретикулум - СР, см. рис. 7-3). СР имеет вид канальцев, идущих преимущественно вдоль миофибрилл и анасто- мозирующих друг с другом. В каждом саркомере СР образует расширенные участки - концевые цистерны. Между двумя соседними концевыми цистернами располагается Т-трубочка - впячивание сарколеммы. Этот комплекс (две концевые цистерны и Т-трубочка) называют «триадой». В триадах происходит передача возбуждения в виде ПД, возникающего в плазматической мембране мышечного волокна, на мембраны концевых цистерн - сопряжение возбуждения и сокращения (электромеханическое сопряжение): дигидропиридиновые рецепторы Т-трубочек регистрируют изменения МП и активируют рианодиновые рецепторы СР (Са2+-канал).
СР - модифицированная гладкая эндоплазматическая сеть - выполняет функцию депо кальция. Са2+-транспортирующие АТФазы
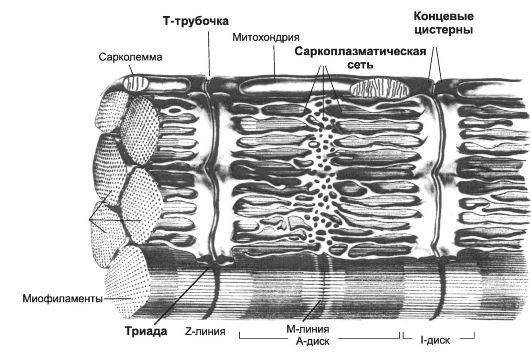
Рис. 7-3. Фрагмент скелетного мышечного волокна [11]. Цистерны СР окружают каждую миофибриллу. Т-трубочки подходят к миофибриллам на уровне границ между тёмными и светлыми дисками и вместе с концевыми цистернами СР образуют триады.
СР откачивают ионы кальция из саркоплазмы. Са2+-связывающий белок кальсеквестрин находится внутри СР. Кальциевые каналы, образованные рецепторами рианодина, высвобождают Ca2+ из депо в саркоплазму.
Депо Ca2+ (рис. 7-4, А). Цистерны гладкой эндоплазматической сети многих клеток предназначены для накопления в них Ca2+ пу- тём постоянного откачивания Ca2+ из цитоплазмы. Подобные депо существуют в скелетной и сердечной мышцах, нейронах, хромаффинных клетках, яйцеклетке, эндокринных клетках. Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на активность клеток и их пролиферацию, изменяя концен- трацию внутриклеточного посредника - Ca2+. Например, услови-
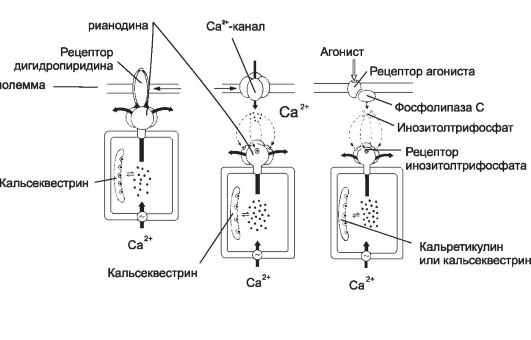
Рис. 7-4. Механизм высвобождения Ca2+ из цистерн саркоплазматического ретикулума [11]. А - рецептор рианодина в мембране цистерны связан с Ca2+-каналом. Работу канала контролируют рецепторы дигидропиридина плазмолеммы, в ответ на деполяризацию активирующие рецепторы рианодина, что и приводит к высвобождению Ca2+; Б - рецептор рианодина в мембране цистерны непосредственно не связан с белками плазмолеммы, но активируется Ca2+ при незначительном повышении концентрации этого катиона в цитозоле за счёт поступления в клетку через потенциалзависимые Ca2+-каналы; В - Ca2+ освобождается из цистерн при активации рецепторов ИТФ. Этот второй посредник образуется при участии фосфолипазы C в ответ на взаимодействие агониста со своим рецептором в плазмолемме.
ем сокращения мышечных элементов является резкое повышение концентрации Ca2+ в цитозоле. Для этого необходимо накопление Ca2+ в специальных депо, образованных Ca2+-запасающими цистернами СР. Внутри цистерн находятся Ca2+-связывающие белки. В мембрану цистерн-депо Ca2+ встроены Ca2+-насос и Ca2+-канал. Цистерны содержат также низкомолекулярные фосфопротеины, регулирующие захват Ca2+ (например, фосфоламбан СР ГМК и сердечной мышцы).
• Ca2+-связывающие белки внутри цистерн (кальсеквестрин, кальретикулин и др.) непрочно связаны с Ca2+. Кальсеквестрин - главный Ca2+-связывающий белок СР волокон поперечнополосатой мышцы и некоторых ГМК. Одна молекула кальсеквестрина связывает приблизительно 50 ионов Ca2+. Кальретикулин содержится в СР большинства ГМК и в эндоплазматическом ретикулуме немышечных клеток.
• Ca^-насос, закачивающий Ca2+ внутрь цистерн, - Ca2+- АТФаза.
• Ca2+-канал, по которому Ca2+ выходит из цистерны в цитозоль по градиенту концентрации. Известно несколько типов Ca2+- каналов, в том числе управляемые рецепторами рианодина и
ИТФ.
Ф Рецепторы рианодина активируются двояко: через рецепторы дигидропиридина и через потенциалзависимые Ca2+- каналы.
Ф Рецепторы дигидропиридина встроены в клеточную мембрану и реагируют на изменения МП: изменение их конформации активирует рецепторы рианодина и приводит к высвобождению Ca2+ из депо (см. рис. 7-4, А). Подобный механизм функционирует в скелетных МВ.
Ф Изменения мембранного потенциала открывают потенциалзависимые Ca2+-каналы, в клетке незначительно повышается концентрация Ca2+. Этот Ca2+ активирует рецепторы рианодина, и запасённый в депо Ca2+ выходит в цитозоль. Этот механизм функционирует в нейронах и кардиомиоцитах.
Ф Кофеин также может открывать Ca2+-каналы, активируя рецепторы рианодина, но в то же время кофеин - мощный ингибитор рецепторов ИТФ, что нивелирует его эффект на рецепторы рианодина.
Ф Инозитолтрифосфат. Каналы в мембране цистерн открываются под действием ИТФ (рис. 7-4, В), образующегося при воздействии на клетку внешнего сигнала. Так, при взаимодействии ангиотензина со своим рецептором в плазматической мембране ГМК активируется фосфолипаза С и образуется ИТФ. Последний диффундирует в цитоплазме, связывается с рецепторами ИТФ в мембране цистерн гладкой эндоплазматической сети и открывает Ca2+-каналы. Этот механизм функционирует в овоцитах, лимфоцитах, ГМК и других клетках.
Иннервация
Двигательная и чувствительная соматическая иннервация МВ скелетных мышц осуществляется соответственно α- и γ-мотонейронами передних рогов спинного мозга и двигательных ядер черепных нервов и псевдоуниполярными чувствительными нейронами спинномозговых узлов и чувствительных ядер черепных нервов. Вегетативная иннервация МВ в скелетных мышцах не обнаружена, но ГМК стенки кровеносных сосудов мышц имеют симпатическую адренергическую иннервацию.
Двигательная иннервация
Каждое экстрафузальное МВ имеет прямую двигательную иннервацию - нервно-мышечные синапсы, образованные терми- нальными ветвлениями аксонов α-мотонейронов и специализированными участками плазмолеммы мышечного волокна (концевая пластинка, постсинаптическая мембрана). Экстрафузальные МВ входят в состав нейромоторных (двигательных) единиц и обеспечивают сократительную функцию мышц. Интрафузальные МВ образуют нервно-мышечные синапсы с эфферентными волокнами γ-мотонейронов.
• Двигательная единица включает один мотонейрон и группу иннервируемых им экстрафузальных МВ. Количество и размеры двигательных единиц в различных мышцах значительно варьируют. Поскольку при сокращении фазные МВ подчиняются закону «всё или ничего», то сила, развиваемая мышцей, зависит от количества активируемых (т.е. участвующих в сокращении МВ) двигательных единиц. Каждая двигатель-
ная единица образована только быстро сокращающимися или только медленно сокращающимися МВ (см. ниже).
• Полинейронная иннервация. Формирование двигательных единиц происходит в постнатальном периоде, а у плода мышечные волокна скелетных мышц иннервируются несколькими мотонейронами. Аналогичная ситуация возникает при денервации мышцы (например, при повреждении нерва) и последующей реиннервации МВ. Понятно, что в этих ситуациях страдает эффективность сократительной функции мышцы.
• Нервно-мышечный синапс. Физиология нервно-мышечных синапсов рассмотрена в главе 6 (см. рис. 6-2).
• Потенциал действия мышечного волокна. Природа и механизм возникновения ПД рассмотрены в главе 5. ПД МВ длится 1-5 мс, скорость его проведения по сарколемме, включая T-трубочки, составляет 3-5 м/с.
Чувствительная иннервация
Чувствительную иннервацию скелетных мышц осуществляют в основном проприорецепторы - мышечные веретёна, сухожильные органы Гольджи, чувствительные нервные окончания в капсуле суставов.
Мышечное сокращение
Сокращение мышцы происходит при поступлении по аксонам двигательных нейронов к нервно-мышечным синапсам волны возбуждения в виде нервных импульсов (ПД нервных волокон). Это непрямое сокращение (опосредованное нервно-мышечной синаптической передачей). Возможно и прямое сокращение мышцы. Под ним понимают сокращение групп МВ (мышечные подёргивания, фибрилляции), происходящее при возбуждении любого звена последовательности процессов после секреции нейромедиатора из терминалей аксона в нервно-мышечном синапсе. Последовательность этих процессов такова: (1) деполяризация постсинаптической мембраны и генерация ПД - (2) распространение ПД по плазмолемме МВ - (3) передача сигнала в триадах на СР - (4) выброс Ca2+ из СР - (5) связывание Ca2+ тропонином С тонких нитей - (6) взаимодействие тонких и толстых нитей (формирование мостиков), появление тянущего усилия и скольжение нитей относительно друг друга - (7) цикл взаимодействия нитей - (8) укоро-
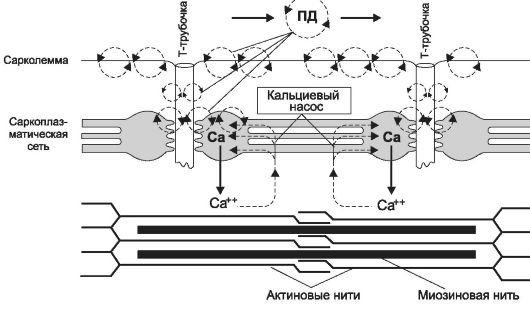
Рис. 7-5. Распространение потенциала действия по сарколемме мышечного волокна и выброс ионов кальция из цистерн саркоплазматического ретикулума.
чение саркомеров и сокращение МВ - (9) расслабление. Позиции 1-4 рассмотрены выше (см. рис. 7-3 и 7-4 и сопровождающий их текст), а этапы 2-4 представлены на рис. 7-5.
5. Связывание Ca2+ тонкими нитями. В покое взаимодействие тонких и толстых нитей невозможно, так как миозинсвязывающие участки F-актина заблокированы тропомиозином. При высокой концентрации Ca2+ эти ионы связываются с тропонином C и вызывают конформационные изменения тропомиозина, приводящие к разблокированию миозинсвязывающих участков (рис. 7-6).
6. Взаимодействие тонких и толстых нитей. В результате разблокирования миозинсвязывающих участков молекул актина головки миозина присоединяются к активным участкам тонкой нити и миозин действует как активная АТФ-аза. Образовавшиеся в ре- зультате гидролиза АТФ молекулы АДФ и неорганического фосфата остаются связанными с миозиновой головкой, изменяя её конформацию. Конформация комплекса миозин-АДФ-Фн создаёт тянущее усилие, - тонкие нити начинают скользить между толстыми (рис. 7-7). За счёт шарнирного участка в области шейки миозина происходит гребное движение, продвигающее тонкую нить
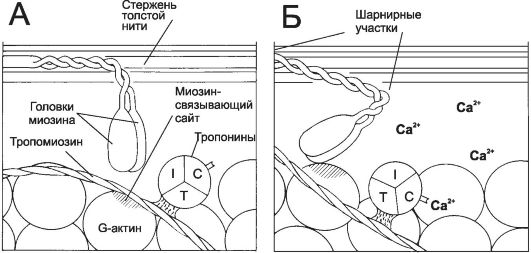
Рис. 7-6. Ca2+-зависимый механизм, регулирующий взаимодействие актина с миозином [11]. В покое миозинсвязывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Ca2+ связываются с тропонином С, а тропомиозин открывает миозинсвязывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити.
к центру саркомера. В результате происходит скольжение тонких нитей относительно толстых. После рабочего хода сродство миозина к АТФ повышается и головка миозина связывается с молекулой АТФ, вследствие чего миозин отделяется от актина. Последующий гидролиз АТФ восстанавливает конформацию глобулярной молекулы миозина к состоянию покоя, сохраняя энергию связи высокоэнергетического фосфата для нового цикла. Такая модель скользящих нитей была предложена Хью Хаксли.
7. Рабочий цикл. Каждый цикл взаимодействия тонких и толстых нитей имеет несколько стадий (рис. 7-8).
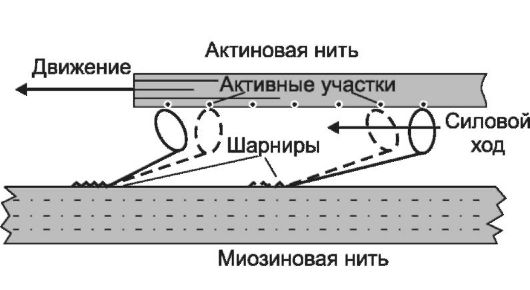
Рис. 7-7. Взаимодействие головки миозина с тонкой нитью и появление тянущего усилия.
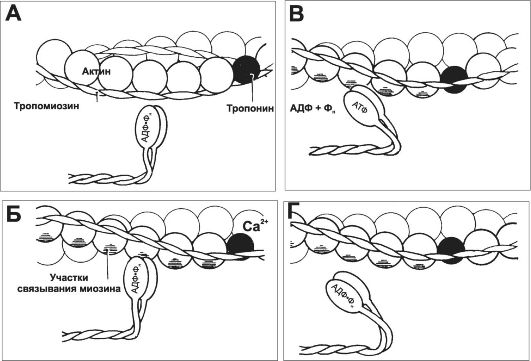
Рис. 7-8. Цикл взаимодействия тонких и толстых нитей [5]. А - исходное положение: головка миозина выстоит над толстой нитью (не показана). Б - благодаря наличию шарнира между тяжёлым и лёгким меромиозинами несущая АДФ и P. головка миозина прикрепляется к актину, происходит поворот головки миозина с одновременным растягиванием эластического компонента S2. В - из головки освобождаются АДФ и Фн, а последующая ретракция эластического компонента S2 вызывает тянущее усилие. Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина (Г). Гидролиз АТФ возвращает молекулу миозина в исходное положение (А).
8. Укорочение саркомера и сокращение мышечного волокна. Головка миозина совершает около пяти циклов в секунду. Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом гребные движения подтягивают тонкие нити к центру саркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая сокращение саркомера. Поскольку в процесс сокращения практически одномоментно вовлечены все саркомеры МВ, происходит его укорочение.
Энергетические потребности. Мышечное сокращение требует значительных энергетических затрат. Основной источник энергии - гидролиз макроэрга АТФ. В мышечных волокнах возможны три пути ресинтеза АТФ: креатинфосфатная система, гликолиз и аэробное окисление питательных веществ с образованием углекислого газа и воды. Гликоген запасается в саркоплазме в виде включений. Анаэробный гликолиз сопряжён с синтезом АТФ. Креатинфосфокиназа, связанная в области М-линии, катализирует перенос фосфата от фосфокреатина на АДФ с образованием креатина и АТФ. Миоглобин, как и Hb, обратимо связывает кислород. Запасы кислорода необходимы для синтеза АТФ при длительной непрерывной работе мышцы. На один рабочий цикл затрачивается 1 молекула АТФ. В МВ концентрация АТФ равна 4 ммоль/л. Такого запаса энергии достаточно, чтобы поддерживать сокращение не более 1-2 с.
Механика мышечного сокращения
Скелетная мышца может развивать при сокращении усилие порядка 3-4 кг на 1 см2. Многие мышцы имеют относительно большое поперечное сечение и могут развивать огромную силу. Общее напряжение, которое могут развить все мышцы человека, составляет приблизительно 25 тонн. Развиваемая мышечная сила существенно зависит от внешних механических условий работы мышцы. Различают изотоническое и изометрическое сокращение.
• Изометрическое сокращение: мышца не укорачивается во время сокращения, поскольку мышечного усилия недостаточно для преодоления нагрузки.
• Изотоническое сокращение: мышца укорачивается, а напряжение остаётся постоянным под воздействием постоянной нагрузки.
• Комбинация изотонического и изометрического компонентов - реальность для большинства сокращений. Изометрический период продолжается до тех пор, пока мышца не разовьёт силу, достаточную для передвижения груза. С этого времени начинается изотоническая фаза сокращения. Чем больше величина нагрузки на мышцы, тем меньше скорость и степень укорочения и тем продолжительнее изометрическая фаза.
• Одиночное мышечное сокращение. В изометрических условиях одиночный стимул вызывает рост сократительного напряжения, которое затем снова падает (рис. 7-9, А). Одиночное мышечное сокращение имеет следующие фазы:
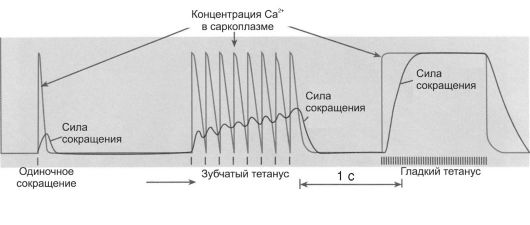
Рис. 7-9. Суммация мышечных сокращений [4]. А - одиночное мышечное сокращение; Б - зубчатый тетанус; В - гладкий тетанус.
Φ латентный период - промежуток между моментами подачи
• стимула и началом сокращения (2 мс); Φ фаза укорочения (0,05 с); Φ фаза расслабления (0,07 с). Суммация мышечных сокращений - сложение сил отдельных сокращений, в результате которого увеличивается общая интенсивность сокращения. При слишком частой стимуляции мышцы частотная суммация обусловливает появление тетануса - длительного и значительного по амплитуде сокращения мышцы (рис. 7-9 Б, В). Во время тетанического сокращения в мышце многократно возникают ПД, обеспечивающие продолжительный выход ионов Са2+ из саркоплазматического ретикулума и поддерживающие высокий уровень кальция, соединенного с тропонином С. Цикл образования поперечных мостиков беспрерывно повторяется и сокращение поддерживается до тех пор, пока не прекратится возбуждение. Зубчатый тетанус возникает при относительно редкой частоте стимуляции (10-15 Гц) и отражает неполную суммацию мышечных сокращений. Каждое следующее сокращение возникает в фазе расслабления предыдущего сокращения. Гладкий тетанус возникает при очень частой стимуляции (20 и более Гц) и отражает полную суммацию мышечных сокращений: каждое последующее сокращение возникает в фазе сокращения или на пике предыдущего сокращения.
Типы мышечных волокон
Скелетные мьшщы и образующие их МВ различаются по множеству параметров: по скорости сокращения, утомляемости, диаметру, цвету и т.д. Например, цвет мышцы может быть обусловлен рядом причин: количеством митохондрий, содержанием миоглобина, плотностью кровеносных капилляров. Традиционно выделяют красные и белые, а также медленные и быстрые мышцы и МВ. Каждая мышца - гетерогенная популяция разных типов МВ. Тип мышцы определяют исходя из преобладания в ней конкретного типа МВ. Применяют следующие классификационные критерии ти- пов МВ: характер сокращения (фазные и тонические), скорость сокращения (быстрые и медленные) и тип окислительного обмена (окислительные - красные и гликолитические - белые). На практике результаты типирования МВ комбинируются. Различают три типа МВ - быстро сокращающиеся красные, быстросокращающиеся белые и медленно сокращающиеся промежуточные. Быстрые МВ приспособлены для выполнения быстрых и мощных сокращений (например, прыжки и бег на короткие дистанции). Медленные МВ адаптированы к продолжительной мышечной деятельности: например, к удержанию тела в выпрямленном положении против сил гравитации или к бегу на марафонскую дистанцию. В зависимости от преобладания в мышцах конкретного типа МВ скелетные мышцы относятся к «красным» и «белым» либо к «быстрым» и «медленным». Таким образом, каждая мышца уни- кальна по спектру входящих в её состав типов МВ. Этот спектр генетически детерминирован (отсюда практика типирования МВ при отборе спортсменов-бегунов - спринтеров и стайеров).
Контроль фенотипа мышечных волокон. Множество факторов (интактная иннервация, уровень физической активности, гормоны) поддерживает унаследованный спектр МВ, уникальный для каждой мышцы. После повреждения нерва скелетная мышца подвергается гипотрофии (уменьшение объёма МВ, разрастание соединительной ткани, увеличение чувствительности к ацетилхолину). Регенерация нерва восстанавливает нормальное состояние мышц. Известно также, что все МВ одной и той же двигательной (нейромоторной) единицы относятся к одному типу. Эти и мно- гие другие наблюдения и эксперименты заставили заключить, что мотонейроны оказывают на иннервируемые ими МВ нейротрофи-
ческий эффект. Факторы реализации нейротрофического эффекта не установлены.
ГЛАДКАЯ МЫШЦА
Типы гладких мышц
Различают два типа гладких мышц: мультиунитарные (множественные) и висцеральные или унитарные (единичные).
• Унитарные гладкие мышцы состоят из больших масс ГМК (от сотен до тысяч), сокращающихся вместе, как единое целое. ГМК объединены в пласты или в пучки, их клеточные мембраны соединены во многих точках друг с другом щелевыми контактами, через которые свободно проходят ионы, различные вещества и, естественно, ПД. Такого типа взаимодействие характерно для функционального синцития. Мышцы такого рода обнаружены во всех внутренних органах, включая кишечник, желудок, пищевод, желчные протоки, мочеточники, матку, мочевой пузырь, кровеносные и лимфатические сосуды, поэтому их часто называют висцеральными гладкими мышцами. В большинстве случаев иннервирующие мышцу нервные волокна (см. рис. 7-11) не имеют прямого контакта с ГМК и образуют так называемые диффузные соединения, которые выделяют медиатор в матрикс, окружающий ГМК. Более того, имеются целые пласты ГМК, иннервируемые только снаружи.
• Мультиунитарные гладкие мышцы состоят из ГМК, сокращающихся независимо друг от друга. В мультиунитарной гладкой мышце каждая ГМК рассматривается как независимая единица, и ответ целой мышцы является результатом реакции многих отдельных клеток. Примером мультиунитарных гладких мышц являются ресничная мышца глаза, мускулатура семявыносящего протока, гладкие мышцы волосяных мешочков. В мультиунитарных гладких мышцах варикозные расширения аксонных терминалей располагаются непосредственно на мембране ГМК, образуя контактные соединения.
Гладкомышечные клетки
Гладкомышечные клетки (ГМК) в составе гладких мышц формируют мышечную стенку полых и трубчатых органов, контролируя их моторику и величину просвета. Регуляцию сократительной активности ГМК осуществляют двигательная вегетативная иннер-
вация и множество гуморальных факторов. В ГМК отсутствует поперечная исчерченность, так как миофиламенты: тонкие (актиновые) и толстые (миозиновые) нити - не образуют характерных для поперечнополосатой мышечной ткани миофибрилл. Заострён- ными концами ГМК вклиниваются между соседними клетками и образуют мышечные пучки, в свою очередь формирующие слои гладкой мускулатуры. Встречаются и единичные ГМК (например, в субэндотелиальном слое сосудов).
• Морфология ГМК (рис. 7-10). Форма ГМК - вытянутая веретеновидная, часто отростчатая. Длина ГМК от 20 мкм до
• Сократительный аппарат. Стабильные актиновые нити ориентированы преимущественно по продольной оси ГМК и прикрепляются к плотным тельцам. Сборку толстых (миозиновых) нитей и взаимодействие актиновых и миозиновых нитей активируют ионы Са2+, поступающие из кальциевых депо - СР. Непременные компоненты сократительного аппарата - кальмодулин (Са2+-связывающий белок), киназа и фосфатаза лёгкой цепи миозина гладкомышечного типа.
• Депо Ca2+ - совокупность длинных узких трубочек (СР и множества находящихся под сарколеммой мелких пузырьков - кавеол). Са2+-АТФаза постоянно откачивает Са2+ из цитоплазмы ГМК в СР. Через Са2+-каналы кальциевых депо ионы Са2+ поступают в цитоплазму ГМК. Активация Са2+-каналов происходит при изменении МП и при помощи рецепторов рианодина и ИТФ (см. рис. 7-4).
• Плотные тельца. В саркоплазме и на внутренней стороне плазмолеммы находятся плотные тельца - аналог Z-линий поперечнополосатой мышечной ткани. Плотные тельца содержат α-актинин и служат для прикрепления тонких (актиновых) нитей.
• Щелевые контакты в мышечных пучках связывают соседние ГМК. Эти нексусы необходимы для проведения возбуждения (ионный ток), запускающего сокращение ГМК.
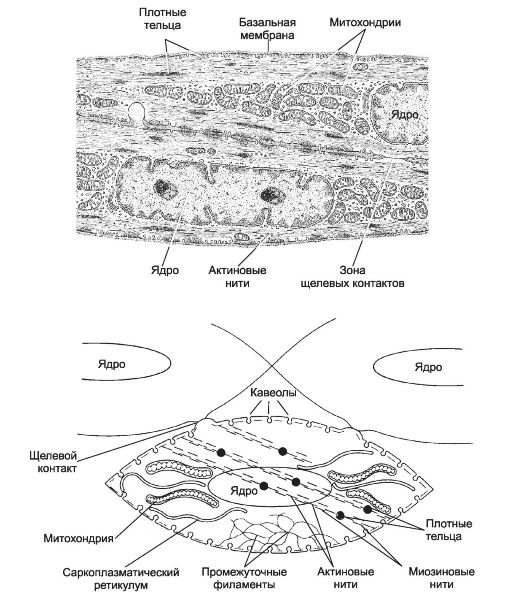
Рис. 7-10. Гладкомышечные клетки [11]. Слева - морфология ГМК. Центральное положение в ГМК занимает крупное ядро. У полюсов ядра находятся митохондрии и СР. Актиновые миофиламенты, ориентированные вдоль продольной оси клетки, прикреплены к плотным тельцам. Миоциты формируют между собой щелевые контакты. Справа - сократительный аппарат гладкомышечной клетки. Плотные тельца содержат α-актинин, это аналоги Z-линий поперечнополосатой мышцы; в саркоплазме плотные тельца связаны сетью промежуточных филаментов. Актиновые нити прикреплены к плотным тельцам, миозиновые нити формируются только при сокращении.
• Иннервация (рис. 7-11). ГМК иннервируют симпатические (адренергические) и отчасти парасимпатические (холинергические) нервные волокна. Нейромедиаторы диффундируют из варикозных терминальных расширений нервных волокон в межклеточное пространство. Последующее взаимодействие нейромедиаторов с их рецепторами в плазмолемме вызывает сокращение либо расслабление ГМК. В составе многих гладких мышц, как правило, иннервированы (точнее, находятся рядом с варикозными терминалями аксонов) далеко не все ГМК. Возбуждение ГМК, не имеющих иннервации, происходит двояко: в меньшей степени - при медленной диффузии нейромедиаторов, в большей степени - посредством щелевых контактов между ГМК.
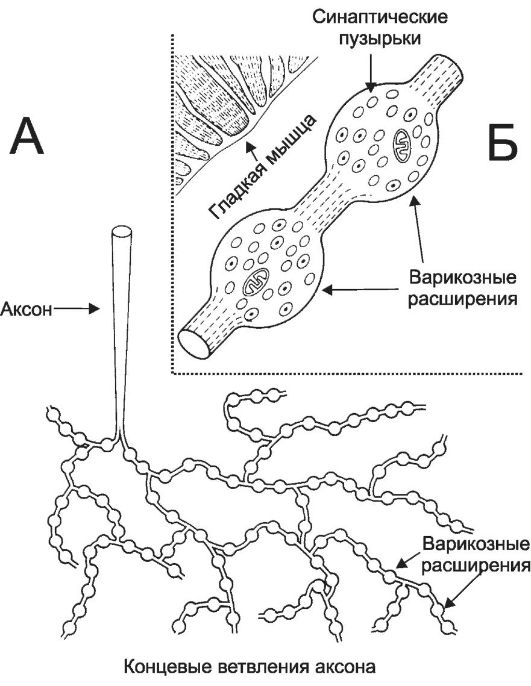
Рис. 7-11. Вегетативная иннервация ГМК. А - терминальные разветвления аксона вегетативного нейрона, содержащие многочисленные расширения - варикозности; Б - варикозные расширения, содержащие синаптические пузырьки.
• Гуморальная регуляция. В мембрану разных ГМК встроены рецепторы ацетилхолина, гистамина, атриопептина, ангиотензина, адренорецепторы и множество других. Агонисты, связываясь со своими рецепторами в мембране ГМК, вызывают сокращение или расслабление ГМК.
Φ Сокращение ГМК. Агонист (адреналин, норадреналин, ангиотензин, вазопрессин) через свой рецептор активирует G-белок (G ), который в свою очередь активирует фосфолипазу С. Фосфолипаза С катализирует образование инозитолтрифосфата (ИТФ). Инозитолтрифосфат стимулирует высвобождение Са2+ из кальциевых депо. Повышение концентрации Са2+ в саркоплазме вызывает сокращение ГМК.
Φ Расслабление ГМК. Агонист (атриопептин, брадикинин, гистамин, VIP) связывается с рецептором и активирует G-белок (Gs), который в свою очередь активирует аденилатциклазу. Аденилатциклаза катализирует образование цАМФ. цАМФ усиливает работу кальциевого насоса, закачивающего Са2+ в депо кальция. В саркоплазме снижается концентрация Са2+, и ГМК расслабляется.
Φ Характер ответа определяют рецепторы. ГМК разных органов различно реагируют (сокращением либо расслаблением) на одни и те же лиганды. Это объясняется тем, что существуют разные подтипы конкретных рецепторов с характерным распределением в разных органах.
Механизм сокращения
В ГМК, как и в других мышечных элементах, работает актомиозиновый хемомеханический преобразователь, но АТФазная ак- тивность миозина в ГМК приблизительно на порядок величины ниже активности АТФазы миозина поперечнополосатой мышцы. Отсюда, а также из факта лабильности миозиновых нитей (их постоянная сборка и разборка при сокращении и расслаблении соответственно) вытекает важное обстоятельство: в ГМК медленно развивается и длительно поддерживается сокращение. При поступлении сигнала к ГМК (через рецепторы плазмолеммы и щелевые контакты, а также при растяжении ГМК) сокращение ГМК запускают ионы кальция, поступающие из кальциевых депо. Рецептор Са2+ - кальмодулин. Таким образом, увеличение содержания Ca2+ в миоплазме - основной фактор сокращения ГМК.
• Регуляция Ca2+ в миоплазме ГМК - процесс, начинающийся с изменения мембранного потенциала (МП) и/или связывания рецепторов плазмолеммы с их лигандами (регистрация сигнала) и заканчивающийся изменением режима работы Са2+- каналов в депо кальция (открытое или закрытое состояние Са2+-каналов).
Φ Изменения мембранного потенциала ГМК происходят при передаче возбуждения от клетки к клетке через щелевые контакты, а также при взаимодействии агонистов (нейромедиаторы, гормоны) с их рецепторами. Изменения МП открывают потенциалзависимые Са2+-каналы плазмолеммы, и в цитоплазме ГМК повышается концентрация Са2+. Этот Са2+ активирует рецепторы рианодина кальциевых депо (см. рис. 7-4).
Φ Рецепторы плазмолеммы ГМК многочисленны. При взаимодействии агонистов с их рецепторами (например, нор- адреналина, гистамина) на внутренней поверхности плазмолеммы активируется фосфолипаза С и образуется второй посредник - инозитолтрифосфат. ИТФ активирует рецепторы ИТФ кальциевых депо (см. рис. 7-5).
Φ Активация рецепторов рианодина и ИТФ в кальциевых депо открывает их Са2+-каналы, и поступающий в миоплазму Са2+ связывается с кальмодулином.
• Сокращение и расслабление ГМК
Φ Сокращение. При связывании Са2+ с кальмодулином (аналог тропонина С поперечнополосатой мышечной ткани) проис- ходит фосфорилирование лёгкой цепи миозина при помощи киназы лёгких цепей - сигнал для сборки миозиновых нитей и их последующего взаимодействия с тонкими нитями. Фосфорилированный (активный) миозин прикрепляется к актину, головки миозина изменяют свою конформацию, и совершается одно гребное движение, т.е. втягивание актиновых миофиламентов между миозиновыми. В результате гидролиза АТФ разрушаются актин-миозиновые связи, головки миозина восстанавливают свою конформацию и готовы к образованию новых поперечных мостиков. Продолжающаяся стимуляция ГМК поддерживает формирование новых миозиновых миофиламентов и вызывает дальнейшее сокращение клетки. Таким образом, сила и продолжитель-
ность сокращения ГМК определяются концентрацией свободного Са2+, окружающего миофиламенты. Φ Расслабление. При уменьшении содержания Са2+ в миоплазме (постоянное откачивание Са2+ в депо кальция) происходит дефосфорилирование лёгкой цепи миозина при помощи фосфатазы лёгких цепей миозина. Дефосфорилированный миозин теряет сродство к актину, что предотвращает обра- зование поперечных мостиков. Расслабление ГМК заканчивается разборкой миозиновых нитей.
• Время сокращения и расслабления. Прикрепление миозиновых мостиков к актину, их освобождение от актина и новое прикрепление для очередного цикла в ГМК намного (в 10-300 раз) медленнее, чем в скелетной. Фазы укорочения и расслабления ГМК длятся в среднем от 1 до 3 с, что в десятки раз продолжительнее сокращения скелетной мышцы.
• Сила сокращения гладкой
мышцы, несмотря на небольшое количество миозиновых нитей и замедленный
цикл поперечных мостиков, подчас превышает силу, развиваемую скелетной
мышцей. В расчёте на поперечное сечение сила гладкой мышцы составляет от
4 до
• Энергия, необходимая для того, чтобы поддерживать сокращение гладкой мышцы, составляет от 1/10 до 1/300 по сравнению со скелетной мышцей. Подобного рода экономное использование энергии важно, поскольку многие внутренние органы: мочевой пузырь, желчный пузырь и др. - поддерживают тоническое сокращение практически постоянно.
• Мембранный потенциал. В состоянии покоя МП ГМК колеблется от -50 до -60 мВ.
• Потенциал действия. В ГМК внутренних органов (моноунитарные гладкие мышцы) можно зарегистрировать два вида ПД - спайковый ПД и ПД с плато (рис. 7-12).
Φ Спайковые ПД, показанные на рис. 7-12, Б, наблюдаются в ГМК многих внутренних органов. Продолжительность потенциала колеблется от 10 до 50 мс, амплитуда (в зависимости от исходного МП) составляет от 30 до 60 мВ. ПД могут вызываться различными путями (например, электростиму-
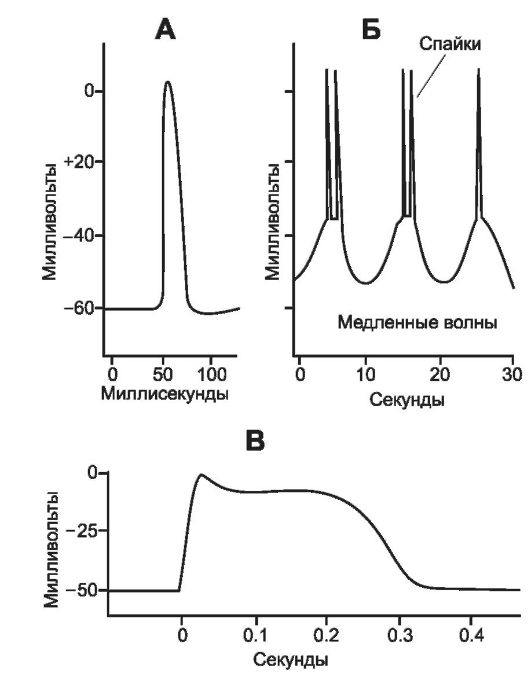
Рис. 7-12. Потенциалы действия в гладкой мышце.
А - ПД в гладкой мышце, вызванный внешним стимулом; Б - повторные спайковые ПД, вызванные медленными ритмическими электрическими волнами, которые наблюдаются в спонтанно сокращающейся гладкой мышце стенки кишечника; В - ПД с плато (ГМК миометрия).
ляцией, действием гормонов, нервной стимуляцией, растяжением мышцы или возникать в результате спонтанной генерации самой ГМК).
ПД с плато (рис. 7-12, В) отличаются от обычных ПД тем, что после достижения пика потенциал выходит на плато, которое длится до 1 с и более, и только затем наступает фаза реполяризации. Физиологическое значение плато за- ключается в необходимости некоторых видов гладких мышц развивать продолжительное сокращение (например, в матке, мочеточниках, лимфатических и кровеносных сосудах).
Ионный механизм ПД. Ключевую роль в возникновении и развитии ПД играют не Na+-каналы, а потенциалзависимые Ca2+-каналы.
Спонтанная электрическая активность. Некоторые гладкие мышцы способны самовозбуждаться в отсутствие внешних стимулов, что связано с медленными постоянными колеба-
• ниями МП (медленные ритмические волны). Если медленные волны достигают пороговой величины (свыше -35мВ), то они вызывают ПД, которые, распространяясь по мембранам ГМК, вызывают сокращения. Рис. 7-12, Б демонстрирует эффект возникновения на вершине медленных волн ПД, которые вызывают серии ритмических сокращений в мускулатуре стенки кишечника. Это дало основание назвать медленные ритмические волны пейсмейкерными волнами. Влияние растяжения на спонтанную активность. Растяжение гладкой мышцы, произведённое с определённой скоростью и достаточно интенсивно, вызывает появление спонтанных ПД. Было обнаружено, что в мембране ГМК существуют специальные Са2+-каналы, активируемые растяжением. Возможно, это является результатом суммации двух процессов - медленных ритмических волн и деполяризации мембраны, вызванной собственно растяжением. Как правило, кишка в ответ на интенсивное растяжение автоматически ритмически сокращается. В заключение приведём последовательность этапов сокращения и расслабления гладкой мышцы: сигнал - повышение концентрации ионов Ca2+ в саркоплазме - связывание Са2+с кальмодулином - фосфорилирование лёгких цепей миозина и сборка миозиновой нити - соединение миозина с актином, сокращение - дефосфорилирование миозина фосфатазами - удаление Ca2+ из саркоплазмы - расслабление или удерживаемое запирательным механизмом сокращение.
Обобщение главы
Сократительный аппарат скелетной мышцы состоит из толстых (содержащих миозин) и тонких (содержащих актин) миофиламен- тов, скомпонованных во множество упорядоченных структур - саркомеров.
Сокращение - результат ферментативной реакции между миофиламентами. Биохимические реакции в цикле поперечных мостиков используют АТФ как метаболическое топливо.
Нервно-мышечное соединение - специализированный химический синапс, который связывает импульсы моторного нерва с активацией мышцы.
Возбуждение мембраны скелетного мышечного волокна вызывает его сокращение благодаря действию кальция на тропонинрегуляторный комплекс, расположенный на тонких филаментах.
Ионы кальция, хранившиеся в саркоплазматическом ретикулуме, поступают к актиновым и миозиновым филаментам в результате деполяризации мембран Т-трубочек. Присоединение ионов кальция к тропонину является пусковым моментом взаимодействия между филаментами актина и миозина. Расслабление наступает тогда, когда кальций закачивается обратно в саркоплазматический ретикулум.
Сила сокращения регулируется количеством стимулируемых нейромоторных единиц и частотой стимуляции. Короткие одиночные сокращения соответствуют вздрагиванию (рывку), суммированные сокращения являются тетаническими.
Изометрическое сокращение происходит при постоянной длине мышцы; изотоническое сокращение совершается в условиях постоянной силы.
Метаболическая и структурная адаптация служит в скелетной мышце разным задачам. Красные мышечные волокна работают в аэробном режиме; белые мышцы используют анаэробный режим.
Гладкая мышца предназначена для медленных и продолжительных сокращений. Она является важной составной частью внутренних органов. В гладкомышечных клетках отсутствует регулярная ультрастуктура, присущая миоцитам скелетной мышцы, но они обладают актин-миозиновой сократительной системой.
Регуляция сокращения гладкой мышцы контролируется ионами кальция, которые обеспечивают фосфорилирование лёгкой цепи молекулы миозина при помощи фермента киназы лёгких цепей миозина. Это спобствует взаимодействию миозина с актином в цикле поперечных мостиков.
Гладкомышечные клетки электрически взаимосвязаны, и возбуждение распространяется от клетки к клетке через всю мышечную ткань. Нервы могут инициировать сокращение или изменять его продолжительность и интенсивность.
Расслабление гладкой мышцы происходит за счет снижения концентрации кальция в цитоплазме и дефосфориляции миозина при помощи фермента фосфатазы.
Резервуарная функция гладкой мышцы осуществляется благодаря её вязкоэластическим свойствам, которые позволяют ей удерживать большие объёмы без развития высокого внутреннего давления.