Нормальная физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. 2010. - 832 с.
|
|
|
|
ГЛАВА 28. ЗАЩИТНЫЕ СИСТЕМЫ ОРГАНИЗМА
Организм человека имеет множество механизмов защиты от различных вредных агентов: от неживых веществ, таких, как токсины, химикалии или инородные частицы, и от живых организмов, в том числе (и в первую очередь) от возбудителей инфекционных болезней - вирусов, бактерий, грибов, простейших и гельминтов. Защиту осуществляют две системы: неспецифическая (сопротивляемость организма) и специфическая (иммунная система).
НЕСПЕЦИФИЧЕСКАЯ ЗАЩИТА ОРГАНИЗМА
Линии защиты. Сопротивляемость организма складывается из двух линий защиты. Поверхностные анатомические барьеры (эпителий кожи и слизистых оболочек), находящиеся на границе внутренней и внешней среды, - первая линия неспецифической защиты. Физико-химические и биологические свойства эпителия, а также выделяемые на поверхность эпителия секреторные вещества и клетки не позволяют патогенам попасть во внутреннюю среду организма. Если же патоген преодолевает этот поверхностный барьер и оказывается во внутренней среде организма, его встречает комплекс клеточных и гуморальных неспецифических факторов. Это вторая линия неспецифической защиты, к которой относятся фагоцитирующие клетки, комплемент, интерфероны, кинины и некоторые другие вещества, а также естественные антитела (антигеннезависимые) и естественные киллеры. В совокупности обе линии защиты составляют врождённые, естественно присущие организму, т.е. конституциональные факторы.
Эпителий
Эпителий кожи и слизистых оболочек эффективно защищает организм человека от различных патологических воздействий.
К факторам, определяющим защитную функцию эпителия, относятся целостность и толщина пласта эпителия, постоянная и бы- страя его регенерация, характер его проницаемости, специализированные структуры на поверхности эпителия, секреция различных веществ, клетки эпителия, выполняющие защитную функцию.
• Целостность эпителия. Неповреждённый эпителий для патогенов, как правило, непроницаем. Необходимое условие проникновения многих патогенов во внутреннюю среду - нарушение целостности эпителия (например, микротравмы) или наличие на поверхности эпителиальных клеток рецепторов для прикрепления ряда патогенов.
• Регенерация эпителия. Любой поверхностный (покровный) эпителий характеризуется быстрой и эффективной регенерацией из собственных стволовых клеток, что обеспечивает восстановление целостности пласта эпителия.
• Толщина эпителия. Кожа с поверхности покрыта эпидермисом - толстым многослойным эпителием, что само по себе является барьером. Многослойный эпителий покрывает также изнутри ротовую полость, глотку, пищевод, мочевыводящие пути, влагалище, выводные протоки желёз с внешней секрецией.
• Проницаемость эпителия. Эпидермис и другие типы многослойного эпителия непроницаемы ни для полярных, ни для неполярных веществ (см. подробнее гл. 2). Проницаемость однослойного эпителия ЖКТ, дыхательных путей, респираторного отдела лёгких, маточных труб, матки определяется характером их строения (см. гл. 2) и выполняемыми ими функциями (см. соответствующие главы).
• Характер поверхности эпителия. Эпидермис покрыт с поверхности сплошным слоем ороговевших кератиноцитов, этот слой полностью блокирует проникновение клеток, полярных и неполярных веществ. В то же время на поверхности однослойного эпителия слизистых оболочек всегда находится слизь, предупреждающая повреждение пласта эпителия и фиксирующая посторонние частицы. Во многих слизистых оболочках на поверхности некоторых клеток имеются мерцательные реснички, обеспечивающие перемещение слизи. В нижних отделах воздухоносных путей и в респираторном отделе лёгкого слизи нет, но поверхность эпителия покрыта
слоем сурфактанта - поверхностно-активного вещества, способного фиксировать и уничтожать бактерии.
• Секрет. На поверхность эпидермиса поступает секрет сальных желёз, усиливающий непроницаемость слоя ороговевших кератиноцитов, а на поверхность эпителия слизистых оболочек - бактерицидные и бактериостатические вещества (например, лизоцим, миелопероксидаза, лактоферрин) и молекулы секреторного IgA. В некоторых органах секретируются органические (молочная, кожа) и неорганические (соляная, желудок) кислоты или бикарбонат (двенадцатиперстная кишка), существенно изменяющие pH, что губительно для многих микроорганизмов.
• Клетки иммунной системы в эпителии. В эпидермисе 3% всех клеток составляют происходящие из костного мозга антигенпредставляющие клетки Лангерханса, относящиеся к системе мононуклеарных фагоцитов. На поверхности альвеол лёгкого всегда мигрируют альвеолярные макрофаги. Между эпителиальными клетками слизистой оболочки ЖКТ и воздухоносных путей содержатся лимфоциты, выполняющие иммунную защитную функцию.
Фагоцитоз
Фагоцитоз - процесс поглощения фагоцитами микроорганизмов, других клеток, фрагментов некротизированной ткани и чуже- родных частиц. Если поглощение микроорганизмов заканчивается их внутриклеточным перевариванием, то фагоцитоз рассматривают как завершённый. В противном случае процесс называют незавер- шённым фагоцитозом. Фагоциты выполняют не только заигитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры). К фагоцитам относятся микрофаги - клетки миелопоэтического ряда (полиморфно-ядерные лейкоциты) и макрофаги - клетки макрофагально-моноцитарной системы (моноциты, тканевые макрофаги, клетки Лангерханса эпидермиса, микроглия ЦНС, альвеолярные и перитонеальные макрофаги и др.). Механизмы активации микро- и макрофагов в принципе одинаковы. Активирующими стимулами неспецифического (конституционального) фагоцитоза могут быть бактериальные продукты (например, липополисахариды, N-формиловые пептиды и др.), компоненты
комплемента (например, С3 и С5) и многие цитокины. Фагоцитоз состоит из четырёх последовательных стадий: хемотаксиса, прикрепления к объекту, его поглощения и уничтожения.
Система комплемента
• Система комплемента - группа по меньшей мере 26 сывороточных белков (компоненты комплемента), опосредующих защитные реакции при участии гранулоцитов и макрофагов. Компоненты комплемента обозначаются буквами латинского алфавита C, B и D с добавлением арабской цифры (номер компонента) и дополнительных строчных букв. Компоненты системы участвуют в реакциях свёртывания крови, вызывают лизис (разрушение) бактерий и инфицированных вирусами клеток. В норме компоненты системы находятся в неактивной форме. Активация комплемента приводит к поочередному (каскадному) появлению его активных компонентов в серии протеолитических реакций, стимулирующих защитные процессы. Основные функции компонентов комплемента в защитных реакциях - стимуляция фагоцитоза и нарушение целостности клеточных стенок, а также индукция синтеза медиаторов воспалительного ответа. Активация компонентов комплемента может происходит по классическому и альтернативному пути. Классический путь. Активацию комплемента по классическому пути осуществляют комплексы «Аг-АТ». При активации происходит поочередное образование всех девяти компонентов (от С1 до С9). Компоненты классического пути обозначаются латинской буквой «С» и арабскими цифрами (С1, С2... С9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (Clq, C3b и т.д.). Активированные компоненты выделяют чертой над литерой, инактивированные компоненты - буквой «i» (например, iC3b). Первоначально с комплексом Аг-АТ взаимодействует С1 (субкомпоненты C1q, C1r, C1s), затем к ним присоединяются «ранние» компоненты С4, С2 и С3. Они активируют компонент С5, прикрепляющийся к мембране клетки-мишени (бактерии, опухолевые или инфицированные вирусами клетки) и запускающий образование литического комплекса (С5Ь, С6, С7, С8 и С9). Иначе он называется мембраноповреждающим (мембраноатакующим) комплексом, так как его образование на мембране вызывает разрушение клетки.
• Альтернативный путь. Активация комплемента по альтернативному пути происходит без участия АТ и задолго до их появления. Факторы альтернативного пути имеют буквенное обозначение: P (пропердин), B и D (ферменты системы комплемента). Запуск альтернативного пути осуществляется активацией компонента С3, взаимодействующего с факторами B и D. Затем через образование компонента С5 (но без участия С1, С2 и С4) альтернативный путь также завершается образованием на поверхности клеток-мишеней мембраноповреждающего комплекса. Альтернативный путь активируется микробными продуктами (эндотоксины бактерий, вирусы).
Другие факторы неспецифической резистентности
• Естественные киллеры. Помимо фагоцитирующих клеток, важную роль в быстром реагировании организма на чужеродные агенты играют естественные киллеры (NK-клетки). Эту популяцию составляют большие зернистые лимфоциты, элиминирующие опухолевые клетки, а также клетки, инфицированные вирусами, некоторыми бактериями и простейшими. NK-клетки не имеют основных маркёров лимфоцитов (поэтому их также называют нулевыми лимфоцитами), но экспрессируют дифференцировочные CD2, CD56 и CD16 (рецептор Fc-фрагмента АТ) Аг. В отличие от цитотоксических лимфоцитов, способность NK-клеток к цитолизу связана с самостоятельным распознаванием «своё-чужое» на поверхности мишени. NK-клетки уничтожают клетку-мишень после установления с ней прямого контакта при помощи специальных белков - перфоринов. Перфорины встраиваются в мембрану чужеродной или трансформированной клетки, образуя в ней «дыру», приводящую к необратимому и гибельному выравниванию ионного состава между цитоплазмой и внешней средой. Активность NK-клеток регулируют цитокины (γ-ИФН и ИЛ-2 усиливают их цитолитическую активность). Наряду с макрофагами, нейтрофилами и эозинофилами они также участвуют в антителозависимом клеточно-опосредованном цитолизе.
• Естественные АТ («антигеннезависимые», «неспецифические» АТ) составляют до 7% общего количества Ig в сыворотке крови неиммунизированных людей. Их происхождение связыва-
• ют с ответом иммунной системы на Аг нормальной микрофлоры. В эту же группу входят АТ, длительно циркулирующие после выздоровления от инфекционного заболевания. Часть пула подобных АТ синтезируется параллельно с образованием специфических АТ. Эти АТ низкоспецифичны, но способны перекрёстно реагировать с широким спектром Аг. Естественные АТ вызывают агглютинацию микробов, их разрушение (в присутствии комплемента), нейтрализуют вирусы и токсины, а также стимулируют фагоцитарные реакции (через опсонизацию возбудителей). Интерфероны. Система интерферона (ИФН) - важнейший фактор неспецифической резистентности организма человека. Главнейшие их функции - антивирусная, противоопухолевая, иммуномодулирующая и радиопротективная. Различают три ИФН: α-ИФН синтезирует лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН); β-ИФН синтезирует фибробласты (ранее был известен как фибробластный ИФН); γ-ИФН - продукт стимулированных Т-лимфоцитов, NK-клеток и, возможно, макрофагов (ранее был известен как иммунный ИФН). По способу образования различают ИФН типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и рядом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин). ИФН видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные продукты, которые схожи по структуре и свойствам, но не способны проявлять перекрёстный антивирусный эффект (т.е. действовать в условиях организма другого вида). Φ Механизм антивирусного действия. ИФН индуцируют «антивирусное состояние» клетки (резистентность к проникновению или блокада репродукции вирусов). Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект ИФН не направлен против конкретных вирусов, т.е. ИФН не обладают вирусоспецифичностью. Этим объясняется их универсально широкий спектр антивирусной активности. ИФН взаимодействует с
• интактными, ещё неинфицированными клетками, препятствуя реализации репродуктивного цикла вирусов за счёт активации клеточных ферментов (протеинкиназ). Кинины обнаруживаются во всех тканях и жидкостях организма. Им свойствен широкий спектр биологического действия. Эти вещества образуют кининовую систему. Φ Компоненты кининовой системы
♦ Кининогены - субстраты, из которых образуются кинины, - синтезируются в основном в печени. В небольших количествах они образуются также в тканях лёгких, почек, сердца, кожи и некоторых других органов.
♦ Кининогеназы (калликреины) - протеолитические ферменты, при участии которых образуются кинины.
♦ Калликреиногены (прекалликреины) - предшественники калликреинов.
♦ Кинины (к ним относятся многие вещества; наибольшее значение имеют брадикинин и каллидин).
■ Каллидин - декапептид, который образуется главным образом под влиянием тканевых калликреинов. Под действием тканевых и плазменных аминопептидаз каллидин превращается в брадикинин.
■ Брадикинин - нонапептид, образующийся преимущественно под влиянием плазменных калликреинов.
♦ Кининазы - ферменты, специфически разрушающие кинины (карбоксипептидазы).
Φ Эффекты кининов
♦ Повышают проницаемость стенок микрососудов (в этом отношении брадикинин в 10-15 раз активнее гистамина).
♦ Расширяют просвет артериол за счёт непосредственного воздействия на ГМК.
♦ Стимулируют миграцию фагоцитов.
Таким образом, различные факторы неспецифической защиты организма функционируют независимо от специфических АТ и комплексов «Аг-АТ». Именно поэтому эти факторы неспецифичны, конститутивны. В тех же случаях, когда происходит распознавание чужеродных Аг, выработка АТ, специфичных к этим Аг, а также другие иммунные реакции говорят об осуществлении специфической (иммунной) защиты.
ИММУННАЯ ЗАЩИТА
Специфическую (иммунную) защиту осуществляет иммунная система организма. Иммунная система развилась в качестве защиты против микробных инфекций и обеспечивает две формы иммунитета - специфическую и неспецифическую. Специфический иммунный ответ защищает организм от конкретного возбудителя и вступает в действие тогда, когда неспецифическая защита организма исчерпывает свои возможности.
Компоненты иммунной защиты
К основным понятиям и компонентам иммунной защиты относятся иммунитет, антигены (Аг), антитела (АТ), иммунокомпе- тентные клетки, главный комплекс гистосовместимости, цитокины и органы лимфоидной системы.
Иммунитет
Термин «иммунитет» происходит от лат. immunitas - избавление, освобождение от чего-либо (в Древнем Риме это слово означало освобождение гражданина от какой-либо обязанности, повинности или службы). Ключевое понятие иммунитета - способность иммунной системы идентифицировать чужое (отличать «своё» от «чужого») и применять по отношению к «чужому» меры нейтрализации и уничтожения - конкретные иммунные реакции. Идентификация «чужого» происходит на основе огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов гистосовместимости (MHC классов I и II). Нейтрализацию «чужого» осуществляют циркулирующие в жидкостях организма АТ (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет). Различают иммунитет врождённый и приобретённый.
• Врождённый иммунитет - генетически закреплённая невосприимчивость, присущая каждому виду.
• Приобретённый иммунитет формируется в течение жизни индивидуума и не передаётся по наследству. Различают активно приобретённый иммунитет (активный иммунитет - состояние невосприимчивости после перенесённого инфекционного заболевания и после вакцинации, т.е. организм активно вырабатывает АТ) и пассивно приобретённый иммунитет (пассив-
ный иммунитет - состояние невосприимчивости в результате поступления в организм уже готовых АТ, т.е. сам организм не вырабатывает эти АТ).
Антигены
Антиген (Аг) - вещество, несущее признаки генетически чужеродной информации. Аг можно также назвать молекулой, кото- рую клетки иммунной системы распознают как чужеродную («не свою»). В качестве синонима применяют также термин «иммуноген», подразумевая, что иммуноген (Аг) способен вызвать ответные реакции иммунной системы, в итоге вызывающие развитие при- обретённого иммунитета. Способность вызывать такие ответные реакции (т.е. образование АТ и сенсибилизацию - приобретение организмом чувствительности к Аг) присуща не всей молекуле Аг, а только особой его части; её называют антигенной детерминантой, или эпитопом. У большинства белковых Аг такую детерминанту образует последовательность из 4-8 аминокислотных остатков, а у полисахаридных Аг - из 3-6 гексозных остатков. Число же детерминант у одного Аг может быть различным. Так, у яичного альбумина их не менее пяти, у дифтерийного токсина - минимум 80, у тиреоглобулина - более 40. Различают Аг экзогенные (Аг, поступающие в организм извне) и эндогенные (аутоантигены - продукты собственных клеток организма), а также Аг, вызывающие аллер- гические реакции, - аллергены. Микроорганизмы часто имеют на своей поверхности уникальные структурные компоненты, которые действуют как Аг. Организмы, которые могут вызвать заболевание, называются патогенами.
Антитела
Антитело (АТ) - гликопротеин, относящийся к классу иммуноглобулинов (Ig). АТ специфически взаимодействует с компле- ментарным Аг, т.е. с той антигенной детерминантой, к которой иммунная система синтезировала данное АТ. В результате образования комплекса «Аг + АТ» происходит нейтрализация Аг. АТ существуют в миллионах разновидностей, и каждая молекула АТ (Ig) имеет уникальный участок связывания антигенной детерминанты. АТ синтезируют плазматические клетки в ходе гуморального иммунного ответа, каждое специфическое АТ (Ig) синтезирует отдельный клон (дифференцированное потомство единственного B-лимфоцита) плазматических клеток (рис. 28-1). Ig образуют один
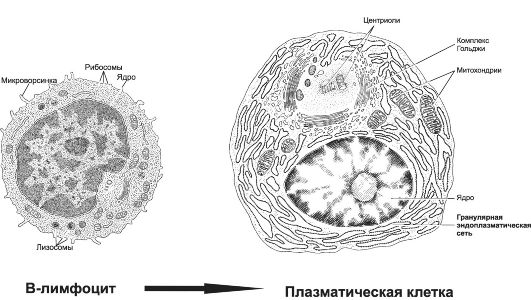
Рис. 28-1. В-лимфоцит и плазматическая клетка [11]. Активированные В-лимфоциты, т.е. получившие информацию о структуре конкретной антигенной детерминанты и сигнал к пролиферации, размножаются и дифференцируются. Конечный этап совокупности дифференцированного потомства В-лимфоцита - клон плазматических клеток, синтезирующих AT (Ig) именно к этой, и только к этой, антигенной детерминанте. Обратите внимание, что в цитоплазме плазматической клетки находится огромное количество синтезирующего белок аппарата - гранулярной эндоплазматической сети.
из основных классов белков крови, составляя 20% массы белка плазмы. Гены, кодирующие синтез известных классов Ig (IgA, IgD, IgE, IgG и IgM), расположены в хромосомах 2, 14 и 22.
• Связывание антигена (рис. 28-2). Молекула Ig состоит из двух лёгких (L-цепи) и двух тяжёлых цепей (H-цепи). В цепях различают вариабельную область (V-область) в N-концевой части и постоянную, или константную, область (C-область). V-область у разных АТ варьирует. V-области L- и Н-цепей образуют Аг-cвязывающий центр - участок связывания с антигенной детерминантой. Константная область молекулы Ig имеет Fc-фрагмент, определяющий специфичность связывания молекулы Ig с клетками-эффекторами, несущими на своей поверхности рецепторы Fc-фрагмента.
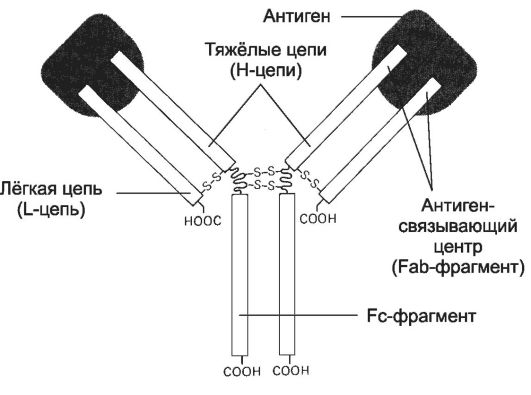
Рис. 28-2. Структура иммуноглобулина [11]. Молекула иммуноглобулина состоит из двух идентичных тяжёлых (Н) и двух идентичных лёгких (L) цепей. N-концевые области L- и Н-цепей образуют два Аг-связывающих центра (Fab-фрагмент). Fc-фрагмент молекулы взаимодействует со своим рецептором в мембране различных типов клеток (макрофаг, нейтрофил, тучная клетка).
Иммунокомпетентные клетки
К иммунокомпетентным клеткам, обеспечивающим выполнение функций иммунной системы, относятся антигенпредставляющие клетки, Т- и В-лимфоциты и NK-клетки.
• Антигенпредставляющие клетки. К Аг-представляющим клеткам относятся макрофаги, отростчатые (дендритные) клетки лимфатических узлов и селезёнки, клетки Лангерханса эпидермиса, М-клетки в лимфатических фолликулах пищеварительного тракта, дендритные эпителиальные клетки вилочковой железы. Эти клетки захватывают, обрабатывают (процессируют) и представляют Аг на своей поверхности Т-лимфоцитамхелперам (рис. 28-3).
• T-лимфоциты отвечают за клеточный иммунный ответ, а также помогают реагировать на Аг B-лимфоцитам при гуморальном иммунном ответе. В организме человека содержится около 1018 различных рецепторов Т-клеток. Каждый Т-лимфоцит содержит Ig-подобный интегральный мембранный гликопротеин - рецептор Т-лимфоцитов строго одной специфичности, т.е. взаимодействующий только с одним Аг. В клеточной мембране рецептор Т-лимфоцитов связан с Аг CD3. Т-клетки по экспрессии дифференцировочных Аг CD подразделяют на CD4+ и CD8+.
Φ CD4+-лимфоциты. Т-клетки, содержащие мембранные молекулы CD4, подразделяются на регуляторные (Т-хелперы, или Т1-хелперы) и эффекторные (Т2-хелперы, или ТГЗТ).
♦ T- хелперы при взаимодействии с Аг-представляющими клетками специфически распознают Аг, а при взаимодействии с В-клетками индуцируют гуморальный иммунный ответ (см. рис. 28-3).
♦ (Т-эффекторы реакций гиперчувствительности замедленного типа) опосредуют реакции гиперчувствительности замедленного типа (см. далее).
Φ CD8+-лимфоциты. Мембранные Аг CD8 экспрессируют субпопуляции Т-клеток, подразделяемые на регуляторные (су- прессоры) и эффекторные (цитотоксические Т-лимфоциты).
♦ T- супрессоры регулируют интенсивность иммунного ответа, подавляя активность CD4+-клеток.
♦ Цитотоксические Т-лимфоциты (Т-киллеры) лизируют клетки-мишени, которые несут чужеродные Аг или видо-
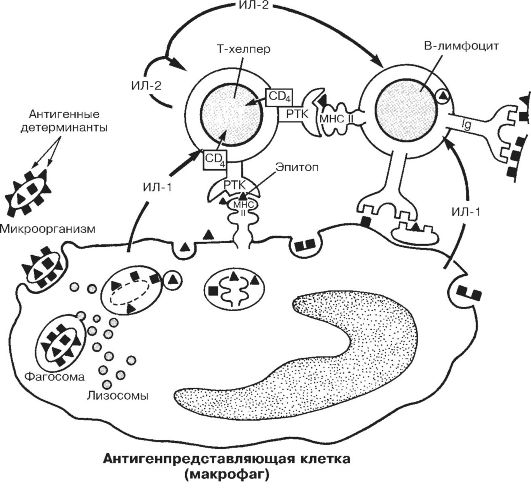
Рис. 28-3. Взаимодействие клеток в ходе гуморального иммунного ответа
[16]. Рецептор Т-хелпера (РТК) распознаёт Аг-детерминанту (эпитоп), экспрессированную на поверхности Аг-представляющей клетки вместе с молекулой класса II MHC. Во взаимодействии участвует дифференцировочный Аг Т-хелпера - CD4. В результате подобного взаимодействия Агпредставляющая клетка секретирует ИЛ-1, стимулирующий в Т-хелпере синтез и секрецию ИЛ-2, а также синтез и встраивание в плазматическую мембрану того же Т-хелпера рецепторов ИЛ-2 (ИЛ-2 также стимулирует пролиферацию Т-хелперов). Отбор В-лимфоцитов проводится при взаимодействии Аг с Fab-фрагментами АТ (Ig) на поверхности этих клеток (правая часть рисунка). Эпитоп этого Аг в комплексе с молекулой MHC класса II распознаёт рецептор Т-хелпера, после чего из Т-лимфоцита секретируются цитокины, стимулирующие пролиферацию В-лимфоцитов и их дифференцировку в плазматические клетки, которые синтезируют АТ к данному Аг.
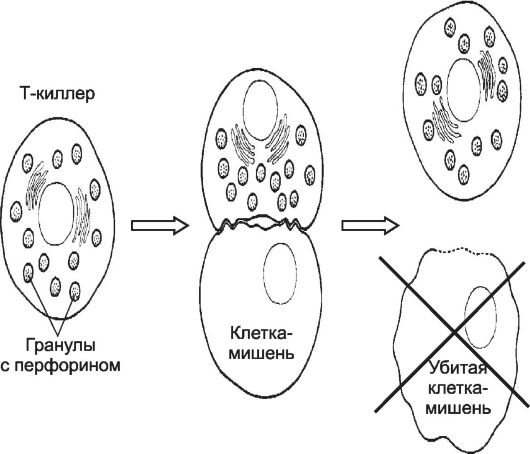
Рис. 28-4. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом [11].
При сближении Т-лимфоцита с клеткой-мишенью после специфического взаимодействия мембранных молекул клеток-партнёров Т-лимфоцит убивает клетку-мишень.
• изменённые собственные Аг - аутоантигены (например, клетки опухолей, трансплантатов, инфицированные вирусами; клетки, несущие Аг). Цитотоксический эффект Т-киллеров реализуется через образование в клеткахмишенях пор (под действием особых белков - перфоринов). Нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки. B-лимфоциты (менее 10% лимфоцитов крови) отвечают за гуморальный иммунный ответ. В мембране всех B-лимфоцитов содержится рецептор Аг - мономер IgM. В организме имеется около 1014 связанных с мембраной форм иммуноглобулинов. Однако каждой B-клетке присущ только один вид
иммуноглобулина. Продолжительность жизни большинства B-лимфоцитов (если они не активируются Аг!) не превышает десяти дней. Различают две подгруппы B-клеток - эффекторные и клетки памяти.
Φ Эффекторные B-лимфоциты. Активированные В-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 28-1), вырабатывающие АТ - Ig всех известных классов.
• Φ В-лимфоциты иммунологической памяти - долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об Аг. Клетки памяти активируются при повторной их стимуляции тем же самым Аг. В этом случае B-лимфоциты памяти (при обязательном участии Т-хелперов и ряда других факторов) обеспечивают быстрый синтез большого количества специфических АТ, взаимодействующих с чужеродным Аг, и развитие эффективного иммунного ответа. NK-клетки (естественные киллеры) - лимфоциты, лишён- ные характерных для Т- и В-клеток поверхностных CD- детерминант. Эти клетки составляют около 5% всех циркулирующих лимфоцитов, содержат цитолитические гранулы с перфорином и уничтожают трансформированные, инфицированные вирусами и чужеродные клетки. Идентификация клеток-мишеней не связана с необходимостью для NK-клеток узнавать белки MHC (главный комплекс гистосовместимости) на поверхности клеток-мишеней, как это происходит с Т-киллерами.
Главный комплекс гистосовместимости
Лейкоцитарные Аг HLA главного комплекса гистосовместимости МНС определяют биологическую индивидуальность каждого человека. HLA-молекулы, кодируемые генами МНС, подразделяются на два класса: гликопротеины МНС класса I (HLA-A, HLA-B и HLA-C) представлены на поверхности практически всех клеток, а Аг МНС класса II (HLA-D, HLA-DP, HLA-DQ и HLA-DR) экспрессированы преимущественно на мембране им- мунокомпетентных клеток, включая макрофаги, моноциты, Т- и В-лимфоциты. Неиммунокомпетентные соматические клетки в нормальных условиях не экспрессируют молекулы Аг класса II.
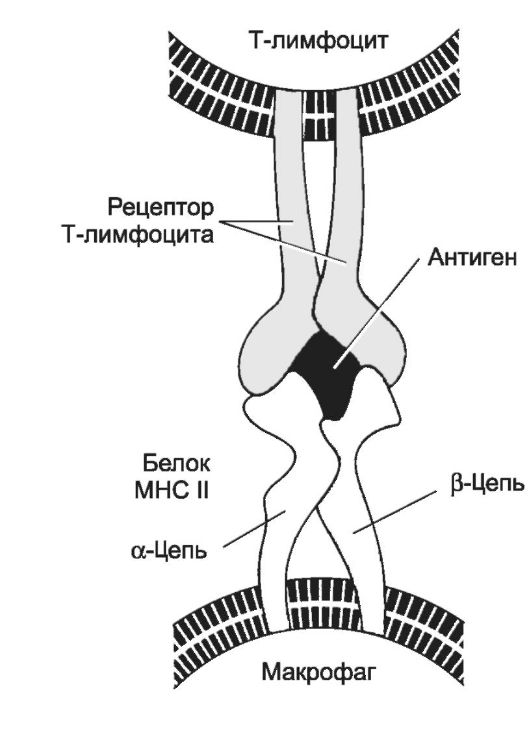
Рис. 28-5. Распознавание антигена рецептором T-лимфоцита [11].
Каждый Аг MHC состоит их разных цепей - α- и β-. При помощи рецептора Т-лимфоцита Т-клетка распознаёт Аг, при условии, что он находится в комплексе с молекулой MHC. Вместе с Т-хелпером в процессе также участвует CD4, который свободным концом связывается с молекулой MHC. Распознаваемый Т-клеткой Аг имеет два участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором Т-лимфоцита. Подобный же тип взаимодействия, но с участием CD8, характерен для процесса распознавания цитотоксическим Т-лимфоцитом Аг, связанного с молекулой MHC класса I.
Молекулы МНС контролируют иммунный ответ. Так, Аг МНС II участвуют в представлении Аг Т-клеткам (рис. 28-5) и во взаимодействии Т- и В-лимфоцитов. Аг MHC I и MHC II распознаются поверхностно-клеточными дифференцировочными Аг CD (МНС I с CD8, МНС II с CD4).
Цитокины (известно не менее ста, устаревшие наименования - лимфокины, монокины) - межклеточные медиаторы, осуществляющие через специфические рецепторы взаимодействия между клетками, вовлекаемыми в защитный (в том числе иммунный) ответ. Для иммунной защиты в особенности важны интерлейкины, интерфероны, факторы некроза опухоли, колониестимулирующие факторы, разные факторы роста.
Органы иммунной системы
Иммунная система состоит из центральных (первичных) и периферических (вторичных) органов.
• Центральные лимфоидные органы - костный мозг и тимус. Здесь лимфоциты дифференцируются из клеток-предшественниц,
размножаются и созревают. Т-клетки созревают в тимусе, а В-лимфоциты - в печени плода и костном мозге взрослого организма. В ходе дифференцировки в центральных органах лимфоциты начинают экспрессировать рецепторы, которые в дальнейшем могут связываться с Аг. В центральных органах отбираются и выживают те лимфоциты (тимоциты), которые толерантны (невосприимчивы) к собственным Аг. Таким образом, в центральных органах происходит антигеннезависимое деление и созревание лимфоцитов, которые впоследствии мигрируют в периферические органы иммунной системы.
• Периферические лимфоидные органы - селезёнка, лимфатические узлы, лимфоидная ткань слизистых оболочек (лимфатические фолликулы, миндалины). В периферических лимфоидных органах антигенпредставляющие клетки, Т- и В-лимфоциты участвуют в иммунном ответе, здесь образуются эффекторные клетки и клетки памяти. Таким образом, в периферических органах происходит и антигеннезависимая, и антигензависимая пролиферация и дифференцировка лимфоцитов. Как правило, лимфоциты впервые контактируют с Аг именно в периферических лимфоидных органах.
• Клоны и циркуляция лимфоцитов. В организме здорового человека в процессе лимфопоэза образуется более 109 разновидностей однородных клонов лимфоцитов (как B-, так и Т-лимфоцитов). При этом каждый клон экспрессирует только один вид специфического антигенсвязывающего рецептора. Большинство лимфоцитов периферических органов иммунной системы не закрепляются в них навсегда. Они постоянно циркулируют с кровью и лимфой не только между различными лимфоидными органами, но и во всех других органах и тканях организма. Именно при циркуляции лимфоцитов реализуется функция иммунологического надзора.
Иммунные реакции и состояния
Взаимодействие клеток при иммунном ответе
И клеточный, и гуморальный иммунный ответ состоит из двух фаз. В первой фазе Аг активирует те лимфоциты, которые его рас- познают. Во второй (эффекторной) фазе эти лимфоциты координируют иммунный ответ, направленный на устранение Аг.
Φ В гуморальном иммунном ответе эффекторными являются антигенпредставляющие клетки и В-лимфоциты, а ре- гуляцию антителообразования осуществляют Т-хелперы и Т-супрессоры.
Φ В клеточном иммунном ответе эффекторными клетками являются цитотоксические Т-лимфоциты, активность кото- рых регулируют Т-хелперы и Т-супрессоры. Иммунологическая толерантность (от лат. tolerantia - терпимость) - состояние, при котором иммунный ответ на специфический Аг не развивается. Другими словами, иммунная система должна различать «своё» и «чужое» и атаковать чужеродные Аг, не повреждая при этом собственные. Иммунный ответ против собственных тканей организма в нормальных условиях не развивается, т.е. иммунная система толерантна к собственным Аг и не толерантна к чужеродным. Различают врождённую и приоб- ретённую толерантность. Врождённая толерантность развивается в вилочковой железе (тимус) в результате отбора клонов лимфоцитов. Приобретённую толерантность обеспечивает активация Т-супрессоров. Толерантность по отношению к собственным At может нарушаться, в результате чего развиваются аутоиммунные заболевания.
Деятельность иммунной системы взаимосвязана с эндокринной и нервной системой
Известно, что характер физиологического ответа на стресс существенно сказывается на уровне активности иммунной систе- мы. Как следствие этого, люди, испытывающие физиологический стресс в связи с потерей близких или другими испытаниями, легко подвержены заболеваниям. Пока нельзя дать немедленный и точный ответ, каковы механизмы, связывающие подобные явления, однако имеется много сведений о взаимодействии между тремя системами через гормоны, нейромедиаторы и цитокины. Иммунная, эндокринная и нервная системы используют значительное число одних и тех же рецепторов, синтезируют и секретируют одни и те же молекулы. Соответственно, сила индивидуального иммунного ответа зависит не только от типа антигена или возраста и генетической наследственности, но и от образа жизни, эмоционального характера и способности справляться со стрессом.
ЦНС и вегетативная нервная система модулируют иммунные функции
Во время иммунного ответа цитокины типа интерлейкина-1 побуждают нейроны паравентрикулярного гипоталамуса выделять кортиколиберин. Эта реакция является начальной фазой физиологического стресс-ответа, целью которого является возвращение человека к нормальному гомеостазу. Кортиколиберин воздействует на гипофиз, стимулируя экспрессию проопиомелакортина, который превращается в бета-эндорфин и АКТГ. АКТГ стимулирует выделение кортикостероидов надпочечниками. Все эти факторы могут непосредственно связываться с рецепторами иммунных клеток. Результатом является либо общее торможение иммунной системы, либо её поддержка, особенно во время острого стресса.
Активация стресс-ответа кортиколиберином стимулирует симпатическую нервную систему, вызывая выделение норадреналина. Цитокины, выделяемые иммунными клетками, клетками микроглии и астроцитами ЦНС, также могут активировать её. ЦНС посылает сигналы по вегетативным нервам к селезёнке и лимфатическим узлам, окончания нервных волокон которых располагаются в непосредственной близости к Т-лимфоцитам и макрофагам. Эти иммунные клетки так же, как и B-клетки, экспрессируют бета-адренегические рецепторы (субтипа бета-2), и их активация тормозит клеточные функции. Так, адренергическая стимуляция Т-клеток уменьшает экспрессию ими интегринов, нарушая миграцию Т-клеток из сосудов в ткани. Этим объясняется значительное содержание Т-клеток в крови вскоре после стрессорного воздействия.
Симпатические нервные окончания и мозговой слой надпочечников выделяют эндорфины и энкефалины. Эти опиоидные пептиды противодействуют ответу организма на стресс и помогают поддерживать гомеостаз во время физиологического и психологического стресса. Иммунные ответы на различные опиоиды зависят от субтипа и концентрации нейропептидов. Мелатонин, гормон шишковидной железы, регулирует опиоидную сеть и, следовательно, иммунную систему.
Влияние иммунных клеток на ЦНС. Модулирующее действие гормонов
Лимфокины и тимокины, согласно последним данным, поступают из периферической иммунной системы в ЦНС. Так,
интерлейкин-1 является потенциальным митогеном клеток астроглии. Кроме того, он действует на гипоталамические клетки, вызывая лихорадку. Интерлейкин-2 способствует делению и созреванию олигодендроцитов, а интерлейкин-3 поддерживает выживание холинергических нейронов. CD4+-T клетки и макрофаги синтезируют нейропептиды: вазоактивный интестинальный пептид (VIP) и гипофизарный пептид, активированный аденилатциклазой.
До недавнего времени считалось, что мозг лишён периферических иммунных клеток. Сейчас установлено, что иммунные клетки способны проходить через гематоэнцефалический барьер и поступать в ЦНС, где они могут служить пусковым механизмом аутоиммунных заболеваний. Однако более вероятно, что нейрональные аутоиммунные клетки, находящиеся в ЦНС, выполняют регулирующие физиологические функции. Например, они могут участвовать в поддержании когнитивных функций мозга.
Многие гормоны имеют связи с иммунными функциями. Например, клетки иммунной системы синтезируют и используют тиреотропный гормон, известный как регулятор метаболических функций. Гормон роста, пролактин, женские и мужские половые гормоны и лептин являются примерами гормонов, которые недвусмысленно модулируют иммунную систему. Типичным для гормонов образом они оказывают разнообразное воздействие на многие клетки-мишени в зависимости от концентрации гормона, характера тканевых мишеней и среды.
Обобщение главы
Неспецифическая защита организма является врождённой. Она включает поверхностные анатомические барьеры (эпителий кожи и слизистых оболочек) и комплекс клеточных и гуморальных факторов внутренней среды.
В иммунную систему входят главные иммунологические органы: тимус, селезенка, костный мозг и лимфатическая система. Кроме того, она включает клетки и неклеточные элементы, входящие в состав каждой ткани организма.
Целью иммунной системы является различение между собственными и чужеродными молекулами внутри нашего организма, толерантность к нормальным веществам собственного организма и ликвидация любой проникшей в организм чужеродной субстанции.
Для борьбы с чужеродными субстанциями используются системы врождённого и приобретённого (адаптивного) иммунитета. Система врождённого иммунитета отвечает немедленно на общие иммуногены, система приобретённого иммунитета, которая изменяется в течение жизни и имеет память, отвечает на повторную встречу с антигеном более мощной реакцией.
Врождённый и приобретённый иммунитет работают совместно таким образом, что иммунный ответ приспособлен к виду и тяжести воздействия.
Приобретённый иммунитет представляет собой задержанный, но высокоэффективный иммунный ответ против специфических анти- генов. Приобретённый иммунитет подразделяется на клеточный, мишенями которого служат инфицированные клетки, а исполнителями - Т-клетки, и гуморальный иммунитет, который подавляет инфекционные агенты в крови и тканях посредством B-клеток и их антител.
B- и Т-клетки содержат антигенспецифические рецепторы. B-клетки связывают непосредственно антиген, Т-клетки - антиген, представленный комплексом MHC белков.
Стимуляция антигеном и другими сигналами побуждает Т-лимфоциты клонировать эффекторные клетки и клетки памяти.
Активированные B-клетки превращаются в антитела, продуцирующие плазматические клетки и клетки памяти.
Антитела представляют собой специфически связывающие антигены белки, которые нейтрализуют и опсонизируют антиген и стимулируют комплемент к участию во многих иммунных реакциях. Антитела встречаются в пяти изотипах со специальными функциями.
Деятельность иммунной системы тесно переплетена с деятельностью эндокринной и нервной системы при поддержании гомеостаза организма.