Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 5. ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ И ПРОЦЕССЫ
Имеющую огромное значение для химии чистую воду. можно рассматривать как слабую кислоту или слабое основание.
С. Аррениус
5.1. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
Живой организм - это открытая стационарная система. Состояние относительного постоянства внутренней среды организма называют гомеостазом. Одним из важнейших факторов гомеостаза живых организмов является поддержание кислотно-основного состояния организма, т.е. концентрации ионов водорода на определенном уровне. Это состояние получило название изогидрии.
Определения кислот и оснований данные Аррениусом получили название «классических». Позднее были предложены другие теории кислот и оснований, из которых наибольшее признание получили теории Брёнстеда и Лоури и электронная теория Льюиса.
5.1.1. Теория Аррениуса
Согласно теории Аррениуса, кислота - это электролит, диссоциирующий в растворе с образованием катионов водорода; основание - это электролит, диссоциирующий в растворе с образованием гидроксид-ионов; амфолит - это электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид-ионов.
Аммиак не содержит гидроксид-ион, но проявляет свойства основания. Углекислый газ не содержит ион водорода, но проявляет в растворах кислотные свойства. Теория Аррениуса имеет ряд ограничений. Она объясняет кислотно-основные свойства молекулы, но не может объяснить кислотно-основные свойства заряженных частиц - ионов.
5.1.2. Теория Брёнстеда и Лоури
По этой теории кислотой называют всякое вещество, молекулы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулы которого (в том числе и ионы) способны присоединять протон, т.е. быть акцептором протонов; амфолитом называют всякое вещество, которое является и донором, и акцептором протонов.
Данная теория объясняет кислотно-основные свойства не только нейтральных молекул, но и ионов. Кислота, отдавая протон, превращается в основание, которое является сопряженным этой кислоте. Понятия «кислота» и «основание» являются относительными понятиями, так как одни и те же частицы - молекулы или ионы - могут проявлять как основные, так и кислотные свойства в зависимости от партнера.
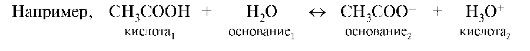
При протолитическом равновесии образуются кислотно-основные пары. Согласно протонной теории, гидролиз, реакции ионизации и нейтрализации не рассматриваются как особое явление, а считаются обычным переходом протонов от кислоты к основанию.
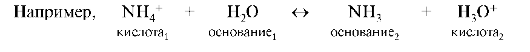
Реакции гидролиза, нейтрализации и ионизации являются частными случаями протолитических равновесий и называются реакциями протолиза. Равновесия, установившиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими.
5.1.3. Электронная теория Льюиса
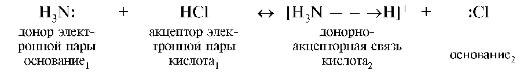
Протонная теория не объясняет кислотно-основные свойства веществ, которые не содержат водород (например, галогенидов бора, кремния), - в этом ее ограниченность. Теория Льюиса объясняет кислотно-основные свойства веществ не на молекулярно-ионном, а на электронном уровне и связывает их с переносом электронной пары от одной частицы к другой. Основание является донором, а кислота - акцептором электронной пары. Взаимодействие между кислотой и основанием заключается в образовании донорно-акцепторной связи между реагирующими частицами.
5.2. ОСНОВНЫЕ ПОЛОЖЕНИЯ ПРОТОЛИТИЧЕСКОЙ
ТЕОРИИ
5.2.1. Автопротолиз воды. Константа автопротолиза
Водородный показатель pH
Вода как слабый электролит в малой степени подвергается ионизации: H2O ↔ H+ + OH-. Ионы в водном растворе подвергаются гидратации (aq.)

Для воды характерна протолитическая амфотерность. Реакция самоионизации (автопротолиза) воды, в ходе которой протон от одной молекулы воды (кислоты) переходит к другой молекуле воды (основанию) описывается уравнением: H2O + H2O ↔ H3O+ + OH-.
Константа равновесия самоионизации воды равна:
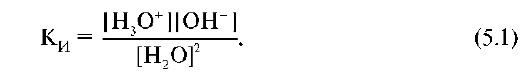
К константе ионизации применим закон действующих масс:
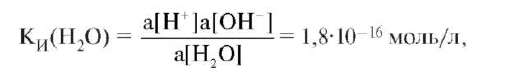
где a - активность.
Для краткости вместо H3O+ в кислотно-основном равновесии пишут
H+.
Так как вода находится в растворе в большом избытке и в малой степени подвергается ионизации, то можно отметить, что ее концентрация величина постоянная и равна 55,6 моль (1000 г : 18 г/моль = 56 моль) в литре воды.
Следовательно, произведение Ки(Н2O) и концентрации воды равны 1,8•10-16 моль/л • 55,6 моль/л = 10-14 моль2/л2. Таким образом, [H+][OH-] = 10-14 (при 25 °С) является постоянной величиной, обозна-
чается Kw и называется константой автопротолиза воды. Иногда используют устаревшее название - ионное произведение воды. Используя это значение, можно рассчитать концентрации ионов гидроксония и гидроксид-ионов в чистой воде:
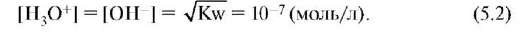
Итак, в чистой воде или любом водном растворе при постоянной температуре произведение концентраций катионов водорода и гидроксид-ионов есть величина постоянная, называемая константой автопротолиза или ионным произведением воды.
Ионное произведение воды величина важная и позволяет для любого водного раствора определить концентрацию ионов водорода при известной концентрации гидроксид-ионов и наоборот.
Например, если [H+] = 10-5 моль/л, то [OH-] = 10-14/10-5 = = 10-9 моль/л.
Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинакова - называют нейтральными растворами [H+] = [OH-] = = 10-7 моль/л. В кислых растворах [H+] > [OH-], [H+] > 10-7моль/л, а в щелочных [OH-] > [H+], [OH-] > 10-7 моль/л. Удобно пользоваться не абсолютными величинами K(H2O), [H+] и [OH-], а их отрицательным десятичным логарифмом. Обозначают рК(Н2О), pH и рОН. Прологарифмировав и изменив знаки в уравнении, получим: pH + + рОН = 14. Если pH = 3, то рОН = 14 - 3 = 11. pH и рОН однозначно тесно связаны между собой. Для упрощения за основу принимают водородный показатель pH - десятичный логарифм концентрации водородных ионов, взятый с обратным знаком: pH = -lg[H+].
Среда нейтральная при pH = 7, среда кислая при pH < 7, а при pH > 7 - среда щелочная.
В растворах различают общую, активную и потенциальную кислотность, которые обозначают: [H+]общ, [H+]акт, [H+]пот и выражают в моль/л. Общая кислотность - это концентрация всех катионов водорода (свободных и связанных), имеющихся в растворе при данных условиях. Определяют общую кислотность методом нейтрализации раствора. Активная кислотность - это концентрация свободных катионов водорода, имеющихся в растворе. Мерой активной кислотности является значение pH раствора. Потенциальная (резервная) кислотность измеряется количеством катионов водорода, связанных в молекулах слабых кислот в растворе. Она равна разности между общей и активной кислотностями: [H+]пот = [H+]общ - [H+]акт.
5.2.2. Методы определения pH
Определение pH осуществляют потенциометрическим, визуально-колориметрическим или фотоколориметрическим методами.
Для определения pH визуально-колориметрическим методом используют кислотно-основные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах. Цвет раствора индикатора зависит от соотношения между ионной и молекулярной формами. Их концентрация зависит от pH раствора. Следовательно, окраска раствора будет показателем концентрации ионов водорода.
На совмещении протолитических равновесий основано использование индикаторов для определения pH. Индикаторы представляют собой слабые кислоты или основания, изменяющие окраску в обратимых протолитических реакциях. Молекулярная форма одноцветных индикаторов бесцветна, ионная - окрашена. В растворе индикатора-кислоты устанавливается равновесие:
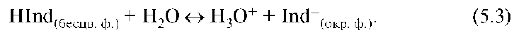
При добавлении к водному раствору такого индикатора более сильной, чем индикатор кислоты, сопряженное основание (Ind-) переходит в соответствующую бесцветную кислоту (HInd): интенсивность окраски ослабевает или исчезает. Наоборот, прибавление нескольких капель раствора щелочи вызывает смещение равновесия в противоположном направлении: концентрация окрашенной формы индикатора [Ind-] возрастает, интенсивность окраски усиливается. Это соответствует определенному значению pH. Очевидно, что в данных условиях возникают конкурентные отношения между основаниями OH- и Ind-за протон.
Преобразовав уравнение кислотной ионизации применительно к индикатору-кислоте, получим:
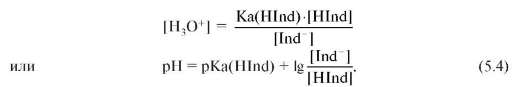
Последнее уравнение можно привести к виду:

где α - степень ионизации индикатора.
Величина pH раствора равна значению pKa(HInd), если концентрации молекулярной и ионной форм индикатора равны между собой. Интенсивность окраски индикатора изменяется в определенном диапазоне значений pH, отвечающих двум крайним случаям полного смещения равновесия, однако отчетливые изменения окраски, фиксируемые визуально или с помощью фотометра, возможны в том случае, если концентрации одной формы превышают другую не более чем в 10 раз. Следовательно, в случае индикаторов-кислот можно обна-

Диапазон значений pH = pKa(HInd) ± 1 называется интервалом перехода окраски индикатора.
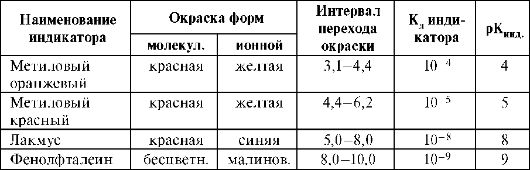
Область значения, при которой происходит изменение окраски индикатора можно рассчитать по формуле pH = рКинд ± 1. Интервал перехода метилового оранжевого ~4±1, т.е. 3-5. Чем выше Кд индикатора, тем легче его молекула распадается на ионы, тем меньше значение pH, при котором он изменяет свою окраску. Например, Кд метилового оранжевого ≈10-4 гораздо больше, чем Кд фенолфталеина ≈10-9. Поэтому область перехода метилового оранжевого лежит при более низких значениях pH раствора.
В настоящее время изготавливают индикаторную бумагу, пропитанную смесью различных индикаторов и показывающую несколько переходов цвета; с помощью такой бумаги можно определить pH раствора с точностью до единицы в интервале pH 1-13. Такую индикаторную бумагу называют универсальной индикаторной бумагой.
Характеристики некоторых кислотно-основных индикаторов
5.2.3. Кислотно-основное равновесие в жизнедеятельности организма
Определение pH имеет большое значение в медицине, так как биохимические процессы протекают при определенном значении pH: кровь (плазма) pH 7,4; эритроциты - 7,25; моча - 5,0-7,0; слюна - 6,0-8,0; желудочный сок - 0,8-1,0; кишечный сок - 8,3; желчь - 6,5-7,3; спинной мозг - 7,5-7,85; пот - 4,2-7,5. Сдвиг pH от нормы сигнализирует о какой-то патологии.
В результате жизнедеятельности в организме образуется большое количество кислот. Больше всего образуется углекислоты (до 13 моль ежесуточно), которая в основном выводится из организма в виде углекислого газа в процессе дыхания. Снижение выделения углекислого газа только на 0,13 моль приводит к серьезным патологическим изменениям в организме. Кроме того, в организме образуются нелетучие кислоты: серная, фосфорная, молочная и другие кислоты в количестве 30-80 ммоль в сутки. При некоторых патологических состояниях увеличивается их выделение до 1 моль. В основном это ацетоуксусная, р-гидроксимасляная кислоты, что приводит к нарушениям кислотно-основного состояния организма, и если нарушение устойчивое и изменение pH ниже нормы, то развивается ацидоз (при передозировке снотворного). При повышении pH выше нормы развивается алкалоз (при длительной рвоте). pH плазмы крови 7,4, эритроцитов - 7,25. Изменение pH плазмы крови <7,4, только на 0,2 приводит к ацидозу, а pH >7,4 только на 0,2 - алкалозу. Активность ферментов проявляется при определенном значении pH. pH чистого желудочного сока 0,9. Пепсин желудочного сока активен при pH 1,5- 2,0, секрет поджелудочной железы - 7,5-8,0, желчи в желчном пузыре - 5,4-6,9. Каталаза крови проявляет ферментативную активность при pH 7,0.
Нарушение состояния изогидрии наблюдается при сердечнососудистых заболеваниях, при ишемии, сахарном диабете (развивается ацидоз). Кислотно-основное равновесие поддерживается дыханием, мочевыделением, потоотделением. Данные системы работают медленно, а немедленная нейтрализация кислых и щелочных продуктов метаболизма осуществляется буферными системами организма. Состояние изогидрии обеспечивается совместным действием ряда физико-химических и физиологических механизмов. Буферное действие обеспечивается путем совмещения нескольких протолитических равновесий.
5.2.4. Сила кислот и оснований.
Реакции нейтрализации с позиций теории
протолитических равновесий
Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности (Ka). В водном растворе для произвольной кислоты HB функцию основания выполняет вода:
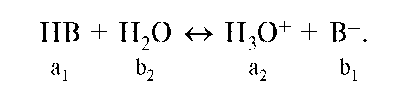
В дальнейшем любую кислоту будем обозначать «а», а основание - «b». В обозначении иногда приписывают индекс «1» или «2», при этом у основания и кислоты одной сопряженной пары индекс одинаковый. Если одну из протолитических пар образует вода, то ей приписывают индекс «2». Важно отметить, что действующие концентрации значительно выше, чем концентрации H+ и OH-.
Константа равновесия в соответствии с законом действующих масс
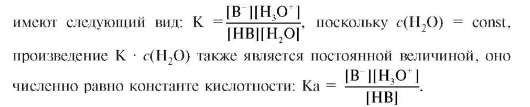
Чем больше константа кислотности, тем сильнее кислота. Например, уксусная кислота сильнее, чем циановодородная кислота, так как Ka(CH3COOH) = 1,74•10-5, Ka(HCN) = 1•10-9. Для удобства расчетов и записи часто пользуются не самими константами, а их отрицательными десятичными логарифмами: pKa = -lgKa. Величину pKa называют силовым показателем кислоты. Например, pKa(CH3COOH) = = -lgKa(CH3COOH) = -lg1,74•10-5 = 4,76; pKa(HCN) = 9. Чем больше величина pKa, тем слабее кислота.
Сильные кислоты практически полностью отдают свой протон молекулам воды, поэтому кислотой, присутствующей в растворе, является фактически ион гидроксония.
В связи с этим при расчете pH раствора сильной одноосновной кислоты концентрацию протонов приравнивают к концентрации кислоты
c(H3O+) = c(HB).
В растворах слабых кислот концентрация ионов гидроксония значительно ниже концентрации кислоты. Она рассчитывается на основании
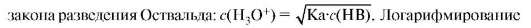
обеих частей этого уравнения дает формулу для расчета pH растворов слабых кислот: pH = 0,5(pKa - lgc(HB)).
Сила оснований определяется их способностью принимать протон.
Мерой этой способности служит константа основности (Kb). Для произвольного основания в растворе функцию кислоты выполняет вода:
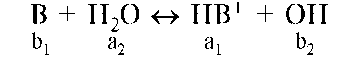
Приложение закона разведения Оствальда к растворам слабых оснований, способных принять только один протон, дает возможность определить в таких растворах концентрацию гидроксид-ионов: c(OH-) =
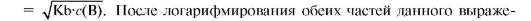
ния получаем: pOH = 0,5(pKb - lgc(B)), pH = pKw - 0,5(pKb - lgc(B)), где pKb - силовой показатель основания (отрицательный десятичный логарифм).
Константы кислотности и основности в сопряженной паре для водного раствора связаны между собой: Ka • Kb = Kw. Чем сильнее кислота, тем слабее сопряженное ей основание, и наоборот. Уксусная кислота (pKa = 4,76) сильнее, чем HCN (pKa = 9). Следовательно, CN- - более сильное основание, чем CH3COO-. При 298 K в водном растворе сумма силовых показателей кислоты и основания в сопряженной протолитической паре равна 14:

В справочных таблицах для кислотно-основных пар приводятся значения только константы кислотности. Для многоосновных кислот Ka определяется для каждой ступени ионизации. На примере ортофос-форной кислоты:
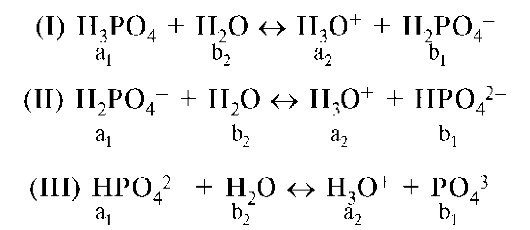
Константа кислотности фосфорной кислоты по второй ступени может трактоваться как константа кислотности дигидрофосфат-иона, а константа кислотности по третьей ступени - как константа кислотности гидрофосфат-иона, т.е. Ka(H3PO4)II = Ka(H2PO4-), Ka(H3PO4)III = = Ka(HPO42-).
Константа равновесия процесса (I-III) H3PO4 + 3H2O о 3H3O+ + + PO43- рассчитывается как произведение констант кислотности всех
стадий: Ka(H3PO4)I-III = Ka(H3PO4)I • Ka(H3PO4)II • Ka(H3PO4)III =
= 7,2 • 10-3 • 6,2-10-8 • 4,6 • 10-13 = 2,1 • 10-22.
В рассмотренном выше процессе ступенчатой диссоциации фосфорной кислоты дигидрофосфат-ион в реакции (I) выполняет функцию основания, а в реакции (II) - кислоты. Аналогично гидрофосфат-ион в реакции (II) - основание, а в реакции (III) - кислота. Частицы, способные к взаимодействию как с кислотами, так и с основаниями называются амфолитами. Типичными амфолитами являются аминокислоты. Например, глицин:
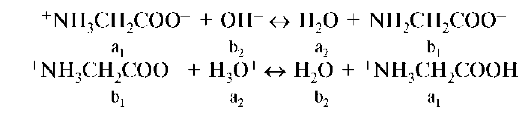
Константу равновесия реакции нейтрализации можно выразить не только через равновесные концентрации веществ и ионов, но и через константы кислотности. В общем случае выражение для константы реакции нейтрализации, как и для любого другого прото-литического взаимодействия, можно получить, разделив константу кислотности вещества, стоящего в левой части уравнения, на кон-
станту кислотности вещества, стоящего в правой части уравнения:
Кобщ.= Ka (в левой части уравнения)/Ка (в правой части уравнения).
Реакция нейтрализации имеет большую роль в жизнедеятельности организма. Постоянная нейтрализация кислого желудочного содержимого с помощью желчи и секретов кишечника обеспечивает оптимальное переваривание пищи, поскольку ферменты, необходимые для этого, имеют значительно различающиеся оптимальные величины pH: pHопт. (пепсин) = 2; pHопт. (гастриксин) = 3,0-3,5; pHопт. (трипсин) = 7,8; pHопт.(панкреатическая липаза) = 9.
Реакция нейтрализации обеспечивает оплодотворение яйцеклетки сперматозоидом. Движению сперматозоида способствует слабощелочная среда, в кислой среде они малоподвижны. Поскольку у влагалищных секретов среда в норме кислая, для ее нейтрализации первая капля спермы, в которую добавляется специальный секрет, вырабатываемый придаточными половыми железами, имеет сильнощелочную реакцию среды. Под действием семенной жидкости кислая среда влагалища становится слабощелочной, что обеспечивает оптимальные условия для продвижения сперматозоидов.
pH межклеточной жидкости большинства органов составляет в норме 7,4. В целом pH внутриклеточной жидкости варьирует от 4,5. Даже в одном органе клетки, отличающиеся в морфологическом отношении, имеют разные значения pH внутриклеточного содержимого. Определенное значение pH поддерживается и в отдельных структурах внутри клеток. Например, содержимое лизосом всех клеток имеет pH 5.
5.2.5. Реакции гидролиза соединений биогенных элементов с позиций протолитической теории
Гидролиз является частным случаем сольволиза. В общем случае под гидролизом понимают реакцию обменного разложения между водой и соответствующим соединением.
Согласно протолитической теории, ионный гидролиз не рассматривается как особое явление, а считается обычным явлением перехода протона от кислоты к основанию. Химизм гидролиза соединений, распадающихся в растворе на ионы, можно рассматривать как результат поляризационного взаимодействия ионов с их гидратной оболочкой. Способность иона к гидролизу определяется величиной заряда и размером иона. В зависимости от природы гидролизуемого иона различают катионный, анионный и смешанный типы гидролиза.
Гидролизу катионного типа подвергаются соли, образованные слабым основанием. Чем выше заряд катиона и меньше его размер, тем сильнее поляризация связи O-H координированной молекулы воды при образовании гидроксоаквакомплекса:
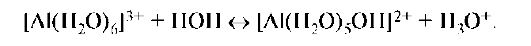
В результате катионного гидролиза реакция раствора становится кислой. В общем случае гидролиз по катиону можно записать так: HB+ + H2O ↔ B + H3O+. Константа равновесия этого процесса является одновременно константой кислотности HB+ и константой гидролиза по катиону:
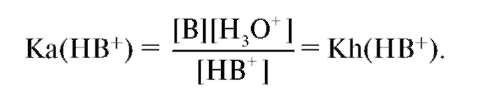
Используя выражение

можно преобразовать его к виду:

Из этого следует, что чем слабее основание, тем полнее протекает гидролиз, и, следовательно, более кислой будет реакция среды.
Расчет pH раствора соли, гидролизующейся по катиону, проводят по формуле: pH = 0,5pKa - 0,5lgc(HB+), где c(HB+) - концентрация катиона, в том числе и гидратированного иона металла.
Гидролизу анионного типа подвергаются соли, образованные слабой кислотой. Чем больше отрицательный заряд и меньше размер аниона, тем легче он отрывает протон от молекулы воды:
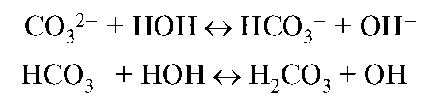
Анионы многоосновных кислот подвергаются гидролизу ступенчато.
В результате анионного гидролиза реакция среды становится щелочной. Основание, сопряженное слабой кислоте, может быть достаточно сильным, чтобы в какой-то степени конкурировать с гидроксид-ионом за протон. Некоторая часть анионов B- присоединяет протоны от молекул воды, входящих в гидратную оболочку, высвобождая гидроксид-ионы. Конкуренция гидроксид-ионов будет тем больше, чем сильнее основание, сопряженное кислоте, т.е. чем слабее кислота. Это можно подтвердить анализом выражения константы гидролиза Kh(B-), совпадающей по смыслу с константой основности ионного основания Kb(B-). В общем случае гидролиз по аниону можно записать так: B- + H2O ↔ HB + OH-.
Кислотой в левой части уравнения является вода, в правой - HB. Согласно выражению
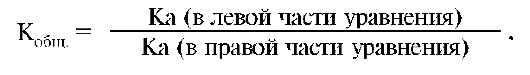
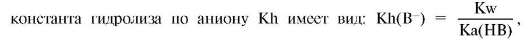
из выражения вытекает, что чем слабее кислота, тем полнее протекает гидролиз и, следовательно, тем более щелочной будет реакция среды. Например, раствор ацетата калия имеет более щелочную среду, чем раствор формиата калия той же молярной концентрации.
Расчет pH раствора соли, гидролизующейся по аниону, проводят по формуле:
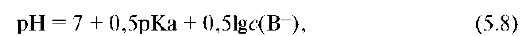
где c(B-) - концентрация аниона, равная или кратная концентрации соли.
Анализ рассчитанных значений подтверждает, что при одинаковых концентрациях раствор соли более слабой кислоты (KCN) имеет более щелочную реакцию среды, чем раствор соли более сильной кислоты (NaF).
Интенсивность гидролиза увеличивается с разбавлением растворов, т.е. с уменьшением концентрации. Степень гидролиза, как и степень ионизации, выводится с помощью закона разведения Оствальда. Степень гидролиза численно равна отношению количества вещества (иона), подвергшегося гидролизу, к общему количеству вещества (иона) в растворе и рассчитывается следующим образом:

где α - степень гидролиза; с - концентрация иона, моль/л.
Гидролизу смешанного типа подвергаются соли, образованные слабым основанием и слабой кислотой. В растворах таких солей в реакцию с молекулами воды могут вступать как катионы, высвобождая протоны, так и анионы, высвобождая гидроксид-ионы. Для определения характера среды растворов таких солей необходимо сравнивать между собой силу кислоты и основания. Например, раствор CH3COONH4 имеет почти нейтральную реакцию среды, потому что силовой показатель уксусной кислоты 4,76, а гидроксида аммония - 4,75. Оба процесса
CH3COO- + H2O ↔ CH3COOH + OH- и NH4+ + H2O ↔ H3O+ + NH3
протекают с одинаковой интенсивностью, и концентрация [OH-] = = [H3O+]. Таким образом, равновесие автопротолиза воды не нарушается и pH ≈7. В некоторых случаях гидролиз протекает полностью и необратимо, например Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑ Это объясняется тем, что ионы, сопряженные сильным электролитам, являются настолько слабыми протолитами, что не вступают во взаимодействие с водой. Равновесие автопротолиза воды в таком случае не нарушается.
В организме эссенциальные элементы существуют в виде гидратиро-ванных, гидролизованных, но чаще в виде биоорганических комплексов, что обусловлено особенностями строения их атомов. В водных растворах их соединения участвуют в протолитических реакциях ионного гидролиза: по катиону, по аниону или по катиону и аниону в зависимости от строения их атомов, концентрации и концентрации катионов водорода в растворе. Соединения d-элементов в кислых растворах находятся в виде гидратированных ионов [M(H2O)m]n+. При повышении pH растворов гидратированные ионы многих биоэлементов, вследствие большого заряда ядер их атомов и небольшого размера,
наличия большого числа свободных орбиталей, обладают сильным поляризующим действием на молекулы воды, акцепторной способностью к гидроксид-ионам, подвергаются гидролизу катионного типа, образуют прочные ковалентные связи с OH-. Процесс заканчивается образованием основных солей [M(OH)m](n-m)-. Процесс гидролитического взаимодействия может протекать с образованием многоядерных комплексов в результате процесса полимеризации.
p-Элементы имеют много валентных электронов, обладающих различной энергией. В процессе реакции p-элементы могут проявлять различную степень окисления. Биологическое действие высокомолекулярных соединений p-элементов определяется атомами (N, P, S, O), в которых они выступают в качестве биологически активных частиц, обладающих сильными нуклеофильными свойствами, характерными для полидентатных лигандов, к числу которых относятся аминокислоты, полипептиды, белки, углеводы, нуклеиновые кислоты, витамины. Для них характерны реакции комплексообразования, амфотерные свойства, реакции гидролиза анионного типа. Данные свойства определяют их участие в основных биохимических процессах, обеспечивающих состояние изогидрии. Они образуют белковые, фосфатные, гидрокарбонатные буферные системы, участвуют в транспорте питательных веществ, продуктов метаболизма и других процессах.
5.2.6. Совмещенные протолитические равновесия и конкурирующие протолитические процессы
Особый интерес представляет поведение анионов кислых солей. Теоретически они могут с водой реагировать двояко. Рассмотрим это на примере кислых солей ортофосфорной кислоты.
Дигидрофосфат-ион способен к кислотной ионизации:
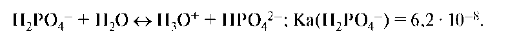
В то же время дигидрофосфат-ион может вступать с водой в реакцию гидролиза:
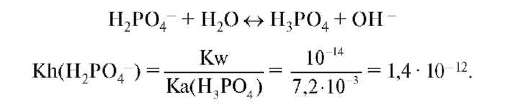
Сравнение полученных констант (Ka > Kh) показывает, что в растворе дигидрофосфата натрия должен преобладать процесс кислотной
ионизации, т.е. раствор должен быть кислым, что подтверждается экспериментально.
Для гидрофосфат-иона принципиально возможны те же процессы:
кислотная ионизация: HPO42- + H2O ↔ H3O+ + PO43-; Ka(HPO42-) =
= 4,6 • 10-13 и гидролиз: HPO42- + H2O ↔ H2PO4- + OH-.
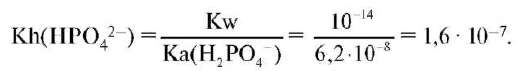
Поскольку Kh > Ka, очевидно, что преобладающим является процесс гидролиза, в результате чего раствор гидрофосфата натрия имеет щелочную среду.
Протолитические равновесия могут быть изолированными и совмещенными. Существование в растворе только одной сопряженной кислотно-основной пары (кроме воды) отвечает изолированному протолитическо-му равновесию. В том случае если в растворе существует, по крайней мере, две сопряженные кислотно-основные пары, то в системе возникают конкурентные отношения между основаниями за протон. Такое состояние отвечает совмещенному равновесию. Наиболее сильная кислота подавляет ионизацию слабой кислоты. Так соляная кислота в желудочном соке подавляет ионизацию уксусной кислоты.
5.3. ВОПРОСЫ И УПРАЖНЕНИЯ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. Основные положения протолитической теории. Автопротолиз воды.
2. Водородный показатель pH. Методы определения pH.
3. Активность и коэффициент активности. Закон разведения Оствальда.
4. Основные понятия о кислотно-основных индикаторах. Интервал перехода окраски индикатора.
5. Понятие реакций гидролиза, нейтрализации и ионизации как частных случаев протолитических равновесий.
6. Совмещенные протолитические равновесия и конкурирующие протолитические процессы в биологических системах.
7. Рассмотреть основные пути поддержания кислотно-основного равновесия в организме - состояние изогидрии.
8. Какие виды взаимодействия ионов с водой вы знаете? Какие частицы при этом образуются? Какова их биологическая роль?
9. Какая зависимость существует между зарядом и размером иона и его склонностью к гидролизу?
10. Гидролиз АТФ как универсальный источник энергии в организме.
11. Гидролиз какого типа характерен для s-, p-, d-элементов? Обоснуйте ответ исходя из особенностей строения их атомов.
12. Какая зависимость существует между степенью гидролиза соли и ее концентрацией?
13. Как повлияет температура на гидролиз аммоний ацетата?
14. Определите [ОН-], pH и рОН раствора, если [Н+] = 6•10-7 моль/л.
15. Вычислите константу гидролиза и pH для 0,1 М растворов: а) CH3COONa; б) CH3COONH4; в) NH4Cl.
16. Что будет наблюдаться при сливании солей железа (III) хлорида и натрий карбоната? Напишите ионные и молекулярные уравнения гидролиза.
5.4. ТЕСТОВЫЕ ЗАДАНИЯ
1. Какая из ниже приведенных формул является выражением водородного показателя?
а) [Н+][ОН-] = 10-14;
б) pH + рОН = 14;
в) [Н+] = 10-14/[ОН-];
г) pH = -lg[Н+];
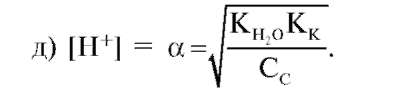
2. Кто является автором классической теории электролитической диссоциации?
а) Менделеев;
б) Аррениус;
в) Дебай;
г) Хюккель.
3. Какая из ниже приведенных формул является выражением ионного произведения воды?
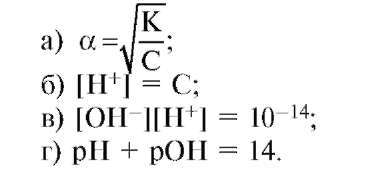
4. Какая реакция раствора будет наблюдаться при гидролизе соли NH4Cl?
а) сильнощелочная;
б) нейтральная;
в) кислая;
г) слабощелочная.
5. Гидролиз соли BiCl3 усиливается:
а) с понижением температуры;
б) с добавлением соляной кислоты;
в) с разбавлением раствора;
г) с увеличением концентрации соли.
6. В чем измеряется степень гидролиза?
а) моль/л;
б) долях единицы или в процентах;
в) г/мл;
г) моль/кг;
д) моль/мл.
7. В каком случае гидролиз будет протекать полно и необратимо?
а) NaCl + H2O →
б) Cu(NO3)2 + H2O →
в) NH4Cl + H2O →
г) Al2(SO4)3 + Na2CO3 + H2O →
д) NH4NO3 + H2O →
8. Какая из указанных солей подвергается гидролизу?
а) KCl;
б) BaSO4;
в) Na2CO3;
г) CuS;
д) Na2SO4.
9. Какая соль будет подвергаться сложному (ступенчатому) гидролизу?
а) NaCl;
б) CH3COONa;
в) Na3PO4;
г) NH4Cl;
д) NH4NO3.
10. У какой соли гидролиз будет простым?
а) Na2CO3;
б) K2SO4;
в) AlCl3;
г) NH4Cl;
д) K2S.