Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Часть III.БИОГЕОХИМИЯ И ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Глава 10. БИОГЕОХИМИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Химию в ее современном состоянии можно назвать учением об элементах.
Д. И. Менделеев
10.1. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ В ОКРУЖАЮЩЕЙ
СРЕДЕ И В ОРГАНИЗМЕ. ПОНЯТИЕ О БИОГЕОХИМИИ, БИОСФЕРЕ
И ГЕОХИМИЧЕСКОЙ ЭКОЛОГИИ.
ПОРОГОВЫЕ КОНЦЕНТРАЦИИ ЭЛЕМЕНТОВ. МИКРО- И МАКРОЭЛЕМЕНТНЫЙ ГОМЕОСТАЗ
В естественных условиях на нашей планете в более или менее ощутимых количествах обнаружено 92 элемента. На стыке химии, биологии и геологии возникла новая наука биогеохимия. «Биогеохимия - интегрированная наука об элементном составе живого вещества и его роли в миграции, трансформации и концентрировании химических элементов и их соединений в биосфере, их биологической роли. Она является приоритетным научным направлением в связи с техногенной эволюцией планеты и поисками адекватных путей взаимодействия человека и природы». Часть земной оболочки, переработанная человеком, природой и космическими излучениями и приспособленная к жизни, называют биосферой.
В.И. Вернадский в работе «Биосфера и ноосфера» писал: «...Биосферу определяют как область жизни, однако более точно ее можно определить как оболочку, в которой могут происходить изменения, вызванные приходящим солнечным излучением. Вещество, составляющее биосферу, неоднородно, и мы различаем косное и живое вещество. Косное вещество преобладает по массе. Происходит непрерывная миграция атомов из косного вещества биосферы в живое и обратно». «Живое вещество охватывает и регулирует в области биосферы все или почти все химические элементы. Они все нужны для жизни и все попадают в состав
организма не случайно. Нет особых, жизни свойственных элементов. Есть господствующие» (Вернадский В.И., 1938). «Жизнь есть планетное явление», которое определяет основным образом химизм, миграцию всех химических элементов верхней земной оболочки биосферы. Многие десятки и сотни тысяч химических реакций, совершающихся в живом теле, не только гармонично сочетаются в едином порядке, но весь этот порядок закономерно обусловливает самосохранение и самовоспроизведение всей жизненной системы в целом в данных условиях внешней среды, в поражающем соответствии с этими условиями. В.В. Ковальский (1982), развивая идеи В.И. Вернадского - «организм и среда» (в частности биогеохимическая), отметил, что организм и среда, настолько зависимые явления в биосфере, что невозможно рассматривать отдельно эволюцию жизни и среды. Это единая система, в которой в процессах ее существования вырабатываются характерные особенности у организмов к среде, включаемых в число фенотипических реакций, обогащающих систему «жизнь - среда».
В этой системе устанавливаются по отношению к геохимическим факторам среды глубокие метаболические связи. Примером может служить выделение в почвенную среду органических веществ, дающих с химическими элементами среды вне организма комплексные соединения, в которых химические элементы (металлы, микроэлементы) приобретают активность в процессах проникновения через клеточные мембраны и в последующих превращениях в звеньях биогенного цикла. Урбанизированные ареалы выступают не только самостоятельными источниками эмиссии новых соединений, но и ареной формирования техногенной хелатной матрицы, которая поглощает металлы в комплексы и включает их в глобальный миграционный цикл. Изучение влияния химических элементов среды на обменные процессы, выявление причинных зависимостей нормальных и патологических реакций организмов от факторов биогеохимической среды в природных условиях и эксперименте составляют конечную цель в геохимической экологии как следствие системного изучения биосферы. При воздействии на организм имеет значение природа, концентрация, доза, мольное соотношение элементов, форма и условия, в которых они находятся. Поэтому в организме под влиянием отдельных элементов и их совместного действия может наблюдаться усиление или ослабление биохимических процессов и даже дисфункции процессов обмена веществ. Об этом свидетельствуют единство механизмов, лежащих в основе концентрирования элементов живым веществом, которое связано как с особенностями химического состава биологической системы и процессов
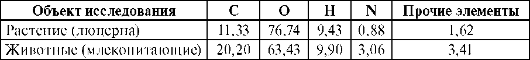
метаболизма в ней, так и со строением и свойствами химических элементов. Согласно биогеохимической теории В.И. Вернадского, биосфера не только среда, в которой происходит жизнедеятельность, но и сама является результатом этой жизнедеятельности. Специфика биосферы состоит в том, что в ней постоянно происходит обусловленный деятельностью организмов круговорот элементов. В организме можно обнаружить почти все элементы, которые есть в земной коре и морской воде. По теории В.И. Вернадского существует биогенная миграция атомов по цепочке: почва > вода > пища > человек. Реальные зоны, в которых в результате жизнедеятельности осуществляется круговорот элементов, называются экосистемами и, как назвал их В.Н. Сукачев, биогеоценозами. По мнению А.П. Виноградова (1949) содержание микроэлементов в организме является характерным признаком вида и зависит от ряда условий: возраста, пола, времени года и суток, условий труда и физиологических состояний. Установлены биоритмы колебаний содержания элементов (в 3-часовом интервале до 100%) для макро- и микроэлементов. Однако в нормально функционирующей системе хаоса в элементном составе нет. Несмотря на многообразие природных условий, человек, животные и растения в целом имеют сходный элементный химический состав (табл. 10.1).
Таблица 10.1. Содержание элементов органогенов, %
В образовании комплексных соединений участвуют как макро-, так и микроэлементы, и их свойства определяются строением и соотношением данных элементов, условиями их функционирования. По ряду веществ химический состав организма очень лабилен. Соотношение органических составляющих (лигандов), образованных макроэлементами, и комплексообразователей - ионов металлов - центральных частиц комплексов заметно варьирует.
Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом, способных к образованию комплексных соединений, то наблюдаются конкурирующие равновесия: в первом случае лигандообменное - конкуренция за ион металла, во втором - металлообменное между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса.
В природе никогда не действует изолированно один химический элемент, значение имеют природа, концентрация и соотношение между элементами (Аnke М., Ge1i М., 1995-1996). В биологических системах комплексные соединения - наиболее обширный и разнообразный класс соединений (Джиллард Р.Д., 1967). В работе Г.Н. Саенко (1992) показана прямая и обратная взаимосвязь между органическими био-лигандами, биокомплексами металлов и общим содержанием металлов: общее содержание металлов комплексные соединения металлов органические лиганды. Важнейшие процессы жизнедеятельности протекают с участием биологически активных соединений и зависят от их состава, содержания, соотношения иона металла и органической составляющей, называемой биотиком. Биотиками считают вещества, в количественном и качественном отношении свойственные организму, обладающие физиологической активностью, способные регулировать нарушенные процессы обмена веществ в организме, повышать его защитные функции.
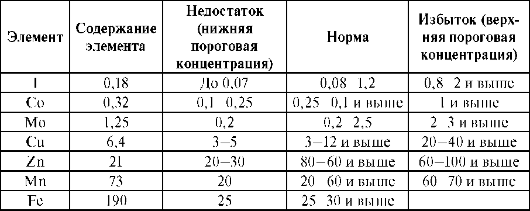
В организме животных обнаружено более 60 элементов, причем 45 из них определены количественно и являются постоянными составными частями организма. Элементы, жизненно необходимые организму, называют биогенными элементами. Биогенность 30 элементов установлена. Концепция гомеостаза является центральной проблемой геохимической экологии и отражает состояние относительного постоянства внутренней и внешней среды организма. По мнению В.В. Ковальского, 1991 макро- и микроэлементный гомеостаз определяется не только их биологической природой, средой, но и пищевыми цепями, через которые осуществляется связь организма и среды. В пищевой цепи может происходить уменьшение концентрации одних химических элементов и накопление других. Животные и человек получают биогенные элементы в основном из растительной и животной пищи. Установлены ориентировочные пороговые концентрации ряда химических элементов, выше и ниже которых проявляются биологические эффекты на целом организме (табл. 10.2).
Пороговые концентрации для каждого элемента - величины относительные; они могут повышаться или понижаться в зависимости от концентрации других элементов, вида организма, биологического состояния, сезона года и содержания элементов на техногенных территориях. Например, содержание железа в пастбищных растениях. Данные о формировании биогеохимических аномалий свидетельствуют об интенсивном вовлечении железа в локальные биогеохимические циклы.
Таблица 10.2. Пороговые концентрации микроэлементов в кормах, мг/кг сухого корма
Несмотря на широкие колебания содержания макро- и микроэлементов в продуктах питания, почве, воде, в растительных и животных организмах, содержание макро- и микроэлементов остается постоянным. Однако биорегуляторные механизмы не беспредельны, и в экстремальных условиях могут наблюдаться нарушения макро-, микроэлементного, молекулярного и антиоксидантного гомеостаза, что может быть лимитирующим фактором роста и развития организма. Поэтому сохранение гомеостаза является важнейшей задачей любой биологической системы. В организме постоянно образуются вещества, обладающие окислительными свойствами. В живых организмах анти-оксидантная защита представлена различными системами, которые при нормальном функционировании организма находятся во взаимно компенсаторном взаимодействии. Снижение концентрации или активности одних антиоксидантов приводит к соответствующему изменению других. Структура межорганных и межсистемных взаимодействий отражает триггерный характер процессов адаптации. Человек, растения и животные постоянно подвергаются прооксидантному действию окружающей среды, которая подвергается техногенному загрязнению. Следовательно, актуальны исследования взаимодействий между макро-, микроэлементами и разработка методов антиоксидантной терапии.
Содержание некоторых элементов в организме по сравнению с окружающей средой повышенное, и это называют биологическим концентрированием элемента. Например, углерода в земной коре 0,35%, и по содержанию в живых организмах он занимает второе место (21%). Эта закономерность наблюдается не всегда. Так, кремния в земной коре 27,6%, а в живых организмах его мало, алюминия - 7,45%,
в живых организмах - 1•10-5%. Наиболее выражена концентрационная функция у морских организмов. Обнаружено повышенное концентрирование 10 переходных элементов, особенно характерное для железа, титана и марганца. Различие между концентрациями кремния, титана и алюминия в земной коре и их небольшим содержанием в живом веществе обусловлено растворимостью в воде соединений этих элементов. Биоконцентрирование характерно для отдельных органов (печени, почек, пищеварительного тракта). Из них микроэлементы вовлекаются в процессы метаболизма для поддержания микроэлементного гомео-стаза. Степень концентрирования элементов определяется уровнем организации материи в пользу структур, несущих определенную физиологическую нагрузку.
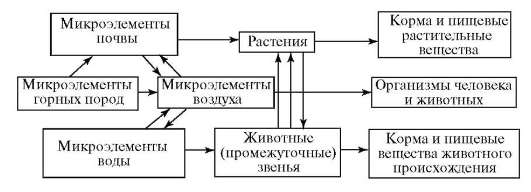
Рис. 10.1. Биохимические пищевые цепи химических элементов (Ковальский В.В., 1974)
Доказано, что от химического элементного состава среды обитания организмов зависят их морфологическая и физиологическая изменчивость, размножение, рост и развитие (рис. 10.1). Поэтому нарушение баланса химических элементов в среде, как это происходит в биогеохимических провинциях, вызывает патологические изменения в организме животных и человека. Становится очевидным, что наряду с биогеохимическими эндемиями природного происхождения следует изучать эндемические болезни, являющиеся реакцией на аномальный состав природной среды, измененной техногенной деятельностью человека. Использование огромных масс химических элементов, обусловленное техногенезом, пока не сказывается на глобальных циклах химических элементов, поддерживающих целостность биосферы. Но в будущем ряд техногенных процессов может оказать заметное влияние на миграцию элементов в биосфере (блокирование атмосферного азота, окисление серы и углерода, повышение кислотности природных вод), способствуя образованию техногенных
провинций в результате изменения биогеохимических циклов отдельных химических элементов и их групп. Несомненно, более глубокого подхода требует и оценка биологических реакций организмов на экстремальные техногенные и природные факторы.
10.2. КЛАССИФИКАЦИИ БИОГЕННЫХ ЭЛЕМЕНТОВ.
КРИТЕРИИ ОЦЕНКИ БИОГЕННОСТИ ЭЛЕМЕНТОВ
И ИХ СОЕДИНЕНИЙ
Существует несколько классификаций биогенных элементов. По В.И. Вернадскому, в зависимости от среднего содержания выделено 3 группы:
• макроэлементы, содержание которых в организме выше 10-2%; к ним относятся кислород, углерод, водород, азот, кальций, фосфор, сера, калий, натрий, хлор, магний; они составляют 99,99% живого субстрата; еще более поразительно, что 99% живых тканей содержат только шесть элементов: С, Н, О, N, P, Са;
• микроэлементы, содержание которых в организме находится в пределах от 10-2 до 10-5%; к ним относятся кремний, йод, фтор, стронций, железо, марганец, медь, цинк, рубидий, бром и др.;
• ультрамикроэлементы, содержание которых в организме ниже 10-5%; к ним относятся молибден, селен, титан, кобальт, цезий и др.
Макроэлементы - C,P, H,O,N,S - входят в состав белков, нуклеиновых кислот. В зависимости от функциональной роли макроэлементы делят на органогены, в организме их 97,4% (С, Н, О, N, Р, S), и элементы электролитного фона (Na, К, Са, Мg, Cl) (табл. 10.3, 10.4). Содержание углерода в белках от 51 до 55%, кислорода - от 22 до 24%, азота - от 15 до 18%, водорода - от 6,5 до 7%, серы - от 0,3 до 2,5%, фосфора - около 0,5%. Максимальное количество белков (80%) животных и человека содержится в селезенке, легких, мышцах; минимальное (~25%) в костях и зубах. Углерод, водород и кислород входят в состав углеводов, содержание которых ~2%. Эти элементы входят в состав липидов, а в состав фосфолипидов входят также соединения фосфора. Липиды концентрируются в головном мозге (12%), в печени (5%), молоке 2-3%, сыворотке крови 0,6%. Основное количество соединений фосфора (600 г) содержится в костной ткани, что составляет 85% массы всего фосфора, входящего в состав организма. Кальций, калий, натрий, магний и хлор называют элементами электролитного фона. Наибольшее содержание кальция приходится на костную ткань
(до 17% ее массы), более половины содержания магния также находится в костной ткани. Фракция внекостного кальция составляет всего 1% его общего содержания. Элементы К, Na, Mg, Fe, Cl, S называют олигобиогенными элементами. Содержание их колеблется от 0,1 до 1%.
Таблица 10.3. Содержание макроэлементов-органогенов в организме
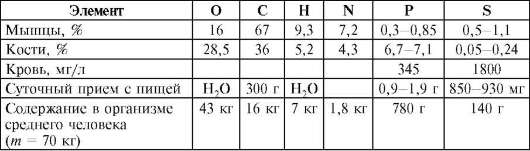
Таблица 10.4. Содержание элементов электролитного фона в организме
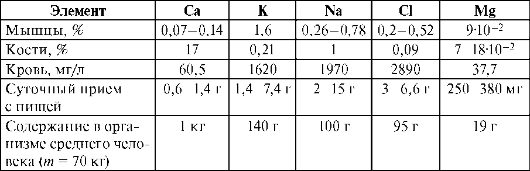
Элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Их содержание <0,001% (10-3-10-5%). Большинство микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Некоторые микроэлементы проявляют сродство к определенным тканям (йод - к щитовидной железе, фтор - к эмали зубов, цинк - к поджелудочной железе, молибден - к почкам и т.д.). Элементы, содержание которых меньше, чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов не выяснены до конца. Некоторые из них постоянно содержатся в организме животных и человека: Ga, Ti, F, Al, As, Cr, Ni, Sc, Ge, Sn и др. Биологическая роль их мало выяснена. Их относят к условно-биогенным элементам. Другие элементы (Те, Sc, In, W, Re и др.) обнаружены в организме человека и животных, а данные об их количестве и биологической
роли не выяснены. Они отнесены к примесным элементам. Примесные элементы делят на аккумулирующиеся (Hg, Pb, Cd) и неаккумули-рующиеся (Al, Ag, Ga, Ti, F). Известны крылатые слова, сказанные немецкими учеными Вальтером и Идой Ноддак: «В каждом булыжнике на мостовой присутствуют все элементы периодической системы». Если согласиться с этим, то тем более это должно быть справедливо для живого организма.
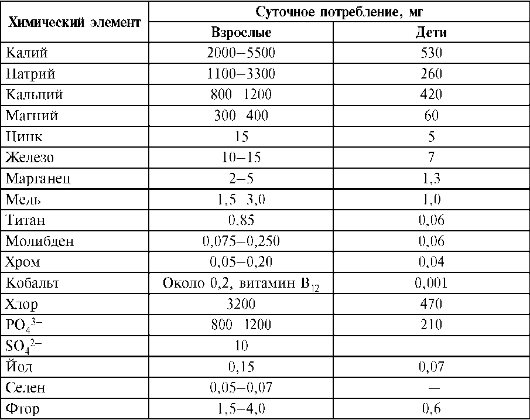
Все живые организмы имеют тесный контакт с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствуют питание и потребляемая вода. Организм состоит из воды на 60%, 34% приходится на органические вещества, 6% - на неорганические. Основными компонентами органических веществ являются С, Н, О. B их состав входят также N, Р, S. В составе неорганических веществ обязательно присутствуют 22 химических элемента. Например, если вес человека составляет 70 кг, то в нем содержится (в граммах): Са - 1700, К - 250, Na - 70, Mg - 42, Fe - 5, Zn - 3. На долю металлов приходится 2,1 кг. Содержание в организме элементов IIIA-VIA групп, ковалентносвязанных с органической частью молекул, уменьшается с ростом заряда ядра атомов данной группы периодической системы Д.И. Менделеева. Например, ω(О) > ω(S) > ω(Se) >ω(Fe). Количество элементов, находящихся в организме в виде ионов (s-элементы IA, IIA групп, р-элементы VIIA группы), с ростом заряда ядра атома в группе увеличивается до элемента с оптимальным ионным радиусом, а затем уменьшается. Например, во IIA группе при переходе от Be к Са содержание в организме увеличивается, а затем от Ва к Ra снижается (Ершов Ю.А. и др., 2000). Элементы-аналоги, имеющие близкое строение атомов, имеют много общего в биологическом действии. В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определенном уровне (табл. 10.5).
Столько же химических элементов должно выводиться из организма, поскольку их содержание в организме находится в относительном постоянстве. Классификация, основанная на концентрации элементов в организме проста и удобна, но она не отвечает на главный вопрос биологической роли элементов.
Классификация, основанная на биологической роли элементов, делит элементы, обнаруженные в организме, на три группы: жизненно необходимые (биогенные, эссенциальные); условно-необходимые и примесные элементы с мало изученной или неустановленной ролью (рис. 10.2).
Таблица 10.5. Суточное поступление химических элементов в организм человека
Группа эссенциальных элементов включает в себя все макроэлементы, часть микро- и ультрамикроэлементов. Следовательно, концентрация того или иного элемента в организме не определяет его биологическое значение.
Элемент может быть отнесен к биогенным (эссенциальным) элементам, если он удовлетворяет следующим требованиям (Георгиевский В.И. и др., 1979):
• постоянно присутствует в организме в количествах, сходных у разных индивидуумов;
• ткани по содержанию элемента всегда располагаются в определенном порядке;
• питательный рацион, не содержащий этого элемента, вызывает у животных характерные симптомы недостаточности и определенные биохимические изменения в тканях (микроэлементозы);
• эти симптомы и изменения могут быть предотвращены или устранены путем добавления данного элемента в пищу.
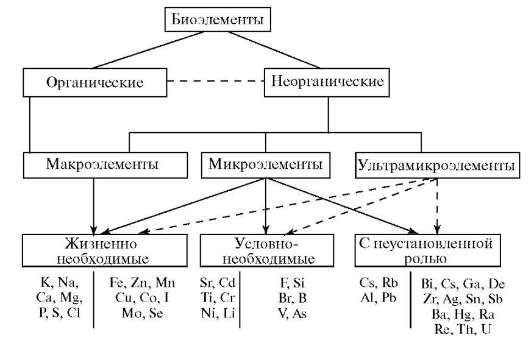
Рис. 10.2. Классификация биогенных элементов (Георгиевский В.И., 1979)
По мнению основоположников биогеохимии, все имеющиеся в природе элементы необходимы для существования живого вещества. В настоящее время нет единого мнения по биогенным элементам. Ряд авторов относят к числу биогенных элементов 17 химических элементов (H, C, N, O, Ca, Mg, K, Na, P, S, Cl, Fe, Zn, Mn, Cu, Co, Mo). Другие придерживаются иной точки зрения и увеличивают число эссенциальных элементов до 30. Но эта точка зрения не является общепринятой. В группу эссен-циальных элементов МЭ P.J. Aggett (1985) относит МЭ: Fe, Cu, Zn, Mn, Cr, Se, Mo, I, Co. Воспроизведение феномена эссенциальности и, в частности, поддержание жизни, нормального роста и развития, репродуктивной способности, предотвращение заболеваний и преждевременного летального исхода были получено и у потомства животных (Anke M. et al., 1987). Эти авторы различают классические МЭ, перечень которых совпадает с приведенным выше (с добавлением фтора и так называемые новые эссенциальные МЭ: Si, Sn, V, Ni, As, Cd, Li, Pb) (Авцын А.В. и др., 1991). Итак, эта точка зрения пока еще не является общепризнанной:
• доказательством биогенности элемента эти авторы считают распространенность в природе, всасывание, транспорт, выделение из организма, физиологическая роль и патологические процессы, обусловленные дефицитом и избытком МЭ в организме животных и человека;
• токсичные элементы обнаруживаются во всех исследованных органах, причем их концентрация в почках необычно высока - 0,59 ммоль/кг. Ртуть содержится во всех органах, причем в головном мозге его концентрация достигает 0,014 ммоль/кг; еще выше концентрация данного микроэлемента в печени (0,018 ммоль/кг). Таллий во всех органах находится почти на одном уровне (1,96 ммоль/кг) и только в головном мозге увеличивается до 2,44 мкмоль/кг. Содержание Sn также необычно высокое в головном мозге (16,8 мкмоль) и на порядок превышает соответствующие показатели в сердце и почках;
• содержание МЭ в крови невелико. Многие авторы считают их условно-эссенциальными или физиологически инертными МЭ;
• закономерная реакция на добавку МЭ в состав пищи, возникновение дефицита МЭ при устранении его из диеты, коррекция состояние МЭ с субнормальным уровнем его концентрации в крови или в тканях лабораторных животных;
• содержание МЭ в различных органах и тканях эмбрионов и плодов человека в пренатальном периоде указывает на биогенность элемента. В процессе онтогенеза определенные органы и ткани способны концентрировать те или иные МЭ. Большинство исследователей объясняют это физиологической ролью МЭ и специфической деятельностью органа у новорожденных. Наибольшее количество Cu, Ti содержится в зрительных буграх и продолговатом мозге. В зрелом возрасте Ti концентрируется в коре полушарий большого мозга.
Вероятно, что необходимые элементы (или условно-эссенциальные) также можно обнаружить в различных биосредах в относительно стабильных количествах, однако они не удовлетворяют всем перечисленным выше требованиям. Участие этих элементов в обменных процессах может ограничиваться отдельными тканями и в ряде случаев требует экспериментального подтверждения. Что касается элементов, роль которых в организме мало изучена или неизвестна, то некоторые из них, по-видимому, случайно накапливаются в организме, поступая с пищей и не выполняя какой-либо полезной функции. Однако строго ограничивать группу биогенных элементов тоже нельзя, поскольку возможно открытие биологической роли новых элементов. Например, в последние годы установлена биотическая роль селена, появились экспериментальные и клинические данные об участии в метаболических процессах фтора, хрома, кремния, мышьяка.
Классификация элементов по степени их биогенности, как и две предыдущие, содержит существенные недостатки: она имеет слишком
общий вид, не отражает механизма влияния элементов на организм и не позволяет достаточно точно предвидеть возможную биологическую роль или токсикологический эффект того или иного элемента. В настоящее время исследователи вынуждены давать индивидуальную оценку каждому элементу. В принципе любой химический элемент, пройдя биогеохимические барьеры, приобретает «биотический вид», т.е. становится биоэлементом. Например, кларк Si и Al в цепочке «почва - растения - животные организмы и человек» прогрессирующе снижается, при этом уменьшаются роль и значение этих двух элементов для живых (биотических) систем. По мере продвижения по пищевой (трофической) цепи у некоторых элементов происходит процесс аккумуляции в живых организмах, (например, цинка), а других элементов (Si, Al, Ti) в количественном выражении становится меньше.
Основу живых систем составляют 6 элементов, так называемых органогенов. К ним относятся углерод, водород, кислород, азот, фосфор и сера. Органогены по своему содержанию в организме относятся к макроэлементам, составляя 97,4% массы живого организма, и играют важнейшую роль в поддержании жизнедеятельности. Для органогенов характерно образование водорастворимых соединений, что способствует их концентрированию в живых организмах. Разнообразие биомолекул в живых организмах определяется способностью органогенов к образованию множества различных химических связей. Из органогенов, или «органических макроэлементов», в основном состоят углеводы, белки, жиры и нуклеиновые кислоты. Главная функция макроэлементов состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава.
Микроэлементы, входя в состав ферментов, гормонов, витаминов и биологически активных веществ в качестве комплексообра-зователей или активаторов, участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсичных веществ. Микроэлементы активно влияют на процессы кроветворения, окисления-восстановления, проницаемость сосудов и тканей (Ершов Ю.А., Плетенева Т.В., 1989).
Микроэлементы непосредственно участвуют в построении витаминов, применяемых в качестве общеукрепляющего и общетонизирующего средства. Примером может служить витамин B12 (цианкобаламин), в структуру которого входит кобальт - 4,5%. Содержание витаминов в растениях соответствует содержанию в них того или иного микроэлемента. Например, содержание марганца и витамина B1. Выявлена взаимосвязь между микроэлементами и витаминами у ряда микроэлементов
(Мп, Cu, Zn), способность влиять на синтез некоторых витаминов - аскорбиновую кислоту, витамин B1. К витаминам относятся некоторые органические вещества разнообразной природы. Суточная потребность в них, как и в микроэлементах, измеряется весьма малыми количествами - миллиграммами и даже микрограммами (витамин D - 25 мкг). В организме они обычно участвуют в качестве необходимых компонентов ферментативных процессов путем вхождения элемента в про-стетическую группу фермента.
Общефизиологическое значение микроэлементов связано также и со специфической функцией желез внутренней секреции. Их деятельность связана с содержанием определенных микроэлементов в организме. Например, йод - с функцией щитовидной железы, цинк - с функцией семенников и инсулярного аппарата поджелудочной железы. Экспериментально доказана возможность влияния на функцию щитовидной железы и других микроэлементов Co, Ca. Роль эндокринных желез многообразна. Так, щитовидная железа влияет на белковый, углеводный и жировой обмен веществ, на рост, развитие организма и центральную нервную систему. В свою очередь, гипофиз с его тиреотропным гормоном влияет на функцию щитовидной железы. Микроэлемент может иметь много точек приложения в ферментных системах и, следовательно, через них распространять свое влияние на организм, в том числе и на эндокринные железы.
В организмах постоянно содержатся такие радиоактивные элементы, как радий, уран. В больших концентрациях они угнетают и нарушают нормальное протекание физиологических процессов. Однако при использовании их в чрезвычайно малых концентрациях, близких к естественному содержанию в обычных условиях природы, они могут стимулировать ряд биологически важных процессов. Уран, например, способствует лучшему прорастанию семян, ассимиляции угольной кислоты на свету и усвоению азота корнями растений. Радиоактивные вещества широко применяются в медицине. Поэтому их можно причислить к биотическим элементам. Микроэлементы в организме в основном проявляют активность в ионной форме и, будучи носителями электронного заряда, входят в структуру соответствующих биологически активных веществ.
По данным F. Kieffer (1990), содержание микроэлементов, таких, как ванадий, хром, марганец, кобальт, никель, медь, селен, молибден, олово, йод, в теле человека находится в пределах между 3 и 100 мг на 70 кг веса. Возникает вопрос: могут ли столь незначительные количества выполнять биологические функции? Проще найти ответ, если
выразить вес в молярных количествах. Величины этих показателей свидетельствуют, что тело человека содержит по меньшей мере 1019 ионов каждого из этих элементов, если принять за факт, что в теле человека находится примерно 1014 клеток (эту цифру приводят многие учебники биологии) и что каждая клетка должна содержать от 105 до 106 ионов этих элементов. Метаболически активные клетки будут содержать даже большее количество, тогда как в случае жиров, хрящей и костей наблюдается противоположная картина. Таким образом, даже самые редкие из элементов способны оказывать физиологическое воздействие на каждую клетку организма.
Мы считаем, что все постоянно содержащиеся в организме элементы выполняют определенную жизненно важную функцию. Современное состояние знаний о биологической роли элементов можно характеризовать как поверхностное прикосновение к этой проблеме. Накоплено много фактических данных по содержанию элементов в различных компонентах биосферы, ответные реакции организма на их недостаток и избыток. Составлены карты биогеохимического районирования и биогеохимических провинций. Но нет общей теории, рассматривающей функции, механизм воздействия и роль микроэлементов в биосфере. Характерным признаком жизненной необходимости элемента является колоколообразный характер кривой, построенной в координатах: ответная реакция организма (R) - доза элемента (Д) (рис. 10.3).
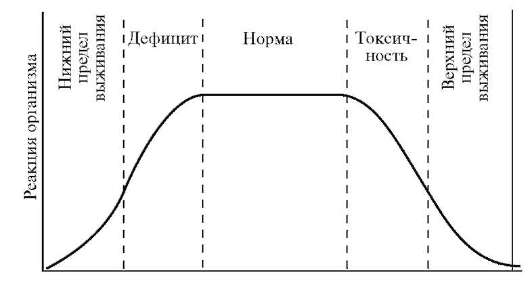
Рис. 10.3. Зависимость реакции организма от дозы соединений железа в пище в определенном интервале концентраций (по Ершову Ю.А. и др., 2000)
При недостаточном поступлении элемента в организм наносится существенный ущерб росту и развитию организма. Это объяс-
няется снижением активности ферментов, в состав которых входит элемент. При повышении дозы этого элемента ответная реакция организма возрастает, достигает нормы (биотическая концентрация элемента). Чем больше ширина плато, тем меньше токсичность элемента. Дальнейшее увеличение дозы приводит к снижению функционирования вследствие токсического действия избытка элемента вплоть до летального исхода. Дефицит и избыток биогенного элемента наносят вред организму. Все живые организмы реагируют на недостаток и избыток или неблагоприятное соотношение элементов.
Обычные микроэлементы, когда их концентрация в организме превышает биотическую концентрацию, проявляют токсическое действие на организм. Токсичные элементы при очень малых концентрациях не оказывают вредного воздействия на организм. Например, мышьяк при микроконцентрациях оказывает биостимулирующее действие. Следовательно, нет токсичных элементов, а есть токсичные дозы. Таким образом, малые дозы элемента - лекарство, большие дозы - яд. «Все есть яд, и ничто не лишено ядовитости, одна лишь доза делает яд незаметным», - говорил Парацельс. Уместно вспомнить слова таджикского поэта Рудаки: «Что нынче снадобьем слывет, то завтра станет ядом».
Итак, биогенность 30 элементов установлена. Относительно постоянно содержание в организме человека 70 элементов (в пределах порядка). Отмечаются сильные колебания уровня (несколько порядков) примесных элементов у горожан и относительно низкий уровень примесных элементов у сельских жителей. Постоянство содержания необходимых элементов вероятнее всего определяется эффективными механизмами гомеостаза. Предположения ученых идут еще дальше. «В живом организме не только присутствуют все элементы, но каждый из них выполняет какую-то функцию» (Вернадский В.И., 1937; Авцын А.В. и др., 1991).
В 1937 г. В.И. Вернадский сделал предположение о том, что титан нужен для организма и выполняет определенные жизненно важные функции. Титан относится к числу наиболее распространенных в природе элементов. В земной коре содержание только девяти элементов (О, Fe, Si, Са, Mg, К, Na, Al, Н) превышает титан, массовая доля которого составляет 0,61%. Содержание титана в тканях рыб составляет 10-4%, в организме животных, обитающих на суше, - 9•10-4%. В организме человека он обнаружен еще в 19 веке. Концентрация его в пределах 10-6%. Содержание титана в крови человека колеблется от 2,3 до 20,7 мг% на золу. Цельная кровь содержит 6,53 мкг% титана, эритроциты - 2,34 мкг%, плазма - 2,39 мкг%, лейкоциты - 0,0067 мкг%. В органах челове-
ка содержание титана составляет в среднем 1 мг% на золу или 0,02 мг% на сырое вещество. Распределение титана в различных отделах головного мозга неравномерно. Наибольшее количество его обнаружено в слуховом центре и зрительном бугре. Он постоянно присутствует в женском молоке в количестве 14,7 мг%. Постоянное присутствие титана в эмбрионе указывает на проходимость плаценты для циркулирующих в крови соединений титана и является собирателем соединений титана.
Отмечено возникновение ряда заболеваний при нарушении обмена титана. В развернутой фазе острого лейкоза, при гастрогенной железодефицитной анемии, постгеморрагической анемии, раке, язвенной болезни желудка и при оперативном вмешательстве в ранние послеоперационные сроки содержание титана в крови снижается. Нарушение обмена титана отмечено также при болезни Боткина, токсикозе и нефропатии беременных, у больных микробной экземой и нейродермитом, при ожогах.
В качестве одного из показателей активного включения соединений титана в метаболические процессы можно привести их взаимосвязь с одним из белков плазмы крови - сывороточным альбумином, который обеспечивает биотранспорт низкомолекулярных веществ в организме. Отмечены в основном три фактора влияния соединений титана на биообъекты: интенсификация синтеза аминокислот, белков, углеводов и липидов; активирующее действие на кроветворные, ферментативные системы; участие в обеспечении макро-, микроэлементного гомеостаза и повышение гомеостатической емкости. Следовательно, титан можно отнести к жизненно необходимым неаккумулирующимся элементам (Жолнин А.В., 2005).
10.3. СВОЙСТВА СОЕДИНЕНИЙ S-ЭЛЕМЕНТОВ
10.3.1. Общая характеристика s-элементов и их соединений
Биогенные элементы подразделяют на элементы: s-, p- и d-блоки. Химические элементы, в атомах которых заполняются электронами s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns1-2. Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов - типичные активные металлы; показателем этого является невысокий потенциал их ионизации. Катионы IIА группы имеют меньший радиус и больший заряд и обладают, следовательно, более высоким поляризующим действием,
образуют более ковалентные и менее растворимые соединения. Атомы стремятся принять конфигурацию предшествующего инертного газа. При этом элементы IA и IIA групп образуют соответственно ионы М+ и М2+. Химия таких элементов является в основном ионной химией, за исключением лития и бериллия, которые обладают более сильным поляризующим действием.
Для s-элементов IA группы небольшой заряд ядер атомов, невысокий потенциал ионизации валентных электронов, большой размер атома и увеличение его в группе сверху вниз определяют состояние их ионов в водных растворах в виде гидратированных ионов. Наибольшее сходство лития с натрием обусловливает их взаимозаменяемость, синергизм их действия. Деструктурирующие свойства в водных растворах ионов калия, рубидия и цезия обеспечивают их лучшую мембранопроница-емость, взаимозаменяемость и синергизм их действия. Концентрация К+ внутри клеток в 35 раз выше, чем вне, а концентрация Na+ во внеклеточной жидкости в 15 раз больше, чем внутри клетки. Эти ионы в биологических системах являются антагонистами, s-элементы IIA группы в организме находятся в виде соединений, образованных фосфорной, угольной и карбоновой кислотами. Кальций, содержащийся в основном в костной ткани, по своим свойствам близок к стронцию и барию, которые могут замещать его в костях. При этом наблюдаются как случаи синергизма, так и антагонизма. Ионы кальция являются также антагонистами ионов натрия, калия и магния. Сходство физико-химических характеристик ионов Be2+ и Mg2+ обусловливает их взаимозаменяемость в соединениях, содержащих связи Mg-N и Mg-O. Этим можно объяснить ингибирование магнийсодержащих ферментов при попадании в организм бериллия. Бериллий - антагонист магния. Следовательно, физико-химические свойства и биологическое действие микроэлементов определяются строением атомов.
В водном растворе ионы способны в небольшой степени к реакциям комплексообразования, образованию донорно-акцепторных связей с монодентатными лигандами (аквакомплексы) и даже с полиден-татными лигандами (эндо- и экзогенными комплексонами). Такие комплексы обладают, как правило, невысокой устойчивостью. Более прочные комплексы образуются с циклическими полиэфирами - краун-эфирами, которые представляют собой плоский многоугольник. Ионы s-элементов имеют связи сразу с несколькими атомами кислорода соединения типа циклической молекулы, которые называют макроциклическими соединениями. Это мембраноактивные комплексо-ны (ионофоры) - соединения, переносящие ионы s-элементов через
липидные барьеры мембран. Молекулы ионофоров имеют внутримолекулярную полость, в которую может войти ион определенного размера, геометрии по принципу ключа и замка. Полость окаймлена активными центрами (эндорецепторами). В зависимости от природы металла может происходить нековалентное взаимодействие (электростатическое, образование водородных связей, проявление ван-дер-ваальсовых сил) со щелочными металлами (грамицидин с Na+, валиномицин с К+ [рис. 10.4]) и ковалентное - со щелочноземельными металлами. Образуются при этом супрамолекулы - сложные ассоциаты, состоящие из двух химических частиц или более, удерживаемых вместе межмолекулярными силами.
Двухзарядные ионы элементов IIА группы являются более сильными комплексообразователями. Для них наиболее характерно образование координационных связей с донорными атомами кислорода, а для магния - также с атомами азота (порфириновая система). Из макроци-клических соединений приведенный ниже представитель криптандов высоко селективен по отношению к катиону стронция.
Криптанд - это макроциклический лиганд, который связывает катионы еще более специфично, чем циклические эфиры. В молекулах криптан-дов атомами, общими для всех циклов (узловыми атомами), могут быть С и N, атомами в циклах - О, S и N. Если узловые атомы в молекуле соеди-
нены оксиэтиленовыми цепочками, то в тривиальных названиях крип-тандов цифрами в квадратных скобках перед словом «криптанд» указывается количество эфирных атомов О в каждой цепочке, причем первой указывается наиболее длинная цепь. Размер полости криптанда задается по трем направлениям, а не в плоскости, как это было в случае краун-эфира. Комплексы металлов с криптандами существенно более устойчивые, чем с краун-эфирами.
Соединения криптандов со щелочными металлами носят название криптатов. Механизм действия антибиотика тетрациклина заключается в разрушении рибосом микроорганизмов за счет связывания ионов магния, что определяет лечебный эффект.
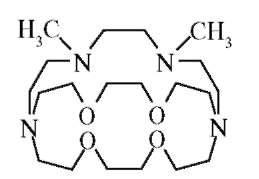
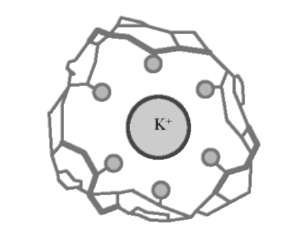
Рис. 10.4. Валиномицин фиксируется в центре за счет ион-дипольного взаимодействия с участием карбонильных групп пептида (кружки)
10.3.2. Медико-биологическое значение s-элементов и их соединений
Биологические функции s-элементов очень разнообразны: активация ферментов, участие в процессах свертывания крови, в различных реакциях организма, связанных с изменением проницаемости мембран по отношению к ионам калия, натрия и кальция, участие в образовании мембранного потенциала, в запуске внутриклеточных процессов, таких, как обмен веществ, рост, развитие, сокращение, деление и секреция, перенос информации. Чувствительность клеток к данным ионам обеспечивается разностью их содержания вне и внутри клетки, градиентом концентрации (ионной асимметрией). Старение - понижение градиента концентрации, смерть - выравнивание концентрации вне и внутри клетки. Градиент концентрации регулируется связыванием свободных ионов клетки специфическими белками. Одним из немногих универсальных регуляторов жизнедеятельности клеток являются ионы кальция. Градиент концентраций Са2+ между цитоплазмой и средой на уровне 4 порядков и обеспечивается связыванием Са2+ в хелатное соединение специфическими белками. Кальмодулин - один из наиболее изученных кальцийсвя-зывающих белков, широко распространенных, и встречается в клетках животных, растений и грибов. Этот белок способен регулировать большое число (более 30 описанных в настоящее время) различных процессов, происходящих в клетке. Поэтому в цитоплазме свободные ионы кальция присутствуют в субмикромолярных концентрациях.
Вещества, регулирующие поток ионов, называются эффекторами, которые делятся на блокаторы и активаторы. Биологическое действие эффекторов может быть весьма разнообразным как по направлению, так и по интенсивности воздействия. Вещества, обеспечивающие повышение градиента концентрации, активизируют внутриклеточные процессы, рост и развитие организма и являются активаторами метаболических процессов. Вещества, обеспечивающие снижение градиента концентрации, наоборот, ингибируют внутриклеточные процессы, снижают интенсивность обменных процессов в организме. Внутриклеточная регуляция процессов с помощью эффекторов нам представляется перспективным механизмом управления ростом и развитием живого организма. Поэтому весьма актуальным и важным направлением научных исследований являются поиск и синтез высокоизбирательных и эффективных эффекторов, биорегуляторов
внутриклеточных процессов, способных изменять свойства K+-, Na+-, Са2+-каналов за счет взаимодействия со специфическими участками его структуры - рецепторами, которые могут быть либо на поверхности, либо скрыты в глубине этих каналов.
В нормальных условиях ионы кальция играют роль важнейших вторичных посредников, участвующих в запуске внутриклеточных процессов (биосинтез, сокращение, деление, секреция). Они отвечают на сигналы первичных посредников биохимических процессов, в роли которых выступают различные биологически активные вещества (эффекторы): медиаторы, гормоны, витамины, ферменты, факторы роста. Связывание эффектора с рецепторами подчиняется закону действующих масс.
В клинической практике применяются блокаторы в сердечнососудистой терапии (стенокардия, аритмия, инфаркт миокарда), иммунологии, химиотерапии онкологических заболеваний. Верапамил, дигидропиридил ингибируют на 80-90% образование метастазов меланомы, значительно снижают адгезию (прилипание) опухолевых клеток к эндотелию и образованию колоний. Система регуляции градиента концентрации вне и внутри клеток является перспективным направлением в биотехнологии (химической ионике) для получения важных веществ из клеток-продуцентов (р-клетки - источник инсулина, гипофизарные клетки - продуценты гормонов, фибробласты - источники факторов роста). Кроме активации ферментов, ионы щелочных металлов играют важную роль в осмотическом давлении, действуют как переносчики зарядов при передаче нервного импульса, стабилизируют структуру нуклеиновых кислот. Ионы кальция, магния инициируют некоторые физиологические процессы, такие, как сокращение мышц, секрецию гормонов, свертывание крови и др. Содержание ионов натрия, кальция и хлора во внеклеточной среде выше, а ионов калия и магния - наоборот. Стационарное состояние достигается при равенстве потоков ионов калия внутрь клетки (активный транспорт) и из клетки за счет диффузии. Обратное явление наблюдается при транспорте ионов натрия. Существование калиево-натриевого градиента концентраций приводит к возникновению мембранного и диффузионного потенциалов. Увеличение концентраций калия вне клетки в 2 раза приводит к нарушению сердечного ритма и смерти, биологическая роль других ионов s-элементов пока неясна. Известно, что введением в организм ионов лития удается лечить одну из форм маниакально-депрессивного психоза.
В последние годы заметно возрос интерес к проблемам клеточной регуляции, а также к поиску путей использования этих процессов в медицине, биотехнологии и сельском хозяйстве. В процессе жизнедеятельности границы клетки пересекают разнообразные вещества, потоки которых эффективно регулируются. С этой задачей справляется клеточная мембрана с встроенными в нее транспортными системами, включающими ионные насосы, систему молекул-переносчиков и высокоселективные ионные каналы. В настоящее время ключевые участки процессов, ощущаемых клеткой в виде внешних стимулов, изучены и обнаружены универсальные передатчики этих сигналов - Na+-, K+-, Ca2+-каналы. Высокая чувствительность клеток к ионам натрия, калия, кальция обеспечивается разностью их содержания вне и внутри клетки (ионной асимметрией, мембранным потенциалом).
10.4. СВОЙСТВА СОЕДИНЕНИЙ D-ЭЛЕМЕНТОВ
10.4.1. Общая характеристика d-элементов и их соединений
Элементы d-блока - это элементы, у которых происходит достройка d-подуровня предвнешнего уровня. Они образуют В-группы (табл. 10.6). Электронное строение валентного уровня d-элементов: (n - 1)d1-10, ns1-2. Они расположены между s- и p-элементами, поэтому получили название «переходные элементы». d-Элементы образуют 3 семейства в больших периодах и включают по 10 элементов (4-й период семейство Sc21-Zn30, 5-й период - Y39-Cd48, 6-й период - La57-Hg80, 7-й период - Ac89-Mt109).
Таблица 10.6. Положение d-элементов в периодической системе и их биоген-ность
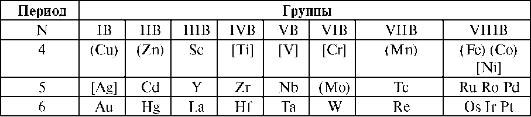
Примечание: () - металлы жизни; [] - условно биогенные элементы.
Вслед за лантаном 5 d16s2 предполагается появление еще 8 элементов с все возрастающим количеством 5d-электронов. В связи с тем, что 4f оболочка лантана несколько более устойчива, чем 5d, у последующих 14 элементов электроны заполняют 4f оболочку, пока она целиком не застроится. Эти элементы называются f-элементами. Они занимают в периодической системе одну клетку с лантаном, так как имеют общие с ними свойства и называются лантаноидами.
Особенности свойств d-элементов определяются электронным строением их атомов; во внешнем электронном слое содержится, как правило, не более 2 s-электронов, р-подуровень свободный, происходит заполнение d-подуровня предвнешнего уровня. Свойства простых веществ d-элементов определяется в первую очередь структурой внешнего слоя и лишь в меньшей степени зависят от строения предшествующих электронных слоев. Невысокие значения энергии ионизации этих атомов указывают на сравнительно слабую связь внешних электронов с ядром. Это определяет их общие физические и химические свойства, исходя из которых следует отнести простые вещества d-элементов к типичным металлам. Для V, Сr, Mn, Fe, Co энергия ионизации составляет соответственно от 6,74 до 7,87 эв. Именно поэтому переходные элементы в образуемых ими соединениях проявляют только положительную степень окисления и проявляют свойства металлов. Большая часть d-элементов - это тугоплавкие металлы. По химической активности d-элементы весьма разнообразны. Такие, как Sc, Mn, Zn, наиболее химически активны (как щелочноземельные).
Наиболее химически устойчивы Au, Pt, Ag, Сu. В 1 ряду инертны Ti, Сr, В семействе Sc и Zn наблюдается плавный переход в изменении химических свойств слева направо, так как возрастание порядкового номера не сопровождается существенным изменением структуры внешнего электронного слоя, происходит только достройка d-подуровня предпоследнего уровня. Поэтому химические свойства в периоде хотя и закономерно, но гораздо менее резко изменяются, чем у элементов А групп, в которых ряд начинается активным металлом и заканчивается неметаллом. По мере увеличения заряда ядра d-элементов слева направо возрастает энергия ионизации, необходимая для отрыва электрона. В пределах одного семейства (декады) устойчивая максимальная степень окисления элементов сначала возрастает, благодаря увеличению числа d-электронов, способных участвовать в образовании химических связей, а затем убывает (вследствие усиления взаимодействия d-электронов с ядром по мере увеличения его заряда). Так, максимальная степень окисления Sc, Ti, V, Сr, Mn совпадает с номером
группы, в которой они находятся, у последнего не совпадает, для Fe равна 6, для Со, Ni, Сu - 3, а для Zn - 2 и соответственно меняется устойчивость соединений, отвечающих определенной степени окисления. В степени окисления +2 оксиды TiO и VO - сильные восстановители, неустойчивы, а СuО и ZnO не проявляют восстановительных свойств и устойчивы. Водородных соединений не образуют.
Как изменяются свойства элементов в различных семействах сверху вниз? Размеры атомов сверху вниз от d-элементов 4 периода к d-элементам 5 периода возрастают, энергия ионизации уменьшается, и металлические свойства увеличиваются. Когда переходим от 5 к 6 периоду, то размер атомов остается практически без изменений, свойства атомов также близки, например, Zn и Hf по свойствам очень близки и их трудно разделить. То же можно сказать о Мо и W, Те и Re. Элементы 6 периода идут после семейства лантаноидов, за счет этого происходит дополнительное возрастание заряда ядра атома, а это приводит к оттягиванию электронов, более плотной их упаковке - происходит лантаноидное сжатие.
В физических и химических свойствах простых веществ d-элементов много общего для типичных металлов. Общность и различие их проявляются особенно в химических свойствах соединений d-элементов. d-Элементы имеют довольно много валентных электронов (Mn от 2 до 7ē), энергия которых различна, и они не всегда и не все принимают участие в образовании связей. Поэтому d-элементы проявляют переменную степень окисления, следовательно, для них характерны реакции окисления-восстановления. Степени окисления элементов Sc-Zn представлены в табл. 10.7. d-Элементы способны проявлять степень окисления +2 за счет потери 2s-электронов, характерна также степень окисления +3 (исключение Zn). Высшая степень окисления большинства d-элементов
Таблица 10.7. Характеристика степени окисления d-элементов 4 периода
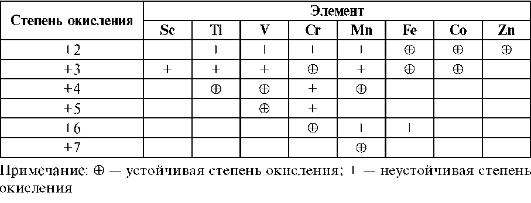
соответствует номеру группы, в которой они находятся. С увеличением порядкового номера d-элемента значение устойчивой степени окисления возрастает. Отрицательную степень окисления не проявляют, следовательно, водородных соединений не образуют.
Как следует из таблицы, наибольшее число переменных степеней окисления у элементов в VB-VIIВ группах. Поэтому для элементов этих групп наиболее характерны реакции окисления-восстановления.
В связи с тем что d-элементы способны проявлять различные степени окисления, они способны образовывать соединения, резко отличающиеся по кислотно-основным свойствам. Свойства оксидов и гидрооксидов зависят от степени окисления образующего их d-элемента. По мере повышения степени окисления d-элемента ослабевает основной характер их и усиливается кислотный характер. В степени окисления +2 проявляют только основной характер, промежуточной степени окисления - амфотерный характер и в высшей степени - кислотный характер:
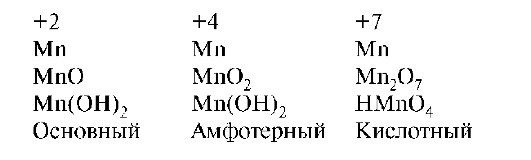
В ряду d-элементов в высшей степени окисления в периоде слева направо кислотный характер соединений возрастает от Sc к Zn:
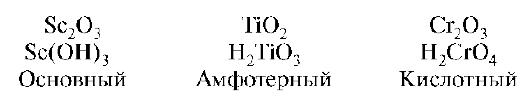
В низшей степени окисления -1, -2 соединения проявляют основные свойства. В группах сверху вниз усиливается основный характер:
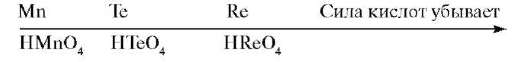
В организме d-элементы представлены как существующие в виде гидратированных, гидролизованных ионов, но чаще в виде биоорганических комплексов. Они выступают в качестве сильных комплексообразователей, что обусловлено наличием на d-подуровне предвнешнего уровня валентных электронов. Способность образовывать комплексные соединения обусловлена наличием в их атомах свободных орбиталей (одной s-, трех р- и пяти
d-орбиталей), проявляя к.ч. = 6, реже 2, 3, 5 и 8 для образования связи с полидентатными лигандами с образованием хелатов (биокастеров, гете-ровалентных и гетероядерных соединений).
В кислых средах ионы d-элемента находятся в виде гидратирован-ных ионов [М(Н2О)m]n+. При повышении pH гидратированные ионы многих d-элементов вследствие большого заряда и небольшого размера иона обладают высоким поляризующим влиянием на молекулы воды, акцепторной способностью к гидроксид-ионам, подвергаются гидролизу катионного типа, образуют прочные ковалентные связи с ОН-. Процесс заканчивается либо образованием основных солей [M(OH)m](m-n)+, либо малорастворимых гидроксидов М(ОН)n, либо гидроксокомплексов[M(OH)m](m-n)-. Процесс гидролитического взаимодействия может протекать с образованием многоядерных комплексов в результате реакции полимеризации:
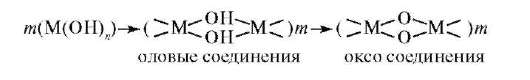
10.4.2. Медико-биологическое значение d-элементов и их соединений
Большинство биогенных элементов - это члены второго, третьего и четвертого периодов периодической системы Д.И. Менделеева. Это относительно легкие атомы, со сравнительно небольшим зарядом ядер.
Содержание d-элементов не превышает 10-3%. Они входят в состав ферментов, гормонов, витаминов и других жизненно важных соединений. Для белкового, углеводного и жирового обмена веществ необходимы: Fе, Со, Mn, Zn, Мо, V, В, W; в синтезе белков участвуют: Mg, Mn, Fe, Co, Cu, Ni, Cr, в кроветворении - Со, Ti, Cu, Mn, Ni, Zn; в дыхании - Mg, Fe, Cu, Zn, Mn и Со. Поэтому микроэлементы нашли широкое применение в медицине, в качестве микроудобрений для полевых культур, подкормки в животноводстве, птицеводстве и рыбоводстве. Микроэлементы входят в состав большого числа биорегуляторов живых систем, в основе которых лежат биокомплексы. Ферменты - это особые белки, которые действуют как катализаторы в биологических системах. Ферменты - уникальные катализаторы, обладающие непревзойденной эффективностью действия и высокой селективностью. Пример эффективности протекания реакции разложения перекиси водорода 2Н2О2 ↔ 2Н2О + О2 приведен в табл. 10.8.
Таблица 10.8. Энергия активации (Еа) и относительная скорость реакции разложения H2O2
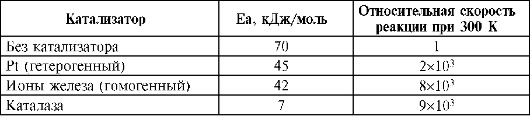
В настоящее время известно более 2000 ферментов, многие из которых катализируют одну реакцию. Активность большой группы ферментов проявляется только в присутствии определенных соединений небелковой природы, называемых кофакторами. В качестве кофакторов выступают ионы металлов или органические соединения. Примерно третья часть ферментов активируется переходными металлами.
Ионы металлов в ферментах выполняют ряд функций: являются электрофильной группой активного центра фермента и облегчают взаимодействие с отрицательно заряженными участками молекул субстрата, формируют каталитически активную конформацию структуры фермента (в формировании спиральной структуры РНК участвуют ионы цинка и марганца), участвуют в транспорте электронов (комплексы переноса электрона). Способность иона металла выполнять свою роль в активном центре соответствующего фермента зависит от способности иона металла к комплексообразованию, геометрии и устойчивости образуемого комплекса. Это обеспечивает повышение селективности фермента по отношению к субстратам, активации связей в ферменте или субстрате посредством координации и изменения формы субстрата в соответствии со стерическими требованиями активного центра. Биокомплексы различаются по устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. В тех случаях когда связь кофактора и белка фермента прочна и разделить их трудно, его называют «простетической группой». Такие связи обнаружены в ферментах, содержащих гемком-плексное соединение железа с производным порфина. Роль металлов таких комплексов высокоспецифична: замена его даже на близкий по свойствам элемент приводит к значительной или полной утрате физиологической активности. Данные ферменты относят к специфическим ферментам.
Примерами таких соединений являются хлорофилл, полифени-локсидаза, витамин B12, гемоглобин и некоторые металлоферменты
(гемоглобин, цитохромы). Немногие ферменты участвуют только в одной определенной или единственной реакции. Каталитические свойства большинства ферментов определяются активным центром, образуемым разными микроэлементами. Ферменты синтезируются на период выполнения функции. Ион металла выполняет роль активатора, и его можно заменить ионом другого металла без потери физиологической активности фермента. Такие ферменты отнесены к неспецифическим.
В организме присутствуют и менее прочные комплексы, которые образуются только для выполнения определенных функций, после чего распадаются: например, образование между ионом металла и ферментом комплексного соединения на период осуществления катализа. Большинство таких ферментов обладает каталитической активностью, но без иона металла она будет ниже. Ионы металлов выполняют функцию активаторов. Специфичность металлов в этих комплексах не выражена. Он может быть заменен на другой металл без потери физиологической активности. К биологическим соединениям с невысокими значениями констант устойчивости можно отнести соединения, которые стабилизируют сложные структуры. Например, образование металлополинуклеотидных комплексов стабилизирует двойную спираль ДНК. Комплексы с ДНК (в основном с донорным атомом кислорода фосфатных групп, частично с донорными атомами азота оснований) образуют двухзарядные ионы Mn2+, Co2+, Fe2+, Ni2+. Они взаимозаменяемы. Промежуточное положение между этими двумя группами биокомплексов занимают диссоциирующие металлофермен-ты. Ионы металлов в этих комплексах выполняют функции кофактора. Например, карбоксипептидаза при отсутствии иона металла неактивна. Максимальная активность в присутствии иона цинка.
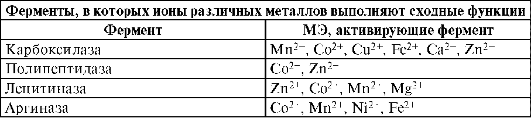
Один микроэлемент может активировать работу различных ферментов, а один фермент может быть активирован различными микроэлементами. Наибольшую близость в биологическом действии оказывают ферменты с микроэлементами с одинаковой степенью окисления +2.
Как видно, для микроэлементов переходных элементов в их биологическом действии характерно больше горизонтальное сходство, чем вертикальное в периодической системе Д.И. Менделеева (в ряду Ti-Zn). Значения атомных и ионных радиусов, энергий ионизации, координационных чисел, склонность к образованию связей с одними и теми же элементами в молекулах биолигандов обусловливают эффекты, наблюдаемые при взаимном замещении ионов: может происходить как с усилением (синергизм), так и с угнетением их биологической активности (антагонизм) замещаемого элемента. Ионы d-элементов в степени окисления +2 (Mn2+, Fe2+, Co2+, Cu2+, Ni2+, Zn2+) имеют сходные физико-химические характеристики, что обусловливает их частичную взаимозамещаемость и параллелизм в биологическом действии. В виде комплексов с органическими соединениями, в том числе в металло-ферментах, они стимулируют процессы кроветворения, усиливают процессы обмена веществ. Синергизм элементов в процессах кроветворения связан, возможно, с участием ионов этих элементов в различных этапах процесса синтеза форменных элементов крови человека.
Повышение прочности биокомплекса фермента повышает специфичность его биологического действия. На эффективность ферментативного действия иона металла фермента оказывает влияние его степень окисления. Комплексонаты, образованные ионом металла с более высокой степенью окисления, малым размером иона, более высоким сродством к электрону, обладают наиболее высоким стимулирующим эффектом. По интенсивности влияния микроэлементы расположены в следующий ряд: Ti4+ → Fe3+ → Cu2+ → Fe2+ → Mg2+ → Mn2+. Ион Mn3+, в отличие от иона Mn2+, очень прочно связан с белками, причем преимущественно с кислородсодержащими группами совместно Fe3+ входит в состав металлопротеинов. Микроэлементы в комплексонат-ной форме выступают в организме в качестве фактора, определяющего, по-видимому, высокую чувствительность клеток к микроэлементам путем их участия в создании высокого градиента концентрации.
Итак, с повышением прочности комплекса повышается специфичность его биологического действия.
В живых организмах действует большое число ферментов, в состав которых входят ионы металлов, выполняющие следующие функции:
1) они являются электрофильной группой активного центра фермента и облегчают взаимодействие с отрицательно заряженными участками молекул субстрата;
2) ион металла формирует каталитически активную конформацию структуры фермента;
3) в ряде случаев ионы металла, которые могут находиться в переменных степенях окисления, участвуют в транспорте электронов (многоядерные комплексы).
Концентрации ионов d-элементов в организме поддерживаются постоянными за счет существования механизма металлолигандного гомеостаза, основными звеньями которого являются всасывание, распределение, транспорт, депонирование и элиминация. Параметры всасывания и элиминации в норме сбалансированы, т.е. при уменьшении поступления в организм того или иного микроэлемента уменьшается его выведение, и наоборот. Для поддержания постоянной концентрации ионов металлов в организме существуют депонированные и транспортные формы. Например, железо в организме млекопитающих депонируется в составе ферритина - водорастворимого белка, в котором находится мицеллярное ядро неорганического соединения железа (III). В депонированной форме находится около 25% железа. Регуляция металлолигандного гомеостаза осуществляется с помощью нервной, эндокринной и иммунной систем. Комплексонаты переходных металлов обеспечивают сбалансированность минерального питания, активизируют метаболические процессы, интенсифицируют рост и развитие организма.
В живом организме многие процессы имеют циклический, волнообразный характер. Химические процессы, лежащие в их основе, должны быть обратимы. Обратимость процессов определяется взаимодействием термодинамических и кинетических факторов. К обратимым относятся реакции, имеющие константы от 10-3 до 103 и с небольшим значением ΔGo - и E°-процессов. При этих условиях концентрации исходных веществ и продуктов реакции могут находиться в соизмеримых концентрациях, и при изменении их в некотором диапазоне можно добиваться обратимости процесса. С кинетических позиций должны быть низкие значения энергии активации. Поэтому удобным переносчиком электронов в живых системах являются ионы металлов (железо, медь, марганец, кобальт, молибден, титан и др.). Присоединение и отдача электрона вызывают изменения лишь электронной конфигурации иона металла, не изменяя существенно структуру органической составляющей комплекса. Уникальная роль в живых системах отведена двум окислительно-восстановительным системам: Fe3+/Fe2+ и Cu2+/Cu+. Биолиганды стабилизируют в большей степени в первой паре окисленную форму, а во второй паре - преимущественно восстановленную. Поэтому у систем, содержащих железо, формальный потенциал всегда ниже, а у систем, содержащих
медь, часто выше; окислительно-восстановительные системы, имеющие в своем составе медь и железо, перекрывают широкий диапазон потенциалов, что позволяет им со многими субстратами вступать во взаимодействие, сопровождающиеся умеренными изменениями ΔG° и Е°, что отвечает условиям обратимости. Важным этапом обмена веществ является отщепление водорода от питательных веществ. Атомы водорода переходят при этом в ионное состояние, а отделенные от них электроны поступают в дыхательную цепь; в этой цепи, переходя из одного соединения к другому, они отдают свою энергию на образование одного из основных источников энергии - адено-зинтрифосфорную кислоту (АТФ), а сами в конечном счете попадают к молекуле кислорода и присоединяются к ней, образуя молекулы воды. Мостиком, по которому осциллируют электроны, служат комплексные соединения железа с порфириновым ядром, аналогичные по составу гемоглобину.
Большая группа железосодержащих ферментов, которые катализируют процесс переноса электронов в митохондриях, называется цитохромами (ц.х.). Всего известно около 50 цитохромов. Цитохромы представляют собой железопорфирины, в которых все шесть орбита-лей иона железа заняты донорными атомами биолиганда. Различие цитохромов только в составе боковых цепей порфиринового кольца. Вариации в структуре биолиганда вызывает различие в величине потенциалов. Все клетки содержат, по крайней мере, три близких по строению белка, названных цитохромами а, b, с.
Одним из механизмов функционирования цитохромов, составляющих одно из звеньев электронно-транспортной цепи, является перенос электрона от одного субстрата к другому.
С химической точки зрения цитохромы являются соединениями, проявляющими в обратимых условиях окислительно-восстановительную двойственность.
Перенос электрона цитохромом сопровождается изменением степени окисления железа: ц.х. Fe3+ + ē → ц.х. Fe2+.
Ионы кислорода реагируют с ионами водорода окружающей среды и образуют воду или перекись водорода. Пероксид быстро разлагается специальным ферментом каталазой на воду и кислород по схеме:
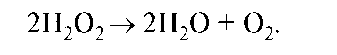
Фермент пероксидаза ускоряет реакции окисления органических веществ перекисью водорода по схеме:
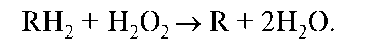
Эти ферменты в своей структуре имеют гем, в центре которого находится железо со степенью окисления +3.
В цепи переноса электронов цитохром передает электроны цитохромам, называемым цитохромоксидазами. Они имеют в своем составе ионы меди. Цитохром - одноэлектронный переносчик. Наличие наряду с железом в составе одного из цитохромов меди превращает его в двухэлектронный переносчик, что позволяет регулировать скорость процесса.
Медь входит в состав важного фермента - супероксиддисмутазы (СОД), которая утилизирует в организме токсичный супероксид анион-радикал •O2- путем реакции:
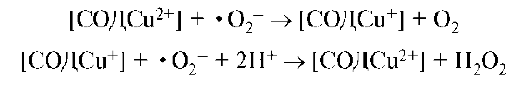
Водородпероксид разлагается в организме под действием каталазы.
В настоящее время известно около 25 медьсодержащих ферментов. Они составляют группу оксигеназ и гидроксилаз.
Комплексы переходных элементов являются источником микроэлементов в биологически активной форме, обладающих высокой мембра-нопроницаемостью и ферментативной активностью. Они участвуют в защите организма от «окислительного стресса». Это связано с их участием в утилизации продуктов метаболизма, определяющих неконтролируемый процесс окисления (перекисями, свободными радикалами и другими кислородактивными частицами), а также в окислении субстратов. Механизм свободнорадикальной реакции окисления субстрата (RH) перекисью водорода с участием в качестве катализатора комплекса железа (FeL) можно представить схемами реакций:
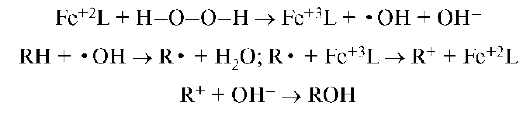
Дальнейшее протекание радикальной реакции приводит к образованию продуктов с более высокой степенью гидроксилирования.
10.5. СВОЙСТВА СОЕДИНЕНИЙ Р-ЭЛЕМЕНТОВ
10.5.1. Общая характеристика р-элементов и их соединений
Элементы, у которых происходит достройка р-подуровня внешнего валентного уровня, называют р-элементами, они образуют главные подгруппы. Электронное строение валентного уровня ns2р1-6. Валентными являются электроны s- и р-подуровней. Положение р-элементов в ПСЭ представлено в табл. 10.9.
Таблица 10.9. Положение р-элементов в периодической системе элементов
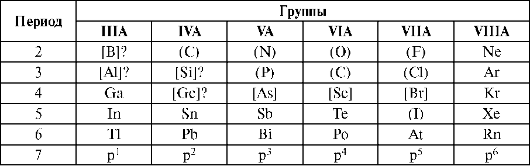
Примечание: () - металлы жизни; [] - условно биогенные элементы.
Элементы-органогены имеют небольшие радиусы атомов и промежуточные значения электроотрицательностей, что благоприятствует образованию прочных ковалентных связей.
В периодах слева направо возрастает заряд ядер, влияние которого превалирует над увеличением сил взаимного отталкивания между электронами. Поэтому потенциал ионизации, сродство к электрону, а следовательно, акцепторная способность и неметаллические свойства в периодах увеличиваются. Все элементы, лежащие на диагонали B-At и выше, являются неметаллами и образуют только ковалент-ные соединения и анионы. Все остальные р-элементы (за исключением In, Tl, Po, Bi, которые проявляют металлические свойства), являются амфотерными элементами и образуют как катионы, так и анионы, причем и те, и другие сильно гидролизуются. Большинство р-элементов-неметаллов - биогенные (исключение - теллур, астат и благородные газы). Из р-элементов-металлов к биогенным относят только алюминий.
Различия в свойствах соседних элементов как внутри, так и по периоду выражены значительно сильнее, чем у s-элементов. р-Элементы
второго периода - азот, кислород, фтор - обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующего периодов эту способность теряют. Их сходство заключается только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d- и f-подуровней).
Отмеченные тенденции к образованию различных типов связей представлены на рис. 10.5 для элементов II и III периодов.

Рис. 10.5. Закономерности образования соединений элементов II и III периодов
Все р-элементы, и в особенности р-элементы второго и третьего периодов (С, N, P, О, S, Si, Cl), образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений - это соединения р-элементов. Пять главных (макробиогенных) р-элементов - О, P, С, N и S - это основной строительный материал, из которого сложены молекулы белков, жиров, углеводов и нуклеиновых кислот. Из низкомолекулярных соединений р-элементов наибольшее значение имеют оксоанионы: СО32-, НСО3-, С2О42-, СН3СОО-, РО43-, НРО42-, H2PO4-, SО42- и галогенидионы. р-Элементы имеют много валентных электронов, обладающих различной энергией. Поэтому в соединениях проявляют различную степень окисления. Например, углерод проявляет различные степени окисления от -4 до +4. Азот - от -3 до +5, хлор - от -1 до +7.
В процессе реакции р-элемент может отдавать и принимать электроны, выступая соответственно восстановителем или окислителем в зависимости от свойств элемента, с которым вступает во взаимодействие. Это порождает широкий ассортимент образуемых ими соединений. Взаимопереход атомов р-элементов различных степеней окисления, в том числе и за счет метаболических процессов (окисление спиртовой
группы в их альдегидную и далее в карбоксильную), вызывает богатство их химических превращений.
Соединения углерода проявляют окислительные свойства, если в результате реакции атомы углерода увеличивают число его связей с атомами менее электроотрицательных элементов (металл, водород), потому что, притягивая к себе общие электроны связей, атом углерода понижает свою степень окисления:
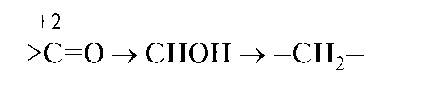
Соединения углерода проявляют восстановительные свойства, если в результате реакции атомы углерода увеличивают число его связей с атомами более электроотрицательных элементов (О, N, S), потому что, отталкивая от себя общие электроны этих связей, атом углерода повышает свою степень окисления:
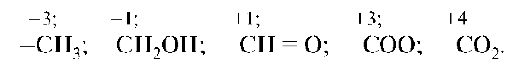
Перераспределение электронов между окислителем и восстановителем в органических соединениях может сопровождаться лишь смещением общей электронной плотности химической связи к атому, выполняющему роль окислителя. В случае сильной поляризации эта связь может и разорваться.
10.5.2. Медико-биологическое значение p-элементов и их соединений
Азот является биогенным элементом, необходимым для существования животных и растений, он входит в состав белков (16-8% по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2%, по массовой доле - около 2,5% (4-е место после водорода, углерода и кислорода). Кларк азота в земной коре равен
0,025%.
Азот - основной компонент воздуха: его объемная доля равна 78,2%. Во вдыхаемом воздухе азот служит полезным разбавителем кислорода. Однако вследствие растворения азота в крови при резком снижении окружающего давления возможно возникновение кессонной болезни.
Аммиак NH3 в организме человека является одним из продуктов дезаминирования аминокислот, белков, биогенных аминов, пуриновых и пиримидиновых оснований, поступающих с пищей.
В организме человека обязательно синтезируется NO с помощью фермента NO-синтазы из аминокислоты аргинина. Время жизни NO в клетках организма порядка секунды, но их нормальное функционирование невозможно без NО. Это соединение обеспечивает расслабление гладкой мускулатуры мышц сосудов, регуляцию работы сердца, эффективную работу иммунной системы, передачу нервных импульсов. Предполагают, что NO обеспечивает важную роль в обучении и запоминании.
Окислительно-восстановительные реакции, в которых участвуют р-элементы, лежат в основе их токсического действия на организм. Токсическое действие оксидов азота связано с их высокой окислительно-восстановительной способностью. Нитраты, попадающие в продукты питания, в организме восстанавливаются до нитритов.
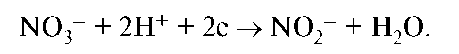
Нитриты обладают высокими токсическими свойствами. Они превращают гемоглобин в метгемоглобин, который является продуктом гидролиза и окисления гемоглобина.
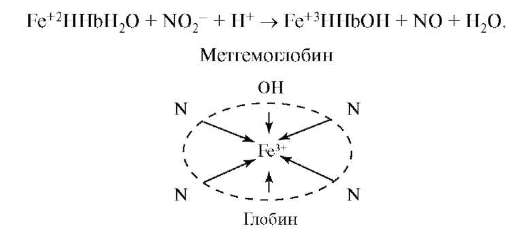
В результате гемоглобин теряет способность транспорта кислорода к клеткам организма. В организме развивается гипоксия. Кроме того, нитриты, как соли слабой кислоты, реагируют с соляной кислотой в желудочном содержимом, образуя при этом азотистую кислоту, которая с вторичными аминами образует канцерогенные нитрозамины:
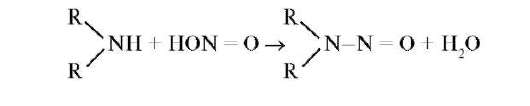
Фосфор и его соединения играют выдающуюся роль в биологии человека, животных, растений, микроорганизмов и других носителей жизни. «Фосфор - элемент жизни и мысли» - писал А.Е. Ферсман. В организме человека содержится около 1% фосфора по массе, что позволяет смело отнести его к макроэлементам. Суточная потребность в фосфоре составляет 1,3 г. В природе и организме фосфор встречается только в формах, содержащих фосфат-анион. Это обусловлено тем, что фосфор образует с кислородом более прочные связи, чем с другими органогенами. Все они имеют тетраэдрическую структуру, в которой атом фосфора расположен в центре тетраэдра, а атомы кислорода - в его вершинах. Тетраэдрические структуры могут объединяться между собой одной, двумя или тремя вершинами. При объединении двумя вершинами образуются полифосфаты, например трифосфатион.
Фосфаты в живых организмах служат структурными компонентами скелета, клеточных мембран и нуклеиновых кислот. Костная ткань построена главным образом из гидроксиапатита Са5(РО4)3ОН. Из 1,5 кг фосфора условного человека 1,4 кг содержатся в костной ткани. Основу клеточных мембран составляют фосфолипиды. В фосфо-липидах фосфорная кислота образует две сложноэфирные связи: одну с глицерином, другую - с аминоспиртом (холинолом, этаноламином или серином). Нуклеиновые кислоты состоят из рибозоили дезокси-рибозофосфатных цепей. В цепях полинуклеотидов - ДНК и РНК - каждый остаток фосфорной кислоты, кроме двух концевых, образует по две сложноэфирные связи: одну с группой -ОН в положении С-5' остатка пентозы одного полинуклеотида, а другую - с группой -ОН в положении С-3' остатка пентозы соседнего полинуклеотида.
В.А. Энгельгардом и М.Н. Любимовым открыта энергетическая роль фосфора в живых организмах. В.А. Энгельгард еще в 1948 году писал, что биохимическую динамику клетки можно характеризовать как химию соединений фосфорной кислоты. За последние 40-50 лет накопилось огромное множество данных о многообразном значении органических и неорганических соединений фосфора в биологических системах. Выяснена их ключевая роль практически во всех процессах анаболизма и катаболизма, в частности гликолиза и фотосинтеза, сборке макромолекул и аккумуляции энергии. Фосфор входит
в состав нуклеопротеинов, фосфолипидов, сахарофосфатов, ряда витаминов и ферментов. Органические соединения фосфора участвуют во многих окислительно-восстановительных реакциях: карбоксили-рования, декарбоксилирования, ацетилирования, переаминирования, а также в качестве коферментов переноса фосфатных групп АТФ, АДФ и АМФ.
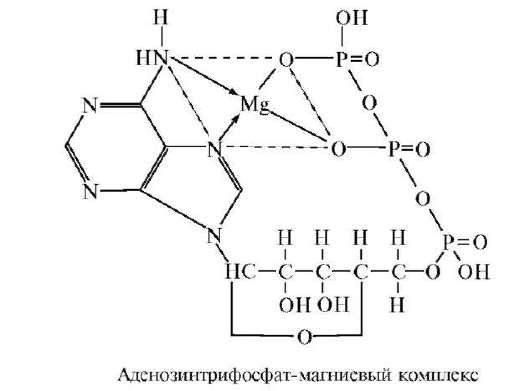
Высокомолекулярные неорганические полифосфаты представляют собой линейные полимеры ортофосфорной кислоты, в которых фосфорные остатки связаны между собой фосфоангидридными связями. Они имеются практически у всех групп организмов. В наибольшем количестве они накапливаются в клетках микроорганизмов, в частности в некоторых бактериях, составляя при определенных условиях выращивания до 36% сухого вещества клетки. С момента открытия у бактерий гранул волютина, состоящих в основном из осмотически инертных высокомолекулярных полифосфатов кальция, магния и калия, эти биополимеры стали рассматривать в первую очередь как резервы фосфата. Высокомолекулярные полифосфаты бактерий аналогичны по функциям так называемым «фосфогенам» животных - креатинфосфату и аргининфосфату. Фосфогены - это соединения, в виде которых в клетках как бы «складируются» богатые энергией фосфатные остатки АТФ и которые в то же время в любой нужный момент могут использоваться для синтеза этого важнейшего макроэр-гического соединения.
Многие коферменты являются эфирами либо фосфорной, либо дифосфорной кислот. Важнейшие окислители в метаболических
окислительно-восстановительных реакциях - никотинамиддинуклео-тид (НАД+) и флавинадениндинуклеотид (ФАД) - сложные эфиры дифосфорной кислоты. Восстановленная форма никотинамиддинукле-отидфосфата (НАДФH) выполняет функцию восстановителя во многих метаболических реакциях.
Соединения фосфора находят широкое применение в народном хозяйстве и медицине. Многие фосфорорганические вещества применяются в качестве лекарственных препаратов, например димефосфон оказывает мембраностабилизирующее, иммуномодулирующее и радиопротекторное действия, клодроновая кислота ингибирует костную резорбцию и нормализует содержание кальция в костной ткани.
В качестве фосфорных и комплексных удобрений используются чаще всего суперфосфат Са(Н2РO4)2, преципитат СаНРO4 и аммофос - смесь кислых солей аммония и ортофосфорной кислоты (NH4)2HPO4 и NH4H2PO4. Ортосфорная кислота применяется в ряде стран в качестве подкислителя различных напитков. Гидрофосфаты калия KH2PO4 и К2НРО4 входят в состав пекарских дрожжей, гидрофосфат калия K2HPO4 является одним из компонентов питательной среды для выращивания грибов, продуцирующих пенициллины. Гексагидрат трифосфата натрия №5Р5О10 • 6Н2O добавляется в некоторые продукты для повышения их однородности (сыры, сгущенное молоко и др.). Трифосфат натрия является также компонентом многих моющих средств. Дигидрофосфат натрия ограниченно применяется как слабительное в клизмах.
Биологическое действие высокомолекулярных органических соединений (аминокислот, полипептидов, белков, жиров, углеводов и нуклеиновых кислот) определяется атомами (N, P, S, О) или образуемыми группами атомов (функциональными группами), в которых они выступают в качестве химически активных центров, доноров электронных пар, способных к образованию координационных связей с ионами металлов и органическими молекулами. Следовательно, р-элементы образуют полидентат-ные хелатирующие соединения (аминокислоты, полипептиды, белки, углеводы и нуклеиновые кислоты). Для них характерны реакции ком-плексообразования, амфотерные свойства, реакции гидролиза анионного типа. Данные свойства определяют их участие в основных биохимических процессах, в обеспечении состояния изогидрии. Они образуют белковые, фосфатные, гидрокарбонатные буферные системы. Участвуют в транспорте питательных веществ, продуктов метаболизма и других процессах.
10.6. РОЛЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ПРОЦЕССАХ АДАПТАЦИИ ОРГАНИЗМА К ВОЗДЕЙСТВИЯМ НЕБЛАГОПРИЯТНЫХ ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ
Одной из центральных проблем в современной биологии и медицине, имеющей фундаментальную значимость, имеет адаптация, которая проявляется как на популяционном, так и на индивидуальном уровнях. В настоящее время на арену жизни выходят принципиально новые воздействия, которые угрожают постоянству сохранения внутренней среды организма, вызывают напряжение как наиболее универсальных, так и достаточно специфических регу-ляторных и гомеостатических систем. Кроме того, увеличивается число действующих факторов различной природы, начиная от космических, физических, химических, включая лекарственные препараты, и социальные, что приводит проблему адаптации и эволюции организма в новое русло, определяемое тем, что конечный биотроп-ный эффект, т.е. сохранение постоянства внутренней среды, достигается громадным напряжением большого количества сопряженных между собой систем, которые в ряде случаев уже не способны выполнять свои эволюционно закрепленные функции, что чревато наступлением болезней адаптации.
Необходимо управлять адаптацией, способствовать повышению выносливости организма. Одним из условий для этого является своевременное, полноценное и рациональное питание. Недостаточность или избыточность минеральных веществ, микроэлементов в рационе сказываются на деятельности организма, снижают его сопротивляемость, а следовательно, и способность к адаптации. На основе многофакторности следует разработать научно-обоснованные подходы к оценке нормы здоровья. Если норма здоровья это равновесие со средой обитания, то любое устойчивое нарушение гомеостаза есть болезнь.
Одна из главенствующих задач экологической физиологии и медицины состоит в глубоком изучении механизмов адаптации с целью использования защитных эффектов для лечения и профилактики болезней, а также изыскания адекватных методов воспроизведения защитных эффектов адаптации с помощью фармакологических средств и природных адаптогенов. Окислительно-восстановительные процессы в организме совершаются в присутствии оксидоредуктаз. Кофакторами оксидоредуктаз являются переходные металлы (желе-
зо, медь, марганец, молибден), образующие с белком фермента комплексные соединения. Поскольку переходные металлы проявляют переменную степень окисления, то они могут выступить и окислителем, и восстановителем и быть переносчиком электронов, протонов, а также быть компонентом электронно- и протонно-транспортных цепей. Одна из особенностей окислительно-востановительных процессов - возможность их протекания как по гомолитическому, так и по гетеролитическому механизму, когда реагирующими частицами являются радикалы. Все окислительно-восстановительные процессы, глубина и скорость которых контролируется ферментами, протекают по гетеролитическому механизму. В то же время в организме имеет место свободнорадикальное окисление-восстановление, которое при низкой интенсивности является метаболически нормальным. Свободные радикалы участвуют в процессах клеточного деления, образовании мембран и многих других важных процессах. Это необходимо, пока интенсивность образования радикалов и их концентрация в клетке на превышает определенную норму. Главным источником радикалов является кислород, так как молекула кислорода бирадикал •О2 • при полном восстановлении про-соединяет 4 электрона и 4 протона и превращаются в 2 молекулы H2О. При экстремальных условиях образование кислородных радикалов усиливается, так как интенсифицируется окислительное фос-форилирование и гидроксилирование ксенобиотиков. В организме свободнорадикальное окисление сдерживается малокомпонентной антиоксидантной системой, которая превращает радикалы в малоактивные соединения, прерывает цепные реакции. Эти функции осуществляют антиоксидантные и антиперекисные ферменты: супе-роксиддисмутаза, каталаза, глутатионпероксидаза.
Антиоксиданты - вещества, обратимо реагирующие со свободными радикалами и окислителями и предохраняющие от их воздействия на жизненно важные метаболиты (Слесарев В.И., 2000). Весь этот обширный класс соединений объединяет определение, данное J.M. Gutteridge в 1995 году: «Антиоксидант - это соединение, которое присутствуя в низких, по сравнению с окисляемым субстратом, концентрациях существенно задерживает или ингибирует его окисление». Коферменты образуют прочные связи с рядом биологически активных органических соединений: убихинонами, флавоноидами, аскорбиновой кислотой. Эффективными антиоксиданта-ми являются тиолы R-SH, т.е. соединения, содержащие тиольную группу, которая за счет серы со степенью окисления -2 легко окисляется, образуя дисульфиды R-S-S-R (тиол-дисульфидная система):

За счет сильных восстановительных свойств тиолы являются эффективными ловушками радикалов, поэтому на их основе созданы радиопротекторы - средства, защищающие организм от радиации (унитиол).
В настоящее время накоплено множество данных, подтверждающие зависимость элементного состава живых организмов, в том числе человека, от содержания химических элементов в среде обитания, т.е. состав внутренней среды организма испытывает влияние внешней среды. Так, концентрации As, Pb, Ni, Mn и Cu в волосах детей положительно коррелируют одновременно с уровнем этих элементов в почве и питьевой воде, отобранных в местах их проживания, а концентрации Cd и Мо - только с уровнем их в воде, Zn, Cr и В - только с уровнем их в пробах почвы (рис. 10.6).
При подробном рассмотрении общих закономерностей связи элементного состава внешней и внутренней сред учеными установлено, что во всех природных системах (и объектах) концентрация элемента уменьшается с увеличением его относительной атомной массы или порядкового номера (заряда) (Кист А.А., 1987; 1990). Прямую связь элементных составов внешней и внутренней сред можно предполагать лишь на начальной стадии зарождения жизни, когда внешняя и внутренняя среды протобионтов могли быть практически идентичными в отношении элементного состава.
По мере усложнения живых организмов зависимость становится более сложной и нелинейной. Вначале концентрация элемента в живом организме растет с увеличением его концентрации во внешней среде. По достижении определенных уровней накопления элемента во внутренней среде организм уменьшает долю поступающего элемента (снижение абсорбции и усиление экскреции) в результате включения защитных механизмов и естественных барьеров. Впоследствии, как показывает А.А. Кист (1987), в зависимости от вида организма, изучаемого органа, способа введения элемента и его соединения и ряда других факторов, наблюдается либо незначительный дальнейший рост концентрации, либо его прекращение и сохранение постоянства, либо новое резкое, но кратковременное увеличение концентрации во внутренней среде.
Во всех этих случаях отмечаются выраженные патофизиологические изменения и, наконец, гибель организма. Следует отметить, что живые организмы, в том числе человек, имеют различную чувствительность
Рис. 10.6. Корреляция между концентрацией микроэлементов в почве, питьевой воде и волосах детей (расстояние 0,5, 1, 5 км от металлургического завода г. Златоуста, Челябинская область) (по Скальный А.В., 2004)
к изменению концентрации во внешней среде различных химических элементов. Макро- и микроэлементы, активно участвующие в регуляции обменных процессов в организме человека, можно условно разделить на элементы с низкой, средней и высокой гомеостатической емкостью.
Структура межорганных и межсистемных взаимодействий наиболее полно отражает переходный (триггерный) характер процессов
адаптации, вскрывая не только количественные, но и качественные особенности взаимодействия регуляторных и гомеостатических систем организма, позволяя тем самым оценить и выявить основные и периферические контуры регуляции ведущих физиологических и метаболических процессов в зависимости от структуры и экстремальности действующих средовых факторов (Fowler В.А., 1990; Kabata-Pendias A., 1992; Куликов В.Ю., 2003). Триггерный характер регуляции активных реакций основывается на появлении нового качества в системных механизмах регуляции обратимо за счет эффективного функционирования сопряженных между собой прямых или обратных связей.
Принцип Ле Шателье гласит, что в биосистемах на каждое действие формируется такое же по силе и характеру противодействие, которое уравновешивает биологические регуляторные процессы и реакции. При патологических процессах существующая замкнутость регулятор-ного контура нарушается. В зависимости от уровня неравновесности изменяется качество межсистемных и межорганных отношений, они приобретают все более нелинейный характер. Структуру и специфику этих взаимоотношений подтверждает анализ между показателями системы перекисного окисления липидов и уровнем антиоксидантов, между гармоничными показателями в условиях адаптации и патологии (Куликов В.Ю., 2003). Данные системы участвуют в поддержании антиокислительного гомеостаза. Показателем высоких антиоксидант-ных свойств эндогенных адаптогенов, обеспечивающих постоянство концентрации окислителей в организме, является содержание церу-лоплазмина в крови, противодействующего отрицательному влиянию антропогенных факторов, которые, как правило, способствуют формированию окислительной среды в организме, определяющей содержание в крови малонового альдегида. При применении фосфорсодержащих комплексонатов титана и БАД люцэвита в технологии выращивания цыплят бройлеров в дозе 0,05-1,5 мг/кг живой массы отмечен триггерный характер взаимоотношений церулоплазмина и прооксиданта малонового диальдегида. В крови цыплят содержание церулоплазмина возрастает, а малонового диальдегида снижается. Следовательно, препарат является активным биорегулятором свободно радикальных процессов, системой утилизации активных форм кислорода, перекиси водорода и дугих радикалов. Их ферментативное действие аналогично и более эффективно действию пероксидазы и каталазы.
10.7. БИОРЕГУЛЯТОРНЫЕ СВОЙСТВА КОМПЛЕКСОНАТОВ МЕТАЛЛОВ
10.7.1. Значение концентрации комплексонатов металлов в их биологическом действии
Проведено исследование биорегуляторных свойств комплексонатов металлов (ФКМ) в хроническом эксперименте на растениях и животных (пчелах, цыплятах, мышах, крысах, свиньях) в широком интервале концентраций (Жолнин А.В., 2005).
Рис. 10.7. Кривая ответной реакции растения на введение фосфорсодержащего комплексоната титана (ФКТ)
Биостимулирующее действие ФКП находится в прямопропор-циональной зависимости от его концентрации в изученном интервале концентраций, до 0,5% раствора ФКТ (рис. 10.7).
Фосфорсодержащие комплексонаты титана интенсифицируют рост и развитие растений. Применение их в производстве картофеля повышает урожайность до 30-40%, снижает нитраты на 25-30%, нейтрализует вредное воздействие неблагоприятных экологических и метеорологических факторов. Соединения титана ускоряют биосинтез аминокислот, активизируют липоксигеназную активность. Сопротивляемость к разным заболеваниям повышается в два раза.
Хелаты титана влияют на воспроизводительные функции свиноматок. При введении 0,05 мг/кг живой массы титана многоплодие свиноматок повышается на 16%. Выживаемость поросят к отъему увеличивается
на 37,5%. Рост живой массы максимальный при концентрации хелата 0,15 мг Ti/кг. При дозе 0,05 мг/кг среднесуточный прирост живой массы составляет 537 г, за репродуктивный цикл - 17,1 кг. Перевариваемость сухого вещества повышается на 5,3%, органического вещества на 4,8%, протеина на 3,9%, сырой клетчатки на 52%. В сыворотке крови повышается концентрация аминного азота, общих липидов, β-липопротеидов и снижается содержание мочевины и холестерина.
На мышах и крысах показано положительное влияние ФКТ на процессы обмена веществ (белкового, углеводного и липидного), поддержание микро- и макроэлементного гомеостаза.
Учитывая единство иммунной и метаболической систем резистентности организма, объяснено участие гетеровалентных и гетероядерных соединений титана в защите организма от «окислительного стресса» и в окислении субстратов. Ферментативное действие комплексонатов титана аналогично и более эффективно действию пероксидазы и ката-лазы. Соединения титана участвуют в поддержании антиокислительного гомеостаза организма, являются активными регуляторами свободнора-дикальных процессов и систем утилизации активных форм кислорода, участвуют в окислении субстратов. В хронических экспериментах на мышах установлен ряд элементов, расположенных в порядке снижения их элиминации из организма: Ti >> Al >> Cr. Взаимодействие биологических объектов с малыми и сверхмалыми дозами этих элементов обладает рядом специфических особенностей. При сверхмалых дозах вещества, когда исчезают побочные эффекты, проявляется специфика ответной реакции организма. При введении вещества в дозе 10-12 моль в клетке будет содержаться от 1 до 10 молекул вещества и наблюдается немонотонная, нелинейная зависимость «доза-эффект». Это может быть связано с общностью критических состояний клеточных и субклеточных мембран и особенностями кинетики реакций, в которых важную роль играют слабые взаимодействия. Кривая зависимости активности препарата от концентрации субстрата имеет сложный вид и может быть представлена в первом приближении как сочетание гиперболы и сигмоиды (рис. 10.8). Гиперболическая зависимость является обычной для описания функций белков-ферментов.
Рабочее звено фосфорсодержащих комплексонатов титана представляет собой пентамер гетеровалентных многоядерных комплексов титана (ГВК) с различным составом и строением как комплексообразователя, так и мостиковых лигандов, в качестве которых выступают комплексо-ны. В разных тканях набор субъединиц различен (Болдырев А.А., 1997). Фермент работает в виде олигомерных ассоциатов. С этих позиций понятна роль липидного окружения фермента. От упаковки липид-
ного бислоя зависит эффективность взаимодействия индивидуальных молекул фермента в мембране. Другими словами изменение вязкости микроокружения белковых молекул позволит управлять взаимодействием между белками в олигомерных комплексах и регулирует активность мембранных ассоциатов и обеспечивает тонкую настройку их работы на сиюминутные потребности клетки.
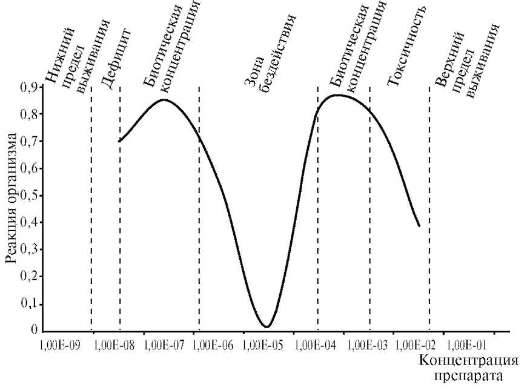
Рис. 10.8. Зависимость биологического действия комплексонатов металлов в функции их концентрации
Адаптогенные свойства веществ изучали на объектах различного уровня биологической организации (органе, клетке, ткани). В работе (Бурлакова Е.Б., 1999) приведены обзорные и собственные данные изучения биологического действия веществ в широком диапазоне концентраций: от 10-2-10-4 М (обычные концентрации) до 10-6-10-16 М (ультрамалые концентрации).
В исследованиях на животных первоначальная доза (10-3 мольТi/кг живой массы) была токсичной. Дальнейшее снижение концентрации комплексоната титана проявляло меньший токсический эффект (см. рис. 10.8). Затем совпадало с контрольными результатами. Последующее уменьшение дозы приводило к изменению знака эффек-
та. Доза 10-4 мольTi/кг живой массы была активной. Препарат обладает антиоксидантным действием, уровень которого возрастал по мере снижения концентрации. При дальнейшем снижении концентрации наблюдали полимодальную зависимость. Затем в дозовой зависимости обнаруживается «перемена знака» эффекта. В области малых доз отмечалась ингибирующая активность, которая в последующем изменялась на стимулирующее действие, возрастающее по мере снижения концентрации (10-6-10-7 мольTi/кг живой массы) препарата. Последующее снижение дозы приводило к снижению антиоксидантных свойств. Как следует из результатов исследований, биологическая активность комплексона-тов титана (ФКТ) при обычных (10-3 мольTi/кг живой массы) и малых (10-6 мольTi/кг живой массы) концентрация однотипна, что указывает на общность механизма их действия. Максимумы стимулирующего, инги-бирующего действия веществ наблюдаются при определенной дозе.
При малых концентрациях, когда с → 0 (≤10-6 мольTi/кг живой массы), происходит формирование мономолекулярного слоя фермента на поверхности плазматической мембраны. В данных условиях величина биостимулирующего действия прямо пропорциональна концентрации БАВ. Увеличение дозы титана приводит к постепенному насыщению мембраны молекулами фермента, формированию монослоя. При больших концентрациях, когда начинается процесс формирования второго слоя, наблюдается полоса концентрационного ферментативного «бездействия». Отмечается слабая зависимость интенсивности биологического действия от дозы вещества. Происходит процесс формирования полимолекулярного слоя в результате межмолекулярного взаимодействия комплексоната титана, изменения конформации молекул и образование олигомерных ассоциатов. Процесс заканчивается резким увеличением биостимулирующего действия, что обусловлено формированием полимолекулярного слоя.
Итак, биоэффекты фосфорсодержащих комплексонатов титана носят дозо-, природо-, возрастозависимый, универсальный, иммунотропный, анти-оксидантный, антистрессорный, буферный, дезинтоксикационный и циклический характер.
10.7.2. Роль органической составляющей комплексонатов металлов в их биологическом действии
Вещества, обеспечивающие снижение градиента концентрации, ингибируют внутриклеточные процессы (Бурлакова Е.В., 1999).
Разнообразные механизмы контроля регулируют активность клеточных ферментов при изменении существующих в клетке условий. Наиболее общая форма регуляции - это легкообратимые ингибированные по принципу обратной связи, когда первый фермент метаболического пути ингибируется конечным продуктом этого пути. Более длительная форма регуляции включает в себя химическую модификацию одного фермента под действием другого, что часто происходит в результате фосфорилирования. Изменение конформации фермента усиливает или подавляет его ферментативную активность. Механизм активного вторичного транспорта рассмотрен Питером Митчелом в хемио-осмотической теории окислительного фосфорилирования, в основе которой лежит сочетание химических реакций с осмотическим давлением. Мембранная регуляция осуществляется благодаря изменениям в мембранном транспорте, связыванию или освобождению ферментов, изменению его конформации, а следовательно, изменению активности мембранных ферментов. На активность ферментов оказывает влияние концентрация веществ, подвергающихся превращениям. Большая концентрация субстрата снижает скорость ферментативной реакции. Отмечено также, что мембранные ферменты образуют оли-гомерные ассоциаты. От упаковки липидного окружения ферментов зависят эффективность взаимодействия ферментов в мембране, вязкость микроокружения фермента и активность мембранных ассоциатов.
Изучено биологическое действие комплексоната калия с рядом фосфорсодержащих комплексонов с различным числом фосфоно-вых групп. Дополнительная обработка растений комплексонатами калия в период цветения приводит к снижению содержания хлорофилла в листьях при одновременном повышении урожайности. Изменяется активность хлоропластов. Снижается, а затем прекращается процесс обновления хлорофилла. Прекращается рост надземной массы. Через 72 ч после начала цветения содержание хлорофилла в контроле снижается только на 3,9%, а на кустах, обработанных пестицидами группы ФКК, - на 33-47%. Полученные данные свидетельствуют о том, что калиевые соли нейтрализуют стимулирующее действие титана и железа. Они выступают в качестве антиферментов. Антиферментативное действие возрастает с увеличением концентрации хелатообразующего иона в системе. Данные условия способствуют разрушению гетеровалентных полиядерных соединений титана и железа - комплексов переноса электрона и образованию моноядерных соединений, в которых наблюдается изменение состава и геометрии активного центра фермента (аллостерический эффект).
Ион калия относится к числу деструктурирующих ионов в водных растворах и способствуют разрушению ферментативной системы, обеспечивающей биостимулирующее действие комплексов титана и железа. В результате обработка растения фосфорсодержащими ком-плексонатами s-элементов изменяет направленность биологического действия.
Впервые (Ковальский В.В., 1991) обратил внимание на то, что активность и направленность действия ферментов определяется природой фермента, наличием конкурирующих частиц, результатом конкурирующего комплексообразования. Протекание биохимического процесса подчиняется закону действующих масс. В.В. Ковальский обозначил этот процесс как ферментативная адаптация.
Ферментативная адаптация используется при разработке технологий производства животных и растений. Повышение урожайности в результате второй обработки растений раствором калиевых солей является результатом интенсификации физиологических процессов, связанных с разрушением монолигандных гетеровалентных комплексов титана и транспортом пластических веществ в клубни картофеля. В результате у растения сокращается вегетационный период. Качество клубней повышается. Содержание нитратов снижается на 24%, а при хранении клубней еще на 40% (в контроле только на 25%). Повышение урожайности наблюдается до 20%.
Таким образом, обработка комплексонатами переходных элементов в период бутонизации растения стимулирует рост и развитие организма, а обработка комплексонатами s-элементов - ингибирует процесс роста и развития, что обеспечивается снижением градиента концентрации на мембране растительной клетки. Это способствует повышению урожайности и быстрому переходу растения в состояние покоя. Испытания показали, что фосфоновые группы повышают биологическую эффективность ФКМ.
10.7.3. Роль гидратной оболочки комплексонатов
металлов в их биологическом действии
В работе В.Е. Литвиненко (1982) показана корреляция между биологическим действием биорегулятора и строением его гидратной оболочки. Фосфорсодержащие комплексонаты переходных элементов имеют мощную гидратную оболочку физически и химически сорбированных молекул воды, что обусловлено особенностями строения ионов переходных элементов и полидентатных лигандов. Ионы металлов пере-
ходных элементов обладают сильными электрофильными свойствами (большое число валентных электронов с различной энергией, большое число свободных орбиталей), что определяет высокое координационное число. Одним из этапов образования гидратированных ком-плексонов являются замещение молекул воды гидратной оболочки ФКМ на донорно-акцепторные группы белка (образование водородных и других связей) и повышение мембранной проницаемости. Поэтому ФКМ имеют высокое соотношение внешнесферной (свободной) и вну-трисферной (связанной) воды, это определяет высокую биологическую активность. Внутрисферная вода образует большое количество водородных связей с атомами кислорода комплексона, что приводит к высокой температуре ее отщепления, внешнесферная вода почти не образует водородных связей, при этом межмолекулярные водородные связи не возникают. Полидентатные лиганды, обладающие высокими нуклеофильными свойствами, высокой координационной емкостью, проявляют до 14 различных типов взаимодействий с соседними ионами металлов в качестве хелатно-мостиковых лигандов и определяют эффект субстехиометрического взаимодействия ФКМ. Координационное насыщение частиц превращает токсичные формы в малотоксичные и даже биологически активные. Формирование состава, геометрии биокомплексов и их транспорт в организме происходят с участием их гидратной оболочки.
Изучен состав полимерных форм фосфорсодержащих ком-плексонатов титана (Жолнин А.В., Носова Р.Л., 1997) с нитрило-триметиленфосфоновой кислотой: [Ti5(HL)4(H2O)3] • 12H2O (1) и [Ti5(OH)10(HL)2(H2O)6] • 10H2O (2).
ИК-спектроскопия и методы ядерного магнитного резонанса (ЯМР) показали наличие в комплексах свободной и связанной воды (связанная вода - свободная вода - связанная вода - свободная вода), соотношение которых в образце (1) равно 4:1, а в образце (2) - 1,6:1, что подтверждено более высоким биостимулирующим действием первого образца на рост и развитие картофеля.
Важным условием роста и развития растений является нормальное состояние тургора клетки. Установлено влияние обработки комплек-сонатами на кинетику испарения воды листьями картофеля, тургор-ное состояние клетки. Листья лучше сохраняли тургор. При засухе отношение свободная/связанная вода в растении смещается в сторону последней. При наличии засухи в органах растений подавляется активность стимуляторов роста и накапливаются в активной форме ингибиторы роста. Известно, что микроэлементы действуют на тургор клеток.
При недостатке меди листья становились поникшими и вялыми. Нами наблюдалось достоверное увеличение оводненности тканей листьев под действием комплексонатов на 1-2%. В листьях увеличивалось содержание свободной воды, в результате чего снижалось отношение «свободная/связанная вода» и происходило частичное ее деструктиро-вание. Особенно увеличивалось содержание свободной воды в листьях картофеля в период интенсивного клубнеобразования. Из комплек-сонатов переходных элементов наибольшее воздействие оказывают комплексонаты титана, железа (III) и меди. Содержание хлорофилла в листьях после обработки возрастало. В период бутонизации при обработке комплексонатом меди на 27,7%, железа на 38,9%. Изменялся элементный состав листьев. Комплексонаты железа и цинка увеличивали содержание азота на 21,65 и 12,6% соответственно, содержание фосфора увеличивалось на 18,2% при обработке комплексонатом цинка и на 12,1-15,2% при обработке комплексонатами железа, кобальта и меди. Следовательно, свободная вода больше, чем связанная, определяет интенсивность фотосинтеза. В период максимального развития фотосинтетического аппарата продуктивность фотосинтеза составила 7-8 г сухой массы на 1 м2. В клетках растений создавался оптимальный режим оводненности тканей на 1-2%, листья лучше сохраняли тургор. Повышалась устойчивость к заболеваниям в 2 раза.
10.8. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МАКРО- И МИКРОЭЛЕМЕНТАМИ
Вероятность взаимодействия между минеральными веществами вследствие их лабильности и способности к образованию связей значительно больше, чем между другими питательными веществами. Что касается синергизма и антагонизма элементов в организме, то эти понятия в литературе освещены недостаточно. По-видимому, синерги-стами можно считать такие элементы, которые взаимно способствуют абсорбции друг друга в пищеварительном канале и взаимодействуют при существовании какой-либо обменной функции на тканевом и клеточном уровне.
Синергизм элементов в области желудочно-кишечного канала предполагает возможность следующих механизмов взаимодействия: непосредственное взаимодействие элементов (Са и Р, Na и Cl, Zn и Мо), когда уровень абсорбции определяется их оптимальным соотношением в рационе и химусе; взаимодействие, опосредованное через процес-
сы фосфорилирования в стенке кишечника и активность пищеварительных ферментов (например, влияние Р, Zn, Co на освобождение из корма и абсорбцию других элементов); непрямое взаимодействие путем стимуляции роста и активности микрофлоры в желудке и кишечнике. На уровне тканевого и клеточного метаболизма также возможны разные механизмы синергического взаимодействия: прямое взаимодействие элементов в структурных процессах (взаимодействие Са и Р в образовании костей, совместное участие Fe и Сu в образовании гемоглобина, взаимодействие Мn и Zn в конформации молекул РНК); одновременное участие элементов в активном центре какого-либо фермента (Fe и Мо в составе ксантин- и альдегидоксидаз, Сu и Fe в составе цитохромоксидаз); активирование ферментных систем и усиление синтетических процессов, требующих для своего осуществления присутствия других элементов (активация синтеза ионами Mg2+ с последующим включением в синтез Р, S и других элементов); активирование функций эндокринных органов и опосредствованное влияние через гормоны на обмен других макроили микроэлементов (йод - тироксин - усиление анаболических процессов - задержка калия и магния в организме).
Антагонистами можно считать элементы, которые: а) тормозят абсорбцию друг друга в пищеварительном канале; б) оказывают противоположное влияние на какую-либо биохимическую функцию в организме. В отличие от синергизма, который чаще бывает взаимным, антагонизм может быть либо обоюдным, либо односторонним. Так, фосфор и магний, цинк и медь взаимно тормозят абсорбцию друг друга в кишечнике, а кальций ингибирует абсорбцию цинка и марганца (но не наоборот). Антагонистические взаимосвязи также предполагают несколько возможных механизмов взаимодействия. В частности, эффект ингибирования абсорбции одних элементов другими в пищеварительном канале может быть обусловлен следующими механизмами: простым химическим взаимодействием элементов (образование фосфата магния при избытке последнего в рационе, взаимодействие меди с сульфатом, образование тройной соли Са-Р-Zn при повышенных дозах кальция в рационе); адсорбцией на поверхности коллоидных частиц (фиксация Мn и Fe на частицах нерастворимых солей магния или алюминия); В, Pb, Te и др. на окислительное фосфорилирование, сокоотделение и активность ферментов (что ухудшает расщепление кормовых ингредиентов, освобождение и всасывание неорганических ионов); конкуренцией за вещество-переносчик ионов в кишечной стенке (например,Co2+-Fe2+).
В процессе тканевого метаболизма, где элементы находятся в основном в ионной форме, возможны следующие механизмы антагонистических взаимосвязей: непосредственное взаимодействие простых и сложных неорганических ионов (например, медь-молибден); конкуренция ионов за активные центры в ферментативных формах (Mg2+ и Мn2+ в металлоферментных комплексах щелочной фос-фатазы, холинэстеразы и др.); конкуренция за связь с веществом-переносчиком в крови (Fe2+ и Zn2+ как конкуренты за связь с транс-феррином плазмы); активирование ионами ферментативных систем с противоположной функцией (активация ионами меди аскорби-ноксидазы, окисляющей аскорбиновую кислоту, и активация ионами цинка и марганца лактоназ, способствующих синтезу этого витамина); анатагонистическое влияние ионов на один и тот же фермент (активация АТФазы ионами Mg2+ и торможение ионами Са2+); смягчение ионами биотических элементов токсического влияния тяжелых металлов, присутствующих в корме и средах организма (уменьшение уровня Рb в организме при добавках в рацион меди, цинка, марганца). Все вышесказанное свидетельствует о том, что антагонизм элементов является сложным комплексом биотических взаимоотношений. Его итогом не всегда является снижение уровня того или иного элемента или его повышенная экскреция из организма. Иногда антагонизм выполняет протекторную роль в отношении биохимических функций, и лишь при резком нарушении соотношения ионов наблюдаются отклонения в уровне обменных процессов. Возможность антагонистических взаимоотношений элементов можно в известной мере предвидеть исходя из их положения в периодической системе. В основе этих взаимодействий лежат физико-химическая аналогия элементов, их способность к комплексообразованию, большее или меньшее сродство к соответствующим активным группам биополимеров. В целом можно предположить, что антагонистами являются химические аналоги и гомологи (например, Са-Mg), а также элементы, имеющие одинаковую валентность и способность к образованию аналогичных комплексов. Анионы и катионы способствуют связыванию соответственно катионов и анионов, как простых, так и сложных. Это объясняет, в частности, антагонизм таких элементов, как Zn и Cd, V и Cr, As и Se, Zn и Сu, Са и Fe. На рисунке 10.9 изображены биохимические взаимосвязи (слева - синергические, справа - антагонистические) 15 жизненно необходимых элементов, учтены как пищевые связи, так и взаимодействия в процессе промежуточного обмена.
Рис. 10.9. Метаболические взаимосвязи жизненно необходимых элементов: 1 - синергизм; 2 - антагонизм; сплошная линия - односторонний, пунктирная линия - взаимный) (по Георгиевский В.И. и др., 1979)
Обычные взаимодействия могут нарушаться также при недостатке или избытке в корме витаминов, жира, протеина и других питательных веществ. Также нельзя не учитывать и возможную специфику взаимосвязей у разных видов млекопитающих и их разное физиологическое состояние.
Схема на рис. 10.9, разумеется, не отражает всех возможных вариантов взаимодействия, так как в ней отсутствуют условно необходимые элементы. В частности, в плане антагонизма заслуживают внимания такие вероятные взаимодействия, как: Mg-F, F-I, Al-F, As-I, Al-P, Be-P, Pb-Cu, Sr-Ca, Ag-Cu, Cd-Cu, Ti-Zn, B-Zn, B-Mo. На рисунке 10.10 представлена наиболее совершенная, на наш взгляд, схема, отражающая синергизм и антагонизм макро- и микроэлементов в организме (направление стрелки отражает характер взаимодействия). Схема, разумеется, не отражает всех возможных вариантов взаимодействия. Кроме того, следует также учитывать возможную специфику таких взаимосвязей у представителей разного пола, различные физиологические состояния, влияние психоэмоциональных и физиологических нагрузок и временной фактор.
Как это следует из рис. 10.10, количество обнаруженных положительных связей значительно меньше, чем антагонистических. Возможно, это связано с тем, что последние более отчетливо выявляются в эксперименте, а в практике питания животных вызывают характерные симптомы недостаточности.
Рис. 10.10. Взаимодействие химических элементов (по Momcilivic В., 1987)
Синергические же взаимоотношения нередко ускользают из поля зрения исследователей. Необходимо подчеркнуть, что перечисленные взаимосвязи зависят от верхнего и нижнего уровня физиологических границ. Это важно потому, что характер взаимодействия между минеральными веществами может меняться при недостатке или избытке изучаемых элементов, равно как и других элементов в рационе. Так, медь может оказаться токсичной для организма даже при ее нормальном содержании в рационе (10-11 мг/кг), если в нем недостаточно молибдена. Слишком высокие дозы меди не могут не вызывать токсикоза и являются причиной паракератоза, вследствие нарушенной абсорбции цинка.
10.9. БИОСФЕРА - ИСТОЧНИК МАКРО- И МИКРОЭЛЕМЕНТОВ ОРГАНИЗМА
Химические элементы распространены в окружающей среде очень неравномерно. Обращают на себя внимание огромное содержание таких микроэлементов (по отношению к человеческому организму), как Si, Al, Fe, Zr, Mn, Zn, а также макроэлементов К, Са в земной коре (верхней литосфере) и их небольшие концентрации в пресной, морской воде и атмосфере. Однако в биосфере происходят накопление многих из этих элементов, их концентрирование, что свидетельствует о высокой потребности в них живых организмов для осуществления процессов жизнедеятельности.
В биосфере концентрируются такие химические элементы, как О, К, S, С, Р, Cl, N, Sn, As, относительно высоко содержание Са, В, Zn, Ba, Sr, Rb, Cu, Pb. В связи с различными средами обитания существенно различаются концентрации химических элементов в морских и наземных растениях и животных. Так, в «дарах моря» растительного и животного происхождения сконцентрированы такие элементы, как Са, К, Na, Mg, S, Cl, О, Zn, Cu, Mn, Fe, I, Ni, Ti, Sr, Zr, Cr, Li, B, La. Предоставляемые человеку на суше «дары природы» в целом менее богаты макро- и микроэлементами, однако следует выделить N, С, F, а также Mn и А1, содержание которых в наземных растениях выше, чем в морских в 10 раз. Наземные растения являются основным источником такого важного микроэлемента, как Мn, а морские - Са, Fe, Zr, Si, Li и I. Представители наземной фауны служат основным резервом для обеспечения человека Р, N, Н, т.е. макроэлементами, и чрезвычайно бедны Сr, V, Мn, элементами, принимающими активное участие в регуляции углеводного и жирового обмена, толерантности к глюкозе.
В свою очередь, представители морской фауны накапливают в себе повышенные количества Zn, Со, Сu. Таким образом, поступление химических элементов с пищей может существенно различаться в зависимости от режима питания, доступности, например, морепродуктов для организма. Все это не может не сказываться на суточном балансе поступления элементов в организм человека. Таким образом, в основном химические элементы поступают в организм человека с водой и пищей. Исключение составляет только Si, большие количества которого могут попадать в организм ингаляционным путем в виде пыли, песка или в виде различных соединений этого элемента (SiO2, Si2O3 и др.). В приморских районах и на небольших островах в виде аэрозолей и испарений в организм могут попадать существенные количества йода.
Выделение же химических элементов происходит более разнообразными путями. Так, с мочой преимущественно выделяется Se, Fe, I, Co, Cd, В, Br, Ge, Mo, Nb, Rb, Cs, Те и Sb. С потом в основном выделяется Se, F, Pb, Sn, Ni, а с волосами Hg. И все же основное количество химических элементов элиминируется из организма с калом. Если обратить внимание, то выявляется следующая закономерность: анионы (I, F, Se, Cl) относительно легко абсорбируются (70-95%), и их гомеостаз регулируется в основном за счет выделения через мочевыделительные пути; катионы и микроэлементы (Cr, Zn, V, Mn и др.) абсорбируются значительно хуже, и их гомеостаз регулируется в основном за счет выделения через ЖКТ. Катионы нуждаются
в специфических путях абсорбции, в их гомеостазе принимают участие ЖКТ и желчная секреция. Многие микроэлементы лучше усваиваются в виде органических комплексов (аспарагинаты, глутаматы, цитраты, ацетаты, глюконаты металлов).
Как указывают Ю.А. Ершов и соавт. (2000), в процессе эволюции от неорганических веществ к биоорганическим основой использования тех или иных химических элементов при создании биосистемы является естественный отбор. В таблице 10.10 приведены данные о содержании химических элементов в земной коре, морской воде, растительных и животных организмах.
Из таблицы видно, что большую долю вещества живых организмов составляют элементы, которые имеют довольно высокую распространенность в земной коре. Однако эта закономерность соблюдается не всегда. Так, в земной коре содержится много кремния (27,6%), а в живых организмах его мало. Аналогичная ситуация прослеживается и для алюминия, который в большом количестве содержится в земной коре (7,45%) и в очень незначительном в живых организмах (1х10-8%). Непропорциональное содержание элементов в организме и среде связано с тем, что на усвоение элементов влияет растворимость их природных соединений в воде. Природные соединения кремния (SiO2), алюминия (Al2O3) практически нерастворимы, поэтому они не усваиваются живыми организмами. Наблюдается и обратная картина. Например, органоген углерод в незначительных количествах содержится в земной коре (0,35%), а по содержанию в живых организмах занимает второе место (21%). Таким образом, по мере движения ряда химических элементов по пищевой цепи происходит их биологическое концентрирование, как, например, в случаях с углеродом, азотом, кислородом, фосфором или кальцием, который извлекается из окружающей среды для построения скелета живого организма. Для населения развитых стран характерно включение в рацион разнообразных продуктов питания, часть из которых производится в других биохимических районах, ввиду чего ликвидируются условия, способствующие воздействию на человека биохимических особенностей данной местности. То есть разнообразная пища со значительной долей привозных продуктов не только предупреждает возникновение эндемических дефицитов или избытков макро- и микроэлементов, но и является одним из мощных средств ликвидации эндоэкологических заболеваний биохимического происхождения (Авцын А.П. и соавт., 1991).
Пока не удалось воспитать в человеке не только бережного отношения к окружающей природе, как среде обитания, и к своей внутренней
среде, к составу своего организма, обеспеченности его необходимыми материалами для жизнедеятельности. Вышеперечисленные факторы свидетельствуют о жизненно важной необходимости формирования и воспитания в обществе нооэкологического мировоззрения - одного из немногих резервов, которые продуцируются исключительно человеком. Только в соединении таких факторов с ресурсами природы можно достичь дальнейшего гармоничного развития человечества, исключающего его самоуничтожение.
Таблица 10.10. Содержание химических элементов (масс. доля, %) в земной коре, почвах, морской воде, растениях, животных (по А.П. Виноградову)
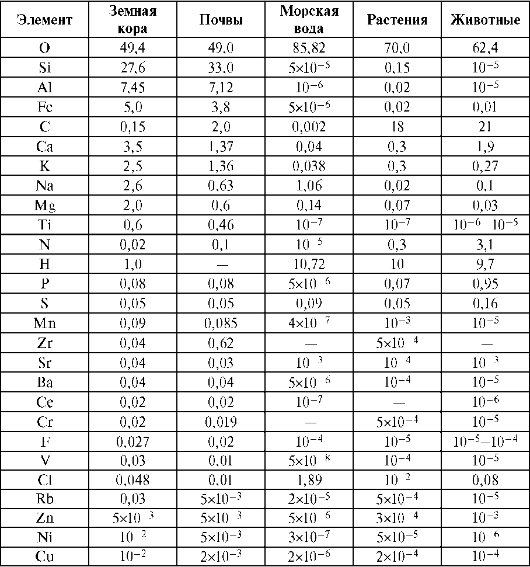
Окончание табл. 10.10
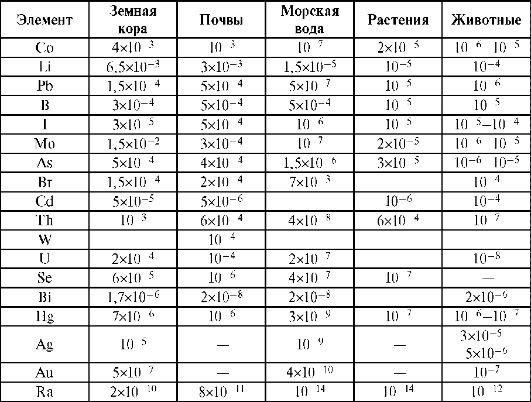
10.10. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. Как распределены биогенные элементы по s-, p- и d-блокам и по периодам периодической системы элементов?
2. Биологическая роль s-элементов. Градиент концентрации ионов, механизм регуляции концентрации ионов в клетках, мембранный потенциал.
3. р-Элементы какого периода обладают ярко выраженной способностью участвовать в образовании водородных связей?
4. Назовите пять макробиогенных р-элементов, являющихся основным строительным материалом, из которого сложены молекулы белков, жиров, углеводов и нуклеиновых кислот.
5. Какую роль выполняют d-элементы в живых организмах? Чем вызвано токсическое действие хроматов и дихроматов на организм?
6. Изменяется ли степень окисления железа в молекуле гемоглобина в процессе присоединения и отдачи кислорода?
7. Назовите комплексообразователь в молекуле витамина В12. Что общего в структурах молекул гемоглобина и витамина В12?
8. Объясните сходство и различие в биологическом действии соединений железа и титана.
9. Чем объясняются уникальные свойства углерода?
10. Назовите p-элементы, которые выступают в качестве химически активных центров полидентатных хелатообразующих лигандов, определяющих их участие в основных биохимических процессах, обеспечении состояния изогидрии организма.
11. В земной коре меди содержится значительно меньше, чем титана, а в живом организме меди содержится в десятки раз больше. Объясните.
12. На каких свойствах перекиси водорода основано ее применение в медицине?
13. Приведите примеры антагонизма Ca2+ и Mg2+, синергизма Mg2+, Mn2+. Объясните, почему Mn2+ выступает синергистом Mg2+?
14. Приведите примеры соединений железа, находящихся в организме.
15. Объясните сходство в биологическом действии ионов Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+.
16. Каков химизм токсического действия соединений ртути, кадмия, свинца и никеля?
17. Каков химизм токсического действия нитратов и нитритов?
18. Может ли цинк катализировать процессы, связанные с переносом электронов?
19. На чем основано применение комплексонов как лечебных препаратов при отравлении соединениями цинка, кадмия и ртути?
20. Имеется ли взаимосвязь между Mg2+ и Be2+ образовывать комплексы с биолигандами неодинаковой прочности и токсическим действием Be2+?
21. Каков механизм токсического действия Ba2+? На каком свойстве ионов бария и стронция основано применение водного раствора сульфата натрия в качестве антидота?
22. Почему рентгеноконтрастное вещество BaSO4 принимают внутрь при рентгеновской диагностике заболеваний пищеварительного тракта без опасения?
23. На каком свойстве сульфида натрия основано его применение в качестве противоядия соединений тяжелых металлов?
24. Почему тиолсодержащие энзимы необратимо отравляются Cu2+
и Ag+?
25. Какие свойства соединений азота (оксидов азота, нитритов, нитратов, нитрозоаминов) определяют их токсическое действие на организм?
10.11. ТЕСТОВЫЕ ЗАДАНИЯ
1. К какому элементу принадлежит 6s2-, 6р2-конфигурация валентных электронов?
а) Se;
б) Po;
в) Pb;
г) Hf..
2. К какому элементу принадлежит 3d1-, 4s2-конфигурация валентных электронов?
а) Br;
б) Mn;
в) Co;
г) Cl.
3. d- и p-элементы одной группы различаются между собой:
а) числом валентных электронов;
б) числом наружных электронов;
в) высшей степенью окисления;
г) формулой высшего оксида.
4. Какой элемент может замещать серу аминокислот в белках?
а) Se;
б) O;
в) Cr;
г) Cl.
5. Какие ионы могут замещать кальций в костной ткани:
а) СО32-;
б) Cs+;
в) Br-;
г) NO3-.
6. Натрий относится:
а) к макроэлементам;
б) элементам электролитного фона;
в) микроэлементам;
г) примесным элементам.
7. Антиоксидантами являются соединения, содержащие группу:
а) -SH;
б) -OH;
в) -COOH;
г) -NH2.
8. Фосфор в фосфоновых группах НТФ, ОЭДФ имеет степень окисления:
а) +3;
б) +5;
в) -3;
г) 0.