Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 3. СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ
Свойства простых и сложных тел находятся в периодической зависимости от атомного веса элементов.
Д. И. Менделеев
3.1. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
Орбиталь - область пространства внутри атома, в которой сосредоточена большая часть заряда электрона. Орбиталь рассматривается как совокупность вероятных (примерно 90% возможных) положений электрона. Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме, подчеркивая тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории.
Изучение атомных орбиталей, рассчитанных с помощью уравнения Шредингера, показало, что характер движения электрона в атоме определяется четырьмя числами - п, l, m, s, получившими общее название квантовых чисел: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n. Это число может принимать любые положительные целочисленные значения: n = 1, 2, 3. Определяет орбитальный радиус и соответствующий главный энергетический уровень En. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Орбитальным радиусом rорб называют расстояние от ядра атома до наиболее удаленной точки поверхности, изображающей атомную орбиталь. Для сферической поверхности орбитальный радиус равен радиусу сферы. Для поверхности в виде песочных часов орбитальный радиус равен диаметру одной из составляющих сфер (рис. 3.1).
Главным энергетическим уровнем называют часть энергии атома, определяемой главным квантовым числом п.
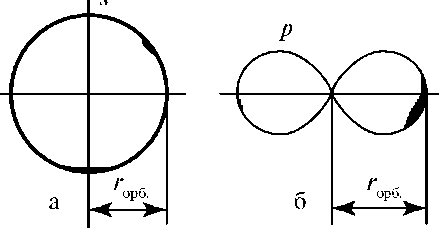
Рис. 3.1. Определение орбитального радиуса rорб для атомных орбиталей разной формы: а - s-орбитали; б - _р-орбитали
Энергия притяжения между электроном и ядром уменьшается обратно пропорционально квадрату главного квантового числа n2, а орбитальный радиус rорб увеличивается пропорционально этой величине. С увеличением числа п электрон в среднем находится все дальше от ядра. При п → ∞ энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома.
Таким образом, главные энергетические уровни Еп атома можно определять экспериментально измерением минимальной энергии, необходимой для отрыва электрона от атома. Определяемая таким способом величина называется энергией ионизации атома - I. Это очень важная характеристика атома, от которой зависят его свойства, в частности электроотрицательность. Еп уменьшается с возрастанием главного квантового числа п и орбитального радиуса rорб.
Орбитальное квантовое число l. Число l может принимать целочисленные значения: l = 0, 1, 2, п - 1, т.е. максимальное значение l не превышает п - 1, где п - главное квантовое число.
Величина l определяет форму атомной орбитали и орбитальный подуровень энергии Enl - главного энергетического уровня атома при данном п. При l = 0 форма орбитали сферическая и называется s-орбиталью. При l = 1 орбиталь имеет форму песочных часов (гантели) и называется р-орбиталью. При l = 2 форма орбитали четырехлопастная и называется d-орбиталью.
У р-орбиталей имеется узел, а у d-орбиталей узловые плоскости, где волновые функции равны нулю. Знаки лопастей чередуются. При п = 1 имеется только одна s-орбиталь и отсутствуют другие подуровни энергии и орбитали. При п = 2 имеются 2s (l = 0)- и 2р (l = 1)-орбитали разной ориентации. Им соответствуют энергетические подуровни Е2s" Е2р. При п = 3 имеются одна 3s (l = 0)-, 3р (l = 1)- и 3d (l = 2)-орбитали разных ориен-таций. Им соответствуют энергетические подуровни E3s, Е3p' E3d.
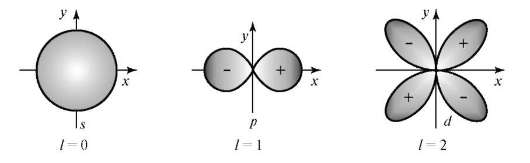
Рис. 3.2. Пространственная форма s-, p-, d-атомных орбиталей
Размер атомных орбиталей разной формы возрастает с увеличением п.
Магнитное квантовое число m. Число т принимает целочисленные значения: 0, ±1, ±2, ±l. Определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне Enl и магнитный энергетический подуровень Enlm. На каждом орбитальном подуровне Е (l = 1) имеется три пр-орбитали с ориентацией вдоль осей х, у, z. Например, при п= 2 подуровню E2l(l = 1) соответствуют орбитали 2рх(m = ±1), 2ру(m = -1) и 2рz(m = 0) (рис. 3.3).
При п = 3 подуровню Е31 (l = 2) отвечают пять орбиталей разных ориентаций.
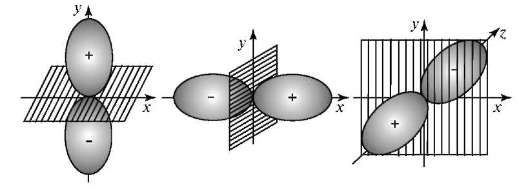
Рис. 3.3. Ориентация р-атомных орбиталей при разных значениях магнитного квантового числа т
Спиновое квантовое число s. Число s принимает два значения: +0,5 и -0,5. Характеризует собственное вращательное движение электрона. На каждой атомной орбитали двум значениям S = ± 0,5 отвечает вращение по часовой и против часовой стрелки. Соответственно имеются два спиновых подуровня энергии Enlms.
Четыре квантовых числа n, l, m, s характеризуют различные типы пространственного квантования при движении одного электрона в атоме и определяют соответствующие квантовые энергетические уровни.
Орбиталь φnlm и соответствующий энергетический уровень Enlm, определяемый четырьмя квантовыми числами п, l, m, s, называют квантовым состоянием электрона в атоме.
3.2. СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
Число электронов в атоме химического элемента определяется зарядом ядра Ze, где Z - номер элемента (число протонов или зарядовое число атома); е - заряд протона, равный по абсолютному значению заряду электрона. Рассмотренные выше квантовые числа точно характеризуют возможные состояния одного электрона в поле ядра. Это - квантовые состояния одноэлектронного иона.
Во всех атомах, кроме водорода, электроны взаимодействуют не только с ядром, но и друг с другом. С помощью уравнения Шредингера можно рассчитать волновые функции атомов с разным числом электронов. Расчеты показывают, что состояния электронов в таких атомах можно также охарактеризовать квантовыми числами n, l, т, s. Взаимодействие между электронами приводит к тому, что происходит их распределение по разным квантовым состояниям. Это распределение определяет строение или конфигурацию электронных оболочек атомов.
Конфигурацию электронной оболочки произвольного атома можно определить путем «заполнения» квантовых состояний одноэлектрон-ного иона на основе принципов или правил заполнения, предложенных В. Паули.
Каждое квантовое состояние можно изобразить на энергетической диаграмме с помощью черты - энергетического уровня Enlm и соответствующей ему волновой функции атомной орбитали. При построении электронной конфигурации удобно любую орбиталь и соответствующий ей уровень изображать с помощью кружка и черты или квадрата и черты. Это так называемая квантовая ячейка. Кружок с чертой символически обозначает энергетический уровень и соответствующую ему атомную орбиталь. Но и такую энергетическую диаграмму можно упростить, изобразив каждое квантовое состояние (ячейку) одной чертой.
Электронную конфигурацию произвольного атома получают, «заполняя» диаграмму состояний электронами по методу Паули с помощью следующих трех правил:
• принцип минимума энергии: электроны в невозбужденном атоме распределяются по квантовым состояниям таким образом, чтобы суммарная энергия атома Еат была минимальна: Еат = Enlm min. Конфигурация, при которой атом обладает минимальной энергией, называют основным или невозбужденным состоянием атома.
• принцип Паули: на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов. В соответствии с принципом Паули на энергетической диаграмме состояний
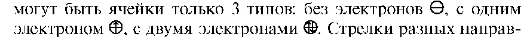
лений в ячейке изображают электроны с разными значениями спинового квантового числа; • правило Гунда: при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек.

Наиболее просто электронная конфигурация представляется в виде электронной формулы атома. Для этого символы заполненных квантовых ячеек записывают в одну строчку с показателем степени, равным числу электронов в ячейке. Символы ячеек записывают в порядке повышения энергетических уровней. Например, для атома азота электронная формула оболочки имеет вид: N - 1s22s22px2py2pz, или еще короче: N - 1s22s22p3. Очевидно, что сумма степеней при символах должна равняться числу электронов Z в оболочке или номеру элемента. Для азота (Z = 7) эта сумма равна 2 + 2 + 3 = 7. Существенно, что в электронной формуле атома, как и в энергетической диаграмме, отображена последовательность расположения энергетических уровней по высоте: ls < 2s < 3s.
При поглощении энергии один или несколько электронов атома могут перейти на более высокие энергетические уровни. Такой атом называется возбужденным. В возбужденном атоме электроны занимают новые квантовые ячейки, уже не подчиняясь принципу минимальной энергии. Соответственно изменяются энергетические диаграммы и электронные формулы. Для примера - переход атома углерода из основного состояния С - 1s22s22p2 в возбужденное С* - 1s22s12p3.
3.3. ХИМИЧЕСКАЯ СВЯЗЬ И ЕЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ХАРАКТЕРИСТИКИ
Разработка современной модели атома и предсказание на ее основе свойств индивидуальных атомов - очень важные достижения квантовой механики. Однако в земных условиях редко встречаются изолированные атомы. Окружающие нас тела неживой и живой природы состоят из разнообразных молекул.
Молекулы - наименьшие частицы вещества, которые состоят из двух атомов и более и определяют химические свойства вещества.
Перед квантовой механикой стояла задача расшифровки электронного строения молекул и прогнозирования их свойств.
Живые организмы построены из самых разнообразных молекул. Здесь множество низкомолекулярных соединений - аминокислоты, сахара, жиры, неорганические вещества. Здесь и высокомолекулярные соединения - очень сложные молекулы белков, нуклеиновых кислот, составляющих основу жизни.
Химиков всегда интересовал вопрос, почему одни атомы соединяются в молекулы, другие нет? Почему одни вещества устойчивы, другие быстро распадаются? Почему все молекулы даже самого сложного вещества одинаковы? Ответы на все эти вопросы важно знать и биологам, и медикам. Например, идентичность всех молекул ДНК (дезок-сирибонуклеиновая кислота) в организме животного - необходимое условие устойчивости наследственных свойств и причина генетических болезней.
На многие из этих вопросов ответил выдающийся русский химик А.М. Бутлеров (1828-1886), создавший теорию химического строения органических веществ (1861). С этого времени в химию начинают постепенно входить понятия валентность и химическая связь.
Валентностью называют способность атома присоединять определенное число других атомов с образованием молекулы.
Валентность обозначают черточками у символа элемента. Водород (Н-) - одновалентный, кислород (О=) - двухвалентный. Число валентных черточек определяет число химических связей, которые данный атом может образовать с другими атомами. Так, кислород соединяется с двумя атомами водорода, образуя воду Н-О-Н. Углерод может соединяться с четырьмя атомами водорода, образуя метан CH4, или с двумя атомами кислорода, образуя молекулу углерод диоксида О=С=О. Представления о валентности и химической связи, разработанные в XIX в., широко используют до настоящего времени.
Однако классическая теория валентности носит эмпирический характер. Непонятно, например, почему валентность кислорода равна двум, а водорода - единице. Почему не образуются молекулы гелия? Почему валентность атомов может быть переменной? Природа химической связи была установлена лишь после открытия законов квантовой механики и расчета атомных орбиталей. Только тогда удалось ответить на поставленные и многие другие вопросы.
Химической связью называют совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу. Свойства химической связи изучают различными методами (с помощью химических методов определяют число связей атомов (валентность) и их реакционную способность.
Длиной химической связи rc называют величину, измеряемую расстоянием между ядрами связываемых атомов. Характерное значение для одинарной связи rс = 100 мм.
Прочность химической связи Ес - величина, измеряемая энтальпией ΔHc образования связи. В качестве единицы измерения прочности химической связи Ес используют кДж/моль. Характерное значение для одинарной связи Ес = 400 кДж/моль. Прочность химической связи определяют с помощью закона Гесса на основе энтальпий реакций, при которых образуется или разрывается изучаемая связь.
Ориентация химической связи αс - величина, измеряемая углом между направлениями связей данного атома с соседними атомами молекулы. Угол αс называют валентным. Единица измерения валентного угла αс - градус. Значение αс может меняться в пределах от 80 до 180°. Например, для воды αс равен 104°. Валентные углы определяют на основе данных по рентгеноструктурному анализу и других физических методов.
Полярность химической связи μс - величина, измеряемая электрическим моментом данной связи. Электрический момент для двух электрических зарядов +q и - q, равных по абсолютному значению и противоположных по знаку, равен qr, где r - расстояние между зарядами. Такие два заряда образуют электрический диполь:
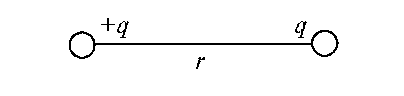
Химическая связь поляризуется, когда связываются два атома с разной электроотрицательностью (ОЭО). В результате на атоме с большим значением ОЭО возникает избыточный отрицательный заряд, а на другом атоме с меньшим значением ОЭО - избыточный положительный заряд.
В качестве единицы измерения полярности химической связи принято использовать внесистемную единицу Дебай 1 D = 3,3•10-30 Кл•м. Полярность О-Н связи в молекуле воды равна μ(Н20) = 1,5 D.
3.4. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
При постепенном сближении атомов взаимодействие возрастает и становится особенно большим, когда расстояние между ядрами оказывается меньше 2rорб. На этом расстоянии электронные орбитали атомов перекрываются. При таком сближении электроны разных атомов водорода уже не могут двигаться независимо. Во-первых, при попадании электрона из одного атома в область перекрывания он может не вернуться, а переходит на ls-орбиталь второго атома. То же может происходить с электроном второго атома.
Таким образом, вследствие перекрывания орбиталей атомы постоянно обмениваются электронами, если их спиновые числа противоположны по знаку. Противоположная направленность спинов обусловлена принципом Паули, который запрещает электронам с одинаковыми спиновыми числами находиться на одной орбитали.
Квантово-механические расчеты показывают, что в результате обмена электронами между атомами возникает сильное притяжение. Такой тип взаимодействия называется обменным. Соответствующую этому взаимодействию обменную энергию обозначают Еоб. Для молекулы водорода обменная энергия составляет примерно 90% всей энергии связи Ес. По своей сущности обменное взаимодействие электрическое.
Помимо обменного взаимодействия, определенный вклад в энергию химической связи вносят кулоновские силы, действующие между электронами и ядрами, как и между любыми точечными зарядами. Кулоновское взаимодействие возрастает с уменьшением расстояния между зарядами. При сближении атомов водорода энергия электростатического притяжения возрастает, достигая максимума при расстоянии, равном длине связи. При дальнейшем сближении электростатическое притяжение уменьшается вследствие отталкивания ядер, и на малых расстояниях кулоновское отталкивание становится преобладающим. Таким образом, энергия взаимодействия между атомами Н складывается из двух слагаемых: обменной энергии и кулоновской энергии.
Характер взаимодействия между атомами зависит от знака спиновых чисел электронов. Электроны в разных атомах могут характеризоваться одинаковыми по знаку спинами. В этом случае энергия взаимодействия
между атомами всегда положительна. При уменьшении расстояния между атомами растет сила отталкивания, и химическая связь не образуется.
Если спиновые числа электронов в атомах противоположны по знаку, энергия взаимодействия отрицательна, когда расстояние между ядрами не слишком мало. Атомы притягиваются, и образуется химическая связь. На энергетической кривой в этом случае имеется минимум. Энергия, отвечающая минимуму энергетической кривой, равна прочности химической связи Ес. Для молекулы водорода квантово-механический расчет по методу ВС дает значение Ес = 350 кДж/моль. Расстояние, отвечающее минимуму энергетической кривой, равно длине химической связи rс. Для молекулы водорода по методу ВС получают rс = 80 пм.
Таким образом, расчетные значения прочности и длины химической связи для водорода близки к экспериментальным: Ес = 430 кДж/моль, rс = 74 пм. Отсюда можно сделать вывод, что положения метода ВС правильно отражают природу взаимодействий при образовании химической связи.
Квантово-механические расчеты характеристик различных химических связей позволяют сформулировать следующие два основных положения метода ВС о природе химической связи:
1) химическая связь между двумя атомами, которая возникает в результате перекрывания внешних атомных орбиталей и путем обобщения электронов, находящихся на этих орбиталях, называют ковалентной;
2) характеристики химической связи (Ес, rс, αс, μс) и ее природа определяются типом перекрывающихся орбиталей атомов.
Длина химической связи. Наиболее наглядная характеристика химической связи - длина химической связи rс. Химическая связь образуется в результате частичного перекрывания валентных орби-талей. Очевидно, что длина связи rс должна быть примерно равной сумме орбитальных радиусов, связываемых атомы А и В: rc(A - В) =
= rорб.(А)+ rорб.(В).
Кратные связи. Образование кратных (двойных и тройных) связей также находит объяснение в методе ВС. Например, образование связей в молекуле кислорода О2 объясняется следующим образом.
Электронная формула 2s22px22py12pz1 валентной оболочки атома О указывает на возможность образования двух связей с помощью орбиталей 2ру и 2pz. При взаимодействии двух атомов кислорода одна связь образуется в результате перекрывания их орбиталей 2pz вдоль оси z (рис. 3.4).
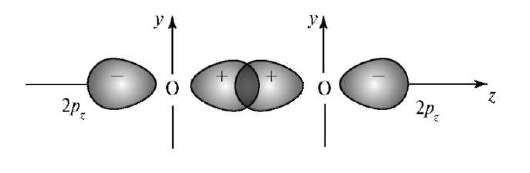
Рис. 3.4. Образование σ-связи
Такая связь называется σ-связью. Связи такого же типа образуются в молекулах Н2, F2, HCl.
σ-Связью называют химическую связь, которая образуется в результате перекрывания валентных орбиталей на прямой, соединяющей ядра этих атомов.
Вторая связь между атомами кислорода образуется в результате бокового перекрывания орбиталей 2ру (рис. 3.5).
Боковое перекрывание не противоречит принципам метода ВС. Такая химическая связь называется π-связью. Тот же тип связи в молекулах этилена, бензола.
π-Связью называют химическую связь между атомами, которая образуется в результате перекрывании валентных орбиталей вне прямой, проходящей через ядра этих атомов.
Таким образом, две химические связи в молекуле кислорода, обозначаемые традиционно двумя черточками О=О, с точки зрения метода ВС имеют разную природу. Одна из связей σ, другая π. Прочность двойной связи Ec (О=О) = 490 кДж/моль существенно выше прочности одинарной связи, Ес (Н-Н) = 430 кДж/моль (см. рис. 3.5).
Необходимо иметь в виду, что с увеличением кратности длина химической связи уменьшается.
Валентный угол. Помимо расчета прочности Ес и длины связи важным результатом метода ВС является также предсказание валентных углов.
В соответствии со 2-м положением метода ВС ориентация химических связей определяется типом перекрывающихся атомных орбиталей. s-Орбитали сферически симметричны, и для них степень перекрывания одинакова по всем
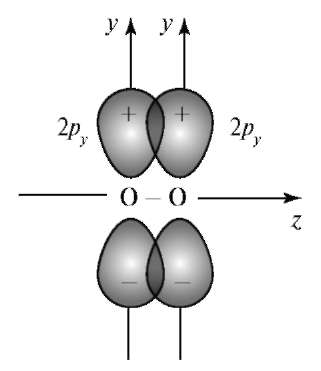
Рис. 3.5. Образование π-связи
направлениям. Строго определенным образом ориентированы в пространстве р- и d-орбитали.
Соответственно, высокая степень перекрывания и сильная связь могут обеспечиваться лишь по некоторым направлениям. Это прямое следствие пространственно-квантованного движения электронов в атоме.
3.5. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Таким образом, метод ВС простыми средствами позволяет объяснить возникновение и свойства химических связей во многих соединениях. Но в ряде случаев имеются явные расхождения экспериментальных данных и теоретических предсказаний метода в той его форме, которую предложили В. Гайтлер и Ф. Лондон.
Выдающийся американский ученый нашего времени Л. Полинг предложил усовершенствование метода ВС. Он выдвинул дополнительное положение о возможности гибридизации атомных орбиталей при образовании химических связей.
Гибридизацией называют образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома.
Число гибридных орбиталей равно числу суммируемых орбита-лей φi . При образовании молекулы метана складываются 4 орбитали углерода φi: 2s, 2рх, 2ру, 2рг В результате получают 4 одинаковые по форме и энергии гибридные орбитали с различной ориентацией в пространстве. Название гибридных орбиталей определяется числом и типом складываемых орбиталей. В случае метана spxpypz = sp3. Соответственно говорят, что имеет место sp3-гибридизация.
Гибридные орбитали данного атома участвуют в образовании циклической связи в соответствии с 1-м положением метода ВС так же, как и обычные: путем перекрывания и обмена электронами с орбита-лями другого атома. sp3-Гибридизация углерода имеет место не только в метане, но и в молекулах других предельных углеводородов - гомологов метана. Кроме углерода, sp3-гибридные орбитали могут иметь атомы других элементов, например бора, азота, кремния.
При образовании непредельных соединений углерода с двойными связями происходит sp2-гибридизация: φg = sp2 = 2s ± 2рх± 2ру.
В этилене С2Н4 каждый атом углерода имеет три sр2-гибридные орбитали и одну негибридизированную 2рz -орбиталь. sр2-Орбитали лежат в одной плоскости. Их «лопасти» ориентированы под углом 120° друг к другу. Атомы углерода связаны двойной связью. Одна
связь σsp2 образуется путем перекрывания sр2-орбиталей на прямой, соединяющей ядра атомов С, другая связь πр1 возникает в результате перекрывания негибридизированных рz-орбиталей вне этой прямой. Четыре атома водорода образуют одинарные σ-связи путем перекрывания 1s- и sр2-орбиталей.
Таким образом, на основе метода ВС можно сделать ряд предсказаний. Шесть атомов молекулы этилена С2Н4 лежат в одной плоскости. Валентные углы одинаковы и равны 120°. В производных этилена замещающие атомы также лежат в одной плоскости. Прочность π-связи велика. Поэтому в обычных условиях вращение около С-С-связи не происходит. В результате возможно существование геометрических цис- и транс-изомеров. Эти теоретические предсказания согласуются с экспериментальными измерениями.
По схеме, описанной для этилена, двойная связь может образоваться между атомами разных элементов. Например, связь С=О в кетонах и альдегидах. При образовании ацетилена (этина) С2Н2 и его производных с тройными связями происходит sp-гибридизация: φg = sp = 2s ± 2px.
В ацетилене каждый атом углерода имеет две sp-гибридные орбитали и две негибридизованные (2ру и 2рz) орбитали. sp-Орбитали ориентированы по оси х в противоположных направлениях. Атомы углерода связаны тройной связью. Одна связь asp образуется путем перекрывания sp-орбиталей на прямой, соединяющей ядра атомов С. Две пр-связи возникают в результате перекрывания негибридизованных р-орбиталей вне этой прямой. Два атома водорода образуют одинарные a-связи путем перекрывания 1s- и 2р-орбиталей. Для ацетилена С2Н2 метод ВС прогнозирует линейную форму молекулы, при которой все четыре атома лежат на одной прямой. Все валентные углы равны 180°. Тройная связь должна быть более прочной, чем двойная. Эти предсказания подтверждаются экспериментом. Гибридизация атомных орбиталей в комплексных соединениях рассмотрена в главе 7.
3.6. ВОДОРОДНЫЕ СВЯЗИ
Химические связи в молекулах обычно очень прочны, их энергия находится в пределах 100-150 кДж/моль. Кроме этого существуют так называемые водородные связи, прочность которых составляет 10-40 кДж/моль. Длина этих связей соответственно 270-230 пм.
Водородной связью между атомами А и Б называют взаимодействие, осуществляемое атомом водорода, соединенным с А или Б химической
связью. Изображение водородной связи в общем случае имеет вид:
А-Н---Б.
Очевидно, что водородная связь трехцентровая, так как в ее образовании принимают участие три атома. Для возникновения такой связи необходимо, чтобы атомы А и Б обладали большой электроотрицательностью.
Это атомы наиболее отрицательных элементов: азота, кислорода, фтора и хлора. Водородную связь называют:
1) внутримолекулярной, если атомы, соединенные этой связью, принадлежат одной и той же молекуле;
2) межмолекулярной, если атомы, соединенные связью, находятся в разных молекулах.
Внутримолекулярные водородные связи играют важнейшую биологическую роль, так как определяют, например, спиральную структуру полимерных молекул белков. В белках это связи N-Н-О между аминокислотными остатками.
Не менее важны межмолекулярные водородные связи. С их помощью соединены цепи нуклеиновых кислот, образующих двойную спираль. Здесь имеются 2 типа связей между азотистыми основаниями N-H---N и N-Н-О.
Водородные связи достаточно прочны, чтобы выдерживать постоянные удары окружающих молекул и обеспечивать постоянство формы полимерных биологических структур. Вместе с тем при ударах активных молекул водородные связи периодически разрываются, вновь восстанавливаются, обеспечивая протекание различных процессов жизнедеятельности.
3.7. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. С помощью каких квантовых чисел можно полностью описать состояние электрона в атоме?
2. Что определяет главное квантовое число? Какая связь между числом энергетических уровней и положением элементов в периодической системе?
3. Что характеризует орбитальное квантовое число? Как оно выражается? Объясните понятие «энергетические подуровни», и чему равно максимально возможное число электронов на каждом из подуровней? Какие формы имеют электронные облака s-, p- и d-элементов? Сколько подуровней:
а) на третьем энергетическом уровне - Mg?
б) на четвертом энергетическом уровне - N?
На каком из подуровней второго энергетического уровня электронные облака имеют форму гантели?
4. Какое из квантовых чисел определяет ориентацию электронного облака в пространстве? Сколько пространственных ориентаций возможно для s-, p-, d- и f-электронов? Составьте электронные формулы атомов титана, азота, углерода, марганца, кремния.
5. Укажите характер связей между всеми атомами в следующих веществах: натрия хлорид, NaCl; нитрит-ион, NO2-; ион гидроксония, H3O+; аммиак, NH3; водород, H2; барий карбонат, BaCO3?
6. Какие типы химических связей встречаются в комплексных соединениях?
7. Охарактеризовать, исходя из электронного строения атомов s-, p-, d-элементов, их способность к реакциям комплексообразования и расположить их по увеличению этой способности.
8. Перечислить основные типы гибридизации атомных орбиталей, которые могут возникнуть у комплексообразователя в комплексных соединениях и влияние их на геометрию комплексов.
9. Какова природа и причины возникновения химической связи? Назовите основные типы химической связи.
10. Дайте характеристику основным параметрам химической связи.
11. Какие электронные облака принимают участие в образовании σ-связи, π-связи? Приведите примеры.
12. Какие типы гибридизации атомных орбиталей углерода соответствуют строению молекул CH4, C2H6, C2H4, C2H2?
13. Укажите типы связи в молекуле H2O2, значение длины и энергии связи, степени окисления кислорода.
14. Сравните значения валентных углов молекул и объясните характер их изменения в ряду CH4(109,5°), NH3(107,3°), H2O(104,5°).
3.8. ТЕСТОВЫЕ ЗАДАНИЯ
1. Что определяет главное квантовое число?
а) энергию электрона на уровне и удаленность электронной плотности от ядра;
б) ориентацию орбиталей в пространстве;
в) собственное вращательное движение электрона;
г) энергию электрона на подуровне и форму атомной орбитали.
2. Что характеризует орбитальное квантовое число?
а) собственное вращательное движение электрона;
б) энергию электрона на энергетическом уровне;
в) ориентацию орбиталей в пространстве;
г) энергию электрона на подуровне и форму атомной орбитали.
3. Какое из квантовых чисел определяет ориентацию электронного облака в пространстве?
а) главное;
б) спиновое;
в) орбитальное;
г) магнитное.
4. Какова максимальная емкость p-подуровня?
а) 2;
б) 4;
в) 6;
г) 8.
5. Какова максимальная емкость d-подуровня?
а) 14;
б) 12;
в) 10;
г) 8.
6. В какой молекуле наблюдается sp-гибридизация?
а) СН4;
б) ВеF2;
в) С6Н6;
г) NH3.
7. Какой тип гибридизации наблюдается в молекуле NH3, валентный угол равен 107,3°?
а) sp;2
б) sp2;
в) sp3;
г) sp3d.
8. Химические связи, энергия которых составляет 10-40 кДж/моль:
а) ионные;
б) ковалентные;
в) металлические;
г) водородные.
9. Валентный угол в молекуле этилена составляет:
а) 120°;
б) 180°;
в) 109°28';
г) 60°.
10. Формулировка «при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек» является выражением:
а) принципа минимума энергии;
б) правила Гунда;
в) принципа Паули;
г) положением теории Бутлерова.