Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ И ПРОЦЕССЫ
Жизнь - непрерывная цепь окислительно-восстановительных процессов.
А.-Л. Лавуазье
8.1. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
Процессы обмена веществ, дыхания, гниения, брожения, фотосинтеза являются в своей основе окислительно-восстановительными процессами. В случае аэробного метаболизма основным окислителем является молекулярный кислород, а восстановителем - органические вещества продуктов питания. Показателем того, что в основе жизнедеятельности организма лежат окислительно-восстановительные реакции, являются биоэлектрические потенциалы органов и тканей. Биопотенциалы являются качественной и количественной характеристикой направления, глубины и интенсивности протекания биохимических процессов. Поэтому регистрация биопотенциалов органов и тканей широко применяется в клинической практике при изучении их деятельности, в частности при диагностике сердечно-сосудистых заболеваний снимают электрокардиограмму, при измерении биопотенциалов мышц снимают электромиограмму. Регистрация потенциалов мозга - энцефалография - позволяет судить о патологических нарушениях нервной системы. Источником энергии жизнедеятельности клеток служит мембранный потенциал, равный 80 мВ, обусловленный возникновением ионной асимметрии, т.е. неодинаковым распределением по обе стороны мембраны катионов и анионов. Мембранный потенциал имеет ионную природу. В многоядерных комплексах протекают процессы, связанные с переносом электронов и протонов между частицами, которые сопро-
вождаются изменением степени окисления реагирующих частиц и возникновением окислительно-восстановительного потенциала. Окислительно-восстановительный потенциал имеет электронную природу. Эти процессы имеют обратимый циклический характер и лежат в основе многих важных физиологических процессов. Михаэлис отмечал важную роль окислительно-восстановительных процессов в жизни: «Окислительно-восстановительные процессы, происходящие в живых организмах, относятся к разряду тех, которые не только бросаются в глаза и могут быть опознаны, но и являются самыми важными для жизни и с биологической, и с философской точки зрения».
8.2. СУЩНОСТЬ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
В 1913 году Л.В. Писаржевский выступил с электронной теорией окислительно-восстановительных процессов, которая является в настоящее время общепринятой. Этот тип реакций осуществляется за счет перераспределения электронной плотности между атомами реагирующих веществ (переходом электронов), что проявляется в изменении степени окисления.
Реакции, в результате которых изменяются степени окисления атомов, входящих в состав реагирующих веществ вследствие переноса электрона между ними, называются окислительно-восстановительными реакциями.
Окислительно-восстановительный процесс состоит из 2 элементарных актов или полуреакций: окисления и восстановления.
Окисление - это процесс потери (отдачи) электронов атомом, молекулой или ионом. При окислении степень окисления частиц повышается:
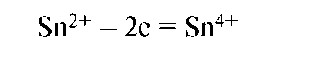
Частица, отдающая электроны, называется восстановителем. Продукт окисления восстановителя называется его окисленной формой:
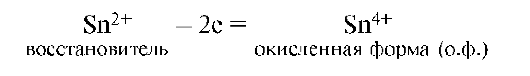
Восстановитель со своей окисленной формой составляют одну пару окислительно-восстановительной системы (Sn2+/Sn4+).
Мерой восстановительной способности того или иного элемента является потенциал ионизации. Чем меньше потенциал ионизации элемента, тем более сильным восстановителем он является, s-элементы и элементы в низшей и промежуточной степени окисления - сильные восстановители. Способность частицы отдавать электроны (донорная способность) определяет ее восстановительные свойства.
Восстановление - это процесс присоединения электронов частицей. При восстановлении степень окисления понижается:
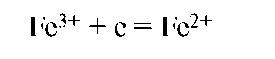
Частица (атомы, молекулы или ионы), присоединяющая электроны, называется окислителем. Продукт восстановления окислителя называется его восстановленной формой:
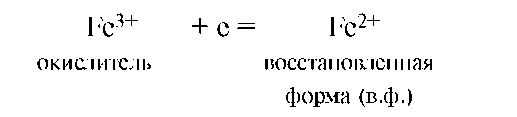
Окислитель со своей восстановленной формой составляет другую пару (Fe3+/Fe2+) окислительно-восстановительной системы. Мерой окислительной способности частиц является сродство к электрону. Чем больше сродство к электрону, т.е. электроноакцепторная способность частицы, тем более сильным окислителем он является. Окисление всегда сопровождается восстановлением, и, наоборот, восстановление связано с окислением.
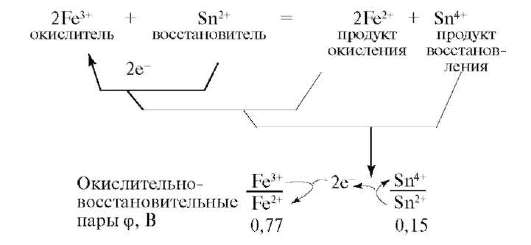
Рассмотрим взаимодействие FeCl3 с SnCl2. Процесс состоит из двух полуреакций:
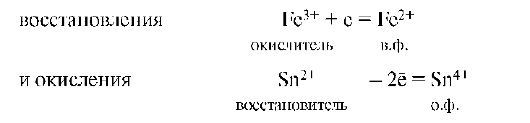
Окислительно-восстановительную реакцию можно представить в виде сочетания двух сопряженных пар.
В ходе реакций окислитель превращается в сопряженный восстановитель (продукт восстановления), а восстановитель в сопряженный окислитель (продукт окисления). Их рассматривают как окислительно-восстановительные пары:
Поэтому окислительно-восстановительные реакции представляют единство двух противоположных процессов окисления и восстановления, которые в системах не могут существовать один без другого. В этом мы видим проявление универсального закона единства и борьбы противоположностей. Реакция произойдет, если сродство к электрону окислителя больше, чем потенциал ионизации восстановителя. Для этого введено понятие электроотрицательности - величины, характеризующей способность атомов отдавать или принимать электроны.
Составление уравнений окислительно-восстановительных реакций проводится методом электронного баланса и методом полуреакций. Методу полуреакций необходимо отдать предпочтение. Применение его связано с применением ионов, реально существующих, видна роль среды. При составлении уравнений необходимо выяснить, какие из веществ, вступающих в реакцию, выполняют роль окислителя, а какие - восстановителя, влияние на ход реакции pH среды и каковы возможные продукты реакции. Окислительно-восстановительные свойства проявляют соединения, которые содержат атомы, имеющие большое число валентных электронов, обладающих различной энергией. Такими свойствами обладают соединения d-элементов (IB, VIIB, VIIIB групп) и р-элементов (VIIA, VIA, VA групп). Соединения, которые содержат элемент в высшей степени окисления, проявляют только окислительные свойства (КМnО4, H2SO4), в низшей - только восстановительные свойства (H2S), в промежуточной - могут вести себя двояко (Na2SO3). После составления уравнений полуреакций, ионного уравнения составляют уравнение реакции в молекулярной форме:
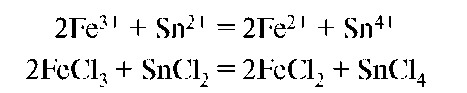
Проверка правильности составления уравнения: число атомов и зарядов левой части уравнения должно быть равно числу атомов и зарядов правой части уравнения для каждого элемента.
8.3. ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ. МЕХАНИЗМ ВОЗНИКНОВЕНИЯ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. УРАВНЕНИЕ НЕРНСТА
Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn2+/Zn°.
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (по первому механизму) (рис. 8.1). При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu2+/Cu°. Потенциал образуется в результате процесса восстановления по второму механизму (рис. 8.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
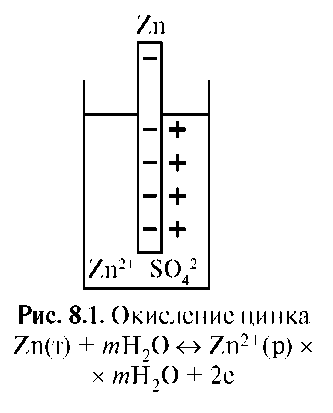
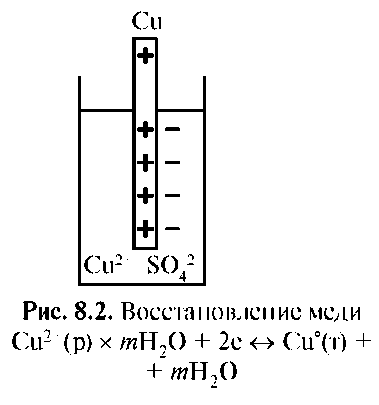
Итак, потенциал возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы - электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления:
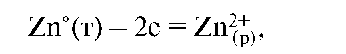
а на медном - полуреакция восстановления:
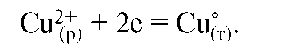
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
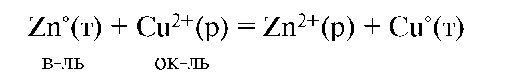
В цепи появляется электрический ток. Причиной возникновения и протекания электрического тока (ЭДС) в гальваническом элементе является разность электродных потенциалов (Е) - рис. 8.3.
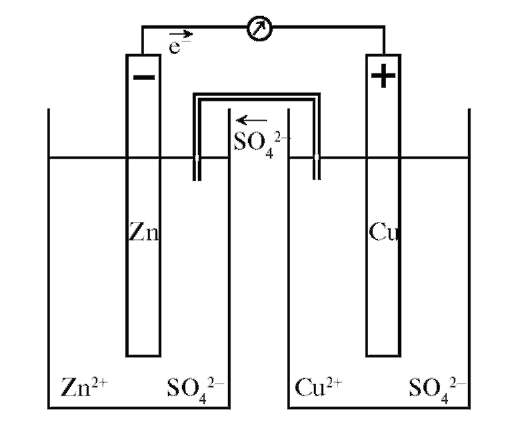
Рис. 8.3. Схема электрической цепи гальванического элемента
Гальванический элемент - это система, в которой химическая энергия окислительно-восстановительного процесса превращается
в электрическую. Химическая цепь гальванического элемента обычно записывается в виде краткой схемы, где слева помещают более отрицательный электрод, указывают пару, образующуюся на этом электроде, вертикальной чертой, показывают скачок потенциала. Две черты обозначают границу между растворами. Заряд электрода указывается в круглых скобках: (-) Zn°|Zn2+||Cu2+|Cu° (+) - схема химической цепи гальванического элемента.
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста. Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина - водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
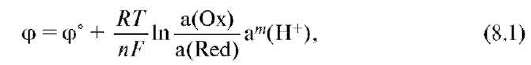
где а(Oх) и a(Red) - активность окисленной и восстановленной форм соответственно; R - универсальная газовая постоянная; Т - термодинамическая температура, К; F - постоянная Фарадея (96 500 Кл/моль); n - число электронов, принимающих участие в элементарном редокс-процессе; а - активность ионов гидроксония; m - стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° - стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H+) = 1 и данной температуре.
Стандартный потенциал системы 2Н+/Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25 °С (298К) после подстановки постоянных величин (R = = 8,31 Дж/моль • град; F = 96 500 Кл/моль) уравнение Нернста принимает следующий вид:
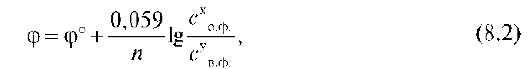
где φ°- стандартный окислительно-восстановительный потенциал пары, В; со.фю и св.ф. - произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у - стехиометри-ческие коэффициенты в уравнении полуреакций.
Электродный потенциал образуется на поверхности металлической пластины, погруженной в раствор ее соли, и зависит только от концентрации окисленной формы [Мn+], так как концентрация восстановленной формы не изменяется. Зависимость электродного потенциала от концентрации одноименного с ним иона определяется уравнением:
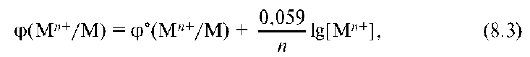
где [Мn+] - равновесная концентрация иона металла; n - число электронов, участвующих в полуреакции, и соответствует степени окисления иона металла.
Редокс-системы делят на два типа:
1) в системе осуществляется только перенос электронов Fe3+ + ē = = Fe2+, Sn2+ - 2ē = Sn4+. Это изолированное окислительно-восстановительное равновесие;
2) системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н+ + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО42-, Cr2О72-, MnО4-. Например, MnО4- + 8Н+ + 5ē = = Mn2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны. Расчет потенциала пары ведут по формуле:
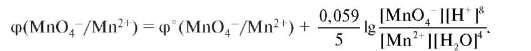
В более широком круге сопряженных пар окисленная и восстановленная формы пары находятся в растворе в различной степени окисления (MnО4-/Mn2+). В качестве измерительного электрода
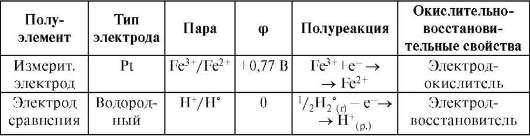
в данном случае применяют электрод из инертного материала (Pt). Электрод не является участником электродного процесса и играет роль только переносчика электронов. Потенциал, образующийся за счет окислительно-восстановительного процесса, происходящего в растворе, называют окислительно-восстановительным потенциалом.
Измерение его выполняют на окислительно-восстановительном электроде - это инертный металл, находящийся в растворе, содержащем окисленную и восстановленную формы пары. Например, при измерении Еo пары Fe3+/Fe2+ применяют окислительно-восстановительный электрод - платиновый измерительный электрод. Электрод сравнения - водородный, потенциал пары которого известен.
Реакция, протекающая в гальваническом элементе:
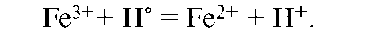
Схема химической цепи: (-)Pt|(H2°), H+||Fe3+, Fe2+|Pt(+).
Окислительно-восстановительный потенциал является мерой окислительно-восстановительной способности веществ. Значение стандартных потенциалов пар указаны в справочных таблицах.
В ряду редокс-потенциалов отмечают следующие закономерности.
1. Если стандартный редокс-потенциал пары отрицателен, например φ°(Zn2+(р)/Zn°(т)) = -0,76 В, то по отношению к водородной паре, потенциал которой выше, данная пара выступает в качестве восстановителя. Потенциал образуется по первому механизму (реакции окисления).
2. Если потенциал пары положителен, например φ°(Сu2+(р)/ Cu(т)) = +0,345 В по отношению к водородной или другой сопряженной паре, потенциал которой ниже, данная пара является окислителем. Потенциал данной пары образуется по второму механизму (реакции восстановления).
3. Чем выше алгебраическая величина стандартного потенциала пары, тем выше окислительная способность окисленной формы и ниже восстановительная способность восстановленной формы этой
пары. Снижение величины положительного потенциала и возрастание отрицательного соответствует падению окислительной и росту восстановительной активности. Например:
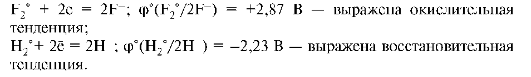
8.4. ВОДОРОДНЫЙ ЭЛЕКТРОД, ИЗМЕРЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПОТЕНЦИАЛОВ
Окислительно-восстановительный потенциал пары определяется потенциалом двойного электрического слоя, но, к сожалению, нет метода для его измерения. Поэтому определяют не абсолютное, а относительное значение, выбирая какую-либо другую пару для сравнения. Измерение потенциала проводят с помощью потенциометрической установки, в основе которой лежит гальванический элемент, имеющий схему: электрод испытуемой пары (измерительный электрод) соединяют с электродом водородной пары (Н+/Н°) или какой-либо другой, потенциал которой известен (электрод сравнения). Гальванический элемент подсоединяют к усилителю и измерителю электрического тока (рис. 8.4).
Водородная пара образуется на водородном электроде в результате окислительно-восстановительного процесса: 1/2H2o(г) ↔ H+(p) + e-. Водородный электрод представляет собой полуэлемент, состоящий
из платиновой пластины, покрытой тонким, рыхлым слоем платины, опущенной в 1 н раствор серной кислоты. Через раствор пропускают водород, в пористом слое платины часть его переходит в атомарное состояние. Все это заключено в стеклянный сосуд (ампулу). Водородный электрод представляет собой трехфазный электрод первого рода (газометаллический). Анализируя уравнение электродного потенциала для водородного электрода, можно сделать вывод, что потенциал водородного электрода линейно увеличивается
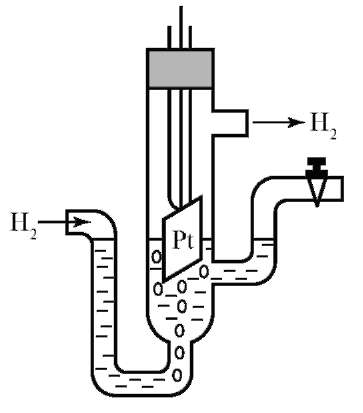
Рис. 8.4. Водородный электрод
с уменьшением водородного показателя pH (ростом кислотности) среды и уменьшением парциального давления газообразного водорода над раствором.
8.5. ПРОГНОЗИРОВАНИЕ НАПРАВЛЕНИЯ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ
ПО ИЗМЕНЕНИЮ СВОБОДНОЙ ЭНЕРГИИ ВЕЩЕСТВ И ПО ВЕЛИЧИНЕ СТАНДАРТНЫХ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПОТЕНЦИАЛОВ
О направлении окислительно-восстановительной реакции можно судить по изменению изобарно-изотермического потенциала системы (энергии Гиббса), свободной энергии (ΔG) процесса. Реакция принципиально возможна при ΔGo < 0. В окислительно-восстановительной реакции изменение свободной энергии равно электрической работе, совершаемой системой, в результате которой ē переходит от восстановителя к окислителю. Это находит отражение в формуле:

где F - постоянная Фарадея, равная 96,5 кК/моль; n - число электронов, участвующих в окислительно-восстановительном процессе, в расчете на 1 моль вещества; Еo - величина разности стандартных окислительно-восстановительных потенциалов двух сопряженных пар системы, которую называют электродвижущей силой реакций (ЭДС). Данное уравнение отражает физический смысл взаимосвязи Еo и свободной энергии Гиббса реакции.
Для самопроизвольного протекания окислительно-восстановительной реакции необходимо, чтобы разность потенциалов сопряженных пар была величиной положительной, что следует из уравнения, т.е. пара, потенциал которой выше, может выполнять роль окислителя. Реакция идет до тех пор, пока потенциалы обеих пар не станут равными. Следовательно, чтобы ответить на вопрос, будет ли данный восстановитель окисляться данным окислителем или, наоборот, нужно знать ΔEo : ΔEo = φ°окисл. - φ°восстан. Реакция протекает в направлении, которое приводит к образованию более слабого окислителя и более слабого восстановителя. Таким образом, сравнивая потенциалы двух сопряженных пар, можно принципиально решить вопрос направления процесса.
Задача. Можно ли восстановить ион Fe3+ ионами T1+ по предлагаемой схеме:
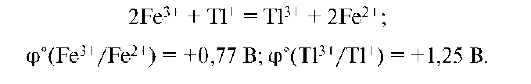
ΔЕ° реакции имеет отрицательное значение:
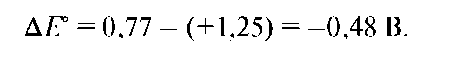
Реакция невозможна, так как окисленная форма Fe3+ пары Fe3+/ Fe2+ не может окислить T1+ пары Т13+/Т1+.
Если ЭДС реакции является отрицательной величиной, то реакция идет в обратном направлении. Чем больше ΔЕ°, тем реакция протекает более интенсивно.
Задача. Каково химическое поведение FeC13 в растворе, содержащем:
a) NaI; б) NaBr?
Составляем полуреакции и находим потенциалы для пар:
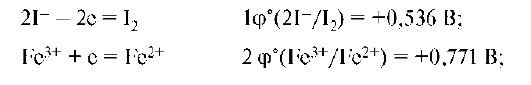
а) Е реакции 2I- + 2Fe3+ = I2 + 2Fe2+ будет равна 0,771-0,536 = = 0,235 В, Е имеет положительное значение. Следовательно, реакция идет в сторону образования свободного йода и Fe2+.
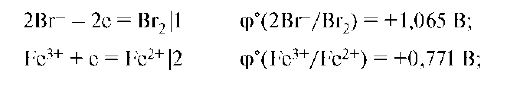
б) Е° реакции 2Br- + 2Fe3+ = Br2 + 2Fe2+ будет равна 0,771-1,065 = = -0,29 В. Отрицательное значение Еo показывает, что хлорид железа не будет окисляться бромидом калия.
8.6. КОНСТАНТА РАВНОВЕСИЯ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ
В некоторых случаях необходимо знать не только направление и интенсивность окислительно-восстановительных реакций, но и полноту протекания реакций (на сколько процентов исходные вещества превращаются в продукты реакции). Например, в количественном анализе можно опираться только на те реакции, которые практически протекают на 100%. Поэтому прежде чем использовать ту или иную реакцию для решения какой-либо задачи, определяют константу рав-
новесия (КР) данной о-в системы. Для определения Кр окислительно-восстановительных процессов используют таблицу стандартных окислительно-восстановительных потенциалов и уравнение Нернста:
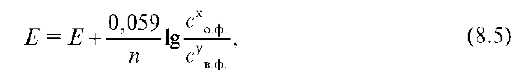
поскольку при достижении равновесия потенциалы сопряженных пар окислителя и восстановителя окислительно-восстановительного процесса становятся одинаковыми: φ°окисл. - φ°восстан. = 0, то Еo = 0. Из уравнения Нернста в равновесных условиях Еo реакции равна:
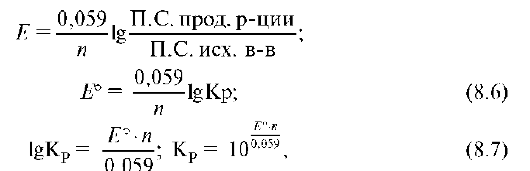
где n - число электронов, участвующих в окислительно-восстановительной реакции; П.С. прод. р-ции и П.С. исх. в-в - соответственно произведение равновесных концентраций продуктов реакции и исходных веществ в степени их стехиометрических коэффициентов в уравнении реакции.
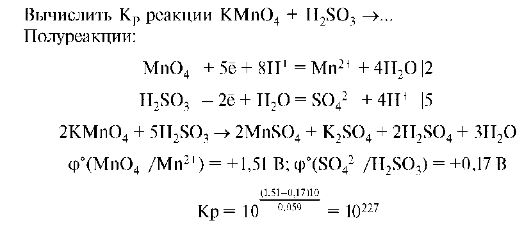
Константа равновесия указывает, что состояние равновесия данной реакции наступает тогда, когда произведение равновесных концентраций продуктов реакции станет в 10 раза больше произведения равновесных концентраций исходных веществ. Кроме того, большая величина Кр указывает, что реакция протекает слева направо. Зная Кр, можно, не прибегая к опытным данным, рассчитать полноту протекания реакции.
8.7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
В процессе жизнедеятельности в клетках и тканях могут возникать разности электрических потенциалов. Электрохимические превращения в организме можно разделить на 2 основные группы.
1. Окислительно-восстановительные процессы вследствие переноса электронов от одних молекул к другим. Эти процессы имеют электронную природу.
2. Процессы, связанные с переносом ионов (без изменения их зарядов) и с образованием биопотенциалов. Биопотенциалы, регистрируемые в организме, - это в основном мембранные потенциалы. Они имеют ионную природу. В результате этих процессов возникают потенциалы между разными прослойками тканей, находящихся в разных физиологических состояниях. Они связаны с различной интенсивностью протекания физиологических окислительно-восстановительных процессов. Например, потенциалы, образующиеся в тканях поверхности листа на освещенной и неосвещенной стороне в результате различной интенсивности протекания процесса фотосинтеза. Освещенный участок оказывается положительно заряженным по отношению к неосвещенному.
В окислительно-восстановительных процессах, имеющих электронную природу, можно выделить три группы.
К первой группе можно отнести процессы, связанные с переносом электронов между веществами без участия кислорода и водорода. Эти процессы осуществляются с участием комплексов переноса электронов - гетеровалентных и гетероядерных комплексов. Перенос электронов происходит в комплексных соединениях одного и того же металла или атомов различных металлов, но в разной степени окисления. Действующим началом переноса электронов являются переходные металлы, которые проявляют несколько устойчивых степеней окисления, и для переноса электронов и протонов не требуются большие энергетические затраты, перенос может осуществляться на большие расстояния. Обратимость процессов позволяет многократно участвовать в циклических процессах. Данные колебательные процессы обнаружены в ферментативном катализе (цитохромы), синтезе белков, обменных процессах. Данная группа превращений участвует в поддержании антиокислительного гомеостаза и в защите организма от окислительного стресса. Они являются активными регуляторами свободно-радикальных процессов, системой утилизации активных форм кислорода, перекиси водорода, участвуют в окислении субстратов
типа каталазы, пероксидазы, дегидрогеназы. Эти системы осуществляют антиоксидантное, антиперекисное действие.
Ко второй группе можно отнести окислительно-восстановительные процессы, связанные с участием кислорода и водорода. Например, окисление альдегидной группы субстрата в кислотную:
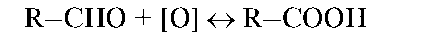
В третью группу относят процессы, связанные с переносом протонов и электронов от субстрата, которые носят pH-зависимый характер, протекают в присутствии ферментов дегидрогеназ (E) и коферментов (Ко) с образованием активированного комплекса фермент-кофермент-субстрат (Е-Ко-S), присоединяя электроны и катионы водорода от субстрата, и вызывают его окисление. Таким коферментом является никотинамидадениндинуклеотид (НАД+), который присоединяет два электрона и один протон:
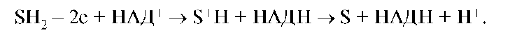
В биохимических процессах имеют место совмещенные химические равновесия: окислительно-восстановительные, протолитиче-ские и процессы комплексообразования. Процессы, как правило, имеют ферментативный характер. Виды ферментативного окисления: дегидрогеназное, оксидазное (цитохромы, свободнорадикальное окисление-восстановление). Протекающие в организме окислительно-восстановительные процессы условно можно разделить на следующие типы: 1) реакции внутримолекулярной дисмутации (диспропорцио-нирования) за счет атомов углерода субстрата; 2) реакции межмолекулярные. Наличие у атомов углерода широкого диапазона степеней окисления от -4 до +4 свидетельствует об его двойственности. Поэтому в органической химии распространены реакции окислительно-восстановительной дисмутации за счет атомов углерода, которые протекают внутри- и межмолекулярно.
8.8. МЕМБРАННЫЙ ПОТЕНЦИАЛ
Со времен Р. Вирхова известно, что живая клетка - это элементарная ячейка биологической организации, обеспечивающая все функции организма. Протекание многих физиологических процессов в организме связано с переносом ионов в клетках и тканях и сопровождается возникновением разности потенциалов. Большая роль в мембранном транспорте принадлежит пассивному транспорту веществ: осмосу,
фильтрации и биоэлектрогенезу. Эти явления определяются барьерными свойствами клеточных мембран. Разность потенциала между растворами разной концентрации, разделенными мембраной с избирательной проницаемостью, называют мембранным потенциалом. Мембранный потенциал имеет ионную, а не электронную природу. Он обусловлен возникновением ионной асимметрии, т.е. неодинаковым распределением ионов по обе стороны мембраны.
Катионный состав межклеточной среды близок к ионному составу морской воды: натрий, калий, кальций, магний. В процессе эволюции природа создала особый способ переноса ионов, получивший название пассивного транспорта, сопровождающегося возникновением разности потенциалов. Во многих случаях основой переноса веществ является диффузия, поэтому потенциал, который образуется на клеточной мембране, называют иногда диффузионным потенциалом. Он существует, пока концентрация ионов не выравнивается. Величина потенциала невелика (0,1 В). Облегченная диффузия осуществляется через ионные каналы. Ионная асимметрия используется для генерации возбуждения в нервных и мышечных клетках. Однако наличие ионной асимметрии по обе стороны мембраны важно и для тех клеток, которые не способны генерировать возбуждающий потенциал.
8.9. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ
И ЭКЗАМЕНАМ
1. Дайте понятие об электродном и окислительно-восстановительном потенциалах.
2. Отметить основные закономерности, наблюдаемые в ряду редокс-потенциалов.
3. Что является мерой восстановительной способности веществ? Приведите примеры наиболее часто встречающихся восстановителей.
4. Что является мерой окислительной способности вещества? Приведите примеры наиболее часто встречающихся окислителей.
5. Как можно экспериментально определить величину редокс-потенциала?
6. Как изменится потенциал системы Со3+/Со2+ при введении в нее цианид-ионов? Ответ поясните.
7. Приведите пример реакций, в которых пероксид водорода играет роль окислителя (восстановителя) в кислой и щелочной средах.
8. Какое значение имеет феномен выявления лигандного окружения центрального атома на редокс-потенциал для функционирования живых систем?
9. Циклу Кребса при биологическом окислении глюкозы непосредственно предшествует реакция:
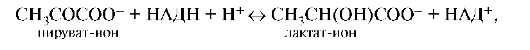
где НАДН и НАД+ - восстановленная и окисленная форма нико-тинамиддинуклеотида. В каком направлении идет эта окислительно-восстановительная реакция при стандартных условиях?
10. Как называются вещества, обратимо реагирующие с окислителями и предохраняющие субстраты?
11. Приведите примеры действия бактерицидных веществ, основанного на окислительных свойствах.
12. Реакции, лежащие в основе методов перманганатометрии и иодо-метрии. Рабочие растворы и методы их приготовления.
13. В чем заключается биологическая роль реакций, в которых изменяется степень окисления марганца и молибдена?
14. В чем заключается механизм токсического действия соединений азота (III), азота (IV), азота (V)?
15. Как происходит обезвреживание супероксид иона в организме? Приведите уравнение реакций. Какова роль ионов металлов в этом процессе?
16. В чем заключается биологическая роль полуреакций: Fe3+ + ē ↔ Fe2+; Cu2+ + ē ↔ Cu+; Co3+ + ē ↔ Co2+? Приведите примеры.
17. Как стандартная ЭДС связана с изменением энергии Гиббса редокс-процесса?
18. Сравните окислительную способность озона, кислорода и перок-сида водорода по отношению к водному раствору иодида калия. Ответ подтвердите табличными данными.
19. Какие химические процессы лежат в основе обезвреживания супероксид-анионрадикала и пероксида водорода в организме? Приведите уравнения полуреакций.
20. Приведите примеры редокс-процессов в живых системах, сопровождающиеся изменением степеней окисления d-элементов.
21. Приведите примеры использования окислительно-восстановительных реакций для детоксикации.
22. Приведите примеры токсического действия окислителей.
23. В растворе имеются частицы Cr3+, Cr2O72-, I2, I-. Определите, между какими из них самопроизвольно осуществляется взаимодействие в стандартных условиях?
24. Какая из указанных частиц является более сильным окислителем в кислой среде КMnO4 или K2Cr2O7?
25. Как определить константу диссоциации слабого электролита с помощью потенциометрического метода? Составьте схему химической цепи гальванического элемента.
26. Допустимо ли единовременное введение в организм растворов RMnO4 и NaNO2?
8.10. ТЕСТОВЫЕ ЗАДАНИЯ
1. Какие молекулы галогенов (простые вещества) проявляют окислительно-восстановительную двойственность?
а) ни один, все они только окислители;
б) все, кроме фтора;
в) все, кроме йода;
г) все галогены.
2. Какой галогенид-ион обладает наибольшей восстановительной активностью?
а) F-;
б) C1-;
в) I-;
г) Br-.
3. Какие галогены вступают в реакции диспропорционирования?
а) все, кроме фтора;
б) все, кроме фтора, хлора, брома;
в) все, кроме хлора;
г) ни один из галогенов не участвует.
4. В двух пробирках находятся растворы КВr и KI. В обе пробирки прибавлен раствор FeCl3. В каком случае галогенид-ион окисляется до свободного галогена, если Eo(Fe3+/Fe2+) = 0,77 В; E°(Br2/2Br-) = 1,06 В; Еo(I2/2I-) = 0,54 В?
а) KBr и KI;
б) KI;
в) КВr;
г) ни в одном случае.
5. Наиболее сильный восстановитель:
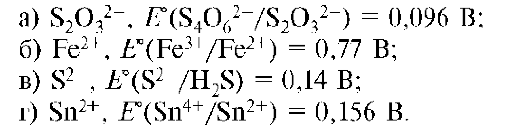
6. В какой из реакций с участием перекиси водорода одним из продуктов реакции будет газообразный кислород?
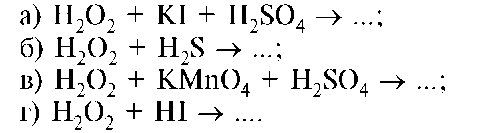
7. Какой из предложенных элементов имеет наибольшее значение относительной электроотрицательности?
а) O;
б) C1;
в) N;
г) S.
8. Углерод в органических соединениях проявляет свойства:
а) окислителя;
б) восстановителя;
в) и окислителя, и восстановителя;
г) не проявляет окислительных свойств.
9. Основу водородного электрода составляет пластинка:
а) из Fe;
б) Ni;
в) Pt;
г) С.
10. Способность участвовать в реакциях диспропорционирования проявляют элементы, находящиеся:
а) в низшей степени окисления;
б) высшей степени окисления;
в) промежуточной степени окисления;
г) только нулевой степени окисления.