Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 14. СВОЙСТВА РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Растворы составляют еще нерешенную задачу естествознания, потому что, будучи химическими соединениями, они не подчиняются законам атомизма или кратных отношений...
Д. И. Менделеев
14.1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ ПОЛИМЕРОВ. СТРОЕНИЕ ВЫСОКОМОЛЕКУЛЯРНЫХ
СОЕДИНЕНИЙ
Многие высокомолекулярные соединения (ВМС) являются полимерами с молекулярной массой >104. Молекулы биополимеров состоят из большого числа мономерных звеньев - повторяющихся одинаковых групп атомов. Структурные единицы ВМС - макромолекулы (104-106 г/моль). Размер макромолекул весьма велик по сравнению с размерами обычных молекул. Например, если длина молекулы этана составляет несколько ангстрем, то длина некоторых линейных макромолекул составляет 4000- 8000 Ǻ (при поперечном размере 3-7,5 А). Моделью подобных молекул могут служить нити длиной от 800 до 1600 мм и диаметром 1 мм.
Структурной химической основой организмов являются природные высокомолекулярные биополимеры: белки, нуклеиновые кислоты, полисахариды, пектины, натуральный каучук, а также биополимеры смешанного типа: липопротеиды, гликопротеиды и липополисахариды. Природные ВМС характеризуются постоянным значением молекулярной массы.
Синтетические полимеры получаются в результате реакции полимеризации или поликонденсации. К ним относятся: полиэтилен, синтетический каучук, фенолформальдегидные пластмассы. Синтетические полимеры состоят из смеси макромолекул, различных по длине и массе. Таким образом, ВМС - это обычные органические вещества, молекулы которых имеют очень большой размер.
Практически все важные свойства ВМС тесно связаны с их строением. Различают три типа структуры цепей: линейную, разветвленную и пространственную (сетчатую) (рис. 14.1).
Линейные ВМС представляют собой открытую линейную цепь (натуральный каучук, целлюлоза).
Макромолекулы разветвленных ВМС имеют форму линейной цепи с ответвлениями (амилопектин, гликоген).
Пространственные (сетчатые) ВМС, макромолекулы которых представляют собой трехмерные сетки, образованы отрезками цепного строения (например, фенолформальдегидные смолы). Из пространственных полимеров в особую группу выделяют полимеры со сшитой структурой, цепи которых сшиты короткими мостиками.
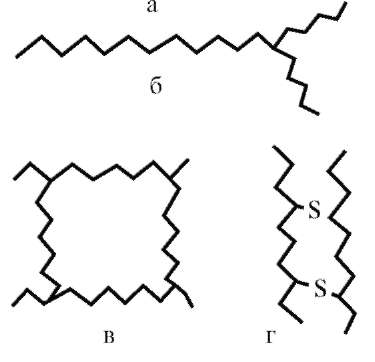
Рис. 14.1. Схемы строения макромолекул полимеров: а - линейного; б - разветвленного; в - пространственного; г - сшитого
Однако из всех структур именно линейной формой макромолекул определяются типичные свойства полимеров: каучукоподобная эластичность, способность образовывать прочные пленки и нити, набухать, давать при растворении вязкие растворы. Эти свойства цепных макромолекул и их растворов представляют наибольший интерес. Полимеры с пространственной структурой не способны растворяться, поэтому свойства сетчатых полимеров мы не рассматриваем.
Специфические свойства полимеров обусловлены гибкостью линейных макромолекул. Чтобы понять причину гибкости линейных макромолекул, рассмотрим строение молекулы этана, представляющую из себя две группы Н3С-, соединенные одинарной связью. Известно, что группы Н3С- способны вращаться вокруг одинарной связи С-С. Это хорошо согласуется с тем, что, например, ни сам этан,
ни бутан, ни симметричный дихлорэтан при комнатной температуре не имеют изомеров. Однако при низких температурах свободное вращение вокруг связи С-С затруднено, так как не все возможные положения группы -СН3 относительно друг друга равноценны в энергетическом отношении. Такая неравноценность обусловлена тем, что при повороте одной группы -СН3 по отношению к другой изменяется расстояние между С-Н-связями обеих групп. Это ведет к изменению энергии взаимодействия между группами -СН3. Поэтому при низких температурах -СН3 группы не вращаются вокруг оси С-С, а лишь вращательно колеблются на сравнительно небольшой угол. Только при достаточно высокой температуре благодаря увеличению кинетической энергии может быть преодолен энергетический барьер, и группы -СН3 будут свободно вращаться вокруг соединяющей их связи.
Высота потенциального барьера тем больше, чем больше разность максимального и минимального значения энергии взаимодействия атомов или групп атомов при их вращении относительно друг друга. В положении, когда связи находятся одна за другой, расстояние между ними минимально и взаимодействие друг с другом будет максимальным - энергия U1.
Когда связи или атомные группы находятся на максимальном расстоянии друг от друга, то энергия взаимодействия между ними будет минимальной (U2).
Очевидно, что поворот звеньев и переход молекул из одной конфор-мации в другую отвечает изменению потенциальной энергии:
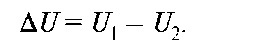
Эта величина носит название потенциального (энергетического) барьера вращения и служит мерой термодинамической гибкости полимерных цепей. Чем меньше величина ΔU, тем легче происходит вращение, и цепь является более гибкой. Полимеры с гибкими макромолекулами легко деформируются и вновь возвращаются в исходное состояние после снятия нагрузки, т.е. обладают свойством эластичности. Подобные тела проявляют одновременно свойства жидкостей и твердых тел. К таким системам относятся и гели.
Межклеточное вещество состоит из протеогликанов, находящихся в гелеобразном состоянии, белков коллагена, эластина и фибронек-тина. Эластин по сравнению с коллагеном содержит больше остатков гидрофобных аминокислот; резиноподобный характер этого полимера обусловливает достаточно большую его способность к упругому растяжению. В меньшей степени это характерно для коллагена.
Повышение энергетического барьера приводит к увеличению жесткости макромолекул. Наименьшим барьером вращения и наибольшей гибкостью характеризуются цепи неполярных незамещенных углеводородов (ΔU = 1-3 кДж/моль). Введение полярных заместителей (-CONH-, -СООН, -ОН, -С1) увеличивает высоту энергетического барьера и повышает жесткость цепей. Это объясняется тем, что введение полярных групп усиливает взаимодействие звеньев как внутри макромолекул (внутримолекулярное взаимодействие), так и между соседними молекулами (межмолекулярное взаимодействие).
Таким образом, гибкость цепей полимеров зависит от химического строения цепи, природы заместителей, их числа и распределения по длине цепи, от числа звеньев цепи.
14.2. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА ПОЛИАМФОЛИТОВ
Белки относятся к полиамфолитам, т.е. к веществам, способным в зависимости от условий проявлять свойства как оснований, так и кислот. Остатки ионогенных аминокислот (аспарагиновой и глутаминовой кислот, аргинина, лизина и гистидина) могут находиться как в прото-нированной, так и в депротонированной формах. Состояние, при котором суммарный заряд полиамфолита равен нулю, называется изоэлек-трическим. Значение pH раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pi). В среде с большей кислотностью, чем в изоэлектрической точке (pH < pi), ионизация карбоксильных групп подавлена, вследствие чего белок находится в форме макрокатионов, положительный заряд которых обусловлен наличием -R-NH3+-групп. В среде с меньшей кислотностью, чем в изоэлек-трической точке (pH > pi), карбоксильные группы депротонированы, вследствие чего белок находится в форме макроанионов, отрицательный заряд которых обусловлен наличием -R-СОО--групп.
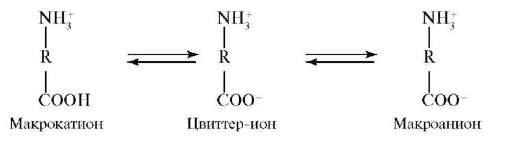
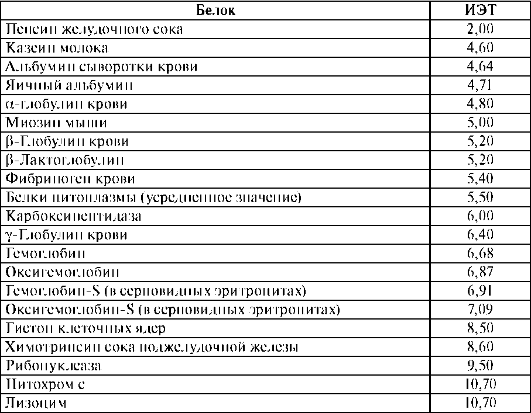
Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков. Направление движения макромолекул белков в электрическом поле (к катоду или аноду) зависит от значения pH. Белки, как и все амфолиты, имеют определенную величину изоэлектрической точки. В таблице 14.1 приведены значения изоэлектрических точек некоторых наиболее распространенных белков.
Таблица 14.1. Изоэлектрические точки некоторых белков
При pH <pi протонируются основные группы в боковых цепях; белок находится в форме макрокатиона и перемещается к катоду. При pH = pi белок находится в электронейтральной форме (макромолекула) и в электрическом поле не перемещается. При pH >pi белок перемещается к аноду, так как находится в форме макроаниона вследствие депротонирования кислотных групп в боковых цепях. Макроанионы различаются электрофоретической подвижностью, которая зависит от размера иона и его заряда. Изменяя pH поддерживающей среды, можно добиться значительного изменения подвижности макроаниона:
она будет тем больше, чем больше разница между pH и pi. Например, для белка с pi = 5 при pH 9 степень депротонированности боковых ионогенных групп больше, чем при pH 7. Больший заряд макроаниона при pH 9 обусловливает его большую подвижность (рис. 14.2).
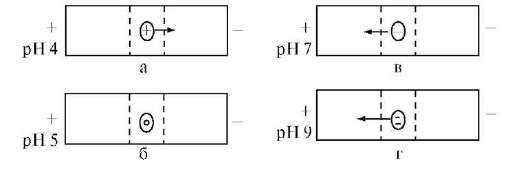
Рис. 14.2. Зависимость подвижности частиц белка (pi = 5) в электрическом
поле от pH среды
Описанные закономерности используются в электрофоретическом методе анализа белков. С помощью электрофореза можно разделить на отдельные фракции сложные смеси белков. Некоторые заболевания сопровождаются изменением состава и соотношения белков, что отражается на электрофореграммах.
14.3. ТЕРМОДИНАМИКА ОБРАЗОВАНИЯ РАСТВОРОВ БИОПОЛИМЕРОВ
Растворение высокомолекулярных веществ принято рассматривать как процесс смешения двух жидкостей. Аналогия между растворением высокомолекулярного вещества и смешением двух жидкостей не является формальной, а отвечает самому существу явления. Так, ограниченное набухание высокомолекулярного вещества соответствует процессу ограниченного смешения, а неограниченное набухание, переходящее в растворение, - процессу неограниченного смешения.
Самопроизвольное растворение ВМС при постоянном давлении должно сопровождаться уменьшением изобарно-изотермического потенциала (свободной энергии при постоянном давлении). Согласно второму закону термодинамики изменение изобарно-изотермического потенциала системы составляет: ΔG = ΔН - TΔS.
Очевидно, для того чтобы произошло самопроизвольное растворение полимера, ΔG должно иметь отрицательное значение. Это может быть в двух случаях:
1) при условии ΔН < 0, которое соблюдается, если при растворении выделяется теплота, так как изменение энтальпии (или внутренней энергии) равно интегральной теплоте растворения с обратным знаком. Такое условие часто соблюдается на практике, например, при растворении полярных полимеров в полярных растворителях. Положительный тепловой эффект при растворении объясняется тем, что теплота сольватации макромолекул больше теплоты собственно растворения, а как известно, общий тепловой эффект растворения равен алгебраической сумме теплот сольватации и собственно растворения;
2) при условии ΔS > 0, которое всегда осуществляется на практике при растворении, так как энтропия смешения всегда положительна. Энтропия смешения ВМС с растворителем, рассчитанная на весовую долю вещества, лежит между значениями энтропии растворения низкомолекулярных веществ и типичных коллоидных систем.
Поэтому относительная роль энтропийного фактора при растворении ВМС меньше, чем при растворении низкомолекулярных веществ, а энтальпийный фактор (сольватация) имеет относительно большое значение. Вместе с тем, поскольку в рассматриваемом случае энтропийный член не равен нулю, а может иметь сравнительно большие значения, некоторые полимеры способны растворяться с поглощением, а не с выделением тепла, т.е. при ΔН > 0. Это обусловлено тем, что в таких случаях TΔS > ΔН и, следовательно, ΔG < 0.
При повышении температуры значение энтропийного фактора возрастает. Таким образом, для всякого ВМС и растворителя должна существовать критическая температура растворения Tкрит, выше которой наблюдается их смешение во всех отношениях. Теоретически такая критическая температура должна существовать для любой комбинации
Еще 70 лет тому назад существовали две теории растворов полимеров. Согласно одной из них (мицеллярная теория, развитая Майером и Марком), макромолекулы находятся в растворе в виде мицелл, согласно второй - достаточно разбавленные растворы ВМС содержат отдельные, не связанные друг с другом молекулы (молекулярная теория).
В настоящее время мицеллярная теория потеряла свое значение. Как показали исследования, ВМС в подходящих растворителях само-
произвольно диспергируются до отдельных молекул. Молекулярная теория находит подтверждение в ряде фактов.
1. Определение молекулярных масс в разбавленных растворах полимеров однозначно показало отсутствие в таких растворах мицелл.
2. Растворение высокомолекулярного вещества, как и растворение низкомолекулярного, идет самопроизвольно, часто с выделением тепла. При диспергировании же вещества до коллоидного состояния требуется затрата энергии на преодолении межмолекулярных сил.
Растворы полимеров термодинамически устойчивы и при соответствующих предосторожностях могут храниться достаточно долго. Коллоидные растворы, наоборот, термодинамически неустойчивы, и в них происходит коагуляция.
Растворение полимеров не требует присутствия в системе стабилизатора. Лиофобные же золи не могут быть получены без специального стабилизатора, придающего системе агрегативную устойчивость.
Это все относится к разбавленным растворам ВМС. В концентрированных растворах макромолекулы могут взаимодействовать и образовывать так называемые ассоциаты. С увеличением концентрации растворов ВМС или с понижением их температуры размер и длительность существования ассоциатов увеличиваются. Это может привести к тому, что ассоциаты можно будет рассматривать как новую фазу.
На образование дисперсий оказывает влияние и растворитель. В растворителях, полярность которых соответствует полярности ВМС, происходит истинное растворение с образованием молекулярных растворов (агар-агар и желатин в воде или каучук в неполярном растворителе). При несоответствии полярности растворителя и ВМС образуются золи или дисперсии.
Истинному растворению полимеров часто предшествует процесс набухания. Он заключается в увеличении объема и массы полимера за счет поглощения им какого-то количества растворителя. При контакте полимера с растворителем начинается взаимная диффузия молекул растворителя в полимер, а макромолекул полимера - в растворитель. Однако скорость диффузии будет различаться в той же пропорции, что и размеры, а также подвижности диффундирующих частиц. Резкое различие в подвижностях молекул растворителя и макромолекул ВМС является причиной набухания.
Количественной мерой набухания является степень набухания а, которая может иметь объемное или массовое выражение:

где V0, V, m0, m - соответственно объемы и массы исходного и набухшего полимера.
Более точным является определение а по ее массовому выражению, так как в этом случае результаты измерений не зависят от явления контракции. Контракция заключается в том, что объем раствора (смеси) двух жидкостей оказывается меньше, чем сумма объемов взятых жидкостей.
В зависимости от структуры полимера и температуры набухание может быть ограниченным или неограниченным (рис. 14.3). При ограниченном набухании (1) а достигает предельного значения, после чего набухание не зависит от времени (желатин в холодной воде). Для неограниченного набухания характерна зависимость (2), проходящая через максимум, после чего а падает до нуля в результате постепенного растворения полимера.
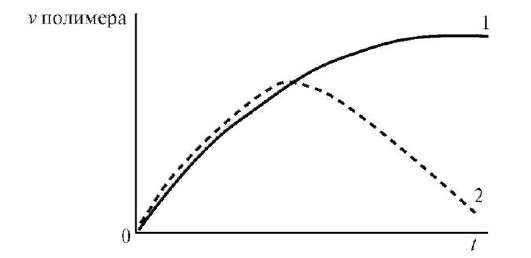
Рис. 14.3. Кривые ограниченного (1) и неограниченного (2) набухания
Ограниченность или неограниченность набухания определяются соотношением энергий связей в полимере с энергией сольватации и энтропийным фактором. В линейных и разветвленных полимерах молекулы связаны ван-дер-ваальсовыми силами, энергия этих связей невелика, поэтому энергия сольватации и энтропийный фактор уже при комнатной температуре превышают их. При таких условиях набухание идет неограниченно. Если между цепями полимера имеются химические связи, то для их разрыва недостаточно бывает энергии соль-
ватации и энтропийного фактора. Набухание протекает ограниченно, и полимер превращается в студень.
В основе процесса набухания лежит сольватация макромолекуляр-ных цепей. О сольватационном механизме набухания свидетельствуют выделение теплоты набухания и контракция (уменьшение общего объема системы). В то время как при набухании объем полимера всегда увеличивается, объем всей системы (полимер + растворитель) обычно уменьшается. Это особенно заметно при набухании полярных полимеров в полярных растворителях. Причиной контракции является упорядоченная ориентация молекул растворителя в сольватных слоях. Набухание, как и сольватация, специфично, так как полимер набухает в растворителе, соответствующем его природе. В процессе набухания происходит односторонняя диффузия молекул воды в полимер. Это объясняется тем, что крупные макромолекулы, связанные в надмолекулярные структуры, практически не могут переходить в растворитель, а мелкие и хорошо диффундирующие молекулы воды легко проникают в полимер, увеличивая его объем. При набухании отдельные молекулы надмолекулярных структур гидратируются, межмолекулярное взаимодействие значительно ослабевает, в результате чего становится возможной диффузия макромолекул в растворитель (рис. 14.4).

Рис. 14.4. Взаимодействие растворителя с полимером: 1 - межструктурное набухание; 2 - внутриструктурное набухание; 3 - растворение
Набухание является экзотермическим процессом, поэтому в соответствии с принципом Ле Шателье степень набухания увеличивается при увеличении давления и уменьшении температуры, однако скорость набухания при уменьшении температуры уменьшается, так как при более низких температурах диффузия протекает менее интенсивно.
Процесс набухания включает две стадии. На первой происходит выделение теплоты набухания наблюдается контракция системы, однако а не достигает высоких значений. Вторая стадия почти не сопровождается контракцией и выделением теплоты, но характеризуется увеличением а и объема набухающего полимера.
При набухании полимеров их объем увеличивается в 10-15 раз, и возникает давление набухания, достигающее иногда сотен мегапаска-лей. Силу давления при набухании крахмала и белков гороха раньше использовали для разъединения костей черепа при приготовлении анатомических препаратов. Давление набухания эквивалентно внешнему давлению, приложение которого могло бы остановить увеличение объема набухающего полимера.
Степень набухания полимера и его способность к растворению зависят от гибкости полимерных цепей. Так, волокна незрелого коллагена (в котором еще не установились поперечные ковалентные «сшивки») достаточно хорошо набухают и могут переходить в раствор, тогда как волокна зрелого коллагена нерастворимы. На интенсивность процесса набухания влияют также температура, давление, присутствие электролитов и величина pH.
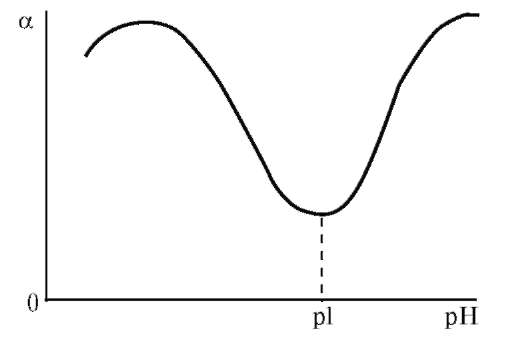
Рис. 14.5. График зависимости степени набухания белка от pH среды
Влияние pH среды на набухание особенно выражено для полиамфо-литов. Зависимость степени набухания белка от pH среды выражается кривой с двумя максимумами и одним минимумом, положение которого соответствует изоэлектрической точке (рис. 14.5). Примером влияния pH на набухание является отек кожи, вызываемый действием муравьиной кислоты, содержащейся в крапиве и выделениях муравьев.
Экспериментально установлено, что на набухание биополимеров анионы оказывают большее влияние, чем катионы. Анионы по степени влияния на набухание белков располагаются в лиотропный ряд (ряд Гоффмейстера):
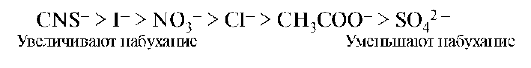
14.4. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРОВ БИОПОЛИМЕРОВ
Растворы ВМС представляют собой истинные растворы, т.е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. В концентрированных растворах ВМС обычно возникают достаточно большие ассоциаты молекул, которые можно рассматривать как вторую фазу. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС.
В противоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью, что используется для определения их молекулярной массы.
С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант-Гоффа (π = cRT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой.
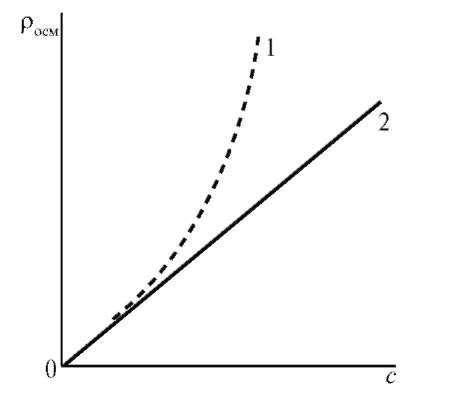
Рис. 14.6. Зависимость осмотического давления от концентрации раствора: 1 - раствор ВМС; 2 - раствор низкомолекулярного неэлектролита
Причиной отклонения от законов Вант-Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера:

где c - концентрация раствора ВМС, г/л; М - молярная масса, г/моль; b - коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе.
В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотиче-ского давления относительно невелика: она составляет примерно 0,5% от суммарного осмотического давления (≈3,1кПа), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма.
14.5. МЕМБРАННОЕ РАВНОВЕСИЕ
Измерения осмотического давления растворов ВМС полиэлектролитов могут быть связаны с ошибками, вызванными присутствием электролитов. Во избежание ошибок необходимо вводить поправки на мембранное равновесие. Теория мембранного равновесия была создана в 1911 г. английским физикохимиком Ф. Доннаном.
Мембранным равновесием Доннана (эффект Доннана) называют равновесие, устанавливающееся в системе растворов, разделенных мембраной, непроницаемой хотя бы для одного вида присутствующих в системе ионов.
Задерживаемый мембраной ион называется недиализируемым. Присутствие такого иона приводит к неравномерному распределению ионов по обе стороны мембраны при равновесном состоянии системы.
Пусть слева от мембраны находится белок в виде соли RNa, где R- - анион, имеющий коллоидные размеры и не проходящий через мембрану. Справа находится раствор NaCl, для ионов которого мембрана проницаема:
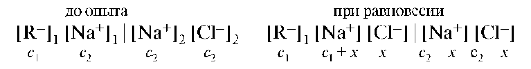
При равновесии произведение концентраций диффундирующих ионов по обе стороны мембраны должно быть одинаковым (недиали-зуемые ионы в расчет не принимаются). Тогда: (c1 + x)x = (c2 - x)2.
При c1 = 0х = ½с2 концентрация NaCl в равновесных растворах одинакова. При c1 >> c2 значение х очень мало, т.е. NaCl практически не переходит через мембрану, и осмотическое давление определяется только полиэлектролитом. При c1 << c2 электролит NaCl равномерно распределяется по обе стороны мембраны. Осмотическое давление определяется в этом случае только ионами низкомолекулярного электролита NaCl и составляет половину от осмотического давления полиэлектролита.
При промежуточных соотношениях концентраций в измеряемые значения осмотического давления необходимо вводить поправку, учитывающую мембранное равновесие.
Эффект Доннана обусловливает распределение электролитов в тканях организма и является причиной возникновения биопотенциалов.
14.6. АНОМАЛЬНАЯ ВЯЗКОСТЬ РАСТВОРОВ ВМС
Растворы ВМС только при очень больших разбавлениях (~0,01%) подчиняются законам Ньютона и Пуазейля. Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях.
Вязкостью (внутренним трением) называют свойство жидкостей оказывать сопротивление действию внешних сил, вызывающих их течение. Помимо этого растворы ВМС не являются ньютоновскими жидкостями, так как величина их вязкости (η) зависит от напряжения сдвига (р) - отношения тангенциально приложенной к образцу силы к единице поверхности (рис. 14.7).
Причины аномалии вязкости заключаются в наличии структурной вязкости у подобных систем. Структурная вязкость - это дополнительная вязкость, обусловленная добавочным сопротивлением течению со стороны внутренних надмолекулярных пространственных структур - сеток, нитей, крупных капель эмульсий. Вязкость таких систем не остается постоянной при увеличении напряжения сдвига, а резко падает, пока не достигает постоянной величины, но на более низком уровне вследствие разрушения структуры (рис. 14.8).
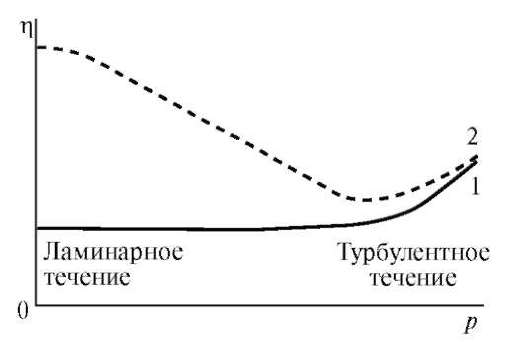
Рис. 14.7. Зависимость вязкости растворов низкомолекулярных веществ ньютоновских жидкостей (1) и растворов ВМС (2) от напряжения сдвига
Особенно сильно это свойство проявляется у полимеров с длинными линейными молекулами, например у каучука. Растворы полимеров с той же молекулярной массой, но со сферической формой молекул имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре вязкость возрастает с увеличением молекулярной массы. Она зависит также от концентрации полимера и межмолекулярных сил взаимодействия.
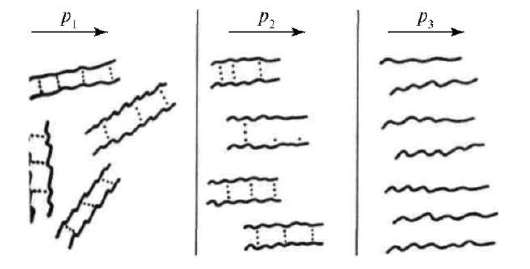
Рис. 14.8. Изменение структуры растворов ВМС при увеличении напряжения сдвига
Область постоянства вязкости аномально вязких жидкостей называют псевдопластической областью. Дальнейшее повышение напряжения сдвига вызывает увеличение коэффициента вязкости, что связано с турбулентностью.
Экспериментальные данные показывают, что коллоидные аномально вязкие системы могут течь и при очень малых давлениях и при этом
вязкость остается постоянной, но очень высокой. Такое течение называют ползучестью.
Увеличение давления резко снижает вязкость ползучих систем, пока не наступает вторая область постоянства вязкости - псевдопластическая.
Аномалии вязкости вызываются рядом причин.
1. Структурообразование - процесс агрегации частиц коллоидных растворов, суспензий, растворов ВМС и образования пространственных легкоразрушимых структур.
2. Изменение ориентации в потоке частиц удлиненной формы и макромолекул при увеличении градиента скорости.
3. Деформация клубков макромолекул полимера или капель эмульсий в потоке.
С повышением температуры вязкость структурированных систем резко уменьшается за счет разрушения структуры. При понижении температуры доля структурной вязкости значительно увеличивается.
Для характеристики вязкости растворов пользуются величинами относительной и удельной вязкости. Относительную вязкость ηотн рассчитывают по уравнению:

где η - вязкость раствора; ηо - вязкость растворителя. Для расчета удельной вязкости используют соотношение:

Вязкость растворов ВМС увеличивается с возрастанием их средней молярной массы, поэтому вязкость растворов полимеров часто характеризуют приведенной вязкостью ηпр:
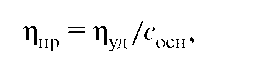
где сосн - концентрация в основных молях:
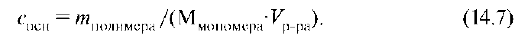
Приведенная вязкость увеличивается при увеличении концентрации
(рис. 14.9).
Приведенную вязкость бесконечно разбавленного раствора называют характеристической вязкостью [η].
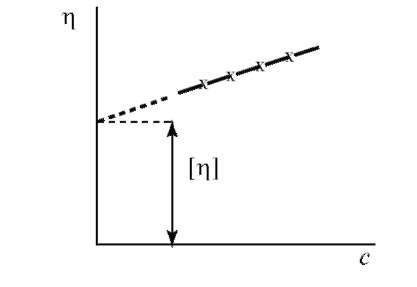
Рис. 14.9. График зависимости приведенной вязкости от концентрации
14.7. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ РАСТВОРОВ ВМС И ЕЕ НАРУШЕНИЕ
Растворы ВМС агрегативно устойчивы, как и истинные растворы. Однако при введении больших количеств электролитов наблюдается выделение ВМС из раствора. Но это не следует отождествлять с коагуляцией типичных коллоидных систем. Коагуляция золей происходит при введении сравнительно небольших количеств электролита и представляет собой обычно необратимое явление. Выделение же из раствора ВМС происходит при добавлении относительно больших количеств электролита, не подчиняется правилу Шульце-Гарди и является обычно обратимым процессом. После удаления из осадка электролита промыванием или диализом ВМС снова способно к растворению.
Коагуляция золей происходит за счет сжатия двойного электрического слоя и исчезновения заряда на поверхности частицы. Выделение из раствора полимера при добавлении электролита объясняется уменьшением растворимости ВМС в концентрированном растворе электролита. Такое явление называется высаливанием.
Считается, что при высаливании молекулы растворенного вещества вытесняются из электрического поля введенных ионов, которые связываются с полярными молекулами растворителя. Таким образом, высаливание принципиально не отличается от выделения ВМС из раствора при добавлении нерастворителя. Как правило, высаливающее действие ионов изменяется соответственно тому порядку, в каком они стоят в лиотропном ряду. Так, катионы по мере уменьшения их высаливающей способности могут быть расположены в ряд:
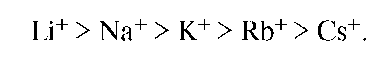
Подобный же ряд анионов имеет вид:
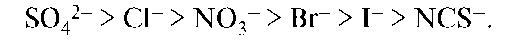
Взаимосвязь между высаливающим действием и местом иона в лио-тропном ряду вполне понятна: чем больше ион способен связывать растворитель, тем больше он будет уменьшать способность среды растворять ВМС.
Высаливание лежит в основе одного из методов фракционирования ВМС, поскольку способность этих соединений выделяться из раствора весьма сильно зависит от их химической природы и резко возрастает с увеличением молекулярной массы. Особенно широко применяется фракционирование с помощью высаливания при разделении белков. При этом высаливание часто сочетают с введением в систему нерастворителя (спирт) и охлаждением раствора. Высаливание белков целесообразно проводить при значении pH, близком к изоэлектрической точке, так как при значении pH, большем или меньшем изоэлектри-ческой точки, возрастают заряд и гидратация белковых молекул и увеличивается их растворимость.
В растворах ВМС при изменении температуры, pH или при введении низкомолекулярных веществ иногда наблюдается явление коацер-вации. Это явление заключается в разделении системы на две фазы, из которых одна представляет собой раствор ВМС в растворителе, а другая - раствор растворителя в ВМС. Раствор, более богатый ВМС, обычно выделяется в виде мельчайших капелек.
Практическая важность коацервации возросла в связи с развитием технологии микрокапсулирования. Микрокапсулирование в фармации используют с целью защиты лекарственного вещества от соприкосновения с окружающей средой. Микрокапсулы представляют заключенные в оболочку из полимера твердые, жидкие или газообразные лекарственные вещества. Оболочка их образуется из адсорбированных капель коацервата полимера, которые слипаются в сплошную пленку и специальной обработкой переводятся в твердое состояние.
Коацервация, используемая при микрокапсулировании, подразделяется на простую и сложную.
Простая коацервация наблюдается при обезвоживании гидрофильных коллоидных растворов, что приводит к снижению их растворимости. В простых коацерватах объединяются молекулы одного и того же химического соединения. В качестве материала для пленкообразования используют желатин и фибриноген.
Сложная коацервация обусловлена взаимодействием между положительными и отрицательными ионами различных молекул полиэлектролитов. Она происходит при изменении концентрации раствора полимера или изменении pH. Сложные коацерваты делят на три типа: однокомплексные, двухкомплексные и трехкомплексные.
В однокомплексных - молекулы одного и того же соединения притягиваются положительными и отрицательными зарядами друг к другу, что вызывает микроскопические изменения в системе. Пример - образование коацерватов из молекул белка в изоэлектри-ческой точке.
В основе двухкомплексной коацервации лежит взаимодействие двух соединений с противоположно заряженными ионами. Например, желатин и гуммиарабик.
Трехкомплексные коацерваты являются сложными системами, образованными из полиамфолита, поликислоты или полиоснования и низкомолекулярного иона.
14.8. КОЛЛОИДНАЯ ЗАЩИТА
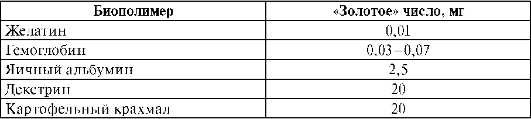
Белки плазмы оказывают защитное действие по отношению к коллоидно-дисперсным частицам крови, повышая агрегативную устойчивость системы в целом. Этот феномен известен под названием коллоидная защита. Количественно защитное действие ВМС оценивают в «золотых» числах. «Золотым» числом называют минимальную массу ВМС в миллиграммах, предотвращающую коагуляцию 10 мл коллоидного раствора золота [w(Au) = 0,0006%] при добавлении к нему 1 мл раствора хлорида натрия [w(NaCl) = 10%]. Чем меньше «золотое» число данного ВМС, тем сильнее выражено его стабилизирующее действие (табл. 14.2).
Таблица 14.2. «Золотые» числа некоторых биополимеров
Белковый состав плазмы оказывает влияние на вязкость крови. При некоторых патологических состояниях изменяются белковый состав плазмы и как следствие вязкость крови. Причиной этих изменений чаще всего является образование крупных агрегатов: слипшихся эритроцитов, тромбоцитов, лейкоцитов. Глобулины, существующие в форме макрокатионов, адсорбируются на поверхности эритроцитов, снижая тем самым величину отрицательного заряда их поверхности. Это, в свою очередь, приводит к нарушению агрегативной устойчивости крови (можно оценить по величине СОЭ), увеличению ее вязкости и нарушению гемодинамики.
В современном фармакотерапевтическом арсенале имеются лекарственные средства, уменьшающие вязкость крови (например, пенто-ксифиллин, ксантинола никотинат, ницерголин).
14.9. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. Объясните причину возникновения в растворах ВМС надмолекулярных структур.
2. Объясните, почему в изоэлектрическом состоянии проявляются экстремальные значения свойств растворов белков.
3. В чем заключается сущность определения ИЭТ белка электро-форетическим методом?
4. Объясните, почему осмотическое давление в растворах полимеров средних концентраций превышает значения, рассчитанные по уравнению Вант-Гоффа?
5. Что называют онкотическим давлением, и какова его биологическая роль?
6. Объясните, почему вязкость растворов ВМС понижается при увеличении приложенного давления?
7. Какие факторы, связанные с природой полимера, влияют на вязкость их растворов?
8. Чем высаливание ВМС из растворов отличается от электролитной коагуляции золей?
9. Действием каких факторов можно нарушить устойчивость растворов ВМС?
10. Какое явление называется коацервацией? Приведите примеры.
11. В чем заключается биологическая роль явления коллоидной защиты?
14.10. ТЕСТОВЫЕ ЗАДАНИЯ
1. Найдите определение, не относящееся к растворам ВМС:
а) гомогенные;
б) гетерогенные;
в) равновесные;
г) образующиеся самопроизвольно.
2. Какой вид устойчивости теряют коллоидные системы при коагуляции?
а) кинетическую;
б) конденсационную;
в) агрегативную;
г) седиментационную.
3. Процессу растворения ВМС предшествует стадия:
а) ограниченное набухание;
б) растворение происходит без набухания;
в) неограниченное набухание;
г) тиксотропное набухание.
4. Набухание - это процесс проникновения:
а) ВМС в полимер;
б) полимера в ВМС;
в) ВМС в НМС;
г) НМС в ВМС.
5. Специфические свойства растворов ВМС:
а) агрегативная устойчивость;
б) аномальная вязкость;
в) большой размер частиц;
г) мембранное равновесие Доннана.
6. Заряд белковой молекулы не зависит:
а) от pH среды;
б) соотношения групп NH2 и СООН;
в) степени диссоциации ионогенных групп;
г) температуры.
7. Слияние водных оболочек нескольких частиц без объединения самих частиц называется:
а) желатинированием;
б) синерезисом;
в) тиксотропией;
г) коацервацией.
8. Онкотическое давление - это часть осмотического давления, обусловленная присутствием:
а) белков;
б) электролитов;
в) неорганических неэлектролитов;
г) низкомолекулярных соединений.
9. К свойствам студней относятся:
а) денатурация;
б) коацервация;
в) синерезис;
г) светорассеяние.
10. Необратимый процесс старения геля, сопровождающийся упорядочением структуры с сохранением первоначальной формы, сжатием сетки и выделением из нее растворителя, называется:
а) синерезисом;
б) коалесценцией;
в) коагуляцией;
г) тиксотропией;
11. Способность геля разжижаться при механическом воздействии и самопроизвольно восстанавливать свои свойства в состоянии покоя, называется:
а) синерезисом;
б) коалесценцией;
в) коагуляцией;
г) тиксотропией.
12. Разрушение лиофильных коллоидных растворов в результате полной десольватации мицелл, сопровождающихся выделением ПАВ и ВМС в виде хлопьев, называется:
а) солюбилизацией;
б) высаливанием;
в) коагуляцией;
г) коацервацией.
13. Проникновение в структуру мицелл молекул различных веществ называется:
а) солюбилизацией;
б) высаливанием;
в) коагуляцией;
г) коацервацией.
14. Явление тиксотропии характерно для:
а) гелей;
б) суспензий;
в) золей;
г) истинных растворов.
15. Повышение порога коагуляции коллоидного раствора при добавлении к нему ВМС называется:
а) денатурацией;
б) коллоидной защитой;
в) синерезисом;
г) коацервацией.