Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Часть IV. ГЕТЕРОГЕННЫЕ СИСТЕМЫ. Глава 12. ФИЗИЧЕСКАЯ ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
Общая площадь, поделенная на количество молекул, равна площади, занимаемой каждой молекулой.
И. Лэнгмюр
12.1. ОБРАЗОВАНИЕ И РАСТВОРЕНИЕ ОСАДКОВ. КОНСТАНТА РАСТВОРИМОСТИ
Основные положения теории гетерогенных равновесий позволяют понять сущность процессов коагуляции крови и семенной жидкости, образования и растворения минеральной основы костной ткани, этиологию подагры, мочекаменной и желчекаменной болезней. Осаждение веществ в результате химической реакции является одной из основных операций в качественном и количественном анализе, когда реакцию необходимо довести до конца и обеспечить полноту осаждения. Разработаны методы весового анализа гравиметрии и осадительного титрования - седиметрии.
Взаимное растворение веществ протекает тем легче, чем ближе их химическое строение и характер межчастичных взаимодействий. Ионные соединения растворяются лучше в полярных растворителях, неэлектролиты - в неполярных. Вещества с различным характером связи и слабым межчастичным взаимодействием взаимно нерастворимы. Твердые вещества характеризуются самой различной растворимостью.
Растворимость (s) вещества рассчитывают в граммах растворенного вещества на 100 г растворителя. Существуют приближенные таблицы, которые делят вещества на 3 условные группы по растворимости.
В группу растворимых веществ (Р) относят соли и гидроксиды, растворимость которых выше 1 г в 100 г H2O.
Растворимость малорастворимых веществ (М) находится в пределах от 1 мг (10-3 г) до 1 г в 100 г H2O.
Абсолютно нерастворимых веществ в природе нет. Выделяют группу условно нерастворимых веществ (Н), растворимость которых ниже 1 мг в 100 г H2O. Насыщенные растворы таких электролитов представляют
собой практически чистый растворитель с очень малым количеством вещества, перешедшего в раствор.
Если пренебречь разницей между массой и плотностью насыщенного раствора труднорастворимого вещества по сравнению с чистой водой, растворимость удобно рассчитывать на 1 л раствора по формуле:

Таким образом, растворимость удобно выразить через концентрацию насыщенного раствора:

Однако обычные способы выражения растворимости труднорастворимых сильных электролитов не отражают истинного состояния такой системы, поскольку вся растворенная часть вещества полностью ионизирована. При этом количество ионов в растворе не отвечает молярной концентрации.
Рассмотрим равновесие между твердым осадком труднорастворимой соли AgCl и ее ионами в водном растворе: AgCl(тв)↔ Ag+ + Cl-.
Константа равновесия имеет вид: K = [Ag+][Cl-]/[AgCl(тв)].
Поскольку растворимость и концентрации ионов этой соли в растворе чрезвычайно малы, их взаимодействие отсутствует. Тогда поведение ионов в растворе можно уподобить идеальному газу. При этом концентрация конденсированной фазы хлорида серебра как величина постоянная из выражения для константы равновесия исключается: K = [Ag+][Cl-].
В общем случае для электролита вида KtnAnm константа равновесия, названная константой растворимости (Ks) находится по уравнению:
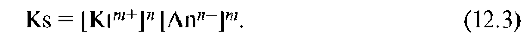
Эта величина характеризует растворимость труднорастворимого сильного электролита при постоянной температуре при отсутствии в растворе посторонних веществ.
Константа растворимости - справочная величина. Значения Ks изменяются в широких пределах от 10-2 для KClO4 до 10-96 для Bi2S3.
Концентрацию насыщенного раствора малорастворимого электролита (с) можно рассчитать, зная Ks для этого вещества по формуле:

где x и y - стехиометрические коэффициенты.
В насыщенном растворе труднорастворимого электролита произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, есть величина постоянная при данной температуре.
Зависимость константы растворимости от температуры очевидна, так как для подавляющего большинства электролитов растворимость возрастает при нагревании.
На основе Ks можно прогнозировать образование и растворение осадков электролитов.
Электролит выпадает в осадок, если стехиометрическое произведение концентраций его ионов в растворе больше константы растворимости:
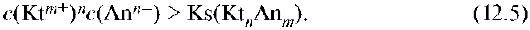
Осадок электролита растворяется, если стехиометрическое произведение концентраций его ионов в растворе меньше константы растворимости:
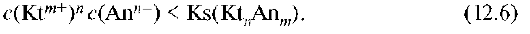
Постоянство Ks не означает постоянства концентраций отдельных ионов в растворе. Однако при уменьшении концентрации одного иона, концентрация другого будет увеличиваться по принципу Ле Шателье. Для электролитов, ионы которых имеют различный по величине заряд, зависимость несколько усложняется. Так, для Cu(OH)2 справедливо выражение: Ks(Cu(OH)2) = [Cu2+][OH-]2 = 2,2•10-20. При увеличении концентрации [Cu2+] в 10 раз, концентрация [OH-] возрастет всего в √10 ≈ 3,1 раза. В то время как 10-кратное увеличение концентрации гидроксильных ионов приведет к 102 = 100-кратному уменьшению концентрации ионов меди (II), и значительное их количество перейдет из раствора в осадок.
Присутствие в растворе посторонних веществ оказывает влияние на растворимость. Растворимость труднорастворимых веществ зависит: 1) от введения в раствор электролита, содержащего одноименный ион с осадком; 2) от присутствия посторонних электролитов; 3) от присутствия веществ, способных образовывать растворимые комплексные соединения с осадком.
Введение одноименного иона, например хлорид-аниона, способствует уменьшению концентрации иона Ag+, поскольку Ks величина постоянная. При этом часть ионов Ag+ связывается и растворимость AgCl уменьшается. Таким образом, в присутствии избытка одноименного иона может быть достигнута полнота осаждения малорастворимого соединения.
Присутствие в растворе посторонних электролитов вызывает так называемый солевой эффект, выражающийся в увеличении растворимости. Причиной является усиление электростатического взаимодействия между ионами, в результате чего активность ионов растворяемого вещества уменьшается и новые их порции переходят в раствор из осадка. Солевой эффект наблюдается и при введении одноименного иона, однако его влияние на фоне резкого уменьшения растворимости незначительно.
При введении в раствор вещества, способного образовывать комплексы с ионами малорастворимого соединения, растворимость также увеличивается. На этом эффекте основана регенерация серебра из старых рентгеновских снимков через стадию образования растворимого тиосульфатного комплекса.
Получить абсолютно чистый осадок невозможно. Также не следует забывать о различных формах образования осадков. Осадки бывают плотные и рыхлые, кристаллические и аморфные. Существуют соединения, образующие разные кристаллические полиморфы, отличающиеся по растворимости. Карбонат кальция образует несколько минералов, из них наиболее известны кальцит и арагонит. Разработан современный метод очистки котлов и труб паровых систем от накипи под действием электромагнитного поля, когда кальцит расщепляется до арагонита, не образующего известковых отложений.
Осадочные горные породы - минералы, существующие в термодинамических условиях, характерных для поверхностной части земной коры, и образующиеся в результате переотложения продуктов выветривания и разрушения различных горных пород, химического и механического выпадения осадка из воды, жизнедеятельности организмов или всех трех процессов одновременно. Говоря о морских осадках, необходимо отметить, что их изучает одна из геологических наук, называемая литологией. Ученые познают вещественный состав, строение и закономерности образования, а также распределение этих осадков на морском дне.
Ученые-эволюционисты считают, что различная растворимость солей в природных водах оказала большое влияние на их содержание в живых организмах. Между растворимостью соединений в воде и токсическим действием ряда ионов химических элементов имеется тесная взаимосвязь. Введение ионов Al3+ в организм приводит к рахиту вследствие образования малорастворимого AlPO4.
Метод осаждения используют в клиническом анализе хлоридов в моче, поте, крови, желудочном соке, при анализе качества питьевых
вод. Реакции осаждения широко применяют при отравлении ионами тяжелых металлов, которые обладают способностью связываться с белками плазмы крови, для создания конкурирующего равновесия с элиминацией токсического агента в твердую фазу. Труднорастворимая даже в сильнокислой среде соль BaSO4 используется как рентгенокон-трастное вещество при исследовании ЖКТ.
12.2. ОБЩАЯ ХАРАКТЕРИСТИКА СОРБЦИОННЫХ ЯВЛЕНИЙ. ФИЗИЧЕСКАЯ СОРБЦИЯ
И ХЕМОСОРБЦИЯ. АДСОРБЦИЯ И АБСОРБЦИЯ
Биологические системы являются гетерогенными, т.е. состоят из нескольких фаз, отделенных друг от друга поверхностью раздела. Процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного слоя, называются поверхностными явлениями. Среди процессов, происходящих на поверхности раздела фаз, большое значение имеют сорбционные явления.
Сорбция - это способность одного вещества поглощать (концентрировать) другое. Вещество - жидкое или твердое, которое в гетерогенной системе является поглотителем, носит название сорбента. Вещество, которое сорбируется на нем, называют сорбатом.
В зависимости от глубины проникновения сорбата в сорбент сорб-ционные процессы делят на абсорбцию, адсорбцию и капиллярную конденсацию (переход поглощаемого пара, газа в жидкое состояние в узких порах адсорбента). Проникновение сорбата по всему объему сорбента называется абсорбцией (объемной сорбцией) (например, усвоение питательных веществ в кишечнике). Процесс накопления одного вещества в результате диффузии в поверхностном слое другого вещества на границе раздела фаз называется адсорбцией.
Вещество, которое адсорбируется, называется адсорбатом. Вещество, на поверхности которого происходит адсорбция - адсорбентом. Адсорбция протекает на активных центрах поверхности: впадинах (а) и выступах (б). Если взаимодействие между адсорбатом и адсорбентом ограничивается межмолекулярным взаимодействием и является проявлением физических сил (индукционное, электростатическое взаимодействие; ван-дер-ваальсовы силы), то наблюдается физическая адсорбция. Она протекает на активных центрах, находящихся на впадинах рельефа поверхности (а) и носит обратимый характер. При повышении температуры она уменьшается.
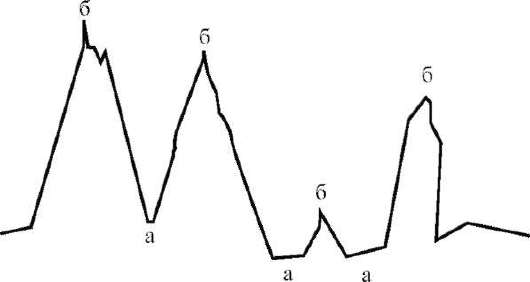
Если же в процессе взаимодействия проявляются химические силы (перераспределение электронной плотности, ионно-молекулярное взаимодействие), то наблюдается химическая адсорбция (хемосорбция). Она происходит на выступах микрорельефа поверхности (б). Хемосорбция носит специфический и необратимый характер. С повышением температуры химическая адсорбция увеличивается.
12.3. АДСОРБЦИОННЫЕ РАВНОВЕСИЯ НА ПОДВИЖНЫХ ГРАНИЦАХ РАЗДЕЛА ФАЗ.
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ. АДСОРБЦИЯ ИЗ РАСТВОРОВ НА ТВЕРДОЙ ПОВЕРХНОСТИ.
ПРАВИЛО ВЫРАВНИВАНИЯ ПОЛЯРНОСТЕЙ ФАЗ РЕБИНДЕРА, ПРАВИЛО ДЮКЛО-ТРАУБЕ. УРАВНЕНИЕ ЛЭНГМЮРА
Адсорбция из растворов на твердом теле бывает двух видов: молекулярная адсорбция - это адсорбция из растворов молекул неэлектролитов, слабых электролитов; ионная адсорбция - это адсорбция из растворов ионов.
Молекулярную адсорбцию из растворов открыл русский химик Ловиц. Адсорбция веществ из растворов осложняется одновременно протекающей на поверхности того же твердого тела адсорбцией молекул растворителя, которые конкурируют с молекулами растворенного вещества за центры адсорбции на адсорбенте. Адсорбенты бывают полярные и неполярные. Молекулярная адсорбция происходит на неполярных адсорбентах, а ионная - на полярных. Неполярные адсорбенты имеют гидрофобную поверхность. Это угли, графит, парафин, тальк. Полярные адсорбенты имеют гидрофильную поверхность. Это силикагель, глины, оксиды металлов.
Величина адсорбции на твердом адсорбенте зависит от природы адсорбента, адсорбата и растворителя. Чем ближе адсорбат и адсорбент по полярности и больше их различие в полярности с растворителем, тем полнее происходит адсорбция. Наш соотечественник Ребиндер сформулировал правило выравнивания полярностей фаз, согласно которому вещества из раствора тем лучше адсорбируются на адсорбенте, чем больше разность полярностей между адсорбентом и растворителем. Неполярные адсорбенты (уголь, алмаз, графит, парафин, тальк) хорошо адсорбируют из полярных растворителей (H2O) различного ряда неполярные вещества (спирты, карбоновые кислоты, фенолы). И чем меньше полярность адсорбата, тем больше величина адсорбции на неполярном адсорбенте. Следовательно, чем больше длина углеродной цепи адсорбата, тем больше величина адсорбции вещества из полярного растворителя.
При адсорбции поверхностно-активных веществ (ПАВ) из неполярных растворителей полярными адсорбентами выполняется правило Дюкло и Траубе. С ростом длины углеродной цепи веществ одного гомологичного ряда адсорбция на неполярном адсорбенте из полярного растворителя возрастает примерно в 3 раза при увеличении углеводородной цепи на одну метиленовую группу -СН2- (для разбавленных растворов).
Правило хорошо иллюстрируется семейством кривых, изображенных на рис. 12.1. Биологическое действие бактерицидное, наркотическое и других веществ одного и того же гомологического ряда возрастает с увеличением их поверхностной активности, т.е. в соответствии с правилом Дюкло-Траубе.
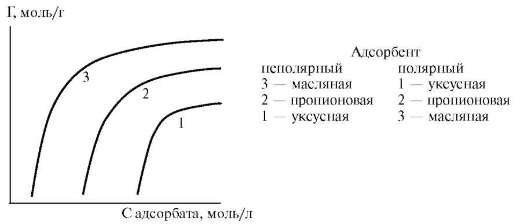
Рис. 12.1. Изотермы адсорбции для гомологического ряда жирных кислот: СН3-СООН уксусная кислота; СН3-СН2-СООН пропионовая кислота; СН3-(СН2)2-СООН масляная кислота
Поверхностно-активные вещества, как и все вещества, в зависимости от способности к диссоциации делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ катионак-тивные (цетилтриметиламмония бромид [CH3-(CH2)15-N(CH3)3]+Br-; анионактивные ПАВ - натрия лаурилсульфат [CH3-(Ch2)11-SO3]-Na+; амфотерные. Ионные формы ПАВ применяют в хирургии в качестве антисептиков, при длине алкильного радикала от C8 до C14 обладают ярко выраженной антифаговой активностью, которую связывают с их влиянием на проницаемость клеточных мембран и ингибирующим действием на ферментативные системы организмов.
Факторы, влияющие на адсорбцию веществ - природа адсорбента, адсорбата и растворителя; на неполярном адсорбенте лучше адсорбируется неполярное вещество из полярного растворителя, а на полярном - полярное вещество из неполярного растворителя; чем лучше растворяется в данном растворителе адсорбат, тем хуже он из него адсорбируется; если растворимость вещества увеличивается с повышением температуры, то величина молекулярной адсорбции уменьшается. Если растворимость вещества уменьшается с повышением температуры, то величина адсорбции увеличивается с повышением температуры; адсорбция прямо пропорциональна удельной поверхности адсорбента; адсорбция зависит от концентрации адсорбата в растворе и описывается уравнением Фрейндлиха и Лэнгмюра.
Уравнение Фрейндлиха:

где K - константа, численно равная адсорбции при равновесной концентрации, равной единице; n - константа, определяющая кривизну изотермы адсорбции, ее значение колеблется в пределах от 0,1 до 0,6.
Уравнение Фрейндлиха применимо при средних значениях равновесных концентраций. Для нахождения констант его логарифмированием приводят к уравнению прямой: lgKф + nlgc;
Уравнение Лэнгмюра:

где Г - адсорбция, моль/г; Г∞ - предельная адсорбция: количество адсорбата, покрывающего поверхность адсорбента плотным монослоем. Характеризует адсорбционную способность адсорбента; α - константа адсорбционного равновесия, отражает способность адсорбата
адсорбироваться; равна отношению констант скоростей десорбции и адсорбции; с - концентрация вещества в растворе, моль/л.
Адсорбцию характеризуют количеством молей или массой вещества, накапливающегося на границе раздела фаз в расчете на единицу массы адсорбента (моль/г) или на единице площади поверхности раздела фаз (моль/см2 или г/см2).
Уравнение Лэнгмюра охватывает широкий диапазон концентраций адсорбата в растворе, в том числе область концентрационного насыщения при условии мономолекулярного адсорбционного слоя. Уравнение Лэнгмюра соответствует изотерме адсорбции Лэнгмюра, которая отражает зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре (рис. 12.2).
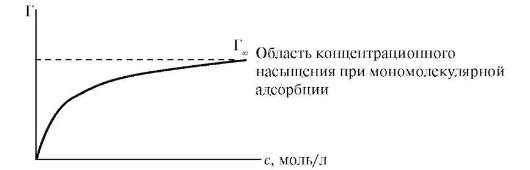
Рис. 12.2. Изотерма адсорбции Лэнгмюра
Из изотермы следует, что при с << α величина адсорбции пропорциональна концентрации.
Для нахождения констант уравнения Лэнгмюра (α, Г∞) кривую изотермы адсорбции следует спрямить. Для этого строят зависимость 1/Г
от 1/c
Механизм молекулярной адсорбции лежит в основе одного из самых современных методов лечения - гемосорбции, т. е. очистке крови от токсичных веществ с помощью различных адсорбентов. В медицине этот метод называют гемоперфузией и применяют при почечной, печеночной недостаточности, при отравлении снотворными, фосфорорганическими соединениями, ожоговой болезни, обморожениях. В качестве адсорбентов применяют активированный уголь, реже иониты, когда нужно вывести ионы из организма, иногда применяют энтеросорбенты.
Методы определения величины адсорбции вещества из раствора
На опыте измеряют изменение концентрации одного из компонентов, происходящее при соприкосновении раствора с адсорбентом, т.е. Δс = с0 - с, где с0 и с - концентрации исходного и равновесного с адсорбентом растворов. Величину адсорбции определяют по формуле:

где V - объем раствора, мл; m - масса адсорбента, г.
12.4. ИЗБИРАТЕЛЬНАЯ И ОБМЕННАЯ АДСОРБЦИЯ ИОНОВ. ЛИОТРОПНЫЕ РЯДЫ. ПРАВИЛО ПАНЕТА-ФАЯНСА. ИОНИТЫ. КАТИОНИТЫ, АНИОНИТЫ
Сильные электролиты в водных растворах полностью диссоциированы. Поэтому адсорбция сильных электролитов сводится к выяснению особенностей адсорбции ионов. Ионы, как правило, адсорбируются на полярных адсорбентах (оксиды, нерастворимые соли). Особенность (специфичность) ионной адсорбции заключается в самопроизвольном накоплении на твердом адсорбенте либо катионов, либо анионов. Это определяется природой адсорбента и природой адсорбируемых ионов.
Необходимо различать два случая адсорбции ионов: избирательная (специфическая) адсорбция; обменная (эквивалентная) адсорбция.
Правило избирательной адсорбции было сформулировано Н.П. Песковым и К. Фаянсом, согласно которому адсорбируются ионы, имеющиеся в составе решетки, либо изоморфные им. Адсорбция носит необратимый характер. Например, полярный адсорбент АgI - нерастворимое в воде соединение - адсорбирует из растворов АgNО3, CН3CООАg, АgClО4 ион серебра. Соответственно из растворов KI, NaBr - ионы йода и ионы, способные замещать йод в кристаллической решетке АgI, образуя изоморфное соединение, например, Cl-, Br-, но не К+, Са+. Они образуют с Аg+ прочные связи, их называют фиксированными ионами.
Поскольку адсорбируются заряженные частицы, то поверхность, заполненная ими, приобретает свойственный им заряд. Поэтому избирательно адсорбирующиеся ионы называют потенциалопределя-ющими. Они определяют величину и знак заряда поверхности адсорбента (рис. 12.3).
Обменная (эквивалентная) адсорбция носит обратимый характер. Для понимания обменной адсорбции продолжим рассмотрение формирования адсорбента - АgI. К заряженной поверхности электростатически притягиваются оставшиеся в растворе ионы (NO3-) противоположного знака (противоионы). Противоионы электростатически притягиваются потенциало-пределяющими ионами и могут обмениваться на другие ионы того же знака (рис. 12.4).
Такой вторичный процесс адсорбции получил название обменной адсорбции ионов, которая заключается в том, что твердая фаза, практически нерастворимая в воде, способна поглощать из раствора катионы или анионы, отдавая в раствор эквивалентное количество ионов другого рода. Обменная адсорбция зависит от природы адсорбента и адсорбируемых ионов.
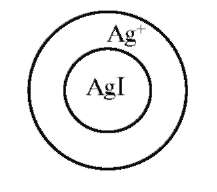
Рис. 12.3
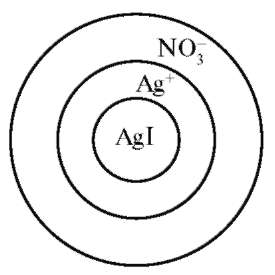
Рис. 12.4
Адсорбируются те ионы, которые с потенциа-лопределяющим ионом адсорбента образуют более прочные соединения. Показателем прочности образуемых соединений являются их нерастворимость и их способность к образованию комплексных соединений.
Ионообменная адсорбция - наиболее распространенный вид адсорбции сильных электролитов. Это чисто поверхностное явление. Адсорбционная способность ионов (особенно катионов) на данной поверхности возрастает с увеличением их заряда. Экспериментально установлено, что при одинаковых зарядах адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше. В соответствии с этим ионы по их адсорбционной способности располагаются в определенной последовательности, получившей название лиотропных рядов.
Лиотропный ряд адсорбции катионов в воде имеет вид:
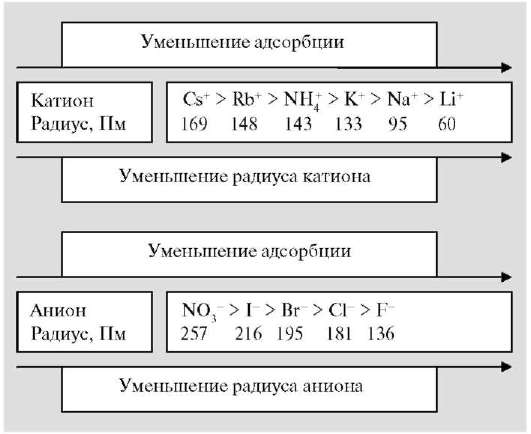
Ионообменной адсорбцией называют процесс, в котором адсорбент и раствор обмениваются между собой в эквивалентных количествах одноименно заряженными ионами: RM1 + M2+ <=> RM2 + + M1+ или RA1 + A2- <=> RA2 + A1-, где RM1, RА1 - адсорбенты, содержащие катионы М1 или анионы А1 и способные к обмену соответственно с катионом М2+ или анионом А2- в растворе. Они получили название ионитов. Ионит - это твердое или жидкое вещество неорганическое (силикагель) или органическое (КУ-2, АВ-17). Иониты обладают сетчатой структурой (каркас, матрица). В сетке закреплены группы атомов R+/-, несущие положительный или отрицательный заряд (фиксированные ионы - ионы внутреннего слоя и подвижные противоионы - ионы наружного слоя (R-M+ или R+A-). Фиксированные ионы вместе с подвижными противооионами называют ионогенными группами или функциональными группами ионита. По типу ионогенных групп иониты делят на катиониты R-M+ (кислотные иониты, обменивающие катион) и аниониты R+A- (основные иониты, обменивающие анион). Катиониты (катионообменники) - иониты с катионами в качестве противоионов. Они ведут себя как кислоты, и их называют кислотными ионитами (КУ-2, КУ-1 и нерастворимые оксиды SiO2, Al2O3 и т. д). Аниониты (анионообменники) - иониты с анионами в качестве противоионов. Они ведут себя как основания, и их называют основными ионитами
(АВ-17, ЭДЭ-10П, нерастворимые гидроксиды металлов Fe(OH)3, Al(OH)3, Ti(OH)4).
Ионообменные реакции можно представить следующими уравнениями:
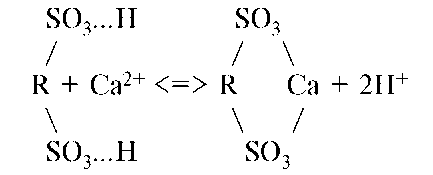
где катионит RH, R - матрица
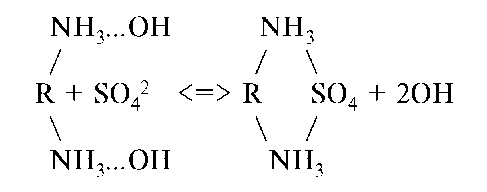
Адсорбционную способность ионитов характеризуют обменной емкостью, которая измеряется количеством ионов (ммоль), поглощенным 1 г сухого ионита из раствора в равновесных условиях. Ионный обмен - процесс обратимый, поэтому иониты можно регенерировать, катиониты - раствором кислоты, аниониты - раствором щелочи. Иониты широко применяют в медицине для дезинтоксикации, поддержания состояния изогидрии организма и т.д.
12.5. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. Дать понятие о поверхностных явлениях.
2. Почему адсорбция является процессом самопроизвольным?
3. Какую зависимость выражает изотерма адсорбции? Приведите пример изотерм адсорбции.
4. Представьте на одном графике семейство изотерм адсорбции масляной, уксусной и пропионовой кислот.
5. Как формулируется правило выравнивания полярностей Ребиндера? Приведите примеры, иллюстрирующие это правило.
6. В качестве противоядия при отравлении метанолом применяют этанол. Дайте обоснование такому применению этанола.
7. Как экспериментально определяется величина адсорбции из водного раствора на неполярном адсорбенте? Вид адсорбции. Приведите уравнение для расчета величины адсорбции.
8. Факторы, влияющие на адсорбцию веществ.
9. Особенности адсорбции сильных электролитов? Перечислите разновидности адсорбции электролитов.
10. При какой температуре - 25 или 50 °С величина адсорбции азота активированным углем будет больше?
11. Растворимость метиленовой сини с повышением температуры увеличивается? При какой температуре - 25 или 50 °С величина адсорбции метиленовой сини активированным углем будет больше?
12. Какие ионы будут адсорбироваться на поверхности AgI из растворов солей: NaCl, NaBr, NH4I.
13. Расположите катионы вышеуказанных электролитов: Na2SO4, KNO3, LiOH по убывающей способности адсорбироваться. Поясните ответ.
14. Определите, сколько граммов соли вступило в реакцию в колонке с ионообменной смолой, если 10 мл 0,02 М раствора CH3COONa пропустили через колонку с катионообменной смолой, затем фильтрат оттитровали 0,02 М раствором щелочи. На титрование пошло 8 мл 0,02 М раствора щелочи.
15. Один грамм катионита залили 100 мл раствора CaC12 с молярной концентрацией эквивалента 0,1 моль/л на 12 ч. Вычислите статическую обменную емкость катионита, если на титрование 25 л отобранного раствора над катионитом пошло 4,3 мл щелочи с молярной концентрацией эквивалента 0,1 моль/л.
16. У какого из сорбентов на основе углерода СКН или СКН-А, имеющих удельную поверхность 1950 и 150 м2/г соответственно, величина адсорбции аллергена домашней пыли будет выше?
17. Предельная адсорбция Г∞ = 7•10-10 моль/м2 иα = 0,935. Вычислите величину адсорбции при равновесной концентрации 0,05 моль/л.
18. Дать понятие об эффекте общего иона.
12.6. ТЕСТОВЫЕ ЗАДАНИЯ
1. Выберите верные утверждения:
1) частицы на поверхности раздела фаз обладают большей энергией, чем частицы в глубине фазы;
2) избыточная энергия частиц на поверхности, отнесенная к объему фазы, называется поверхностным натяжением;
3) самопроизвольный процесс коагуляции сопровождается уменьшением поверхностной энергии;
4) увеличение температуры не влияет на значение поверхностного натяжения.
а) 1; б) 1, 2; в) 3, 4; г) 1, 3.
2. Молекулярное притяжение между поверхностями двух соприкасающихся разнородных фаз называется:
а) когезией;
б) смачиванием;
в) адгезией;
г) адсорбцией.
3. При физической адсорбции частицы удерживаются на поверхности адсорбента за счет:
1) проникновения в поры адсорбента;
2) межмолекулярных ван-дер-ваальсовых сил;
3) водородных связей;
4) химического взаимодействия. а) 1; б) 1, 2, 3; в) 2, 3; г) 2, 4.
4. Изотерма адсорбции Лэнгмюра и Фрейндлиха характеризуются следующими уравнениями соответственно:
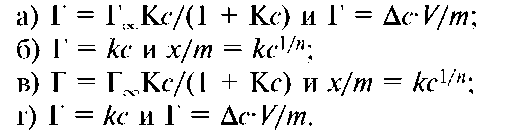
5. Активированный уголь - гидрофобный сорбент и лучше адсорбирует:
а) полярные вещества из неполярных растворителей;
б) неполярные вещества из полярных растворителей;
в) полярные вещества из полярных растворителей;
г) неполярные вещества из неполярных растворителей.
6. Согласно правилу Дюкло-Траубе, поверхностная активность с увеличением длины углеводородного радикала на одну СН2-группу:
а) увеличивается в 3-3,5 раза;
б) не изменяется;
в) уменьшается в 3-3,5 раза;
г) изменяется незакономерно.
7. К ПАВ относятся вещества, обладающие:
а) положительной поверхностной активностью, при этом адсорбция отрицательная;
б) отрицательной поверхностной активностью, при этом адсорбция положительна;
в) положительной поверхностной активностью, при этом адсорбция положительна;
г) отрицательной поверхностной активностью, при этом адсорбция отрицательна.
8. К ПАВ относятся:
а) желчные кислоты;
б) фосфолипиды;
в) сахароза;
г) белки.
9. Какие группы могут содержаться в анионитах:
а) -SO3H;
б) -PO3H;
в) -NH3+OH;
г) -COOH.
10. Для регенерации катионита его промывают:
а) раствором кислоты;
б) раствором щелочи;
в) раствором NaCl;
г) H2O.