Общая химия : учебник / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
|
|
|
|
Глава 13. ФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ
Жизнь - это особая коллоидная система,... это особое царство природных вод.
В.И. Вернадский
13.1 ДИСПЕРСНЫЕ СИСТЕМЫ, ИХ КЛАССИФИКАЦИИ, СВОЙСТВА
Коллоидные растворы
Материальная основа современной цивилизации и самого существования человека и всего биологического мира связана с дисперсными системами. Человек живет и работает в окружении дисперсных систем. Воздух, особенно воздух рабочих помещений, - это дисперсная система. Многие пищевые продукты, полупродукты и продукты их переработки представляют дисперсные системы (молоко, мясо, хлеб, масло, маргарин). Многие лекарственные вещества производятся в форме тонких суспензий или эмульсий, мазей, паст или кремов (протаргол, колларгол, желатиноль и др.). Дисперсными являются все живые системы. Мышечные и нервные клетки, волокна, гены, вирусы, протоплазма, кровь, лимфа, спинномозговая жидкость - все это высокодисперсные образования. Протекающие в них процессы управляются физико-химическими закономерностями, которые изучает физикохи-мия дисперсных систем.
Дисперсными называют системы, в которых вещество находится в состоянии более или менее высокой раздробленности и равномерно распределено в окружающей среде. Науку о высокодисперсных системах называют коллоидной химией. В основе живого вещества лежат соединения, находящиеся в коллоидном состоянии.
Дисперсная система состоит из дисперсионной среды и дисперсной фазы. Существует несколько классификаций дисперсных систем, основанных на различных признаках дисперсных систем.
1. По агрегатному состоянию дисперсионной среды все дисперсные системы можно свести к 3 типам. Дисперсные системы с газообразной
дисперсионной средой - аэрозоли (дым, воздух рабочих помещений, облака и т.д.). Дисперсные системы с жидкой дисперсионной средой - лиозоли (пены, эмульсии - молоко, суспензии, пыль, попавшая в дыхательные пути; кровь, лимфа, моча представляют собой гидрозоли). Дисперсные системы с твердой дисперсионной средой - солидозоли (пемза, силикагель, сплавы).
2. Вторая классификация группирует дисперсные системы в зависимости от размера частиц дисперсной фазы. Мерой раздробленности частиц служит либо поперечный размер частиц - радиус (r), либо
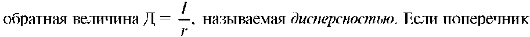
(радиус) частиц (r) выражать в сантиметрах, то дисперсность Д - это число частиц, которое можно уложить вплотную по длине одного сантиметра. Наконец, можно характеризовать удельной поверхностью (∑), единицами измерения ∑ являются м2/г или м2/л. Под удельной поверхностью понимают отношение поверхности (S) дисперсной фазы к ее
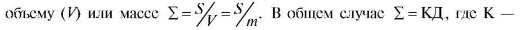
коэффициент зависимости удельной поверхности от формы частиц. Удельная поверхность прямо пропорциональна дисперсности (Д) и обратно пропорциональна поперечному размеру частицы (r). С повышением дисперсности, т.е. с уменьшением размера частиц, ее удельная поверхность возрастает.
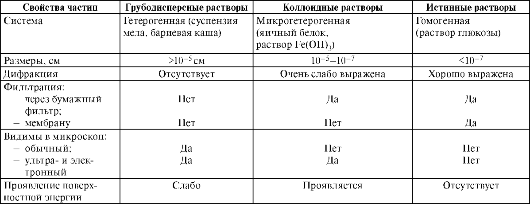
Вторая классификация группирует дисперсные системы в зависимости от размера частиц дисперсной фазы на следующие группы (табл. 13.1): грубодисперсные системы; коллоидные растворы; истинные растворы.
Коллоидные системы могут быть газообразными, жидкими и твердыми. Наиболее распространены и изучены жидкие (лиозоли). Коллоидные растворы для краткости обычно называют золями. В зависимости от природы растворителя - дисперсионной среды, т.е. воды, спирта или эфира, лиозоли называют соответственно гидрозоли, алкозоли или этерозоли. По интенсивности взаимодействия частиц дисперсной фазы и дисперсионной среды золи делят на 2 группы: лиофильные - интенсивное взаимодействие, в результате которого образуются развитые сольватные слои, например, золь протоплазмы, крови, лимфы, крахмала, белка и т.д.; лиофобные золи - слабое взаимодействие частиц дисперсной фазы с частицами дисперсионной среды. Золи металлов, гидроксидов, практически все классические коллоидные системы. ВМС и растворы ПАВ выделяют в отдельные группы.
Таблица 13.1. Классификация дисперсных систем по размеру частиц и их свойства
Большой вклад в теорию коллоидных растворов внесли наши отечественные ученые И.Г. Борщов, П.П. Веймарн, Н.П. Песков, Д.И. Менделеев, Б.В. Дерягин, П.А. Ребиндер и т.д.
Всякий коллоидный раствор является микрогетерогенной, многофазной, высоко- и полидисперсной системой с высокой степенью дисперсности. Условием образования коллоидного раствора является нерастворимость вещества одной фазы в веществе другой, ибо только между такими веществами могут существовать физические поверхности раздела. По силе взаимодействия между частицами дисперсной фазы различают свободно-дисперсные и связнодисперсные системы. Примером последних являются биологические мембраны.
Получение коллоидных растворов проводят двумя методами: диспергированием крупных частиц до коллоидной степени дисперсности и конденсацией - созданием условий, при которых атомы, молекулы или ионы соединяются в агрегаты коллоидной степени дисперсности.
Образовать гидрозоли могут металлы, малорастворимые в воде соли, оксиды и гидроксиды, многие неполярные органические вещества. Хорошо растворяющиеся в воде вещества, но малорастворимые в неполярных соединениях не способны образовывать гидрозоли, но могут образовывать органозоли.
В качестве стабилизаторов используются вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, в том числе белки и полисахариды.
Для достижения требуемой для коллоидных систем дисперсности (10-7-10-9 м) применяют:
• механическое дробление с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсной среды и стабилизатора;
• действие ультразвука (например, гидрозоля серы, графита, гидроксидов металлов и т.д.);
• метод пептизации, добавление небольшого количества электролита - пептизатора;
• одной из разновидностей конденсационного способа является метод замены растворителя, в результате которой происходит понижение растворимости вещества дисперсной фазы. Молекулы вещества конденсируются в частицы коллоидных размеров в результате разрушения сольватных слоев молекул в истинном растворе и образования более крупных частиц. В основе хими-
ческих конденсационных методов лежат химические реакции (окисления, восстановления, гидролиза, обмена), приводящие к образованию малорастворимых веществ в присутствии тех или иных стабилизаторов.
13.2. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ. ОСМОС.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Броуновское движение - это тепловое движение частиц в коллоидных системах, которое имеет молекулярно-кинетическую природу. Установлено, что движение коллоидных частиц является следствием беспорядочных ударов, наносимых им молекулами дисперсионной среды, находящихся в тепловом движении. В результате коллоидная частица часто меняет свое направление и скорость. За 1 с коллоидная частица может изменить свое направления свыше 1020 раз.
Диффузией называется самопроизвольно протекающий процесс выравнивания концентрации коллоидных частиц в растворе под влиянием их теплового хаотического движения. Явление диффузии необратимо. Коэффициент диффузии численно равен количеству вещества, продиффундировавшего через единицу площади в единицу времени при градиенте концентрации, равном 1 (т.е. изменению концентрации в 1 моль/см3 на расстоянии в 1 см). А. Эйнштейн (1906) вывел уравнение, связывающее коэффициент диффузии с абсолютной температурой, вязкостью и размером частиц дисперсной фазы:

где T - температура, К; r - радиус частицы, м; η - вязкость, Н•с/м2; кБ - постоянная Больцмана, 1,38•10-23; D - коэффициент диффузии, м2/с.
Коэффициент диффузии прямо пропорционален температуре и обратно пропорционален вязкости среды (η) и радиусу частиц (r). Причиной диффузии, как и броуновского движения, является молекулярно-кинетическое движение частиц растворителя и вещества. Известно, что кинетическая энергия движущейся молекулы тем меньше, чем больше ее объем (табл. 13.2).
Пользуясь уравнением Эйнштейна, можно легко определить массу 1 моля вещества, если известны D, T, η и r. Из уравнения (13.1) можно определить r:

где R - универсальная газовая постоянная, 8,3 (Дж/моль-К); Na постоянная Авогадро.
Таблица 13.2. Коэффициент диффузии некоторых веществ

В случае когда система отделена от других частей системы перегородкой, которая проницаема для одного компонента (например, вода) и непроницаема для другого (например, растворенного вещества), диффузия становится односторонней (осмос). Сила, обусловливающая осмос, отнесенная к единице поверхности мембраны, называется осмотическим давлением. Роль полупроницаемых перегородок (мембран) могут выполнять ткани человека, животных и растений (мочевой пузырь, стенки кишечника, оболочки клеток и др.). Для коллоидных растворов осмотическое давление меньше, чем в истинных растворах. Процесс диффузии сопровождается возникновением разности потенциала в результате различной подвижности ионов и образования градиента концентрации (мембранного потенциала).
Седиментация. На распределение частиц оказывает влияние не только диффузия, но и гравитационное поле. Кинетическая устойчивость коллоидной системы зависит от действия двух факторов, направленных взаимно противоположно: силы тяжести, под действием которой частицы оседают, и силы, при которой частицы стремятся разойтись по всему объему и противодействовать оседанию.
Оптические свойства коллоидных растворов. Светорассеяние. Уравнение Д. Рэлея. Различить коллоидный и истинный растворы с первого взгляда невозможно. Хорошо приготовленный золь - практически чистая прозрачная жидкость. Микрогетерогенность его можно обнаружить специальными методами. Если золь, находящийся в неосвещенном месте, осветить узким лучом, то при наблюдении сбоку можно увидеть светлый конус, вершина которого находится в месте входа луча в негомогенное пространство. Это так называемый конус Тиндаля - своеобразное мутное свечение коллоидов, наблюдаемое при боковом освещении, называется эффектом Фарадея-Тиндаля.
Причина этого характерного для коллоидов явления в том, что размер коллоидных частиц меньше половины длины световой волны, при этом наблюдается дифракция света, в результате рассеивания частицы светятся, превращаясь в самостоятельный источник света, и луч становится видимым.
Теория рассеивания света разработана Рэлеем в 1871 году, который вывел для сферических частиц уравнение, связывающее интенсивность падающего света (I0) с интенсивностью света, рассеянного единицей объема системы (Ip).

где I, I0 - интенсивность рассеянного и падающего света, Вт/м2; кр - константа Рэлея, постоянная, зависящая от показателей преломления веществ дисперсной фазы и дисперсионной среды, м-3; сv - концентрация частиц золя, моль/л; λ - длина волны падающего света, м; r - радиус частицы, м.
13.3. МИЦЕЛЛЯРНАЯ ТЕОРИЯ СТРОЕНИЯ КОЛЛОИДНЫХ ЧАСТИЦ
Мицеллы образуют дисперсную фазу золя, а интермицеллярная жидкость - дисперсионную среду, в состав которой входят растворитель, ионы электролитов и молекулы неэлектролитов. Мицелла состоит из электронейтрального агрегата и ионогенной частицы. Масса коллоидной частицы сосредоточена главным образом в агрегате. Агрегат может иметь как аморфное, так и кристаллическое строение. Согласно правилу Панета-Фаянса на агрегате адсорбируется необратимо с образованием прочных связей с атомами агрегата ионы, которые входят в состав кристаллической решетки агрегата (или изоморфны с ней). Показателем этого является нерастворимость этих соединений. Они называются потенциалопределяющими ионами. Агрегат в результате избирательной адсорбции ионов или ионизации поверхностных молекул приобретает заряд. Итак, агрегат и потенциалопределяющие ионы образуют ядро мицеллы и группируют вокруг ядра ионы противоположного знака - противоионы. Агрегат вместе с ионогенной частью мицеллы образуют двойной электрический слой (адсорбционный слой). Агрегат вместе с адсорбционным слоем называют гранулой. Заряд гранулы равен сумме зарядов противоионов и потенциалопределяющих ионов. Ионогенная
часть мицеллы состоит из двух слоев: адсорбционного и диффузного. На этом заканчивается формирование электронейтральной мицеллы, которая является основой коллоидного раствора. Мицеллу изображают в виде коллоидно-химической формулы.
Рассмотрим строение мицеллы гидрозолей на примере образования коллоидного раствора сульфата бария при условии избытка BaCl2:
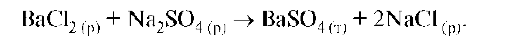
Труднорастворимый барий сульфат образует кристаллический агрегат, состоящий из m молекул BaSO4. На поверхности агрегата адсорбируется n ионов Ва2+. С поверхностью ядра связано 2(n - x) хлорид ионов С1-. Остальные противоионы (2x) располагаются в диффузном слое:

Строение мицеллы золя бария сульфата, полученного при избытке натрий сульфата, записывается в виде:
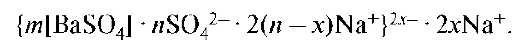
Из приведенных выше данных следует, что знак заряда коллоидной частицы зависит от условий получения коллоидного раствора.
13.4. ЭЛЕКТРОКИНЕТИЧЕСКИЙ ПОТЕНЦИАЛ
КОЛЛОИДНОЙ ЧАСТИЦЫ
Дзета-(ζ )-потенциал. Величину заряда ζ-потенциала определяет заряд гранулы. Она определяется разностью суммы зарядов потенциал-определяющих ионов и зарядов противоионов, находящихся в адсорбционном слое. Он уменьшается по мере увеличения числа противоионов в адсорбционном слое и может стать равным нулю, если заряд противо-ионов равен заряду ядра. Частица будет находиться в изоэлектрическом состоянии. По величине ζ-потенциала можно судить об устойчивости дисперсной системы, ее структуре и об электрокинетических свойствах.
ζ-потенциал различных клеток организма разнится. Живая протоплазма заряжена отрицательно. При pH 7,4 величина ζ-потенциала эритроцитов от -7 до -22 мв, у человека равна -16,3 мв. У моноцитов примерно в 2 раза ниже. Электрокинетический потенциал рассчитывают, определяя скорость движения частиц дисперсной фазы при электрофорезе.
Электрофоретическая подвижность частиц зависит от ряда величин и рассчитывается по уравнению Гельмгольца-Смолуховского:

где иэф - электрофоретическая подвижность (скорость электрофореза), м/с; ε- относительная диэлектрическая проницаемость раствора; ε0- электрическая постоянная, 8,9•10-12 А с/Вт м; Δφ - разность потенциалов от внешнего источника тока, В; ζ - электрокинетический потенциал, В; η - вязкость дисперсионной среды, Н•с/м2; l - расстояние между электродами, м; кф - коэффициент, значение которого зависит от формы коллоидной частицы.
13.5. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ.
ЭЛЕКТРОФОРЕЗ. ЭЛЕКТРОФОРЕЗ
В МЕДИКО-БИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
Электрокинетические явления отражают связь, существующую между движением фаз дисперсной системы относительно друг друга и электрическими свойствами границы раздела этих фаз. Различают четыре вида электрокинетических явлений - электрофорез, электроосмос, потенциал течения (протекания) и потенциал оседания (седиментации). Электрокинетические явления открыты Ф.Ф. Рейссом. В кусок влажной глины он погрузил на некоторое расстояние две стеклянные трубки, в которые насыпал немного кварцевого песка, налил воды до одинакового уровня и опустил электроды (рис. 13.1).
Пропуская постоянный ток, Рейсс установил, что в анодном пространстве вода над слоем песка становится мутной вследствие появления суспензии глинистых частиц, вместе с тем уровень воды в колене понижается; в катодной трубке вода остается прозрачной, но уровень ее повышается. По результатам опыта можно сделать вывод: частицы глины, двигающиеся к положительному электроду, заряжены отрицательно, а прилегающий слой воды заряжен положительно, так как перемещается к отрицательному полюсу.
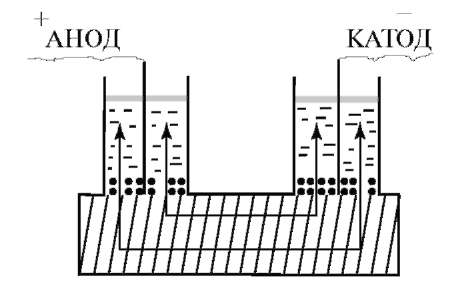
Рис. 13.1. Электрокинетические явления движения частиц дисперсной фазы
в дисперсной системе
Явление движения заряженных частичек дисперсной фазы относительно частиц дисперсионной среды под действием электрического поля получило название электрофореза. Явление движения жидкости относительно твердой фазы через пористое твердое тело (мембрану) называется электроосмосом. В условиях описанного опыта наблюдалось одновременно два электрокинетических явления - электрофорез и электроосмос. Передвижение коллоидных частиц в электрическом поле является ярким доказательством того, что коллоидные частицы несут на своей поверхности заряд.
Коллоидную частицу - мицеллу можно рассматривать как огромный по размеру сложный ион. Коллоидный раствор под действием постоянного тока подвергается электролизу, коллоидные частицы переносятся к аноду или катоду (зависит от заряда коллоидной частицы). Таким образом, электрофорез есть электролиз высокодисперсной системы.
Позднее были обнаружены 2 явления, противоположные электрофорезу и электроосмосу. Дорн обнаружил, что при оседании каких-либо частиц в жидкости, например песка в воде, возникает ЭДС между 2 электродами, введенными в разные места столба жидкости, называемое потенциалом седиментации (эффект Дорна).
При продавливании жидкости через пористую перегородку, по обеим сторонам которой находятся электроды, также появляется ЭДС - потенциал течения (протекания).
Коллоидная частица движется со скоростью, пропорциональной величине ζ-потенциала. Если в системе сложная смесь, то можно изучить и разделить ее, используя метод электрофореза, основанный на электро-форетической подвижности частиц. Это широко используется в медико-биологических исследованиях в виде макро и микроэлектрофореза.
Создаваемое электрическое поле вызывает движение частиц дисперсной фазы со скоростью, пропорциональной величине ζ-потенциала, которое можно наблюдать по перемещению границы раздела между исследуемым раствором и буфером с помощью оптических приспособлений. В результате смесь разделяется на ряд фракций. При регистрации получают кривую с несколькими пиками, высота пика - количественный показатель содержания каждой фракции. Этим методом удается выделить и исследовать отдельные фракции белков плазмы крови. Электрофореграммы плазмы крови всех людей в норме одинаковы. При патологии они имеют характерный для каждого заболевания вид. Они используются для установления диагноза и лечения заболеваний. Электрофорез используется для разделения аминокислот, антибиотиков, ферментов, антител и т.д. Микроэлектрофорез заключается в определении скорости движения частиц под микроскопом, электрофорез - на бумаге. Явление электрофореза происходит при миграции лейкоцитов в воспалительные очаги. Как методы лечения сейчас разрабатываются и внедряются имуноэлек-трофорез, диск-электрофорез, изотахофорез и др. Они решают многие медико-биологические задачи как препаративного, так и аналитического характера.
13.6. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ. СЕДИМЕНТАЦИОННАЯ, АГРЕГАТИВНАЯ И КОНДЕНСАЦИОННАЯ УСТОЙЧИВОСТЬ ЛИОЗОЛЕЙ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСТОЙЧИВОСТЬ
Вопрос об устойчивости коллоидных систем - весьма важный вопрос, касающийся непосредственно самого их существования. Седиментационная устойчивость - устойчивость частиц дисперсной системы к оседанию под действием сил тяжести.
Песков ввел понятие агрегативной и кинетической устойчивости. Кинетическая устойчивость - способность дисперсной фазы коллоидной системы находиться во взвешенном состоянии, не седимен-тировать и противодействовать силам тяжести. Высокодисперсные системы - кинетически устойчивы.
Под агрегативной устойчивостью нужно понимать способность дисперсной системы сохранять первоначальную степень дисперсности. Это возможно только при наличии стабилизатора. Следствием нарушения агрегативной устойчивости является кинетическая неустойчивость,
ибо образовавшиеся из первоначальных частиц агрегаты под действием сил тяжести выделяются (оседают или всплывают).
Агрегативная и кинетическая устойчивость взаимосвязаны. Чем больше агрегативная устойчивость системы, тем больше ее кинетическая устойчивость. Устойчивость определяется результатом борьбы сил тяжести и броуновского движения. Это пример проявления закона единства и борьбы противоположностей. Факторы, определяющие устойчивость систем: броуновское движение, дисперсность частиц дисперсной фазы, вязкость и ионный состав дисперсионной среды и т.д.
Факторы устойчивости коллоидных растворов: наличие электрического заряда коллоидных частиц. Частицы несут одноименный заряд, поэтому при встрече частицы отталкиваются; способность к сольватации (гидратации) ионов диффузного слоя. Чем более гидратированы ионы в диффузном слое, тем толще общая гидратная оболочка, тем стабильнее система. Упругие силы сольватных слоев оказывают расклинивающее действие на дисперсные частицы и не дают им сближаться; адсорбционно-структурирующие свойства систем. Третий фактор связан с адсорбционными свойствами дисперсных систем. На развитой поверхности дисперсной фазы легко абсорбируются молекулы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Большие размеры молекул, несущих собственные сольватные слои, создают на поверхности частиц адсорбционно-сольватные слои значительной протяженности и плотности. Такие системы по устойчивости близки к лиофильным системам. Все эти слои обладают определенной структурой, создают по П.А. Ребиндеру структурно-механический барьер на пути сближения дисперсных частичек.
13.7. КОАГУЛЯЦИЯ ЗОЛЕЙ. ПРАВИЛА КОАГУЛЯЦИИ. КИНЕТИКА КОАГУЛЯЦИИ
Золи являются термодинамически неустойчивыми системами. Частицы дисперсной фазы золей стремятся к уменьшению свободной поверхностной энергии за счет сокращения удельной поверхности коллоидных частиц, что происходит при их объединении. Процесс объединения коллоидных частиц в более крупные агрегаты, и в конечном итоге выпадение их в осадок, называется коагуляцией.
Коагуляцию вызывают различные факторы: механическое воздействие, изменение температуры (кипячение и вымораживание), излуче-
ние, посторонние вещества, особенно электролиты, время (старение), концентрация дисперсной фазы.
Наиболее изученным процессом является коагуляция золей электролитами. Существуют следующие правила коагуляции золей электролитами.
1. Все электролиты способны вызывать коагуляцию лиофобных золей. Коагулирующим действием (Р) обладают ионы, имеющие заряд, противоположный заряду гранулы (потенциалопределяющих ионов) и одинаковый по знаку с противоионами (правило Гарди). Коагуляцию положительно заряженных золей вызывают анионы.
2. Коагулирующая способность ионов (Р) зависит от величины их заряда. Чем выше заряд иона, тем выше его коагулирующее действие (правило Шульце): РА13+ > PCa2+ > PK+.
Соответственно для порога коагуляции можно записать:
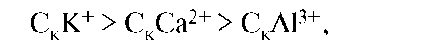
т.е. чем ниже заряд иона, тем при большей концентрации будет происходить коагуляция.
3. Для ионов одного заряда коагулирующая способность зависит от радиуса (r) сольватированного иона: чем больше радиус, тем больше его коагулирующее действие:

4. Каждый электролит характеризуется пороговой концентрацией процесса коагуляции коллоидного раствора (порог коагуляции), т.е. наименьшей концентрацией, выраженной в миллимолях, которую необходимо добавить к одному литру коллоидного раствора, чтобы вызвать его коагуляцию. Порог коагуляции или пороговая концентрация обозначается Ск. Порог коагуляции является относительной характеристикой устойчивости золя по отношению к данному электролиту и является величиной, обратной коагулирующей способности:

5. Коагулирующее действие органических ионов больше, чем неорганических; коагуляция многих лиофобных золей наступает раньше,
чем достигается их изоэлектрическое состояние, при котором начинается явная коагуляция. Это действие называется критическим. Его величина составляет +30 мВ.
Процесс коагуляции для каждой дисперсной системы идет с определенной скоростью. Зависимость скорости коагуляции от концентрации электролита-коагулятора показана на рис. 13.2.
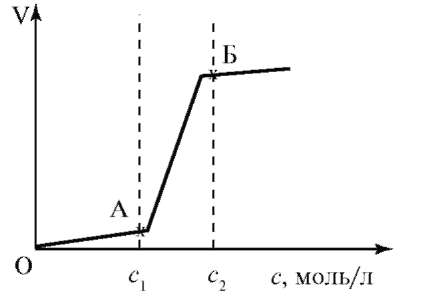
Рис. 13.2. Зависимость скорости коагуляции от концентрации электролитов.
Пояснения в тексте
Выделены 3 области и две характерные точки АиБ. Область, ограниченная линией ОА (по оси концентрации), называется областью скрытой коагуляции. Здесь скорость коагуляции практически равна нулю. Это зона устойчивости золя. Между точками А и Б расположена область медленной коагуляции, в которой скорость коагуляции зависит от концентрации электролита. Точка А соответствует наименьшей концентрации электролита, при которой начинается явная коагуляция (порог коагуляции), и имеет критическое значение. Об этой стадии можно судить по внешним признакам: изменению окраски, появлению мути. Происходит полное разрушение коллоидной системы: выделение вещества дисперсной фазы в осадок, который называется коагулятом. В точке Б начинается быстрая коагуляция, т. е. все столкновения частичек оказываются эффективными и не зависят от концентрации электролита. В точке Б ζ-потенциал равен 0. Количество вещества, необходимое для коагуляции коллоидного, раствора зависит от того, прибавляется электролит сразу или постепенно, небольшими порциями. Замечено, что в последнем случае приходится прибавлять больше вещества, чтобы вызвать такое же явление коагуляции. Это явление используется при дозировке лекарств.
Если слить два коллоидных раствора с противоположными зарядами, то они быстро коагулируют. Процесс носит электростатический характер. Это используют для очистки промышленных и сточных вод. На водопроводных станциях к воде добавляют перед песчаными фильтрами алюминий сульфат или железо (III) хлорид. При их гидролизе образуются положительно заряженные золи гидроксидов металлов, которые вызывают коагуляцию отрицательно заряженных частиц микрофлоры, почвы, органических примесей.
В биологических системах явления коагуляции играют очень важную роль. Цельная кровь - это эмульсия. Форменные элементы крови - дисперсная фаза, плазма - дисперсионная среда. Плазма является более высокодисперсной системой. Дисперсная фаза: белки, ферменты, гормоны. В крови работают система свертывания крови и анти-свертывающая система. Первое обеспечивается тромбином, который действует на фибриноген и вызывает образование нитей фибрина (сгустка крови). Эритроциты седиментируют с определенной скоростью (СОЭ). Процесс свертывания обеспечивает минимальную потерю крови и образование тромбов в кровеносной системе. При патологии эритроциты адсорбируют крупные молекулы гамма-глобулинов и фибриногенов и СОЭ увеличивается. Основной антисвертывающей способностью крови является гепаринантикоагулянт крови. В клиниках пользуются коагулограммами - совокупностью анализов по свертывающей и антисвертывающей способности крови (содержание протромбина, время рекальцификации плазмы, толерантность к гепарину, общее количество фибриногена и т.д.), это важно при сильных кровотечениях, при образовании тромбов. Свертываемость крови необходимо учитывать при ее консервировании. Удаляют нитратом натрия в осадок ионы Са2+, который повышает свертываемость. Применяют антикоагулянт, гепарин, дикумарин. Полимеры, используемые для эндопроте-зирования элементов сердечно-сосудистой системы, должны обладать антитромбогенными или тромборезистентными свойствами.
13.8. СТАБИЛИЗАЦИЯ КОЛЛОИДНЫХ СИСТЕМ (ЗАЩИТА КОЛЛОИДНЫХ РАСТВОРОВ)
Стабилизация коллоидных растворов по отношению к электролитам путем создания на поверхности коллоидных частиц дополнительных адсорбционных слоев с повышенными структурно-механическими свойствами, добавлением незначительного количества раствора высо-
комолекулярных соединений (желатин, казеинат натрия, яичный альбумин и др.) получила название коллоидной защиты. Защищенные золи весьма устойчивы к электролитам. Защищенный золь приобретает все свойства адсорбированного полимера. Дисперсная система становится лиофильной и поэтому устойчивой. Защитное действие ВМС или ПАВ характеризуют защитным числом. Под защитным числом следует понимать минимальную массу ВМС (в миллиграммах), которое необходимо добавить к 10 мл исследуемого золя, чтобы защитить его от коагуляции при введении в системы 1 мл 10% раствора натрий хлорида. Степень защитного действия растворов ВМС зависят: от природы ВМС, природы защищаемого золя, степени дисперсности, pH среды, от примесей.
Явление коллоидной защиты в организме играет очень важную роль в ряде физиологических процессов. Защитным действием в организме обладают различные белки, полисахариды, пептиды. Они адсорбируют Са на коллоидных частицах таких гидрофобных систем организма, как карбонаты, фосфаты кальция, переводя их в устойчивое состояние. Примером защищенных золей является кровь и моча. Если выпарить 1 л мочи, собрать получившийся осадок и потом попытаться растворить его в воде, то для этого нужно 14 л растворителя. Следовательно, моча - коллоидный раствор, в котором дисперсные частицы защищены альбуминами, муцинами и другими белками. Протеины сыворотки крови увеличивают растворимость карбоната кальция почти в 5 раз. Повышенное содержание кальций фосфата в молоке обусловлено белковой защитой, которая при старении нарушается.
В развитии атеросклероза играет большую роль лейцетино-холестериновое равновесие, при нарушении которого изменяется соотношение между холестерином, фосфолипидами и белками, приводящее к отложению холестерина на стенках сосудов, следствием чего является атерокальциноз. Большая роль в защите отводится крупномолекулярным жиробелковым компонентам. С другой стороны способность крови удерживать в растворенном состоянии в больших концентрациях газов углерода и кислорода, также обусловлено защитным действием белков. В данном случае белки обволакивают микропузырьки газов и предохраняют их от слипания.
Защита коллоидньгх частиц, применяемых при изготовлении лекарственных препаратов. В организм часто необходимо вводить лекарственные вещества в коллоидном состоянии, чтобы они равномерно распределялись в организме и усваивались. Так, защищенные белковыми веществами коллоидные растворы серебра, ртути, серы, используемые
как лекарственные препараты (протаргол, колларгол, лизоргинон), становятся не только малочувствительными к электролитам, но и могут быть выпарены досуха. Сухой остаток после обработки водой снова переходит в золь.
13.9. ПЕПТИЗАЦИЯ
Пептизация - процесс, обратный коагуляции, процесс перехода коагулята в золь. Пептизация идет при добавлении к осадку (коагуляту) веществ, способствующих переходу осадка в золь. Их называют пепти-заторами. Обычно пептизаторами являются потенциалопределяющие ионы. Например, осадок железа (III) гидроксида пептизируется солями железа (III). Но роль пептизатора может выполнять и растворитель (Н2О). Процесс пептизации обусловлен адсорбционными явлениями. Пептизатор облегчает образование структуры двойного электрического слоя и образованию дзета-потенциала.
Следовательно, процесс пептизации в основном обусловлен адсорбцией потенциалопределяющих ионов и десорбцией противоионов, в результате которых происходят повышение ζ-потенциала дисперсных частиц и увеличение степени сольвации (гидратации), образования вокруг частиц сольватных оболочек, производящих расклинивающее действие (адсорбционная пептизация).
Помимо адсорбционной различают еще диссолюционную пептиза-цию. Этот вид охватывает все, когда процесс пептизации сопряжен с химической реакцией поверхностно расположенных молекул дисперсной фазы. Он состоит из двух фаз: образования пептизатора путем химической реакции введенного электролита пептизатора с дисперсной частицей; адсорбцией образовавшегося пептизатора на поверхности дисперсной фазы, приводящей к образованию мицелл и пептиза-ции осадка. Типичным примером диссолюционной пептизации может служить пептизация гидроксидов металлов кислотами.
Максимальная дисперсность золей, получаемых при адсорбционной пептизации, определяется степенью дисперсности первичных частиц, образующих хлопья осадка. При диссолюционной пептизации граница дробления частиц может выходить из области коллоидов и достигать молекулярной степени дисперсности. Процесс пептизации имеет большое значение в живых организмах, так как коллоиды клеток и биологических жидкостей постоянно испытывают на себе действие электролитов в организме.
Действие многих детергентов, в том числе моющих средств, основано на явлении пептизации. Коллоидный ион мыла является диполем, адсорбируется частицами грязи, сообщает им заряд и способствует их пептизации. Грязь в виде золя легко удаляется с поверхности.
13.10. ГЕЛИ И СТУДНИ. ТИКСОТРОПИЯ. СИНЕРЕЗИС
Растворы ВМС и золи некоторых гидрофобных коллоидов способны при известных условиях претерпевать изменения: происходят потеря текучести, застудневание, желатирование растворов, при этом образуются студни и гели (от лат. «замерзший»).
Студни (гели) - это твердообразные нетекучие, структурированные системы, возникающие в результате действия молекулярных сил сцепления между коллоидными частицами или макромолекулами полимеров. Силы межмолекулярного взаимодействия приводят к образованию пространственного сетчатого каркаса, ячейки пространственных сеток заполнены жидким раствором, как губка, пропитанная жидкостью. Образование студня можно представить как высаливание ВМС или начальную стадию коагуляции, возникновения коагуляционного структурирования.
Водный раствор желатина при нагревании смеси до 45 °C становится гомогенной жидкой средой. При охлаждении до комнатной температуры вязкость раствора увеличивается, система утрачивает текучесть, застудневает, консистенция полутвердой массы сохраняет форму (можно резать ножом).
В зависимости от природы веществ, образующих студень или гель, различают: построенные из жестких частиц - хрупкие (необратимые); образованные гибкими макромолекулами - эластичные (обратимые). Хрупкие образованы коллоидными частицами (TiO2, SiO2). Высушенные - это твердая пена с большой удельной поверхностью. Высушенный студень не набухает, высушивание вызывает необратимые изменения.
Эластичные гели образованы полимерами. При высушивании легко деформируются, сжимаются, получается сухой полимер (пирогель), который сохраняет эластичность. Он способен набухать в подходящем растворителе, процесс обратим, можно повторять неоднократно.
Слабые молекулярные связи в студнях можно механически разрушить (встряхиванием, переливанием, температурой). Разрыв связи вызывает разрушение структуры, частицы приобретают способность
к тепловому движению, система разжижается и становится текучей. Через некоторое время структура самопроизвольно восстанавливается. Это можно повторить десятки раз. Такое обратимое превращение получило название тиксотропии. Это изотермическое превращение можно представить схемой:
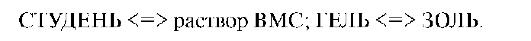
Тиксотропия наблюдается в слабых растворах желатина, протоплазмы клеток. Обратимость тиксотропии свидетельствует о том, что структурирование в соответствующих системах обусловлено межмолекулярными (ван-дер-ваальсовыми) силами - коагуляционно-тиксотропная структура.
Гелями в организме являются мозг, кожа, глазное яблоко. Конденсационно-кристаллизационный тип структуры характеризуется более прочной связью химического характера. В этом случае обратимость тиксотропных изменений нарушается (гель кремниевой кислоты).
Студень - это неравновесное состояние системы, некоторый этап медленно протекающего процесса разделения фаз и приближение системы к состоянию равновесия. Процесс сводится к постепенному сжатию каркаса студня в более плотную компактную массу с опрессованием второй подвижной жидкой фазы, которая механически удерживается в пространственной сетке каркаса. На поверхности студней при хранении вначале появляются отдельные капли жидкости, со временем они увеличиваются и сливаются в сплошную массу жидкой фазы. Такой самопроизвольный процесс расслаивания студня получил название синерезиса. Для хрупких студней синерезис - необратимая агрегация частиц, уплотнение всей структуры. Для студней ВМС повышением температуры можно приостановить синерезис и вернуть студень в исходное положение. Расслоение сгустков свернувшейся крови, очерствение хлеба, отмокание кондитерских изделий - примеры синерези-са. Ткани молодых людей эластичны, содержат больше воды, с возрастом эластичность теряется, меньше воды - это синерезис.
13.11. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1. Дать понятие о дисперсных системах, дисперсной фазе и дисперсионной среде.
2. Как классифицируются дисперсные системы по агрегатному состоянию дисперсной фазы и дисперсионной среды? Приведите примеры медико-биологического профиля.
3. Как классифицируются дисперсные системы по силе межмолекулярного взаимодействия в них? Приведите примеры медико-биологического профиля.
4. Основной частью аппарата «искусственная почка» является диализатор. Каков принцип устройства простейшего диализатора? От каких примесей можно очистить кровь посредством диализа? От каких факторов зависит скорость диализа?
5. Какими способами можно различить раствор низкомолекулярного вещества и коллоидный раствор? На каких свойствах основаны эти способы?
6. Какими способами можно отличить золь от грубодисперсной системы? На каких свойствах основаны эти способы?
7. Какие существуют методы получения коллоидно-дисперсных систем? В чем они отличаются друг от друга?
8. В чем заключаются особенности молекулярно-кинетических и оптических свойств коллоидно-дисперсных систем? Что их отличает от истинных растворов и грубодисперсных систем?
9. Дать понятие агрегативной, кинетической и конденсационной устойчивости дисперсных систем. Факторы, определяющие устойчивость систем.
10. Покажите взаимосвязь электрокинетических свойств коллоидно-дисперсных систем.
11. Какие электрокинетические явления наблюдаются при механическом перемешивании частиц дисперсной фазы: а) относительно дисперсионной среды; б) относительно частиц дисперсной фазы?
12. Объясните, какой из указанных ниже препаратов относится к коллоидным растворам: а) препарат барий сульфата в воде, применяющийся как контрастное вещество при рентгенологических исследованиях с размером частиц 10-7 м; б) препарат серебра в воде - колларгол, применяющийся для обработки гнойных ран с размером частиц 10-9 м.
13. Понятие коагуляции золей. Коагуляция лиофильных золей. Каковы внешние признаки коагуляции? Укажите возможные продукты коагуляции золей.
14. Факторы, вызывающие коагуляцию золей. Правила коагуляции золей электролитами. Кинетика коагуляции. Порог коагуляции.
15. В результате нарушения микро (Са2+)- и макро (С2О42-)-элементного и кислотно-основного гомеостаза в ЖКТ в почках происходит реакция:
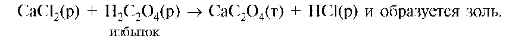
Каков заряд золя? Какие из указанных ионов будут обладать коагулирующим действием для частиц этого золя: K+, Mg2+, SO42-, NO3-, PO43-, Al3+?
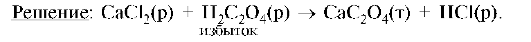
Образуется золь кальций оксалата. Запишем формулу мицеллы золя
(13.3.).

Заряд гранулы золя положительный, значит, коагулирующим действием (к) для частиц этого золя будут обладать ионы: SO42-, PO43-, NO3-, согласно правилу Гарди. Чем выше заряд коагулирующего иона, тем сильнее его коагулирующее действие (правило Шульце). Согласно правилу Шульце, данные анионы можно расположить в следующий ряд: СкР043- > СкSO42- > СкNO3-. Чем ниже заряд иона, тем при больших концентрациях будет происходить коагуляция. Порог коагуляции (р) является относительной характеристикой устойчивости золя по отношению к данному электролиту и является величиной, обратной
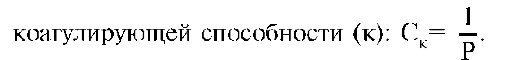
13.12. ТЕСТОВЫЕ ЗАДАНИЯ
1. Выберите неверное утверждение:
а) к конденсационным методам получения коллоидных растворов относятся ОВР, гидролиз, замена растворителя;
б) к дисперсионным методам получения коллоидных растворов относятся механический, УЗ, пептизация;
в) к оптическим свойствам коллоидных систем относятся опалес-ценция, дифракция, эффект Тиндаля;
г) к молекулярно-кинетическим свойствам коллоидных систем относятся броуновское движение, светорассеяние, изменение окраски раствора.
2. Выберите неверное утверждение:
а) электрофорез - это перемещение в электрическом поле дисперсной фазы относительно неподвижной дисперсионной среды;
б) электроосмос - это перемещение в электрическом поле дисперсионной среды относительно неподвижной дисперсной фазы;
в) проникновение жидкостей, содержащих лечебные ионы и молекулы, через капиллярную систему под действием электрического поля, называется электродиализом;
г) электрофорез применяется для разделения белков, нуклеиновых кислот и форменных элементов крови.
3. Коллоидный раствор, потерявший текучесть, - это:
а) эмульсия;
б) гель;
в) золь;
г) суспензия.
4. Плазма крови - это:
а) золь;
б) гель;
в) истинный раствор;
г) эмульсия.
5. Гетерогенная система, состоящая из микрокристалла дисперсной фазы, окруженная сольватируемыми ионами стабилизатора, называется:
а) гранулой;
б) ядром;
в) агрегатом;
г) мицеллой.
6. При образовании мицеллы потенциалопределяющие ионы адсорбируются по правилу:
а) Шульце-Гарди;
б) Ребиндера;
в) Панета-Фаянса;
г) Шилова.
7. Гранулой мицеллы называют агрегат:
а) вместе с адсорбционным слоем;
б) диффузионным слоем;
в) адсорбционным и диффузионным слоями;
г) потенциалопределяющими ионами.
8. Межфазный потенциал - это потенциал между:
а) твердой и жидкой фазами;
б) адсорбционным и диффузным слоями на границе скольжения;
в) ядром и противоионами;
г) потенциалопределяющими ионами и противоионами.
9. Способность мелкопористых мембран задерживать частички дисперсной фазы и свободно пропускать ионы и молекулы, называется:
а) коагуляцией;
б) седиментацией;
в) диализом;
г) опалесценцией.
10. К веществам, способным вызвать коагуляцию, относятся:
а) электролиты;
б) белки;
в) полисахариды;
г) ПАВ.
11. Коагулирующее действие электролита определяется правилом:
а) Панета-Фаянса;
б) Шульце-Гарди;
в) Ребиндера;
г) Шилова.